Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Urokinase-Typ-Plasminogen-Aktivator-induziertes Modell für Rückenschmerzen bei Mäusen
In diesem Artikel
Zusammenfassung
Methoden zur einfachen, schnellen Induktion eines Rückenschmerzmodells bei Mäusen werden hier unter Verwendung einer intraligamenten Injektion eines Plasminogenaktivators im Urin bereitgestellt.
Zusammenfassung
Ein Modell anhaltender Schmerzen im unteren Rücken kann bei Mäusen mit der hier beschriebenen einfachen Methodik induziert werden. Schritt-für-Schritt-Methoden zur einfachen, schnellen Induktion eines persistierenden Rückenschmerzmodells bei Mäusen werden hier unter Verwendung einer Injektion eines Urokinase-Typ-Plasminogenaktivators (Urokinase), einer Serinprotease, die bei Menschen und anderen Tieren vorhanden ist, bereitgestellt. Die Methode zur Induktion von anhaltenden Schmerzen im unteren Rücken bei Mäusen beinhaltet eine einfache Injektion von Urokinase entlang der bandartigen Ansatzregion der Lendenwirbelsäule. Der Urokinase-Entzündungsstoff aktiviert Plasminogen zu Plasmin. In der Regel kann das Modell innerhalb von 10 Minuten induziert werden und die Überempfindlichkeit hält mindestens 8 Wochen an.
Überempfindlichkeit, Gangstörungen und andere angst- und depressionsähnliche Standardmaße können im persistierenden Modell getestet werden. Rückenschmerzen sind die häufigste Art von Schmerzen. Um das Bewusstsein für Rückenschmerzen zu schärfen, hat die International Association for the Study of Pain (IASP) das Jahr 2021 zum "Globalen Jahr über Rückenschmerzen" und 2022 zum "Globalen Jahr für die Umsetzung von Schmerzwissen in die Praxis" ernannt. Eine Limitierung der therapeutischen Weiterentwicklung von Schmerztherapeutika ist der Mangel an geeigneten Modellen zur Testung von persistierenden und chronischen Schmerzen. Die Merkmale dieses Modells eignen sich für die Erprobung potenzieller Therapeutika, die auf die Verringerung von Rückenschmerzen und deren Begleiterscheinungen abzielen, und tragen dazu bei, dass die IASP das Jahr 2022 zum Globalen Jahr für die Übertragung von Schmerzwissen in die Praxis ernannt hat.
Einleitung
Rückenschmerzen sind eine der häufigsten Ursachen für Behinderungen, wobei weltweit 1 von 5 Menschen leidet1. Trotz dieser Bemühungen werden nur wenige zuverlässige Tiermodelle für Rückenschmerzen in der Tierforschung im Schmerzbereich verwendet, insbesondere an Mäusen. Bisherige Modelle nutzten fast ausschließlich Ratten zur Induktion von chronischen Rückenschmerzen (CBP), wie sie z. B. durch Injektion von Plasminogenaktivator (uPA) im Urin in das Lendenfacettengelenk 2,3, Injektion von Nervenwachstumsfaktor (NGF) in die Rumpfmuskulatur4 oder Mononatriumjodacetat (MIA)5 oder Interleukin-1beta6 induziert werden Injektion in die Bandscheibe. Natürlich werden Ratten für diese Modelle bevorzugt, vor allem wegen ihrer größeren Größe und des einfachen Zugangs für die Injektion von Entzündungsmitteln.
Um es klar zu sagen: Es gibt zwar Mausmodelle für Rückenschmerzen, wie z. B. das seit vielen Jahren verwendete SPARC-Null-Mausmodell der Bandscheibendegeneration7, aber diese sind kostspieliger und zeitaufwändiger zu etablieren als injektionsbasierte Modelle. Eine kürzlich durchgeführte Studie an Mäusen etablierte ein Modell für Schmerzen im unteren Rückenbereich, indem die NGF-Injektion in die unteren Rückenmuskeln mit vertikaler chronischer Belastungsbelastung kombiniertwurde 8. Im folgenden Protokoll haben wir das uPA-induzierte CBP-Modell von Ratten für Mäuse2 adaptiert. Die Überempfindlichkeit stellt sich innerhalb von 1 Woche ein und hält bis zu 6-8 Wochen an. Darüber hinaus stellen wir fest, dass Mäuse angst- und depressionsähnliche Verhaltensweisen entwickeln. Angesichts der Prävalenz von Rückenschmerzen und der häufigeren Verwendung von Mäusen in der molekularen Schmerzforschung ist dieses langlebige Modell leicht für die Entwicklung neuer Behandlungsstrategien zur Linderung von Rückenschmerzen geeignet.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle beschriebenen Tierverfahren entsprechen dem NIH-Leitfaden für die Pflege und Verwendung von Labortieren. Die Studien wurden vom lokalen Institutional Care and Use Committee (IACUC #23-201364-HSC) des Health Sciences Center der University of New Mexico genehmigt. Alle Studien entsprechen den Richtlinien unter der Schirmherrschaft einer OLAW Assurance of Compliance (A3002-01) für die Verwendung von Tieren in der Forschung, wie in Teil III beschrieben. II. Zusicherungen und Zertifizierungen. Die Tiere werden in der Unterkunft des Animal Resources Center (ARC) untergebracht, die vom Laborpersonal und den Mitarbeitern der Abteilung für Labor- und Tierressourcen (DLAR) unterhalten wird. Die Methode der Euthanasie (100 μl mit 59 mg/ml Pentobarbital-Injektion) ist schnell und zuverlässig und ermöglicht die Sektion und Entnahme verschiedener Gewebe für weitere Forschungen.
1. Tiere
- Adulte (~3-4 Wochen alte) männliche und weibliche BALB/c-Mäuse (20-25 g) in einem umgekehrten 12 h:12 h Hell-Dunkel-Zyklus, so dass ihre aktive Zeit im Dunkeln während der Laborarbeitszeiten stattfindet.
HINWEIS: Dies ermöglicht die Beurteilung aller Parameter während der natürlichen aktiven Zeit der Tiere, da Nagetiere von Natur aus nachtaktive Tiere sind. Dadurch wird der Beitrag von Veränderungen der zirkadianen Uhr reduziert, so dass die Tiere während ihrer aktiven Zeit, die jetzt tagsüber ist, getestet werden können. - Überwachen Sie die Tiere zweimal täglich.
- Halten Sie die Mäuse bei normalem Mäuse-Zuchtfutter, das im Vergleich zu Standard-Nagetierfutter (von dem bekannt ist, dass es die Überempfindlichkeit verändert) einen geringeren Sojaproteingehalt aufweist, wenn Sie die Wirkung von Medikamenten auf schmerzbezogenes Verhalten beurteilen.
- Wiegen Sie die Tiere einmal pro Woche, um eine gesunde Gewichtszunahme zu gewährleisten.
HINWEIS: Während der 8-10-wöchigen Studien wurden keine Gruppenunterschiede im Gewicht festgestellt, was eine Studienverblindung ermöglichte.
2. Modell-Induktion
- Führen Sie die Modellinduktion auf einer warmen, sterilen, flachen Oberfläche durch, die mit einer Vorrichtung zum Anbringen von Stabilisierungsfesseln ausgestattet ist, um die Maus an Ort und Stelle zu halten (Abbildung 1A). Führen Sie die Operation mit einem Präpariermikroskop auf einer sterilisierten Oberfläche durch.
HINWEIS: Verwenden Sie einen Abzug in chemischer Qualität, wenn keine Anästhesieerfassung verfügbar ist. - Verwenden Sie chirurgische Seide oder sogar Garn mit Gummibändern, die am Ende der Schnüre geknotet sind und an den gerippten Kanten der Platte befestigt sind, als Fesseln, wenn Sie die in der Materialtabelle empfohlene Grundplatte verwenden.
- Platzieren Sie eine Heizkissen-Aufwachstation auf einer Fläche neben der Operationsanordnung, um die Mäuse unmittelbar nach der Injektion in die Station zu bringen (Abbildung 1B).
HINWEIS: Mindestens 10 Minuten vor der Injektion einen leeren Gehäusekäfig auf das Heizkissen stellen, damit sich der Käfig auf eine angenehme Temperatur (37 °C) aufheizen kann. Platzieren Sie den Käfig halb vom Pad, um der wachen Maus eine Präferenz für die Erholungstemperaturen zu ermöglichen. - Bereiten Sie die Urokinase in sterilem Wasser vor, indem Sie sie verdünnen. Reinigen Sie die Hamilton-Spritze mit Alkohol und spülen Sie sie in sterilem Wasser ab. Ziehen Sie die Lösung im Voraus auf, damit die Maus so kurz wie möglich unter Narkose steht. Verwenden Sie 5 μl 2 mg/ml Plasminogenaktivator im Urin für das Modell; Verwenden Sie für Scheinpräparate 5 μl sterile Kochsalzlösung.
- Stellen Sie die Isofluran-Anästhesiestation für diesen kurzen Eingriff auf einem Niveau von 4 % oder weniger ein. Legen Sie die Maus in die Induktionskammer; In der Regel verlangsamt sich die schnelle Atemfrequenz der Maus innerhalb von 1-2 Minuten und bewegt sich von der Bewegung des oberen Brustkorbs zum unteren Brustkorb.
- Verwenden Sie einen Sauerstoffgehalt von 1,5 l/min und einen Aktivkohle-F-Kanister oder arbeiten Sie unter einem biologischen Durchfluss oder einer Überkopf-Evakuierungshaube, um das Isofluran zu schrubben, um eine Exposition gegenüber dem Tierchirurgen zu vermeiden. Falls nicht vorhanden, führen Sie das Verfahren in einer Chemikalienschutzhaube durch.
- Schalten Sie den Maus- und Anästhesiefluss schnell auf einem 37 °C warmen Kissen in den Operationsbereich um und legen Sie die Nase der Maus in die Nasenspitze, um das Anästhesieniveau aufrechtzuerhalten (Abbildung 1C,D). Vergewissern Sie sich, dass die Maus keine reflexartige Bewegung hat, um die Zehen einzuklemmen, und halten Sie die Maus dann auf der Grundplatte fest.
HINWEIS: Wenn es überhaupt Bewegung gibt, setzen Sie die Maus zurück in die Induktionskammer und wiederholen Sie dies. - Reinigen Sie den hinteren Hautbereich mit einem Alkoholtupfer. Stellen Sie die LED-Beleuchtung nach Bedarf ein, um eine klare Sicht auf den Rücken der betäubten Maus zu haben.
HINWEIS: Verwenden Sie bei Bedarf einen elektrischen Rasierer, um Haare vom Rücken der Maus zu entfernen, damit Sie die Rillen der Wirbelsäule unter der Haut ungehindert sehen können. Wenn die Versuchsmäuse rasiert sind, rasieren Sie auch den Rücken der naiven Mäuse und der Scheinmäuse, um sie zu verblinden. - Injizieren Sie die Maus, während sie vollständig betäubt und immobilisiert ist (kein Aufrichtungsreflex und Zehenklemmen). Fühlen Sie mit zwei Fingern vorsichtig an der Stelle, an der die Unterseite des Brustkorbs der Maus auf die Wirbelsäule trifft (Abbildung 2A). Unterhalb dieses Punktes befinden sich die Wirbelsäulensegmente des Lumbers; Richten Sie die Injektion hier auf L2-L3.
- Platzieren Sie die Spitze der Hamilton-Spritze neben der Wirbelsäule (Abbildung 2B,C). Richten Sie die Spritze in einem Winkel von ~45° auf das Band, das unmittelbar an den Knochen angrenzt.
HINWEIS: Abhängig von der Zähigkeit der Haut der Maus kann es manchmal besser funktionieren, sich auf die Schwerkraft anstelle des aktiven Drucks und einen 90°-Winkel zu verlassen. - Führen Sie die Nadelspitze vorsichtig, aber fest in das Bandum interspinosum ein (Abbildung 3B,C).
HINWEIS: Das Ziel ist nicht, die Bauchhöhle zu durchbrechen, sondern das Band zu injizieren. - Entleeren Sie den Inhalt der Nadel langsam. Wenn sich an irgendeiner Stelle Flüssigkeit an der Spitze befindet, ist die Nadel nicht durch die Haut. Fahren Sie fort, bis alle 5 μl injiziert wurden.
- Halten Sie die Nadel ~5 s lang an Ort und Stelle, um einen Rückfluss durch die Injektion zu verhindern. Die Verwendung von blauem Farbstoff in terminalen oder akuten Pilotversuchen wird empfohlen.
HINWEIS: Wenn es richtig gemacht wird, sollte sich die Flüssigkeit wie gezeigt in das Band verteilen (Abbildung 3A). - Entfernen Sie die Nadel vorsichtig und langsam. Stellen Sie sicher, dass kein Blut oder Ausfluss vorhanden ist.
- Legen Sie die Maus in die Wärmerückgewinnungsstation mit einem Käfigdeckel, bis sie aufwacht und beweglich ist, bevor Sie sie wieder in den heimischen Käfig zurückbringen.
HINWEIS: Unter der Annahme, dass der Vorgang schnell durchgeführt wurde, sollte es nicht länger als eine Minute dauern, bis die Maus erwacht. - Kontrollieren Sie die Mäuse vorsichtshalber bis 1 Stunde nach der Operation, um sicherzustellen, dass die normale motorische Funktion fortgesetzt wird.
HINWEIS: Wenn es richtig gemacht wird, sollte es bei diesem Verfahren keine Komplikationen geben. - Kontrollieren Sie die Mäuse in der Woche nach der Operation täglich, einschließlich Gewichtsbestimmung und Inspektion der Injektionsstelle, um sicherzustellen, dass keine Infektion oder Komplikationen aufgetreten sind. Verwenden Sie die Maus nicht für weitere Experimente, wenn es zu einer Verhaltensänderung kommt, wie z. B. Gewichtsverlust und Lethargie.

Abbildung 1: Aufbau für die Urokinase-CBP-Induktion. (A) Die Fine Science Tools-Grundplatte, die für Mäuseoperationen empfohlen wird. Die gerippten Kanten können mit einer Hakenschnur versehen werden, um die Maus an Ort und Stelle zu halten. (B) Wiederherstellungsstation. Ein leerer Gehäusekäfig wird empfohlen, halb auf dem Heizkissen, halb ausgeschaltet. Ein sauberes Tuch wird auf die Unterseite gelegt, um der Maus einen bequemen Ruhebereich zu bieten. (C) Empfehlung für die Einrichtung von Anästhesiegeräten. Richten Sie mit einem zweikanaligen Zuführsystem einen Schlauch zur Induktionskammer und einen anderen zur Operationsstation ein. (D) Ansicht der Mausfesseln. Zwei Schnüre werden auf die gerippten Kanten der Grundplatte geknotet und dann vorsichtig über den Hals bzw. das Gesäß der Maus gezogen. Achten Sie darauf, die Maus nicht zu fest zu festhalten, damit sie noch normal atmen kann. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Urokinase-Injektionsinduktion von CBP. (A) Ansicht der Platzierung der Injektionsstelle. Wie gezeigt, tasten Sie mit den Fingern, um die Unterseite des Brustkorbs der Maus als Referenzpunkt für L4-L5 zu finden. (B) Eine Ansicht des Injektionsvorgangs, die den Winkel für eine ordnungsgemäße Injektion zeigt. (C) Ein Winkel von 45° ist hier vorzuziehen, aber passen Sie ihn nach Bedarf an, um sicherzustellen, dass die Nadel dorthin gelangt, wo sie benötigt wird. Rasieren Sie bei Bedarf die Injektionsstelle zur besseren Visualisierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Schematische Darstellung der Injektionsstelle. (A) Ein Foto der Lage der Injektionsstelle. Tinte wird hier verwendet, um anzuzeigen, wo die Flüssigkeit in das Wirbelband zwischen den Wirbeln L2 und L3 eintritt. (B) Ein Diagramm, das die richtige Positionierung der Nadel und die Lage der Injektionsstelle von der Seite zeigt. (C) Ein Diagramm, das eine Draufsicht auf die Wirbel und die Injektionsstellen für die interspinösen Bänder zeigt. Die Injektionen erfolgen in der Regel an den interspinösen Bändern neben der Wirbelsäule, aber die Nadel kann auch in den Raum zwischen den Wirbeln und die Querwirbel eingeführt werden. Die Verwendung von blauem Farbstoff in Pilotversuchen wird empfohlen, wie in (A) gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Verhaltensbasierte Assays
- Von Frey mechanische Reflexreaktionsschwellenprüfung
HINWEIS: Die mechanische Abzugsschwelle ist die minimale Kraft, die erforderlich ist, um in 50 % der Fälle eine Reaktion mit einer Reihe von 8 von-Frey-Monofilamenten mit einem Durchmesser von ~0,2 g zu erzeugen, was zu logarithmischen Änderungen der mechanischen Kraft führt (Materialtabelle).- Testen Sie die mechanische Stimulation mit von-Frey-Fasern, die an der Hinterpfote, dem Innervationsgebiet der lumbosakralen Nerven, angebracht werden. Bestimmen Sie die Ausgangswerte für den Pfotenrückzug vor der Operation. Bestimmen Sie nach der Operation die mechanische Schwelle einmal pro Woche während des chronischen Experiments.
- Bringen Sie die Tiere aus dem Stallraum und akklimatisieren Sie sie vor dem Test für 30 Minuten im Testraum in ihren häuslichen Käfigen. Von dort aus bewegen Sie die Tiere, um sie einzeln in kleinen durchsichtigen Kabinen auf dem Testtisch mit Bildschirmaufsatz für 15-20 Minuten festzuhalten, je nach ihrem Aktivitätsniveau.
HINWEIS: Der Test kann beginnen, nachdem sich die Mäuse in eine Ruheposition begeben haben und sich nicht mehr in der Kammer drehen und bewegen. Die Eingewöhnung in die Rückhaltekabine minimiert stressinduzierte Effekte. Wenn Mäuse in einem umgekehrten Lichtzyklus gehalten wurden, sollte der Test unter Rotlichtbedingungen durchgeführt werden. - Fahren Sie mit dem Test fort, indem Sie abgestufte Serien von Frey-Fasern verwenden, wie unten und in Chaplan et al.9 beschrieben.
- Sondieren Sie den Fußballen an einer gleichmäßigen Stelle bei jedem Tier mit dem 3,61 von Frey-Filament, das beim Biegen eine Kraft von 0,4 g entfaltet (Materialtabelle). Anschließend erfolgt die Stimulation mit dem 4.08 von Frey-Filament, das eine Kraft von 1,0 g entlockt.
HINWEIS: Keine dieser Fasern löst bei naiven, akklimatisierten Tieren Reaktionen aus. - Tragen Sie jedes Filament 5x in Abständen von >5 s senkrecht zum Fußpolster auf und achten Sie darauf, keine Falte/Spalte oder Haare zu berühren. Eine positive Reaktion ist ein Fußrückzug auf drei von fünf Reizen. Wenden Sie das nächstschwächere Filament in der Serie an, bis das Tier nicht mehr auf die mechanische Stimulation reagiert. Verwenden Sie an dieser Stelle das nächsthöhere Filament. Wenn es eine Reaktion hervorruft, verwenden Sie das untere Filament erneut, bis nach der Änderung der Reaktion auf die mechanische Stimulation des Fußballens vier Versuche durchgeführt wurden.
- Verwenden Sie das resultierende Antwortmuster, um die mechanische Entnahmeschwelle zu berechnen, d. h. die minimale Kraft, die erforderlich ist, um in 50 % der Fälle eine Reaktion hervorzurufen, wobei ein Kurvenanpassungsalgorithmus9 verwendet wird. Eine Abnahme der Kraft, die erforderlich ist, um eine Fußrückzugsreaktion hervorzurufen, im Vergleich zu naiven Mäusen oder dem eigenen Ausgangswert des Tieres deutet auf eine erhöhte Empfindlichkeit des Tieres hin.
- Sondieren Sie den Fußballen an einer gleichmäßigen Stelle bei jedem Tier mit dem 3,61 von Frey-Filament, das beim Biegen eine Kraft von 0,4 g entfaltet (Materialtabelle). Anschließend erfolgt die Stimulation mit dem 4.08 von Frey-Filament, das eine Kraft von 1,0 g entlockt.
- Prüfung der Schwelle für die thermische Reflexreaktion
HINWEIS: Die Schwellenwerte für die Wärme- und Kältereaktion werden mit dem Hargreaves- bzw. dem Cold-Plate-Test ermittelt.- Hargreaves-Test
- Stellen Sie die Mäuse in Kabinen auf eine Glasfläche, die mit einem Infrarotstrahler von unten beheizt wird. Die Latenz bis zum Zurückziehen des Fußes ist die Zeit in Sekunden von der Anwendung des Infrarotlichtreizes (50 °C), der vom Gerät auf die Hinterpfote der Maus abgegeben wird, bis zum Abbruch der Stimulation.
- Kühlplatten-Test
- Legen Sie die Mäuse auf die auf -9 °C gekühlte Kühlplatte. Notieren Sie die Latenz beim Zurückziehen des Fußes als die Zeit in Sekunden vom Aufsetzen der Maus auf das Gerät bis zum Anheben des Fußes.
- Alternativ können Sie eine auf -9 °C gekühlte Kaltsonde unter die Hinterpfote der Maus legen, während die Maus auf einem Drahtgeflecht eingesperrt ist. Notieren Sie die Wartezeit für den Rückzug als Zeit in Sekunden zwischen dem Platzieren des Geräts unter der Hinterpfote, bis die Maus beginnt, den Fuß zu heben, zu lecken oder zu schütteln. Um eine nozizeptive Reaktion zu vermeiden, gewöhnen Sie die Maus daran, von der Sonde bei Raumtemperatur berührt zu werden.
- Hargreaves-Test
- Kognitions- und emotionsabhängige Verhaltenstests
HINWEIS: Lang anhaltende Überempfindlichkeit bei Tieren führt zu emotionalen und kognitionsabhängigen Funktionsstörungen. Diese werden in der Regel nur einmal in Woche 6 nach der Induktion des Schmerzmodells gemessen, um Praxiseffekte zu vermeiden.- Angst-Tests
HINWEIS: Angstzustände und Depressionen können auch zuverlässig getestet werden, um die Wirksamkeit des Modells zu ermitteln. Es ist am besten, mindestens bis zur 4-6. Woche nach der Induktionsinjektion zu warten, damit sich die Komorbiditäten entwickeln können. Die Bevorzugung der dunklen gegenüber der hellen Kammer ist ein Maß für nozizeptionsbedingte Angstzustände. Im Null- oder Plus-Labyrinth-Test verbringen die Schmerzmodellmäuse weniger Zeit in den offenen Quadranten als naive Kontrolltiere, was ein angstähnliches Verhalten zeigt 10,11.- Hell-/Dunkelplatzpräferenztest: Jedes Tier wird in die Testbox für die Platzpräferenz mit einem Durchgang zwischen zwei Kammern (10 x 10 x 10 cm3) gelegt. Eine Kammer des Apparates ist hell beleuchtet, während die gegenüberliegende Seite dunkel bleibt. Überwachen Sie während jedes 10-minütigen Tests den Standort des Tieres per Computer, um helle und dunkle Belegungszeiten und die Anzahl der Übergänge zu bestimmen.
HINWEIS: Alternativ können Sie eine Videokamera über der Prüfkammer montieren und die in jeder Kammer verbrachte Zeit manuell aufzeichnen. - Erhöhte Plus- oder Null-Labyrinthe: Platzieren Sie die Modell-Nagetiere oder naiven Tiere im Labyrinth und verwenden Sie eine Stoppuhr, um die Zeit zu bewerten, die Sie in den geschlossenen Teilen des Labyrinths verbringen. Bestimmen Sie die Zeit, die Sie in den beiden ummauerten "sicheren" Bereichen und zwei offenen "unsicheren" Bereichen verbringen. Tiere mit Schmerzen bevorzugen geschlossene, sichere Bereiche.
HINWEIS: Angstähnliches Verhalten kann entweder in einem Null- oder Plus-Labyrinth (10 Minuten) getestet werden. Das Null-Labyrinth ist eine kreisförmige Spur im Gegensatz zum Plus-Labyrinth, das "Plus-Zeichen-förmig" ist. Beide haben zwei offene und zwei geschlossene Quadranten, die ein kontinuierliches Erkundungsverhalten ermöglichen. Beide sind 1 m über dem Boden angehoben, entweder ein kreisförmiger oder ein plusförmiger Gehweg, der in vier gleich große Quadranten unterteilt ist.
- Hell-/Dunkelplatzpräferenztest: Jedes Tier wird in die Testbox für die Platzpräferenz mit einem Durchgang zwischen zwei Kammern (10 x 10 x 10 cm3) gelegt. Eine Kammer des Apparates ist hell beleuchtet, während die gegenüberliegende Seite dunkel bleibt. Überwachen Sie während jedes 10-minütigen Tests den Standort des Tieres per Computer, um helle und dunkle Belegungszeiten und die Anzahl der Übergänge zu bestimmen.
- Saccharose-Spritz-Depressionstest
HINWEIS: Der Saccharose-Spritztest wird verwendet, um depressionsähnliches Verhalten zu bestimmen. Der Splash-Test ermöglicht die Messung des Fehlens eines normalen Pflegeverhaltens als Symptom einer Depression als Folge chronischer Schmerzen.- Bewerten Sie die Häufigkeit, Dauer und Latenz der Fellpflege für 10 Minuten, nachdem Sie eine 10-30%ige Saccharoselösung auf das Rückenfell gesprüht haben (~250 μl in der Nähe des Schwanzansatzes). Lassen Sie verblendete Beobachter die Anzahl der Putzmanöver anhand von Videoaufzeichnungen zählen12.
HINWEIS: Es wurde berichtet, dass dieser Index in Nagetiermodellen für affektive Störungen, wie z. B. chronischen leichten Stress, beeinflusst wird und durch die Behandlung mit chronischen Antidepressiva korrigiert wird13.
- Bewerten Sie die Häufigkeit, Dauer und Latenz der Fellpflege für 10 Minuten, nachdem Sie eine 10-30%ige Saccharoselösung auf das Rückenfell gesprüht haben (~250 μl in der Nähe des Schwanzansatzes). Lassen Sie verblendete Beobachter die Anzahl der Putzmanöver anhand von Videoaufzeichnungen zählen12.
- Neuartiger Objekttest
HINWEIS: Kognitive Dysfunktion ist mit dem neuartigen Objekttest messbar.- Akklimatisieren Sie die Mäuse einzeln in einem durchsichtigen Plastikkäfig mit offenem Oberteil (56 x 30 x 20 cm) für 1 h. Füge 5 Minuten lang zwei identische Spielzeug-Minifiguren in gegenüberliegenden Ecken des Käfigs hinzu.
- Gewöhnen Sie die Tiere am Versuchstag erneut für 1 Stunde an den durchsichtigen Käfig, bevor Sie die beiden identischen Minifiguren für 5 Minuten in die gleichen Positionen des Käfigs setzen, bevor Sie sie in den Heimatkäfig zurückbringen.
- Ersetzen Sie eine der Originalfiguren durch ein deutlich anderes neuartiges Objekt, bringen Sie die Mäuse 4 Stunden später in den Testkäfig zurück und notieren Sie die Zeit, die Sie mit der Erkundung der Objekte verbracht haben.
- Berechnen Sie den gemeldeten Erkennungsindex (RI) als Prozentsatz der Zeit, die für die Erkundung des neuen Objekts aufgewendet wurde, der gesamten Objekterkundungszeit14.
- Beurteilung der Motorik
HINWEIS: Der Tintenklecks-Mobilitäts- und Gangstörungstest15 beurteilt die motorische Funktion im Rückenschmerzmodell.- Baue einen Tunnel aus einer Papierhandtuchröhre, die längs an einer Kante geschnitten ist. Breiten Sie den Tunnel auf einem sauberen Stück Druckerpapier aus.
- Halten Sie die Mäuse vorsichtig in ein Handtuch gewickelt, bis sie sich beruhigt haben. Legen Sie die Pfoten auf ein Stempelkissen, das mit ungiftiger Tusche benetzt ist, um sie mit Tinte zu bestreichen, oder malen Sie die Tinte mit einem Wattestäbchen auf die Unterseite der Füße der Maus. Lass die Mäuse am Tunneleingang frei und lass sie durch den Tunnel laufen, um sie am Ende einzufangen.
- Bewerten Sie die Pfotenabdrücke anhand von drei Parametern: Schrittlänge (der vertikale Abstand vom hinteren Ende eines Drucks zum nächsten), Schrittbreite (horizontaler Abstand zwischen den Abdrücken) und Zehenspreizung (der Abstand zwischen den Zehen auf den gegenüberliegenden Seiten der Pfote).
HINWEIS: Zugelassene Leckerlis können auch verwendet werden, um die Maus zu ermutigen, durch den Tunnel zu kommen. Sind Pfotenabdrücke verschmiert oder unklar, muss das Experiment wiederholt werden.
- Angst-Tests
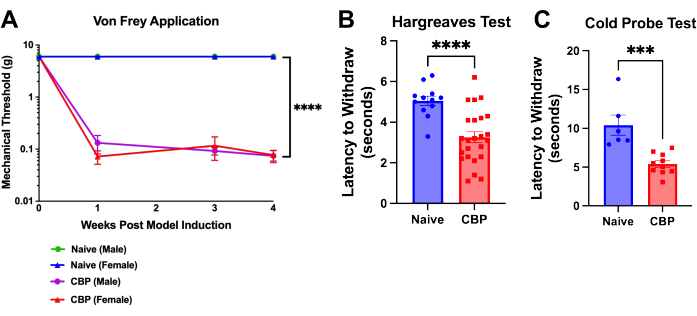
Abbildung 4: Mechanische und thermische Überempfindlichkeit nach CBP-Induktion. Der Schmerz ist eine Woche nach der Modellinduktion messbar und hält 8 Wochen lang an. (A) Von-Frey-Test. Die mechanische Schwellenprüfung wird mit von-Frey-Filamenten durchgeführt, die über einen Mesh-Top-Tisch mit der hier gezeigten Up-Down-Methode über einen Mesh-Top-Tisch auf das Fußpolster aufgebracht werden, wie hier gezeigt. Die naive männliche Schwelle (grün) verbirgt sich unter der blauen Linie für die naiven weiblichen Mäuse. Die CBP-Mäuse (n = 4 Männchen, 4 Weibchen) zeigten im Vergleich zu den naiven Kontrollpersonen (n = 2 Männchen, 2 Weibchen) eine signifikant erhöhte mechanische Empfindlichkeit. Eine Zwei-Wege-ANOVA (Dunnett's Multiple Comparisons Test) wurde mit diesen Daten durchgeführt: n = 4 pro Gruppe. In Post-hoc-Analysen ergab die Bonferroni-Anpassung an alle P-Werte für wöchentliche Vergleiche von CBP und Naive alle 11 Werte < 0,0011. p < 0,0001. (B) Hargreaves-Test. Die Hitzeschwelle wurde am Fußpolster mit dem Hargreaves-Test (50 °C) getestet. Die CBP-Mäuse (n = 12 Männchen, 12 Weibchen) zeigten eine signifikant erhöhte Hitzeempfindlichkeit im Vergleich zu den naiven Kontrollpersonen (n = 6 Männchen, 6 Weibchen). Ein zweiseitiger Mann-Whitney-t-Test wurde durchgeführt, um die Signifikanz zu testen (p < 0,0001). (C) Kälteempfindlichkeit. Der Kältesondentest wurde durchgeführt, indem Mäuse auf die auf -9 °C gekühlte Kühlplattenapparatur gesetzt wurden. Die Latenz bis zum Zurückziehen wurde als die Zeit in Sekunden vom Aufsetzen der Maus auf den Apparat bis zum Heben, Lecken oder Schütteln des Fußes aufgezeichnet. In den gezeigten Daten wurde eine auf -9 °C abgekühlte Kältesonde unter die Hinterpfote der Maus gelegt, während die Maus auf einem Drahtgeflecht eingesperrt ist. Alle Mäuse wurden 1-3 Wochen nach der Injektion getestet. Die CBP-Mäuse (n = 4 Männchen, 6 Weibchen) zeigten im Vergleich zu den naiven Kontrollpersonen (n = 2 Männchen, 4 Weibchen) eine signifikant erhöhte Kälteempfindlichkeit. Ein zweiseitiger Mann-Whitney-t-Test wurde durchgeführt, um die Signifikanz zu testen (p = 0,0002). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Nozizeptive Verhaltenstests und Datenanalyse
Evozierte Maßnahmen
Eine Überempfindlichkeit des Fußballens entwickelt sich innerhalb eines Tages nach der Urokinase-Injektion. Innerhalb von 1 Woche wird die Entzugsschwelle deutlich gesenkt und bleibt bis zur Euthanasie bestehen; dies zeigt sich in der postoperativen Woche 4 (Abbildung 4A). Die Latenz des Pfotenrückzugs wird mit der von-Frey-Up-Down-Methode9 und dem Hargreaves-T...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Modell chronischer Rückenschmerzen ist einfach zu induzieren, und eine Überempfindlichkeit, die innerhalb von 1 Woche auftritt, kann bis zu (und möglicherweise darüber hinaus) 8 Wochen andauern. Dies ermöglicht eine genaue Untersuchung des chronischen Schmerzzustands im Gegensatz zu anderen akuten Modellen, die nur ein oder zwei Wochen dauern. Während wir das Modell in Mäusen zeigen, kann das uPA-induzierte CBP-Modell auch in Ratten2 etabliert werden. Ein Vorteil des Modells ist, das...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass es keine konkurrierenden finanziellen Interessen gibt. KNW erkennt die unbezahlte Beratung mit NeuroChronix, Bessor Pharma und USA Elixeria BioPharm, Inc. an.
Danksagungen
Die Finanzierung erfolgte durch NIH HEAL UG3 NS123958. Die Unterkünfte wurden von der AAALAC inspiziert und akkreditiert. Die Tiere wurden in der Unterkunft des Animal Resources Center (ARC) untergebracht, die von den Mitarbeitern des Labors und der Abteilung für Labor- und Tierressourcen (DLAR) unterhalten wurde. Die Verfahren für Verhaltenstests sind Standardmethoden auf diesem Gebiet, die von der American Pain Society und der International Association for the Study of Pain anerkannt sind. Die Methode der Euthanasie steht im Einklang mit den Empfehlungen des Gremiums für Euthanasie der American Veterinary Medical Association.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Animals and Consumables | |||
| 70% ethanol | Local Source | ||
| BALB/c mice | Envigo | 20-25 g | |
| Cotton balls | Fisher Scientific | 19-090-702 | |
| Cotton-tipped applicators | Fisher Scientific | 19-062-616 | |
| Isoflurane inhalant anesthetic | MedVet | RXISO-250 | |
| Labeling tape | Fisher Scientific | NGFP7002 | |
| Nitrile exam gloves | Fisher Scientific | ||
| Oxygen tank | Local Source | ||
| Surgical drape, Steri-Drape Utility Sheet, Absorbent Prevention | VWR | 76246-788 | cut into 15 x 15 cm pieces |
| Tygon tubing with 3 mm inner diameter | Grainger | 22XH87 | |
| Equipment | |||
| #11 carbon steel scalpel blades | VWR | 21909-612 | |
| Anesthesia induction chamber | Summit Medical Equipment Company | AS-01-0530-LG | |
| Autoclave | Local Unit | ||
| Biology Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| Glass bead sterilizer Germinator 500 | VWR | 102095-946 | |
| IITC Life Sciences Series 8 Model PE34 Hot/Cold Plate Analgesia Meter | IITC | PE34 | |
| Integra Miltex cotton & dressing pliers | Safco Dental Supply | 66-317 | |
| OPTIKA CL31 double arm LED illuminator | New York Microscope Company | OPCL-31 | |
| Plantar Test System with InfraRed Emitter, i. e. Hargreaves Apparatus | Ugo Basile | 37370-001 and 37370-002 | |
| Scalpel Handle No. 3 | VWR | 25607-947 | |
| Small animal heating pad | Valley Vet Supply | 47375 | |
| Student Vannas spring scissors, straight blade | Fine Science Tools | 91500-09 | |
| Table top animal research portable anesthesia workstation “PAM” | Patterson Scientific | AS-01-0007 | |
| Von Frey Filaments | Ugo Basile | 37450-275 |
Referenzen
- O'Sullivan, P. B., et al. Back to basics: 10 facts every person should know about back pain. British Journal of Sports Medicine. 54 (12), 698-699 (2020).
- Nauta, H. J., McIlwrath, S. L., Westlund, K. N. Punctate midline myelotomy reduces pain responses in a rat model of lumbar spine pain: evidence that the postsynaptic dorsal column pathway conveys pain from the axial spine. Cureus. 10 (3), 2371(2018).
- Shuang, F., et al. Establishment of a rat model of lumbar facet joint osteoarthritis using intraarticular injection of urinary plasminogen activator. Scientific Reports. 5 (1), 9828(2015).
- Reed, N. R., et al. Somatosensory behavioral alterations in a NGF-induced persistent low back pain model. Behavioural Brain Research. 418, 113617(2022).
- Suh, H. R., Cho, H. -Y., Han, H. C. Development of a novel model of intervertebral disc degeneration by the intradiscal application of monosodium iodoacetate (MIA) in rat. The Spine Journal. 22 (1), 183-192 (2022).
- Kim, H., Hong, J. Y., Lee, J., Jeon, W. -J., Ha, I. -H. IL-1β promotes disc degeneration and inflammation through direct injection of intervertebral disc in a rat lumbar disc herniation model. The Spine Journal. 21 (6), 1031-1041 (2021).
- Millecamps, M., Tajerian, M., Sage, E. H., Stone, L. S. Behavioral signs of chronic back pain in the SPARC-null mouse. Spine. 36 (2), 95-102 (2011).
- La Porta, C., Tappe-Theodor, A. Differential impact of psychological and psychophysical stress on low back pain in mice. Pain. 161 (7), 1442-1458 (2020).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Takao, K., Miyakawa, T. Light/dark transition test for mice. Journal of Visualized Experiments JoVE. (1), e104(2006).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- David, D. J., et al. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron. 62 (4), 479-493 (2009).
- Yalcin, I., et al. A time-dependent history of mood disorders in a murine model of neuropathic pain. Biological Psychiatry. 70 (10), 946-953 (2011).
- Madathil, S. K., et al. Astrocyte-specific overexpression of insulin-like growth factor-1 protects hippocampal neurons and reduces behavioral deficits following traumatic brain injury in mice. PloS One. 8 (6), e67204(2013).
- Sugimoto, H., Kawakami, K. Low-cost protocol of footprint analysis and hanging box test for mice applied the chronic restraint stress. Journal of Visualized Experiments: JoVE. (143), e59027(2019).
- Hassan, S., et al. Identifying chronic low back pain phenotypic domains and characteristics accounting for individual variation: a systematic review. Pain. , (2023).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten