Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle de maux de dos de souris induit par l’activateur de plasminogène de type urokinase
Dans cet article
Résumé
Des méthodes d’induction simple et rapide d’un modèle de mal de dos chez la souris sont fournies ici à l’aide d’une injection intraligamentaire d’activateur urinaire du plasminogène.
Résumé
Un modèle de lombalgie persistante peut être induit chez la souris avec la méthodologie simple décrite ici. Des méthodes étape par étape pour l’induction simple et rapide d’un modèle de mal de dos persistant chez la souris sont fournies ici à l’aide d’une injection d’activateur de plasminogène de type urokinase (urokinase), une protéase à sérine présente chez l’homme et d’autres animaux. La méthodologie d’induction de la lombalgie persistante chez la souris implique une simple injection d’urokinase le long de la région d’insertion ligamentaire de la colonne lombaire. L’agent inflammatoire urokinase active le plasminogène en plasmine. En règle générale, le modèle peut être induit en 10 minutes et l’hypersensibilité persiste pendant au moins 8 semaines.
L’hypersensibilité, les troubles de la marche et d’autres mesures standard de type anxiété et dépression peuvent être testés dans le modèle persistant. Le mal de dos est le type de douleur le plus répandu. Pour améliorer la sensibilisation aux maux de dos, l’Association internationale pour l’étude de la douleur (IASP) a nommé 2021 « Année mondiale sur les maux de dos » et 2022 « Année mondiale pour la traduction des connaissances sur la douleur en pratique ». L’une des limites de l’avancement thérapeutique de la thérapie de la douleur est le manque de modèles appropriés pour tester la douleur persistante et chronique. Les caractéristiques de ce modèle sont adaptées pour tester des thérapies potentielles visant à réduire les maux de dos et leurs caractéristiques auxiliaires, contribuant ainsi à la désignation de 2022 par l’IASP comme l’Année mondiale de l’application des connaissances sur la douleur à la pratique.
Introduction
La lombalgie est l’une des causes les plus fréquentes d’invalidité, avec 1 personne sur 5 qui en souffre dans le monde1. Malgré ces efforts, peu de modèles animaux fiables de maux de dos sont couramment utilisés dans la recherche animale dans le domaine de la douleur, en particulier chez la souris. Les modèles précédents utilisaient presque exclusivement des rats pour l’induction de maux de dos chroniques (CBP) tels que ceux induits par l’injection d’un activateur urinaire du plasminogène (uPA) dans l’articulation facettaire lombaire 2,3, l’injection de facteur de croissance nerveuse (NGF) dans la musculature du tronc4, ou d’iodoacétate monosodique (MIA)5 ou d’interleukine-1bêta6 injection dans le disque intravertébral. Bien sûr, les rats sont préférés pour ces modèles, principalement en raison de leur plus grande taille et de leur facilité d’accès pour l’injection d’agents inflammatoires.
Pour être clair, il existe des modèles murins de maux de dos, tels que le modèle murin de dégénérescence du disque intervertébral SPARC-null utilisé depuis de nombreuses années7, mais ils sont plus coûteux et plus longs à établir que les modèles basés sur l’injection. Une étude récente sur la souris a établi un modèle de douleur au bas du dos en combinant l’injection de NGF dans les muscles du bas du dos avec un stress de contention chronique verticale8. Dans le protocole suivant, nous avons adapté le modèle CBP induit par l’uPA à partir de rats pour la souris2. L’hypersensibilité s’établit en 1 semaine et persiste jusqu’à 6 à 8 semaines. De plus, nous établissons que les souris développent des comportements anxieux et dépressifs. Compte tenu de la prévalence des maux de dos et de l’utilisation plus courante de souris dans la recherche moléculaire sur la douleur, ce modèle durable est facilement établi pour être utilisé dans le développement de nouvelles stratégies de traitement pour soulager les maux de dos.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures décrites sur les animaux sont conformes au Guide des NIH pour le soin et l’utilisation des animaux de laboratoire. Les études ont été approuvées par le comité local de soins et d’utilisation en établissement (IACUC #23-201364-HSC) du Centre des sciences de la santé de l’Université du Nouveau-Mexique. Toutes les études sont conformes aux politiques énoncées dans le cadre de l’assurance de conformité du BALAW (A3002-01) sur l’utilisation d’animaux dans la recherche, tel qu’il est décrit dans la partie III. II. Assurances et certifications. Les animaux sont hébergés dans les installations d’hébergement du Centre de ressources animales (CRA) entretenues par le personnel du laboratoire et le personnel de la Division des ressources de laboratoire et des animaux (DLAR). La méthode d’euthanasie (100 μL d’injection de pentobarbital à 59 mg/mL) est rapide et fiable et permet la dissection et le prélèvement de divers tissus pour des recherches plus approfondies.
1. Animaux
- Hébergez des souris BALB/c mâles et femelles adultes (~3-4 semaines) (20-25 g) sur un cycle lumière : obscurité inversé de 12 h : 12 h, de sorte que leur temps d’activité dans l’obscurité se produise pendant les heures de travail en laboratoire.
REMARQUE : Cela permettra d’évaluer tous les paramètres pendant la période d’activité naturelle des animaux, car les rongeurs sont naturellement des animaux nocturnes. Cela réduit la contribution des altérations de l’horloge circadienne afin que les animaux puissent être testés pendant leur temps d’activité qui est maintenant le jour. - Surveillez les animaux deux fois par jour.
- Maintenez les souris sur de la nourriture reproductrice de souris normale, qui a une teneur en protéines de soja inférieure à celle de la nourriture standard pour rongeurs (connue pour modifier l’hypersensibilité) si vous évaluez les effets des médicaments sur les comportements liés à la douleur.
- Pesez les animaux une fois par semaine pour assurer le maintien d’une prise de poids saine.
REMARQUE : Aucune différence de poids entre les groupes n’a été notée tout au long des études de 8 à 10 semaines, ce qui a permis l’aveuglement de l’étude.
2. Induction du modèle
- Effectuez l’induction du modèle sur une surface plane chaude et stérile munie d’un moyen de fixer des dispositifs de stabilisation pour maintenir la souris en place (Figure 1A). Effectuez la chirurgie avec un microscope à dissection sur une surface stérilisée.
REMARQUE : Utilisez une hotte de qualité chimique si la capture d’anesthésie n’est pas disponible. - Utilisez de la soie chirurgicale ou même du fil avec des élastiques noués à l’extrémité des cordes accrochées aux bords nervurés de la plaque comme contention si vous utilisez la plaque de base recommandée dans le tableau des matériaux.
- Placer une station de récupération de coussins chauffants sur une surface adjacente à l’installation chirurgicale pour le transfert des souris à la station immédiatement après l’injection (Figure 1B).
REMARQUE : Placez une cage de boîtier vide sur le coussin chauffant au moins 10 minutes avant l’injection pour permettre à la cage de chauffer jusqu’à une température confortable (37 °C). Placez la cage à moitié hors du coussinet, pour permettre à la souris éveillée de préférer les températures de récupération. - Préparez l’urokinase en la diluant dans de l’eau stérile. Nettoyez la seringue Hamilton à l’aide d’un alcool et rincez-la à l’eau stérile. Préparez la solution à l’avance afin que la souris soit sous anesthésie le moins longtemps possible. Utiliser 5 μL d’activateur urinaire du plasminogène à 2 mg/mL pour le modèle ; pour les couvre-oreillers, utilisez 5 μL de sérum physiologique stérile.
- Réglez la station d’anesthésie à l’isoflurane à un niveau de 4 % ou moins pour cette courte procédure. Placez la souris dans la chambre d’induction ; En règle générale, le rythme respiratoire rapide de la souris ralentit en 1 à 2 minutes, passant du mouvement du haut de la poitrine au bas de la poitrine.
- Utilisez un niveau d’oxygène de 1,5 L/min et une cartouche de charbon actif F ou travaillez sous un flux biologique ou une hotte d’évacuation aérienne pour frotter l’isoflurane afin d’éviter l’exposition au chirurgien animalier. S’il n’est pas disponible, effectuez la procédure dans une hotte de sécurité chimique.
- Basculez rapidement le flux de souris et d’anesthésique vers la zone chirurgicale sur un coussin chauffant à 37 °C, en plaçant le nez de la souris dans le cône nasal pour maintenir le niveau d’anesthésie (Figure 1C,D). Assurez-vous que la souris n’a pas de mouvement réflexe pour pincer les orteils, puis retenez la souris sur la plaque de base.
REMARQUE : S’il y a du mouvement, replacez la souris dans la chambre d’induction et répétez cette opération. - Nettoyez la zone de la peau du dos avec un tampon imbibé d’alcool. Ajustez l’éclairage LED au besoin pour avoir une vue claire du dos de la souris anesthésiée.
REMARQUE : Si nécessaire, utilisez un rasoir électrique pour enlever les poils du dos de la souris afin qu’il y ait une vue dégagée sur les crêtes de la colonne vertébrale sous la peau. Si les souris expérimentales sont rasées, rasez également le dos des souris naïves et factices pour l’étude de l’aveuglement. - Injecter la souris alors qu’elle est complètement anesthésiée et immobilisée (pas de réflexe de redressement ni de retrait du pincement des orteils). À l’aide de deux doigts, palpez doucement l’endroit où le bas de la cage thoracique de la souris rencontre la colonne vertébrale (Figure 2A). En dessous de ce point se trouvent les segments de la colonne vertébrale du bois d’œuvre ; visez l’injection ici à L2-L3.
- Placez l’embout de la seringue Hamilton à côté de la colonne vertébrale (Figure 2B,C). Dirigez la seringue à un angle de ~45° dans le ligament interépineux immédiatement adjacent à l’os.
REMARQUE : En fonction de la ténacité de la peau de la souris, il est parfois préférable de s’appuyer sur la gravité au lieu d’une pression active et d’un angle de 90°. - Insérez la pointe de l’aiguille doucement mais fermement dans le ligament interépineux (Figure 3B,C).
REMARQUE : Le but n’est pas de percer la cavité abdominale mais d’injecter le ligament. - Videz lentement le contenu de l’aiguille. Si, à un moment donné, il y a du liquide à l’extrémité, l’aiguille n’est pas à travers la peau. Continuez jusqu’à ce que les 5 μL aient été injectés.
- Maintenez l’aiguille en place pendant ~5 s pour empêcher le reflux de l’injection. L’utilisation d’un colorant bleu dans les essais pilotes en phase terminale ou en phase aiguë est recommandée.
REMARQUE : Si cela est fait correctement, le liquide devrait se répandre dans le ligament comme indiqué (Figure 3A). - Retirez l’aiguille doucement et lentement. Assurez-vous qu’il n’y a pas de sang ou d’écoulement.
- Placez la souris dans la station de récupération de chaleur avec un dessus de cage jusqu’à ce qu’elle se réveille et soit mobile avant de la ramener dans la cage d’accueil.
REMARQUE : En supposant que la procédure a été effectuée rapidement, il ne devrait pas s’écouler plus d’une minute avant que la souris ne se réveille. - Examinez les souris pendant 1 heure après la chirurgie pour vous assurer que toutes les fonctions motrices normales se poursuivent par mesure de précaution.
REMARQUE : Si cela est fait correctement, il ne devrait y avoir aucune complication de cette procédure. - Examinez les souris tous les jours pendant la semaine suivant la chirurgie, y compris l’évaluation du poids et l’inspection du site d’injection pour vous assurer qu’aucune infection ou complication ne s’est produite. N’utilisez pas la souris pour d’autres expériences s’il y a un changement de comportement, comme une perte de poids et une léthargie.

Figure 1 : Configuration de l’induction de l’urokinase CBP. (A) La plaque de base Fine Science Tools recommandée pour les chirurgies de la souris. Les bords nervurés peuvent avoir une ficelle accrochée pour maintenir la souris en place. (B) Station de récupération. Il est recommandé d’utiliser une cage de boîtier vide, à moitié sur le coussin chauffant, à moitié éteinte. Un chiffon propre est placé sur le fond pour donner à la souris une zone de repos confortable. (C) Recommandation de configuration de l’appareil d’anesthésie. À l’aide d’un système d’administration à deux canaux, installez un tuyau vers la chambre d’induction et un autre vers le poste de chirurgie. (D) Une vue des dispositifs de retenue des souris. Deux cordes sont nouées sur les bords nervurés de la plaque de base, puis tirées doucement sur le manche et l’arrière de la souris respectivement. Assurez-vous de ne pas trop retenir la souris pour qu’elle puisse continuer à respirer normalement. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Induction de la CBP par injection d’urokinase. (A) Vue de l’emplacement du site d’injection. Comme illustré, tâtez avec les doigts pour trouver le bas de la cage thoracique de la souris pour un point de référence pour L4-L5. (B) Une vue du processus d’injection, montrant l’angle d’injection approprié. (C) Un angle de 45° est préférable ici, mais ajustez au besoin pour vous assurer que l’aiguille arrive là où elle doit aller. Si nécessaire, rasez le site d’injection pour une meilleure visualisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Schéma du site d’injection. (A) Une photographie de l’emplacement du site d’injection. L’encre est utilisée ici pour indiquer où le liquide entrera dans le ligament interépineux entre les vertèbres L2 et L3. (B) Un schéma montrant le bon positionnement de l’aiguille et l’emplacement du site d’injection, vu de côté. (C) Un schéma montrant une vue de haut en bas des vertèbres et des sites d’injection des ligaments interépineux. Les injections se font généralement sur les ligaments interépineux à côté de la colonne vertébrale, mais l’aiguille peut également être insérée dans l’espace entre les vertèbres et les vertèbres intertransverses. L’utilisation d’un colorant bleu dans les essais pilotes est recommandée, comme indiqué en (A). Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Tests comportementaux
- Test de seuil de réponse réflexe mécanique de von Frey
REMARQUE : Le seuil de retrait mécanique est la force minimale nécessaire pour obtenir une réponse dans 50 % des cas avec une série de 8 monofilaments von Frey de diamètre gradué avec des augmentations de ~0,2 g, fournissant des changements de force mécanique par palier logarithmique (tableau des matériaux).- Testez la stimulation mécanique avec des fibres de von Frey appliquées sur la patte arrière, le territoire d’innervation des nerfs lombo-sacrés. Déterminez les valeurs de base du retrait de la patte avant la chirurgie. Après la chirurgie, déterminez le seuil mécanique une fois par semaine pendant l’expérience chronique.
- Sortez les animaux de la salle de logement et acclimatez-les dans la salle d’examen pendant 30 minutes dans leurs cages d’accueil avant les tests. À partir de là, déplacez les animaux pour les retenir individuellement dans de petites cabines transparentes sur la table de test surmontée d’un écran pendant 15 à 20 minutes selon leur niveau d’activité.
REMARQUE : Les tests peuvent commencer une fois que les souris se sont installées en position de repos et ne tournent pas et ne bougent pas dans la chambre. L’acclimatation à la cabine de contention minimise les effets induits par le stress. Si les souris ont été maintenues sur un cycle d’éclairage inversé, les tests doivent être effectués dans des conditions de lumière rouge. - Procéder à l’essai en utilisant des séries graduées de fibres de von Frey comme décrit ci-dessous et dans Chaplan et al.9.
- Sondez le coussinet plantaire à un endroit constant sur chaque animal à l’aide du filament de von Frey 3,61 qui, lorsqu’il est plié, provoque une force de 0,4 g (tableau des matériaux). Poursuivez avec la stimulation avec le filament de von Frey 4,08 qui provoque une force de 1,0 g .
REMARQUE : Aucune de ces fibres ne suscite de réponses chez les animaux naïfs et acclimatés. - Appliquez chaque filament 5 fois à des intervalles de >5 s perpendiculairement au coussinet plantaire, en prenant soin de ne pas toucher un pli/une crevasse ou un poil. Une réponse positive est un retrait du pied à trois des cinq stimuli. Appliquez le filament suivant plus faible de la série jusqu’à ce que l’animal ne réponde plus à la stimulation mécanique ; À ce stade, utilisez le filament supérieur suivant. S’il suscite une réponse, utilisez à nouveau le filament inférieur jusqu’à ce que quatre essais aient été appliqués après le changement de réponse à la stimulation mécanique du coussinet plantaire.
- Utilisez le modèle de réponse obtenu pour calculer le seuil de retrait mécanique, la quantité minimale de force nécessaire pour obtenir une réponse dans 50 % des cas, à l’aide d’un algorithme d’ajustement de courbe9. Une diminution de la force nécessaire pour provoquer une réaction de retrait du pied par rapport aux souris naïves ou à la ligne de base de l’animal indique une sensibilité accrue de l’animal.
- Sondez le coussinet plantaire à un endroit constant sur chaque animal à l’aide du filament de von Frey 3,61 qui, lorsqu’il est plié, provoque une force de 0,4 g (tableau des matériaux). Poursuivez avec la stimulation avec le filament de von Frey 4,08 qui provoque une force de 1,0 g .
- Test de seuil de réponse réflexe thermique
NOTA : Les seuils de réponse à la chaleur et au froid sont déterminés à l’aide des essais de Hargreaves et de la plaque froide, respectivement.- Test de Hargreaves
- Placez les souris dans des cabines sur une surface en verre chauffée par le bas à l’aide d’un émetteur infrarouge. Enregistrez la latence pour retirer le pied sous forme de temps en secondes entre l’application du stimulus de lumière infrarouge (50 °C) fourni par l’appareil sur la patte arrière de la souris jusqu’au retrait de la stimulation.
- Test de la plaque froide
- Placez les souris sur l’appareil à plaque froide refroidi à -9 °C. Enregistrez la latence pour retirer le pied sous forme de temps en secondes entre le placement de la souris sur l’appareil et le moment où la souris commence à lever le pied.
- Vous pouvez également placer une sonde froide refroidie à -9 °C sous la patte arrière de la souris pendant que celle-ci est en cage au sommet d’un grillage. Enregistrez la latence de retrait sous forme de temps en secondes entre le placement de l’appareil sous la patte arrière et le moment où la souris commence à soulever, à lécher ou à secouer les pieds. Pour éviter de provoquer une réponse nociceptive, habituez la souris à être touchée par la sonde à température ambiante.
- Test de Hargreaves
- Tests comportementaux dépendants de la cognition et des émotions
REMARQUE : L’hypersensibilité de longue durée chez les animaux produit un dysfonctionnement émotionnel et cognitionneux. Ceux-ci ne sont généralement mesurés qu’une seule fois au cours de la semaine 6 après l’induction du modèle de douleur pour éviter les effets de la pratique.- Tests d’anxiété
REMARQUE : L’anxiété et la dépression peuvent également être testées de manière fiable pour déterminer l’efficacité du modèle. Il est préférable d’attendre au moins jusqu’à 4 à 6 semaines après l’injection d’induction pour permettre aux comorbidités de se développer. La préférence pour l’obscurité plutôt que pour la chambre claire est une mesure de l’anxiété liée à la nociception. Dans le test du labyrinthe zéro ou plus, les souris modèles de douleur passent moins de temps dans les quadrants ouverts que les animaux témoins naïfs, ce qui montre un comportement anxieux10,11.- Test de préférence de place claire/sombre : placer chaque animal dans la boîte de test de préférence de place avec un passage entre deux chambres (10 x 10 x 10 cm3). Une chambre de l’appareil est très éclairée, tandis que le côté opposé reste sombre. Au cours de chaque test de 10 minutes, surveillez l’emplacement de l’animal à l’aide d’un ordinateur pour déterminer les temps d’occupation de la lumière et de l’obscurité et le nombre de transitions.
REMARQUE : Vous pouvez également monter une caméra vidéo sur la chambre d’essai et enregistrer manuellement le temps passé dans chaque chambre. - Labyrinthes surélevés plus ou zéro : placez les modèles de rongeurs ou d’animaux naïfs sur le labyrinthe et utilisez un chronomètre pour évaluer le temps passé dans les parties fermées du labyrinthe. Déterminez le temps passé dans les deux zones « sûres » fortifiées et les deux zones « dangereuses » ouvertes. Les animaux souffrant de douleur préfèrent les zones fermées et sûres.
REMARQUE : Le comportement anxieux peut être testé dans un labyrinthe zéro ou plus (10 min). Le labyrinthe zéro est une piste circulaire par opposition au labyrinthe plus, qui est « en forme de signe plus ». Les deux ont deux quadrants ouverts et deux quadrants fermés qui permettent un comportement exploratoire continu. Les deux sont surélevés à 1 m du sol, soit une passerelle circulaire ou en forme de plus divisée en quatre quadrants de taille égale.
- Test de préférence de place claire/sombre : placer chaque animal dans la boîte de test de préférence de place avec un passage entre deux chambres (10 x 10 x 10 cm3). Une chambre de l’appareil est très éclairée, tandis que le côté opposé reste sombre. Au cours de chaque test de 10 minutes, surveillez l’emplacement de l’animal à l’aide d’un ordinateur pour déterminer les temps d’occupation de la lumière et de l’obscurité et le nombre de transitions.
- Test de dépression par éclaboussures de saccharose
REMARQUE : Le test d’éclaboussure de saccharose est utilisé pour déterminer un comportement semblable à la dépression. Le test d’éclaboussures permet de mesurer l’absence de comportement de toilettage normal en tant que symptôme de dépression résultant de douleurs chroniques.- Évaluez la fréquence, la durée et la latence du toilettage pendant 10 minutes après avoir pulvérisé une solution de saccharose à 10-30 % sur le pelage dorsal (~ 250 μL près de la base de la queue). Demander à des observateurs aveuglés de compter le nombre de manœuvres de toilettage à partir d’enregistrements vidéo12.
REMARQUE : Il a été rapporté que cet indice était affecté dans des modèles de rongeurs de troubles de l’humeur, tels que le stress chronique léger, et qu’il était corrigé par un traitement antidépresseur chronique13.
- Évaluez la fréquence, la durée et la latence du toilettage pendant 10 minutes après avoir pulvérisé une solution de saccharose à 10-30 % sur le pelage dorsal (~ 250 μL près de la base de la queue). Demander à des observateurs aveuglés de compter le nombre de manœuvres de toilettage à partir d’enregistrements vidéo12.
- Test d’objet novateur
REMARQUE : Le dysfonctionnement cognitif est mesurable à l’aide du test du nouvel objet.- Acclimatez les souris individuellement dans une cage en plastique transparent avec un couvercle ouvert (56 x 30 x 20 cm) pendant 1 h. Ajoutez deux figurines identiques dans les coins opposés de la cage pendant 5 minutes.
- Le jour du test, acclimatez à nouveau les animaux à la cage transparente pendant 1 h avant de placer les deux figurines identiques dans les mêmes positions de la cage pendant 5 minutes avant de les remettre dans la cage d’accueil.
- Remplacez l’une des figurines originales par un nouvel objet nettement différent, remettez les souris dans la cage d’essai 4 h plus tard et notez le temps passé à explorer les objets.
- Calculez l’indice de reconnaissance (IR) déclaré comme le pourcentage de temps passé à explorer le nouvel objet par rapport au temps total d’exploration de l’objet14.
- Évaluation de la fonction motrice
REMARQUE : Le test de mobilité et de perturbation de la marche par tache d’encre15 évalue la fonction motrice dans le modèle de mal de dos.- Construisez un tunnel à partir d’un tube d’essuie-tout coupé dans le sens de la longueur sur un bord. Étalez le tunnel sur un morceau de papier d’imprimante propre.
- Tenez les souris doucement enveloppées dans une serviette jusqu’à ce qu’elles soient calmes. Placez les pattes sur un tampon encreur humide avec de l’encre de Chine non toxique pour les enduire d’encre ou peignez l’encre sur le dessous des pattes de la souris à l’aide d’un coton-tige. Relâchez les souris à l’entrée du tunnel et laissez-les courir à travers le tunnel, les capturant à la fin.
- Évaluez les empreintes de pattes en fonction de trois paramètres : la longueur de la foulée (la distance verticale entre l’extrémité arrière d’une empreinte à l’autre), la largeur de la foulée (la distance horizontale entre les empreintes) et l’écartement des orteils (la distance entre les orteils des côtés opposés de la patte).
REMARQUE : Des friandises approuvées peuvent également être utilisées pour encourager la souris à traverser le tunnel. Si les empreintes de pattes sont tachées ou peu claires, l’expérience doit être répétée.
- Tests d’anxiété
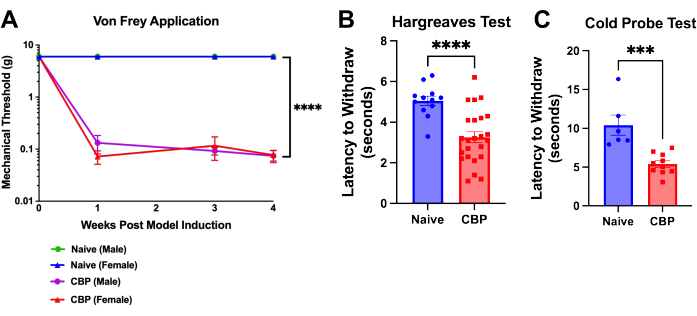
Figure 4 : Hypersensibilité mécanique et thermique suite à l’induction du CBP. La douleur est mesurable une semaine après l’induction du modèle et persiste pendant 8 semaines. (A) Critère de von Frey. Le test de seuil mécanique est effectué avec des filaments von Frey appliqués sur le repose-pieds à travers une table supérieure en maille avec la méthode haut-bas comme indiqué ici sur une période de 4 semaines. Le seuil du mâle naïf (vert) est caché sous la ligne bleue pour les souris femelles naïves. Les souris CBP (n = 4 mâles, 4 femelles) ont montré une sensibilité mécanique significativement accrue par rapport aux témoins naïfs (n = 2 mâles, 2 femelles). Une ANOVA bidirectionnelle (test de comparaisons multiples de Dunnett) a été réalisée sur ces données : n = 4 par groupe. Dans les analyses post-hoc, l’ajustement de Bonferroni à toutes les valeurs de P pour les comparaisons semaine par semaine du CBP par rapport à Naïve a donné les 11 valeurs < 0,0011. p < 0,0001. (B) Critère de Hargreaves. Le seuil de chaleur a été testé sur le repose-pieds avec le test de Hargreaves (50 °C). Les souris CBP (n = 12 mâles, 12 femelles) ont montré une sensibilité à la chaleur significativement accrue par rapport aux témoins naïfs (n = 6 mâles, 6 femelles). Le test t bilatéral de Mann-Whitney a été effectué pour tester la signification (p < 0,0001). (C) Sensibilité au froid. L’essai de la sonde froide a été effectué en plaçant des souris sur l’appareil à plaque froide refroidi à -9 °C. La latence de retrait a été enregistrée comme le temps en secondes entre le placement de la souris sur l’appareil et le moment où la souris commence à soulever, à lécher ou à secouer le pied. Dans les données présentées, une sonde froide refroidie à -9 °C a été placée sous la patte arrière de la souris pendant que la souris est en cage au sommet d’un grillage. Toutes les souris ont été testées 1 à 3 semaines après l’injection. Les souris CBP (n = 4 mâles, 6 femelles) ont montré une sensibilité au froid significativement accrue par rapport aux témoins naïfs (n = 2 mâles, 4 femelles). Le test t bilatéral de Mann-Whitney a été effectué pour tester la signification (p = 0,0002). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
Tests comportementaux liés à la nociceptivité et analyse des données
Mesures évoquées
L’hypersensibilité sur le coussinet plantaire se développe dans la journée suivant l’injection d’urokinase. En 1 semaine, le seuil de sevrage est significativement diminué et persiste jusqu’à l’euthanasie ; c’est ce que montre la semaine postopératoire 4 (Figure 4A). La latence de retrait des pattes est analysée à l’aide de la méthode de v...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ce modèle de mal de dos chronique est simple à induire, et l’hypersensibilité établie en 1 semaine peut durer jusqu’à (et peut-être au-delà) 8 semaines. Cela permet une étude précise de l’état de douleur chronique, contrairement à d’autres modèles aigus qui ne durent qu’une semaine ou deux. Bien que nous montrions le modèle chez la souris, le modèle CBP induit par l’uPA peut également être établi chez le rat2. L’un des avantages du modèle est que l’évolution prol...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas d’intérêts financiers concurrents. KNW reconnaît avoir consulté de manière non rémunérée NeuroChronix, Bessor Pharma et USA Elixeria BioPharm, Inc.
Remerciements
La subvention a été fournie par NIH HEAL UG3 NS123958. Les installations d’hébergement ont été inspectées et accréditées par l’AAALAC. Les animaux étaient hébergés dans les locaux du Centre des ressources animales (ARC) entretenus par le personnel du laboratoire et le personnel de la Division des ressources de laboratoire et des animaux (DLAR). Les procédures de test comportemental sont des méthodes standard dans le domaine, approuvées par l’American Pain Society et l’Association internationale pour l’étude de la douleur. La méthode d’euthanasie est conforme aux recommandations du groupe d’experts sur l’euthanasie de l’American Veterinary Medical Association.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Animals and Consumables | |||
| 70% ethanol | Local Source | ||
| BALB/c mice | Envigo | 20-25 g | |
| Cotton balls | Fisher Scientific | 19-090-702 | |
| Cotton-tipped applicators | Fisher Scientific | 19-062-616 | |
| Isoflurane inhalant anesthetic | MedVet | RXISO-250 | |
| Labeling tape | Fisher Scientific | NGFP7002 | |
| Nitrile exam gloves | Fisher Scientific | ||
| Oxygen tank | Local Source | ||
| Surgical drape, Steri-Drape Utility Sheet, Absorbent Prevention | VWR | 76246-788 | cut into 15 x 15 cm pieces |
| Tygon tubing with 3 mm inner diameter | Grainger | 22XH87 | |
| Equipment | |||
| #11 carbon steel scalpel blades | VWR | 21909-612 | |
| Anesthesia induction chamber | Summit Medical Equipment Company | AS-01-0530-LG | |
| Autoclave | Local Unit | ||
| Biology Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| Glass bead sterilizer Germinator 500 | VWR | 102095-946 | |
| IITC Life Sciences Series 8 Model PE34 Hot/Cold Plate Analgesia Meter | IITC | PE34 | |
| Integra Miltex cotton & dressing pliers | Safco Dental Supply | 66-317 | |
| OPTIKA CL31 double arm LED illuminator | New York Microscope Company | OPCL-31 | |
| Plantar Test System with InfraRed Emitter, i. e. Hargreaves Apparatus | Ugo Basile | 37370-001 and 37370-002 | |
| Scalpel Handle No. 3 | VWR | 25607-947 | |
| Small animal heating pad | Valley Vet Supply | 47375 | |
| Student Vannas spring scissors, straight blade | Fine Science Tools | 91500-09 | |
| Table top animal research portable anesthesia workstation “PAM” | Patterson Scientific | AS-01-0007 | |
| Von Frey Filaments | Ugo Basile | 37450-275 |
Références
- O'Sullivan, P. B., et al. Back to basics: 10 facts every person should know about back pain. British Journal of Sports Medicine. 54 (12), 698-699 (2020).
- Nauta, H. J., McIlwrath, S. L., Westlund, K. N. Punctate midline myelotomy reduces pain responses in a rat model of lumbar spine pain: evidence that the postsynaptic dorsal column pathway conveys pain from the axial spine. Cureus. 10 (3), 2371(2018).
- Shuang, F., et al. Establishment of a rat model of lumbar facet joint osteoarthritis using intraarticular injection of urinary plasminogen activator. Scientific Reports. 5 (1), 9828(2015).
- Reed, N. R., et al. Somatosensory behavioral alterations in a NGF-induced persistent low back pain model. Behavioural Brain Research. 418, 113617(2022).
- Suh, H. R., Cho, H. -Y., Han, H. C. Development of a novel model of intervertebral disc degeneration by the intradiscal application of monosodium iodoacetate (MIA) in rat. The Spine Journal. 22 (1), 183-192 (2022).
- Kim, H., Hong, J. Y., Lee, J., Jeon, W. -J., Ha, I. -H. IL-1β promotes disc degeneration and inflammation through direct injection of intervertebral disc in a rat lumbar disc herniation model. The Spine Journal. 21 (6), 1031-1041 (2021).
- Millecamps, M., Tajerian, M., Sage, E. H., Stone, L. S. Behavioral signs of chronic back pain in the SPARC-null mouse. Spine. 36 (2), 95-102 (2011).
- La Porta, C., Tappe-Theodor, A. Differential impact of psychological and psychophysical stress on low back pain in mice. Pain. 161 (7), 1442-1458 (2020).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Takao, K., Miyakawa, T. Light/dark transition test for mice. Journal of Visualized Experiments JoVE. (1), e104(2006).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- David, D. J., et al. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron. 62 (4), 479-493 (2009).
- Yalcin, I., et al. A time-dependent history of mood disorders in a murine model of neuropathic pain. Biological Psychiatry. 70 (10), 946-953 (2011).
- Madathil, S. K., et al. Astrocyte-specific overexpression of insulin-like growth factor-1 protects hippocampal neurons and reduces behavioral deficits following traumatic brain injury in mice. PloS One. 8 (6), e67204(2013).
- Sugimoto, H., Kawakami, K. Low-cost protocol of footprint analysis and hanging box test for mice applied the chronic restraint stress. Journal of Visualized Experiments: JoVE. (143), e59027(2019).
- Hassan, S., et al. Identifying chronic low back pain phenotypic domains and characteristics accounting for individual variation: a systematic review. Pain. , (2023).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon