Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Модель боли в спине мыши, индуцированная активатором плазминогена урокиназного типа
В этой статье
Резюме
Здесь представлены методы простой и быстрой индукции модели боли в спине у мышей с использованием интрасвязочной инъекции активатора плазминогена в моче.
Аннотация
Модель персистирующей боли в пояснице может быть индуцирована у мышей с помощью простой методики, описанной в этой статье. Здесь представлены пошаговые методы простой и быстрой индукции модели персистирующей боли в спине у мышей с использованием инъекции активатора плазминогена урокиназного типа (урокиназы), сериновой протеазы, присутствующей у людей и других животных. Методика индукции персистирующей боли в пояснице у мышей включает простую инъекцию урокиназы вдоль области прикрепления связок поясничного отдела позвоночника. Воспалительный агент урокиназа активирует плазминоген в плазмин. Как правило, модель может быть индуцирована в течение 10 минут, и гиперчувствительность сохраняется не менее 8 недель.
Гиперчувствительность, нарушение походки и другие стандартные тревожные и депрессивные показатели могут быть проверены в персистирующей модели. Боль в спине является наиболее распространенным типом боли. Чтобы повысить осведомленность о боли в спине, Международная ассоциация по изучению боли (IASP) назвала 2021 год «Глобальным годом боли в спине», а 2022 год — «Глобальным годом воплощения знаний о боли в практику». Одним из ограничений терапевтического прогресса в области лечения боли является отсутствие подходящих моделей для тестирования постоянной и хронической боли. Особенности этой модели подходят для тестирования потенциальных терапевтических средств, направленных на уменьшение боли в спине и ее вспомогательных характеристик, что способствовало тому, что IASP назвала 2022 год Всемирным годом воплощения знаний о боли в практику.
Введение
Боль в пояснице является одной из наиболее распространенных причин инвалидности, от которой страдает каждый пятыйчеловек во всем мире1. Несмотря на эти усилия, лишь немногие надежные модели боли в спине на животных широко используются в исследованиях боли на животных, особенно на мышах. Предыдущие модели использовали почти исключительно крыс для индукции хронической боли в спине (ХБП), например, вызванной инъекцией активатора плазминогена в моче (uPA) в поясничный фасеточный сустав 2,3, инъекцией фактора роста нервов (NGF) в мускулатуру туловища4 или йодоацетата натрия (MIA)5 или интерлейкина-1бета6 инъекция во внутрипозвоночный диск. Конечно, крысы предпочтительны для этих моделей в основном из-за их большего размера и легкости доступа для инъекций воспалительных агентов.
Чтобы внести ясность, мышиные модели боли в спине действительно существуют, такие как SPARC-нулевая мышиная модель дегенерации межпозвоночных дисков, используемая в течение многих лет7, но они более дорогостоящие и трудоемкие для создания, чем модели, основанные на инъекциях. Недавнее исследование на мышах установило модель боли в пояснице путем сочетания инъекций NGF в мышцы нижней части спины с вертикальнымхроническим стрессом. В следующем протоколе мы адаптировали uPA-индуцированную модель CBP на крысах для мышей2. Гиперчувствительность устанавливается в течение 1 недели и сохраняется до 6-8 недель. Кроме того, мы установили, что у мышей развивается поведение, похожее на тревогу и депрессию. Учитывая распространенность боли в спине и более распространенное использование мышей в молекулярных исследованиях боли, эта устойчивая модель легко устанавливается для использования в разработке новых стратегий лечения боли в спине.
Access restricted. Please log in or start a trial to view this content.
протокол
Все описанные процедуры с животными соответствуют Руководству NIH по уходу за лабораторными животными и их использованию. Исследования были одобрены местным Комитетом по институциональному уходу и использованию (IACUC #23-201364-HSC) Центра медицинских наук Университета Нью-Мексико. Все исследования проводятся в соответствии с политикой OLAW Assurance of Compliance (A3002-01) в отношении использования животных в исследованиях, как описано в Части III. II. Заверения и сертификаты. Животные размещаются в помещениях Центра ресурсов животных (ARC), обслуживаемом персоналом лаборатории и сотрудниками Отдела лабораторных ресурсов и ресурсов для животных (DLAR). Метод эвтаназии (инъекция пентобарбитала в дозе 100 мкл 59 мг/мл) является быстрым и надежным и позволяет проводить вскрытие и забор различных тканей для дальнейших исследований.
1. Животные
- Содержание взрослых (~3-4 недель) самца и самки мышей BALB/c (20-25 г) в обратном цикле 12 ч:12 ч свет:темнота, поэтому их активное время в темноте приходится на время работы лаборатории.
ПРИМЕЧАНИЕ: Это позволит оценить все параметры в естественное время активности животных, так как грызуны по своей природе являются ночными животными. Это уменьшает вклад изменений в циркадные часы, чтобы животные могли быть протестированы во время их активности, которое теперь является дневным. - Наблюдайте за животными два раза в день.
- При оценке влияния препарата на поведение, связанное с болью, содержание соевого белка у мышей ниже, чем у стандартного корма для грызунов (который, как известно, изменяет гиперчувствительность), содержат мышей на нормальном корме, связанном с болью.
- Взвешивайте животных один раз в неделю, чтобы обеспечить поддержание здорового набора веса.
ПРИМЕЧАНИЕ: На протяжении 8-10-недельных исследований не было отмечено групповых различий в весе, что позволило провести исследование с ослеплением.
2. Индукция модели
- Выполните индукцию модели на теплой стерильной плоской поверхности, оснащенной средствами для крепления стабилизационных ограничителей для удержания мыши на месте (рис. 1A). Проводите операцию с помощью диссекционного микроскопа на стерилизованной поверхности.
ПРИМЕЧАНИЕ: Используйте вытяжной шкаф для химикатов, если захват анестезии недоступен. - Используйте хирургический шелк или даже пряжу с резиновыми лентами, завязанными на концах веревок, прикрепленных к ребристым краям пластины, в качестве ограничителей при использовании опорной пластины, рекомендованной в таблице материалов.
- Разместите станцию восстановления грелки на поверхности, прилегающей к операционной установке для переноса мышей на станцию сразу после инъекции (рис. 1B).
ПРИМЕЧАНИЕ: Поместите пустую клетку корпуса на электрогрелку не менее чем за 10 минут до впрыска, чтобы клетка нагрелась до комфортной температуры (37 °C). Поместите клетку наполовину с подушечки, чтобы просыпающаяся мышь могла предпочесть температуру восстановления. - Приготовьте урокиназу, разведя ее в стерильной воде. Спиртом очистите шприц Hamilton и промойте в стерильной воде. Составьте раствор заранее, чтобы мышь находилась под наркозом как можно меньшее время. Используйте 5 мкл 2 мг/мл активатора плазминогена в моче для модели; для шамс используйте 5 мкл стерильного физиологического раствора.
- Настройте анестезиологическую станцию изофлурана на уровне 4% или меньше для этой короткой процедуры. Поместите мышь в индукционную камеру; Как правило, учащенное дыхание мыши замедляется в течение 1-2 минут, переходя от движения верхней части груди к нижней.
- Используйте уровень кислорода 1,5 л/мин и канистру с активированным углем F или работайте под биологическим потоком или верхним вакуумным колпаком, чтобы очистить изофлуран, чтобы избежать контакта с ветеринаром. Если нет такой возможности, выполните процедуру в химическом защитном колпаке.
- Быстро переключите поток мыши и анестетика в операционную область на грелке с температурой 37 °C, поместив нос мыши в носовой конус для поддержания уровня анестетика (рис. 1C, D). Убедитесь, что у мыши нет рефлекторного движения, чтобы зажать пальцы ног, а затем удерживать мышь на опорной пластине.
ПРИМЕЧАНИЕ: Если есть движение, поместите мышь обратно в индукционную камеру и повторите это. - Очистите участок кожи спины спиртовым тампоном. Отрегулируйте светодиодное освещение по мере необходимости, чтобы иметь четкий обзор спины мыши под наркозом.
ПРИМЕЧАНИЕ: При необходимости используйте электробритву, чтобы удалить волосы со спины мыши, чтобы обеспечить беспрепятственный обзор гребней позвоночника под кожей. Если подопытные мыши побриты, также побрейте спину наивным и бутафорским мышам для ослепления изучения. - Вводите мышь под полным наркозом и обездвиженным (без рефлекса выпрямления и снятия зажима пальца ноги). Двумя пальцами осторожно пощупайте место, где нижняя часть грудной клетки мыши встречается с позвоночником (рис. 2A). Ниже этой точки находятся поясничные сегменты позвоночника; направьте впрыск здесь на L2-L3.
- Поместите наконечник шприца Hamilton рядом с позвоночником (Рисунок 2B, C). Направьте шприц под углом ~45° в межостистую связку, непосредственно прилегающую к кости.
ПРИМЕЧАНИЕ: В зависимости от прочности кожи мыши, иногда лучше полагаться на гравитацию вместо активного давления и угол 90°. - Осторожно, но плотно введите кончик иглы в межостистую связку (рис. 3B, C).
ПРИМЕЧАНИЕ: Цель состоит не в том, чтобы прорвать брюшную полость, а в том, чтобы ввести связку. - Медленно опорожните содержимое иглы. Если в какой-то точке на кончике есть жидкость, игла не проходит через кожу. Продолжайте до тех пор, пока не будут введены все 5 мкл.
- Удерживайте иглу на месте в течение ~5 с, чтобы предотвратить обратный поток от инъекции. Рекомендуется использовать синий краситель в терминальных или острых пилотных испытаниях.
ПРИМЕЧАНИЕ: Если все сделано правильно, жидкость должна распределиться по связке, как показано на рисунке (Рисунок 3A). - Извлеките иглу осторожно и медленно. Убедитесь, что нет крови или выделений.
- Поместите мышь в станцию рекуперации тепла с верхней частью, пока она не проснется и не станет подвижной, прежде чем возвращать ее в домашнюю клетку.
ПРИМЕЧАНИЕ: При условии, что процедура была выполнена быстро, до пробуждения мыши должно пройти не более минуты. - В качестве меры предосторожности проверяйте мышей в течение 1 часа после операции, чтобы убедиться, что все нормальные двигательные функции продолжаются.
ПРИМЕЧАНИЕ: Если все сделано правильно, осложнений от этой процедуры возникнуть не должно. - Проверяйте мышей ежедневно в течение недели после операции, включая оценку веса и осмотр места инъекции, чтобы убедиться в отсутствии инфекции или осложнений. Не используйте мышь для дальнейших экспериментов, если есть изменения в поведении, такие как потеря веса и вялость.

Рисунок 1: Настройка для индукции КБП урокиназы. (A) Базовая пластина Fine Science Tools, рекомендуемая для операций на мышах. На ребристых краях может быть веревка с крючком для удержания мыши на месте. (B) Станция восстановления. Рекомендуется пустая клетка корпуса, наполовину на грелке, наполовину выключенная. На дно положена чистая ткань, чтобы мышь могла удобно отдыхать. (C) Рекомендации по настройке наркозного аппарата. Используя двухканальную систему подачи, проложите один шланг к индукционной камере, а другой к операционному пункту. (D) Вид ограничителей мыши. Две нити завязываются на ребристых краях опорной пластины, а затем осторожно натягиваются на шею и заднюю часть мыши соответственно. Следите за тем, чтобы мышь не удерживалась слишком сильно, чтобы она могла нормально дышать. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Индукция инъекции ХБП урокиназой. (A) Вид места инъекции. Как показано на рисунке, нащупайте пальцами, чтобы найти нижнюю часть грудной клетки мыши для опорной точки для L4-L5. (B) Вид процесса впрыска с указанием угла для правильного впрыска. (C) Здесь предпочтительнее угол 45°, но при необходимости отрегулируйте, чтобы игла попала туда, куда нужно. При необходимости побрейте место инъекции для лучшей визуализации. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Схема места инъекции. (А) Фотография расположения места инъекции. Чернила здесь используются, чтобы указать, где жидкость будет попадать в межостистую связку между позвонками L2 и L3. (B) Схема, показывающая правильное положение иглы и расположение места инъекции, показанная сбоку. (C) Диаграмма, показывающая вид сверху вниз на позвонки и места инъекций для межостистых связок. Инъекции, как правило, делаются в межостистые связки рядом с позвоночником, но игла также может быть введена в пространство между позвонками и между ними. Использование синего красителя в пилотных испытаниях рекомендуется, как показано на рисунке (А). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Поведенческие анализы
- Пороговое испытание механического рефлекса фон Фрея
ПРИМЕЧАНИЕ: Механический порог отвода - это минимальное усилие, необходимое для получения ответной реакции в 50% случаев с серией из 8 мононитей фон Фрея, градуированных по диаметру с увеличением ~0,2 g, обеспечивающих логарифмические изменения шага механического усилия (Таблица материалов).- Тестовая механическая стимуляция волокнами фон Фрея, приложенная к задней лапе, территории иннервации пояснично-крестцовых нервов. Определите исходные значения отведения лапы перед операцией. После операции определяйте механический порог один раз в неделю во время хронического эксперимента.
- Переместите животных из помещения содержания и акклиматизируйте их в испытательной комнате в течение 30 минут в домашних клетках перед тестированием. Оттуда переместите животных, чтобы удерживать их по отдельности в небольших прозрачных кабинках на столе для тестирования с экраном в течение 15-20 минут в зависимости от уровня их активности.
ПРИМЕЧАНИЕ: Тестирование можно начинать после того, как мыши устроятся в положении покоя и не будут поворачиваться и двигаться в камере. Акклиматизация к удерживающей кабине сводит к минимуму эффекты, вызванные стрессом. Если мыши находились в обратном световом цикле, тестирование следует проводить в условиях красного света. - Продолжайте тестирование с использованием градуированных серий волокон фон Фрея, как описано ниже и в Chaplan et al.9.
- Прощупайте подушечку лапы в одном месте на каждом животном с помощью нити 3,61 фон Фрея, которая при сгибании вызывает усилие 0,4 g (Таблица материалов). Затем следует стимуляция нитью фон Фрея 4,08, которая вызывает усилие 1,0 g .
Примечание: Ни одно из этих волокон не вызывает реакции у наивных, акклиматизированных животных. - Наносите каждую нить 5 раз с интервалом >5 с перпендикулярно подушечке стопы, стараясь не касаться складки/щели или волос. Положительной реакцией является отвод стопы на три из пяти раздражителей. Применяйте следующую более слабую нить в серии до тех пор, пока животное не перестанет реагировать на механическую стимуляцию; В этот момент используйте следующую более высокую нить. Если он вызывает ответную реакцию, используйте нижнюю нить снова до тех пор, пока не будут применены четыре попытки после изменения реакции на механическую стимуляцию подушечки стопы.
- Используйте полученный шаблон отклика для вычисления механического порога отвода, минимального усилия, необходимого для получения ответной реакции в 50% случаев, используя алгоритм аппроксимации кривой9. Уменьшение силы, необходимой для вызова реакции отдергивания ноги, по сравнению с наивными мышами или собственным исходным уровнем животного, указывает на повышенную чувствительность животного.
- Прощупайте подушечку лапы в одном месте на каждом животном с помощью нити 3,61 фон Фрея, которая при сгибании вызывает усилие 0,4 g (Таблица материалов). Затем следует стимуляция нитью фон Фрея 4,08, которая вызывает усилие 1,0 g .
- Испытание порогового значения теплового рефлекса
ПРИМЕЧАНИЕ: Пороговые значения реакции на тепло и холод определяются с помощью тестов Харгривза и холодной пластины соответственно.- Тест Харгривза
- Поместите мышей в кабинки на стеклянную поверхность, которая нагревается инфракрасным излучателем снизу. Запишите задержку отвода стопы как время в секундах с момента приложения инфракрасного света (50 °C), подаваемого аппаратом, на заднюю лапу мыши до прекращения стимуляции.
- Испытание холодной пластиной
- Поместите мышей на холодную пластину, охлажденную до -9 °C. Запишите задержку отвода ноги как время в секундах с момента установки мыши на устройство до тех пор, пока мышь не начнет поднимать ногу.
- В качестве альтернативы поместите холодный зонд, охлажденный до -9 °C, под заднюю лапу мыши, пока мышь находится в клетке поверх проволочной сетки. Запишите задержку для отвода как время в секундах с момента помещения аппарата под заднюю лапу до того, как мышь начнет поднимать лапу, лизать или трясти. Чтобы избежать ноцицептивной реакции, приучите мышь к прикосновению зонда комнатной температуры.
- Тест Харгривза
- Когнитивные и эмоционально-зависимые поведенческие тесты
ПРИМЕЧАНИЕ: Длительная гиперчувствительность у животных вызывает эмоциональную и когнитивную дисфункцию. Обычно они измеряются только один раз на 6-й неделе после индукции модели боли, чтобы избежать практических эффектов.- Тесты на тревожность
Примечание: Тревога и депрессия также могут быть надежно протестированы, чтобы убедиться в эффективности модели. Лучше всего подождать, по крайней мере, до 4-6 недели после индукционной инъекции, чтобы позволить развитию сопутствующих заболеваний. Предпочтение темной, а не светлой камеры является мерой тревоги, связанной с ноцицепцией. В эксперименте с нулевым или плюсовым лабиринтом мыши с моделью боли проводили меньше времени в открытых квадрантах, чем наивные контрольные животные,демонстрируя тревожное поведение.- Тест на предпочтение светлого/темного места: поместите каждое животное в коробку для тестирования предпочтений места с проходом между двумя камерами (10 x 10 x 10 см3). Одна камера аппарата ярко освещена, в то время как противоположная сторона остается темной. Во время каждого 10-минутного теста следите за местоположением животного с помощью компьютера, чтобы определить время пребывания в свете и темноте, а также количество переходов.
ПРИМЕЧАНИЕ: В качестве альтернативы можно установить видеокамеру над испытательной камерой и вручную записывать время, проведенное в каждой камере. - Приподнятые плюсовые или нулевые лабиринты: поместите модель грызунов или наивных животных в лабиринт и используйте секундомер, чтобы оценить время, проведенное в закрытых частях лабиринта. Определите время, проведенное в двух огороженных «безопасных» зонах и двух открытых «небезопасных» зонах. Животные, испытывающие боль, предпочитают закрытые безопасные зоны.
ПРИМЕЧАНИЕ: Тревожное поведение можно проверить в лабиринте с нулевым или плюсовым значением (10 минут). Нулевой лабиринт представляет собой круговую дорожку, в отличие от лабиринта с плюсом, который имеет форму «знака плюс». Оба имеют два открытых и два закрытых квадранта, которые обеспечивают непрерывное исследовательское поведение. Оба находятся на высоте 1 м от земли, представляя собой круговую или плюсовую дорожку, разделенную на четыре квадранта одинакового размера.
- Тест на предпочтение светлого/темного места: поместите каждое животное в коробку для тестирования предпочтений места с проходом между двумя камерами (10 x 10 x 10 см3). Одна камера аппарата ярко освещена, в то время как противоположная сторона остается темной. Во время каждого 10-минутного теста следите за местоположением животного с помощью компьютера, чтобы определить время пребывания в свете и темноте, а также количество переходов.
- Тест на депрессию всплеска сахарозы
ПРИМЕЧАНИЕ: Тест на сахарозу используется для определения депрессивного поведения. Плеск-тест позволяет измерить отсутствие нормального поведения по уходу за шерстью как симптом депрессии, вызванной хронической болью.- Оцените частоту, продолжительность и латентность груминга в течение 10 минут после распыления 10-30% раствора сахарозы на спинную шерсть (~250 мкл у основания хвоста). У ослепленных наблюдателей подсчитывают количество манипуляций по грумингу по видеозаписям12.
ПРИМЕЧАНИЕ: Сообщалось, что этот индекс влияет на моделях расстройств настроения у грызунов, таких как хронический умеренный стресс, и корректируется лечением хроническими антидепрессантами13.
- Оцените частоту, продолжительность и латентность груминга в течение 10 минут после распыления 10-30% раствора сахарозы на спинную шерсть (~250 мкл у основания хвоста). У ослепленных наблюдателей подсчитывают количество манипуляций по грумингу по видеозаписям12.
- Тест нового объекта
ПРИМЕЧАНИЕ: Когнитивная дисфункция может быть измерена с помощью нового объектного теста.- Приучайте мышей индивидуально к прозрачной пластиковой клетке с открытым верхом (56 x 30 x 20 см) в течение 1 часа. Добавьте две одинаковые игрушечные минифигурки в противоположные углы клетки на 5 минут.
- В день тестирования снова приучите животных к прозрачной клетке в течение 1 часа, прежде чем поместить две одинаковые мини-фигурки в те же положения клетки на 5 минут, прежде чем вернуть их в домашнюю клетку.
- Замените одну из исходных фигур совершенно другим новым объектом, верните мышей в тестовую клетку через 4 часа и запишите время, затраченное на изучение объектов.
- Вычислите заявленный индекс распознавания (RI) как процент времени, затраченного на изучение нового объекта, от общего времени исследования объекта14.
- Оценка двигательной функции
ПРИМЕЧАНИЕ: Тест на нарушение подвижности и походки15 оценивает двигательную функцию в модели боли в спине.- Соорудите туннель из трубки от бумажного полотенца, разрезанной вдоль с одного края. Разложите открытый туннель на чистом листе бумаги для принтера.
- Держите мышей, аккуратно завернутых в полотенце, пока они не успокоятся. Положите лапы на тампон, смоченный нетоксичными индийскими чернилами, чтобы покрыть их чернилами, или нарисуйте чернила на нижней части лапок мыши с помощью ватного тампона. Отпустите мышей у входа в туннель и дайте им пробежать через туннель, поймав их в конце.
- Оценивайте отпечатки лап по трем параметрам: длина шага (расстояние по вертикали от заднего конца одного отпечатка до другого), ширина шага (расстояние между отпечатками по горизонтали) и разброс пальцев (расстояние между пальцами на противоположных сторонах лапы).
ПРИМЕЧАНИЕ: Одобренные лакомства также можно использовать, чтобы побудить мышь пройти через туннель. Если отпечатки лап размазаны или нечеткие, эксперимент необходимо повторить.
- Тесты на тревожность
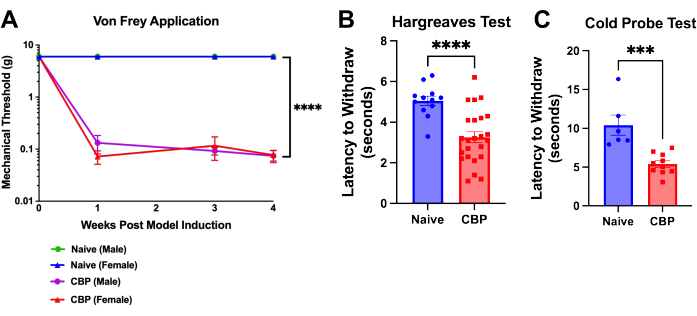
Рисунок 4: Механическая и термическая гиперчувствительность после индукции CBP. Боль измеряется через неделю после индукции модели и сохраняется в течение 8 недель. (А) Тест фон Фрея. Механические пороговые испытания проводятся с помощью нитей фон Фрея, нанесенных на подножку через сетчатый верхний стол методом вверх-вниз, как показано здесь, в течение 4 недель. Наивный мужской порог (зеленый) скрыт под синей линией для наивных самок мышей. Мыши CBP (n = 4 самца, 4 самки) показали значительно повышенную механическую чувствительность по сравнению с наивными контрольными группами (n = 2 самца, 2 самки). На этих данных был проведен двухфакторный ANOVA (тест множественных сравнений Даннета): n = 4 на группу. В анализе post-hoc поправка Бонферрони на все P-значения для недельного сравнения CBP с Naiv показала, что все 11 значений < 0,0011. p < 0,0001. (Б) Тест Харгривза. Тепловой порог был проверен на подножке с помощью теста Харгривза (50 °C). Мыши CBP (n = 12 самцов, 12 самок) показали значительно повышенную чувствительность к теплу по сравнению с наивными контрольными группами (n = 6 самцов, 6 самок). Для проверки значимости использовали двусторонний t-критерий Манна-Уитни (p < 0,0001). (C) Чувствительность к холоду. Испытание с помощью холодного зонда проводили путем помещения мышей в аппарат с холодной пластиной, охлажденный до -9 °C. Задержка отвода была записана как время в секундах с момента размещения мыши на аппарате до того, как мышь начнет поднимать ногу, лизать или трясти. На представленных данных холодный зонд, охлажденный до -9 °C, был помещен под заднюю лапу мыши, в то время как мышь была помещена в клетку поверх проволочной сетки. Все мыши были протестированы через 1-3 недели после инъекции. У мышей CBP (n = 4 самца, 6 самок) наблюдалась достоверно повышенная чувствительность к холоду по сравнению с наивной контрольной группой (n = 2 самца, 4 самки). Для проверки значимости был проведен двусторонний t-критерий Манна-Уитни (p = 0,0002). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Поведенческое тестирование, связанное с ноцицептивами, и анализ данных
Вызванные меры
Гиперчувствительность на подушечке стопы развивается в течение суток после инъекции урокиназы. В течение 1 недели порог отмены значительно снижается и сохраняется до эвтаназии...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Эту модель хронической боли в спине легко вызвать, а гиперчувствительность, установленная в течение 1 недели, может длиться до (а возможно, и дольше) 8 недель. Это позволяет точно изучать состояние хронической боли в отличие от других острых моделей, которые длятся всего неделю или две. В ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов. KNW признает неоплачиваемую консультацию с NeuroChronix, Bessor Pharma и США Elixeria BioPharm, Inc.
Благодарности
Грантовое финансирование было предоставлено NIH HEAL UG3 NS123958. Объекты жилищного фонда были проверены и аккредитованы AAALAC. Животные были размещены в жилом помещении Центра ресурсов животных (ARC), обслуживаемом сотрудниками лаборатории и сотрудниками Отдела лабораторных и животноводческих ресурсов (DLAR). Процедуры поведенческого тестирования являются стандартными методами в этой области, одобренными Американским обществом боли и Международной ассоциацией по изучению боли. Метод эвтаназии соответствует рекомендациям Группы по эвтаназии Американской ветеринарной медицинской ассоциации.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Animals and Consumables | |||
| 70% ethanol | Local Source | ||
| BALB/c mice | Envigo | 20-25 g | |
| Cotton balls | Fisher Scientific | 19-090-702 | |
| Cotton-tipped applicators | Fisher Scientific | 19-062-616 | |
| Isoflurane inhalant anesthetic | MedVet | RXISO-250 | |
| Labeling tape | Fisher Scientific | NGFP7002 | |
| Nitrile exam gloves | Fisher Scientific | ||
| Oxygen tank | Local Source | ||
| Surgical drape, Steri-Drape Utility Sheet, Absorbent Prevention | VWR | 76246-788 | cut into 15 x 15 cm pieces |
| Tygon tubing with 3 mm inner diameter | Grainger | 22XH87 | |
| Equipment | |||
| #11 carbon steel scalpel blades | VWR | 21909-612 | |
| Anesthesia induction chamber | Summit Medical Equipment Company | AS-01-0530-LG | |
| Autoclave | Local Unit | ||
| Biology Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| Glass bead sterilizer Germinator 500 | VWR | 102095-946 | |
| IITC Life Sciences Series 8 Model PE34 Hot/Cold Plate Analgesia Meter | IITC | PE34 | |
| Integra Miltex cotton & dressing pliers | Safco Dental Supply | 66-317 | |
| OPTIKA CL31 double arm LED illuminator | New York Microscope Company | OPCL-31 | |
| Plantar Test System with InfraRed Emitter, i. e. Hargreaves Apparatus | Ugo Basile | 37370-001 and 37370-002 | |
| Scalpel Handle No. 3 | VWR | 25607-947 | |
| Small animal heating pad | Valley Vet Supply | 47375 | |
| Student Vannas spring scissors, straight blade | Fine Science Tools | 91500-09 | |
| Table top animal research portable anesthesia workstation “PAM” | Patterson Scientific | AS-01-0007 | |
| Von Frey Filaments | Ugo Basile | 37450-275 |
Ссылки
- O'Sullivan, P. B., et al. Back to basics: 10 facts every person should know about back pain. British Journal of Sports Medicine. 54 (12), 698-699 (2020).
- Nauta, H. J., McIlwrath, S. L., Westlund, K. N. Punctate midline myelotomy reduces pain responses in a rat model of lumbar spine pain: evidence that the postsynaptic dorsal column pathway conveys pain from the axial spine. Cureus. 10 (3), 2371(2018).
- Shuang, F., et al. Establishment of a rat model of lumbar facet joint osteoarthritis using intraarticular injection of urinary plasminogen activator. Scientific Reports. 5 (1), 9828(2015).
- Reed, N. R., et al. Somatosensory behavioral alterations in a NGF-induced persistent low back pain model. Behavioural Brain Research. 418, 113617(2022).
- Suh, H. R., Cho, H. -Y., Han, H. C. Development of a novel model of intervertebral disc degeneration by the intradiscal application of monosodium iodoacetate (MIA) in rat. The Spine Journal. 22 (1), 183-192 (2022).
- Kim, H., Hong, J. Y., Lee, J., Jeon, W. -J., Ha, I. -H. IL-1β promotes disc degeneration and inflammation through direct injection of intervertebral disc in a rat lumbar disc herniation model. The Spine Journal. 21 (6), 1031-1041 (2021).
- Millecamps, M., Tajerian, M., Sage, E. H., Stone, L. S. Behavioral signs of chronic back pain in the SPARC-null mouse. Spine. 36 (2), 95-102 (2011).
- La Porta, C., Tappe-Theodor, A. Differential impact of psychological and psychophysical stress on low back pain in mice. Pain. 161 (7), 1442-1458 (2020).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Takao, K., Miyakawa, T. Light/dark transition test for mice. Journal of Visualized Experiments JoVE. (1), e104(2006).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- David, D. J., et al. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron. 62 (4), 479-493 (2009).
- Yalcin, I., et al. A time-dependent history of mood disorders in a murine model of neuropathic pain. Biological Psychiatry. 70 (10), 946-953 (2011).
- Madathil, S. K., et al. Astrocyte-specific overexpression of insulin-like growth factor-1 protects hippocampal neurons and reduces behavioral deficits following traumatic brain injury in mice. PloS One. 8 (6), e67204(2013).
- Sugimoto, H., Kawakami, K. Low-cost protocol of footprint analysis and hanging box test for mice applied the chronic restraint stress. Journal of Visualized Experiments: JoVE. (143), e59027(2019).
- Hassan, S., et al. Identifying chronic low back pain phenotypic domains and characteristics accounting for individual variation: a systematic review. Pain. , (2023).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены