È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello di mal di schiena di topo indotto dall'attivatore del plasminogeno di tipo urochinasi
In questo articolo
Riepilogo
I metodi per l'induzione semplice e rapida di un modello di mal di schiena nei topi sono forniti qui utilizzando un'iniezione intralegamentosa di attivatore del plasminogeno urinario.
Abstract
Un modello di dolore lombare persistente può essere indotto nei topi con la semplice metodologia qui descritta. I metodi passo-passo per l'induzione semplice e rapida di un modello di mal di schiena persistente nei topi sono forniti qui utilizzando un'iniezione di attivatore del plasminogeno di tipo urochinasi (urochinasi), una serina proteasi presente nell'uomo e in altri animali. La metodologia per l'induzione del dolore lombare persistente nei topi prevede una semplice iniezione di urochinasi lungo la regione di inserzione legamentosa della colonna lombare. L'agente infiammatorio urochinasi attiva il plasminogeno in plasmina. In genere, il modello può essere indotto entro 10 minuti e l'ipersensibilità persiste per almeno 8 settimane.
L'ipersensibilità, i disturbi dell'andatura e altre misure standard simili all'ansia e alla depressione possono essere testate nel modello persistente. Il mal di schiena è il tipo di dolore più diffuso. Per migliorare la consapevolezza del mal di schiena, l'Associazione internazionale per lo studio del dolore (IASP) ha nominato il 2021 "Anno globale del mal di schiena" e il 2022 "Anno globale per tradurre la conoscenza del dolore in pratica". Un limite del progresso terapeutico delle terapie del dolore è la mancanza di modelli adatti per testare il dolore persistente e cronico. Le caratteristiche di questo modello sono adatte a testare potenziali terapie volte alla riduzione del mal di schiena e delle sue caratteristiche accessorie, contribuendo a far sì che IASP nominasse il 2022 come l'Anno Globale per la Traduzione della Conoscenza del Dolore nella Pratica.
Introduzione
La lombalgia è una delle cause più comuni di disabilità, con 1 persona su 5 che ne soffre in tutto il mondo. Nonostante questi sforzi, pochi modelli animali affidabili di mal di schiena sono comunemente utilizzati nella ricerca sugli animali nel campo del dolore, specialmente nei topi. I modelli precedenti hanno fatto uso quasi esclusivamente di ratti per l'induzione del mal di schiena cronico (CBP) come quelli indotti dall'iniezione di attivatore del plasminogeno urinario (uPA) nell'articolazione della faccetta lombare 2,3, dall'iniezione del fattore di crescita nervoso (NGF) nella muscolatura del tronco4, o dallo iodoacetato monosodico (MIA)5 o dall'interleuchina-1beta6 iniezione nel disco intravertebrale. Naturalmente, i ratti sono preferiti per questi modelli principalmente a causa delle loro dimensioni maggiori e della facilità di accesso per l'iniezione di agenti infiammatori.
Per essere chiari, esistono modelli murini di mal di schiena, come il modello murino SPARC-null di degenerazione del disco intervertebrale utilizzato permolti anni, ma questi sono più costosi e richiedono più tempo per essere stabiliti rispetto ai modelli basati sull'iniezione. Un recente studio sui topi ha stabilito un modello di mal di schiena combinando l'iniezione di NGF nei muscoli lombari con lo stress di contenzione cronica verticale8. Nel seguente protocollo, abbiamo adattato il modello CBP indotto da uPA dai ratti per i topi2. L'ipersensibilità si instaura entro 1 settimana e persiste fino a 6-8 settimane. Inoltre, abbiamo stabilito che i topi sviluppano comportamenti simili all'ansia e alla depressione. Data la prevalenza del mal di schiena e l'uso più comune dei topi nella ricerca sul dolore molecolare, questo modello durevole è prontamente stabilito per l'uso nello sviluppo di nuove strategie di trattamento per alleviare il mal di schiena.
Protocollo
Tutte le procedure sugli animali descritte sono conformi alla Guida NIH per la cura e l'uso degli animali da laboratorio. Gli studi sono stati approvati dal comitato locale per la cura e l'uso istituzionale (IACUC #23-201364-HSC) del Centro di scienze della salute dell'Università del New Mexico. Tutti gli studi sono conformi alle politiche sotto l'egida di una garanzia di conformità OLAW (A3002-01) sull'uso di animali nella ricerca, come descritto nella Parte III. II. Garanzie e certificazioni. Gli animali sono ospitati nella struttura di stabulazione dell'Animal Resources Center (ARC) gestita dal personale del laboratorio e dal personale della Division of Laboratory and Animal Resources (DLAR). Il metodo di eutanasia (100 μL di 59 mg/mL di pentobarbital iniettabile) è rapido e affidabile e consente la dissezione e la raccolta di vari tessuti per ulteriori ricerche.
1. Animali
- Ospita topi BALB/c adulti (~3-4 settimane) maschi e femmine (20-25 g) con un ciclo inverso luce:buio di 12 ore:12 ore, quindi il loro tempo di attività al buio si verifica durante l'orario di lavoro del laboratorio.
NOTA: Ciò consentirà la valutazione di tutti i parametri durante il tempo di attività naturale degli animali, poiché i roditori sono animali naturalmente notturni. Ciò riduce il contributo delle alterazioni dell'orologio circadiano in modo che gli animali possano essere testati durante il loro tempo attivo, che ora è diurno. - Monitora gli animali due volte al giorno.
- Mantenere i topi su un normale cibo da riproduzione di topi, che ha un contenuto di proteine di soia inferiore rispetto al cibo standard per roditori (noto per alterare l'ipersensibilità) se si valutano gli effetti dei farmaci sui comportamenti correlati al dolore.
- Pesare gli animali una volta alla settimana per garantire il mantenimento di un sano aumento di peso.
NOTA: Non sono state osservate differenze di peso nel gruppo durante gli studi di 8-10 settimane, il che ha consentito l'accecamento dello studio.
2. Induzione del modello
- Eseguire l'induzione del modello su una superficie piana e sterile calda dotata di un mezzo per fissare i dispositivi di stabilizzazione per tenere il mouse in posizione (Figura 1A). Eseguire l'intervento chirurgico con un microscopio di dissezione su una superficie sterilizzata.
NOTA: Utilizzare una cappa aspirante di grado chimico se non è disponibile la cattura dell'anestesia. - Utilizzare seta chirurgica o anche filato con elastici annodati all'estremità delle corde agganciate ai bordi nervati della piastra come vincoli se si utilizza la piastra di base consigliata nella Tabella dei materiali.
- Posizionare una stazione di recupero del termoforo su una superficie adiacente alla configurazione chirurgica per il trasferimento dei topi alla stazione immediatamente dopo l'iniezione (Figura 1B).
NOTA: Posizionare una gabbia vuota sul termoforo almeno 10 minuti prima dell'iniezione per consentire alla gabbia di riscaldarsi a una temperatura confortevole (37 °C). Posiziona la metà della gabbia fuori dal pad, per consentire al mouse di risvegliarsi di preferire le temperature di recupero. - Preparare l'urochinasi diluendola in acqua sterile. Pulire la siringa Hamilton con alcool e sciacquare in acqua sterile. Prelevare la soluzione in anticipo in modo che il topo sia sotto anestesia il più breve possibile. Utilizzare 5 μL di attivatore del plasminogeno urinario da 2 mg/mL per il modello; per le shams, utilizzare 5 μL di soluzione fisiologica sterile.
- Impostare la stazione di anestesia con isoflurano a un livello del 4% o inferiore per questa breve procedura. Posizionare il mouse nella camera di induzione; In genere, la rapida frequenza respiratoria del topo rallenterà entro 1-2 minuti, spostandosi dal movimento della parte superiore del torace a quello inferiore.
- Utilizzare un livello di ossigeno di 1,5 L/min e una bombola di carbone attivo F o lavorare sotto un flusso biologico o una cappa di evacuazione dall'alto per strofinare l'isoflurano ed evitare l'esposizione al chirurgo animale. Se non disponibile, eseguire la procedura in una cappa di sicurezza chimica.
- Commutare rapidamente il mouse e il flusso di anestetico verso l'area chirurgica su un cuscinetto riscaldante a 37°C, posizionando il naso del topo nell'ogiva per mantenere il livello di anestetico (Figura 1C,D). Verificare che il mouse non abbia movimenti riflessi per pizzicare le dita dei piedi, quindi trattenere il mouse sulla piastra di base.
NOTA: In caso di movimento, riposizionare il mouse nella camera di induzione e ripetere l'operazione. - Pulisci l'area della pelle posteriore con un tampone imbevuto di alcol. Regolare l'illuminazione a LED secondo necessità per avere una visione chiara della schiena del topo anestetizzato.
NOTA: Se necessario, utilizzare un rasoio elettrico per rimuovere i peli dalla schiena del mouse in modo che ci sia una visione libera delle creste della colonna vertebrale sotto la pelle. Se i topi sperimentali vengono rasati, radere anche il dorso dei topi ingenui e finti per l'accecamento dello studio. - Iniettare il topo mentre è completamente anestetizzato e immobilizzato (nessun riflesso di raddrizzamento e ritiro del pizzicamento delle dita dei piedi). Usa due dita per sentire delicatamente il punto in cui la parte inferiore della gabbia toracica del mouse incontra la colonna vertebrale (Figura 2A). Al di sotto di questo punto si trovano i segmenti spinali del legname; puntare l'iniezione qui a L2-L3.
- Posizionare la punta della siringa Hamilton vicino al dorso (Figura 2B,C). Puntare la siringa con un angolo di ~45° nel legamento interspinoso immediatamente adiacente all'osso.
NOTA: A seconda della durezza della pelle del mouse, a volte fare affidamento sulla gravità invece che sulla pressione attiva e su un angolo di 90° può funzionare meglio. - Inserire la punta dell'ago delicatamente ma saldamente nel legamento interspinoso (Figura 3B,C).
NOTA: L'obiettivo non è quello di aprire una breccia nella cavità addominale ma di iniettare il legamento. - Svuotare lentamente il contenuto dell'ago. Se in qualsiasi punto c'è del liquido sulla punta, l'ago non passa attraverso la pelle. Continuare fino a quando tutti i 5 μL sono stati iniettati.
- Tenere l'ago in posizione per ~5 s per evitare il riflusso dall'iniezione. Si raccomanda l'uso del colorante blu in studi pilota terminali o acuti.
NOTA: Se eseguito correttamente, il liquido dovrebbe diffondersi nel legamento come mostrato (Figura 3A). - Rimuovere l'ago delicatamente e lentamente. Assicurati che non ci siano sangue o secrezioni.
- Posizionare il mouse nella stazione di recupero del calore con la parte superiore della gabbia fino a quando non si risveglia ed è mobile prima di rimetterlo nella gabbia di casa.
NOTA: Supponendo che la procedura sia stata eseguita rapidamente, non dovrebbe passare più di un minuto prima che il mouse si risvegli. - Controllare i topi fino a 1 ora dopo l'intervento chirurgico per assicurarsi che tutte le normali funzioni motorie continuino per precauzione.
NOTA: Se eseguita correttamente, non dovrebbero esserci complicazioni da questa procedura. - Controllare i topi ogni giorno per la settimana successiva all'intervento chirurgico, compresa la valutazione del peso e l'ispezione del sito di iniezione per assicurarsi che non si siano verificate infezioni o complicazioni. Non utilizzare il mouse per ulteriori esperimenti se c'è un cambiamento nel comportamento, come la perdita di peso e la letargia.

Figura 1: Configurazione per l'induzione dell'urochinasi CBP. (A) La piastra di base Fine Science Tools consigliata per gli interventi chirurgici sui topi. I bordi a coste possono avere una corda uncinata su di essi per tenere il mouse in posizione. (B) Stazione di recupero. Si consiglia una gabbia di alloggiamento vuota, metà sul termoforo, metà spenta. Un panno pulito viene posizionato sul fondo per dare al mouse una comoda area di riposo. (C) Raccomandazione per la configurazione della macchina per anestesia. Utilizzando un sistema di erogazione a due canali, impostare un tubo flessibile per la camera di induzione e un altro per la stazione chirurgica. (D) Una vista dei sistemi di ritenuta del topo. Due corde vengono annodate sui bordi a coste della piastra di base, quindi tirate delicatamente rispettivamente sul collo e sulla parte posteriore del mouse. Assicurati di non trattenere troppo il mouse in modo che possa ancora respirare normalmente. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Induzione del CBP per iniezione di urochinasi. (A) Una vista del posizionamento del sito di iniezione. Come mostrato, tocca con le dita per trovare la parte inferiore della gabbia toracica del mouse come punto di riferimento per L4-L5. (B) Una vista del processo di iniezione, che mostra l'angolo per una corretta iniezione. (C) In questo caso è preferibile un angolo di 45°, ma regolare secondo necessità per garantire che l'ago arrivi dove serve. Se necessario, radere il sito di iniezione per una migliore visualizzazione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Diagramma del sito di iniezione. (A) Una fotografia dell'ubicazione del sito di iniezione. L'inchiostro viene utilizzato qui per indicare dove il liquido entrerà nel legamento interspinoso tra le vertebre L2 e L3. (B) Un diagramma che mostra il corretto posizionamento dell'ago e la posizione del sito di iniezione, mostrato da una vista laterale. (C) Un diagramma che mostra una vista dall'alto verso il basso delle vertebre e dei siti di iniezione per i legamenti interspinosi. Le iniezioni saranno in genere sui legamenti interspinosi vicino alla colonna vertebrale, ma l'ago può essere inserito anche nello spazio tra le vertebre intertrasversali. L'uso del colorante blu nelle prove pilota è raccomandato come mostrato in (A). Fare clic qui per visualizzare una versione più grande di questa figura.
3. Saggi comportamentali
- Test della soglia di risposta del riflesso meccanico di von Frey
NOTA: La soglia di ritiro meccanico è la forza minima necessaria per ottenere una risposta il 50% delle volte con una serie di 8 monofilamenti von Frey di diametro graduato con aumenti di ~0,2 g, fornendo variazioni di passo logaritmiche nella forza meccanica (Tabella dei materiali).- Testare la stimolazione meccanica con fibre di von Frey applicate alla zampa posteriore, il territorio di innervazione dei nervi lombosacrali. Determinare i valori basali di ritiro della zampa prima dell'intervento chirurgico. Dopo l'intervento chirurgico, determinare la soglia meccanica una volta alla settimana durante l'esperimento cronico.
- Spostare gli animali dalla stanza di stabulazione e acclimatarli nella stanza di prova per 30 minuti nelle loro gabbie domestiche prima del test. Da lì, sposta gli animali per trattenerli individualmente in piccoli cubicoli trasparenti sul tavolo di prova sormontato da uno schermo per 15-20 minuti a seconda del loro livello di attività.
NOTA: Il test può iniziare dopo che i topi si sono sistemati in una posizione di riposo e non si girano e si muovono nella camera. L'acclimatazione alla cabina di contenzione riduce al minimo gli effetti indotti dallo stress. Se i topi sono stati mantenuti in un ciclo di luce inverso, il test deve essere eseguito in condizioni di luce rossa. - Procedere con il test utilizzando serie graduate di fibre di von Frey come descritto di seguito e in Chaplan et al.9.
- Sondare il cuscinetto della zampa in un punto coerente su ciascun animale utilizzando il filamento von Frey da 3,61 che, quando piegato, provoca una forza di 0,4 g (Tabella dei materiali). Proseguire con la stimolazione con il filamento 4.08 von Frey che suscita una forza di 1.0 g .
NOTA: Nessuna di queste fibre suscita risposte in animali ingenui e acclimatati. - Applicare ogni filamento 5 volte a intervalli di >5 s perpendicolarmente al cuscinetto del piede, facendo attenzione a non toccare una piega/fessura o capelli. Una risposta positiva è un ritiro del piede a tre dei cinque stimoli. Applicare il filamento successivo più debole della serie fino a quando l'animale non risponde alla stimolazione meccanica; A quel punto, usa il filamento successivo più alto. Se suscita una risposta, utilizzare nuovamente il filamento inferiore fino a quando non sono state applicate quattro prove dopo il cambiamento della risposta alla stimolazione meccanica del cuscinetto plantare.
- Utilizzare il modello di risposta risultante per calcolare la soglia di ritiro meccanico, la quantità minima di forza necessaria per ottenere una risposta il 50% delle volte, utilizzando un algoritmo di adattamento della curva9. Una diminuzione della forza necessaria per suscitare una risposta di ritiro del piede rispetto ai topi ingenui o alla linea di base dell'animale indica una maggiore sensibilità dell'animale.
- Sondare il cuscinetto della zampa in un punto coerente su ciascun animale utilizzando il filamento von Frey da 3,61 che, quando piegato, provoca una forza di 0,4 g (Tabella dei materiali). Proseguire con la stimolazione con il filamento 4.08 von Frey che suscita una forza di 1.0 g .
- Test della soglia di risposta del riflesso termico
NOTA: Le soglie di risposta al caldo e al freddo sono accertate rispettivamente con i test Hargreaves e cold plate.- Test di Hargreaves
- Posiziona i topi in cubicoli su una superficie di vetro riscaldata con un emettitore di infrarossi dal basso. Registrare la latenza di ritiro del piede come tempo in secondi dall'applicazione dello stimolo di luce infrarossa (50 °C) fornito dall'apparecchio sulla zampa posteriore del topo fino al ritiro dalla stimolazione.
- Test su piastra fredda
- Posizionare i mouse sull'apparecchio a piastra fredda raffreddato a -9 °C. Registrare la latenza per ritirare il piede come tempo in secondi dal posizionamento del mouse sull'apparecchio fino a quando il mouse inizia a sollevare il piede.
- In alternativa, posizionare una sonda fredda raffreddata a -9 °C sotto la zampa posteriore del topo mentre il topo è ingabbiato sopra una rete metallica. Registrare la latenza di ritiro come tempo in secondi dal posizionamento dell'apparecchio sotto la zampa posteriore fino a quando il mouse inizia a sollevare, leccare o scuotere il piede. Per evitare di evocare una risposta nocicettiva, abituare il topo a essere toccato dalla sonda a temperatura ambiente.
- Test di Hargreaves
- Saggi comportamentali dipendenti dalla cognizione e dalle emozioni
NOTA: L'ipersensibilità di lunga durata negli animali produce disfunzioni emotive e cognitivo-dipendenti. Questi vengono in genere misurati solo una volta nella settimana 6 dopo l'induzione del modello di dolore per evitare gli effetti della pratica.- Test d'ansia
NOTA: Anche l'ansia e la depressione possono essere testate in modo affidabile per accertare l'efficacia del modello. È meglio aspettare almeno fino ad almeno 4-6 settimane dopo l'iniezione di induzione per consentire lo sviluppo delle comorbidità. La preferenza per la camera oscura piuttosto che per quella luminosa è una misura dell'ansia correlata alla nocicezione. Nel test del labirinto zero o plus, i topi modello di dolore trascorrono meno tempo nei quadranti aperti rispetto agli animali di controllo ingenui, una dimostrazione di comportamento simile all'ansia10,11.- Test di preferenza del luogo chiaro/scuro: posizionare ogni animale nella scatola del test di preferenza del luogo con un passaggio tra due camere (10 x 10 x 10 cm3). Una camera dell'apparecchio è illuminata, mentre il lato opposto rimane buio. Durante ogni test di 10 minuti, monitora la posizione dell'animale tramite computer per determinare i tempi di occupazione della luce e del buio e il numero di transizioni.
NOTA: In alternativa, montare una videocamera sopra la camera di prova e registrare manualmente il tempo trascorso in ciascuna camera. - Labirinti più o zero elevati: posiziona il modello di roditori o animali ingenui sul labirinto e usa un cronometro per valutare il tempo trascorso nelle porzioni chiuse del labirinto. Determina il tempo trascorso nelle due aree "sicure" murate e nelle due aree "non sicure" aperte. Gli animali con dolore preferiscono le aree chiuse e sicure.
NOTA: Il comportamento ansioso può essere testato in un labirinto zero o più (10 min). Il labirinto zero è una pista circolare al contrario del labirinto più, che è "a forma di segno più". Entrambi hanno due quadranti aperti e due chiusi che consentono un comportamento esplorativo continuo. Entrambi sono rialzati di 1 m da terra, una passerella circolare o a forma di plus divisa in quattro quadranti di uguali dimensioni.
- Test di preferenza del luogo chiaro/scuro: posizionare ogni animale nella scatola del test di preferenza del luogo con un passaggio tra due camere (10 x 10 x 10 cm3). Una camera dell'apparecchio è illuminata, mentre il lato opposto rimane buio. Durante ogni test di 10 minuti, monitora la posizione dell'animale tramite computer per determinare i tempi di occupazione della luce e del buio e il numero di transizioni.
- Test di depressione da spruzzi di saccarosio
NOTA: Lo splash test del saccarosio viene utilizzato per determinare il comportamento simile alla depressione. Lo splash test permette di misurare l'assenza di un normale comportamento di toelettatura come sintomo di depressione derivante da dolore cronico.- Valutare la frequenza, la durata e la latenza della toelettatura per 10 minuti dopo aver spruzzato una soluzione di saccarosio al 10-30% sul mantello dorsale (~250 μL vicino alla base della coda). Avere osservatori accecati contare il numero di manovre di toelettatura da registrazioni video12.
NOTA: È stato riportato che questo indice è influenzato nei modelli di roditori di disturbi dell'umore, come lo stress cronico lieve, e che deve essere corretto dal trattamento antidepressivo cronico13.
- Valutare la frequenza, la durata e la latenza della toelettatura per 10 minuti dopo aver spruzzato una soluzione di saccarosio al 10-30% sul mantello dorsale (~250 μL vicino alla base della coda). Avere osservatori accecati contare il numero di manovre di toelettatura da registrazioni video12.
- Test di un nuovo oggetto
NOTA: La disfunzione cognitiva è misurabile con il test del nuovo oggetto.- Acclimatare i topi singolarmente a una gabbia di plastica trasparente con la parte superiore aperta (56 x 30 x 20 cm) per 1 ora. Aggiungi due minifigure giocattolo identiche negli angoli opposti della gabbia per 5 min.
- Il giorno del test, acclimatare nuovamente gli animali alla gabbia trasparente per 1 ora prima di posizionare le due minifigure identiche nelle stesse posizioni della gabbia per 5 minuti prima di riportarle nella gabbia di casa.
- Sostituisci una delle figure originali con un oggetto nuovo distintamente diverso, riporta i topi nella gabbia di prova 4 ore dopo e registra il tempo trascorso ad esplorare gli oggetti.
- Calcolare l'indice di riconoscimento (RI) riportato come percentuale di tempo trascorso a esplorare il nuovo oggetto del tempo totale di esplorazionedell'oggetto 14.
- Valutazione della funzione motoria
NOTA: Il test della mobilità e dei disturbi dell'andatura delle macchie d'inchiostro15 valuta la funzione motoria nel modello di mal di schiena.- Costruisci un tunnel da un tubo di carta assorbente tagliato longitudinalmente su un bordo. Stendere il tunnel aperto su un foglio di carta per stampante pulito.
- Tieni i topi delicatamente avvolti in un asciugamano finché non si calmano. Posiziona le zampe su un tampone bagnato con inchiostro di china atossico per ricoprirle di inchiostro o dipingi l'inchiostro sulla parte inferiore dei piedi del topo usando un batuffolo di cotone. Rilascia i topi all'ingresso del tunnel e lasciali correre attraverso il tunnel, catturandoli alla fine.
- Segna le impronte delle zampe in base a tre parametri: lunghezza del passo (la distanza verticale dall'estremità posteriore di una stampa all'altra), larghezza del passo (distanza orizzontale tra le impronte) e diffusione delle dita dei piedi (la distanza tra le dita dei piedi sui lati opposti della zampa).
NOTA: I dolcetti approvati possono essere utilizzati anche per incoraggiare il topo a passare attraverso il tunnel. Se le impronte delle zampe sono imbrattate o poco chiare, l'esperimento deve essere ripetuto.
- Test d'ansia
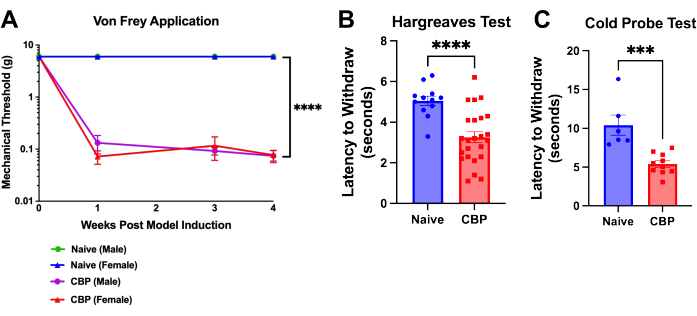
Figura 4: Ipersensibilità meccanica e termica in seguito all'induzione di CBP. Il dolore è misurabile una settimana dopo l'induzione del modello e persiste per 8 settimane. (A) Test di von Frey. Il test di soglia meccanica viene eseguito con filamenti di von Frey applicati al poggiapiedi attraverso un tavolo superiore in rete con il metodo up-down come mostrato qui nel corso di 4 settimane. La soglia maschile ingenua (verde) è nascosta sotto la linea blu per i topi femmina ingenui. I topi CBP (n = 4 maschi, 4 femmine) hanno mostrato una sensibilità meccanica significativamente aumentata rispetto ai controlli naïve (n = 2 maschi, 2 femmine). L'ANOVA a due vie (test di confronto multiplo di Dunnett) è stata eseguita su questi dati: n = 4 per gruppo. Nelle analisi post-hoc , l'aggiustamento di Bonferroni a tutti i valori P per i confronti settimanali di CBP rispetto a Naïve ha prodotto tutti gli 11 valori < 0,0011. p < 0,0001. (B) Prova di Hargreaves. La soglia di calore è stata testata sulla pedana con il test di Hargreaves (50 °C). I topi CBP (n = 12 maschi, 12 femmine) hanno mostrato una sensibilità al calore significativamente aumentata rispetto ai controlli naïve (n = 6 maschi, 6 femmine). È stato eseguito il test t a due code di Mann-Whitney per testare la significatività (p < 0,0001). (C) Sensibilità al freddo. Il test della sonda fredda è stato eseguito posizionando i topi sull'apparecchio a piastra fredda raffreddato a -9 °C. La latenza di ritiro è stata registrata come il tempo in secondi dal posizionamento del mouse sull'apparecchio fino a quando il mouse inizia a sollevare, leccare o scuotere il piede. Nei dati mostrati, una sonda fredda raffreddata a -9 °C è stata posizionata sotto la zampa posteriore del topo mentre il topo è ingabbiato sopra una rete metallica. Tutti i topi sono stati testati 1-3 settimane dopo l'iniezione. I topi CBP (n = 4 maschi, 6 femmine) hanno mostrato una sensibilità al freddo significativamente aumentata rispetto ai controlli naïve (n = 2 maschi, 4 femmine). Il test t a due code di Mann-Whitney è stato eseguito per testare la significatività (p = 0,0002). Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Test comportamentali nocicettivi e analisi dei dati
Misure evocate
L'ipersensibilità sul cuscinetto plantare si sviluppa entro un giorno dall'iniezione di urochinasi. Entro 1 settimana, la soglia di sospensione è significativamente diminuita e persiste fino all'eutanasia; questo è dimostrato fino alla settimana postchirurgica 4 (Figura 4A). La latenza di astinenza della zampa viene analizzata utilizzando il metodo di von Frey up-down
Discussione
Questo modello di mal di schiena cronico è semplice da indurre e l'ipersensibilità stabilita entro 1 settimana può durare fino a (e possibilmente oltre) 8 settimane. Ciò consente uno studio accurato dello stato di dolore cronico rispetto ad altri modelli acuti che durano solo una settimana o due. Mentre mostriamo il modello nei topi, il modello CBP indotto da uPA può essere stabilito anche nei ratti2. Un vantaggio del modello è che il decorso prolungato provoca lo sviluppo di comportamenti s...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione. KNW riconosce la consulenza non retribuita con NeuroChronix, Bessor Pharma e USA Elixeria BioPharm, Inc.
Riconoscimenti
Il finanziamento della sovvenzione è stato fornito da NIH HEAL UG3 NS123958. Le strutture abitative sono state ispezionate e accreditate dall'AAALAC. Gli animali sono stati ospitati nella struttura di stabulazione dell'Animal Resources Center (ARC) gestita dal personale del laboratorio e dal personale della Division of Laboratory and Animal Resources (DLAR). Le procedure per i test comportamentali sono metodi standard nel campo come approvato dall'American Pain Society e dall'International Association for the Study of Pain. Il metodo di eutanasia è coerente con le raccomandazioni del gruppo di esperti scientifici sull'eutanasia dell'American Veterinary Medical Association.
Materiali
| Name | Company | Catalog Number | Comments |
| Animals and Consumables | |||
| 70% ethanol | Local Source | ||
| BALB/c mice | Envigo | 20-25 g | |
| Cotton balls | Fisher Scientific | 19-090-702 | |
| Cotton-tipped applicators | Fisher Scientific | 19-062-616 | |
| Isoflurane inhalant anesthetic | MedVet | RXISO-250 | |
| Labeling tape | Fisher Scientific | NGFP7002 | |
| Nitrile exam gloves | Fisher Scientific | ||
| Oxygen tank | Local Source | ||
| Surgical drape, Steri-Drape Utility Sheet, Absorbent Prevention | VWR | 76246-788 | cut into 15 x 15 cm pieces |
| Tygon tubing with 3 mm inner diameter | Grainger | 22XH87 | |
| Equipment | |||
| #11 carbon steel scalpel blades | VWR | 21909-612 | |
| Anesthesia induction chamber | Summit Medical Equipment Company | AS-01-0530-LG | |
| Autoclave | Local Unit | ||
| Biology Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| Glass bead sterilizer Germinator 500 | VWR | 102095-946 | |
| IITC Life Sciences Series 8 Model PE34 Hot/Cold Plate Analgesia Meter | IITC | PE34 | |
| Integra Miltex cotton & dressing pliers | Safco Dental Supply | 66-317 | |
| OPTIKA CL31 double arm LED illuminator | New York Microscope Company | OPCL-31 | |
| Plantar Test System with InfraRed Emitter, i. e. Hargreaves Apparatus | Ugo Basile | 37370-001 and 37370-002 | |
| Scalpel Handle No. 3 | VWR | 25607-947 | |
| Small animal heating pad | Valley Vet Supply | 47375 | |
| Student Vannas spring scissors, straight blade | Fine Science Tools | 91500-09 | |
| Table top animal research portable anesthesia workstation “PAM” | Patterson Scientific | AS-01-0007 | |
| Von Frey Filaments | Ugo Basile | 37450-275 |
Riferimenti
- O'Sullivan, P. B., et al. Back to basics: 10 facts every person should know about back pain. British Journal of Sports Medicine. 54 (12), 698-699 (2020).
- Nauta, H. J., McIlwrath, S. L., Westlund, K. N. Punctate midline myelotomy reduces pain responses in a rat model of lumbar spine pain: evidence that the postsynaptic dorsal column pathway conveys pain from the axial spine. Cureus. 10 (3), 2371 (2018).
- Shuang, F., et al. Establishment of a rat model of lumbar facet joint osteoarthritis using intraarticular injection of urinary plasminogen activator. Scientific Reports. 5 (1), 9828 (2015).
- Reed, N. R., et al. Somatosensory behavioral alterations in a NGF-induced persistent low back pain model. Behavioural Brain Research. 418, 113617 (2022).
- Suh, H. R., Cho, H. -. Y., Han, H. C. Development of a novel model of intervertebral disc degeneration by the intradiscal application of monosodium iodoacetate (MIA) in rat. The Spine Journal. 22 (1), 183-192 (2022).
- Kim, H., Hong, J. Y., Lee, J., Jeon, W. -. J., Ha, I. -. H. IL-1β promotes disc degeneration and inflammation through direct injection of intervertebral disc in a rat lumbar disc herniation model. The Spine Journal. 21 (6), 1031-1041 (2021).
- Millecamps, M., Tajerian, M., Sage, E. H., Stone, L. S. Behavioral signs of chronic back pain in the SPARC-null mouse. Spine. 36 (2), 95-102 (2011).
- La Porta, C., Tappe-Theodor, A. Differential impact of psychological and psychophysical stress on low back pain in mice. Pain. 161 (7), 1442-1458 (2020).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Takao, K., Miyakawa, T. Light/dark transition test for mice. Journal of Visualized Experiments JoVE. (1), e104 (2006).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284 (2017).
- David, D. J., et al. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron. 62 (4), 479-493 (2009).
- Yalcin, I., et al. A time-dependent history of mood disorders in a murine model of neuropathic pain. Biological Psychiatry. 70 (10), 946-953 (2011).
- Madathil, S. K., et al. Astrocyte-specific overexpression of insulin-like growth factor-1 protects hippocampal neurons and reduces behavioral deficits following traumatic brain injury in mice. PloS One. 8 (6), e67204 (2013).
- Sugimoto, H., Kawakami, K. Low-cost protocol of footprint analysis and hanging box test for mice applied the chronic restraint stress. Journal of Visualized Experiments: JoVE. (143), e59027 (2019).
- Hassan, S., et al. Identifying chronic low back pain phenotypic domains and characteristics accounting for individual variation: a systematic review. Pain. , (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon