É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo de dor nas costas de camundongo induzido pelo ativador do plasminogênio do tipo uroquinase
Neste Artigo
Resumo
Métodos para indução simples e rápida de um modelo de dor nas costas em camundongos são fornecidos aqui usando uma injeção intraligamentar de ativador de plasminogênio urinário.
Resumo
Um modelo de dor lombar persistente pode ser induzido em camundongos com a metodologia simples aqui descrita. Métodos passo a passo para indução simples e rápida de um modelo de dor persistente nas costas em camundongos são fornecidos aqui usando uma injeção de ativador de plasminogênio do tipo uroquinase (uroquinase), uma serinoprotease presente em humanos e outros animais. A metodologia para indução de dor lombar persistente em camundongos envolve uma simples injeção de uroquinase ao longo da região de inserção ligamentar da coluna lombar. O agente inflamatório uroquinase ativa plasminogênio em plasmina. Normalmente, o modelo pode ser induzido dentro de 10 minutos e a hipersensibilidade persiste por pelo menos 8 semanas.
Hipersensibilidade, distúrbio da marcha e outras medidas padrão semelhantes à ansiedade e depressão podem ser testadas no modelo persistente. A dor nas costas é o tipo de dor mais prevalente. Para melhorar a conscientização sobre a dor nas costas, a Associação Internacional para o Estudo da Dor (IASP) nomeou 2021 o "Ano Global sobre Dor nas Costas" e 2022 o "Ano Global para Traduzir o Conhecimento da Dor para a Prática". Uma limitação do avanço terapêutico da terapêutica da dor é a falta de modelos adequados para testar a dor persistente e crônica. As características deste modelo são adequadas para testar potenciais terapêuticas destinadas à redução da dor nas costas e suas características auxiliares, contribuindo para que o IASP nomeie 2022 como o Ano Global para a Tradução do Conhecimento da Dor para a Prática.
Introdução
A dor lombar é uma das causas mais comuns de incapacidade, com 1 em cada 5 pessoas sofrendo em todo o mundo1. Apesar desses esforços, poucos modelos animais confiáveis de dor nas costas são popularmente usados em pesquisas com animais no campo da dor, especialmente em camundongos. Modelos anteriores utilizaram quase que exclusivamente ratos para a indução de dor lombar crônica (CEC), como aquelas induzidas pela injeção do ativador do plasminogênio urinário (uPA) na articulação da facetalombar2,3, injeção de fator de crescimento nervoso (NGF) namusculatura do tronco4, ou iodoacetato monossódico (MIA)5 ou interleucina-1beta6 injeção no disco intravertebral. É claro que os ratos são preferidos para esses modelos principalmente devido ao seu maior tamanho e facilidade de acesso para injeção de agentes inflamatórios.
Para ser claro, existem modelos de dor nas costas em camundongos, como o modelo SPARC-null de degeneração do disco intervertebral em camundongos, usado por muitos anos7, mas estes são mais caros e demorados para serem estabelecidos do que os modelos baseados em injeção. Um estudo recente em camundongos estabeleceu um modelo de dor lombar combinando a injeção de NGF em músculos lombares com estresse de restrição crônica vertical8. No protocolo a seguir, adaptamos o modelo de CBP induzida por uPA de ratos para camundongos2. A hipersensibilidade é estabelecida dentro de 1 semana e persiste até 6-8 semanas. Além disso, estabelecemos que os ratos desenvolvem comportamentos semelhantes aos da ansiedade e da depressão. Dada a prevalência de dor nas costas e o uso mais comum de camundongos em pesquisas moleculares sobre dor, este modelo durável é prontamente estabelecido para uso no desenvolvimento de novas estratégias de tratamento para alívio da dor nas costas.
Protocolo
Todos os procedimentos para animais descritos estão em conformidade com o Guia do NIH para o Cuidado e Uso de Animais de Laboratório. Os estudos foram aprovados pelo Comitê de Cuidado e Uso Institucional local (IACUC #23-201364-HSC) do Centro de Ciências da Saúde da Universidade do Novo México. Todos os estudos estão em conformidade com as políticas sob os auspícios de uma Garantia de Conformidade OLAW (A3002-01) sobre o uso de animais em pesquisa, conforme descrito na Parte III. II. Garantias e Certificações. Os animais são alojados no alojamento do Centro de Recursos Animais (ARC) mantido pela equipe do laboratório e pela equipe da Divisão de Laboratório e Recursos Animais (DLAR). O método de eutanásia (100 μL de injeção de 59 mg/mL de pentobarbital) é rápido e confiável e permite a dissecção e coleta de vários tecidos para pesquisas posteriores.
1. Animais
- Camundongos BALB/c machos e fêmeas adultos (~3-4 semanas de idade) machos e fêmeas (20-25 g) em um ciclo claro:escuro reverso de 12 h:12 h, de modo que seu tempo ativo no escuro ocorre durante o horário de trabalho do laboratório.
NOTA: Isso permitirá a avaliação de todos os parâmetros durante o tempo de atividade natural dos animais, uma vez que os roedores são animais naturalmente noturnos. Isso reduz a contribuição de alterações do relógio circadiano para que os animais possam ser testados durante seu tempo ativo, que agora é diurno. - Monitorar os animais duas vezes ao dia.
- Manter os camundongos em ração normal de camundongos, que é menor em teor de proteína de soja em comparação com a ração padrão de roedores (conhecida por alterar a hipersensibilidade) se avaliar os efeitos da droga em comportamentos relacionados à dor.
- Pesar os animais uma vez por semana para garantir a manutenção do ganho de peso saudável.
NOTA: Não foram observadas diferenças de peso entre os grupos ao longo dos estudos de 8-10 semanas, o que permitiu o cegamento do estudo.
2. Indução do modelo
- Realizar a indução do modelo em uma superfície plana estéril, quente, equipada com um meio de fixar restrições de estabilização para manter o mouse no lugar (Figura 1A). Realizar a cirurgia com microscópio de dissecção em superfície esterilizada.
NOTA: Use um exaustor de grau químico se a captura de anestesia não estiver disponível. - Utilizar seda cirúrgica ou mesmo fios com elásticos amarrados na extremidade das cordas presas às bordas nervuradas da placa como contenção se utilizar a placa de base recomendada na Tabela de Materiais.
- Colocar uma estação de recuperação da almofada de aquecimento em uma superfície adjacente ao arranjo cirúrgico para a transferência dos camundongos para a estação imediatamente após a injeção (Figura 1B).
NOTA: Coloque uma gaiola de alojamento vazia na almofada de aquecimento pelo menos 10 minutos antes da injecção para permitir que a gaiola aqueça até uma temperatura confortável (37 °C). Coloque a gaiola metade fora da almofada, para permitir ao rato acordado uma preferência de temperaturas de recuperação. - Prepare a uroquinase diluindo-a em água estéril. Álcool limpe a seringa Hamilton e enxágue em água estéril. Desenhe a solução com antecedência para que o rato fique sob anestesia durante o menor tempo possível. Utilizar 5 μL de ativador de plasminogênio urinário 2 mg/mL para o modelo; para shams, usar 5 μL de soro fisiológico estéril.
- Instalar a estação de anestesia com isoflurano em um nível de 4% ou menos para este procedimento curto. Coloque o rato na câmara de indução; Normalmente, a taxa de respiração rápida do rato irá abrandar dentro de 1-2 minutos, movendo-se do movimento superior do peito para o peito inferior.
- Use um nível de oxigênio de 1,5 L/min e um recipiente F de carvão ativado ou trabalhe sob um fluxo biológico ou capa de evacuação aérea para esfregar o isoflurano para evitar a exposição ao cirurgião animal. Se não estiver disponível, execute o procedimento em uma capa de segurança química.
- Alternar rapidamente o mouse e o fluxo anestésico para a área cirúrgica em uma bolsa térmica de 37°C, colocando o nariz do mouse no cone nasal para manter o nível anestésico (Figura 1C,D). Verifique se o mouse não tem nenhum movimento reflexivo para apertar os dedos dos pés e, em seguida, segure o mouse na placa de base.
NOTA: Se houver movimento, coloque o mouse de volta na câmara de indução e repita isso. - Limpe a área da pele das costas com um cotonete com álcool. Ajuste a iluminação LED conforme necessário para ter uma visão clara das costas do mouse anestesiado.
NOTA: Se necessário, use um barbeador elétrico para remover o cabelo das costas do mouse para que haja uma visão desobstruída das cristas da coluna vertebral sob a pele. Se os camundongos experimentais forem raspados, raspe também as costas dos camundongos ingênuos e falsos para o estudo de cegamento. - Injete o rato enquanto estiver totalmente anestesiado e imobilizado (sem reflexo de endireitamento e retirada da pinça dos dedos). Use dois dedos para sentir suavemente onde a parte inferior da caixa torácica do mouse encontra a coluna vertebral (Figura 2A). Abaixo desse ponto estão os segmentos da coluna lombar; mirar a injeção aqui em L2-L3.
- Coloque a ponta da seringa de Hamilton ao lado da coluna vertebral (Figura 2B,C). Aponte a seringa em um ângulo de ~45° para o ligamento interespinhoso imediatamente adjacente ao osso.
NOTA: Dependendo da resistência da pele do rato, às vezes depender da gravidade em vez da pressão ativa e de um ângulo de 90° pode funcionar melhor. - Inserir a ponta da agulha suavemente, mas com firmeza, no ligamento interespinhoso (Figura 3B,C) .
NOTA: O objetivo não é romper a cavidade abdominal, mas injetar o ligamento. - Esvazie lentamente o conteúdo da agulha. Se em algum momento houver líquido na ponta, a agulha não passa pela pele. Continue até que todos os 5 μL tenham sido injetados.
- Segure a agulha no lugar por ~5 s para evitar o refluxo da injeção. Recomenda-se o uso de corante azul em ensaios piloto terminais ou agudos.
NOTA: Se feito corretamente, o líquido deve se espalhar para dentro do ligamento como mostrado (Figura 3A). - Retire a agulha suave e lentamente. Certifique-se de que não há sangue ou corrimento.
- Coloque o rato na estação de recuperação de calor com um topo de gaiola até que ele desperte e fique móvel antes de devolvê-lo à gaiola de casa.
NOTA: Supondo que o procedimento foi realizado rapidamente, não deve ser mais de um minuto antes que o mouse desperte. - Verifique os ratos através de 1 h após a cirurgia para garantir que toda a função motora normal continua como precaução.
NOTA: Se feito corretamente, não deve haver complicações deste procedimento. - Verifique os ratos diariamente durante a semana seguinte à cirurgia, incluindo avaliação de peso e inspeção do local de injeção para garantir que nenhuma infecção ou complicações tenham ocorrido. Não use o mouse para experimentação adicional se houver uma mudança de comportamento, como perda de peso e letargia.

Figura 1: Configuração para indução de uroquinase com CBP. (A) A placa de base Fine Science Tools recomendada para cirurgias em camundongos. As bordas nervuradas podem ter corda presa nelas para segurar o mouse no lugar. (B) Estação de recuperação. Recomenda-se uma gaiola de alojamento vazia, metade na almofada de aquecimento, metade desligada. Um pano limpo é colocado na parte inferior para dar ao mouse uma área de descanso confortável. (C) Recomendação de instalação do aparelho de anestesia. Com sistema de liberação de dois canais, coloque-se uma mangueira na câmara de indução e outra no posto cirúrgico. (D) Uma visão dos dispositivos de retenção do mouse. Duas cordas são amarradas nas bordas nervuradas da placa de base e, em seguida, puxadas suavemente pelo pescoço e pela traseira do mouse, respectivamente. Certifique-se de não conter o mouse com muita força para que ele ainda possa respirar normalmente. Clique aqui para ver uma versão maior desta figura.

Figura 2: Indução da injeção de uroquinase da CEC. (A) Uma visão do local de injeção. Como mostrado, sinta com os dedos para encontrar a parte inferior da caixa torácica do mouse para um ponto de referência para L4-L5. (B) Uma visão do processo de injeção, mostrando o ângulo para a injeção adequada. (C) Um ângulo de 45° é preferível aqui, mas ajuste conforme necessário para garantir que a agulha chegue onde precisa. Se necessário, raspe o local da injeção para melhor visualização. Clique aqui para ver uma versão maior desta figura.

Figura 3: Diagrama do local de injeção. (A) Uma fotografia da localização do local de injeção. A tinta é usada aqui para indicar onde o líquido estará entrando no ligamento interespinhoso entre as vértebras L2 e L3. (B) Um diagrama mostrando o posicionamento adequado da agulha e a localização do local de injeção, mostrado a partir de uma vista lateral. (C) Um diagrama mostrando uma visão de cima para baixo das vértebras e locais de injeção para os ligamentos interespinhosos. As injeções normalmente estarão nos ligamentos interespinhosos próximos à coluna, mas a agulha também pode ser inserida no espaço entre as vértebras intertransversas. Recomenda-se o uso de corante azul em ensaios piloto, conforme demonstrado em (A). Clique aqui para ver uma versão maior desta figura.
3. Ensaios comportamentais
- Teste do limiar de resposta reflexa mecânica de von Frey
NOTA: O limiar de retirada mecânica é a força mínima necessária para provocar uma resposta 50% do tempo com uma série de 8 monofilamentos de von Frey graduados em diâmetro com ~0,2 g de aumento, proporcionando mudanças de passo logarítmico na força mecânica (Tabela de Materiais).- Teste de estimulação mecânica com fibras de von Frey aplicadas na pata traseira, território de inervação dos nervos lombossacrais. Determinar os valores basais de retirada da pata antes da cirurgia. Após a cirurgia, determinar o limiar mecânico uma vez por semana durante o experimento crônico.
- Mova os animais da sala de alojamento e aclimate-os na sala de teste por 30 minutos em suas gaiolas domésticas antes do teste. A partir daí, mova os animais para contê-los individualmente em pequenos cubículos transparentes na mesa de teste com tampa de tela por 15-20 minutos, dependendo de seu nível de atividade.
NOTA: Os testes podem começar depois que os ratos se acomodaram em uma posição de repouso e não estão girando e se movendo na câmara. A aclimatação ao cubículo de contenção minimiza os efeitos induzidos pelo estresse. Se os ratos tiverem sido mantidos em um ciclo de luz inversa, o teste deve ser feito sob condições de luz vermelha. - Prossiga com os testes usando séries graduadas de fibras de von Frey como descrito abaixo e em Chaplan et al.9.
- Sondar a almofada do pé em um ponto consistente em cada animal usando o filamento de 3,61 von Frey que, quando dobrado, provoca 0,4 g de força (Tabela de Materiais). Seguir com estimulação com o filamento de 4,08 von Frey que provoca 1,0 g de força.
NOTA: Nenhuma dessas fibras provoca respostas em animais ingênuos e aclimatados. - Aplicar cada filamento 5x a intervalos de >5 s perpendicularmente ao coxim do pé, tomando cuidado para não tocar em dobra/fenda ou cabelo. Uma resposta positiva é a retirada dos pés a três dos cinco estímulos. Aplicar o próximo filamento mais fraco da série até que o animal não responda ao estímulo mecânico; Nesse ponto, use o próximo filamento superior. Se provocar uma resposta, utilizar novamente o filamento inferior até que quatro tentativas tenham sido aplicadas após a mudança de resposta à estimulação mecânica do coxim plantar.
- Utilizar o padrão de resposta resultante para calcular o limiar de retirada mecânica, a quantidade mínima de força necessária para eliciar uma resposta em 50% das vezes, utilizando um algoritmo de ajuste de curvas9. Uma diminuição na força necessária para provocar uma resposta de retirada do pé em comparação com camundongos virgens ou a linha de base do próprio animal indica um aumento da sensibilidade do animal.
- Sondar a almofada do pé em um ponto consistente em cada animal usando o filamento de 3,61 von Frey que, quando dobrado, provoca 0,4 g de força (Tabela de Materiais). Seguir com estimulação com o filamento de 4,08 von Frey que provoca 1,0 g de força.
- Teste de limiar de resposta do reflexo térmico
NOTA: Os limiares de resposta ao calor e ao frio são determinados com os testes de Hargreaves e de placa fria, respectivamente.- Teste de Hargreaves
- Coloque os ratos em cubículos em uma superfície de vidro aquecida com um emissor infravermelho de baixo. Registrar a latência para retirada do pé como o tempo, em segundos, da aplicação do estímulo de luz infravermelha (50 °C) fornecido pelo aparelho na pata traseira do camundongo até a retirada da estimulação.
- Teste de placa fria
- Coloque os ratos no aparelho de placa fria refrigerado a -9 °C. Registre a latência para retirar o pé como o tempo, em segundos, desde a colocação do mouse no aparelho até que o mouse comece a levantar o pé.
- Alternativamente, coloque uma sonda fria resfriada a -9 °C sob a pata traseira do rato enquanto o rato está enjaulado em cima de uma malha de arame. Registre a latência para retirar como o tempo em segundos da colocação do aparelho sob a pata traseira até que o mouse comece a levantar, lamber ou agitar os pés. Para evitar evocar uma resposta nociceptiva, aclimate o rato a ser tocado pela sonda à temperatura ambiente.
- Teste de Hargreaves
- Ensaios comportamentais dependentes da cognição e da emoção
NOTA: A hipersensibilidade de longa duração em animais produz disfunção emocional e cognitiva-dependente. Estes são tipicamente medidos apenas uma vez na semana 6 após a indução do modelo de dor para evitar efeitos práticos.- Testes de ansiedade
NOTA: A ansiedade e a depressão também podem ser testadas de forma confiável para verificar a eficácia do modelo. É melhor esperar até pelo menos semanas 4-6 após a injeção de indução para permitir que as comorbidades se desenvolvam. A preferência pela câmara escura em vez da câmara clara é uma medida da ansiedade relacionada à nocicepção. No teste de labirinto zero ou mais, camundongos modelo de dor passam menos tempo nos quadrantes abertos do que animais controles virgens, uma demonstração de comportamento semelhante à ansiedade10,11.- Teste de preferência de lugar claro/escuro: colocar cada animal na caixa de teste de preferência de local com uma passagem entre duas câmaras (10 x 10 x 10 cm3). Uma câmara do aparelho é iluminada intensamente, enquanto o lado oposto permanece escuro. Durante cada teste de 10 minutos, monitore a localização do animal por computador para determinar os tempos de ocupação claro e escuro e o número de transições.
NOTA: Alternativamente, monte uma câmera de vídeo sobre a câmara de teste e registre manualmente o tempo gasto em cada câmara. - Labirintos elevados mais ou zero: coloque os roedores modelo ou animais ingênuos no labirinto e use um cronômetro para avaliar o tempo gasto nas partes fechadas do labirinto. Determine o tempo gasto nas duas áreas "seguras" muradas e nas duas áreas abertas "inseguras". Animais com dor preferem áreas seguras fechadas.
NOTA: O comportamento semelhante à ansiedade pode ser testado em um labirinto zero ou mais (10 min). O labirinto zero é uma faixa circular em oposição ao labirinto plus, que é "sinal de mais em forma". Ambos possuem dois quadrantes abertos e dois fechados que permitem um comportamento exploratório contínuo. Ambos são levantados a 1 m do chão, uma passarela circular ou em forma de plus dividida em quatro quadrantes de tamanho igual.
- Teste de preferência de lugar claro/escuro: colocar cada animal na caixa de teste de preferência de local com uma passagem entre duas câmaras (10 x 10 x 10 cm3). Uma câmara do aparelho é iluminada intensamente, enquanto o lado oposto permanece escuro. Durante cada teste de 10 minutos, monitore a localização do animal por computador para determinar os tempos de ocupação claro e escuro e o número de transições.
- Teste de depressão por salpicos de sacarose
NOTA: O teste de salpicos de sacarose é usado para determinar o comportamento semelhante à depressão. O splash test permite mensurar a ausência de comportamento normal de tosa como sintoma de depressão decorrente de dor crônica.- Pontuar a frequência, duração e latência da tosa por 10 min após pulverizar uma solução de sacarose a 10-30% no revestimento dorsal (~250 μL perto da base da cauda). Já observadores cegos contam o número de manobras de aliciamento a partir de gravações em fitas de vídeo12.
NOTA: Este índice tem sido relatado como afetado em modelos de roedores de transtornos de humor, como estresse crônico leve, e para ser corrigido pelo tratamento antidepressivo crônico13.
- Pontuar a frequência, duração e latência da tosa por 10 min após pulverizar uma solução de sacarose a 10-30% no revestimento dorsal (~250 μL perto da base da cauda). Já observadores cegos contam o número de manobras de aliciamento a partir de gravações em fitas de vídeo12.
- Teste de objeto novo
NOTA: A disfunção cognitiva é mensurável com o teste de objeto novo.- Aclimatar camundongos individualmente a uma gaiola de plástico transparente com tampo aberto (56 x 30 x 20 cm) por 1 h. Adicione duas minifiguras de brinquedo idênticas em cantos opostos da gaiola por 5 min.
- No dia do teste, aclimatar os animais à gaiola transparente novamente por 1 h antes de colocar as duas minifiguras idênticas nas mesmas posições da gaiola por 5 minutos antes de devolvê-los à gaiola de origem.
- Substitua uma das figuras originais por um objeto novo distintamente diferente, devolva os ratos à gaiola de teste 4 h depois e registre o tempo gasto explorando os objetos.
- Calcule o Índice de Reconhecimento (IR) relatado como a porcentagem de tempo gasto explorando o novo objeto do tempo total de exploração do objeto14.
- Avaliação da função motora
OBS: O teste de mobilidade inkblot e distúrbio da marcha15 avalia a função motora no modelo de dor nas costas.- Construa um túnel a partir de um tubo de papel toalha cortado longitudinalmente em uma borda. Espalhe o túnel em um pedaço limpo de papel de impressora.
- Segure os ratos suavemente enrolados em uma toalha até que fiquem calmos. Coloque as patas em uma almofada de carimbo molhada com tinta não tóxica da Índia para revesti-las com tinta ou pinte a tinta na parte inferior dos pés do rato usando um cotonete. Solte os ratos na entrada do túnel e deixe-os correr pelo túnel, capturando-os no final.
- Pontuar impressões da pata com base em três parâmetros: comprimento da passada (a distância vertical da extremidade traseira de uma impressão para a seguinte), largura da passada (distância horizontal entre as impressões) e distância dos dedos dos pés (a distância entre os dedos nos lados opostos da pata).
NOTA: As guloseimas aprovadas também podem ser usadas para incentivar o rato a atravessar o túnel. Se as impressões das patas estiverem manchadas ou pouco claras, o experimento deve ser repetido.
- Testes de ansiedade
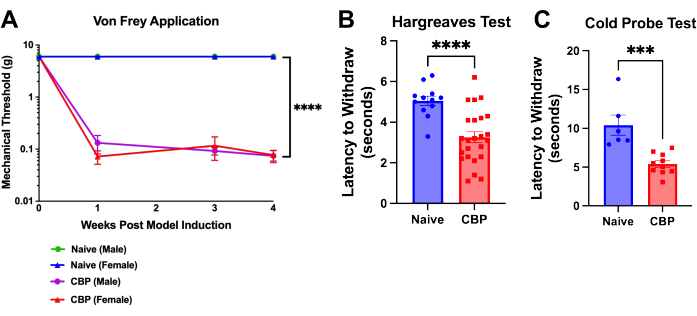
Figura 4: Hipersensibilidade mecânica e térmica após indução com CEC. A dor é mensurável uma semana após a indução do modelo e persiste por 8 semanas. (A) Teste de von Frey. O teste de limiar mecânico é realizado com filamentos de von Frey aplicados ao coxim plantar através de uma mesa superior de malha com o método up-down como mostrado aqui ao longo de 4 semanas. O limiar masculino ingênuo (verde) está escondido sob a linha azul para os ratos fêmeas ingênuos. Os camundongos CBP (n = 4 machos, 4 fêmeas) apresentaram sensibilidade mecânica significativamente aumentada em comparação com os controles virgens (n = 2 machos, 2 fêmeas). A ANOVA two-way (teste de comparações múltiplas de Dunnett) foi realizada com os seguintes dados: n = 4 por grupo. Nas análises post-hoc , o ajuste de Bonferroni a todos os valores de P para comparações semanais de CBP versus Naïve produziu todos os 11 valores < 0,0011. p < 0,0001. (B) Teste de Hargreaves. O limiar térmico foi testado no coxim plantar com o teste de Hargreaves (50 °C). Os camundongos CBP (n = 12 machos, 12 fêmeas) apresentaram sensibilidade ao calor significativamente aumentada em comparação com os controles virgens (n = 6 machos, 6 fêmeas). O teste t bicaudal de Mann-Whitney foi realizado para testar a significância (p < 0,0001). (C) Sensibilidade ao frio. O teste com sonda fria foi realizado colocando-se camundongos no aparelho de placa fria resfriado a -9 °C. A latência para retirada foi registrada como o tempo, em segundos, desde a colocação do mouse no aparelho até que o mouse comece a levantar, lamber ou agitar os pés. Nos dados mostrados, uma sonda fria resfriada a -9 °C foi colocada sob a pata traseira do camundongo enquanto o camundongo está enjaulado em cima de uma malha de arame. Todos os camundongos foram testados 1-3 semanas após a injeção. Os camundongos CBP (n = 4 machos, 6 fêmeas) apresentaram sensibilidade ao frio significativamente aumentada em comparação com os controles virgens (n = 2 machos, 4 fêmeas). O teste t bicaudal de Mann-Whitney foi realizado para testar a significância (p = 0,0002). Clique aqui para ver uma versão maior desta figura.
Resultados
Testes comportamentais relacionados à nocicepção e análise de dados
Medidas evocadas
A hipersensibilidade no coxim plantar desenvolve-se dentro de um dia após a injeção de uroquinase. Dentro de 1 semana, o limiar de retirada é significativamente reduzido e persiste até a eutanásia; isso é demonstrado até a semana 4 pós-cirúrgica (Figura 4A). A latência de retirada da pata é analisada pelo método de von Frey up-down9
Discussão
Este modelo de dor lombar crônica é simples de induzir, e a hipersensibilidade estabelecida dentro de 1 semana pode durar até (e possivelmente além) de 8 semanas. Isso permite um estudo preciso do estado de dor crônica, em oposição a outros modelos agudos que duram apenas uma ou duas semanas. Enquanto mostramos o modelo em camundongos, o modelo de CBP induzida por uPA também pode ser estabelecido em ratos2. Uma vantagem do modelo é que o curso temporal prolongado provoca o desenvolvimento...
Divulgações
Os autores declaram não haver interesses financeiros concorrentes. A KNW reconhece consultas não pagas com a NeuroChronix, a Bessor Pharma e a USA Elixeria BioPharm, Inc.
Agradecimentos
O financiamento da subvenção foi fornecido pelo NIH HEAL UG3 NS123958. As instalações habitacionais foram inspecionadas e credenciadas pela AAALAC. Os animais foram alojados no alojamento do Centro de Recursos Animais (ARC), mantido pela equipe do laboratório e pela equipe da Divisão de Laboratório e Recursos Animais (DLAR). Os procedimentos para testes comportamentais são métodos padrão na área, aprovados pela American Pain Society e pela International Association for the Study of Pain. O método de eutanásia é consistente com as recomendações do Painel de Eutanásia da Associação Médica Veterinária Americana.
Materiais
| Name | Company | Catalog Number | Comments |
| Animals and Consumables | |||
| 70% ethanol | Local Source | ||
| BALB/c mice | Envigo | 20-25 g | |
| Cotton balls | Fisher Scientific | 19-090-702 | |
| Cotton-tipped applicators | Fisher Scientific | 19-062-616 | |
| Isoflurane inhalant anesthetic | MedVet | RXISO-250 | |
| Labeling tape | Fisher Scientific | NGFP7002 | |
| Nitrile exam gloves | Fisher Scientific | ||
| Oxygen tank | Local Source | ||
| Surgical drape, Steri-Drape Utility Sheet, Absorbent Prevention | VWR | 76246-788 | cut into 15 x 15 cm pieces |
| Tygon tubing with 3 mm inner diameter | Grainger | 22XH87 | |
| Equipment | |||
| #11 carbon steel scalpel blades | VWR | 21909-612 | |
| Anesthesia induction chamber | Summit Medical Equipment Company | AS-01-0530-LG | |
| Autoclave | Local Unit | ||
| Biology Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| Glass bead sterilizer Germinator 500 | VWR | 102095-946 | |
| IITC Life Sciences Series 8 Model PE34 Hot/Cold Plate Analgesia Meter | IITC | PE34 | |
| Integra Miltex cotton & dressing pliers | Safco Dental Supply | 66-317 | |
| OPTIKA CL31 double arm LED illuminator | New York Microscope Company | OPCL-31 | |
| Plantar Test System with InfraRed Emitter, i. e. Hargreaves Apparatus | Ugo Basile | 37370-001 and 37370-002 | |
| Scalpel Handle No. 3 | VWR | 25607-947 | |
| Small animal heating pad | Valley Vet Supply | 47375 | |
| Student Vannas spring scissors, straight blade | Fine Science Tools | 91500-09 | |
| Table top animal research portable anesthesia workstation “PAM” | Patterson Scientific | AS-01-0007 | |
| Von Frey Filaments | Ugo Basile | 37450-275 |
Referências
- O'Sullivan, P. B., et al. Back to basics: 10 facts every person should know about back pain. British Journal of Sports Medicine. 54 (12), 698-699 (2020).
- Nauta, H. J., McIlwrath, S. L., Westlund, K. N. Punctate midline myelotomy reduces pain responses in a rat model of lumbar spine pain: evidence that the postsynaptic dorsal column pathway conveys pain from the axial spine. Cureus. 10 (3), 2371 (2018).
- Shuang, F., et al. Establishment of a rat model of lumbar facet joint osteoarthritis using intraarticular injection of urinary plasminogen activator. Scientific Reports. 5 (1), 9828 (2015).
- Reed, N. R., et al. Somatosensory behavioral alterations in a NGF-induced persistent low back pain model. Behavioural Brain Research. 418, 113617 (2022).
- Suh, H. R., Cho, H. -. Y., Han, H. C. Development of a novel model of intervertebral disc degeneration by the intradiscal application of monosodium iodoacetate (MIA) in rat. The Spine Journal. 22 (1), 183-192 (2022).
- Kim, H., Hong, J. Y., Lee, J., Jeon, W. -. J., Ha, I. -. H. IL-1β promotes disc degeneration and inflammation through direct injection of intervertebral disc in a rat lumbar disc herniation model. The Spine Journal. 21 (6), 1031-1041 (2021).
- Millecamps, M., Tajerian, M., Sage, E. H., Stone, L. S. Behavioral signs of chronic back pain in the SPARC-null mouse. Spine. 36 (2), 95-102 (2011).
- La Porta, C., Tappe-Theodor, A. Differential impact of psychological and psychophysical stress on low back pain in mice. Pain. 161 (7), 1442-1458 (2020).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Takao, K., Miyakawa, T. Light/dark transition test for mice. Journal of Visualized Experiments JoVE. (1), e104 (2006).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284 (2017).
- David, D. J., et al. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron. 62 (4), 479-493 (2009).
- Yalcin, I., et al. A time-dependent history of mood disorders in a murine model of neuropathic pain. Biological Psychiatry. 70 (10), 946-953 (2011).
- Madathil, S. K., et al. Astrocyte-specific overexpression of insulin-like growth factor-1 protects hippocampal neurons and reduces behavioral deficits following traumatic brain injury in mice. PloS One. 8 (6), e67204 (2013).
- Sugimoto, H., Kawakami, K. Low-cost protocol of footprint analysis and hanging box test for mice applied the chronic restraint stress. Journal of Visualized Experiments: JoVE. (143), e59027 (2019).
- Hassan, S., et al. Identifying chronic low back pain phenotypic domains and characteristics accounting for individual variation: a systematic review. Pain. , (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados