需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
尿激酶型纤溶酶原激活剂诱导的小鼠背痛模型
摘要
这里提供了使用韧带内注射尿纤溶酶原激活剂在小鼠中简单、快速诱导背痛模型的方法。
摘要
使用本文描述的简单方法可以在小鼠中诱导持续性腰痛的模型。这里提供了使用尿激酶型纤溶酶原激活剂(尿激酶)的简单、快速诱导小鼠持续性背痛模型的分步方法,尿激酶是一种存在于人类和其他动物中的丝氨酸蛋白酶。诱导小鼠持续性腰痛的方法包括沿腰椎韧带插入区域简单地注射尿激酶。尿激酶炎症因子将纤溶酶原激活为纤溶酶。通常,该模型可以在 10 分钟内诱导,并且超敏反应持续至少 8 周。
超敏反应、步态障碍和其他标准的焦虑和抑郁样测量可以在持续模型中进行测试。背痛是最普遍的疼痛类型。为了提高对背痛的认识,国际疼痛研究协会 (IASP) 将 2021 年命名为"全球背痛年",将 2022 年命名为"将疼痛知识转化为实践的全球年"。疼痛疗法治疗进步的一个局限性是缺乏合适的模型来测试持续性和慢性疼痛。该模型的特点适用于测试旨在减轻背痛及其辅助特征的潜在疗法,有助于 IASP 将 2022 年命名为将疼痛知识转化为实践的全球年。
引言
腰痛是最常见的残疾原因之一,全世界每 5 人中就有 1 人患有腰痛1。尽管做出了这些努力,但很少有可靠的背痛动物模型被广泛用于疼痛领域的动物研究,尤其是在小鼠中。以前的模型几乎完全利用大鼠来诱导慢性背痛 (CBP),例如通过将尿纤溶酶原激活剂 (uPA) 注射到腰椎小关节 2,3、将神经生长因子 (NGF) 注射到躯干肌肉组织4 或碘乙酸钠 (MIA)5 或白细胞介素-1β6 诱导的疼痛在椎间盘中注射。当然,大鼠是这些模型的首选,主要是因为它们的体型较大且易于注射炎症剂。
需要明确的是,背痛的小鼠模型确实存在,例如使用多年的椎间盘退行性SPARC无效小鼠模型7,但这些模型的建立比基于注射的模型更昂贵和耗时。最近的一项小鼠研究通过将 NGF 注射到具有垂直慢性约束压力的腰部肌肉中,建立了腰痛模型8。在以下方案中,我们已将来自大鼠的uPA诱导的CBP模型改编为小鼠2。超敏反应在 1 周内建立,并持续长达 6-8 周。此外,我们确定小鼠会发展出类似焦虑和抑郁的行为。鉴于背痛的普遍性和小鼠在分子疼痛研究中的更常见用途,这种持久的模型很容易被建立起来,用于开发缓解背痛的新治疗策略。
Access restricted. Please log in or start a trial to view this content.
研究方案
所描述的所有动物程序均符合美国国立卫生研究院(NIH)的实验动物护理和使用指南。研究已获得新墨西哥大学健康科学中心当地机构护理和使用委员会 (IACUC #23-201364-HSC) 的批准。所有研究均符合OLAW合规保证(A3002-01)主持的关于在研究中使用动物的政策,如第三部分所述。II. 保证和认证。动物被安置在动物资源中心(ARC)的住房设施中,由实验室工作人员和实验室和动物资源部(DLAR)的工作人员维护。安乐死方法(100 μL 59 mg/mL 戊巴比妥注射液)快速可靠,可以解剖和收集各种组织以供进一步研究。
1. 动物
- 饲养成年(~3-4周龄)雄性和雌性BALB / c小鼠(20-25g)在反向12小时:12小时光照:黑暗循环中,因此它们在黑暗中的活跃时间发生在实验室工作时间。
注意:这将允许评估动物自然活动期间的所有参数,因为啮齿动物是天然的夜行动物。这减少了生物钟变化的贡献,因此可以在动物的活动时间(现在是白天)进行测试。 - 每天监测动物两次。
- 如果评估药物对疼痛相关行为的影响,将小鼠维持在正常的小鼠饲养食物上,与标准啮齿动物食物(已知会改变超敏反应)相比,大豆蛋白含量较低。
- 每周称重一次,以确保保持健康的体重增加。
注意:在为期8-10周的研究中,没有发现体重的组差异,这使得研究盲法成为可能。
2. 模型归纳
- 在温暖的无菌平面上进行模型感应,该表面装有连接稳定约束装置以将鼠标固定到位的装置(图1A)。用解剖显微镜在灭菌的表面上进行手术。
注意: 如果没有麻醉捕获,请使用化学级通风橱。 - 如果使用 材料表中推荐的底板,请使用手术丝绸甚至纱线,橡皮筋打结在钩在板的罗纹边缘的绳子末端作为约束。
- 将加热垫恢复站放置在与手术装置相邻的表面上,以便在注射后立即将小鼠转移到该站(图1B)。
注意: 在注射前至少 10 分钟将空壳体笼放在加热垫上,以使笼子加热到舒适的温度 (37 °C)。将笼子放在垫子上的一半,让醒来的老鼠优先选择恢复温度。 - 准备尿激酶,将其稀释在无菌水中。酒精清洁汉密尔顿注射器并用无菌水冲洗。提前制定溶液,使鼠标处于麻醉状态的时间尽可能短。模型使用 5 μL 2 mg/mL 尿纤溶酶原激活剂;对于 shams,使用 5 μL 无菌生理盐水。
- 对于这个简短的程序,将异氟醚麻醉站设置在 4% 或更低的水平。将鼠标放入感应室;通常,小鼠的快速呼吸频率会在 1-2 分钟内减慢,从上胸部运动移动到下胸部。
- 使用 1.5 L/min 的氧气水平和活性炭 F 罐,或在生物流或头顶抽真空罩下擦洗异氟醚,以避免接触动物外科医生。如果不可用,请在化学安全罩中执行该程序。
- 在37°C加热垫上快速将小鼠和麻醉剂流切换到手术区域,将小鼠的鼻子放在鼻锥中以保持麻醉水平(图1C,D)。检查以确保鼠标没有反射性运动来捏脚趾,然后将鼠标束缚在底板上。
注意: 如果有移动,请将鼠标放回感应室并重复此操作。 - 用酒精棉签清洁背部皮肤区域。根据需要调整 LED 照明,以便清楚地看到麻醉鼠标的背部。
注意: 如果需要,请使用电动剃须刀去除鼠标背部的毛发,以便一览无余地看到皮肤下方的脊柱脊。如果实验小鼠被剃光,也要剃掉幼稚和假小鼠的背部以进行研究盲法。 - 在完全麻醉和固定的情况下注射鼠标(无矫正反射和脚趾捏拔)。用两根手指轻轻感受鼠标胸腔底部与脊柱相接的位置(图2A)。该点下方是木材脊柱节段;将注射对准 L2-L3。
- 将汉密尔顿注射器的尖端放在脊柱旁边(图2B,C)。将注射器以 ~45° 角对准紧邻骨骼的棘间韧带。
注意:根据鼠标皮肤的韧性,有时依靠重力而不是主动压力和 90° 角可以更好地工作。 - 轻轻但牢固地将针尖插入棘间韧带(图3B,C)。
注意:目标不是突破腹腔,而是注射韧带。 - 慢慢清空针头的内容物。如果尖端有液体,则针头没有穿过皮肤。继续直到进样所有 5 μL。
- 将针头固定到位 ~5 秒,以防止注射回流。建议在终末期或急性试验中使用蓝色染料。
注意:如果操作正确,液体应如图所示扩散到韧带中(图3A)。 - 轻轻缓慢地取出针头。确保没有血液或分泌物。
- 将鼠标放入带有笼顶的热回收站中,直到它醒来并移动,然后再将其放回家笼。
注意:假设该过程执行得很快,那么鼠标唤醒前不应超过一分钟。 - 手术后1小时检查小鼠,以确保所有正常的运动功能继续作为预防措施。
注意:如果操作正确,此过程应该不会出现并发症。 - 在手术后的一周内每天检查小鼠,包括体重评估和注射部位检查,以确保没有发生感染或并发症。如果行为发生变化,例如体重减轻和嗜睡,请勿使用鼠标进行进一步实验。

图 1:尿激酶 CBP 诱导的设置。 (A) 推荐用于小鼠手术的 Fine Science Tools 底板。带肋的边缘可以有钩绳,用于将鼠标固定到位。(B) 回收站。建议使用一个空的外壳笼,一半在加热垫上,一半在加热垫上。底部放一块干净的布,给鼠标一个舒适的休息区。(C) 麻醉机设置建议。使用双通道输送系统,将一根软管连接到诱导室,另一根连接到手术站。(D) 鼠标约束装置的视图。将两根绳子打结在底板的肋状边缘,然后分别轻轻拉过鼠标的脖子和后部。确保不要将鼠标束缚得太紧,以便它仍然可以正常呼吸。 请点击这里查看此图的较大版本.

图 2:CBP 的尿激酶注射诱导。 (A) 注射部位放置的视图。如图所示,用手指触摸鼠标胸腔的底部,作为 L4-L5 的参考点。(B) 注射过程的视图,显示正确注射的角度。(C) 这里最好是 45° 角,但要根据需要进行调整以确保针到达需要的位置。如果需要,剃掉注射部位以获得更好的可视化效果。 请点击这里查看此图的较大版本.

图 3:注射部位示意图。 (A) 注射部位位置的照片。这里使用墨水来指示液体将进入 L2 和 L3 椎骨之间的棘间韧带的位置。(B) 从侧面显示针头的正确位置和注射部位位置的图表。(C) 显示椎骨和棘间韧带注射部位的自上而下的视图的图表。注射通常在脊柱旁边的棘间韧带上,但针头也可以插入横椎之间的空间。建议在试点试验中使用蓝色染料,如(A)所示。请点击这里查看此图的较大版本.
3. 行为分析
- von Frey 机械反射反应阈值测试
注意:机械撤回阈值是在 50% 的时间内引起响应所需的最小力,一系列 8 个 von Frey 单丝的直径分级为 ~0.2 g,提供机械力的对数阶跃变化(材料表)。- 用应用于后爪(腰骶神经的神经支配区域)的 von Frey 纤维测试机械刺激。在手术前确定基线爪子拔出值。手术后,在慢性实验期间每周确定一次机械阈值。
- 在测试之前,将动物从饲养室中移出,并在测试室中在家中笼子中适应它们 30 分钟。从那里,移动动物,根据它们的活动水平,将它们单独限制在屏幕顶部测试台上的小透明隔间中15-20分钟。
注意:在小鼠进入休息位置并且没有在腔室中转动和移动后,可以开始测试。适应约束隔间可最大限度地减少压力引起的影响。如果小鼠保持在反光周期,则应在红光条件下进行测试。 - 继续使用分级系列的 von Frey 纤维进行测试,如下所述和 Chaplan 等人 9。
- 使用 3.61 von Frey 灯丝在每只动物的一致位置探测脚垫,该灯丝在弯曲时会产生 0.4 g 的力(材料表)。随后用 4.08 von Frey 灯丝刺激,产生 1.0 g 的力。
注意:这些纤维都不会在幼稚的、适应环境的动物中引起反应。 - 以垂直于脚垫的间隔 >5 秒将每根细丝涂抹 5 次,注意不要接触褶皱/缝隙或头发。积极的反应是对五种刺激中的三种进行足部退缩。施加该系列中下一个较弱的细丝,直到动物对机械刺激没有反应;此时,使用下一个更高的灯丝。如果它引起反应,再次使用下部细丝,直到在对脚垫机械刺激的反应改变后进行四次试验。
- 使用生成的响应模式计算机械撤回阈值,即使用曲线拟合算法9 在 50% 的时间内引起响应所需的最小力。与幼稚小鼠或动物自身的基线相比,引起足部退缩反应所需的力量降低表明动物的敏感性增加。
- 使用 3.61 von Frey 灯丝在每只动物的一致位置探测脚垫,该灯丝在弯曲时会产生 0.4 g 的力(材料表)。随后用 4.08 von Frey 灯丝刺激,产生 1.0 g 的力。
- 热反射响应阈值测试
注意:热响应阈值和冷响应阈值分别通过 Hargreaves 和冷板测试确定。- 哈格里夫斯试验
- 将小鼠放在玻璃表面上的小隔间中,该玻璃表面由红外线发射器从下方加热。将退出脚的延迟记录为从将设备提供的红外光(50°C)刺激施加到小鼠后爪直到退出刺激的时间(以秒为单位)。
- 冷板试验
- 将小鼠放在冷却至-9°C的冷板装置上。 将撤回脚的延迟记录为从将鼠标放置在设备上到鼠标开始抬起脚的时间(以秒为单位)。
- 或者,将冷却至-9°C的冷探头放在小鼠后爪下方,同时将小鼠笼在金属丝网的顶部。将退出的延迟记录为从将设备放置在后爪下到鼠标开始抬脚、舔舐或摇晃的时间(以秒为单位)。为避免引起伤害性反应,请使鼠标适应在室温下被探针触摸。
- 哈格里夫斯试验
- 认知和情绪依赖性行为检测
注意:动物的长期超敏反应会产生情绪和认知依赖性功能障碍。这些通常只在疼痛模型诱导后的第 6 周测量一次,以避免练习效果。- 焦虑测试
注意:焦虑和抑郁也可以可靠地测试,以确定模型的有效性。最好等到诱导注射后至少第 4-6 周,让合并症发展。偏爱黑暗而不是明亮的房间是伤害感受相关焦虑的衡量标准。在零或加迷宫测试中,疼痛模型小鼠在开放象限中花费的时间比幼稚对照动物少,表现出类似焦虑的行为10,11。- 亮/暗场所偏好测试:将每只动物放入位置偏好测试箱中,两个腔室之间有通道(10 x 10 x 10 cm3)。设备的一个腔室明亮,而另一侧保持黑暗。在每 10 分钟的测试期间,通过计算机监控动物的位置,以确定明暗占用时间和过渡次数。
注意: 或者,在测试室上方安装摄像机并手动记录在每个腔室中花费的时间。 - 高架加号或零号迷宫:将模型啮齿动物或幼稚的动物放在迷宫上,并使用秒表评估在迷宫封闭部分花费的时间。确定在两个有围墙的"安全"区域和两个开放的"不安全"区域花费的时间。有疼痛的动物更喜欢封闭的安全区域。
注意:焦虑样行为可以在零或加迷宫(10 分钟)中进行测试。零迷宫是一条圆形轨道,而不是加号迷宫,后者是"加号形"。两者都有两个开放象限和两个封闭象限,允许持续的探索行为。两者都高出地面 1 m,呈圆形或正形走道,分为四个大小相等的象限。
- 亮/暗场所偏好测试:将每只动物放入位置偏好测试箱中,两个腔室之间有通道(10 x 10 x 10 cm3)。设备的一个腔室明亮,而另一侧保持黑暗。在每 10 分钟的测试期间,通过计算机监控动物的位置,以确定明暗占用时间和过渡次数。
- 蔗糖飞溅压低试验
注意:蔗糖飞溅试验用于确定抑郁样行为。飞溅测试可以测量缺乏正常的美容行为,这是慢性疼痛导致的抑郁症状。- 在背毛上喷洒 10-30% 蔗糖溶液(尾巴底部附近~250 μL)后,对梳理毛发的频率、持续时间和潜伏期进行评分 10 分钟。让失明的观察者从录像带记录中计算梳理动作的次数12.
注:据报道,该指数在啮齿动物的情绪障碍模型中受到影响,例如慢性轻度压力,并通过慢性抗抑郁治疗来纠正13。
- 在背毛上喷洒 10-30% 蔗糖溶液(尾巴底部附近~250 μL)后,对梳理毛发的频率、持续时间和潜伏期进行评分 10 分钟。让失明的观察者从录像带记录中计算梳理动作的次数12.
- 新颖对象测试
注意:认知功能障碍可以通过新对象测试来测量。- 将小鼠单独适应具有开盖(56×30×20cm)的透明塑料笼1小时。在笼子的相对角上添加两个相同的玩具小人仔,持续 5 分钟。
- 在测试当天,将动物再次适应透明笼子 1 小时,然后将两个相同的小人仔放在笼子的相同位置 5 分钟,然后将它们放回家庭笼子。
- 用一个明显不同的新物体替换其中一个原始图形,4小时后将小鼠送回测试笼,并记录探索物体所花费的时间。
- 将报告的识别指数 (RI) 计算为探索新对象所花费的时间占总对象探索时间的百分比 14.
- 运动功能评估
注意:墨迹活动性和步态障碍测试15 评估背痛模型中的运动功能。- 用在一条边纵向切开的纸巾管建造隧道。在一张干净的打印纸上铺开隧道。
- 用毛巾轻轻包裹老鼠,直到它们平静下来。将爪子放在沾有无毒印度墨水的邮票垫上,涂上墨水或用棉签将墨水涂在鼠标脚的底部。在隧道入口处释放老鼠,让它们穿过隧道,在最后捕获它们。
- 根据三个参数对爪印进行评分:步幅(从一个印迹的后端到下一个印迹的垂直距离)、步幅(印迹之间的水平距离)和脚趾张开(爪子两侧脚趾之间的距离)。
注意:经批准的零食也可用于鼓励老鼠通过隧道。如果爪印被弄脏或不清楚,则必须重复实验。
- 焦虑测试
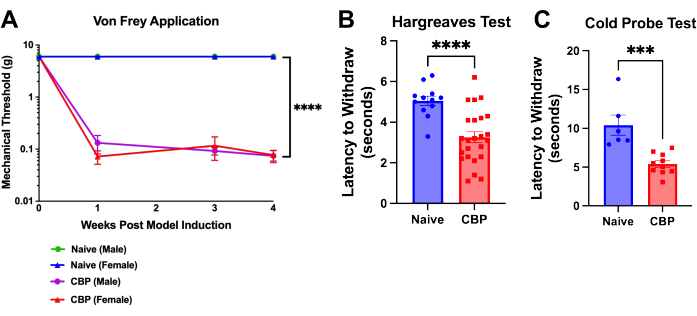
图 4:CBP 诱导后的机械和热超敏反应。 模型诱导后一周可测量疼痛,并持续 8 周。(A)von Frey试验。机械阈值测试是在 4 周内通过网状顶台将 von Frey 长丝施加到脚垫上,如上所示,如下所示。幼稚的雄性阈值(绿色)隐藏在幼稚雌性小鼠的蓝线下方。与幼稚对照组(n = 2 只雄性,2只雌性)相比,CBP小鼠(n = 4只雄性,4只雌性)显示出显着增加的机械敏感性。对这些数据进行了双因素方差分析(Dunnett 多重比较检验):每组 n = 4。在 事后 分析中,Bonferroni 对所有 P 值进行调整,以逐周比较 CBP 与 Naïve 的比较,得出所有 11 个值< 0.0011。 p < 0.0001。(B) 哈格里夫斯试验。使用Hargreaves测试(50°C)在脚垫上测试了热阈值。与幼稚对照组(n = 6 雄性,6 雌性)相比,CBP 小鼠(n = 12 雄性,12 雌性)的热敏感性显着增加。采用Mann-Whitney双尾 t检验检验显著性(p < 0.0001)。(C) 冷敏感性。通过将小鼠置于冷却至-9°C的冷板装置上进行冷探针测试。 退出延迟记录为从将鼠标放置在设备上到鼠标开始抬脚、舔舐或摇晃的时间(以秒为单位)。在显示的数据中,将冷却至-9°C的冷探针放置在小鼠的后爪下方,而将小鼠笼在金属丝网的顶部。所有小鼠在注射后1-3周进行测试。与幼稚对照组(n = 2 只雄性,4 只雌性)相比,CBP 小鼠(n = 4 只雄性,6 只雌性)表现出显着增加的冷敏感性。进行 Mann-Whitney 双尾 t 检验以检验显着性 (p = 0.0002)。 请点击这里查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
结果
伤害性相关行为测试和数据分析
诱发措施
脚垫上的超敏反应在尿激酶注射后一天内发生。1周内,戒断阈值显著降低,持续到安乐死;这在术后第 4 周显示(图 4A)。使用 von Frey 上下方法9 和 Hargreaves 检验分析爪子退出潜伏期。在绘制的示例中,与对照组(n = 2 雄性,2 雌性)相比,具有 CBP 的小鼠(n = 4 雄性,4 雌性)表现出?...
Access restricted. Please log in or start a trial to view this content.
讨论
这种慢性背痛模型很容易诱发,在 1 周内建立的超敏反应可持续长达(甚至可能超过)8 周。这允许准确研究慢性疼痛状态,而不是其他仅持续一两周的急性模型。虽然我们在小鼠中展示了该模型,但 uPA 诱导的 CBP 模型也可以在大鼠2 中建立。该模型的一个优点是,长时间的疗程会引起焦虑和抑郁样行为的发展,这在慢性腰痛患者中观察到。鉴于背痛的普遍性16...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明没有相互竞争的经济利益。KNW承认与NeuroChronix、Bessor Pharma和USA Elixeria BioPharm, Inc.的无偿咨询。
致谢
赠款资金由 NIH HEAL UG3 NS123958 提供。住房设施已通过AAALAC的检查和认可。动物被安置在动物资源中心(ARC)的住房设施中,由实验室工作人员和实验室和动物资源部(DLAR)工作人员维护。行为测试程序是美国疼痛协会和国际疼痛研究协会批准的该领域的标准方法。安乐死的方法符合美国兽医协会安乐死小组的建议。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Animals and Consumables | |||
| 70% ethanol | Local Source | ||
| BALB/c mice | Envigo | 20-25 g | |
| Cotton balls | Fisher Scientific | 19-090-702 | |
| Cotton-tipped applicators | Fisher Scientific | 19-062-616 | |
| Isoflurane inhalant anesthetic | MedVet | RXISO-250 | |
| Labeling tape | Fisher Scientific | NGFP7002 | |
| Nitrile exam gloves | Fisher Scientific | ||
| Oxygen tank | Local Source | ||
| Surgical drape, Steri-Drape Utility Sheet, Absorbent Prevention | VWR | 76246-788 | cut into 15 x 15 cm pieces |
| Tygon tubing with 3 mm inner diameter | Grainger | 22XH87 | |
| Equipment | |||
| #11 carbon steel scalpel blades | VWR | 21909-612 | |
| Anesthesia induction chamber | Summit Medical Equipment Company | AS-01-0530-LG | |
| Autoclave | Local Unit | ||
| Biology Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| Glass bead sterilizer Germinator 500 | VWR | 102095-946 | |
| IITC Life Sciences Series 8 Model PE34 Hot/Cold Plate Analgesia Meter | IITC | PE34 | |
| Integra Miltex cotton & dressing pliers | Safco Dental Supply | 66-317 | |
| OPTIKA CL31 double arm LED illuminator | New York Microscope Company | OPCL-31 | |
| Plantar Test System with InfraRed Emitter, i. e. Hargreaves Apparatus | Ugo Basile | 37370-001 and 37370-002 | |
| Scalpel Handle No. 3 | VWR | 25607-947 | |
| Small animal heating pad | Valley Vet Supply | 47375 | |
| Student Vannas spring scissors, straight blade | Fine Science Tools | 91500-09 | |
| Table top animal research portable anesthesia workstation “PAM” | Patterson Scientific | AS-01-0007 | |
| Von Frey Filaments | Ugo Basile | 37450-275 |
参考文献
- O'Sullivan, P. B., et al. Back to basics: 10 facts every person should know about back pain. British Journal of Sports Medicine. 54 (12), 698-699 (2020).
- Nauta, H. J., McIlwrath, S. L., Westlund, K. N. Punctate midline myelotomy reduces pain responses in a rat model of lumbar spine pain: evidence that the postsynaptic dorsal column pathway conveys pain from the axial spine. Cureus. 10 (3), 2371(2018).
- Shuang, F., et al. Establishment of a rat model of lumbar facet joint osteoarthritis using intraarticular injection of urinary plasminogen activator. Scientific Reports. 5 (1), 9828(2015).
- Reed, N. R., et al. Somatosensory behavioral alterations in a NGF-induced persistent low back pain model. Behavioural Brain Research. 418, 113617(2022).
- Suh, H. R., Cho, H. -Y., Han, H. C. Development of a novel model of intervertebral disc degeneration by the intradiscal application of monosodium iodoacetate (MIA) in rat. The Spine Journal. 22 (1), 183-192 (2022).
- Kim, H., Hong, J. Y., Lee, J., Jeon, W. -J., Ha, I. -H. IL-1β promotes disc degeneration and inflammation through direct injection of intervertebral disc in a rat lumbar disc herniation model. The Spine Journal. 21 (6), 1031-1041 (2021).
- Millecamps, M., Tajerian, M., Sage, E. H., Stone, L. S. Behavioral signs of chronic back pain in the SPARC-null mouse. Spine. 36 (2), 95-102 (2011).
- La Porta, C., Tappe-Theodor, A. Differential impact of psychological and psychophysical stress on low back pain in mice. Pain. 161 (7), 1442-1458 (2020).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Takao, K., Miyakawa, T. Light/dark transition test for mice. Journal of Visualized Experiments JoVE. (1), e104(2006).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- David, D. J., et al. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron. 62 (4), 479-493 (2009).
- Yalcin, I., et al. A time-dependent history of mood disorders in a murine model of neuropathic pain. Biological Psychiatry. 70 (10), 946-953 (2011).
- Madathil, S. K., et al. Astrocyte-specific overexpression of insulin-like growth factor-1 protects hippocampal neurons and reduces behavioral deficits following traumatic brain injury in mice. PloS One. 8 (6), e67204(2013).
- Sugimoto, H., Kawakami, K. Low-cost protocol of footprint analysis and hanging box test for mice applied the chronic restraint stress. Journal of Visualized Experiments: JoVE. (143), e59027(2019).
- Hassan, S., et al. Identifying chronic low back pain phenotypic domains and characteristics accounting for individual variation: a systematic review. Pain. , (2023).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。