Method Article
Uso de matrices de nanofibras de carbono alineadas verticalmente sobre sustratos rígidos o flexibles para la entrega de biomoléculas y colorantes a las plantas
En este artículo
Resumen
Aquí describimos métodos para microfabricar nanofibras de carbono alineadas verticalmente (VACNF), transferir VACNF a sustratos flexibles y aplicar VACNF en sustratos rígidos y flexibles a las plantas para la entrega de biomoléculas y colorantes.
Resumen
La entrega de biomoléculas y colorantes impermeables a las plantas intactas es un gran desafío. Los nanomateriales son herramientas prometedoras para la entrega de ADN a las plantas. A pesar de lo emocionantes que son estas nuevas herramientas, aún no se han aplicado ampliamente. Los nanomateriales fabricados sobre sustrato rígido (soporte) son particularmente difíciles de aplicar con éxito a estructuras vegetales curvas. Este estudio describe el proceso de microfabricación de matrices de nanofibras de carbono alineadas verticalmente y su transferencia de un sustrato rígido a uno flexible. Detallamos y demostramos cómo estas fibras (ya sea en sustratos rígidos o flexibles) se pueden usar para la transformación transitoria o la entrega de colorantes (por ejemplo, fluoresceína) a las plantas. Mostramos cómo los VACNF se pueden transferir de un sustrato de silicio rígido a un sustrato epoxi flexible SU-8 para formar matrices VACNF flexibles. Para superar la naturaleza hidrofóbica del SU-8, las fibras de la película flexible se recubrieron con una fina capa de óxido de silicio (2-3 nm). Para utilizar estas fibras para su entrega a los órganos curvos de la planta, depositamos una gota de 1 μL de colorante o solución de ADN en el lado de la fibra de las películas de VACNF, esperamos 10 minutos, colocamos las películas en el órgano de la planta y empleamos un hisopo con un movimiento de balanceo para introducir las fibras en las células vegetales. Con este método, hemos logrado la entrega de tinte y ADN en órganos de plantas con superficies curvas.
Introducción
La transformación de las plantas (tanto transitoria como estable) aún no se ha logrado ampliamente en todos los tejidos y especies vegetales. La transformación transitoria de las plantas es un proceso por el cual los genes codificados en plásmidos se introducen temporalmente en las plantas, pero no se incorporan de manera estable al genoma. Los métodos tradicionales que utilizan el bombardeo de partículas, las agrobacterias, la electroporación o el tratamiento con polietilenglicol de los protoplastos son lentos o pueden ser engorrosos. Además, no son aplicables a todas las especies vegetales 1,2,3,4. El uso de nanomateriales para la entrega de ADN es un campo floreciente que aún está en pañales5. Los nanomateriales, específicamente las nanofibras de carbono, también se han utilizado con éxito para administrar proteínas, dextranos y colorantes a las hojas de las plantas sin causar respuesta a la herida6. El objetivo de este trabajo es proporcionar un protocolo detallado para el uso de un tipo de nanomaterial, las nanofibras de carbono, para la entrega de biomoléculas o colorantes a las plantas. Aquí, nos centramos en el ADN como la biomolécula de elección, que permite la transformación transitoria de las células en varios órganos de las plantas.
Anteriormente, Morgan et al.7 demostraron el uso de nanofibras de carbono adheridas a sustrato rígido de silicio para transformar transitoriamente hojas de lechuga, N. benthamiana y álamo, y tanto hojas como raíces de Arabidopsis. Aunque las transformaciones tuvieron éxito en una variedad de órganos, las fibras fueron más difíciles de aplicar a los tejidos vegetales con superficies curvas, como raíces o frutos. Razonamos que un soporte flexible para las nanofibras podría mejorar su eficiencia de entrega al adaptarse mejor a la forma del órgano.
En este artículo, detallamos los métodos utilizados para fabricar y diseñar nanofibras de carbono alineadas verticalmente, transferir VACNF a sustratos flexibles y aplicar VACNF en sustratos rígidos y flexibles a las plantas para entregar biomoléculas y colorantes. Las nanofibras de carbono se produjeron utilizando la deposición química de vapor mejorada con plasma catalítico de corriente continua (dc C-PECVD) con catalizador de Ni. La posición, el diámetro y la altura de los puntos del catalizador de Ni se controlaron mediante una combinación de litografía por haz de electrones, evaporación de metales y procesos de despegue como lo describen Melechko et al.8,9. Usando una resistencia de haz de electrones de doble capa, se puede depositar un catalizador de Ni más grueso sobre el sustrato para dar fibras más largas10. La transferencia de fibra de un sustrato rígido a uno flexible se basa en una modificación de los métodos descritos en Fletcher et al.11, con los métodos actuales renunciando al uso de una capa de carbono amorfo o una capa fotorresistente de sacrificio. El despegue del SU-8 con transferencia de fibra se logra utilizando la tensión de tracción intrínseca resultante de la cocción insuficiente y la subexposición del SU-812,13,14. El SU-8, un polímero complejo, es naturalmente hidrofóbico, lo que dificulta su uso para facilitar la entrega de ADN. Para contrarrestar la naturaleza hidrofóbica de SU-8, aplicamos una fina capa de óxido de silicio a través de la deposición de la capa atómica15 después de que las fibras se incrustan en SU-8. La aplicación de fibras sobre un sustrato rígido para la administración de biomoléculas/colorantes utiliza la fuerza de impacto del golpeteo de la pinza descrita en Davern et al.6 y los métodos en planta y en chip descritos en Morgan et al.7. Las películas flexibles de VACNF se aplican a las superficies curvas de las plantas semisecando primero las gotas de ADN o tinte en la película, como con el método en chip de Morgan et al.7, y luego enrollando las películas en las superficies curvas de las plantas utilizando un pequeño aplicador de maquillaje16,17. La Figura 1 muestra varios enfoques para aplicar fibras en sustratos rígidos y flexibles a las plantas.
Protocolo
1. Producción de VACNFs (Figura 2 y Figura 3)
- Centrifugar una oblea de silicio con polimetacrilato de metilo (PMMA) 495 A4 resistir a 4000 rpm y hornear a 180 °C durante 5 min.
NOTA: Deje que la oblea se enfríe durante 10 s antes de continuar con el siguiente paso. - Centrifugar una segunda capa de resina (PMMA 950 A2) y hornear a 180 °C durante 5 min.
- Utilice la litografía por haz de electrones para definir los puntos del catalizador con diámetros de 300 nm a un espaciado lateral especificado (paso: 10 μm o 35 μm) en matrices de 3 mm x 3 mm.
- Desarrollar la resistencia en 30-40 mL de metil-isobutilcetona 1:3: alcohol isopropílico (IPA) durante 1,5 min, seguido de enjuagarlo con IPA y secarlo con N2.
NOTA: Compruebe la matriz de puntos con un microscopio de campo claro (objetivo de 20x). - Limpie la oblea de la resistencia residual con una exposición de 6 s en plasma de oxígeno (desecho) en un grabador de silicona.
- Utilice la evaporación por haz de electrones para depositar primero una capa adhesiva de metal (Ti o Cr, 10 nm) y luego depositar una segunda capa, que es el catalizador de Ni (130 nm o 150 nm). Durante la deposición de metales de Ti o Ni, mantenga la corriente por debajo de 0,2 A a 10 kV, la presión por debajo de 5 x 10-6 Torr y la tasa de deposición a ~ 1 A / s para la deposición con línea de visión.
- Utilice la sonicación en baño secuencial para eliminar el metal (Ni) depositado en la capa de resistencia subyacente, dejando el Ni depositado directamente sobre la oblea de silicio. Este proceso se denomina despegue.
- Para ello, prepara 3 recipientes con acetona y baña la oblea en acetona durante 1 min; repetir 3 veces a temperatura ambiente (RT, 20 °C) a una frecuencia de 35 kHz. Enjuague con IPA y seque con N2.
NOTA: Nunca deje que la acetona se seque en la oblea. Después de la última sonicación con acetona, enjuague inmediatamente con IPA y luego seque con gas N2 . Si en algún momento la oblea se seca prematuramente (antes del enjuague con IPA) existe la posibilidad de que no se elimine todo el exceso de metal y resistencia y la acetona pueda dejar un residuo.
- Para ello, prepara 3 recipientes con acetona y baña la oblea en acetona durante 1 min; repetir 3 veces a temperatura ambiente (RT, 20 °C) a una frecuencia de 35 kHz. Enjuague con IPA y seque con N2.
- Compruebe la geometría de la forma del catalizador mediante microscopía electrónica de barrido (SEM). Para capturar imágenes SEM de los chips VACNF, incline la platina en un ángulo de 30° y utilice un voltaje de 1-3 kV, con una corriente de haz de ~100 pA y una distancia de trabajo de ~5 mm.
NOTA: El catalizador debe parecerse a un disco de hockey (un cilindro compacto) (Figura 4). La altura del cilindro compacto debe reflejar el espesor del Ni depositado en la oblea de silicio. Si el perfil del punto de Ni es alto y parece ser cóncavo en la parte superior, asemejándose a un volcán (Figura 4), entonces es más probable que el catalizador se deshumedezca en múltiples gotas de Ni, lo que resulta en la ramificación de las nanofibras de carbono9 (Figura 4 y Figura 5). Tales problemas pueden ser el resultado de la fusión por resistencia durante la evaporación del metal debido a largos tiempos de deposición o problemas con el procedimiento de despegue (Figura 4 y Figura 5). - Corta la oblea de silicio en cuartos y colócala en la cámara de deposición química de vapor mejorada con plasma de corriente continua (dc-PECVD) con la mezcla de acetileno y amoníaco. Optimizar los parámetros de crecimiento para controlar la longitud y la conicidad de las nanofibras (puntas <200 nm).
- Utilice una corriente de 1-1,5 A y un rango de tensión de 440-560 V. Al cultivar las fibras, utilice una fase de pretratamiento con flujo de amoníaco mientras la máquina y el sustrato se calientan hasta 620 °C. Asegúrese de encender la fuente de carbono (acetileno) 10 s antes de poner en marcha el plasma.
NOTA: Las obleas de un cuarto se utilizan en caso de que sea necesario optimizar los parámetros de funcionamiento de la máquina PECVD. Para producir fibras con longitudes superiores a 40 μm y puntas de menos de 200 nm de diámetro, se sugieren los siguientes parámetros: con un espesor de catalizador de Ni de 130 nm, utilizar una corriente de 1,75 A, un tiempo de crecimiento de 70 min y una relación acetileno: amoníaco de 45 centímetros cúbicos estándar por minuto (sccm): 100 sccm. Con un espesor de Ni de 150 nm, utilice una corriente de 1,5 A, un tiempo de crecimiento de 80 min y una relación acetileno: amoníaco de 48 sccm : 100 sccm. Utilice los siguientes parámetros para cultivar VACNF independientemente del espesor del catalizador: temperatura de crecimiento de 620 °C, presión de 10 torr durante el plasma y una altura del cabezal de ducha de 20 mm (Figura 6).
- Utilice una corriente de 1-1,5 A y un rango de tensión de 440-560 V. Al cultivar las fibras, utilice una fase de pretratamiento con flujo de amoníaco mientras la máquina y el sustrato se calientan hasta 620 °C. Asegúrese de encender la fuente de carbono (acetileno) 10 s antes de poner en marcha el plasma.
- Evaluar la geometría de las fibras resultantes mediante SEM con una inclinación de 30° y un potencial de aceleración de 1 kV.
NOTA: Las fibras óptimas serán rectas y no ramificadas. Es imposible controlar la orientación del cristal del catalizador de Ni con el evaporador de haz de electrones. Como resultado, habrá algunas fibras que se ramificarán debido a la deshumectación del catalizador9. Además, la orientación de los cristales hace que los VACF crezcan a diferentes alturas, por lo que es difícil lograr alturas uniformes en todos los VACNF. - Aplicar una capa de fotorresistencia (SPR955) sobre las fibras a 1000 rpm durante 45 s. A continuación, corta la oblea de 1/4 en matrices de 3 mm x 3 mm con una sierra para cortar en cubitos. Guarde las fibras en este punto para su uso posterior.
NOTA: No realice el paso 1.11 si planea transferir fibras a un sustrato flexible.
2. Transferenciade VACNF a un sustrato flexible (Figura 7 y Figura 8)
- Después de sintetizar las fibras, la capa de centrifugado SU-8 2015 fotorresiste sobre las obleas o cuartos de obleas a 4000 rpm durante 45 s.
- Hornee suavemente la oblea durante 3 minutos a 95 °C.
- Con un alineador de contacto, exponga la oblea con una máscara con patrón de matriz de 3 mm y 3 mm que se alinee con el patrón definido de la litografía por haz de electrones a 95 mJ/cm2.
NOTA: Utilice un modo de contacto de proximidad con un espacio de exposición que sea 20 μm mayor que la fibra más alta. Existe la posibilidad de que las fibras se caigan durante este paso del proceso. - Realice un horneado posterior a la exposición durante 6 minutos a 95 °C.
- Desarrollar la oblea en revelador SU-8 durante 15 s, enjuagarla con IPA y secar la oblea con N2, moviéndose de arriba hacia abajo.
NOTA: Al revelar la oblea, asegúrese de que esté completamente sumergida. - Obleas con patrón de spincoat con una capa protectora de fotorresistencia fina (SPR 955 CM 0,7) a 3000 rpm durante 45 s y softbaking durante 30 s a 90 °C.
- Depositar una fina capa de óxido de silicio en la oblea (2-3 nm) colocándola en una capa atómica de deposición durante 22 ciclos a 100 °C.
- Use una sierra para cortar la oblea en cuadrados de 3 mm x 3 mm. Alinee la sierra para cortar en cubitos con el patrón preexistente en la oblea.
- Evaluar la geometría de las fibras resultantes mediante SEM con una inclinación de 30° y un potencial de aceleración de 3 kV.
- Deténgase aquí si almacena chips para uso a largo plazo (>1 semana). Guarde las papas fritas en la oscuridad.
- Para separar los sustratos flexibles de los rígidos, coloque las virutas individuales en acetona durante 30 minutos o hasta que el SU-8 comience a curvarse.
- Lave las películas SU-8 (adheridas o separadas de sustratos rígidos) con alcohol isopropílico durante 5 minutos y luego con agua durante 5 minutos. Coloque las fichas en una caja comercial con una almohadilla adhesiva cuando las transporte.
- OPCIONAL: Coloque el lado sin fibra de la película SU-8 sobre cinta soluble en agua o encima de una goma de silicona delgada con un respaldo delgado de tereftalato de polietileno (PET) (12,5 μm de grosor).
- Utilice un par de pinzas para transferir la película SU-8. Presione los bordes del cuadrado SU-8 para ayudar a que se adhiera a la cinta/caucho de silicona-PET; Esto es para evitar que se rompan las fibras. En este punto, las películas VACNF están listas para su uso inmediato.
- Para preparar un soporte de caucho de silicona/PET, haga lo siguiente: con un kit de 2 partes para caucho de silicona, mezcle las dos partes (el elastómero y el reticulante). A continuación, recorta un cuadrado de PET y pégalo con cinta adhesiva en un plato de plástico transparente. Vierta una capa muy fina de caucho de silicona sobre el PET y cúrelo a 80 °C durante 1-2 h.
3. Método en planta (en el que se coloca una gota de solución para administrar en la superficie de la planta) utilizando fibras en un sustrato rígido (Figura 1A)
- Retire la fotorresistencia con lavados incrementales de acetona (100%, 5 min), IPA (100%, 5 min) y ddH2O (5 min) antes de usar.
- Coloque el tejido vegetal que se va a empalar sobre una superficie dura como soporte.
- Coloque una gota de 1 μL de colorante o ADN (200 ng) sobre la superficie del tejido vegetal.
- Coloque un chip VACNF con un sustrato rígido en la parte superior de la gota, con las fibras orientadas de tal manera que entren en contacto con la gota.
NOTA: La orientación de las virutas se puede determinar por el "brillo" de la oblea. El lado brillante del chip tiene fibras y el lado opaco no. - Con el lado plano de un par de pinzas, golpea el chip. Marque el área de la planta con la que entró en contacto el chip con un marcador de punta blanda. Retire los chips VACNF después de la entrega.
NOTA: La cantidad de fuerza aplicada al golpear variará según el tipo de tejido vegetal utilizado. Se recomienda practicar el golpeteo de virutas antes de realizar el empalamiento de las fibras. Evite dañar los tejidos vegetales. El daño es evidente cuando se puede ver el contorno del chip VACNF en el tejido vegetal. - Repita los pasos 3.1-3.5 para los controles (+Colorante/ADN, -Fibras; -Colorante/ADN, +Fibras; y -Colorante/ADN, -Fibras). -Las fibras son el lado sin fibras de un chip.
- Almacene las plantas intactas o los órganos de plantas extirpados en cámaras húmedas en condiciones de día largo (16 h de luz, 8 h de oscuridad) si es necesario. Para los órganos extirpados, use una placa de Petri de plástico con toallas de papel húmedas.
4. Método en chip (en el que se coloca una gota de solución para administrar en un chip VACNF), sustrato rígido (Figura 1B)
- Retire la fotorresistencia con lavados incrementales de acetona (100%, 5 min), IPA (100%, 5 min) y ddH2O (5 min) antes de usar.
- Coloque una gota de 1 μL de colorante o ADN plasmídico (200 ng) en el lado de la fibra del chip VACNF con sustrato rígido. Asegúrese de colocar la gota en el centro del chip y cubrir varias fibras. Deja que la gota se seque durante 15 min.
NOTA: La orientación de las virutas se puede determinar por el "brillo" de la oblea. El lado brillante del chip tiene fibras y el lado opaco no. - Cuando trabaje con hojas u otros órganos extirpados, colóquelos encima de una superficie dura. Cuando trabaje con plantas intactas, coloque una superficie dura debajo del órgano al que se aplican las VACNF.
- Después del paso de secado de 15 minutos, coloque el chip VACNF de manera que el lado de la fibra entre en contacto con el tejido vegetal. Golpea el chip con la parte posterior de un par de pinzas.
NOTA: La cantidad de fuerza aplicada al golpear variará según el tipo de tejido vegetal utilizado. Se recomienda practicar el golpeteo de chips. - Repita los pasos 3.6-3.7 del método en planta.
5. Aplicación de VACNF en películas de SU-8 al tejido vegetal mediante el método en chip (Figura 1C)
- Coloque 1 μL de gota de tinte o ADN (200 ng) en el lado de la fibra de la película SU-8 y déjela secar durante 10 minutos. Asegúrese de colocar la gota en el centro del chip.
NOTA: Hay diferentes tiempos de secado dependiendo del sustrato utilizado. - Con un par de pinzas afiladas, coloque la película VACNF sobre la superficie de la planta.
NOTA: Cuanto más tiempo se dejan las películas del SU-8 en el aire, más frágiles se vuelven las películas. Para limitar el riesgo de perder las películas SU-8, asegúrese de tener todas las plantas/muestras y equipos cerca de las películas SU-8. - Pase suavemente un pequeño aplicador de maquillaje sobre la película VACNF. Marque las áreas donde se colocan los sustratos flexibles con un marcador de punta suave. Retire los sustratos flexibles de la superficie de la planta con cinta adhesiva.
NOTA: La cantidad de fuerza aplicada al enrollar el aplicador de maquillaje variará entre los tejidos vegetales utilizados. Practique la aplicación de las películas VACNF antes de realizar la administración de biomoléculas o colorantes. El daño visible a los tejidos vegetales es evidente cuando se pueden ver los contornos de la película VACNF en el tejido vegetal. - Repita los pasos 5.1 a 5.3 para los controles y almacene las plantas, como se menciona en el paso 3.7 del método en planta.
6. Microscopía y análisis de imágenes para todos los métodos de administración
- Obtener imágenes de las muestras utilizando un microscopio confocal utilizando longitudes de onda de emisión y excitación adecuadas para la sonda/reportero fluorescente suministrado.
NOTA: El tiempo requerido para la transformación transitoria varía según la especie de planta y el marcador entregado. Por ejemplo, la expresión de marcadores fluorescentes se detectó después de 48 h en Arabidopsis frente a 96 h en hojas de lechuga7. - Al tomar imágenes, trate de enfocarse en una región con fibras desprendidas. Las fibras tendrán diferentes orientaciones. El éxito de la entrega no depende de la aparición de fibras rotas.
NOTA: Las fibras serán fluorescentes con los ajustes de excitación/emisión más comunes debido a la formación de una capa de nitruro de silicio resultante de la formación de fibras en PECVD18. - Capture al menos 5 imágenes para cada muestra. La señal resultante variará.
- Mida los valores de fluorescencia como fluorescencia total (densidad integrada) en áreas de imagen confocal de 20 μm x 20 μm7 utilizando ImageJ19.
Resultados
La ventaja distintiva de los chips VACNF en sustratos rígidos o flexibles es la capacidad de administrar biomoléculas o colorantes a lugares específicos de una planta (Figura 1). En este caso, utilizamos lecturas de fluorescencia para evaluar la administración. Utilizando diferentes plantas, sustratos y métodos de administración (en el chip o en la planta), puede haber diferencias en el momento de la aparición de la fluoresceína del colorante. Para determinar si los chips/películas VACNF funcionan para la administración, un enfoque rápido es usar fibras para la administración de colorantes (Figura 9). Las imágenes etiquetadas con diferentes tiempos en la Figura 9 son campos de visión diferentes de las mismas muestras. Cuando se utiliza el método en planta, el colorante de fluoresceína se puede observar inmediatamente después de la entrega mediante microscopía de fluorescencia. Además, si se obtiene una imagen del mismo campo de visión a lo largo del tiempo después de administrar el colorante de fluoresceína a una planta, la intensidad de la señal se vuelve menos brillante con el tiempo (Figura 10). El colorante de fluoresceína podría potencialmente estar moviéndose desde el campo de visión a otras áreas de la hoja a través de los plasmodesmos20,21. En comparación con el método en planta, en el método en chip con fibras en el sustrato rígido, el tinte se mueve más lentamente a través del área empalada (Figura 9). Esto podría ser el resultado de que el tinte se desprende de las fibras/se rehidrata en las células y, por lo tanto, tarda más tiempo en moverse.
Las fibras en el sustrato flexible fueron adecuadas para la entrega de tinte a superficies curvas como fresas y manzanas (Figura 11 y Figura 12). Usando un sustrato flexible con fresas, se observó una fuerte señal de fluoresceína de inmediato (Figura 11), mientras que se tardó 2 h en ver una fuerte señal de fluoresceína en manzanas (Figura 12B, D). La administración exitosa de plásmidos que codifican marcadores fluorescentes se puede determinar utilizando microscopía de fluorescencia para encontrar la señal resultante (Figura 12F, Figura 13 y Figura 14). Los controles son necesarios para determinar si la planta elegida no tiene autofluorescencia similar al marcador fluorescente que queremos entregar por fibras. El uso de fibras solas es útil para determinar si la fuerza de impacto aplicada con pinzas provoca daños en el tejido vegetal o si la fluorescencia observada dentro de la muestra se debe a los VACNF, que son inherentemente fluorescentes debido a su capa18 de nitruro de silicio (Figura 13C-D). Las fibras empaladas en el tejido vegetal no inducen la respuesta de la herida según lo evaluado por la producción de H2 O26. Por último, utilizando el control de +ADN, -Fibras es necesario para confirmar que el ADN no está entrando en la planta solo a través de la extracción y confirma que las fibras son necesarias para la entrega a las células vegetales (Figura 13E-F). No debería haber una diferencia clara cuando se utilizan los métodos de administración en planta o en chip utilizando los VACNF en un sustrato rígido, como lo indica la falta de diferencias significativas en los valores de fluorescencia (Figura 13I). El uso de las películas flexibles de VACNF con entrega de ADN en chip dio como resultado una transformación transitoria exitosa de las células epidérmicas en manzanas y cebollas compradas en la tienda (Figura 12F y Figura 14).
Los experimentos fallidos pueden tener fibras rotas en diferentes campos de visión, pero no habrá ninguna señal de fluorescencia resultante del intento de entregar ADN plasmídico o colorante. Si se aplica demasiada presión a la planta, habrá un daño tisular aparente (Figura 15). Este daño mecánico puede verse como pequeños agujeros o áreas transparentes en la planta, como si se hubiera eliminado una capa de células al mirar la planta bajo un microscopio. A veces, las huellas del chip serán visibles. Un experimento en el que no se detecta la expresión de proteínas fluorescentes después de la entrega de ADN también puede deberse al uso de ADN de baja calidad, por lo que puede ser útil preparar ADN fresco.
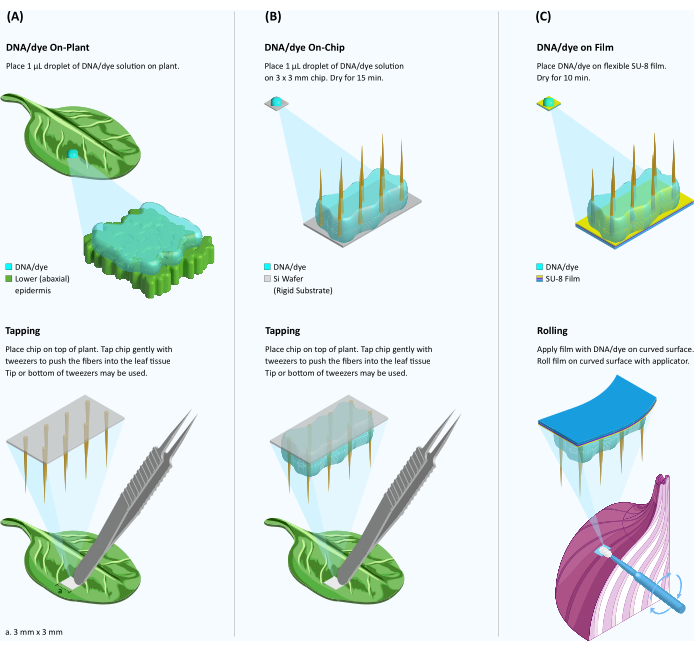
Figura 1: Esquema de la entrega de colorante/ADN al tejido vegetal utilizando fibras sobre sustratos rígidos y flexibles. (A) Entrega de colorante/ADN mediada por fibra en la planta. Se coloca una gota de 1 μL de solución de colorante/ADN en la superficie de una hoja y el chip VACNF se coloca encima de la gota. Con un par de pinzas, el chip se golpea suavemente en el tejido. El sustrato rígido se retira dejando nanofibras dentro del tejido. (B) Entrega de ADN mediada por fibra en chip. Se lanza una gota de 1 μL de colorante o solución de ADN en el chip VACNF y se seca durante 15 minutos. El chip con ADN semiseco se coloca en la parte superior de la superficie de la hoja y se golpea en el tejido como en el panel A. (C) Entrega de ADN de película SU-8 en chip. Las fibras se transfieren del sustrato rígido de silicio al soporte flexible SU-8. Se vierte una gota de 1 μL de solución de colorante/ADN sobre la película VACNF y se seca durante 10 minutos. A continuación, la película VACNF con el colorante/ADN semiseco se enrolla sobre una superficie vegetal curva con un aplicador de maquillaje. Haga clic aquí para ver una versión más grande de esta figura.
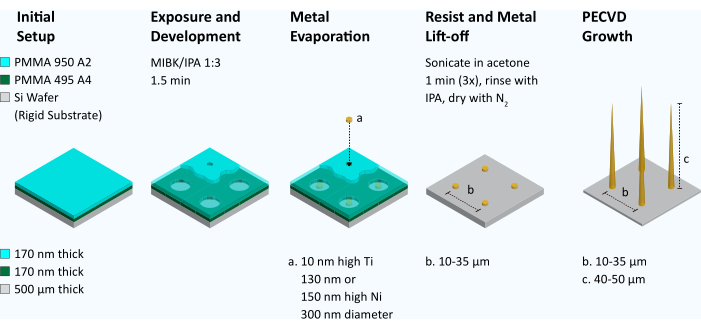
Figura 2: Flujo de trabajo para hacer matrices de nanofibras de carbono alineadas verticalmente. Para producir VACNF, se recubre una doble capa de polimetacrilato de metilo (PMMA 495 A4 seguido de PMMA 950 A2) sobre una oblea de silicio. La litografía por haz de electrones se utiliza para definir una matriz de puntos de 300 nm de diámetro. A continuación, la resistencia se desarrolla en metil isobutil cetona/isopropanol (MIBK/IPA), 1:3 durante 1,5 min. Usando un evaporador de metal, se aplica una capa adhesiva de Ti (10 nm) a la oblea, seguida de una capa de Ni (130 nm o 150 nm). A continuación, la resistencia restante se elimina mediante el despegue (sonicación en baño de acetona). La geometría de los puntos del catalizador se inspecciona mediante SEM. Si los catalizadores se asemejan a discos de hockey y son planos, se colocan en la máquina de deposición química de vapor mejorada por plasma (PECVD) y se cultivan fibras. A continuación, las fibras se inspeccionaron mediante SEM. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Imágenes SEM de nanofibras de carbono alineadas verticalmente ideales . (A) Micrografía electrónica de VACNFs con un paso de ~35 μm y una altura de 10-15 μm, fotografiada en un ángulo de 30°. Esta imagen está duplicada en la Figura 7C. (B) Micrografía electrónica de VANCFs con paso de ~20 μm y altura de 20-30 μm, y fotografiados en un ángulo de 30°. (C) Micrografía electrónica de VANCF con paso de ~35 μm, altura de 50-60 μm y obtención de imágenes en un ángulo de 30°. (D) Micrografía electrónica de punta VACNF con un diámetro <200 nm. Hay variación en los diámetros de las puntas de las fibras (150-300 nm). Debido a que las fibras se fotografiaron en un ángulo de 30°, las alturas parecen ser más pequeñas que la altura real por un factor de seno (30 °) = 1/2. Los paneles A y B han sido reimpresos con permiso de Morgan et al.7. Haga clic aquí para ver una versión más grande de esta figura.
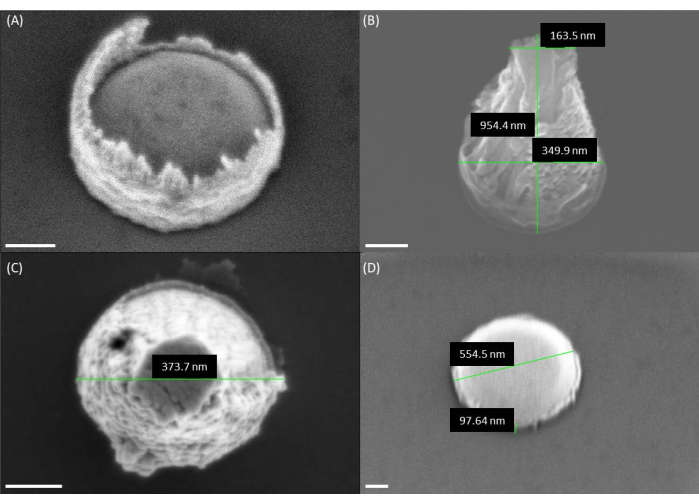
Figura 4: Imágenes SEM de la geometría del catalizador antes del crecimiento de los VACNF. (A) Imagen SEM del catalizador después del despegue. Tenga en cuenta que la fotorresistencia está presente alrededor del borde del catalizador, lo que da como resultado una forma de volcán. (B,C) Las imágenes SEM muestran las formas volcánicas del catalizador después de usar una resistencia de PMMA de una sola capa. (D) Forma deseada de catalizador de disco de hockey hecha de capas dobles de PMMA. Debido a que las fibras se obtuvieron en un ángulo de 30° en los paneles A, B y D, las alturas parecen ser más pequeñas que la altura real por un factor de sin(30°) = 1/2. Las barras de escala representan 100 nm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Efecto del tamaño del punto del catalizador en el crecimiento de la fibra: Para establecer el diámetro óptimo del material del catalizador, las fibras se cultivaron a partir de tamaños de punto que oscilaban entre 200 y 600 nm. Los tamaños de punto que oscilan entre 400 y 600 nm provocaron la deshumectación del catalizador y el crecimiento de múltiples fibras. La mejor geometría de fibra se produjo con un diámetro de 300 nm. Los puntos más pequeños condujeron a una altura de fibra insuficiente. Debido al hecho de que las fibras fueron fotografiadas en un ángulo de 30°, las alturas parecen ser más pequeñas que la altura real por un factor de sin(30°) = 1/2. Las imágenes se tomaron con micrografía electrónica de barrido. Haga clic aquí para ver una versión más grande de esta figura.
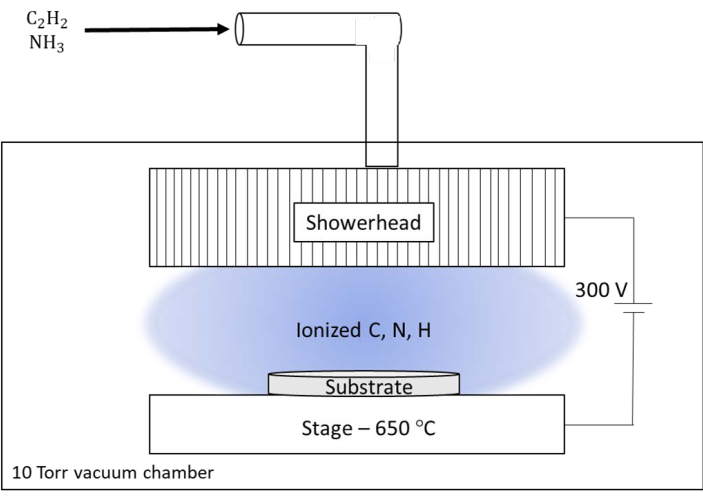
Figura 6: Ilustración esquemática del sistema de deposición química de vapor mejorado por plasma (dc-PECVD) de corriente continua utilizado en el Laboratorio Nacional de Oak Ridge (ORNL). El sistema personalizado en ORNL tiene un cabezal de ducha grande que sirve como reactor para los gases de alimentación y salida para el plasma. El cabezal de ducha se mantuvo a un potencial de CC de 300 V en relación con la etapa calentada para el sustrato. Haga clic aquí para ver una versión más grande de esta figura.
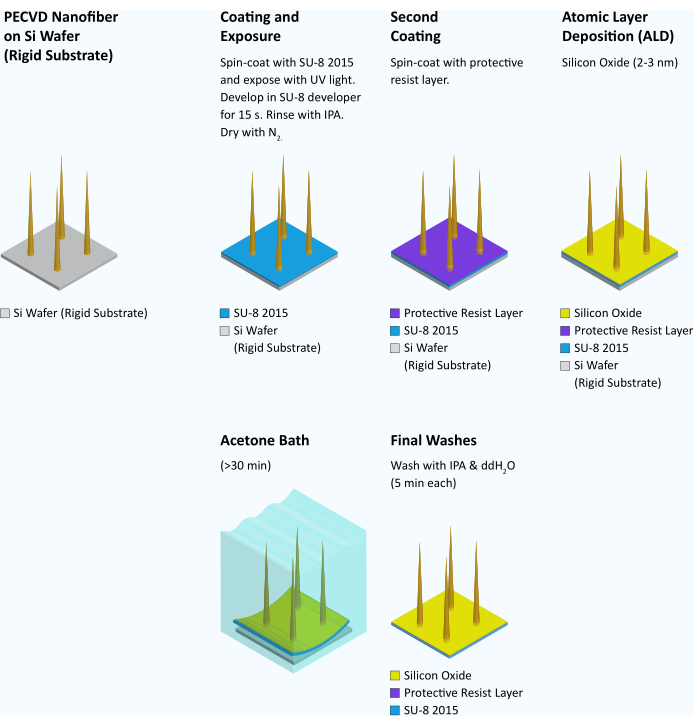
Figura 7: Flujo de trabajo para transferir fibras de un sustrato rígido a un sustrato flexible. Después de la síntesis e inspección de nanofibras, cada oblea se recubre con SU-8 2015 a 4000 rpm durante 45 s. A continuación, la oblea se hornea suavemente durante 3 minutos a 95 °C. A continuación, la oblea se expone a la luz ultravioleta y se modela en un alineador de máscara a 95 mJ/cm2. Después de posthornear durante 6 min a 95 °C, la oblea se desarrolla en el revelador SU-8 durante 15 s, se enjuaga con IPA y se seca con gas N2 . Una capa protectora de resistencia de SPR 955 CM 0,7 se recubre con centrifugación en la oblea a 3000 rpm y se hornea suavemente a 90 °C durante 30 s. A continuación, se añade una capa de óxido de silicio (2-3 nm) a la oblea mediante deposición de capa atómica (ALD) (22 ciclos a 100 °C) para hacer que el sustrato flexible sea hidrófilo15. A continuación, la oblea se corta en cubitos en cuadrados de 3 mm x 3 mm con una sierra para cortar en cubitos. En el momento de su uso, las virutas individuales se colocan en acetona hasta que SU-8 comienza a curvarse y se vuelve cóncavo (>30 min). En este momento, la capa SU-8 de la mayoría de los chips se puede agarrar por el borde con pinzas afiladas y despegar del sustrato de silicio subyacente como una película cuadrada intacta de 3 mm. A continuación, la película se lava sucesivamente en alcohol isopropílico y agua durante 5 minutos cada una y se utiliza inmediatamente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Imágenes SEM de la transferencia de fibra de un sustrato rígido a un sustrato flexible. Las imágenes mostradas son representativas pero provienen de diferentes muestras. (A) Fibras largas después del crecimiento de PECVD (misma imagen que en la Figura 2C). (B,C) Fibras después de la aplicación de SU-8. El epoxi brota alrededor de la base de las fibras. La longitud de la fibra expuesta osciló entre 5 μm y 30 μm. (D) Las fibras incrustadas en Su-8 después del despegue conservaron su geometría. Debido al hecho de que las fibras se obtuvieron en un ángulo de 30 °, las alturas parecen ser más pequeñas que la altura real por un factor de sen (30 °) = 1/2. El Panel A ha sido reimpreso con permiso de Morgan et al.7. Haga clic aquí para ver una versión más grande de esta figura.
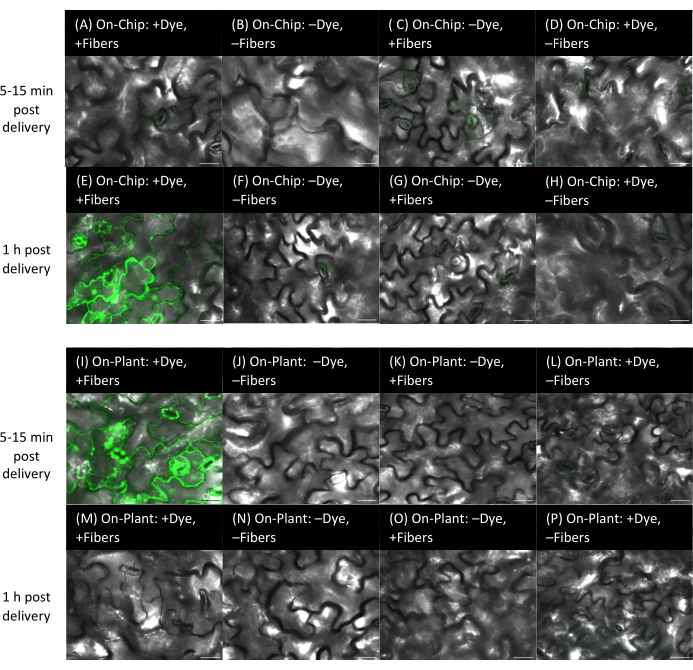
Figura 9: Entrega de colorante a las hojas de Arabidopsis utilizando métodos en chip y en planta con fibras sobre sustratos rígidos. (A-P) Las imágenes se adquirieron mediante microscopía confocal. Método en chip (A-H): 1 μL de colorante fluoresceína de 10 μM se secó durante 15 min en chips VACNF, y luego los chips se golpearon en el lado abaxial de las hojas de Arabidopsis con pinzas. (A-D) Deja imágenes dentro de los 5-15 minutos posteriores al parto. (E-H) Deja la imagen 1 h después del parto. (A,E) +Tinte, +Fibras. Controles: (B,F) -Tinte, -Fibras; (C,G) -Tinte, +Fibras; (D,H) +Tinte, -Fibras. (I-P) Método en planta: se colocó 1 μL de colorante fluoresceína de 10 μM en la superficie de la planta, las virutas se colocaron de manera que entraran en contacto con la gota y se utilizaron pinzas para golpear la viruta en el lado abaxial de las hojas de Arabidopsis. Imágenes de (I-L) dentro de los 5-15 minutos posteriores al parto y (M-P) imágenes 1 h después del parto. (I,M) +Tinte, +Fibras. Controles: (J,N) -Colorante, -Fibras; (K,O) -Tinte, +Fibras; (L,P) +colorante, -fibras. Los paneles A-P son imágenes planas individuales de pilas z. Las barras de escala son de 20 μm. Las fibras tienen un paso de 35 μm. Haga clic aquí para ver una versión más grande de esta figura.
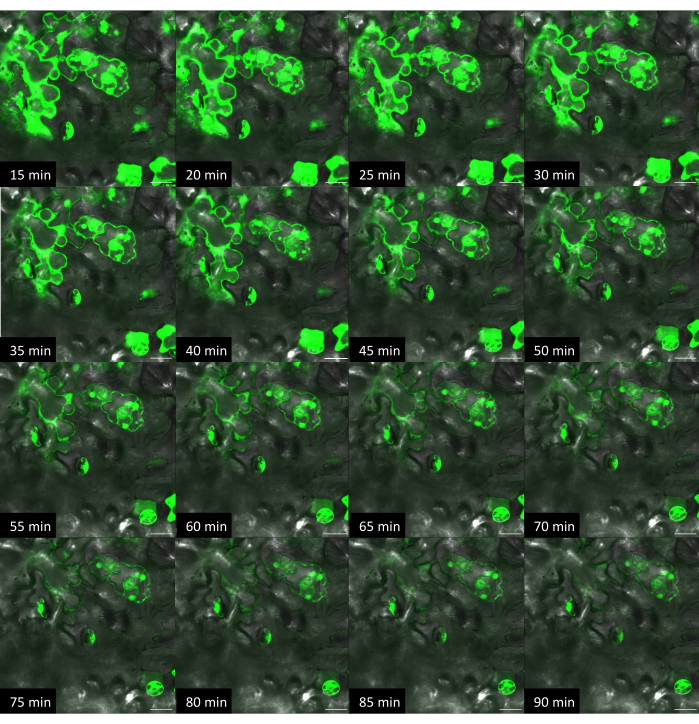
Figura 10: Curso temporal de la administración del colorante en Arabidopsis mediante el método en planta con sustrato rígido. Las imágenes se adquirieron mediante microscopía confocal. Utilizando el método en planta, se colocó 1 μL de gota de solución de colorante fluoresceína (10 μM) en la superficie de una hoja y el chip VACNF se colocó encima de la gota. Con un par de pinzas, el chip se golpeó suavemente en el tejido. +Tinte, +Fibras se adquirieron imágenes de la misma área cada 5 min. Las barras de escala son de 20 μm. Las fibras tienen un paso de 35 μm. Los paneles son imágenes planas individuales de pilas z. Haga clic aquí para ver una versión más grande de esta figura.
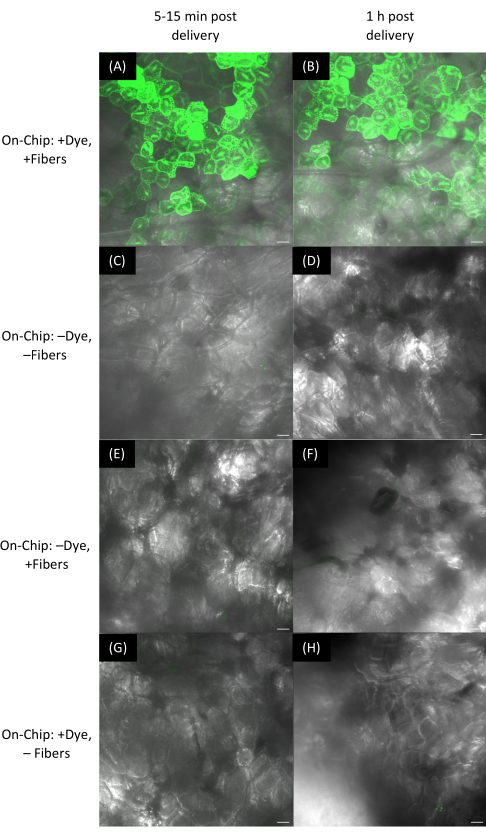
Figura 11: Entrega de colorante a la fruta de fresa usando películas VACNF. (A-H) Las imágenes se adquirieron mediante microscopía confocal. Utilizando el método en chip, las gotas de tinte se secaron en películas VACNF, que luego se enrollaron sobre superficies de frutas con un aplicador de maquillaje. Se administró colorante de fluoresceína (10 μM) a células de fresa y se obtuvieron imágenes después de (A) 10 min y (B) 1 h. (C,D) Sin controles de tratamiento (-colorante, -fibras). (E,F) -Controles de tinte, +fibras después de 10 min y 1 h, respectivamente. (G,H) +Tinte, -Controles de fibras después de 10 min y 1 h, respectivamente. Las barras de escala son de 40 μm. Los paneles A-H son proyecciones máximas de pilas z de 188 μm. Las fibras tienen un paso de 35 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 12: Entrega de colorante y transformación transitoria de manzanas a través de películas VACNF. (A-F) Las imágenes se generaron mediante microscopía confocal. Utilizando el método en chip, se secaron 1 μL de gotas de colorante fluoresceína (10 μM, B y D) o 1 μL de plásmido que codifica pUBQ10:YFP (ADN-YFP) (200 ng) en películas VACNF, que luego se enrollaron sobre superficies de frutas con un aplicador de maquillaje. Se administró colorante de fluoresceína en la epidermis de la manzana y se obtuvieron imágenes después de (B) 10 min y (D) 2 h. (D) El colorante tardó algún tiempo en difundirse en las células después de la administración. Entrega y expresión de ADN-YFP a través de películas VACNF después de (F) 48 h. (A,C,E) sin controles de tratamiento (-Colorante/ADN-YFP, -Fibras). Las barras de escala son de 40 μm. Los paneles A-D son imágenes planas individuales de pilas z. Los paneles E y F son la proyección máxima de pilas z de 53 μm. El paso de la fibra es de 35 μm. Las flechas denotan señales de fluoresceína o YFP. * indica fibras. Haga clic aquí para ver una versión más grande de esta figura.
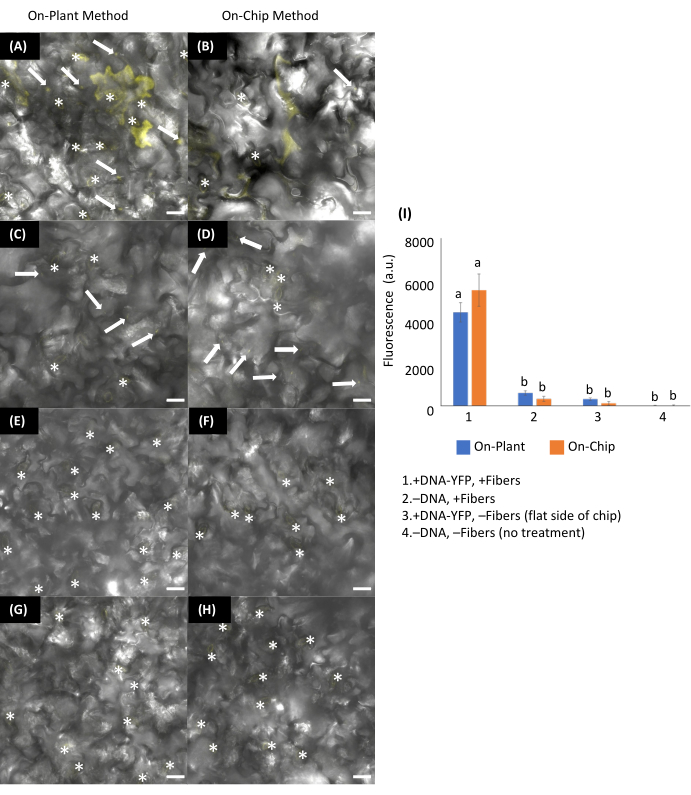
Figura 13: Transformación transitoria de hojas de Arabidopsis utilizando métodos VACNFs en planta o en chip. (Un-H) Las imágenes se adquirieron mediante microscopía confocal 48 h después de la entrega del ADN. (A, C, E, G) Método en planta: se colocó 1 μL de plásmido que codifica pUBQ10:YFP (ADN-YFP) (200 ng) en el lado abaxial de las hojas de Arabidopsis. Los chips se colocaron de tal manera que entraran en contacto con la gota, y se utilizaron pinzas para golpear el chip en el tejido de la hoja. (B, D, F, H) Método en chip: 1 μL de ADN-YFP (200 ng) se secó durante 15 min en chips VACNF y luego los chips se golpearon en el lado abaxial de las hojas de Arabidopsis con pinzas. +ADN-YFP, +Fibras para (A) en planta y (B) en chip. Controles: (C,D) -ADN-YFP, + Fibras; (E,F) +ADN-YFP, -Fibras; y (G,H) -ADN, -Fibras. (I) Gráfico de la intensidad media relativa de la señal de fluorescencia de 25, 20 × 20 μm a partir de imágenes de 5 réplicas biológicas combinadas de 2-3 experimentos utilizando fluorescencia del canal YFP. Se excluyeron las regiones que contenían estomas (*) debido a la autofluorescencia. De cada promedio se restó la intensidad de fluorescencia promedio de la condición -ADN-YFP, -Fibras. Se utilizó ANOVA de 2 vías (y prueba de Tukey) para la prueba de significación, y las barras de error representan el error estándar de la media. Diferentes letras muestran diferencias significativas entre tratamientos (P < 0,0001). Todas las imágenes mostradas son proyecciones máximas de 40 μm z-stacks. Las barras de escala son de 20 μm. Las flechas blancas indican fibras en las imágenes. El paso de la fibra es de 35 μm. Esta figura ha sido reimpresa con permiso de Morgan et al.7. Haga clic aquí para ver una versión más grande de esta figura.

Figura 14: Transformación transitoria de cebollas utilizando películas VACNF. Las imágenes se adquirieron mediante microscopía confocal 48 h después de la entrega del ADN. Utilizando el método en chip, se secaron gotas de 1 μL de ADN plásmido que codifica pUBQ 10:YFP (ADN-YFP) (200 ng) en películas de VACNF durante10 minutos, que luego se enrollaron sobre las superficies de los órganos de las plantas. (A) Se entregó ADN-YFP y se expresó en la epidermis de la cebolla. (B) Ausencia de control del tratamiento; (C) control (+ADN-YFP, -Fibras) y (D) control (-ADN-YFP, +Fibras). Las barras de escala son de 40 μm. Las fibras tienen un paso de 35 μm. Las imágenes son proyecciones máximas de pilas z de 115 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 15: Daño tisular en lechuga por la aplicación de película VACNF . (A-D) Las imágenes se generaron mediante microscopía confocal. (A) El método en chip se utilizó para entregar ADN a las hojas de lechuga a través de películas VACNF. pUBQ 10:Las gotas de ADN YFP (200 ng) se secaron durante10 min en películas VACNF, que luego se enrollaron sobre el lado abaxial de las hojas de lechuga desprendidas y se almacenaron en una cámara de humedad durante 4 días. (B) control (-ADN-YFP, +Fibras). (C) control (+ADN-YFP, -Fibras), y (D) ningún tratamiento (-ADN-YFP, -Fibras). Las barras de escala son de 40 μm. Los VACNF tienen un paso de 35 μm. Las flechas apuntan a daños en las plantas como resultado de rodar el sustrato flexible con demasiada fuerza. Obsérvese que la entrega exitosa de ADN mediada por VACNF en lechuga se logró en otros experimentos7. Haga clic aquí para ver una versión más grande de esta figura.
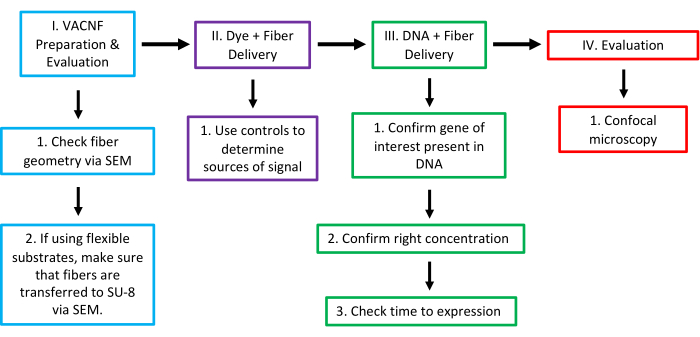
Figura 16: Flujo de trabajo de la entrega mediada por VACF en plantas. En la Etapa I, verifique la geometría de las fibras usando SEM. Para una entrega adecuada, las fibras necesitan una punta con un diámetro <200 nm. Si se utilizan fibras en sustrato flexible, el siguiente paso sería confirmar que las fibras se están transfiriendo a SU-8 y comprobar la altura de las fibras expuestas mediante SEM. En la Etapa II, probamos la utilidad de las fibras tratando de aplicar el tinte en la planta/órgano de elección utilizando un sustrato rígido o flexible. Utilice una gota de 1 μL, colocándola sobre la superficie de la planta o secándola brevemente sobre el chip/film. Con este paso y todos los demás pasos, es imperativo utilizar los controles adecuados (-Tinte,-Fibras; -Tinte, +Fibras; y +Tinte,-Fibras) para estar seguro de que la señal proviene de la entrega de tinte de buena fe . En la etapa III, confirme que el gen de interés está presente en el plásmido, determine la concentración de ADN que se administrará y pruebe la cantidad óptima de tiempo después de la entrega para verificar la expresión. En el estadio IV, el resultado se evaluó mediante microscopía confocal para comprobar la expresión del marcador entregado. Esta figura ha sido modificada con permiso de Morgan et al.7. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este artículo, presentamos métodos para construir matrices de nanofibras de carbono alineadas verticalmente, transferir las fibras a un sustrato flexible y aplicar fibras en un sustrato rígido o flexible a las plantas para su uso en la entrega de biomoléculas o tintes a las plantas. Describimos dos enfoques generales, el método en chip y el método en planta, para la deposición de los materiales introducidos y mostramos resultados exitosos en fibras sobre un sustrato rígido, así como el método en chip utilizando películas VACNF. La aplicación de estas fibras es más sencilla en la práctica y en la teoría que los métodos tradicionales de transformación de plantas (bombardeo de partículas, transformación de protoplastos mediante PEG o electroporación) y puede utilizarse para plantas recalcitrantes a la transformación mediada por Agrobacterium. Sin embargo, solo unas pocas células se transforman.
Las nanofibras de carbono alineadas verticalmente se produjeron en el Centro de Ciencias de Materiales de Nanofase del Laboratorio Nacional de Oak Ridge a través de su programa de usuarios. Los usuarios pueden solicitar el uso de esta instalación para la producción de VACNF. Alternativamente, los chips VACNF se pueden producir en salas limpias con máquinas de deposición química de vapor mejoradas con plasma de corriente continua con una fuente de carbono22,23. Con los métodos descritos, hay algunos pasos que son críticos para la producción de las fibras, la transferencia de fibras y la aplicación de los chips/películas VACNF. Para que la aplicación de fibra funcione, las fibras deben ser rectas y tener un diámetro cónico de <200 nm en la punta para que la entrega en células vegetales sea exitosa 6,7 (Figura 3). Para crear nanofibras de carbono de tamaño y paso particulares, hay una variedad de parámetros que se pueden cambiar, incluido el tamaño del punto, el paso lateral y la cantidad de catalizador depositado. Para seleccionar el tamaño de punto óptimo que se utilizará para la producción de nanofibras de carbono, las fibras se cultivaron a partir de varios tamaños de punto (como se muestra en la Figura 5). Encontramos que los diámetros de 300 nm producían las mejores fibras, por lo que se seleccionó este tamaño de punto (Figura 5). Después de encontrar los parámetros correctos, buscamos usar chips que tengan >50% de fibras con la geometría ideal (recta y un diámetro de punta <200 nm). Para comprobar la geometría de las fibras, utilizamos microscopía electrónica de barrido para obtener imágenes de campos de visión aleatorios en una muestra de chips/películas VACNF.
Además, las fibras deben tener una cierta longitud mínima para lograr la entrega dentro de las células vegetales. La importancia de producir fibras de diferente longitud es que las fibras más largas podrían usarse para penetrar en las capas más profundas del tejido. Las fibras más largas (>40 μm de longitud) son esenciales para las películas flexibles, ya que la transferencia de fibras funciona rompiendo las fibras de su base y requiere la colocación de capas de SU-8 en la parte superior de las fibras. El espesor de trabajo de la capa SU-8 utilizada para este protocolo es de 20-35 μm. La altura mínima necesaria para lograr el parto dentro de la epidermis de varias plantas (curvas o planas) es de 10-15 μm 6,7. Como resultado, las fibras con longitudes >40 μm son necesarias para las películas VACNF. Hay varios parámetros diferentes a tener en cuenta al producir nanofibras de carbono: material del catalizador, geometría del catalizador, espesor del material del catalizador, así como condiciones dentro de la cámara PECVD (relación de gas, presión, temperatura, corriente, altura del cabezal de ducha y tiempo de crecimiento)8,9,24,25. Para producir nanofibras de carbono de más de 25 μm utilizadas por Morgan et al.7 y Davern et al.6, aumentamos la cantidad de catalizador de Ni, alteramos la relación acetileno:amoníaco y aumentamos la corriente y el tiempo de crecimiento. Además, prestamos más atención a la geometría del material catalizador. Para producir fibras altas y rectas, el catalizador depositado debía tener la forma de un disco de hockey en lugar de una forma que se asemejara a un volcán (Figura 4). Las estructuras volcánicas surgen de los restos de fotorresistencia después del despegue. Para evitar la formación de volcanes, se utilizó una doble capa de PMMA para crear un socavado durante la litografía por haz de electrones26. El socavón ayuda a levantar el catalizador metálico depositado (Figura 2). La capa gruesa del catalizador es importante para el crecimiento de VACNF altos. La morfología de los VACNFs ha sido examinada por Merkulova et al.24. La alineación vertical de los VACNF se debe tanto al crecimiento del tipo de punta del catalizador de Ni como a las alineaciones del potencial de CC perpendiculares al sustrato (Figura 6). El cabezal de ducha describe la geometría del reactor PECVD (Figura 6) y sirve como fuente del potencial para el campo eléctrico27.
Para definir la matriz de puntos catalizadores con litografía de haz de electrones, aplicamos una resistencia de haz de electrones (polimetacrilato de metilo), luego usamos el haz de electrones para hacer pequeños agujeros en la resistencia con una forma específica y en ubicaciones específicas de la oblea. Los orificios del diámetro deseado se colocaron en una cuadrícula regular con el espaciado definido (paso) y se cargó un archivo que especificaba el patrón deseado en la herramienta de litografía por haz de electrones antes de cargar el sustrato en la máquina. Además de la altura de la fibra, otro parámetro crítico para una transferencia exitosa de la fibra es la cantidad de tiempo que se pasa en el baño de acetona. Las películas de VACNF deben dejarse en el baño de acetona el tiempo suficiente para que sus bordes comiencen a curvarse; Si se dejan en el baño de acetona durante muy poco tiempo, es más difícil quitar las astillas y pueden romperse. Cuanto más viejas sean las virutas, más tiempo tendrán que permanecer en el baño de acetona. Después del baño de acetona, las películas/chips se colocaron en isopropanol y agua para eliminar la acetona de acceso, así como para eliminar la fotorresistencia protectora de las fibras.
Para realizar el recubrimiento por centrifugación, las obleas o las piezas de oblea se colocan en un mandril de vacío en el recubridor giratorio, y la posición central de la oblea se verifica mediante la función de prueba del recubridor giratorio. Se aplica un pequeño charco (~2,5 cm de diámetro) de resistencia al centro de la oblea y se hace girar (3000 rpm durante 45 s) En la Figura 8 se incluyen imágenes de las fibras antes y después del recubrimiento de centrifugado que muestran la preservación de la geometría de la fibra (altura, orientación y paso). La presencia de fibras hace que la resistencia se hinche en la base de las fibras y da como resultado capas más gruesas de lo esperado. El recubrimiento por rotación después del crecimiento de VACNF ha sido explorado por otros grupos11,18.
Otro paso dentro del proceso que es de vital importancia es asegurarse de que se aplique la cantidad correcta de fuerza a los chips/películas VACNF. El mecanismo de administración depende de que las fibras hagan pequeñas perforaciones en las paredes celulares a través de la fuerza de impulso de la pinza golpeando sustratos rígidos 6,7 o enrollando con el mini aplicador de maquillaje sobre sustratos flexibles. Las fibras pueden o no desprenderse y permanecer incrustadas en las células vegetales6,7 sin impacto en el resultado, pero es necesaria la práctica junto con el examen de la absorción del colorante y el daño tisular para obtener la presión correcta. Además, es importante elegir los puntos de tiempo de imagen apropiados después de la entrega de ADN con chips/películas VACNF, ya que el tiempo para la expresión detectable varía entre las especies de plantas y los tipos de vectores que se administran7 (Figura 16).
A pesar de que este método es ampliamente aplicable a las plantas, tiene algunas limitaciones. Por ejemplo, agregar una capa delgada de óxido de silicio a las películas VACNF no siempre da como resultado que las películas sean completamente hidrófilas debido a la capa protectora de fotorresistencia agregada en la parte superior del SU-8. Si este problema se materializa, se podrían aplicar capas más gruesas de óxido de silicio a los VACNF. Para probar si las películas son hidrófobas o hidrófilas, se pueden colocar en agua. Si las películas se hunden, son hidrófilas, y si flotan, son hidrofóbicas. Además, puede haber variaciones entre los lotes de fibras producidas. Hay varios parámetros que se pueden alterar al cultivar las fibras en la máquina dc -PECVD; lo que se describe en este protocolo es un conjunto de parámetros para dos cantidades diferentes de catalizador de Ni. Además, la orientación cristalina del catalizador de Ni no se puede controlar28 y algunas ramificaciones inevitablemente darán lugar a las fibras.
Si bien demostramos la administración de colorante fluoresceína y ADN a células vegetales utilizando sustratos rígidos y flexibles para este artículo, el método debería ser ampliamente aplicable para otras biomoléculas y enfoques de modificación genética, por ejemplo, el silenciamiento de ARNi para sistemas vegetales como manzanas u otras frutas donde se necesitarían años para producir líneas transgénicas estables. Además, estas fibras también podrían utilizarse para entregar materiales de edición genética o para transformaciones estables en plantas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Las matrices de nanofibras se fabricaron en el Centro de Ciencias de Materiales Nanofásicos, que es una instalación de usuario de la Oficina de Ciencia del Departamento de Energía (ID de propuesta: CNMS2019-103 y CNMS2022-A-1182). El apoyo de CNMS se otorga a través de un sistema de propuestas revisadas por pares y se proporciona sin costo alguno a los solicitantes seleccionados que tengan la intención de publicar sus resultados (http://www.cnms.ornl.gov/user/becoming_a_user.shtml). Agradecemos a Kevin Lester y CNMS por su ayuda en la producción de matrices de nanofibras. Agradecemos al Dr. John Caughmen, al Dr. Timothy McKnight, a la Dra. Amber Webb, a Daryl Briggs y a Travis Bee por sus discusiones críticas sobre el diseño experimental. Agradecemos al Dr. Adam Rondinone por el esquema de la máquina PECVD. Agradecemos a Leslie Carol por las ilustraciones científicas. Este trabajo fue financiado por el Programa de Ciencias de Bioimágenes, Departamento de Energía de EE. UU., Oficina de Ciencia, Investigación Biológica y Ambiental, DE-SC0019104 y Departamento de Agricultura de EE. UU., 2021-67013-34835. JMM contó con el apoyo del Departamento de Agricultura de los Estados Unidos: Instituto Nacional de Alimentos y Agricultura: Beca predoctoral de la Iniciativa de Investigación Agrícola y Alimentaria 2021-67034-35167.
Materiales
| Name | Company | Catalog Number | Comments |
| 13" x 13" White 1/4-fold heavy duty Brawny industrial shop towel 70Ct | Fastenal | 690535 | |
| 2-Propanol (IPA) | Fischer Scientific | A451-4 | |
| 4" Lid | Entegris | H22-401-0615 | Wafer Carriers |
| 4" tray | Entegris | H22-40-0615 | Wafer Carriers |
| Accretech SS10 dicing saw | Accreteck | SS10 | |
| Acetone | Fischer Scientific | A18-4 | |
| Acetone used in the cleanroom at ORNL | JT Baker | 9005-05 | |
| Apples | Grocery store | No product number | |
| Arabidopsis thaliana | Seeds of accession Columbia from the laboratory of Professor Jean Greenberg at the University of Chicago | No product number | |
| Carbon direct current plasma enhanced chemical vapor deposition machine | Oak Ridge National Laboratory | Custom-built | |
| Cobham Green lettuce | Seeds from the laboratory of Professor Richard Michelmore at the University of California, Davis | No product number | Butterhead lettuce |
| Fluorescein dye | Sigma Aldrich | F2456-2.5G | |
| Gel-box | Gel-Pak | AD-23C-00-X4 | |
| Heidelberg DWL 66 direct-write lithography tool | Heidelberg | DWL 66 | |
| ImageJ | National Institues of Health | No product number | |
| Isoproponal (IPA) used in the cleanroom at ORNL | Doe and Ingalls | CMOS Grade 9079-05 | |
| JEOL 9300FS 100kV electron beam lithography system | JEOL | 8100 | |
| Kimwipes | Kimtech | Kimberly-Clark Professional 34120 | |
| Kord-Valmark disposable polystyrene petri dish | VWR | 11019-554 | |
| Layout Editor | juspertor GmbH | No product number | |
| LSM 710 confocal microscope | Zeiss | No product number | |
| LSM 800 confocal microscope | Zeiss | No product number | |
| Make-up applicator | Amazon | G2PLUS | 500 PCS Disposable Micro Applicators Brush for Makeup and Personal Care (Head Diameter: 1.5 mm)- 5 x 100 PCS |
| Merlin field emission scanning electron microscope | Zeiss | Merlin | |
| MIBK/IPA (methyl isobutyl ketone/isopropanol) (1:3) | Microchem | M089025 | |
| Onions | Grocery store | No product number | |
| Oxford FlexAl atomic layer deposition | Oxford | FlexAl | |
| PMMA 495 A4 | Microchem | M130004 | |
| PMMA 950 A4 | Microchem | M230004 | Can dilute down to A2 |
| Polyethylene terephthalate (PET) | Amazon | KS-6304-21-11 | Type D Clear PET (Polyester) Sheet .0005" Thick x 27" Width x 10 Ft Length 1 pc |
| Precision tweezers | Aven Inc. | 18032TT | |
| pUBQ10:YFP-GW | Arabidopsis Biological Resource Center | CD3-1948 | |
| Silicon etcher (used for descum) | Oxford | Plasmalab | |
| Silicon rubber kit | Smooth-On Inc | Ecoflex 00-20 | |
| Silicon wafers | Pure Wafer | 4N0.001-.005SSP-INV | |
| Spin coater | Brewer Sciences | Model 100CB | |
| SPR 955cm 0.7 | Megaposit | 10018314 | |
| Strawberries | Grocery store | No product number | |
| SU-8 2015 | Microchem | SU-8 2000 Series | Toxic. Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| SU-8 developer | Microchem | SU-8 2000 Series | Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| Suss MicroTec contact aligner | Suss MicroTec | MA6/BA6 | |
| Table top microscope | Phenom XL | used for checking Ni catalysts after metal deposition | |
| Thermionics VE-240 e-beam evaporator | Thermionics | VE-240 |
Referencias
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Gou, Y. J., et al. Optimization of the protoplast transient expression system for gene functional studies in strawberry (Fragaria vesca). Plant Cell, Tissue, and Organ Culture. 141, 41-53 (2020).
- Baltes, N. J., Gil-Humanes, J., Voytas, D. F. Genome engineering and agriculture: Opportunities and challenges. Progress in Molecular Biology and Translational Science. 149, 1-26 (2017).
- Ren, R., et al. Highly efficient protoplast isolation and transient expression system for functional characterization of flowering related genes in Cymbidium orchids. International Journal of Molecular Sciences. 21 (7), 2264 (2020).
- Kumar, S., et al. Nanovehicles for plant modifications towards pest-and disease-resistance traits. Trends in Plant Science. 25 (2), 198-212 (2020).
- Davern, S. M., et al. Carbon nanofiber arrays: a novel tool for microdelivery of biomolecules to plants. PLoS One. 11 (4), e0153621 (2016).
- Morgan, J. M., et al. An efficient and broadly applicable method for transient transformation of plants using vertically aligned carbon nanofiber arrays. Frontiers in Plant Science. 13, 1051340 (2022).
- Melechko, A. V., et al. Vertically aligned carbon nanofibers and related structures: Controlled synthesis and directed assembly. Journal of Physics D: Applied Physics. 97, 041301 (2005).
- Melechko, A. V., Desikan, R., McKnight, T. E., Klein, K. L., Rack, P. D. Synthesis of vertically aligned carbon nanofibres for interfacing with live systems. Journal of Physics D: Applied Physics. 42 (19), 193001 (2009).
- Nelson-Fitzpatrick, N. . Novel Materials for the Design of Cantilever Transducers [dissertation]. , (2011).
- Fletcher, B. L., et al. Transfer of flexible arrays of vertically aligned carbon nanofiber electrodes to temperature-sensitive substrates. Advanced Materials. 18 (13), 1689-1694 (2006).
- Keller, S., Blagoi, G., Lillemose, M., Haefliger, D., Boisen, A. Processing of thin SU-8 films. Journal of Micromechanics and Microengineering. 18 (12), 125020 (2008).
- Wouters, K., Puers, R. Diffusing and swelling in SU-8: insight in material properties and processing. Journal of Micromechanics and Microengineering. 20 (9), 095013 (2010).
- Jamal, M., Zarafshar, A. M., Gracias, D. H. Differentially photo-crosslinked polymers enable self-assembling microfluidics. Nature Communications. 2, 527 (2011).
- Williams, R., Goodman, A. M. Wetting of thin layers of SiO2 by water. Applied Physics Letters. 25 (10), 531-532 (1974).
- Kundu, A., Nogueira Campos, M. G., Santra, S., Rajaraman, S. Precision vascular delivery of agrochemicals with micromilled microneedles (µMMNs). Scientific Reports. 9, 14008 (2019).
- Acanda, Y., Welker, S., Orbović, V., Levy, A. A simple and efficient agroinfiltration method for transient gene expression in Citrus. Plant Cell Reports. 40 (7), 1171-1179 (2021).
- Pearce, R., et al. Synthesis and properties of SiNx coatings as stable fluorescent markers on vertically aligned carbon nanofibers. AIMS Materials Science. 1 (2), 87-102 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crafts, A. S. Translocation in plants. Plant Physiology. 13 (4), 791 (1938).
- Martens, H. J., Hansen, M., Schulz, A. Caged probes: a novel tool in studying symplasmic transport in plant tissues. Protoplasma. 223, 63-66 (2004).
- Liu, J., Essner, J., Li, J. Hybrid supercapacitor based on coaxially coated manganese oxide on vertically aligned carbon nanofiber arrays. Chemistry of Materials. 22 (17), 5022-5030 (2010).
- Saleem, A. M., et al. Low temperature and cost-effective growth of vertically aligned carbon nanofibers using spin-coated polymer-stabilized palladium nanocatalysts. Science and Technology of Advanced Materials. 16, 015007 (2015).
- Merkulov, V. I., Lowndes, D. H., Wei, Y. Y., Eres, G., Voelkl, E. Patterned growth of individual and multiple vertically aligned carbon nanofibers. Applied Physics Letters. 76 (24), 3555-3557 (2000).
- Retterer, S. T., Melechko, A., Hensley, D. K., Simpson, M. L., Doktycz, M. J. Positional control of catalyst nanoparticles for the synthesis of high density carbon nanofiber arrays. Carbon. 46 (11), 1378-1383 (2008).
- Rooks, M. J., Wind, S., McEuen, P., Prober, D. E. Fabrication of 30-nm-scale structures for electron transport studies using a polymethylmethacrylate bilayer resist. Journal of Vacuum Science & Technology B: Microelectronics Processing and Phenomena. 5 (1), 318-321 (1987).
- Lee, G., Sohn, D. K., Seok, S. H., Ko, H. S. The effect of hole density variation in the PECVD reactor showerhead on the deposition of amorphous carbon layer. Vacuum. 163, 37-44 (2019).
- Fowlkes, J. D., et al. Control of catalyst particle crystallographic orientation in vertically aligned carbon nanofiber synthesis. Carbon. 44 (8), 1503-1510 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados