Method Article
Utilisation de réseaux de nanofibres de carbone alignés verticalement sur des substrats rigides ou flexibles pour l’administration de biomolécules et de colorants aux plantes
Dans cet article
Résumé
Nous décrivons ici des méthodes de microfabrication de nanofibres de carbone alignées verticalement (VACNF), de transfert de VACNF sur des substrats flexibles et d’application de VACNF sur des substrats rigides et flexibles aux plantes pour l’administration de biomolécules et de colorants.
Résumé
L’acheminement de biomolécules et de colorants imperméables aux plantes intactes est un enjeu majeur. Les nanomatériaux sont des outils prometteurs pour l’acheminement de l’ADN aux plantes. Aussi passionnants que soient ces nouveaux outils, ils n’ont pas encore été largement appliqués. Les nanomatériaux fabriqués sur substrat rigide (support) sont particulièrement difficiles à appliquer avec succès sur des structures végétales courbes. Cette étude décrit le processus de microfabrication de réseaux de nanofibres de carbone alignés verticalement et leur transfert d’un substrat rigide à un substrat flexible. Nous détaillons et démontrons comment ces fibres (sur substrats rigides ou flexibles) peuvent être utilisées pour la transformation transitoire ou l’administration de colorants (par exemple, la fluorescéine) aux plantes. Nous montrons comment les VACNF peuvent être transférés d’un substrat de silicium rigide à un substrat époxy flexible SU-8 pour former des matrices VACNF flexibles. Pour surmonter la nature hydrophobe du SU-8, les fibres du film flexible ont été recouvertes d’une fine couche d’oxyde de silicium (2-3 nm). Pour utiliser ces fibres pour l’administration d’organes végétaux incurvés, nous déposons une gouttelette de 1 μL de colorant ou de solution d’ADN sur le côté fibreux des films VACNF, attendons 10 minutes, plaçons les films sur l’organe végétal et utilisons un écouvillon avec un mouvement de roulement pour enfoncer les fibres dans les cellules végétales. Avec cette méthode, nous avons obtenu une livraison de colorant et d’ADN dans des organes végétaux avec des surfaces incurvées.
Introduction
La transformation des plantes (à la fois transitoire et stable) n’est pas encore devenue largement réalisable dans tous les tissus et espèces végétales. La transformation transitoire des plantes est un processus par lequel les gènes codés dans les plasmides sont temporairement introduits dans les plantes mais ne sont pas incorporés de manière stable dans le génome. Les méthodes traditionnelles qui utilisent le bombardement de particules, les agrobactéries, l’électroporation ou le traitement au polyéthylène glycol des protoplastes sont lentes ou peuvent être encombrantes. De plus, elles ne s’appliquent pas à toutes les espèces végétales 1,2,3,4. L’utilisation de nanomatériaux pour l’administration de l’ADN est un domaine en plein essor qui n’en est encore qu’à ses balbutiements5. Les nanomatériaux, en particulier les nanofibres de carbone, ont également été utilisés avec succès pour fournir des protéines, des dextrans et des colorants aux feuilles des plantes sans provoquer de réponse à la plaie6. L’objectif de ce travail est de fournir un protocole détaillé pour l’utilisation d’un type de nanomatériau, les nanofibres de carbone, pour délivrer des biomolécules ou des colorants aux plantes. Ici, nous nous concentrons sur l’ADN en tant que biomolécule de choix, qui permet la transformation transitoire des cellules dans divers organes végétaux.
Auparavant, Morgan et al.7 ont démontré l’utilisation de nanofibres de carbone fixées sur un substrat de silicium rigide pour transformer transitoirement les feuilles de laitue, N. benthamiana et le peuplier, ainsi que les feuilles et les racines d’Arabidopsis. Bien que les transformations aient été couronnées de succès sur une variété d’organes, les fibres étaient plus difficiles à appliquer sur les tissus végétaux à surface incurvée, tels que les racines ou les fruits. Nous avons pensé qu’un support flexible pour les nanofibres pourrait améliorer leur efficacité d’administration en s’adaptant mieux à la forme de l’organe.
Dans cet article, nous détaillons les méthodes utilisées pour la fabrication et la conception de nanofibres de carbone alignées verticalement, le transfert de VACNF sur des substrats flexibles et l’application de VACNF sur des substrats rigides et flexibles aux plantes pour fournir des biomolécules et des colorants. Les nanofibres de carbone ont été produites à l’aide d’un dépôt chimique en phase vapeur amélioré par plasma catalytique à courant continu (dc C-PECVD) avec un catalyseur Ni. La position, le diamètre et la hauteur des points catalyseurs de Ni ont été contrôlés à l’aide d’une combinaison de lithographie par faisceau d’électrons, d’évaporation du métal et de processus de décollage tels que décrits par Melechko et al.8,9. À l’aide d’une résine à faisceau d’électrons à double couche, un catalyseur de Ni plus épais peut être déposé sur le substrat pour donner des fibres plus longues10. Le transfert de fibres d’un substrat rigide à un substrat flexible est basé sur une modification des méthodes décrites dans Fletcher et al.11, les méthodes actuelles renonçant à l’utilisation d’une couche de carbone amorphe ou d’une couche sacrificielle de résine photosensible. Le décollage du SU-8 avec transfert de fibres est obtenu en utilisant la contrainte de traction intrinsèque résultant de la sous-cuisson et de la sous-exposition du SU-812,13,14. Le SU-8, un polymère complexe, est naturellement hydrophobe, ce qui rend difficile son utilisation pour faciliter la livraison de l’ADN. Pour contrer la nature hydrophobe du SU-8, nous appliquons une fine couche d’oxyde de silicium par dépôt de couche atomique15 après que les fibres aient été incorporées dans le SU-8. L’application de fibres sur un substrat rigide pour l’administration de biomolécules/colorants utilise la force d’impact du taraudage de la pince à épiler décrite dans Davern et al.6 et les méthodes sur plante et sur puce décrites dans Morgan et al.7. Les films VACNF flexibles sont appliqués sur les surfaces incurvées des plantes en séchant d’abord des gouttelettes d’ADN ou de colorant sur le film, comme avec la méthode sur puce de Morgan et al.7, puis en roulant les films sur les surfaces incurvées des plantes à l’aide d’un petit applicateur de maquillage16,17. La figure 1 illustre diverses approches pour l’application de fibres dans des substrats rigides et flexibles sur les plantes.
Protocole
1. Production de VACNF (Figure 2 et Figure 3)
- Enrober une plaquette de silicium avec du polyméthacrylate de méthyle (PMMA) 495 A4 résister à 4000 tr/min et la cuire à 180 °C pendant 5 min.
REMARQUE : Laissez la gaufrette refroidir pendant 10 s avant de passer à l’étape suivante. - Appliquez une deuxième couche de résine (PMMA 950 A2) et faites-la cuire au four à 180 °C pendant 5 min.
- Utilisez la lithographie par faisceau d’électrons pour définir les points catalyseurs d’un diamètre de 300 nm à un espacement latéral spécifié (pas : 10 μm ou 35 μm) dans des réseaux de 3 mm x 3 mm.
- Développer la résine dans 30 à 40 mL de méthyl-isobutylcétone 1 :3 : alcool isopropylique (IPA) pendant 1,5 min, puis la rincer avec de l’IPA et la sécher avec du N2.
REMARQUE : Vérifiez le réseau de points à l’aide d’un microscope à fond clair (objectif 20x). - Nettoyer la plaquette de la résine résiduelle avec une exposition de 6 s dans un plasma d’oxygène (descum) dans un graveur au silicium.
- Utilisez l’évaporation par faisceau d’électrons pour déposer d’abord une couche adhésive de métal (Ti ou Cr, 10 nm), puis déposer une deuxième couche, qui est le catalyseur Ni (130 nm ou 150 nm). Pendant le dépôt de métal Ti ou Ni, maintenez le courant en dessous de 0,2 A à 10 kV, la pression en dessous de 5 x 10-6 Torr et le taux de dépôt à ~1 A/s pour le dépôt en visibilité directe.
- Utilisez la sonication séquentielle du bain pour éliminer le métal (Ni) déposé sur la couche de résine sous-jacente, laissant le Ni déposé directement sur la plaquette de silicium. C’est ce qu’on appelle le décollage.
- Pour cela, préparez 3 récipients avec de l’acétone et baignez la gaufrette dans de l’acétone pendant 1 min ; répéter 3 fois à température ambiante (RT, 20 °C) à une fréquence de 35 kHz. Rincez avec de l’alcool isopropylique et séchez avec du N2.
REMARQUE : Ne laissez jamais l’acétone sécher sur la gaufrette. Après la dernière sonication à l’acétone, rincez immédiatement avec de l’IPA puis séchez avec du gaz N2 . Si, à un moment donné, la plaquette devient prématurément sèche (avant le rinçage de l’IPA), il est possible que tout l’excès de métal et de résine ne soit pas éliminé et que l’acétone puisse laisser un résidu.
- Pour cela, préparez 3 récipients avec de l’acétone et baignez la gaufrette dans de l’acétone pendant 1 min ; répéter 3 fois à température ambiante (RT, 20 °C) à une fréquence de 35 kHz. Rincez avec de l’alcool isopropylique et séchez avec du N2.
- Vérifiez la géométrie de la forme du catalyseur à l’aide de la microscopie électronique à balayage (MEB). Pour capturer des images MEB des puces VACNF, inclinez la platine à un angle de 30° et utilisez une tension de 1 à 3 kV, avec un courant de faisceau de ~100 pA et une distance de travail de ~5 mm.
REMARQUE : Le catalyseur doit ressembler à une rondelle de hockey (un cylindre compact) (figure 4). La hauteur du cylindre compact doit refléter l’épaisseur du Ni déposé sur la plaquette de silicium. Si le profil du point de Ni est grand et semble concave au sommet, ressemblant à un volcan (Figure 4), alors le catalyseur est plus susceptible de se déverser en plusieurs gouttelettes de Ni, ce qui entraîne la ramification des nanofibres de carbone9 (Figure 4 et Figure 5). De tels problèmes peuvent résulter de la fusion de la résine lors de l’évaporation du métal en raison de longs temps de dépôt ou de problèmes liés à la procédure de décollage (Figure 4 et Figure 5). - Coupez la plaquette de silicium en quatre et placez-la dans la chambre de dépôt chimique en phase vapeur améliorée par plasma à courant continu (dc-PECVD) avec le mélange acétylène/ammoniac. Optimiser les paramètres de croissance pour contrôler la longueur et la conicité des nanofibres (pointes <200 nm).
- Utilisez un courant de 1 à 1,5 A et une plage de tension de 440 à 560 V. Lors de la croissance des fibres, utilisez une phase de prétraitement avec un flux d’ammoniac pendant que la machine et le substrat chauffent jusqu’à 620 °C. Assurez-vous d’allumer la source de carbone (acétylène) 10 s avant de démarrer le plasma.
REMARQUE : Des quarts de wafers sont utilisés dans le cas où les paramètres de fonctionnement de la machine PECVD doivent être optimisés. Pour produire des fibres d’une longueur supérieure à 40 μm et d’extrémités inférieures à 200 nm de diamètre, les paramètres suivants sont suggérés : avec une épaisseur de catalyseur Ni de 130 nm, utiliser un courant de 1,75 A, un temps de croissance de 70 min, et un rapport acétylène/ammoniac de 45 centimètre cube standard par minute (sccm) : 100 sccm. Avec une épaisseur de Ni de 150 nm, utilisez un courant de 1,5 A, un temps de croissance de 80 min, et un rapport acétylène/ammoniac de 48 sccm : 100 sccm. Utilisez les paramètres suivants pour faire pousser des VACNF quelle que soit l’épaisseur du catalyseur : une température de croissance de 620 °C, une pression de 10 torr pendant le plasma et une hauteur de pomme de douche de 20 mm (Figure 6).
- Utilisez un courant de 1 à 1,5 A et une plage de tension de 440 à 560 V. Lors de la croissance des fibres, utilisez une phase de prétraitement avec un flux d’ammoniac pendant que la machine et le substrat chauffent jusqu’à 620 °C. Assurez-vous d’allumer la source de carbone (acétylène) 10 s avant de démarrer le plasma.
- Évaluez la géométrie des fibres résultantes à l’aide du MEB à une inclinaison de 30° avec un potentiel d’accélération de 1 kV.
REMARQUE : Les fibres optimales seront droites et non ramifiées. Il est impossible de contrôler l’orientation cristalline du catalyseur Ni avec l’évaporateur à faisceau d’électrons. En conséquence, il y aura des fibres qui se ramifieront à cause de la déshumidification du catalyseur9. De plus, l’orientation des cristaux fait que les VACNF atteignent des hauteurs différentes, de sorte qu’il est difficile d’obtenir des hauteurs uniformes sur tous les VACNF. - Appliquer une couche de résine photosensible (SPR955) sur les fibres à 1000 tr/min pendant 45 s. Coupez ensuite la plaquette 1/4 en dés de 3 mm x 3 mm à l’aide d’une scie à dés. Conservez les fibres à ce stade pour une utilisation ultérieure.
REMARQUE : N’effectuez pas l’étape 1.11 si vous prévoyez de transférer des fibres sur un substrat flexible.
2. Transfertde VACNF sur un substrat flexible (Figure 7 et Figure 8)
- Une fois les fibres synthétisées, la résine photosensible SU-8 2015 est appliquée sur les plaquettes ou les quarts de plaquettes à 4000 tr/min pendant 45 s.
- Faites cuire la gaufrette pendant 3 min à 95 °C.
- À l’aide d’un aligneur de contact, exposez la plaquette avec un masque à motifs matriciels de 3 mm qui s’aligne sur le motif défini par lithographie par faisceau d’électrons à 95 mJ/cm2.
REMARQUE : Utilisez un mode de contact de proximité avec un écart d’exposition supérieur de 20 μm à la fibre la plus haute. Il est possible que les fibres soient renversées au cours de cette étape du processus. - Effectuez une cuisson post-exposition pendant 6 min à 95 °C.
- Développez la plaquette dans le révélateur SU-8 pendant 15 s, rincez-la avec de l’alcool isopropylique et séchez la plaquette avec du N2, en vous déplaçant de haut en bas.
REMARQUE : Lors du développement de la plaquette, assurez-vous qu’elle est complètement immergée. - Plaquettes à motif spincoat avec une couche protectrice de résine photosensible mince (SPR 955 CM 0,7) à 3000 tr/min pendant 45 s et softbake pendant 30 s à 90 °C.
- Déposez une fine couche d’oxyde de silicium sur la plaquette (2-3 nm) en la plaçant dans un dépôt de couche atomique pendant 22 cycles à 100 °C.
- À l’aide d’une scie à découper, découpez la plaquette en carrés de 3 mm x 3 mm. Alignez la scie à découper sur le motif préexistant sur la plaquette.
- Évaluez la géométrie des fibres résultantes à l’aide du MEB à une inclinaison de 30° avec un potentiel d’accélération de 3 kV.
- Arrêtez-vous ici si vous stockez des puces pour une utilisation à long terme (>1 semaine). Conservez les croustilles dans l’obscurité.
- Pour séparer les substrats souples des substrats rigides, placez les copeaux individuels dans de l’acétone pendant 30 minutes ou jusqu’à ce que le SU-8 commence à s’enrouler.
- Lavez les films SU-8 (attachés ou détachés des substrats rigides) avec de l’alcool isopropylique pendant 5 minutes, puis avec de l’eau pendant 5 minutes. Placez les croustilles dans une boîte commerciale avec un tampon collant lors de leur transport.
- FACULTATIF : Placez le côté sans fibres du film SU-8 sur du ruban adhésif soluble dans l’eau ou sur un mince caoutchouc de silicone avec un support mince en polyéthylène téréphtalate (PET) (12,5 μm d’épaisseur).
- Utilisez une pince à épiler pour transférer le film SU-8. Appuyez sur les bords du carré SU-8 pour l’aider à adhérer au ruban/caoutchouc de silicone-PET ; Ceci afin d’éviter de casser les fibres. À ce stade, les films VACNF sont prêts à être utilisés immédiatement.
- Pour préparer un support en caoutchouc de silicone/PET, procédez comme suit : à l’aide d’un kit en 2 parties pour le caoutchouc de silicone, mélangez les deux parties ensemble (l’élastomère et le réticulant). Ensuite, découpez un carré de PET et collez-le dans un plat en plastique transparent. Versez une très fine couche de caoutchouc de silicone sur le PET et faites-le durcir à 80 °C pendant 1 à 2 h.
3. Méthode sur plante (où une goutte de solution à délivrer est placée sur la surface d’une plante) utilisant des fibres dans un substrat rigide (Figure 1A)
- Retirez la résine photosensible avec des lavages incrémentiels d’acétone (100 %, 5 min), d’IPA (100 %, 5 min) et de ddH2O (5 min) avant utilisation.
- Placez le tissu végétal à empaler sur une surface dure pour le soutenir.
- Placez une gouttelette de 1 μL de colorant ou d’ADN (200 ng) à la surface du tissu végétal.
- Placez une puce VACNF avec un substrat rigide sur le dessus de la gouttelette, avec les fibres orientées de manière à ce qu’elles entrent en contact avec la gouttelette.
REMARQUE : L’orientation des puces peut être déterminée par la « brillance » de la plaquette. Le côté brillant de la puce a des fibres, et le côté opaque n’en a pas. - À l’aide du côté plat d’une pince à épiler, tapotez la puce. Marquez la zone de la plante avec laquelle la puce est entrée en contact à l’aide d’un marqueur à pointe souple. Retirez les puces VACNF après la livraison.
REMARQUE : La quantité de force appliquée lors du tapotement varie en fonction du type de tissu végétal utilisé. Il est recommandé de s’entraîner à taper sur les copeaux avant de procéder à l’empalement des fibres. Évitez d’endommager les tissus végétaux. Les dommages sont apparents lorsque l’on peut voir le contour de la puce VACNF dans le tissu végétal. - Répétez les étapes 3.1 à 3.5 pour les contrôles (+Colorant/ADN, -Fibres ; -Colorant/ADN, +Fibres ; et -Colorant/ADN, -Fibres). -Les fibres sont le côté sans fibres d’une puce.
- Conservez les plantes intactes ou les organes végétaux excisés dans des chambres humides dans des conditions de jours longs (16 h de lumière, 8 h d’obscurité) si nécessaire. Pour les organes excisés, utilisez une boîte de Pétri en plastique avec du papier absorbant humide.
4. Méthode sur puce (où une goutte de solution à délivrer est placée sur une puce VACNF), substrat rigide (Figure 1B)
- Retirez la résine photosensible avec des lavages incrémentiels d’acétone (100 %, 5 min), d’IPA (100 %, 5 min) et de ddH2O (5 min) avant utilisation.
- Déposer une gouttelette de 1 μL d’ADN de colorant ou de plasmide (200 ng) sur le côté fibre de la puce VACNF avec un substrat rigide. Assurez-vous de placer la gouttelette au centre de la puce et de recouvrir plusieurs fibres. Laissez sécher la gouttelette pendant 15 min.
REMARQUE : L’orientation des puces peut être déterminée par la « brillance » de la plaquette. Le côté brillant de la puce a des fibres, et le côté opaque n’en a pas. - Lorsque vous travaillez avec des feuilles ou d’autres organes excisés, placez-les sur une surface dure. Lorsque vous travaillez avec des plantes intactes, placez une surface dure sous l’organe sur lequel les VACNF sont appliqués.
- Après l’étape de séchage de 15 minutes, positionnez la puce VACNF de manière à ce que le côté fibre entre en contact avec le tissu végétal. Tapotez la puce avec l’extrémité arrière d’une pince à épiler.
REMARQUE : La quantité de force appliquée lors du tapotement varie en fonction du type de tissu végétal utilisé. Il est recommandé de s’entraîner à taper sur les copeaux. - Répétez les étapes 3.6 à 3.7 de la méthode sur plante.
5. Application de VACNF dans des films SU-8 sur des tissus végétaux à l’aide de la méthode sur puce (Figure 1C)
- Placez 1 gouttelette de colorant ou d’ADN (200 ng) sur le côté fibre du film SU-8 et laissez-la sécher pendant 10 minutes. Assurez-vous de placer la gouttelette au centre de la puce.
REMARQUE : Il existe différents temps de séchage en fonction du substrat utilisé. - À l’aide d’une pince à épiler bien aiguisée, placez le film VACNF sur la surface de la plante.
REMARQUE : Plus les films SU-8 sont laissés longtemps à l’air, plus les films deviennent cassants. Pour limiter le risque de perte des films SU-8, assurez-vous d’avoir toutes les plantes/échantillons et l’équipement à proximité des films SU-8. - Roulez doucement un petit applicateur de maquillage sur le film VACNF. Marquez les zones où les substrats souples sont placés avec un marqueur à pointe souple. Retirez les substrats flexibles de la surface de la plante à l’aide de ruban adhésif.
REMARQUE : La quantité de force appliquée lors du roulement de l’applicateur de maquillage varie selon les tissus végétaux utilisés. Entraînez-vous à appliquer les films VACNF avant d’effectuer l’administration de biomolécules ou de colorants. Les dommages visibles aux tissus végétaux sont apparents lorsque l’on peut voir les contours du film VACNF dans les tissus végétaux. - Répétez les étapes 5.1 à 5.3 pour les plantes témoins et entreposées, comme indiqué à l’étape 3.7 de la méthode sur place.
6. Microscopie et analyse d’images pour toutes les méthodes de livraison
- Imagez les échantillons à l’aide d’un microscope confocal en utilisant des longueurs d’onde d’émission et d’excitation adaptées à la sonde/rapporteur fluorescent livré.
REMARQUE : Le temps nécessaire à la transformation transitoire varie en fonction de l’espèce végétale et du marqueur délivré. Par exemple, l’expression de marqueurs fluorescents a été détectée après 48 h chez Arabidopsis contre 96 h chez les feuilles de laitue7. - Lors de l’imagerie, essayez de vous concentrer sur une région avec des fibres détachées. Les fibres auront des orientations différentes. Le succès de la livraison ne dépend pas de l’apparition de fibres cassées.
REMARQUE : Les fibres seront fluorescentes avec les paramètres d’excitation/d’émission les plus courants en raison de la formation d’une couche de nitrure de silicium résultant de la formation de fibres dans le PECVD18. - Capturez au moins 5 images pour chaque échantillon. Le signal résultant varie.
- Mesurez les valeurs de fluorescence en fluorescence totale (densité intégrée) dans des zones d’image confocales de 20 μm x 20 μm7 à l’aide d’ImageJ19.
Résultats
L’avantage distinct des puces VACNF sur des substrats rigides ou flexibles est la capacité de délivrer des biomolécules ou des colorants à des endroits spécifiques d’une plante (Figure 1). Ici, nous avons utilisé des lectures de fluorescence pour évaluer la livraison. En utilisant différentes plantes, substrats et méthodes d’administration (sur puce ou sur plante), il peut y avoir des différences dans le moment de l’apparition du colorant fluorescéine. Pour déterminer si les puces/films VACNF fonctionnent pour l’administration, une approche rapide consiste à utiliser des fibres pour l’administration du colorant (Figure 9). Les images étiquetées avec des heures différentes dans la figure 9 sont des champs de vision différents à partir des mêmes échantillons. Lors de l’utilisation de la méthode sur la plante, le colorant à la fluorescéine peut être observé immédiatement après l’accouchement à l’aide de la microscopie à fluorescence. De plus, si le même champ de vision est imagé au fil du temps après l’administration d’un colorant à la fluorescéine à une plante, l’intensité du signal devient moins lumineuse avec le temps (Figure 10). Le colorant à la fluorescéine pourrait potentiellement se déplacer du champ de vision vers d’autres zones de la feuille par l’intermédiaire des plasmodesmes20,21. Par rapport à la méthode sur plante, dans la méthode sur puce avec des fibres sur le substrat rigide, le colorant se déplace plus lentement dans toute la zone empalée (Figure 9). Cela pourrait être dû au fait que le colorant se détache des fibres/se réhydrate dans les cellules et prend donc plus de temps à se déplacer.
Les fibres du substrat souple convenaient à l’administration de colorant sur des surfaces courbes telles que les fraises et les pommes (figures 11 et 12). En utilisant un substrat souple avec des fraises, un fort signal de fluorescéine a été observé immédiatement (Figure 11), alors qu’il a fallu 2 h pour voir un fort signal de fluorescéine dans les pommes (Figure 12B,D). La délivrance réussie de plasmides codant pour des marqueurs fluorescents peut être déterminée à l’aide de la microscopie à fluorescence pour trouver le signal résultant (Figure 12F, Figure 13 et Figure 14). Des contrôles sont nécessaires pour déterminer si la plante choisie n’a pas d’autofluorescence similaire au marqueur fluorescent que nous voulons délivrer par fibres. L’utilisation de fibres seules est utile pour déterminer si la force d’impact appliquée avec une pince à épiler endommage le tissu végétal ou si la fluorescence observée dans l’échantillon est due aux VACNF, qui sont intrinsèquement fluorescents en raison de leur couche de nitrure de silicium18 (Figure 13C-D). Les fibres empalées dans les tissus végétaux n’induisent pas de réponse à laplaie telle qu’évaluée par la production de H 2 O2 6. Enfin, l’utilisation du contrôle de l’ADN +, -Fibres est nécessaire pour confirmer que l’ADN n’entre pas dans la plante par le seul tapotement et confirme que les fibres sont nécessaires à la livraison dans les cellules végétales (Figure 13E-F). Il ne devrait pas y avoir de différence distincte lors de l’utilisation des méthodes d’administration sur plante ou sur puce à l’aide des VACNF sur un substrat rigide, comme l’indique l’absence de différence significative dans les valeurs de fluorescence (figure 13I). L’utilisation des films VACNF flexibles avec l’administration d’ADN sur puce a permis une transformation transitoire réussie des cellules épidermiques dans les pommes et les oignons achetés en magasin (Figure 12F et Figure 14).
Les expériences ratées peuvent avoir des fibres cassées dans différents champs de vision, mais il n’y aura pas de signal de fluorescence résultant de la tentative d’administration de l’ADN plasmidique ou du colorant. Si une pression trop forte est appliquée sur la plante, il y aura des lésions tissulaires apparentes (figure 15). Ces dommages mécaniques peuvent ressembler à de petits trous ou à des zones transparentes dans la plante, comme si une couche de cellules avait été enlevée lors de l’observation de la plante au microscope. Parfois, les empreintes de la puce seront visibles. Une expérience dans laquelle l’expression de protéines fluorescentes n’est pas détectée après l’administration de l’ADN peut également être due à l’utilisation d’ADN de mauvaise qualité, il peut donc être utile de préparer de l’ADN frais.
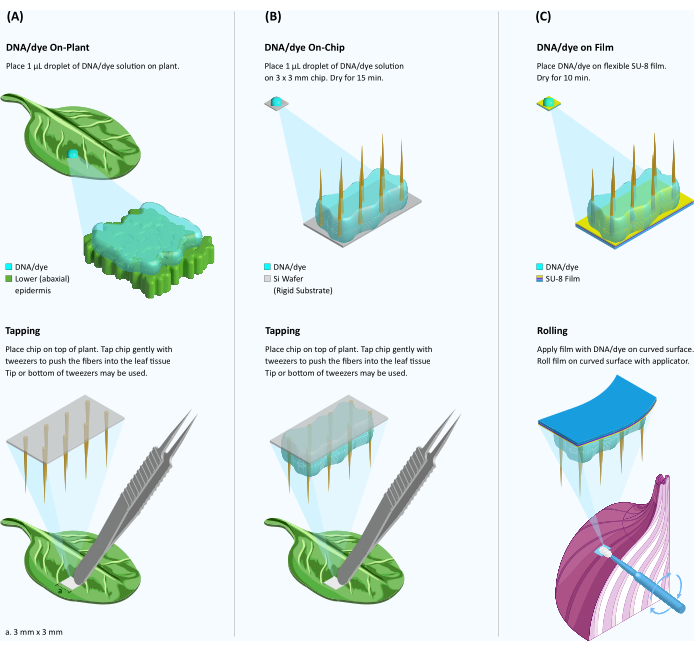
Figure 1 : Schéma de l’administration du colorant et de l’ADN aux tissus végétaux à l’aide de fibres sur des substrats rigides et flexibles. (A) Livraison de colorant ou d’ADN sur la plante, médiée par les fibres. Une gouttelette de 1 μL de solution de colorant/ADN est placée à la surface d’une feuille et la puce VACNF est placée sur le dessus de la gouttelette. À l’aide d’une pince à épiler, la puce est délicatement tapotée dans le tissu. Le substrat rigide est retiré en laissant des nanofibres dans le tissu. (B) Livraison d’ADN médié par fibre sur puce. Une gouttelette de 1 μL de colorant ou de solution d’ADN est coulée sur la puce VACNF et séchée pendant 15 minutes. La puce contenant de l’ADN semi-séché est placée sur la surface de la feuille et taraudée dans le tissu comme dans le panneau A. (C) Livraison d’ADN sur puce par film SU-8. Les fibres sont transférées du substrat de silicium rigide vers un support SU-8 flexible. Une gouttelette de 1 μL de solution de colorant/ADN est coulée sur le film VACNF et séchée pendant 10 minutes. Le film VACNF avec le colorant/ADN semi-séché est ensuite roulé sur une surface végétale incurvée à l’aide d’un applicateur de maquillage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
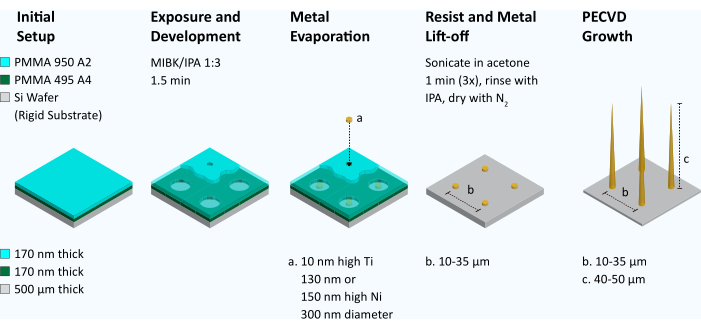
Figure 2 : Flux de travail pour la fabrication de réseaux de nanofibres de carbone alignés verticalement. Pour produire des VACNF, une double couche de polyméthacrylate de méthyle (PMMA 495 A4 suivi de PMMA 950 A2) est enrobée par centrifugation sur une plaquette de silicium. La lithographie par faisceau d’électrons est utilisée pour définir un réseau de points de 300 nm de diamètre. La résine est ensuite développée en méthyl isobutylcétone/isopropanol (MIBK/IPA), 1 :3 pendant 1,5 min. À l’aide d’un évaporateur métallique, une couche adhésive de Ti (10 nm) est appliquée sur la plaquette, suivie d’une couche de Ni (130 nm ou 150 nm). La réserve restante est ensuite éliminée par soulèvement (sonication du bain dans de l’acétone). La géométrie des points de catalyseur est inspectée par MEB. Si les catalyseurs ressemblent à des rondelles de hockey et qu’ils sont plats, ils sont placés dans la machine de dépôt chimique en phase vapeur améliorée par plasma (PECVD) et les fibres sont cultivées. Les fibres ont ensuite été inspectées à l’aide d’un MEB. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Images MEB de nanofibres de carbone idéales alignées verticalement. (A) Micrographie électronique de VACNF avec un pas de ~35 μm et une hauteur de 10-15 μm, imagés à un angle de 30°. Cette image est dupliquée à la figure 7C. (B) Micrographie électronique de VANCF avec un pas de ~20 μm et une hauteur de 20-30 μm, et imagée à un angle de 30°. (C) Micrographie électronique de VANCF avec un pas de ~35 μm, une hauteur de 50 à 60 μm et une image à un angle de 30°. (D) Micrographie électronique de la pointe VACNF d’un diamètre <200 nm. Il existe des variations dans les diamètres des pointes de fibres (150-300 nm). Parce que les fibres ont été imagées à un angle de 30°, les hauteurs semblent être plus petites que la hauteur réelle d’un facteur de sin (30°) = 1/2. Les panneaux A et B ont été reproduits avec la permission de Morgan et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
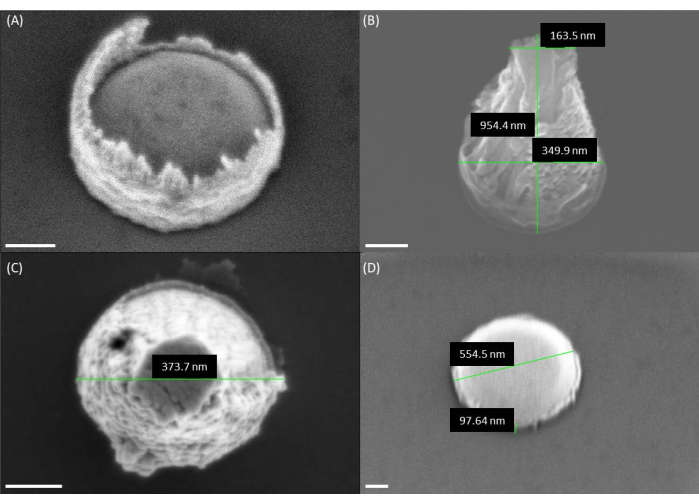
Figure 4 : Images MEB de la géométrie du catalyseur avant la croissance des VACNF. (A) Image MEB du catalyseur après le décollage. Notez que la résine photosensible est présente autour du bord du catalyseur, ce qui donne une forme de volcan. (B,C) Les images MEB montrent les formes volcaniques du catalyseur après l’utilisation d’une résine PMMA monocouche. (D) Forme de catalyseur de rondelle de hockey souhaitée faite de doubles couches de PMMA. Étant donné que les fibres ont été imagées à un angle de 30° dans les panneaux A, B et D, les hauteurs semblent être inférieures à la hauteur réelle d’un facteur de sinus (30°) = 1/2. Les barres d’échelle représentent 100 nm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Effet de la taille des points du catalyseur sur la croissance des fibres : Pour établir le diamètre optimal du matériau du catalyseur, les fibres ont été cultivées à partir de tailles de points allant de 200 à 600 nm. Des tailles de points allant de 400 à 600 nm ont conduit à la déshumidification du catalyseur et à la croissance de plusieurs fibres. La meilleure géométrie de fibre a été produite par un diamètre de 300 nm. Des points plus petits ont conduit à une hauteur de fibre insuffisante. En raison du fait que les fibres ont été imagées à un angle de 30°, les hauteurs semblent être inférieures à la hauteur réelle d’un facteur de sin (30°) = 1/2. Les images ont été prises à l’aide de la micrographie électronique à balayage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
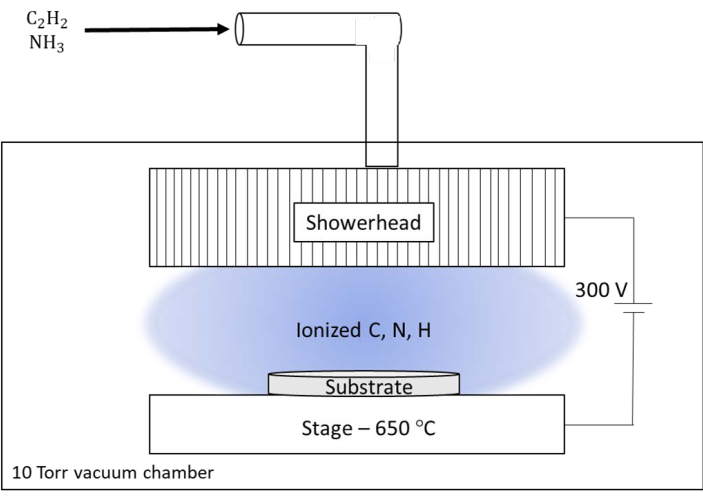
Figure 6 : Illustration schématique du système de dépôt chimique en phase vapeur amélioré par plasma (dc-PECVD) utilisé au Laboratoire national d’Oak Ridge (ORNL). Le système sur mesure de l’ORNL dispose d’une grande pomme de douche qui sert de réacteur pour les gaz d’alimentation et de sortie pour le plasma. La pomme de douche a été maintenue à un potentiel continu de 300 V par rapport à l’étage chauffé pour le substrat. Veuillez cliquer ici pour voir une version agrandie de cette figure.
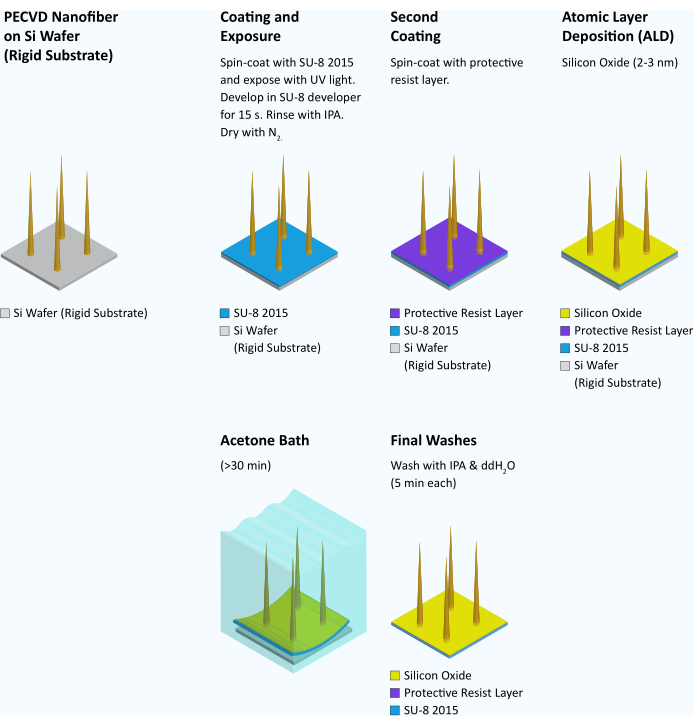
Figure 7 : Flux de travail pour le transfert de fibres d’un substrat rigide à un substrat flexible. Après la synthèse et l’inspection des nanofibres, chaque plaquette est recouverte de SU-8 2015 à 4000 tr/min pendant 45 s. La gaufrette est ensuite cuite pendant 3 min à 95 °C. Ensuite, la plaquette est exposée à la lumière UV et modelée dans un gouttière de masque à 95 mJ/cm2. Après une post-cuisson de 6 min à 95 °C, la plaquette est développée dans le révélateur SU-8 pendant 15 s, rincée avec de l’alcool isopropylique et séchée avec du gaz N2. Une couche protectrice de résine SPR 955 CM 0,7 est enrobée par centrifugation sur la plaquette à 3000 tr/min et cuite à 90 °C pendant 30 s. Une couche d’oxyde de silicium (2-3 nm) est ensuite ajoutée à la plaquette par dépôt de couche atomique (ALD) (22 cycles à 100 °C) pour rendre le substrat flexible hydrophile15. La plaquette est ensuite coupée en dés de 3 mm x 3 mm à l’aide d’une scie à dés. Au moment de l’utilisation, les copeaux individuels sont placés dans de l’acétone jusqu’à ce que le SU-8 commence à s’enrouler et devienne concave (>30 min). À l’heure actuelle, la couche de SU-8 sur la plupart des puces peut être saisie sur le bord avec une pince à épiler tranchante et décollée du substrat de silicium sous-jacent sous la forme d’un film carré intact de 3 mm. Le film est ensuite lavé successivement dans de l’alcool isopropylique et de l’eau pendant 5 min chacun et utilisé immédiatement. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Images MEB du transfert de fibres d’un substrat rigide à un substrat flexible. Les images présentées sont représentatives mais proviennent d’échantillons différents. (A) Fibres longues après la croissance du PECVD (même image que sur la figure 2C). (B,C) Fibres après application de SU-8. L’époxy jaillit autour de la base des fibres. La longueur des fibres exposées variait de 5 μm à 30 μm. (D) Les fibres incorporées dans le Su-8 après le décollage ont conservé leur géométrie. En raison du fait que les fibres ont été imagées à un angle de 30°, les hauteurs semblent être inférieures à la hauteur réelle d’un facteur de sin (30°) = 1/2. Le panneau A a été reproduit avec la permission de Morgan et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
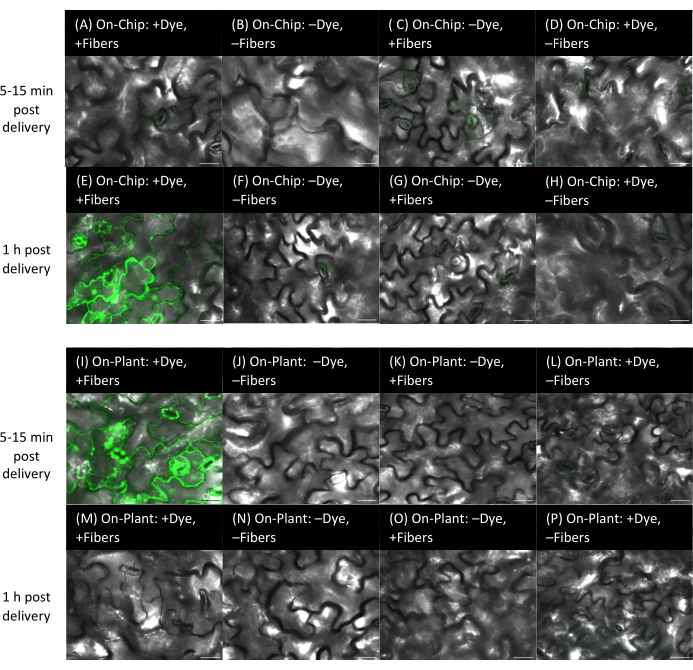
Figure 9 : Distribution du colorant aux feuilles d’Arabidopsis à l’aide de méthodes sur puce et sur plante avec des fibres sur des substrats rigides. (A-P) Les images ont été acquises par microscopie confocale. Méthode sur puce (A-H) : 1 μL de colorant à la fluorescéine de 10 μM a été séché pendant 15 min sur des puces VACNF, puis les copeaux ont été taraudés dans le côté abaxial des feuilles d’Arabidopsis à l’aide d’une pince à épiler. (A-D) Feuilles photographiées dans les 5 à 15 minutes suivant la livraison. (E-H) Laisse en image 1 h après l’accouchement. (A,E) +Colorant, +Fibres. Contrôles : (B, F) -Colorant, -Fibres ; (C,G) -Colorant, +Fibres ; (D,H) +Colorant, -Fibres. (I-P) Méthode sur la plante : 1 μL de colorant à la fluorescéine de 10 μM a été placé sur la surface de la plante, des copeaux ont été positionnés de manière à entrer en contact avec la gouttelette, et une pince à épiler a été utilisée pour tapoter la puce dans la face abaxiale des feuilles d’Arabidopsis. (I-L) photographié dans les 5 à 15 minutes suivant l’accouchement et (M-P) imagé 1 h après l’accouchement. (I, M) +Colorant, +Fibres. Contrôles : (J, N) -Colorant, -Fibres ; (K,O) -Colorant, +Fibres ; (L,P) +Colorant, -Fibres. Les panneaux A-P sont des images planaires uniques issues de z-stacks. Les barres d’échelle sont de 20 μm. Les fibres ont un pas de 35 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
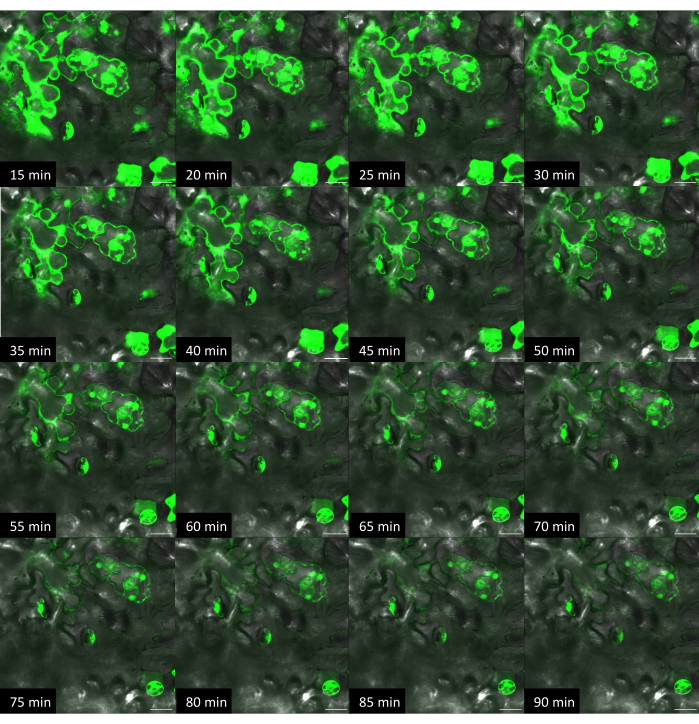
Figure 10 : Évolution temporelle de l’administration du colorant chez Arabidopsis par une méthode sur plante avec un substrat rigide. Les images ont été acquises par microscopie confocale. À l’aide de la méthode sur plante, une gouttelette de 1 μL de solution de colorant à la fluorescéine (10 μM) a été placée à la surface d’une feuille, et la puce VACNF a été placée au-dessus de la gouttelette. À l’aide d’une pince à épiler, la puce a été délicatement tapotée dans le tissu. Des images +Colorant, +Fibres de la même zone ont été acquises toutes les 5 minutes. Les barres d’échelle sont de 20 μm. Les fibres ont un pas de 35 μm. Les panneaux sont des images planes uniques provenant de z-stacks. Veuillez cliquer ici pour voir une version agrandie de cette figure.
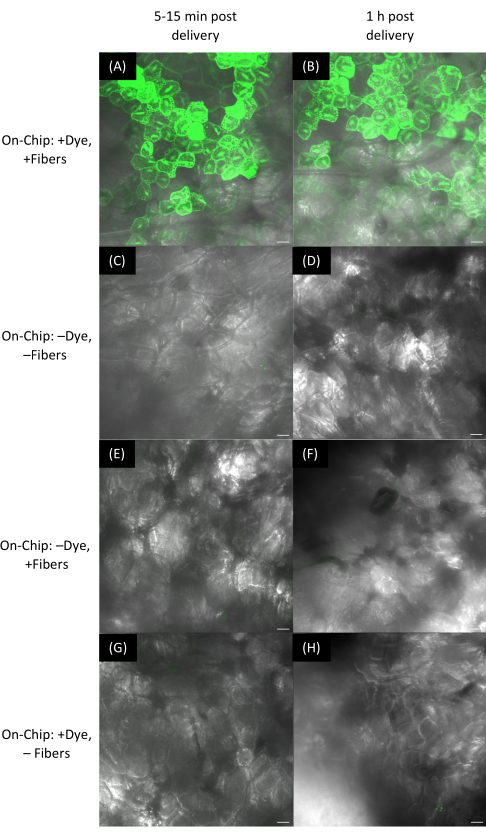
Figure 11 : Distribution du colorant aux fraises à l’aide de films VACNF. (A-H) Les images ont été acquises à l’aide de la microscopie confocale. À l’aide de la méthode sur puce, des gouttelettes de colorant ont été séchées sur des films VACNF, qui ont ensuite été roulées sur la surface des fruits à l’aide d’un applicateur de maquillage. Le colorant à la fluorescéine (10 μM) a été administré aux cellules de fraises et imagé après (A) 10 min et (B) 1 h. (C,D) Aucun contrôle de traitement (-Colorant, -Fibres). (E,F) -Colorant, +Fibres contrôle après 10 min et 1 h, respectivement. (G,H) +Colorant, -Contrôles des fibres après 10 min et 1 h, respectivement. Les barres d’échelle sont de 40 μm. Les panneaux A-H sont des projections maximales de 188 μm de piles z. Les fibres ont un pas de 35 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 12 : Distribution du colorant et transformation transitoire des pommes par l’intermédiaire de films VACNF. (A-F) Les images ont été générées à l’aide de la microscopie confocale. À l’aide de la méthode sur puce, des gouttelettes de 1 μL de colorant à la fluorescéine (10 μM, B et D) ou 1 μL de plasmide codant pour le pUBQ10 :YFP (ADN-YFP) (200 ng) ont été séchées sur des films VACNF, qui ont ensuite été roulés sur la surface des fruits à l’aide d’un applicateur de maquillage. Le colorant à la fluorescéine a été administré à l’épiderme du pommier et imagé après (B) 10 min et (D) 2 h. (D) Le colorant a mis un certain temps à se diffuser dans les cellules après l’accouchement. Délivrance et expression de l’ADN-YFP via des films VACNF après (F) 48 h. (A,C,E) aucun contrôle de traitement (-Colorant/ADN-YFP, -Fibres). Les barres d’échelle sont de 40 μm. Les panneaux A-D sont des images planes uniques provenant de z-stacks. Les panneaux E et F sont la projection maximale des piles z de 53 μm. Le pas de la fibre est de 35 μm. Les flèches indiquent les signaux de fluorescéine ou de YFP. * indique les fibres. Veuillez cliquer ici pour voir une version agrandie de cette figure.
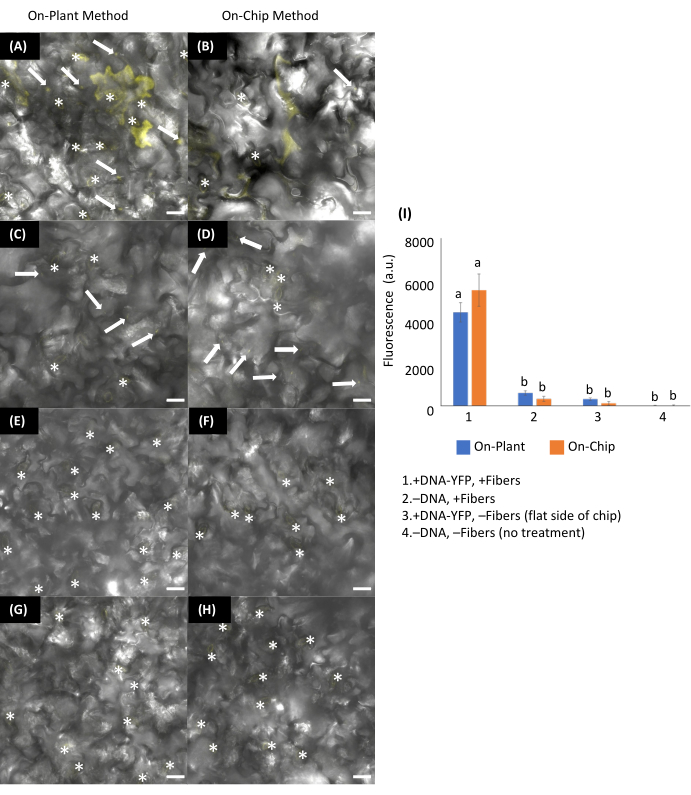
Figure 13 : Transformation transitoire des feuilles d’Arabidopsis à l’aide de méthodes VACNF sur plante ou sur puce. (Un-H) Les images ont été acquises par microscopie confocale 48 h après l’administration de l’ADN. (A,C,E,G) Méthode sur plante : 1 μL de plasmide codant pour pUBQ10 :YFP (ADN-YFP) (200 ng) a été placé sur la face abaxiale des feuilles d’Arabidopsis. Les copeaux étaient positionnés de manière à entrer en contact avec la gouttelette, et des pinces à épiler étaient utilisées pour tapoter les copeaux dans le tissu foliaire. (B, D, F, H) Méthode sur puce : 1 μL d’ADN-YFP (200 ng) a été séché pendant 15 min sur des puces VACNF, puis les puces ont été prélevées sur la face abaxiale des feuilles d’Arabidopsis à l’aide d’une pince à épiler. +ADN-YFP, +Fibres pour (A) sur l’usine et (B) sur la puce. Contrôles : (C,D) -ADN-YFP, + Fibres ; (E,F) +ADN-YFP, -Fibres ; et (G,H) -ADN, −Fibres. (I) Graphique de l’intensité moyenne relative du signal de fluorescence de 25, 20 × 20 μm à partir d’images de 5 répétitions biologiques combinées à partir de 2-3 expériences utilisant la fluorescence du canal YFP. Les régions contenant des stomates (*) ont été exclues en raison de l’autofluorescence. L’intensité moyenne de fluorescence de la condition -ADN-YFP, -Fibres a été soustraite de chaque moyenne. L’ANOVA à 2 facteurs (et le test de Tukey) a été utilisée pour les tests de signification, et les barres d’erreur représentent l’erreur-type de la moyenne. Différentes lettres montrent des différences significatives entre les traitements (P < 0,0001). Toutes les images présentées sont des projections maximales de 40 μm z−stacks. Les barres d’échelle sont de 20 μm. Les flèches blanches indiquent les fibres dans les images. Le pas de la fibre est de 35 μm. Cette figure a été reproduite avec la permission de Morgan et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 14 : Transformation transitoire des oignons à l’aide de films VACNF. Les images ont été acquises par microscopie confocale 48 h après l’administration de l’ADN. À l’aide de la méthode sur puce, des gouttelettes d’ADN plasmidique de 1 μL codant pour pUBQ 10 :YFP (ADN-YFP) (200 ng) ont été séchées sur des films VACNF pendant10 minutes, qui ont ensuite été roulées sur les surfaces des organes végétaux. (A) L’ADN-YFP a été délivré et le YFP a été exprimé dans l’épiderme de l’oignon. (B) Pas de contrôle du traitement ; (C) contrôle (+ADN-YFP, -Fibres) et (D) contrôle (-ADN-YFP, +Fibres). Les barres d’échelle sont de 40 μm. Les fibres ont un pas de 35 μm. Les images sont des projections maximales de 115 μm z-stacks. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 15 : Lésions tissulaires de la laitue dues à l’application d’un film VACNF. (A-D) Les images ont été générées à l’aide de la microscopie confocale. (A) La méthode sur puce a été utilisée pour délivrer de l’ADN aux feuilles de laitue via des films VACNF. Des gouttelettes d’ADN pUBQ 10 :YFP (200 ng) ont été séchées pendant10 minutes sur des films VACNF, qui ont ensuite été roulées sur le côté abaxial des feuilles de laitue détachées et stockées dans une chambre d’humidité pendant 4 jours. (B) contrôle (-ADN-YFP, +Fibres). (C) contrôle (+ADN-YFP, -Fibres), et (D) aucun traitement (-ADN-YFP, -Fibres). Les barres d’échelle sont de 40 μm. Les VACNF ont un pas de 35 μm. Les flèches indiquent les dommages causés aux plantes par le roulage du substrat souple avec trop de force. Il convient de noter que l’administration réussie d’ADN médiée par VACNF dans la laitue a été obtenue dans d’autres expériences7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
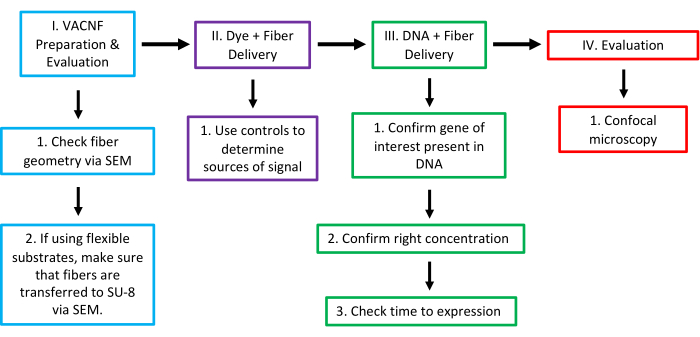
Figure 16 : Flux de travail de la livraison médiée par VACNF dans les usines. À l’étape I, vérifiez la géométrie des fibres à l’aide du MEB. Pour une bonne livraison, les fibres ont besoin d’une pointe d’un diamètre <200 nm. Si vous utilisez des fibres sur un substrat flexible, l’étape suivante consiste à confirmer que les fibres sont transférées au SU-8 et à vérifier la hauteur des fibres exposées via MEB. Au cours de l’étape II, nous avons testé l’utilité des fibres en essayant d’administrer le colorant dans la plante/l’organe de votre choix à l’aide d’un substrat rigide ou flexible. Utilisez une gouttelette de 1 μL, soit en la plaçant sur la surface de la plante, soit en la séchant brièvement sur la puce ou le film. Avec cette étape et toutes les autres, il est impératif d’utiliser les contrôles appropriés (-Colorant,-Fibres ; -Colorant, +Fibres ; et +Colorant,-Fibres) pour être sûr que le signal provient d’une administration de colorant de bonne foi. À l’étape III, confirmez que le gène d’intérêt est présent dans le plasmide, déterminez la concentration d’ADN à délivrer et testez le délai optimal après l’administration pour vérifier l’expression. Au stade IV, le résultat a été évalué à l’aide de la microscopie confocale pour vérifier l’expression du marqueur délivré. Ce chiffre a été modifié avec la permission de Morgan et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans cet article, nous avons présenté des méthodes permettant de construire des réseaux de nanofibres de carbone alignés verticalement, de transférer les fibres sur un substrat flexible et d’appliquer des fibres dans un substrat rigide ou flexible aux plantes pour les utiliser dans l’administration de biomolécules ou de colorants aux plantes. Nous avons décrit deux approches générales, la méthode sur puce et la méthode sur usine, pour le dépôt des matériaux introduits et avons montré des résultats positifs dans les fibres sur un substrat rigide ainsi que la méthode sur puce utilisant des films VACNF. L’application de ces fibres est plus simple en pratique et en théorie que les méthodes traditionnelles de transformation des plantes (bombardement de particules, transformation des protoplastes par PEG ou électroporation) et peut être utilisée pour les plantes récalcitrantes à la transformation médiée par Agrobacterium. Cependant, seules quelques cellules sont transformées.
Des nanofibres de carbone alignées verticalement ont été produites au Centre des sciences des matériaux nanophasés du Laboratoire national d’Oak Ridge dans le cadre de leur programme d’utilisation. Les utilisateurs peuvent demander à utiliser cette installation pour la production de VACNF. Alternativement, les puces VACNF peuvent être produites dans des salles blanches avec des machines de dépôt chimique en phase vapeur améliorées par plasma à courant continu avec une source de carbone22,23. Avec les méthodes décrites, il y a quelques étapes qui sont essentielles à la production des fibres, au transfert des fibres et à l’application des puces/films VACNF. Pour que l’application des fibres fonctionne, les fibres doivent être droites et avoir un diamètre effilé de <200 nm à l’extrémité pour que l’administration dans les cellules végétales soit réussie 6,7 (Figure 3). Pour créer des nanofibres de carbone d’une taille et d’un pas particuliers, il existe une variété de paramètres qui peuvent être modifiés, notamment la taille des points, le pas latéral et la quantité de catalyseur déposée. Pour sélectionner la taille de point optimale à utiliser pour la production de nanofibres de carbone, des fibres ont été cultivées à partir de différentes tailles de points (comme le montre la figure 5). Nous avons constaté que les diamètres de 300 nm produisaient les meilleures fibres, c’est pourquoi cette taille de point a été choisie (Figure 5). Après avoir trouvé les bons paramètres, nous avons cherché à utiliser des puces qui ont >50% de fibres avec la géométrie idéale (droite et un diamètre de pointe <200 nm). Pour vérifier la géométrie des fibres, nous avons utilisé la microscopie électronique à balayage pour imager des champs de vision aléatoires sur un échantillon de puces/films VACNF.
De plus, les fibres doivent avoir une certaine longueur minimale pour être livrées dans les cellules végétales. L’importance de produire des fibres de différentes longueurs est que des fibres plus longues pourraient être utilisées pour pénétrer dans les couches tissulaires plus profondes. Les fibres plus longues (>40 μm de longueur) sont essentielles pour les films flexibles, car le transfert des fibres fonctionne en cassant les fibres de leur base et nécessite de superposer du SU-8 sur les fibres. L’épaisseur de travail de la couche SU-8 utilisée pour ce protocole est de 20 à 35 μm. La hauteur minimale nécessaire pour réaliser l’accouchement dans l’épiderme de diverses plantes (courbes ou plates) est de 10 à 15 μm 6,7. Par conséquent, des fibres d’une longueur >40 μm sont nécessaires pour les films VACNF. Il y a plusieurs paramètres différents à prendre en compte lors de la production de nanofibres de carbone : le matériau du catalyseur, la géométrie du catalyseur, l’épaisseur du matériau du catalyseur ainsi que les conditions à l’intérieur de la chambre PECVD (rapport de gaz, pression, température, courant, hauteur de la pomme de douche et temps de croissance)8,9,24,25. Pour produire des nanofibres de carbone de plus de 25 μm utilisées par Morgan et al.7 et Davern et al.6, nous avons augmenté la quantité de catalyseur Ni, modifié le rapport acétylène/ammoniac et augmenté le courant et le temps de croissance. De plus, nous avons accordé plus d’attention à la géométrie du matériau du catalyseur. Pour produire de grandes fibres droites, le catalyseur déposé devait avoir la forme d’une rondelle de hockey plutôt qu’une forme semblable à celle d’un volcan (figure 4). Les structures volcaniques naissent des restes de résine photosensible après le décollage. Pour éviter la formation de volcans, une double couche de PMMA a été utilisée pour créer une contre-dépouille lors de la lithographie par faisceau d’électrons26. La contre-dépouille facilite le décollement du catalyseur métallique déposé (figure 2). La couche épaisse du catalyseur est importante pour la croissance des VACNF de grande taille. La morphologie des VACNF a été examinée par Merkulova et al.24. L’alignement vertical des VACNF est dû à la fois à la croissance de la pointe du catalyseur Ni et aux alignements du potentiel DC perpendiculaire au substrat (Figure 6). La pomme de douche décrit la géométrie du réacteur PECVD (Figure 6) et sert de source pour le potentiel du champ électrique27.
Pour définir le réseau de points catalyseurs avec la lithographie par faisceau d’électrons, nous avons appliqué une résine de faisceau d’électrons (polyméthacrylate de méthyle), puis utilisé le faisceau d’électrons pour faire de petits trous dans la résine avec une forme spécifique et à des endroits spécifiques sur la plaquette. Les trous du diamètre souhaité ont été placés sur une grille régulière avec l’espacement défini (pas) et un fichier spécifiant le motif souhaité a été chargé dans l’outil de lithographie par faisceau d’électrons avant de charger le substrat dans la machine. En plus de la hauteur des fibres, un autre paramètre critique pour un transfert réussi des fibres est le temps passé dans le bain d’acétone. Les films VACNF doivent être laissés dans le bain d’acétone suffisamment longtemps pour que leurs bords commencent à s’enrouler ; S’ils sont laissés dans le bain d’acétone trop peu de temps, ils sont plus difficiles à soulever des copeaux et peuvent se casser. Plus les copeaux sont vieux, plus ils devront rester longtemps dans le bain d’acétone. Après le bain d’acétone, les films/copeaux ont été placés dans de l’isopropanol et de l’eau pour éliminer l’acétone d’accès ainsi que pour éliminer la résine photosensible protectrice sur les fibres.
Pour effectuer le revêtement par centrifugation, les wafers ou les morceaux de wafer sont placés sur un mandrin à vide dans la vernisseuse et la position centrale de la plaquette est vérifiée à l’aide de la fonction de test de la vernisseuse. Une petite flaque d’eau (~2,5 cm de diamètre) de résine est appliquée au centre de la plaquette et filée (3000 tr/min pendant 45 s) Des images des fibres avant et après le revêtement par centrifugation sont incluses dans la figure 8 montrant la préservation de la géométrie de la fibre (hauteur, orientation et hauteur). La présence de fibres provoque un gonflement de la résistance à la base des fibres et entraîne des couches plus épaisses que prévu. L’enrobage de spin après la croissance de VACNF a été exploré par d’autres groupes11,18.
Une autre étape du processus qui est d’une importance vitale consiste à s’assurer que la bonne quantité de force est appliquée aux puces/films VACNF. Le mécanisme d’administration dépend des fibres qui font de petites perforations dans les parois cellulaires via la force d’impulsion de la pince à épiler en tapotant sur des substrats rigides 6,7 ou en roulant avec l’applicateur mini-maquillage sur des substrats souples. Les fibres peuvent ou non se détacher et rester incrustées dans les cellules végétales6,7 sans impact sur le résultat, mais une pratique en conjonction avec l’examen de l’absorption du colorant et des lésions tissulaires est nécessaire pour obtenir la bonne pression. De plus, il est important de choisir des points de temps d’imagerie appropriés après l’administration de l’ADN avec des puces/films VACNF, car le temps d’expression détectable varie selon les espèces végétales et les types de vecteurs délivrés7 (Figure 16).
Aussi largement applicable que soit cette méthode aux plantes, elle présente quelques limites. Par exemple, l’ajout d’une fine couche d’oxyde de silicium aux films VACNF n’entraîne pas toujours des films complètement hydrophiles en raison de la couche protectrice de résine photosensible ajoutée sur le dessus du SU-8. Si ce problème se matérialise, des couches plus épaisses d’oxyde de silicium pourraient être appliquées aux VACNF. Pour tester si les films sont hydrophobes ou hydrophiles, ils peuvent être placés dans l’eau. Si les films coulent, ils sont hydrophiles, et s’ils flottent, ils sont hydrophobes. De plus, il peut y avoir des variations entre les lots de fibres produites. Il y a plusieurs paramètres qui peuvent être modifiés lors de la croissance des fibres dans la machine dc-PECVD ; ce qui est décrit dans ce protocole est un ensemble de paramètres pour deux quantités différentes de catalyseur Ni. De plus, l’orientation cristalline du catalyseur Ni ne peut pas être contrôlée28 et une certaine ramification entraînera inévitablement la formation des fibres.
Bien que nous ayons démontré l’administration d’un colorant à la fluorescéine et d’ADN à des cellules végétales en utilisant des substrats rigides et flexibles pour cet article, la méthode devrait être largement applicable à d’autres biomolécules et approches de modification génétique, par exemple, le silençage de l’ARNi pour les systèmes végétaux comme les pommes ou d’autres fruits où il faudrait des années pour produire des lignées transgéniques stables. De plus, ces fibres pourraient également être utilisées pour fournir des matériaux d’édition génétique ou pour des transformations stables chez les plantes.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les réseaux de nanofibres ont été fabriqués au Centre des sciences des matériaux nanophasés, qui est une installation d’utilisation du Bureau des sciences du ministère de l’Énergie (ID de proposition : CNMS2019-103 et CNMS2022-A-1182). Le soutien du CNMS est accordé par le biais d’un système de proposition évalué par les pairs et est fourni gratuitement aux candidats retenus qui ont l’intention de publier leurs résultats (http://www.cnms.ornl.gov/user/becoming_a_user.shtml). Nous remercions Kevin Lester et CNMS pour leur aide dans la production de réseaux de nanofibres. Nous remercions le Dr John Caughmen, le Dr Timothy McKnight, la Dre Amber Webb, Daryl Briggs et Travis Bee pour leurs discussions critiques sur la conception expérimentale. Nous remercions le Dr Adam Rondinone pour le schéma de la machine PECVD. Nous remercions Leslie Carol pour les illustrations scientifiques. Ces travaux ont été financés par le Bioimaging Science Program, le département de l’Énergie des États-Unis, le Bureau de la science, de la recherche biologique et environnementale, DE-SC0019104, et le ministère de l’Agriculture des États-Unis, 2021-67013-34835. JMM a reçu le soutien du Département de l’agriculture des États-Unis : National Institute of Food and Agriculture : Agriculture and Food Research Initiative Predoctoral Fellowship 2021-67034-35167.
matériels
| Name | Company | Catalog Number | Comments |
| 13" x 13" White 1/4-fold heavy duty Brawny industrial shop towel 70Ct | Fastenal | 690535 | |
| 2-Propanol (IPA) | Fischer Scientific | A451-4 | |
| 4" Lid | Entegris | H22-401-0615 | Wafer Carriers |
| 4" tray | Entegris | H22-40-0615 | Wafer Carriers |
| Accretech SS10 dicing saw | Accreteck | SS10 | |
| Acetone | Fischer Scientific | A18-4 | |
| Acetone used in the cleanroom at ORNL | JT Baker | 9005-05 | |
| Apples | Grocery store | No product number | |
| Arabidopsis thaliana | Seeds of accession Columbia from the laboratory of Professor Jean Greenberg at the University of Chicago | No product number | |
| Carbon direct current plasma enhanced chemical vapor deposition machine | Oak Ridge National Laboratory | Custom-built | |
| Cobham Green lettuce | Seeds from the laboratory of Professor Richard Michelmore at the University of California, Davis | No product number | Butterhead lettuce |
| Fluorescein dye | Sigma Aldrich | F2456-2.5G | |
| Gel-box | Gel-Pak | AD-23C-00-X4 | |
| Heidelberg DWL 66 direct-write lithography tool | Heidelberg | DWL 66 | |
| ImageJ | National Institues of Health | No product number | |
| Isoproponal (IPA) used in the cleanroom at ORNL | Doe and Ingalls | CMOS Grade 9079-05 | |
| JEOL 9300FS 100kV electron beam lithography system | JEOL | 8100 | |
| Kimwipes | Kimtech | Kimberly-Clark Professional 34120 | |
| Kord-Valmark disposable polystyrene petri dish | VWR | 11019-554 | |
| Layout Editor | juspertor GmbH | No product number | |
| LSM 710 confocal microscope | Zeiss | No product number | |
| LSM 800 confocal microscope | Zeiss | No product number | |
| Make-up applicator | Amazon | G2PLUS | 500 PCS Disposable Micro Applicators Brush for Makeup and Personal Care (Head Diameter: 1.5 mm)- 5 x 100 PCS |
| Merlin field emission scanning electron microscope | Zeiss | Merlin | |
| MIBK/IPA (methyl isobutyl ketone/isopropanol) (1:3) | Microchem | M089025 | |
| Onions | Grocery store | No product number | |
| Oxford FlexAl atomic layer deposition | Oxford | FlexAl | |
| PMMA 495 A4 | Microchem | M130004 | |
| PMMA 950 A4 | Microchem | M230004 | Can dilute down to A2 |
| Polyethylene terephthalate (PET) | Amazon | KS-6304-21-11 | Type D Clear PET (Polyester) Sheet .0005" Thick x 27" Width x 10 Ft Length 1 pc |
| Precision tweezers | Aven Inc. | 18032TT | |
| pUBQ10:YFP-GW | Arabidopsis Biological Resource Center | CD3-1948 | |
| Silicon etcher (used for descum) | Oxford | Plasmalab | |
| Silicon rubber kit | Smooth-On Inc | Ecoflex 00-20 | |
| Silicon wafers | Pure Wafer | 4N0.001-.005SSP-INV | |
| Spin coater | Brewer Sciences | Model 100CB | |
| SPR 955cm 0.7 | Megaposit | 10018314 | |
| Strawberries | Grocery store | No product number | |
| SU-8 2015 | Microchem | SU-8 2000 Series | Toxic. Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| SU-8 developer | Microchem | SU-8 2000 Series | Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| Suss MicroTec contact aligner | Suss MicroTec | MA6/BA6 | |
| Table top microscope | Phenom XL | used for checking Ni catalysts after metal deposition | |
| Thermionics VE-240 e-beam evaporator | Thermionics | VE-240 |
Références
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Gou, Y. J., et al. Optimization of the protoplast transient expression system for gene functional studies in strawberry (Fragaria vesca). Plant Cell, Tissue, and Organ Culture. 141, 41-53 (2020).
- Baltes, N. J., Gil-Humanes, J., Voytas, D. F. Genome engineering and agriculture: Opportunities and challenges. Progress in Molecular Biology and Translational Science. 149, 1-26 (2017).
- Ren, R., et al. Highly efficient protoplast isolation and transient expression system for functional characterization of flowering related genes in Cymbidium orchids. International Journal of Molecular Sciences. 21 (7), 2264 (2020).
- Kumar, S., et al. Nanovehicles for plant modifications towards pest-and disease-resistance traits. Trends in Plant Science. 25 (2), 198-212 (2020).
- Davern, S. M., et al. Carbon nanofiber arrays: a novel tool for microdelivery of biomolecules to plants. PLoS One. 11 (4), e0153621 (2016).
- Morgan, J. M., et al. An efficient and broadly applicable method for transient transformation of plants using vertically aligned carbon nanofiber arrays. Frontiers in Plant Science. 13, 1051340 (2022).
- Melechko, A. V., et al. Vertically aligned carbon nanofibers and related structures: Controlled synthesis and directed assembly. Journal of Physics D: Applied Physics. 97, 041301 (2005).
- Melechko, A. V., Desikan, R., McKnight, T. E., Klein, K. L., Rack, P. D. Synthesis of vertically aligned carbon nanofibres for interfacing with live systems. Journal of Physics D: Applied Physics. 42 (19), 193001 (2009).
- Nelson-Fitzpatrick, N. . Novel Materials for the Design of Cantilever Transducers [dissertation]. , (2011).
- Fletcher, B. L., et al. Transfer of flexible arrays of vertically aligned carbon nanofiber electrodes to temperature-sensitive substrates. Advanced Materials. 18 (13), 1689-1694 (2006).
- Keller, S., Blagoi, G., Lillemose, M., Haefliger, D., Boisen, A. Processing of thin SU-8 films. Journal of Micromechanics and Microengineering. 18 (12), 125020 (2008).
- Wouters, K., Puers, R. Diffusing and swelling in SU-8: insight in material properties and processing. Journal of Micromechanics and Microengineering. 20 (9), 095013 (2010).
- Jamal, M., Zarafshar, A. M., Gracias, D. H. Differentially photo-crosslinked polymers enable self-assembling microfluidics. Nature Communications. 2, 527 (2011).
- Williams, R., Goodman, A. M. Wetting of thin layers of SiO2 by water. Applied Physics Letters. 25 (10), 531-532 (1974).
- Kundu, A., Nogueira Campos, M. G., Santra, S., Rajaraman, S. Precision vascular delivery of agrochemicals with micromilled microneedles (µMMNs). Scientific Reports. 9, 14008 (2019).
- Acanda, Y., Welker, S., Orbović, V., Levy, A. A simple and efficient agroinfiltration method for transient gene expression in Citrus. Plant Cell Reports. 40 (7), 1171-1179 (2021).
- Pearce, R., et al. Synthesis and properties of SiNx coatings as stable fluorescent markers on vertically aligned carbon nanofibers. AIMS Materials Science. 1 (2), 87-102 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crafts, A. S. Translocation in plants. Plant Physiology. 13 (4), 791 (1938).
- Martens, H. J., Hansen, M., Schulz, A. Caged probes: a novel tool in studying symplasmic transport in plant tissues. Protoplasma. 223, 63-66 (2004).
- Liu, J., Essner, J., Li, J. Hybrid supercapacitor based on coaxially coated manganese oxide on vertically aligned carbon nanofiber arrays. Chemistry of Materials. 22 (17), 5022-5030 (2010).
- Saleem, A. M., et al. Low temperature and cost-effective growth of vertically aligned carbon nanofibers using spin-coated polymer-stabilized palladium nanocatalysts. Science and Technology of Advanced Materials. 16, 015007 (2015).
- Merkulov, V. I., Lowndes, D. H., Wei, Y. Y., Eres, G., Voelkl, E. Patterned growth of individual and multiple vertically aligned carbon nanofibers. Applied Physics Letters. 76 (24), 3555-3557 (2000).
- Retterer, S. T., Melechko, A., Hensley, D. K., Simpson, M. L., Doktycz, M. J. Positional control of catalyst nanoparticles for the synthesis of high density carbon nanofiber arrays. Carbon. 46 (11), 1378-1383 (2008).
- Rooks, M. J., Wind, S., McEuen, P., Prober, D. E. Fabrication of 30-nm-scale structures for electron transport studies using a polymethylmethacrylate bilayer resist. Journal of Vacuum Science & Technology B: Microelectronics Processing and Phenomena. 5 (1), 318-321 (1987).
- Lee, G., Sohn, D. K., Seok, S. H., Ko, H. S. The effect of hole density variation in the PECVD reactor showerhead on the deposition of amorphous carbon layer. Vacuum. 163, 37-44 (2019).
- Fowlkes, J. D., et al. Control of catalyst particle crystallographic orientation in vertically aligned carbon nanofiber synthesis. Carbon. 44 (8), 1503-1510 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon