Method Article
Verwendung von vertikal ausgerichteten Kohlenstoff-Nanofaser-Arrays auf starren oder flexiblen Substraten zur Abgabe von Biomolekülen und Farbstoffen an Pflanzen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir Methoden zur Mikrofabrikation von vertikal ausgerichteten Kohlenstoffnanofasern (VACNFs), zur Übertragung von VACNFs auf flexible Substrate und zur Anwendung von VACNFs auf starren und flexiblen Substraten auf Pflanzen zur Verabreichung von Biomolekülen und Farbstoffen.
Zusammenfassung
Die Abgabe von Biomolekülen und undurchlässigen Farbstoffen an intakte Pflanzen ist eine große Herausforderung. Nanomaterialien sind aufstrebende Werkzeuge für die Verabreichung von DNA an Pflanzen. So spannend diese neuen Tools auch sind, sie müssen noch auf breiter Basis eingesetzt werden. Nanomaterialien, die auf starrem Substrat (Träger) hergestellt werden, lassen sich besonders schwer erfolgreich auf gekrümmte Pflanzenstrukturen aufbringen. Diese Studie beschreibt den Prozess zur Mikrofabrikation von vertikal ausgerichteten Kohlenstoff-Nanofaser-Arrays und deren Übertragung von einem starren auf ein flexibles Substrat. Wir beschreiben und demonstrieren, wie diese Fasern (entweder auf starren oder flexiblen Substraten) für die transiente Transformation oder die Verabreichung von Farbstoffen (z. B. Fluorescein) an Pflanzen verwendet werden können. Wir zeigen, wie VACNFs von einem starren Siliziumsubstrat auf ein flexibles SU-8-Epoxidsubstrat übertragen werden können, um flexible VACNF-Arrays zu bilden. Um die hydrophobe Natur von SU-8 zu überwinden, wurden die Fasern in der flexiblen Folie mit einer dünnen Siliziumoxidschicht (2-3 nm) beschichtet. Um diese Fasern für die Verabreichung an gekrümmte Pflanzenorgane zu verwenden, geben wir ein 1 μl großes Tröpfchen Farbstoff oder DNA-Lösung auf die Faserseite von VACNF-Folien, warten 10 Minuten, platzieren die Filme auf dem Pflanzenorgan und verwenden einen Tupfer mit einer Rollbewegung, um Fasern in Pflanzenzellen zu treiben. Mit dieser Methode haben wir die Farbstoff- und DNA-Abgabe in Pflanzenorgane mit gekrümmten Oberflächen erreicht.
Einleitung
Die Transformation von Pflanzen (sowohl vorübergehend als auch stabil) ist noch nicht in allen Pflanzengeweben und -arten allgemein erreichbar. Die transiente Transformation von Pflanzen ist ein Prozess, bei dem in Plasmiden kodierte Gene vorübergehend in Pflanzen eingebracht, aber nicht stabil in das Genom eingebaut werden. Herkömmliche Methoden, die Partikelbeschuss, Agrobakterien, Elektroporation oder Polyethylenglykolbehandlung von Protoplasten verwenden, sind langsam oder können umständlich sein. Darüber hinaus sind sie nicht auf alle Pflanzenarten anwendbar 1,2,3,4. Die Verwendung von Nanomaterialien für die DNA-Verabreichung ist ein aufkeimendes Feld, das noch in den Kinderschuhen steckt5. Nanomaterialien, insbesondere Kohlenstoff-Nanofasern, wurden auch erfolgreich eingesetzt, um Proteine, Dextrane und Farbstoffe an Pflanzenblätter zu liefern, ohne eine Wundreaktion zu verursachen6. Das Ziel dieser Arbeit ist es, ein detailliertes Protokoll für die Verwendung einer Art von Nanomaterial, Kohlenstoffnanofasern, für die Abgabe von Biomolekülen oder Farbstoffen an Pflanzen bereitzustellen. Hier konzentrieren wir uns auf die DNA als Biomolekül der Wahl, die die transiente Transformation von Zellen in verschiedenen pflanzlichen Organen ermöglicht.
Zuvor demonstrierten Morgan et al.7 die Verwendung von Kohlenstoffnanofasern, die auf starrem Siliziumsubstrat befestigt sind, um Blätter von Salat, N. benthamiana und Pappel sowie Blätter und Wurzeln von Arabidopsis vorübergehend umzuwandeln. Obwohl die Transformationen an einer Vielzahl von Organen erfolgreich waren, war es schwieriger, Fasern auf Pflanzengewebe mit gekrümmten Oberflächen wie Wurzeln oder Früchten aufzutragen. Wir kamen zu dem Schluss, dass ein flexibler Träger für Nanofasern deren Effizienz verbessern könnte, indem er sich besser an die Form des Organs anpasst.
Hier beschreiben wir Methoden, die für die Herstellung und das Design von vertikal ausgerichteten Kohlenstoffnanofasern, die Übertragung von VACNFs auf flexible Substrate und die Anwendung von VACNFs auf starren und flexiblen Substraten auf Pflanzen verwendet werden, um Biomoleküle und Farbstoffe zu liefern. Kohlenstoff-Nanofasern wurden mittels katalytischer, plasmaverstärkter chemischer Gasphasenabscheidung (dc C-PECVD) mit Ni-Katalysator hergestellt. Die Position, der Durchmesser und die Höhe der Ni-Katalysatorpunkte wurden mit einer Kombination aus Elektronenstrahllithographie, Metallverdampfung und Lift-off-Prozessen kontrolliert, wie von Melechko et al.8,9 beschrieben. Unter Verwendung eines doppelschichtigen Elektronenstrahlresists kann ein dickerer Ni-Katalysator auf dem Substrat abgeschieden werden, um längere Fasernzu erhalten 10. Der Fasertransfer von einem starren zu einem flexiblen Substrat basiert auf einer Modifikation der in Fletcher et al.11 beschriebenen Verfahren, wobei die derzeitigen Methoden auf die Verwendung einer amorphen Kohlenstoffschicht oder einer Opferfotolackschicht verzichten. SU-8 Lift-off mit Fasertransfer wird durch Ausnutzung der intrinsischen Zugspannung erreicht, die sich aus der Unter- und Unterbelichtung des SU-812,13,14 ergibt. SU-8, ein komplexes Polymer, ist von Natur aus hydrophob, was seine Verwendung zur Erleichterung der DNA-Verabreichung erschwert. Um der hydrophoben Natur von SU-8 entgegenzuwirken, tragen wir eine dünne Schicht Siliziumoxid über Atomlagenabscheidung15 auf, nachdem die Fasern in SU-8 eingebettet wurden. Das Auftragen von Fasern auf ein starres Substrat für die Verabreichung von Biomolekülen/Farbstoffen nutzt die Aufprallkraft des Pinzettenklopfens, die in Davern et al.6 beschrieben ist, und die in Morgan et al.7 beschriebenen On-Plant- und On-Chip-Methoden. Flexible VACNF-Folien werden auf gekrümmte Pflanzenoberflächen aufgebracht, indem zuerst DNA oder Farbstofftröpfchen auf der Folie halbgetrocknet werden, wie bei der On-Chip-Methode von Morgan et al.7und dann die Folien auf gekrümmten Pflanzenoberflächen mit einem kleinen Make-up-Applikator16,17 gerollt werden. Abbildung 1 zeigt verschiedene Ansätze zum Auftragen von Fasern in starren und flexiblen Substraten auf Pflanzen.
Protokoll
1. VACNF-Produktion (Abbildung 2 und Abbildung 3)
- Schleudern Sie einen Siliziumwafer mit Polymethylmethacrylat (PMMA) 495 A4 bei 4000 U/min und backen Sie ihn bei 180 °C für 5 min.
HINWEIS: Lassen Sie den Wafer 10 Sekunden lang abkühlen, bevor Sie mit dem nächsten Schritt fortfahren. - Eine zweite Schicht Resist (PMMA 950 A2) schleudern und bei 180 °C 5 min backen.
- Mittels Elektronenstrahllithographie werden die Katalysatorpunkte mit Durchmessern von 300 nm bei einem vorgegebenen lateralen Abstand (Rastermaß: 10 μm oder 35 μm) in 3 mm x 3 mm großen Arrays definiert.
- Entwickeln Sie den Resist in 30-40 ml 1:3-Methylisobutylketon: Isopropylalkohol (IPA) für 1,5 Minuten, spülen Sie ihn anschließend mit IPA und trocknen Sie ihn mitN2.
HINWEIS: Überprüfen Sie die Anordnung der Punkte mit einem Hellfeldmikroskop (20-fach-Objektiv). - Reinigen Sie den Wafer von dem Restresist mit einer 6-s-Belichtung in Sauerstoffplasma (Descum) in einem Siliziumätzer.
- Mit Hilfe der Elektronenstrahlverdampfung wird zuerst eine Klebeschicht aus Metall (Ti oder Cr, 10 nm) und dann eine zweite Schicht, der Ni-Katalysator (130 nm oder 150 nm), abgeschieden. Halten Sie während der Ti- oder Ni-Metallabscheidung den Strom unter 0,2 A bei 10 kV, den Druck unter 5 x 10-6 Torr und die Abscheiderate bei ~1 A/s für die Abscheidung in Sichtlinie.
- Verwenden Sie eine sequentielle Badbeschallung, um das Metall (Ni) zu entfernen, das sich auf der darunter liegenden Resistschicht abgeschieden hat, so dass das Ni direkt auf dem Siliziumwafer abgeschieden bleibt. Dieser Vorgang wird als Lift-off bezeichnet.
- Bereiten Sie dazu 3 Behälter mit Aceton vor und beschallen Sie die Waffel 1 Minute lang in Aceton; 3 Mal bei Raumtemperatur (RT, 20 °C) mit einer Frequenz von 35 kHz wiederholen. Mit IPA abspülen und mit N2 trocknen.
HINWEIS: Lassen Sie niemals Aceton auf dem Wafer trocknen. Nach der letzten Acetonbeschallung sofort mit IPA abspülen und dann mitN2-Gas trocknen. Wenn der Wafer zu irgendeinem Zeitpunkt vorzeitig trocken wird (vor der IPA-Spülung), besteht die Möglichkeit, dass nicht das gesamte überschüssige Metall und der Resist entfernt werden und das Aceton Rückstände hinterlassen kann.
- Bereiten Sie dazu 3 Behälter mit Aceton vor und beschallen Sie die Waffel 1 Minute lang in Aceton; 3 Mal bei Raumtemperatur (RT, 20 °C) mit einer Frequenz von 35 kHz wiederholen. Mit IPA abspülen und mit N2 trocknen.
- Überprüfen Sie die Geometrie der Katalysatorform mit Hilfe der Rasterelektronenmikroskopie (REM). Um REM-Bilder der VACNF-Chips aufzunehmen, neigen Sie den Tisch in einem Winkel von 30° und verwenden Sie eine Spannung von 1-3 kV mit einem Strahlstrom von ~100 pA und einem Arbeitsabstand von ~5 mm.
HINWEIS: Der Katalysator sollte wie ein Hockeypuck (ein kompakter Zylinder) aussehen (Abbildung 4). Die Höhe des kompakten Zylinders sollte die Dicke des auf dem Siliziumwafer abgeschiedenen Ni widerspiegeln. Wenn das Profil des Ni-Punktes hoch ist und an der Spitze konkav erscheint, ähnlich wie bei einem Vulkan (Abbildung 4), ist es wahrscheinlicher, dass der Katalysator in mehrere Ni-Tröpfchen zernetzt, was zu einer Verzweigung der Kohlenstoffnanofasern9 führt (Abbildung 4 und Abbildung 5). Solche Probleme können sich aus dem Schmelzen des Lacks während der Metallverdampfung aufgrund langer Abscheidungszeiten oder Problemen mit dem Abhebevorgang ergeben (Abbildung 4 und Abbildung 5). - Vierteln Sie den Siliziumwafer und legen Sie ihn mit dem Acetylen/Ammoniak-Gemisch in die mit Gleichstromplasma unterstützte chemische Gasphasenabscheidungskammer (dc-PECVD). Optimieren Sie die Wachstumsparameter, um die Länge und Verjüngung von Nanofasern (Spitzen <200 nm) zu kontrollieren.
- Verwenden Sie einen Strom von 1-1,5 A und einen Spannungsbereich von 440-560 V. Verwenden Sie beim Anbau der Fasern eine Vorbehandlungsphase mit Ammoniakfluss, während Maschine und Substrat auf 620 °C erhitzt werden. Stellen Sie sicher, dass Sie die Kohlenstoffquelle (Acetylen) 10 s einschalten, bevor Sie das Plasma starten.
HINWEIS: Viertelwafer werden verwendet, wenn die PECVD-Maschinenlaufparameter optimiert werden müssen. Zur Herstellung von Fasern mit Längen von mehr als 40 μm und Spitzen mit einem Durchmesser von weniger als 200 nm werden die folgenden Parameter vorgeschlagen: Bei einer Ni-Katalysatordicke von 130 nm wird ein Strom von 1,75 A, eine Wachstumszeit von 70 min und ein Acetylen-Ammoniak-Verhältnis von 45 Standardkubikzentimetern pro Minute (sccm) : 100 sccm verwendet. Bei einer Ni-Dicke von 150 nm ist ein Strom von 1,5 A, eine Wachstumszeit von 80 min und ein Acetylen-Ammoniak-Verhältnis von 48 sccm : 100 sccm zu verwenden. Verwenden Sie die folgenden Parameter, um VACNFs unabhängig von der Katalysatordicke zu züchten: Wachstumstemperatur von 620 °C, Druck von 10 Torr während des Plasmas und eine Duschkopfhöhe von 20 mm (Abbildung 6).
- Verwenden Sie einen Strom von 1-1,5 A und einen Spannungsbereich von 440-560 V. Verwenden Sie beim Anbau der Fasern eine Vorbehandlungsphase mit Ammoniakfluss, während Maschine und Substrat auf 620 °C erhitzt werden. Stellen Sie sicher, dass Sie die Kohlenstoffquelle (Acetylen) 10 s einschalten, bevor Sie das Plasma starten.
- Beurteilen Sie die Geometrie der resultierenden Fasern mit REM bei einer Neigung von 30° mit einem Beschleunigungspotenzial von 1 kV.
HINWEIS: Optimale Fasern sind gerade und nicht verzweigt. Es ist unmöglich, die Kristallorientierung des Ni-Katalysators mit dem Elektronenstrahlverdampfer zu kontrollieren. Infolgedessen gibt es einige Fasern, die sich aufgrund der Entnetzung des Katalysatorsverzweigen 9. Außerdem führt die Kristallorientierung dazu, dass die VACNFs auf unterschiedliche Höhen wachsen, so dass einheitliche Höhen auf allen VACNFs schwierig sind. - Eine Schicht Fotolack (SPR955) wird mit 1000 U/min für 45 s auf die Fasern geschleudert. Anschließend den 1/4 Wafer mit einer Würfelsäge in 3 mm x 3 mm große Arrays würfeln. Bewahren Sie die Fasern an dieser Stelle für die spätere Verwendung auf.
HINWEIS: Führen Sie Schritt 1.11 nicht durch, wenn Sie planen, Fasern auf ein flexibles Substrat zu übertragen.
2. Übertragenvon VACNFs auf ein flexibles Substrat (Abbildung 7 und Abbildung 8)
- Nachdem die Fasern synthetisiert wurden, wird der Fotolack SU-8 2015 45 s lang bei 4000 U/min auf die Wafer oder Viertelwafer aufgetragen.
- Die Waffel 3 min bei 95 °C weichbacken.
- Belichten Sie den Wafer mit einem Kontakt-Aligner mit einer 3 mm 3 mm großen Array-Maske, die mit dem definierten Muster aus der Elektronenstrahllithographie bei 95 mJ/cm2 übereinstimmt.
HINWEIS: Verwenden Sie einen Proximity-Kontaktmodus mit einem Belichtungsabstand, der 20 μm größer ist als der der höchsten Faser. Es besteht die Möglichkeit, dass bei diesem Prozessschritt Fasern umgestoßen werden. - Nach der Belichtung 6 Minuten bei 95 °C backen.
- Entwickeln Sie den Wafer 15 s lang im SU-8-Entwickler, spülen Sie ihn mit IPA ab und trocknen Sie den Wafer mit N2, wobei Sie sich von oben nach unten bewegen.
HINWEIS: Stellen Sie bei der Entwicklung des Wafers sicher, dass er vollständig eingetaucht ist. - Wafer mit Spincoat-Muster mit einer Schutzschicht aus dünnem Fotolack (SPR 955 CM 0,7) bei 3000 U/min für 45 s und Softbake für 30 s bei 90 °C.
- Eine dünne Siliziumoxidschicht (2-3 nm) wird auf den Wafer aufgebracht, indem er für 22 Zyklen bei 100 °C in eine Atomlagenabscheidung gebracht wird.
- Schneiden Sie den Wafer mit einer Würfelsäge in 3 mm x 3 mm große Quadrate. Richten Sie die Würfelsäge auf das bereits vorhandene Muster auf dem Wafer aus.
- Beurteilen Sie die Geometrie der resultierenden Fasern mit REM bei einer Neigung von 30° mit einem Beschleunigungspotenzial von 3 kV.
- Stoppen Sie hier, wenn Sie Chips für den langfristigen Gebrauch (>1 Woche) aufbewahren. Bewahren Sie Chips im Dunkeln auf.
- Um flexible Substrate von starren Substraten zu trennen, legen Sie einzelne Chips für 30 Minuten in Aceton oder bis sich der SU-8 zu kräuseln beginnt.
- Waschen Sie SU-8-Folien (entweder auf starren Substraten befestigt oder von diesen gelöst) 5 Minuten lang mit IPA und dann 5 Minuten lang mit Wasser. Legen Sie die Chips beim Transport in eine handelsübliche Box mit einem Klebepad.
- OPTIONAL: Legen Sie die faserlose Seite der SU-8-Folie auf ein wasserlösliches Klebeband oder auf einen dünnen Silikonkautschuk mit einer dünnen Rückseite aus Polyethylenterephthalat (PET) (12,5 μm dick).
- Verwenden Sie eine Pinzette, um den SU-8-Film zu übertragen. Drücken Sie auf die Kanten des SU-8-Quadrats, damit es auf dem Klebeband/Silikonkautschuk-PET haftet; Damit soll verhindert werden, dass Fasern abbrechen. Zu diesem Zeitpunkt sind die VACNF-Folien sofort einsatzbereit.
- Um einen Silikonkautschuk/PET-Halter herzustellen, gehen Sie wie folgt vor: Mischen Sie mit einem 2-teiligen Set für Silikonkautschuk die beiden Teile (das Elastomer und den Vernetzer) miteinander. Schneide als Nächstes ein Quadrat aus PET aus und klebe es in eine durchsichtige Plastikschale. Gießen Sie eine sehr dünne Schicht Silikonkautschuk auf das PET und härten Sie es bei 80 °C für 1-2 h aus.
3. On-Plant-Methode (bei der ein Tropfen der zu verabreichenden Lösung auf eine Pflanzenoberfläche gegeben wird) unter Verwendung von Fasern in einem starren Substrat (Abbildung 1A)
- Entfernen Sie den Fotolack vor Gebrauch mit inkrementellen Waschungen von Aceton (100 %, 5 min), IPA (100 %, 5 min) und ddH2O (5 min).
- Legen Sie das Pflanzengewebe, das aufgespießt werden soll, zur Unterstützung auf eine harte Oberfläche.
- Geben Sie einen 1 μl-Tropfen Farbstoff oder DNA (200 ng) auf die Oberfläche des Pflanzengewebes.
- Platzieren Sie einen VACNF-Chip mit einem starren Substrat auf der Oberseite des Tröpfchens, wobei die Fasern so ausgerichtet sind, dass sie mit dem Tröpfchen in Kontakt kommen.
HINWEIS: Die Ausrichtung der Chips kann durch den "Glanz" des Wafers bestimmt werden. Die glänzende Seite des Chips hat Fasern, die undurchsichtige Seite nicht. - Tippen Sie mit der flachen Seite einer Pinzette auf den Chip. Markieren Sie den Bereich der Pflanze, mit dem der Chip in Berührung gekommen ist, mit einem weichen Marker. Entfernen Sie die VACNF-Chips nach der Lieferung.
HINWEIS: Die Kraft, die beim Klopfen ausgeübt wird, hängt von der Art des verwendeten Pflanzengewebes ab. Es wird empfohlen, das Klopfen von Spänen vor dem Aufspießen von Fasern zu üben. Vermeiden Sie Schäden am Pflanzengewebe. Die Schädigung wird deutlich, wenn man die Umrisse des VACNF-Chips im Pflanzengewebe erkennen kann. - Wiederholen Sie die Schritte 3.1 bis 3.5 für die Kontrollen (+Farbstoff/DNA, -Fasern; -Farbstoff/DNA, +Fasern; und -Farbstoff/DNA, -Fasern). -Fasern ist die faserlose Seite eines Chips.
- Lagern Sie intakte Pflanzen oder herausgeschnittene Pflanzenorgane bei Bedarf in feuchten Kammern unter Langzeitbedingungen (16 h hell, 8 h dunkel). Verwenden Sie für entfernte Organe eine Petrischale aus Kunststoff mit nassen Papiertüchern.
4. On-Chip-Methode (bei der ein Tropfen der zu liefernden Lösung auf einen VACNF-Chip gegeben wird), starres Substrat (Abbildung 1B)
- Entfernen Sie den Fotolack vor Gebrauch mit inkrementellen Waschungen von Aceton (100 %, 5 min), IPA (100 %, 5 min) und ddH2O (5 min).
- 1 μl Tröpfchen Farbstoff- oder Plasmid-DNA (200 ng) auf die Faserseite des VACNF-Chips mit starrem Substrat tropfen. Stellen Sie sicher, dass Sie das Tröpfchen in der Mitte des Chips platzieren und mehrere Fasern abdecken. Lassen Sie den Tropfen 15 Minuten trocknen.
HINWEIS: Die Ausrichtung der Chips kann durch den "Glanz" des Wafers bestimmt werden. Die glänzende Seite des Chips hat Fasern, die undurchsichtige Seite nicht. - Wenn Sie mit Blättern oder anderen herausgeschnittenen Organen arbeiten, legen Sie sie auf eine harte Oberfläche. Wenn Sie mit intakten Pflanzen arbeiten, legen Sie eine harte Oberfläche unter das Organ, auf das VACNFs aufgetragen werden.
- Nach dem 15-minütigen Trocknungsschritt positionieren Sie den VACNF-Chip so, dass die Faserseite mit dem Pflanzengewebe in Kontakt kommt. Tippe mit dem hinteren Ende einer Pinzette auf den Chip.
HINWEIS: Die Kraft, die beim Klopfen ausgeübt wird, hängt von der Art des verwendeten Pflanzengewebes ab. Es wird empfohlen, das Klopfen von Chips zu üben. - Wiederholen Sie die Schritte 3.6-3.7 der On-Plant-Methode.
5. Auftragen von VACNFs in SU-8-Filmen auf Pflanzengewebe mit der On-Chip-Methode (Abbildung 1C)
- Geben Sie 1 μl Tröpfchen Farbstoff oder DNA (200 ng) auf die Faserseite der SU-8-Folie und lassen Sie sie 10 Minuten trocknen. Achten Sie darauf, das Tröpfchen in der Mitte des Chips zu platzieren.
HINWEIS: Je nach verwendetem Substrat gibt es unterschiedliche Trocknungszeiten. - Legen Sie die VACNF-Folie mit einer scharfen Pinzette auf die Pflanzenoberfläche.
HINWEIS: Je länger die SU-8-Filme in der Luft bleiben, desto spröder werden die Filme. Um das Risiko des Verlusts der SU-8-Folien zu begrenzen, stellen Sie sicher, dass sich alle Pflanzen/Proben und Geräte in der Nähe der SU-8-Folien befinden. - Rollen Sie vorsichtig einen kleinen Make-up-Applikator über die VACNF-Folie. Markieren Sie die Bereiche, in denen die flexiblen Substrate platziert werden, mit einem weichen Marker. Entfernen Sie die flexiblen Substrate mit Klebeband von der Pflanzenoberfläche.
HINWEIS: Die Kraft, die beim Rollen des Make-up-Applikators ausgeübt wird, variiert je nach verwendetem Pflanzengewebe. Üben Sie das Auftragen der VACNF-Folien vor der Verabreichung von Biomolekülen oder Farbstoffen. Sichtbare Schäden am Pflanzengewebe sind offensichtlich, wenn man die Umrisse der VACNF-Folie im Pflanzengewebe erkennen kann. - Wiederholen Sie die Schritte 5.1 bis 5.3 für Kontrollen und Lagerpflanzen, wie in Schritt 3.7 der On-Plant-Methode beschrieben.
6. Mikroskopie und Bildanalyse für alle Verabreichungsmethoden
- Bilden Sie die Proben mit einem konfokalen Mikroskop unter Verwendung von Emissions- und Anregungswellenlängen ab, die für die gelieferte Fluoreszenzsonde/den mitgelieferten Fluoreszenzreporter geeignet sind.
HINWEIS: Die Zeit, die für die transiente Transformation benötigt wird, hängt von der Pflanzenart und dem gelieferten Marker ab. Zum Beispiel wurde die Expression von Fluoreszenzmarkern nach 48 h in Arabidopsis im Vergleich zu 96 h in Salatblättern nachgewiesen7. - Versuchen Sie bei der Bildgebung, sich auf eine Region mit abgelösten Fasern zu konzentrieren. Die Fasern haben unterschiedliche Ausrichtungen. Der Erfolg der Entbindung hängt nicht vom Auftreten abgebrochener Fasern ab.
HINWEIS: Die Fasern werden aufgrund der Bildung einer Siliziumnitridschicht, die aus der Faserbildung in PECVD18 resultiert, mit den gängigsten Anregungs-/Emissionseinstellungen fluoreszieren. - Nehmen Sie mindestens 5 Bilder für jede Probe auf. Das resultierende Signal variiert.
- Messen Sie die Fluoreszenzwerte als Gesamtfluoreszenz (integrierte Dichte) in konfokalen Bildbereichen von 20 μm x 20 μm7 mit BildJ 19.
Ergebnisse
Der entscheidende Vorteil von VACNF-Chips auf starren oder flexiblen Substraten ist die Fähigkeit, Biomoleküle oder Farbstoffe an bestimmte Stellen einer Pflanze zu bringen (Abbildung 1). Hier haben wir Fluoreszenzmessungen verwendet, um die Verabreichung zu beurteilen. Bei Verwendung verschiedener Pflanzen, Substrate und Verabreichungsmethoden (On-Chip oder On-Plant) kann es Unterschiede im Zeitpunkt des Auftretens von Farbstofffluorescein geben. Um festzustellen, ob VACNF-Chips/-Folien für die Verabreichung geeignet sind, besteht ein schneller Ansatz darin, Fasern für die Farbstoffabgabe zu verwenden (Abbildung 9). Bilder, die in Abbildung 9 mit unterschiedlichen Zeiten beschriftet sind, weisen unterschiedliche Sichtfelder derselben Stichproben auf. Bei der On-Plant-Methode kann der Fluoresceinfarbstoff sofort nach der Entbindung mittels Fluoreszenzmikroskopie beobachtet werden. Wenn das gleiche Sichtfeld im Laufe der Zeit nach der Verabreichung des Fluoresceinfarbstoffs an eine Pflanze abgebildet wird, wird die Signalintensität mit der Zeit weniger hell (Abbildung 10). Der Fluorescein-Farbstoff könnte möglicherweise durch Plasmodesmata20,21 aus dem Sichtfeld in andere Bereiche des Blattes wandern. Im Vergleich zur On-Plant-Methode bewegt sich der Farbstoff bei der On-Chip-Methode mit Fasern auf dem starren Substrat langsamer durch den aufgespießten Bereich (Abbildung 9). Dies könnte darauf zurückzuführen sein, dass sich der Farbstoff von den Fasern löst/in den Zellen rehydriert und daher mehr Zeit benötigt, um sich zu bewegen.
Die Fasern im flexiblen Substrat eigneten sich für die Farbstoffabgabe an gekrümmte Oberflächen wie Erdbeeren und Äpfel (Abbildung 11 und Abbildung 12). Bei Verwendung eines flexiblen Substrats mit Erdbeeren wurde sofort ein starkes Fluorescein-Signal beobachtet (Abbildung 11), während es 2 h dauerte, bis ein starkes Fluorescein-Signal in Äpfeln zu sehen war (Abbildung 12B,D). Die erfolgreiche Verabreichung von Plasmiden, die für Fluoreszenzmarker kodieren, kann mit Hilfe der Fluoreszenzmikroskopie bestimmt werden, um das resultierende Signal zu finden (Abbildung 12F, Abbildung 13 und Abbildung 14). Kontrollen sind notwendig, um festzustellen, ob die Pflanze der Wahl keine Autofluoreszenz aufweist, die dem fluoreszierenden Marker ähnelt, den wir durch Fasern abgeben möchten. Die alleinige Verwendung von Fasern ist hilfreich, um festzustellen, ob die mit einer Pinzette aufgebrachte Aufprallkraft zu einer Schädigung des Pflanzengewebes führt oder ob die beobachtete Fluoreszenz innerhalb der Probe auf die VACNFs zurückzuführen ist, die aufgrund ihrer Siliziumnitridschicht18 von Natur aus fluoreszierend sind (Abbildung 13C-D). Fasern, die in Pflanzengewebe aufgespießt sind, induzieren keine Wundreaktion, wie durchH2O2-Produktion6 beurteilt. Schließlich ist die Verwendung der Kontrolle von +DNA, -Fasern notwendig, um zu bestätigen, dass die DNA nicht allein durch Klopfen in die Pflanze gelangt, und um zu bestätigen, dass die Fasern für die Abgabe in Pflanzenzellen notwendig sind (Abbildung 13E-F). Bei der Verwendung der On-Plant- oder On-Chip-Verabreichungsmethoden mit den VACNFs auf einem starren Substrat sollte es keinen deutlichen Unterschied geben, was durch das Fehlen eines signifikanten Unterschieds in den Fluoreszenzwerten angezeigt wird (Abbildung 13I). Die Verwendung der flexiblen VACNF-Filme mit On-Chip-DNA-Abgabe führte zu einer erfolgreichen transienten Transformation von Epidermiszellen in gekauften Äpfeln und Zwiebeln (Abbildung 12F und Abbildung 14).
Bei fehlgeschlagenen Experimenten können Fasern in verschiedenen Sichtfeldern abgebrochen sein, aber es wird kein Fluoreszenzsignal aus dem Versuch resultieren, Plasmid-DNA oder Farbstoff zu liefern. Wenn zu viel Druck auf die Pflanze ausgeübt wird, kommt es zu einer sichtbaren Gewebeschädigung (Abbildung 15). Diese mechanischen Beschädigungen können wie kleine Löcher oder durchsichtige Bereiche in der Pflanze aussehen, als ob eine Zellschicht entfernt worden wäre, wenn man die Pflanze unter dem Mikroskop betrachtet. Manchmal sind Abdrücke des Chips sichtbar. Ein Experiment, bei dem die Expression fluoreszierender Proteine nach der DNA-Abgabe nicht nachgewiesen wird, kann auch auf die Verwendung von minderwertiger DNA zurückzuführen sein, so dass es nützlich sein kann, frische DNA herzustellen.
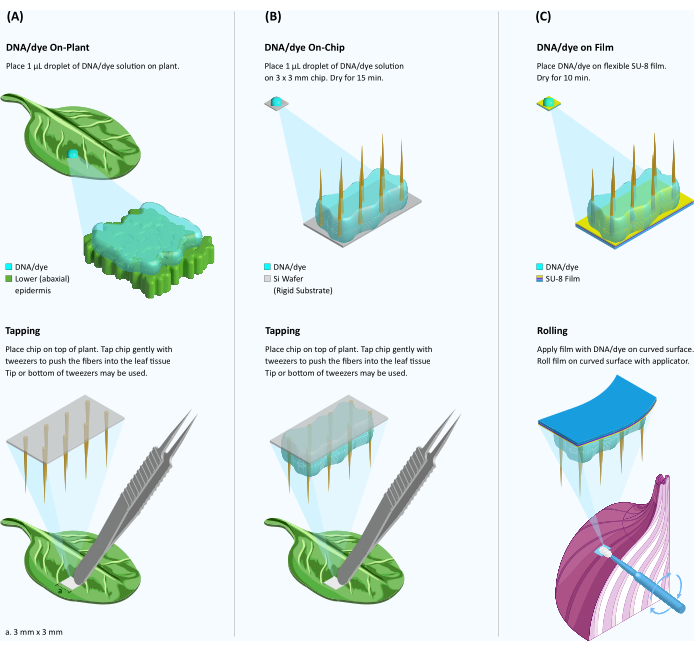
Abbildung 1: Schematische Darstellung der Farbstoff-/DNA-Abgabe an Pflanzengewebe unter Verwendung von Fasern auf starren und flexiblen Substraten . (A) Pflanzliche, faservermittelte Farbstoff-/DNA-Abgabe. Ein 1-μl-Tröpfchen Farbstoff/DNA-Lösung wird auf die Oberfläche eines Blattes gegeben und der VACNF-Chip wird auf das Tröpfchen gelegt. Mit einer Pinzette wird der Chip vorsichtig in das Gewebe geklopft. Das starre Substrat wird entfernt, so dass Nanofasern im Gewebe verbleiben. (B) On-Chip-faservermittelte DNA-Verabreichung. Ein 1-μl-Tröpfchen Farbstoff oder DNA-Lösung wird auf den VACNF-Chip gegossen und 15 Minuten lang getrocknet. Der Chip mit halbgetrockneter DNA wird auf die Blattoberfläche gelegt und wie in Tafel A in das Gewebe geklopft. (C) On-Chip-SU-8-Film-DNA-Verabreichung. Die Fasern werden vom starren Siliziumsubstrat auf einen flexiblen SU-8-Träger übertragen. Ein 1-μl-Tröpfchen Farbstoff/DNA-Lösung wird auf die VACNF-Folie gegossen und 10 Minuten lang getrocknet. Die VACNF-Folie mit dem halbgetrockneten Farbstoff/der DNA wird dann mit einem Make-up-Applikator auf eine gekrümmte Pflanzenoberfläche gerollt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
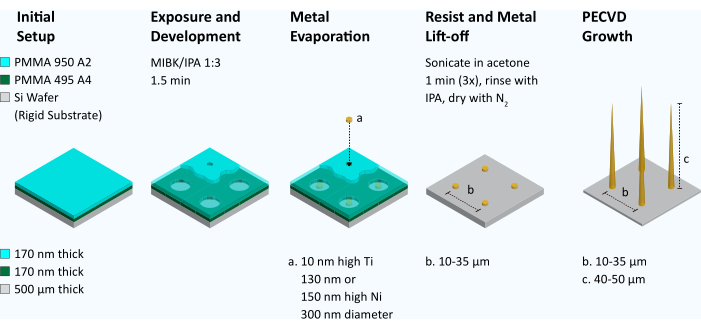
Abbildung 2: Arbeitsablauf zur Herstellung vertikal ausgerichteter Kohlenstoff-Nanofaser-Arrays. Zur Herstellung von VACNFs wird eine Doppelschicht aus Polymethylmethacrylat (PMMA 495 A4 gefolgt von PMMA 950 A2) auf einen Siliziumwafer geschleudert. Die Elektronenstrahllithographie wird verwendet, um eine Anordnung von Punkten mit einem Durchmesser von 300 nm zu definieren. Der Resist wird dann in Methylisobutylketon/Isopropanol (MIBK/IPA) 1:3 für 1,5 min entwickelt. Mit Hilfe eines Metallverdampfers wird eine Klebeschicht aus Ti (10 nm) auf den Wafer aufgebracht, gefolgt von einer Schicht aus Ni (130 nm oder 150 nm). Der verbleibende Resist wird dann durch Lift-Off (Badbeschallung in Aceton) entfernt. Die Geometrie der Katalysatorpunkte wird mittels REM inspiziert. Wenn die Katalysatoren Eishockey-Pucks ähneln und flach sind, werden sie in die plasmaunterstützte chemische Gasphasenabscheidung (PECVD) gegeben und Fasern gezüchtet. Anschließend wurden die Fasern mittels REM inspiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: REM-Aufnahmen von idealen vertikal ausgerichteten Kohlenstoff-Nanofasern . (A) Elektronenmikroskopische Aufnahme von VACNFs mit einem Abstand von ~35 μm und einer Höhe von 10-15 μm, aufgenommen in einem Winkel von 30°. Dieses Bild ist in Abbildung 7C dupliziert. (B) Elektronenmikroskopische Aufnahme von VANCFs mit ~20 μm Pitch und 20-30 μm Höhe, aufgenommen in einem Winkel von 30°. (C) Elektronenmikroskopische Aufnahme von VANCFs mit ~35 μm Pitch, 50-60 μm Höhe, aufgenommen in einem Winkel von 30°. (D) Elektronenmikroskopische Aufnahme der VACNF-Spitze mit einem Durchmesser <200 nm. Es gibt Variationen in den Durchmessern der Faserspitzen (150-300 nm). Da die Fasern in einem Winkel von 30° aufgenommen wurden, scheinen die Höhen um den Faktor sin(30°)=1/2 kleiner zu sein als die tatsächliche Höhe. Die Tafeln A und B wurden mit Genehmigung von Morgan et al.7 nachgedruckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
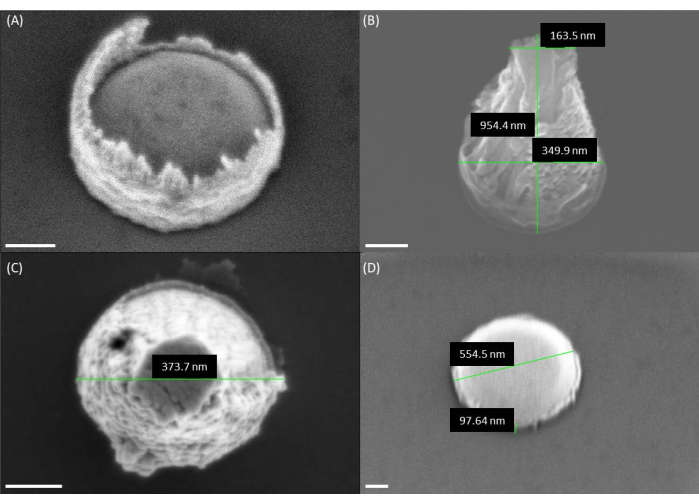
Abbildung 4: REM-Bilder der Katalysatorgeometrie vor dem Wachstum von VACNFs. (A) REM-Aufnahme des Katalysators nach dem Abheben. Beachten Sie, dass sich am Rand des Katalysators Fotolack befindet, was zu einer Vulkanform führt. (B,C) REM-Bilder zeigen die vulkanischen Formen des Katalysators nach der Verwendung eines einschichtigen PMMA-Resists. (D) Gewünschte Form des Hockey-Puck-Katalysators aus doppelten PMMA-Schichten. Da die Fasern in den Panels A, B und D in einem Winkel von 30° abgebildet wurden, scheinen die Höhen um den Faktor sin(30°) = 1/2 kleiner zu sein als die tatsächliche Höhe. Maßstabsbalken stellen 100 nm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Einfluss der Katalysatorpunktgröße auf das Faserwachstum: Um den optimalen Durchmesser des Katalysatormaterials zu ermitteln, wurden Fasern aus Punktgrößen von 200-600 nm gezüchtet. Punktgrößen von 400-600 nm führten zu einer Entnetzung des Katalysators und zum Wachstum mehrerer Fasern. Die beste Fasergeometrie wurde bei 300 nm Durchmesser erzeugt. Kleinere Punkte führten zu einer unzureichenden Faserhöhe. Aufgrund der Tatsache, dass die Fasern in einem Winkel von 30° aufgenommen wurden, scheinen die Höhen um den Faktor sin(30°) = 1/2 kleiner zu sein als die tatsächliche Höhe. Die Aufnahmen erfolgten mittels rasterelektronenmikroskopischer Aufnahme. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
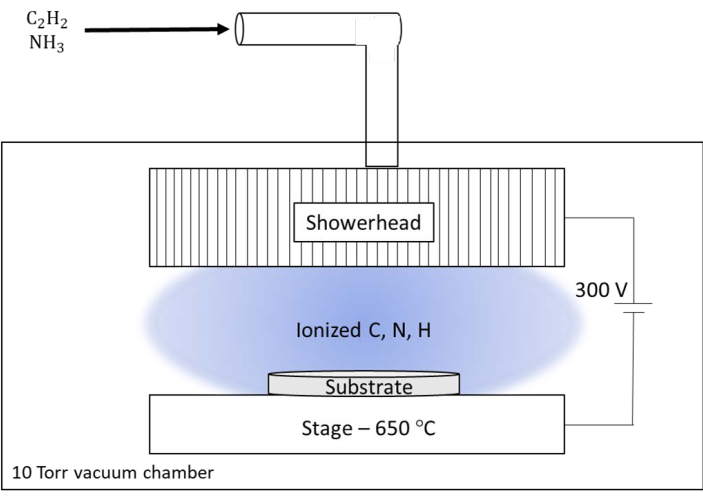
Abbildung 6: Schematische Darstellung des Gleichstrom-Plasma-Enhanced Chemical Vapor Deposition (dc-PECVD)-Systems, das am Oak Ridge National Laboratory (ORNL) verwendet wird. Das kundenspezifische System am ORNL verfügt über einen großen Duschkopf, der als Reaktor für die Speisegase und als Ausgang für das Plasma dient. Der Duschkopf wurde auf einem Gleichstrompotential von 300 V relativ zur beheizten Stufe für das Substrat gehalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
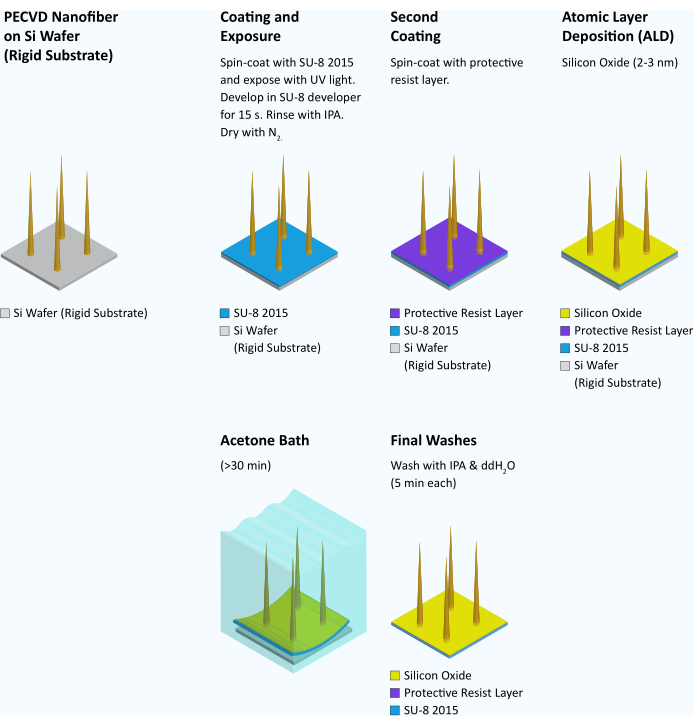
Abbildung 7: Arbeitsablauf für die Übertragung von Fasern von einem starren Substrat auf ein flexibles Substrat. Nach der Nanofasersynthese und -inspektion wird jeder Wafer mit SU-8 2015 bei 4000 U/min für 45 s schleuderbeschichtet. Anschließend wird die Waffel 3 min bei 95 °C weich gebacken. Anschließend wird der Wafer mit UV-Licht bestrahlt und in einem Mask Aligner bei 95 mJ/cm2 strukturiert. Nach 6 min Nachbacken bei 95 °C wird die Waffel 15 s im SU-8 Entwickler entwickelt, mit IPA gespült und mit N2 Gas getrocknet. Eine Schutzlackschicht aus SPR 955 CM 0,7 wird auf dem Wafer bei 3000 U/min schleuderbeschichtet und bei 90 °C für 30 s softbacked. Eine Siliziumoxidschicht (2-3 nm) wird dann durch Atomlagenabscheidung (ALD) (22 Zyklen bei 100 °C) auf den Wafer aufgebracht, um das flexible Substrat hydrophil15 zu machen. Anschließend wird der Wafer mit einer Würfelsäge in 3 mm x 3 mm große Quadrate gewürfelt. Zum Zeitpunkt der Anwendung werden einzelne Chips in Aceton gelegt, bis SU-8 anfängt, sich zu kräuseln und konkav wird (>30 min). Zu diesem Zeitpunkt kann die SU-8-Schicht auf den meisten Chips am Rand mit einer scharfen Pinzette gegriffen und als intakter 3-mm-Quadratfilm vom darunter liegenden Siliziumsubstrat abgezogen werden. Die Folie wird dann nacheinander in IPA und Wasser für jeweils 5 min gewaschen und sofort verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: REM-Bilder des Fasertransfers von einem starren Substrat auf ein flexibles Substrat. Die gezeigten Bilder sind repräsentativ, stammen aber aus unterschiedlichen Stichproben. (A) Lange Fasern nach dem PECVD-Wachstum (gleiches Bild wie in Abbildung 2C). (B,C) Fasern nach dem Auftragen von SU-8. Das Epoxidharz quillt an der Basis der Fasern auf. Die exponierte Faserlänge reichte von 5 μm bis 30 μm. (D) Fasern, die nach dem Abheben in Su-8 eingebettet waren, behielten ihre Geometrie. Aufgrund der Tatsache, dass die Fasern in einem Winkel von 30° aufgenommen wurden, scheinen die Höhen um den Faktor sin(30°)=1/2 kleiner zu sein als die tatsächliche Höhe. Tafel A wurde mit Genehmigung von Morgan et al.7 nachgedruckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
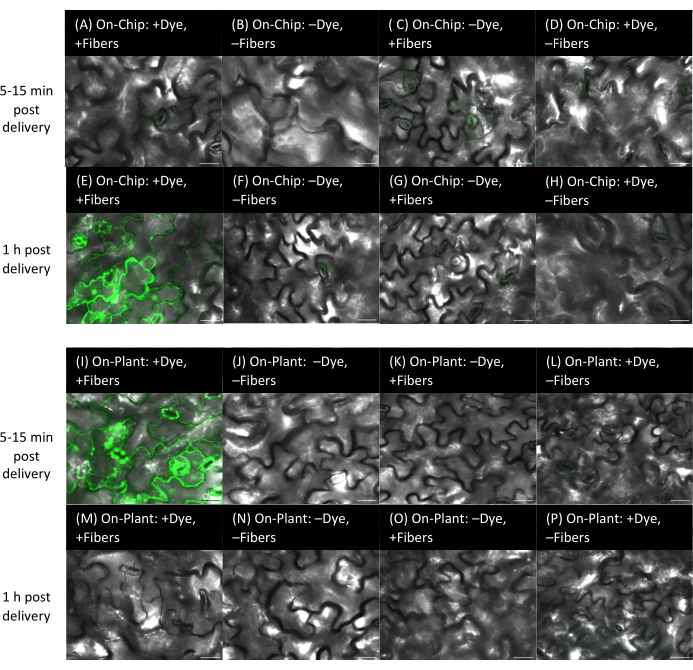
Abbildung 9: Färbeabgabe an Arabidopsis-Blätter unter Verwendung von On-Chip- und On-Plant-Methoden mit Fasern auf starren Substraten. (A-P) Die Bilder wurden mittels konfokaler Mikroskopie aufgenommen. On-Chip-Methode (A-H): 1 μL des 10 μM Fluorescein-Farbstoffs wurde 15 Minuten lang auf VACNF-Chips getrocknet, und dann wurden die Chips mit einer Pinzette in die abaxiale Seite der Arabidopsis-Blätter geklopft. (A-D) Die Blätter werden innerhalb von 5-15 Minuten nach der Entbindung abgebildet. (E-H) Die Blätter werden 1 h nach der Lieferung abgebildet. (A,E) +Farbstoff, +Fasern. Steuerung: (B,F) -Farbstoff, -Fasern; (C,G)-Farbstoff, +Fasern; (D,H) +Farbstoff, -Fasern. (I-P) On-Plant-Methode: 1 μl 10 μM Fluorescein-Farbstoff wurde auf die Pflanzenoberfläche gegeben, Chips wurden so positioniert, dass sie mit dem Tröpfchen in Kontakt kamen, und mit einer Pinzette wurde der Chip in die abaxiale Seite der Arabidopsis-Blätter geklopft. (I-L) innerhalb von 5-15 Minuten nach der Entbindung und (M-P) 1 h nach der Entbindung. (I,M) +Farbstoff, +Fasern. Kontrollen: (J,N) -Farbstoff, -Fasern; (K,O)-Farbstoff, +Fasern; (L,P) +Farbstoff, -Fasern. Die Felder A-P sind einzelne planare Bilder aus Z-Stapeln. Die Maßstabsbalken betragen 20 μm. Die Fasern haben ein Rastermaß von 35 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
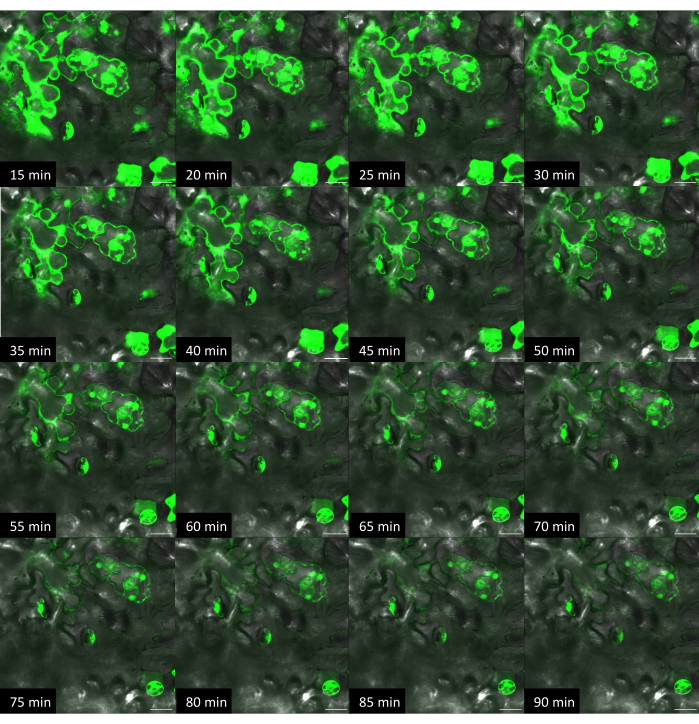
Abbildung 10: Zeitlicher Verlauf der Farbstoffabgabe in Arabidopsis mittels On-Plant-Methode mit starrem Substrat. Die Bilder wurden mittels konfokaler Mikroskopie aufgenommen. Bei der On-Plant-Methode wurde 1 μl Tropfen Fluorescein-Farbstofflösung (10 μM) auf die Oberfläche eines Blattes gegeben und der VACNF-Chip auf das Tröpfchen gelegt. Mit einer Pinzette wurde der Chip vorsichtig in das Gewebe geklopft. +Farbstoff, +Fasern Bilder des gleichen Bereichs wurden alle 5 Minuten aufgenommen. Die Maßstabsbalken betragen 20 μm. Die Fasern haben ein Rastermaß von 35 μm. Bedienfelder sind einzelne planare Bilder aus Z-Stapeln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
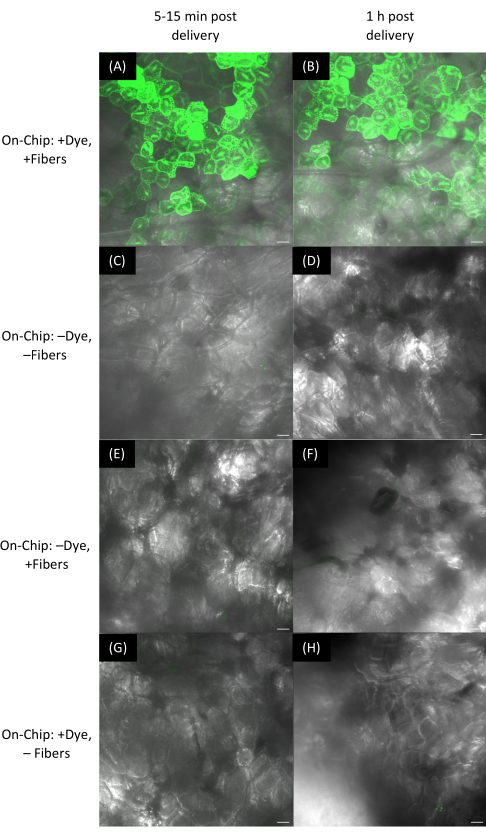
Abbildung 11: Färbeabgabe an Erdbeerfrüchte mit VACNF-Filmen. (A-H) Die Bilder wurden mittels konfokaler Mikroskopie aufgenommen. Bei der On-Chip-Methode wurden Farbstofftröpfchen auf VACNF-Folien getrocknet, die dann mit einem Make-up-Applikator auf Fruchtoberflächen gerollt wurden. Der Fluorescein-Farbstoff (10 μM) wurde den Erdbeerzellen zugeführt und nach (A) 10 min und (B) 1 h abgebildet. (C,D) Keine Behandlungskontrollen (-Farbstoff, -Fasern). (E,F)-Farbstoff, +Fasern kontrolliert nach 10 min bzw. 1 h. (G,H) +Farbstoff, -Fasern kontrolliert nach 10 min bzw. 1 h. Die Maßstabsbalken sind 40 μm. Die Panels A-H sind maximale Projektionen von 188 μm z-Stapeln. Die Fasern haben ein Rastermaß von 35 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 12: Färbeabgabe und transiente Transformation von Äpfeln über VACNF-Filme. (A-F) Die Bilder wurden mittels konfokaler Mikroskopie erzeugt. Bei der On-Chip-Methode wurden 1 μl Fluorescein-Farbstoff (10 μM, B und D) oder 1 μl Plasmid, das pUBQ10:YFP (DNA−YFP) (200 ng) kodiert, auf VACNF-Folien getrocknet, die dann mit einem Make-up-Applikator auf die Fruchtoberflächen gerollt wurden. Der Fluorescein-Farbstoff wurde an die Epidermis des Apfels abgegeben und nach (B) 10 Minuten und (D) 2 Stunden abgebildet. (D) Der Farbstoff brauchte einige Zeit, um nach der Abgabe in die Zellen zu diffundieren. DNA-YFP-Abgabe und -Expression über VACNF-Filme nach (F) 48 h. (A,C,E) keine Behandlungskontrollen (-Farbstoff/DNA-YFP, -Fasern). Die Maßstabsbalken sind 40 μm. Die Panels A-D sind einzelne planare Bilder aus Z-Stapeln. Die Panels E und F sind die maximale Projektion von 53 μm Z-Stacks. Der Faserabstand beträgt 35 μm. Pfeile kennzeichnen Fluorescein- oder YFP-Signale. * zeigt Fasern an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
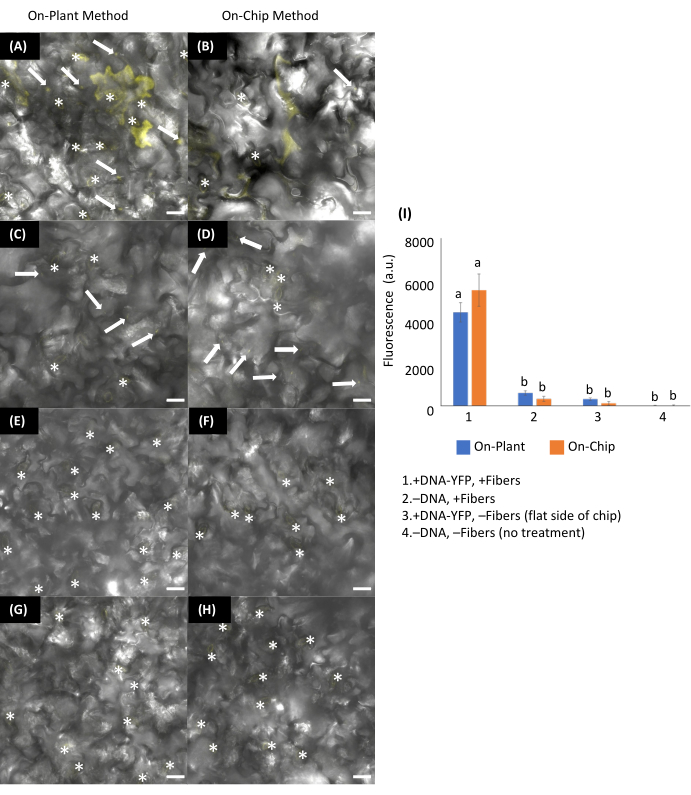
Abbildung 13: Transiente Transformation von Arabidopsis-Blättern mit On-Plant- oder On-Chip-VACNFs-Methoden. (Ein-H) Die Bilder wurden mittels konfokaler Mikroskopie 48 Stunden nach der DNA-Verabreichung aufgenommen. (A,C,E,G) On-Plant-Methode: 1 μl Plasmid, das pUBQ10:YFP (DNA−YFP) kodiert (200 ng), wurde auf die abaxiale Seite der Arabidopsis-Blätter gegeben. Die Chips wurden so positioniert, dass sie mit dem Tröpfchen in Berührung kamen, und eine Pinzette wurde verwendet, um den Chip in das Blattgewebe zu klopfen. (B,D,F,H) On-Chip-Methode: 1 μl DNA−YFP (200 ng) wurde 15 min lang auf VACNF-Chips getrocknet und dann mit einer Pinzette in die abaxiale Seite der Arabidopsis-Blätter geklopft. +DNA-YFP, +Fasern für (A) On-Plant und (B) On-Chip. Kontrollen: (C,D)-DNA-YFP, + Fasern; (E,F) +DNA-YFP, -Fasern; und (G,H)-DNA, −Fasern. (I) Diagramm der relativen durchschnittlichen Fluoreszenzsignalintensität von 25, 20 × 20 μm aus Bildern von 5 biologischen Replikaten, kombiniert aus 2-3 Experimenten unter Verwendung von Fluoreszenz aus dem YFP-Kanal. Regionen, die Spaltöffnungen (*) enthielten, wurden aufgrund der Autofluoreszenz ausgeschlossen. Die durchschnittliche Fluoreszenzintensität aus der Bedingung -DNA-YFP, -Fasern wurde von jedem Mittelwert subtrahiert. 2−Wege−ANOVA (und Tukey−Test) wurden für Signifikanz−Tests verwendet, und Fehlerbalken stellen den Standardfehler des Mittelwerts dar. Unterschiedliche Buchstaben zeigen signifikante Unterschiede zwischen den Behandlungen (P < 0,0001). Bei allen gezeigten Bildern handelt es sich um maximale Projektionen von 40 μm z−stacks. Die Maßstabsbalken betragen 20 μm. Weiße Pfeile zeigen Fasern in den Bildern an. Der Faserabstand beträgt 35 μm. Diese Abbildung wurde mit Genehmigung von Morgan et al.7 nachgedruckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 14: Transiente Transformation von Zwiebeln mit VACNF-Folien. Die Bilder wurden mittels konfokaler Mikroskopie 48 Stunden nach der DNA-Verabreichung aufgenommen. Mit der On-Chip-Methode wurden 1 μL Plasmid-DNA, die für pUBQ 10:YFP (DNA-YFP) (200 ng) Tröpfchen kodiert,10 min lang auf VACNF-Folien getrocknet, die dann auf Pflanzenorganoberflächen gerollt wurden. (A) DNA-YFP wurde an die Epidermis der Zwiebel verabreicht und YFP wurde in ihr exprimiert. (B) Keine Kontrolle der Behandlung; (C) Kontrolle (+DNA-YFP, -Fasern) und (D) Kontrolle (-DNA-YFP, +Fasern). Die Maßstäbe betragen 40 μm. Die Fasern haben ein Rastermaß von 35 μm. Bei den Bildern handelt es sich um maximale Projektionen von 115 μm Z-Stapeln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 15: Gewebeschädigung bei Salat durch VACNF-Folienapplikation . (A-D) Die Bilder wurden mittels konfokaler Mikroskopie erzeugt. (A) Die On-Chip-Methode wurde verwendet, um DNA über VACNF-Folien an Salatblätter abzugeben. pUBQ 10:YFP DNA (200 ng) Tröpfchen wurden für10 min auf VACNF-Folien getrocknet, die dann auf die abaxiale Seite der abgelösten Salatblätter gerollt und 4 Tage lang in einer Feuchtigkeitskammer gelagert wurden. (B) Kontrolle (-DNA-YFP, +Fasern). (C) Kontrolle (+DNA-YFP, -Fasern) und (D) keine Behandlung (-DNA-YFP, -Fasern). Die Maßstäbe betragen 40 μm. VACNFs haben ein Rastermaß von 35 μm. Pfeile weisen auf Pflanzenschäden hin, die durch das Rollen des flexiblen Substrats mit zu viel Kraft entstehen. Es ist zu beachten, dass in anderen Experimenten eine erfolgreiche VACNF-vermittelte DNA-Verabreichung in Salat erreicht wurde7. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
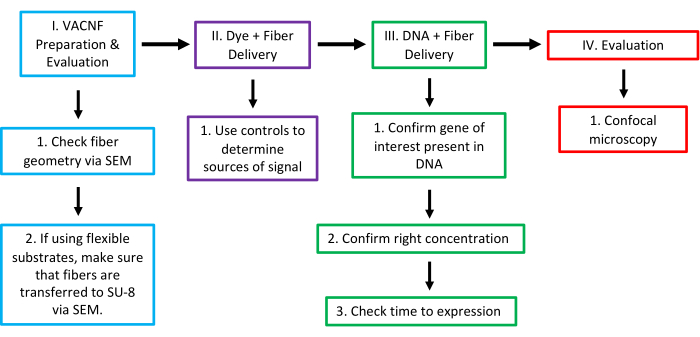
Abbildung 16: Arbeitsablauf der VACNF-vermittelten Verabreichung in Anlagen. In Stufe I prüfen Sie die Geometrie der Fasern mit dem REM. Für eine ordnungsgemäße Abgabe benötigen Fasern eine Spitze mit einem Durchmesser <200 nm. Bei der Verwendung von Fasern auf flexiblem Substrat besteht der nächste Schritt darin, zu bestätigen, dass die Fasern auf SU-8 übertragen werden, und die Höhe der freigelegten Fasern über REM zu überprüfen. In Phase II testeten wir die Nützlichkeit der Fasern, indem wir versuchten, den Farbstoff mit einem starren oder flexiblen Substrat in die Pflanze/das Organ der Wahl zu bringen. Verwenden Sie 1 μl Tröpfchen, geben Sie es entweder auf die Pflanzenoberfläche oder trocknen Sie es kurz auf dem Chip/der Folie. Bei diesem und allen anderen Schritten ist es zwingend erforderlich, die richtigen Steuerelemente (-Dye,-Fasern; -Dye, +Fasern; und +Dye,-Fasern) zu verwenden, um sicher zu sein, dass das Signal von einer echten Farbstoffabgabe stammt. Bestätigen Sie in Phase III, dass das interessierende Gen im Plasmid vorhanden ist, bestimmen Sie die Konzentration der zu verabreichenden DNA und testen Sie die optimale Zeitspanne nach der Verabreichung, um die Expression zu überprüfen. Im Stadium IV wurde das Ergebnis mittels konfokaler Mikroskopie ausgewertet, um die Expression des verabreichten Markers zu überprüfen. Diese Zahl wurde mit Genehmigung von Morgan et al.7 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Arbeit haben wir Methoden vorgestellt, um vertikal ausgerichtete Kohlenstoff-Nanofaser-Arrays zu konstruieren, die Fasern auf ein flexibles Substrat zu übertragen und Fasern in einem starren oder flexiblen Substrat auf Pflanzen aufzubringen, um sie bei der Verabreichung von Biomolekülen oder Farbstoffen an Pflanzen zu verwenden. Wir beschrieben zwei allgemeine Ansätze, die On-Chip- und die On-Plant-Methode, für die Abscheidung der eingebrachten Materialien und zeigten erfolgreiche Ergebnisse in Fasern auf einem starren Substrat sowie die On-Chip-Methode unter Verwendung von VACNF-Schichten. Die Anwendung dieser Fasern ist in Praxis und Theorie einfacher als herkömmliche Methoden der Pflanzenumwandlung (Partikelbeschuss, Protoplastentransformation mittels PEG oder Elektroporation) und kann für Pflanzen verwendet werden, die der Agrobacterium-vermittelten Transformation widerspenstig sind. Allerdings werden nur wenige Zellen transformiert.
Vertikal ausgerichtete Kohlenstoff-Nanofasern wurden am Oak Ridge National Laboratory Center for Nanophase Materials Sciences durch ihr Benutzerprogramm hergestellt. Anwender können beantragen, diese Anlage für die Herstellung von VACNFs zu nutzen. Alternativ können VACNF-Chips in Reinräumen mit Gleichstrom-plasmagestützten chemischen Gasphasenabscheidungsanlagen mit einer Kohlenstoffquelle22,23 hergestellt werden. Bei den beschriebenen Methoden gibt es einige Schritte, die für die Herstellung der Fasern, den Fasertransfer und die Anwendung der VACNF-Chips/-Folien entscheidend sind. Damit die Faserapplikation funktioniert, müssen die Fasern gerade sein und einen sich verjüngenden Durchmesser von <200 nm an der Spitze haben, damit die Verabreichung in Pflanzenzellen erfolgreich ist 6,7 (Abbildung 3). Um Kohlenstoff-Nanofasern mit einer bestimmten Größe und Steigung herzustellen, gibt es eine Vielzahl von Parametern, die geändert werden können, darunter die Punktgröße, die seitliche Steigung und die Menge des abgeschiedenen Katalysators. Um die optimale Punktgröße für die Herstellung von Kohlenstoffnanofasern auszuwählen, wurden Fasern aus verschiedenen Punktgrößen gezüchtet (wie in Abbildung 5 gezeigt). Wir fanden heraus, dass 300 nm Durchmesser die besten Fasern produzierten, daher wurde diese Punktgröße ausgewählt (Abbildung 5). Nachdem wir die richtigen Parameter gefunden hatten, suchten wir nach Chips, die >50 % Fasern mit der idealen Geometrie (gerade und einem Spitzendurchmesser <200 nm) aufweisen. Um die Geometrie der Fasern zu überprüfen, haben wir Rasterelektronenmikroskopie verwendet, um zufällige Sichtfelder auf einer Probe von VACNF-Chips/-Filmen abzubilden.
Darüber hinaus müssen die Fasern eine bestimmte Mindestlänge aufweisen, um eine Abgabe in Pflanzenzellen zu erreichen. Die Bedeutung der Herstellung von Fasern unterschiedlicher Länge besteht darin, dass längere Fasern verwendet werden können, um in tiefere Gewebeschichten einzudringen. Längere Fasern (>40 μm Länge) sind für flexible Folien unerlässlich, da der Fasertransfer funktioniert, indem die Fasern von ihrer Basis gebrochen werden und SU-8 auf die Fasern gelegt werden muss. Die Arbeitsdicke der für dieses Protokoll verwendeten SU-8-Schicht beträgt 20-35 μm. Die Mindesthöhe, die für die Abgabe in der Epidermis verschiedener Pflanzen (gekrümmt oder flach) erforderlich ist, beträgt 10-15 μm 6,7. Daher sind für VACNF-Folien Fasern mit Längen >40 μm notwendig. Bei der Herstellung von Kohlenstoff-Nanofasern sind verschiedene Parameter zu berücksichtigen: Katalysatormaterial, Katalysatorgeometrie, Dicke des Katalysatormaterials sowie Bedingungen innerhalb der PECVD-Kammer (Gasverhältnis, Druck, Temperatur, Strom, Duschkopfhöhe und Wachstumszeit)8,9,24,25. Um Kohlenstoff-Nanofasern herzustellen, die länger als 25 μm sind, die von Morgan et al.7 und Davern et al.6 verwendet wurden, haben wir die Menge des Ni-Katalysators erhöht, das Verhältnis von Acetylen zu Ammoniak verändert und die Strom- und Wachstumszeit erhöht. Darüber hinaus haben wir mehr auf die Geometrie des Katalysatormaterials geachtet. Um hohe, gerade Fasern herzustellen, musste der abgeschiedene Katalysator die Form eines Hockeypucks haben und nicht die Form eines Vulkans (Abbildung 4). Vulkanstrukturen entstehen nach dem Abheben aus Resten von Fotolack. Um die Bildung von Vulkanen zu verhindern, wurde eine doppelte Schicht PMMA verwendet, um bei der Elektronenstrahllithographie einen Hinterschnitt zu erzeugen26. Der Hinterschnitt hilft beim Abheben des abgeschiedenen Metallkatalysators (Abbildung 2). Die dicke Schicht des Katalysators ist wichtig für das Wachstum von hohen VACNFs. Die Morphologie der VACNFs wurde von Merkulova et al.24 untersucht. Die vertikale Ausrichtung der VACNFs ist sowohl auf das Wachstum der Ni-Katalysatorspitze als auch auf die Ausrichtung des DC-Potentials senkrecht zum Substrat zurückzuführen (Abbildung 6). Der Duschkopf beschreibt die Geometrie des PECVD-Reaktors (Abbildung 6) und dient als Quelle für das Potential für das elektrische Feld27.
Um die Anordnung von Katalysatorpunkten mit Elektronenstrahllithographie zu definieren, haben wir einen Elektronenstrahlresist (Polymethylmethacrylat) aufgetragen und dann mit dem Elektronenstrahl kleine Löcher in den Resist mit einer bestimmten Form und an bestimmten Stellen auf dem Wafer gebohrt. Löcher mit dem gewünschten Durchmesser wurden auf einem regelmäßigen Raster mit dem definierten Abstand (Pitch) platziert und eine Datei, die das gewünschte Muster spezifizierte, wurde in das Elektronenstrahllithographie-Tool geladen, bevor das Substrat in die Maschine geladen wurde. Neben der Faserhöhe ist ein weiterer kritischer Parameter für einen erfolgreichen Fasertransfer die Zeit, die im Acetonbad verbracht wird. Die VACNF-Folien müssen lange genug im Acetonbad belassen werden, bis sich ihre Ränder zu kräuseln beginnen; Wenn sie zu wenig Zeit im Acetonbad gelassen werden, lassen sie sich schwieriger von den Spänen abheben und können brechen. Je älter die Chips sind, desto länger müssen sie im Acetonbad verbleiben. Nach dem Acetonbad wurden die Filme/Chips in Isopropanol und Wasser gelegt, um das Zugangsaceton zu entfernen und den schützenden Fotolack auf den Fasern zu entfernen.
Um das Spin Coating durchzuführen, werden Wafer oder Waferstücke auf ein Vakuumfutter im Spin Coater gelegt, und die zentrale Position des Wafers wird mit der Testfunktion des Spin Coaters überprüft. Eine kleine Pfütze (~2,5 cm Durchmesser) aus Resist wird auf die Mitte des Wafers aufgetragen und gesponnen (3000 U/min für 45 s) Abbildung 8 zeigt die Erhaltung der Fasergeometrie (Höhe, Ausrichtung und Teilung). Das Vorhandensein von Fasern führt dazu, dass der Resist an der Basis der Fasern aufquillt und zu dickeren Schichten als erwartet führt. Spin-Coating nach VACNF-Wachstum wurde von anderen Gruppen untersucht11,18.
Ein weiterer Schritt innerhalb des Prozesses, der von entscheidender Bedeutung ist, besteht darin, sicherzustellen, dass die richtige Menge an Kraft auf VACNF-Chips/-Folien ausgeübt wird. Der Abgabemechanismus ist davon abhängig, dass die Fasern kleine Einstiche in die Zellwände über die Impulskraft der Pinzette machen, auf starre Substrate 6,7 klopfen oder mit dem Mini-Make-up-Applikator auf flexiblen Substraten rollen. Fasern können abbrechen und in Pflanzenzellen eingebettet bleiben6,7 ohne Einfluss auf das Ergebnis, aber Übung in Verbindung mit der Untersuchung auf Farbstoffaufnahme und Gewebeschädigung ist notwendig, um den richtigen Druck zu erreichen. Darüber hinaus ist es wichtig, geeignete Bildgebungszeitpunkte nach der DNA-Verabreichung mit VACNF-Chips/-Filmen zu wählen, da die Zeit bis zur nachweisbaren Expression je nach Pflanzenart und den Arten von Vektoren, die verabreicht werden, variiert7 (Abbildung 16).
So breit diese Methode auch auf Pflanzen anwendbar ist, sie hat einige Einschränkungen. Zum Beispiel führt das Hinzufügen einer dünnen Schicht Siliziumoxid zu den VACNF-Schichten nicht immer dazu, dass die Schichten vollständig hydrophil sind, da die Schutzschicht aus Fotolack auf dem SU-8 aufgetragen wird. Wenn dieses Problem auftritt, könnten dickere Schichten aus Siliziumoxid auf VACNFs aufgetragen werden. Um zu testen, ob die Folien hydrophob oder hydrophil sind, können sie in Wasser gelegt werden. Wenn die Filme absinken, sind sie hydrophil, und wenn sie schwimmen, sind sie hydrophob. Darüber hinaus kann es Schwankungen zwischen den produzierten Faserchargen geben. Es gibt mehrere Parameter, die beim Wachstum der Fasern in der DC-PECVD-Maschine geändert werden können. Was in diesem Protokoll beschrieben wird, ist eine Reihe von Parametern für zwei verschiedene Mengen an Ni-Katalysator. Darüber hinaus kann die Kristallorientierung des Ni-Katalysators28 nicht gesteuert werden, und einige Verzweigungen führen unweigerlich zu den Fasern.
Während wir für diese Arbeit die Verabreichung von Fluorescein-Farbstoff und DNA an Pflanzenzellen unter Verwendung von starren und flexiblen Substraten demonstriert haben, sollte die Methode auch für andere Biomoleküle und genetische Modifikationsansätze breit anwendbar sein, z. B. RNAi-Silencing für Pflanzensysteme wie Äpfel oder andere Früchte, bei denen es Jahre dauern würde, stabile transgene Linien zu produzieren. Darüber hinaus könnten diese Fasern auch verwendet werden, um genetische Editierungsmaterialien zu liefern oder um stabile Transformationen in Pflanzen durchzuführen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Nanofaser-Arrays wurden am Center for Nanophase Materials Sciences hergestellt, einer User Facility des Department of Energy Office of Science (Vorschlags-ID: CNMS2019-103 und CNMS2022-A-1182). Die Unterstützung durch das CNMS wird über ein Peer-Review-Vorschlagssystem vergeben und wird erfolgreichen Antragstellern, die beabsichtigen, ihre Ergebnisse zu veröffentlichen, kostenlos zur Verfügung gestellt (http://www.cnms.ornl.gov/user/becoming_a_user.shtml). Wir danken Kevin Lester und CNMS für die Unterstützung bei der Herstellung von Nanofaser-Arrays. Wir danken Dr. John Caughmen, Dr. Timothy McKnight, Dr. Amber Webb, Daryl Briggs und Travis Bee für die kritischen Diskussionen über die Versuchsplanung. Wir danken Dr. Adam Rondinone für den Schaltplan der PECVD-Maschine. Wir danken Leslie Carol für die wissenschaftlichen Illustrationen. Diese Arbeit wurde vom Bioimaging Science Program, U.S. Department of Energy, Office of Science, Biological and Environmental Research, DE-SC0019104, und United States Department of Agriculture, 2021-67013-34835, finanziert. JMM wurde vom US-Landwirtschaftsministerium unterstützt: National Institute of Food and Agriculture: Agriculture and Food Research Initiative Predoctoral Fellowship 2021-67034-35167.
Materialien
| Name | Company | Catalog Number | Comments |
| 13" x 13" White 1/4-fold heavy duty Brawny industrial shop towel 70Ct | Fastenal | 690535 | |
| 2-Propanol (IPA) | Fischer Scientific | A451-4 | |
| 4" Lid | Entegris | H22-401-0615 | Wafer Carriers |
| 4" tray | Entegris | H22-40-0615 | Wafer Carriers |
| Accretech SS10 dicing saw | Accreteck | SS10 | |
| Acetone | Fischer Scientific | A18-4 | |
| Acetone used in the cleanroom at ORNL | JT Baker | 9005-05 | |
| Apples | Grocery store | No product number | |
| Arabidopsis thaliana | Seeds of accession Columbia from the laboratory of Professor Jean Greenberg at the University of Chicago | No product number | |
| Carbon direct current plasma enhanced chemical vapor deposition machine | Oak Ridge National Laboratory | Custom-built | |
| Cobham Green lettuce | Seeds from the laboratory of Professor Richard Michelmore at the University of California, Davis | No product number | Butterhead lettuce |
| Fluorescein dye | Sigma Aldrich | F2456-2.5G | |
| Gel-box | Gel-Pak | AD-23C-00-X4 | |
| Heidelberg DWL 66 direct-write lithography tool | Heidelberg | DWL 66 | |
| ImageJ | National Institues of Health | No product number | |
| Isoproponal (IPA) used in the cleanroom at ORNL | Doe and Ingalls | CMOS Grade 9079-05 | |
| JEOL 9300FS 100kV electron beam lithography system | JEOL | 8100 | |
| Kimwipes | Kimtech | Kimberly-Clark Professional 34120 | |
| Kord-Valmark disposable polystyrene petri dish | VWR | 11019-554 | |
| Layout Editor | juspertor GmbH | No product number | |
| LSM 710 confocal microscope | Zeiss | No product number | |
| LSM 800 confocal microscope | Zeiss | No product number | |
| Make-up applicator | Amazon | G2PLUS | 500 PCS Disposable Micro Applicators Brush for Makeup and Personal Care (Head Diameter: 1.5 mm)- 5 x 100 PCS |
| Merlin field emission scanning electron microscope | Zeiss | Merlin | |
| MIBK/IPA (methyl isobutyl ketone/isopropanol) (1:3) | Microchem | M089025 | |
| Onions | Grocery store | No product number | |
| Oxford FlexAl atomic layer deposition | Oxford | FlexAl | |
| PMMA 495 A4 | Microchem | M130004 | |
| PMMA 950 A4 | Microchem | M230004 | Can dilute down to A2 |
| Polyethylene terephthalate (PET) | Amazon | KS-6304-21-11 | Type D Clear PET (Polyester) Sheet .0005" Thick x 27" Width x 10 Ft Length 1 pc |
| Precision tweezers | Aven Inc. | 18032TT | |
| pUBQ10:YFP-GW | Arabidopsis Biological Resource Center | CD3-1948 | |
| Silicon etcher (used for descum) | Oxford | Plasmalab | |
| Silicon rubber kit | Smooth-On Inc | Ecoflex 00-20 | |
| Silicon wafers | Pure Wafer | 4N0.001-.005SSP-INV | |
| Spin coater | Brewer Sciences | Model 100CB | |
| SPR 955cm 0.7 | Megaposit | 10018314 | |
| Strawberries | Grocery store | No product number | |
| SU-8 2015 | Microchem | SU-8 2000 Series | Toxic. Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| SU-8 developer | Microchem | SU-8 2000 Series | Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| Suss MicroTec contact aligner | Suss MicroTec | MA6/BA6 | |
| Table top microscope | Phenom XL | used for checking Ni catalysts after metal deposition | |
| Thermionics VE-240 e-beam evaporator | Thermionics | VE-240 |
Referenzen
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Gou, Y. J., et al. Optimization of the protoplast transient expression system for gene functional studies in strawberry (Fragaria vesca). Plant Cell, Tissue, and Organ Culture. 141, 41-53 (2020).
- Baltes, N. J., Gil-Humanes, J., Voytas, D. F. Genome engineering and agriculture: Opportunities and challenges. Progress in Molecular Biology and Translational Science. 149, 1-26 (2017).
- Ren, R., et al. Highly efficient protoplast isolation and transient expression system for functional characterization of flowering related genes in Cymbidium orchids. International Journal of Molecular Sciences. 21 (7), 2264 (2020).
- Kumar, S., et al. Nanovehicles for plant modifications towards pest-and disease-resistance traits. Trends in Plant Science. 25 (2), 198-212 (2020).
- Davern, S. M., et al. Carbon nanofiber arrays: a novel tool for microdelivery of biomolecules to plants. PLoS One. 11 (4), e0153621 (2016).
- Morgan, J. M., et al. An efficient and broadly applicable method for transient transformation of plants using vertically aligned carbon nanofiber arrays. Frontiers in Plant Science. 13, 1051340 (2022).
- Melechko, A. V., et al. Vertically aligned carbon nanofibers and related structures: Controlled synthesis and directed assembly. Journal of Physics D: Applied Physics. 97, 041301 (2005).
- Melechko, A. V., Desikan, R., McKnight, T. E., Klein, K. L., Rack, P. D. Synthesis of vertically aligned carbon nanofibres for interfacing with live systems. Journal of Physics D: Applied Physics. 42 (19), 193001 (2009).
- Nelson-Fitzpatrick, N. . Novel Materials for the Design of Cantilever Transducers [dissertation]. , (2011).
- Fletcher, B. L., et al. Transfer of flexible arrays of vertically aligned carbon nanofiber electrodes to temperature-sensitive substrates. Advanced Materials. 18 (13), 1689-1694 (2006).
- Keller, S., Blagoi, G., Lillemose, M., Haefliger, D., Boisen, A. Processing of thin SU-8 films. Journal of Micromechanics and Microengineering. 18 (12), 125020 (2008).
- Wouters, K., Puers, R. Diffusing and swelling in SU-8: insight in material properties and processing. Journal of Micromechanics and Microengineering. 20 (9), 095013 (2010).
- Jamal, M., Zarafshar, A. M., Gracias, D. H. Differentially photo-crosslinked polymers enable self-assembling microfluidics. Nature Communications. 2, 527 (2011).
- Williams, R., Goodman, A. M. Wetting of thin layers of SiO2 by water. Applied Physics Letters. 25 (10), 531-532 (1974).
- Kundu, A., Nogueira Campos, M. G., Santra, S., Rajaraman, S. Precision vascular delivery of agrochemicals with micromilled microneedles (µMMNs). Scientific Reports. 9, 14008 (2019).
- Acanda, Y., Welker, S., Orbović, V., Levy, A. A simple and efficient agroinfiltration method for transient gene expression in Citrus. Plant Cell Reports. 40 (7), 1171-1179 (2021).
- Pearce, R., et al. Synthesis and properties of SiNx coatings as stable fluorescent markers on vertically aligned carbon nanofibers. AIMS Materials Science. 1 (2), 87-102 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crafts, A. S. Translocation in plants. Plant Physiology. 13 (4), 791 (1938).
- Martens, H. J., Hansen, M., Schulz, A. Caged probes: a novel tool in studying symplasmic transport in plant tissues. Protoplasma. 223, 63-66 (2004).
- Liu, J., Essner, J., Li, J. Hybrid supercapacitor based on coaxially coated manganese oxide on vertically aligned carbon nanofiber arrays. Chemistry of Materials. 22 (17), 5022-5030 (2010).
- Saleem, A. M., et al. Low temperature and cost-effective growth of vertically aligned carbon nanofibers using spin-coated polymer-stabilized palladium nanocatalysts. Science and Technology of Advanced Materials. 16, 015007 (2015).
- Merkulov, V. I., Lowndes, D. H., Wei, Y. Y., Eres, G., Voelkl, E. Patterned growth of individual and multiple vertically aligned carbon nanofibers. Applied Physics Letters. 76 (24), 3555-3557 (2000).
- Retterer, S. T., Melechko, A., Hensley, D. K., Simpson, M. L., Doktycz, M. J. Positional control of catalyst nanoparticles for the synthesis of high density carbon nanofiber arrays. Carbon. 46 (11), 1378-1383 (2008).
- Rooks, M. J., Wind, S., McEuen, P., Prober, D. E. Fabrication of 30-nm-scale structures for electron transport studies using a polymethylmethacrylate bilayer resist. Journal of Vacuum Science & Technology B: Microelectronics Processing and Phenomena. 5 (1), 318-321 (1987).
- Lee, G., Sohn, D. K., Seok, S. H., Ko, H. S. The effect of hole density variation in the PECVD reactor showerhead on the deposition of amorphous carbon layer. Vacuum. 163, 37-44 (2019).
- Fowlkes, J. D., et al. Control of catalyst particle crystallographic orientation in vertically aligned carbon nanofiber synthesis. Carbon. 44 (8), 1503-1510 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten