Method Article
Transformación y regeneración de raíces pilosas en Arabidopsis thaliana y Brassica napus
En este artículo
Resumen
El protocolo describe la inducción de raíces pilosas utilizando tallos de inflorescencia primaria de Arabidopsis e hipocótilos de Brassica napus . Las raíces peludas pueden ser cultivadas y utilizadas como explantes para regenerar plantas transgénicas.
Resumen
La transformación de raíces pilosas representa una herramienta versátil para la biotecnología vegetal en diversas especies. La infección por una cepa de Agrobacterium portadora de un plásmido inductor de raíces (Ri) induce la formación de raíces pilosas en el sitio de la herida después de la transferencia de ADN-T del plásmido Ri al genoma de la planta. El protocolo describe en detalle el procedimiento de inducción de la raíz pilosa a base de inyección en Brassica napus DH12075 y Arabidopsis thaliana Col-0. Las raíces pilosas pueden ser utilizadas para analizar un transgén de interés o procesadas para la generación de plantas transgénicas. El medio de regeneración que contiene citoquinina 6-bencilaminopurina (5 mg/L) y auxina 1-naftalenacético (8 mg/L) provoca con éxito la formación de brotes en ambas especies. El protocolo abarca el genotipado y selección de plantas regenerantes y T1 para la obtención de plantas portadoras de un transgén de interés y libres de ADN-T del plásmido Ri . También se representa un proceso alternativo que conduce a la formación de una planta compuesta. En este caso, las raíces pilosas se mantienen en el brote (en lugar de las raíces naturales), lo que permite el estudio de un transgén en cultivos de raíces pilosas en el contexto de toda la planta.
Introducción
La transformación de las plantas es el cuello de botella de cualquier estudio genético en biología vegetal. Una bacteria transmitida por el suelo, Agrobacterium tumefaciens, se usa ampliamente como medio para la entrega de genes por inmersión floral o cultivo de tejidos para generar transformantes. A. tumefaciens infecta a las plantas en el sitio de la herida y causa tumores debido a la transferencia e integración de ADN-T de un plásmido inductor de tumores (Ti) en el genoma de la planta huésped. Las cepas modificadas de A. tumefaciens con plásmido de Ti modificado sin el ADN-T de tipo salvaje y un vector binario con ADN-T artificial y sitios de clonación para insertar un gen de interés se utilizan comúnmente como un sistema eficiente de transformación de plantas1. Sin embargo, muchas especies y cultivos modelo son recalcitrantes a la inmersión floral o a la regeneración in vitro de las plantas o tienen ciclos de crecimiento largos, lo que afecta la eficiencia de este sistema de transformación.
Agrobacterium rhizogenes induce la formación de raíces adventicias, o raíces peludas, en el sitio de la herida después de infectar una planta huésped. Al igual que A. tumefaciens, A. rhizogenes transfiere un ADN-T de un plásmido inductor de raíces (Ri) al genoma de la planta huésped, lo que provoca el desarrollo de raíces pilosas transgénicas. Este proceso está controlado principalmente por los genes de los loci oncogénicos de la raíz (rol) 2,3. Utilizando cepas agrobacterianas portadoras tanto del plásmido Ri como de un vector binario artificial que codifica un gen de interés, se han utilizado cultivos de raíces pilosas para producir proteínas recombinantes, analizar la función de promotores o genes, o editar genomas utilizando repeticiones palindrómicas cortas agrupadas regularmente interespaciadas (CRISPR)/proteína 9 asociada a CRISPR (Cas9)4,5,6.
Nuestro protocolo utiliza la cepa transconjugante Ti-less A. tumefaciens C58C1 portadora del plásmido Ri pRiA4b7. El ADN-T del plásmido Ri consta de dos regiones, ADN-T derecho e izquierdo (ADN-TR y ADN-TL, respectivamente), que pueden integrarse de forma independiente en el genoma de la planta8. Aprovechando este sistema,se optimizó el largo proceso de transformación del explante en el cultivar Brassica napus DH12075 9. El protocolo que se detalla a continuación permite la regeneración de líneas de raíces pilosas seleccionadas y la obtención de plantas T1 portadoras del transgén de interés y libres de genes rol, en aproximadamente 1 año. La transformación de raíz pilosa basada en inyección se puede utilizar en otras especies de Brassicaceae, como se muestra mediante la transformación de Arabidopsis thaliana Col-0. Mientras que el hipocótilo se usa para transformar B. napus, A. thaliana se inyecta en el tallo primario de la inflorescencia.
Protocolo
1. Preparación de medios y soluciones
- Prepara las soluciones madre de hormonas.
- Para la preparación de 50 ml de solución madre de ácido 1-naftalenacético (NAA), 6-bencilaminopurina (BAP) y ácido indol-3-butírico (IBA) con una concentración de 5 mg/ml, disolver 250 mg de la hormona en polvo en 2 ml de hidróxido de sodio (NaOH) 1 M y ajustar el volumen a 50 ml con agua ultrapura.
- Para preparar 50 mL de ácido giberélico (GA3) con una concentración de 1 mg/mL, disuelva 50 mg de la hormona en polvo en 2 mL de etanol y ajuste el volumen a 50 mL de agua ultrapura.
- Filtre la solución con un filtro de jeringa estéril con un tamaño de poro de 0,22 μm y distribúyala en tubos estériles de 2 ml para su almacenamiento. Almacene la solución a -20 °C o 4 °C, según la recomendación del fabricante.
- Prepare soluciones madre antibióticas. Para 50 ml de solución madre disódica de cefotaxima y ticarcilina con una concentración de 100 mg/ml, disolver 0,5 g del antibiótico en polvo en 40 ml de agua ultrapura y ajustar a un volumen final de 50 ml. Filtre la solución con un filtro de jeringa estéril con un tamaño de poro de 0,22 μm y distribúyala en tubos estériles de 2 ml para su almacenamiento. Almacenar la solución a -20 °C.
NOTA: Siempre se agregan antibióticos y hormonas al medio enfriado. - Prepare 1 L de medio de Caldo Luria (LB) agregando 10 g de bactotriptona, 5 g de extracto de levadura y 5 g de cloruro de sodio (NaCl) en un cilindro medidor de 1 L y ajuste el volumen a 1 L con agua bidestilada. Ajuste el pH a 7.0 con KOH con un medidor de pH (siguiendo las instrucciones del fabricante). Trasvasar la solución a un frasco de 1 L y añadir 15 g de agar bacteriológico (1,5%), si se prepara un medio sólido y esterilizarlo en autoclave. Si es necesario, agregue los antibióticos apropiados (la resistencia bacteriana se transmite en el vector binario) al medio enfriado.
NOTA: Utilice un autoclave para esterilizar la solución. Coloque el frasco en la cesta, cierre la tapa y esterilícelo durante 20 minutos a 121 °C y 98,9 kPa. Este protocolo siempre se utiliza para soluciones de autoclave en pasos posteriores. - Prepare 1 litro de extracto de levadura de vacuno medio (YEB) mezclando 5 g de extracto de ternera, 1 g de extracto de levadura, 5 g de peptona, 5 g de sacarosa y 0,5 g de cloruro de magnesio (MgCl2) en agua bidestilada. Ajuste el volumen a 1 L. Transfiera la solución a una botella de 1 L. Autoclave el medio.
- Prepare 1 litro de medio para la germinación de semillas mezclando 2,2 g de polvo de Murashige y Skoog (MS), 10 g de sacarosa (1%) y 0,5 g de sales sódicas de ácido 2-(N-morfolino)etanosulfónico (MES) en agua bidestilada. Ajusta el volumen a 1 L, mezcla y ajusta el pH a 5,8 con KOH. Transfiera la solución a una botella de 1 L y agregue 8 g de agar vegetal (0,8%). Autoclave el medio.
- Prepare 1 litro de medio de crecimiento vegetal mezclando 2,2 g de MS en polvo, 5 g de sacarosa (0,5%) y 0,5 g de sales MES en agua bidestilada. Ajusta el volumen a 1 L, mezcla y ajusta el pH a 5,8 con KOH. Trasvasar la solución a un frasco de 1 litro y añadir 8 g de agar vegetal (0,8 %). Autoclave el medio.
- Prepare 1 L de medio de crecimiento de raíces pilosas mezclando 4,4 g de polvo de vitaminas MS + B5, 30 g de sacarosa (3%) y 0,5 g de sales MES en agua bidestilada. Ajuste el volumen a 1 L, mezcle y ajuste el pH a 5.8 con KOH y transfiera la solución a una botella de 1 L. Añadir 3 g de gelificante (0,3%) y esterilizar el medio en autoclave. Añadir cefotaxima y ticarcilina disódica hasta una concentración final de 100 - 200 mg/L y 100 - 500 mg/L, respectivamente. Si es necesario, añadir los antibióticos adecuados (la resistencia se debe al ADN-T de un vector binario).
- Prepare 1 litro de medio compuesto para el crecimiento de plantas mezclando 2,2 g de polvo de vitaminas MS + B5, 10 g de sacarosa (1%) y 0,5 g de sales MES en agua bidestilada. Ajuste el volumen a 1 L, mezcle y ajuste el pH a 5.8 con KOH y transfiera la solución a una botella de 1 L. Añadir 6 g de gelificante (0,6%) y esterilizar el medio en autoclave. Añadir cefotaxima y ticarcilina disódica hasta una concentración final de 200 mg/L y 500 mg/L, respectivamente. Si es necesario, añadir los antibióticos adecuados (la resistencia se debe al ADN-T de un vector binario).
- Prepare 1 L de medio de regeneración mezclando 4,4 g de vitaminas MS + B5 en polvo, 30 g de sacarosa (3%) y 0,5 g de sales MES en agua bidestilada. Ajusta el volumen a 1 L, mezcla y ajusta el pH a 5,8 con KOH. Trasvasar la solución a un frasco de 1 litro y añadir 3 g de gelificante (0,3 %). Autoclave el medio. Añadir NAA y BAP a una concentración final de 8 mg/L y 5 mg/L, respectivamente, y ticarcilina disódica a una concentración final de 100 mg/L.
- Prepare 1 L de medio de elongación de brotes mezclando 4,4 g de polvo de vitaminas MS + B5, 20 g de sacarosa (2%) y 0,5 g de sales MES en agua bidestilada. Ajusta el volumen a 1 L, mezcla y ajusta el pH a 5,8 con KOH. Transfiera la solución a una botella de 1 L y agregue 3 g de agar vegetal (0,3%). Autoclave el medio. Añadir BAP y GA3 a una concentración final de 0,5 mg/L y 0,03 mg/L, respectivamente, y cefotaxima a una concentración final de 100 mg/L.
- Prepare 1 L de medio de inducción radicular mezclando 2,2 g de polvo de vitaminas MS + B5, 10 g de sacarosa (1%) y 0,5 g de sales MES en agua bidestilada. Ajusta el volumen a 1 L, mezcla y ajusta el pH a 5,8 con KOH. Traspasar la solución a un frasco de 1 litro y añadir 3 g de gelificante (0,3%). Autoclave el medio. Añadir IBA y cefotaxima hasta una concentración final de 0,5 mg/L y 100 mg/L, respectivamente.
- Prepare 1 L de tampón de bromuro de cetiltrimetilamonio (CTAB) añadiendo 20 g de CTAB (2% p/v final), 100 mL de Tris-HCl 1M, pH 8,0 (100 mM final), 40 mL de EDTA 0,5 M, pH 8,0 (20 mM final), 81,8 g de NaCl (1,4 M final) y 5 g de PVP40 (0,5% p/v final). Ajustar a 1 L con agua bidestilada. Esterilizar la solución en autoclave. Almacene la solución hasta por 1 año a temperatura ambiente.
2. Transformación de Agrobacterium con un vector binario
- Preparar el ADN de un plásmido binario verificado que contenga el casete de ADN-T para integrarlo en el genoma de la planta. Asegúrese de que el ADN plasmídico contenga bajas sales para evitar chispas eléctricas cuando se utiliza la electroporación. Se recomienda utilizar un kit de extracción de ADN plasmídico de su elección.
- Prepare células electrocompetentes de Agrobacterium tumefaciens C58C1 que contengan el plásmido pRiA4b inductor de raíces pilosas inoculando 200 mL de YEB líquido precalentado (28 °C) con 8 mL de un cultivo fresco durante la noche. Incubar el cultivo a 28 °C mientras se agita hasta que la densidad óptica a 600 nm (OD600) sea de aproximadamente 0,5, correspondiente a la fase logarítmica media. Se tarda unas 4 - 5 h.
- Divida el cultivo de Agrobacterium en cuatro tubos de centrífuga estériles de 50 ml preenfriados. Centrifugar durante 15 min a 4 °C a 3.200 x g.
NOTA: Las celdas deben mantenerse frías a partir de este paso. - Retirar el sobrenadante y volver a suspender el pellet suavemente en (4x) 2,5 mL de glicerol frío (4 °C) al 10%. Agregue otros 47,5 ml de glicerol frío al 10% y mezcle suavemente.
- Células de pellets a 3.200 x g durante 15 min a 4 °C. Deseche el sobrenadante y vuelva a suspender las células en (4x) 10 ml de glicerol frío al 10%.
- Vuelva a granular las células y vuelva a suspenderlas en (4x) 0,75 ml de glicerol frío al 10%. Agrupe el contenido de los cuatro tubos en uno (volumen total = 3 ml).
- Divida la solución agrobacteriana en alícuotas de 50 μL en microtubos estériles de 1,5 ml preenfriados. Congele las alícuotas en hielo seco o nitrógeno líquido. Guarde los tubos a -80 °C para su uso futuro.
- Colocar un tubo de células competentes (50 μL) en hielo, mezclar con 5 μL de ADN plasmídico (1 μg en total, a partir del paso 2.1), transferir la mezcla a una cubeta de electroporación (espacio de 0,2 cm) e incubar durante 5 min en hielo.
- Coloque la cubeta en el electroporador y electropore las celdas con los siguientes ajustes: capacitancia 25 μFD, resistencia 400 Ω, tensión eléctrica 2,5 kV, duración del pulso 9,7 ms.
- Añadir 950 μL de medio líquido LB a las células, que luego se cultivan a 28 °C durante 2 h a 300 rpm en una termomezcladora. Colocar 50 μL del cultivo celular en un medio sólido LB con el antibiótico selectivo adecuado. Cultivar las placas durante 2 días a 28 °C.
NOTA: Se recomienda sembrar una variedad de cultivos celulares (10 μL - 100 μL) por placa para determinar un volumen de cultivo adecuado y evitar el crecimiento excesivo de bacterias. - Preparar cultivos líquidos de unas pocas colonias seleccionadas en 5 mL de medio líquido LB con antibióticos. Cultivar las bacterias durante la noche a 28 °C agitándolas. Utilice estos cultivos para las reservas de glicerol mezclando 0,5 ml de cultivo de bacterias líquidas y 0,5 ml de glicerol al 40%.
NOTA: Estas colonias se verifican para detectar la presencia del transgén mediante PCR de colonias. Para ello, se añade una pequeña cantidad de una colonia de una placa a la mezcla maestra de PCR que contiene tampón, dNTP y Taq polimerasa de elección, junto con cebadores que amplifican una parte del ADN-T de un vector binario. El inóculo de las reservas de glicerol se utiliza para la transformación de las plantas.
3. Transformación de la raíz pilosa de Brassica napus DH12075
- Coloque las semillas de Brassica napus DH12075 en microtubos y esterilícelas en una caja de flujo. En primer lugar, desengrasar las semillas con agua y detergente al 0,1% mientras se agitan durante 60 s. Luego, enjuague las semillas con agua seguida de etanol al 70%, ambos durante 60 s.
- Esterilizar las semillas con una solución al 10% de lejía comercial que contenga hipoclorito de sodio. Agita las semillas en esta solución durante 20 min.
- Lave las semillas 4 veces con agua estéril durante 60 s cada una. Colóquelos en placas de Petri que contengan el medio de germinación de semillas. Estratificar las semillas en frío a 4 °C durante la noche y trasladar las placas a una sala de cultivo (21 °C, 16 h luz / 8 h oscuridad).
- Transfiera las plántulas de 5 días a cajas de cultivo de plantas que contengan un medio de crecimiento de plantas.
NOTA: La mejor eficiencia de transformación en DH12075 se identificó para plántulas de 18 días de edad. La edad de las plántulas puede optimizarse para las condiciones de crecimiento locales u otros cultivares. - Inocular un cultivo líquido de Agrobacterium tumefaciens C58C1 portador de un plásmido inductor de raíces pilosas pRiA4b y el vector binario para su transformación (a partir del paso 2.11) con un bucle de inoculación. Utilice 5 ml de medio LB. Cultive este cultivo durante la noche a 28 °C hasta que alcance OD600 = 0,9 - 1.
NOTA: Se utiliza agrobacteria que contiene solo el plásmido Ri si se producen raíces peludas de tipo salvaje. - Inyecte una pequeña cantidad de cultivo (aproximadamente 50 μL) con una jeringa de insulina en el hipocótilo de una plántula de 18 días de edad (a partir del paso 3.4.). Perfore el hipocótilo con una aguja de 26G montada en la jeringa a aproximadamente 1 cm por encima de la superficie del medio. Inyecte el líquido en la herida. El tejido de la superficie del hipocótilo también puede ser rayado por la jeringa.
NOTA: El número de plántulas inoculadas debe adaptarse a las necesidades del experimentador. - Regrese las plantas a la sala de cultivo a 21 °C durante 2 a 4 semanas hasta que se forme un callo y raíces pilosas en el sitio de la herida.
- Cortar el callo con las raíces pilosas emergidas del hipocótilo y colocarlo en una placa de Petri con el medio de crecimiento de la raíz pilosa que contenga antibióticos selectivos (transportados por el ADN-T) y cefotaxima (200 mg/L) y ticarcilina (500 mg/L) para suprimir el crecimiento agrobacteriano. Selle las placas de Petri con cinta adhesiva permeable al gas. Cultivar las raíces pilosas a 24 °C en la oscuridad.
NOTA: La concentración adecuada de antibióticos específicos utilizados para la selección funcional debe probarse con raíces peludas de tipo salvaje. Para B. napus DH12075 raíces pilosas resistentes a la kanamicina, se utiliza una concentración de 25 mg/L de kanamicina.
NOTA: En este paso, es posible generar una planta compuesta que consiste en el brote de tipo silvestre y raíces peludas transgénicas que soportan el crecimiento de dicha planta. En lugar de cortar las raíces peludas de un tallo, se eliminan las raíces nativas de la planta. La planta con raíces pilosas emergentes se transfiere a una caja de cultivo de plantas con un medio de crecimiento vegetal compuesto que contiene cefotaxima (200 mg/L) y ticarcilina (500 mg/L) para suprimir el crecimiento agrobacteriano, y el antibiótico selectivo (transportado por el ADN-T). - Después de 1 a 2 semanas, aísle las raíces pilosas en la placa de Petri del callo e individualícelas en placas con el mismo medio de cultivo. Transfiera el cultivo a un plato nuevo cada 4 a 5 semanas. Añadir 0,25 mg/L de IBA para aumentar la ramificación de las raíces.
- Reducir las concentraciones de cefotaxima y ticarcilina gradualmente en cada transferencia en 100 mg/L (es decir, el medio para la primera transferencia contiene 100 mg/L de cefotaxima y 400 mg/L de ticarcilina; para la segunda transferencia, 300 mg/L de ticarcilina, etc.). Después de 3 a 4 meses, cultive las raíces pilosas en un medio de crecimiento de raíces pilosas con 100 mg/L de ticarcilina y el antibiótico selectivo.
4. Regeneración de Brassica napus DH12075 raíces pilosas
- Transfiera las líneas radiculares pilosas independientes a placas con medio de regeneración en condiciones estériles con pinzas, flameadas antes de su uso. Transfiera de 5 a 10 raíces por placa de Petri y cultívelas a 21 °C en un fotoperíodo de día largo (16 h de luz / 8 h de oscuridad). Selle las placas de Petri con cinta adhesiva permeable al gas.
- Cada 3 a 4 semanas, transfiera las raíces pilosas a placas con medio de regeneración fresco. Tenga en cuenta que los callos se forman después de aproximadamente 2 semanas. El callo comienza a dispararse después de 2 semanas más hasta 8 a 9 semanas después de la formación del callo.
- Individualice los brotes y transfiéralos a cajas de cultivo de plantas con medio de elongación de brotes durante 2 a 3 semanas para promover el alargamiento de los brotes.
- Transfiera los brotes alargados a cajas de cultivo de plantas con un medio de inducción de raíces. Refresque el cultivo cada 3 o 4 semanas. La eficiencia de enraizamiento en DH12075 es del 87% a los 30 días y hasta el 100% a los 60 días.
- Transfiera las plantas enraizadas al suelo después de eliminar cualquier rastro de agente gelificante para prevenir infecciones por hongos. Asegúrese de que las plantas se aclimaten primero en los fitotrones (21 °C, fotoperíodo de día largo, 150 μE) y luego transfiéralas a un invernadero para su floración (21 °C / 18 °C, fotoperíodo de día largo, 150 μE).
5. Selección de plantas regeneradoras y T1
NOTA: Las líneas de raíz pilosas se pueden seleccionar antes de entrar en el proceso de regeneración. El tipo de selección depende del contenido que porta el transgén. Las raíces pilosas pueden ser muestreadas para la extracción de ADN y genotipado o detección de mutaciones, extracción de ARN con posterior síntesis de ADNc y RT-qPCR para el análisis del nivel de expresión del gen de elección, microscopía para la detección de fluorescencia o tratamiento para tinción de GUS.
- Después de la transferencia al suelo, genotipar las plantas regenerantes T0 (y las plántulas T1) nuevamente para evitar escapes de los procedimientos de selección. Las plantas T0 exhiben un fenotipo alterado llamado fenotipo Ri: crecimiento extenso de raíces, hojas rizadas y brotes enanos causados por la presencia del TL y/o TR-DNA del plásmido Ri insertado en el genoma de la planta.
- Para acelerar la selección de T1, utilice las semillas que contienen embriones maduros verdes (aprox. 21 - 28 días después de la polinización para DH12075 para un embrión torpedo o más antiguo) de plantas regeneradoras T0 para el rescate de embriones.
- Trabajar en la caja de flujo estéril. Recoger las silicuas y esterilizarlas en la superficie con etanol al 70%.
- Colóquelos en una cinta adhesiva de doble cara pegada con cinta adhesiva en la tapa de un plato o en un portaobjetos.
- Con un binocular estereoscópico, corte la sílice a lo largo de los márgenes de la válvula con una aguja de 26G. Asegúrese de que el corte no dañe las semillas. Para facilitar el agarre, monte la aguja en una jeringa de 1 ml.
- Abre los carpelos y pégalos a la cinta. Recoja las semillas inmaduras y transfiéralas a placas con medio para la germinación de las semillas. Selle las placas con cinta adhesiva permeable al gas.
- Colocar las placas en una sala de cultivo (21 °C, 16 h luz / 8 h oscuridad) hasta la germinación.
- Genotipar las plántulas T1 para determinar la presencia del transgén de interés y la ausencia del Ri TR/TL (Figura 1). Recolectar material foliar y extraer su ADN utilizando el método de su elección. El método CTAB se describe aquí:
- Recoja el material de la hoja en un microtubo de 2 ml que contenga dos perlas de cerámica. Congele el tubo en nitrógeno líquido.
- Muele el material con un molino de bolas. Alternativamente, se puede usar un mortero.
- Después de un centrifugado rápido, agregue 400 μL de tampón CTAB al polvo. Agitar brevemente, girar hacia abajo e incubar a 60 °C durante al menos 50 min.
- Enfríe la solución a temperatura ambiente durante 15 min. Agregue un volumen de cloroformo y mezcle suavemente.
PRECAUCIÓN: Cuando use cloroformo, trabaje bajo el flujo químico y use guantes para protegerse. Cualquier solución que contenga cloroformo debe desecharse en el contenedor de basura apropiado. - Centrifugar durante 5 min a 18.400 x g utilizando una centrífuga de mesa. Transferir 250 - 350 μL de la fase acuosa superior a un nuevo microtubo. Omita la interfase.
- Agregue un volumen de isopropanol, mezcle bien e incube durante 5 minutos a temperatura ambiente. Centrífuga durante 40 min a 18.400 x g.
- Deseche el líquido y agregue 200 μL de etanol al 70%. Lavar el pellet y la centrífuga durante 15 min a 18.400 x g.
- Deseche el líquido. Secar al aire el pellet y añadir 50 - 100 μL de agua ultrapura. Deje que el ADN se disuelva durante 1 h o toda la noche en el refrigerador.
- Realizar un genotipado por PCR para el gen rolA (TL), el gen aux1 (TR) y el locus virC (Agrobacterium). Prepare la reacción de PCR utilizando el ADN preparado (del paso 5.3.), cebadores, tampón, dNTP y Taq polimerasa de acuerdo con el protocolo del fabricante. Los fragmentos amplificados tienen una longitud de 200 a 500 pb.
Imprimaciones específicas para rolA:
Adelante: GTTAGGCGTGCAAAGGCCAAG
Reverso: TGCGTATTAATCCCGTAGGTC
Imprimaciones específicas para aux1:
Adelante: CATAGGATCGCCTCACAGGT
Reverso: CGTTGCTTGATGTCAGGAGA
Imprimaciones específicas para virC:
Adelante: AATGCGTCTCTCTCGTGCAT
Reverso: AAACCGACCACTAACGCGAT
NOTA: La transferencia e integración del ADN-T puede ser parcial, y solo partes de TL y/o TR pueden integrarse en el genoma. Por lo tanto, se recomienda analizar la presencia de otros ORF de TL (p. ej., rolB y rolC) y TR (aux2, mas1, ags1) en plántulas T1. Las secuencias de cebadores específicas de estos loci se enumeran en Jedličková et al.9. - Evaluar las reacciones de PCR mediante electroforesis en gel.
NOTA: Se recomienda incluir un control positivo en este análisis para garantizar que tenga ADN de grado PCR. - Seleccionar la presencia (o ausencia) del transgén de acuerdo con los protocolos basados en el contenido de este transgén.
- Transfiera las plántulas seleccionadas al suelo.
6. Transformación y regeneración de la raíz pilosa en Arabidopsis thaliana Col-0
- Esterilizar las semillas de A. thaliana en la superficie con un método de elección (lejía, etanol o cloro gaseoso).
- Coloque las semillas estériles en un medio para la germinación de las semillas. Después de 2 días de estratificación en frío, traslade las placas a una sala de cultivo (21 °C con fotoperiodo de día largo y 50% de humedad).
- Transfiera las plántulas de 1 semana a una caja de cultivo de plantas con medio de crecimiento de plantas.
- Prepare los cultivos de Agrobacterium como se indica en el paso 3.5.
- Inyecte una pequeña cantidad de cultivo (aproximadamente 50 μL) con una aguja montada en una jeringa de insulina en la base del tallo de la inflorescencia primaria (aproximadamente 1 - 2 cm por encima de la roseta) de plántulas de Arabidopsis de 1 mes de edad. El tejido de la superficie del tallo primario también puede ser rayado por la jeringa.
- A las 2-4 semanas después de la inyección, extirpe las raíces pilosas emergentes y cultívelas en placas de Petri con el medio de crecimiento de raíces pilosas suplementado con el antibiótico selectivo (transportado por el ADN-T) y cefotaxima (200 mg/L) y ticarcilina (500 mg/L) para suprimir el crecimiento agrobacteriano. Incubar las placas a 24 °C en la oscuridad.
- Después de 1 a 2 semanas, individualice las raíces pilosas en placas con el mismo medio de cultivo. Transfiera las líneas de raíz pilosas seleccionadas a un medio fresco cada 4 a 5 semanas.
NOTA: Las raíces pilosas de A. thaliana son más delgadas que las de B. napus, y se debe tener precaución al transferirlas a medios frescos. - Transfiera las raíces pilosas a placas con medio de regeneración para inducir la formación de callos. Cultivar las placas a 21 °C en un fotoperiodo de día largo (16 h luz / 8 h oscuridad).
- Los brotes emergen del callo después de 18 a 21 días de cultivo. Corte los brotes y transfiéralos a un medio de elongación de brotes durante 2 a 3 semanas para promover el crecimiento y el alargamiento.
- Transfiera los brotes alargados al medio de inducción de la raíz.
- Transfiera las plantas enraizadas al suelo. Las plantas T0 también presentan un fenotipo Ri. Realice la selección transgénica, como se describe para B. napus DH12075 (paso 5).
Resultados
Previamente hemos optimizado un protocolo para la inducción de raíces pilosas por inyección en tres cultivares de Brassica napus, a saber, DH12075, Topas DH4079 y Westar9. Para aplicar este protocolo de transformación a la especie modelo A. thaliana, se inyectó un inóculo agrobacteriano a los tallos primarios de la inflorescencia de plántulas de 1 mes de edad. Las raíces pilosas emergieron en el sitio de la inyección después de 2-4 semanas. Las raíces pilosas se extirparon y se cultivaron en el medio sólido. La comparación del método en estas dos especies se muestra en la Figura 1.
Las líneas de raíces pilosas seleccionadas se transfirieron al medio de regeneración para inducir la formación de brotes. En A. thaliana, se indujeron callos amarillos en un plazo de 14 días en las 10 líneas de raíces pilosas probadas. Los primeros primordios del brote, visibles como manchas de color verde oscuro, emergieron dentro de las 3 semanas posteriores a la transferencia al medio de regeneración (Figura 2). Después de 4 semanas de cultivo, los brotes cubrieron las raíces pilosas en 9 de las 10 líneas de raíces pilosas (90% de eficiencia de regeneración). En algunos casos, las raíces adventicias se obtuvieron del callo (Figura 2H). Una línea no se regeneró incluso después de 3 meses en el medio de regeneración (cada 4 semanas, las raíces pilosas se transfirieron a un medio fresco). Por lo tanto, la eficiencia de regeneración de las raíces pilosas de A. thaliana se asemeja a la eficiencia de B. napus DH120759.
Los regenerantes de raíces peludas de B. napus y A. thaliana muestran un fenotipo enano (Figura 3), una característica típica de las plantas derivadas de raíces peludas2. También observamos sistemas radiculares densos, hojas arrugadas y cambios en el tiempo de floración. Este fenotipo llamado raíz pilosa (o Ri) es causado por los genes de rol del plásmido Ri insertados en el genoma de la planta. La inserción del ADN-T Ri y el transgén codificado en un vector binario pueden ser independientes o estar ligados. Por lo tanto, un análisis de segregación de la progenie T1 creada por autopolinización ayuda a identificar plantas libres de rollos que expresan el transgén de interés. El genotipado de las plantas T1 se realiza mediante cebadores de PCR específicos para los ORFs de TL y TR y el transgén de interés. La ausencia de contaminación agrobacteriana se verifica por la ausencia de productos de PCR de los cebadores virC (Figura 1).
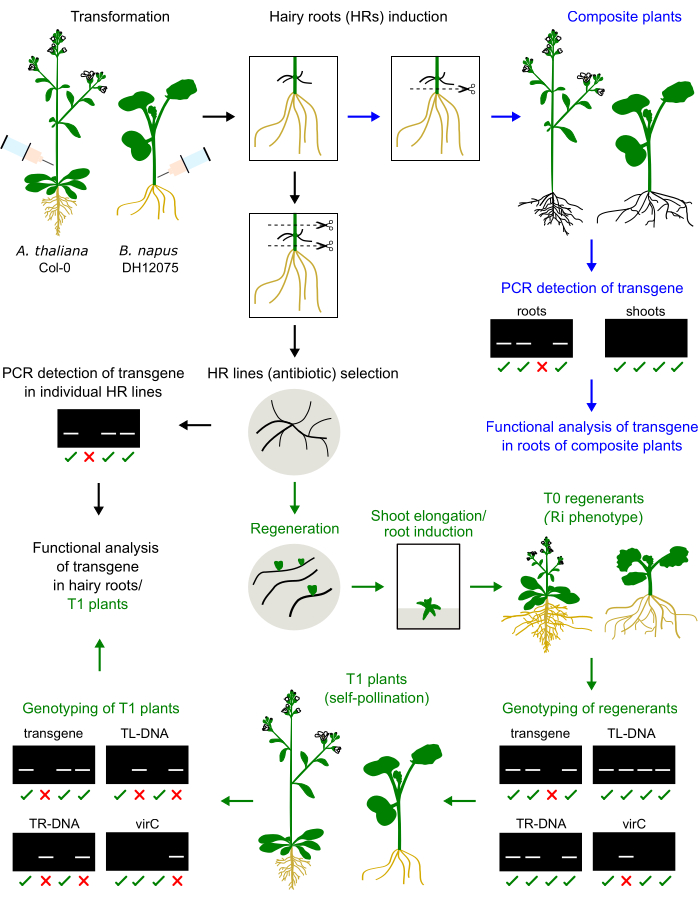
Figura 1: Resumen del procedimiento en A. thaliana y B. napus. La inyección del inóculo de Agrobacterium en el tallo del hipocótilo o inflorescencia primaria induce el desarrollo de raíces pilosas. Las raíces peludas pueden reemplazar a las raíces nativas para generar una planta compuesta que será genotipada y analizada (flechas azules). Las raíces pilosas cultivadas pueden regenerarse en plantas T0, propagarse en plantas T1 y genotiparse (flechas verdes). Las raíces pilosas también se pueden subcultivar para el análisis funcional (flecha negra). Se presentan ejemplos de resultados de genotipado. Haga clic aquí para ver una versión más grande de esta figura.
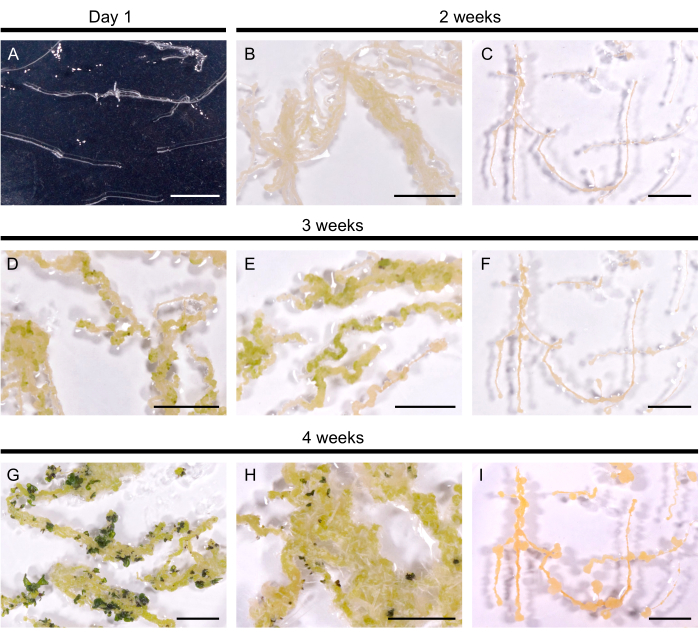
Figura 2: Regeneración de raíces pilosas en A. thaliana. (A) Cultivo de raíces pilosas 1 día después de su transferencia a placas. (B, C) Calli se desarrolló dentro de las 2 semanas posteriores al cultivo en medio de regeneración. (D, E) Los primordios de los brotes emergieron después de 3 semanas de cultivo. (G, H) Los brotes se forman después de 4 semanas. (H) Las raíces adventicias se desarrollaron a partir del callo. (C, F, I) Línea radicular pilosa no regeneradora. Las barras de escala representan 1 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Fotos representativas de plantas silvestres de B. napus y A. thaliana y regenerantes derivados de raíces peludas (plantas T0). Obsérvese el fenotipo Ri de los regenerantes. Las barras de escala representan 2 cm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Desarrollamos un protocolo simple para la transformación de la raíz pilosa y su posterior regeneración en B. napus y A. thaliana. Este proceso incluye la inducción de raíces pilosas a base de inyección en el hipocótilo (B. napus) o en el tallo primario de la inflorescencia (A. thaliana). El método de inyección del hipocótilo con la cepa agrobacteriana C58C1 portadora de un plásmido Ri también fue efectivo en la familia Fabaceae10,11, además de los miembros de Brassicaceae presentados en este estudio.
Una alternativa al método basado en inyección es la transformación basada en inmersión que consiste en la inmersión del explante en una suspensión bacteriana, seguida del cocultivo del explante con agrobacterias. La ventaja del método basado en inyección sobre el método de inmersión es el tiempo ahorrado por la ausencia de algunos pasos del protocolo: preparación del explante, prueba del tiempo de cocultivo y cultivo en un medio que contiene hormonas para la inducción de raíces pilosas. A pesar de que ambos abordajes son efectivos para la inducción de raíces pilosas, se observó una mayor eficiencia de transformación en algunas especies con el método basado en inyección en comparación con el método de inmersión en explantes12,13. Además, la transformación basada en inyección también es útil para generar plantas compuestas (raíces peludas transgénicas y brotes de tipo silvestre). Después de cortar las raíces originales de la planta transformada, las raíces peludas apoyan el crecimiento de la planta y el transgén se puede estudiar en el contexto de toda la planta.
El paso crítico de la inducción de la raíz pilosa es inyectar el inóculo en el hipocótilo o tallo de la inflorescencia primaria. Los hipocótilos de B. napus son frágiles, y cortar todo el hipocótilo puede suceder fácilmente. Lo mismo se puede observar con A. thaliana debido a la delgadez del tallo de la inflorescencia. Si se requiere una comparación de la eficiencia de transformación de diferentes especies/cultivares, recomendamos que una persona realice todos los experimentos para evitar el error causado por la manipulación y la habilidad en la inyección de las plantas.
Desarrollamos un protocolo efectivo para la regeneración de raíces pilosas en B. napus DH12075 y A. thaliana Col-0. Como la regeneración es un proceso muy variable, se pueden aplicar algunas modificaciones al protocolo a una especie o cultivar de elección. Por ejemplo, los brotes peludos derivados de la raíz pueden ser provocados por una relación diferente de auxina/citoquinina (1:1) en B. oleracea14. Alternativamente, se puede utilizar citoquinina tidiazurón en lugar de BAP, como en el caso de las raíces pilosas de B. campestris 15.
Las múltiples inserciones del ADN T del plásmido Ri en el genoma de la planta representan una limitación potencial del sistema de transformación y regeneración de la raíz pilosa. En tales casos, no se descubren plantas libres de TL/TR del plásmido Ri después de un análisis de segregación de plántulas T1. Por lo tanto, recomendamos generar varias líneas de raíces pilosas independientes para cada transgén.
Los cultivos de raíces pilosas son una herramienta extremadamente poderosa para los estudios funcionales de genes, principalmente debido a su rápido establecimiento y mantenimiento barato (no se necesitan hormonas en los medios de cultivo). Este protocolo cubre los métodos para la inducción y regeneración de raíces pilosas en B. napus y A. thaliana, que se pueden utilizar para estudiar el transgén de interés directamente en cultivos de raíces pilosas, en el contexto de toda la planta utilizando plantas compuestas, o después de la regeneración de las plantas transgénicas.
Divulgaciones
Los autores declaran que la investigación se llevó a cabo sin ninguna relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Agradecimientos
Agradecemos a Jiří Macas (Centro de Biología CAS, České Budějovice, República Checa) por proporcionar la cepa agrobacteriana. El Core Facility Plants Sciences de CEITEC MU es reconocido por su apoyo técnico. Este trabajo fue apoyado por el Ministerio de Educación, Juventud y Deportes de la República Checa con el Proyecto del Fondo Europeo de Desarrollo Regional "SINGING PLANT" (no. CZ.02.1.01/0.0/0.0/16_026/0008446) y el proyecto INTER-COST LTC20004.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
Referencias
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados