Method Article
Haarwurzeltransformation und -regeneration bei Arabidopsis thaliana und Brassica napus
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt die Induktion der Haarwurzel unter Verwendung von primären Arabidopsis-Blütenstandsstämmen und Brassica napus-Hypokotylen . Die Haarwurzeln können kultiviert und als Explantate zur Regeneration transgener Pflanzen verwendet werden.
Zusammenfassung
Die Haarwurzeltransformation stellt ein vielseitiges Werkzeug für die Pflanzenbiotechnologie bei verschiedenen Arten dar. Die Infektion mit einem Agrobacterium-Stamm , der ein wurzelinduzierendes (Ri) Plasmid trägt, induziert die Bildung von Haarwurzeln an der Wundstelle nach dem Transfer von T-DNA aus dem Ri-Plasmid in das Pflanzengenom. Das Protokoll beschreibt detailliert das Verfahren der injektionsbasierten Haarwurzelinduktion bei Brassica napus DH12075 und Arabidopsis thaliana Col-0. Die Haarwurzeln können verwendet werden, um ein Transgen von Interesse zu analysieren oder für die Erzeugung transgener Pflanzen zu verarbeiten. Regenerationsmedium, das Cytokinin 6-Benzylaminopurin (5 mg/L) und Auxin-1-Naphthalinessigsäure (8 mg/L) enthält, löst bei beiden Spezies erfolgreich die Sprossbildung aus. Das Protokoll umfasst die Genotypisierung und Auswahl von Regeneriermitteln und T1-Pflanzen, um Pflanzen zu erhalten, die ein Transgen von Interesse tragen und frei von T-DNA aus dem Ri-Plasmid sind. Ein alternativer Prozess, der zur Bildung einer Verbundanlage führt, wird ebenfalls dargestellt. In diesem Fall werden behaarte Wurzeln am Spross (anstelle der natürlichen Wurzeln) belassen, was die Untersuchung eines Transgens in behaarten Wurzelkulturen im Kontext der gesamten Pflanze ermöglicht.
Einleitung
Die Pflanzentransformation ist der Flaschenhals jeder genetischen Studie in der Pflanzenbiologie. Ein bodenbürtiges Bakterium, Agrobacterium tumefaciens, wird häufig als Mittel zur Genübertragung durch Blütendip oder Gewebekultur zur Erzeugung von Transformanten verwendet. A. tumefaciens infiziert Pflanzen an einer Wundstelle und verursacht Tumore durch die Übertragung und Integration von T-DNA von einem tumorinduzierenden (Ti) Plasmid in das Genom der Wirtspflanze. Modifizierte A. tumefaciens-Stämme mit modifiziertem Ti-Plasmid ohne Wildtyp-T-DNA und einem binären Vektor mit künstlicher T-DNA und Klonierungsstellen zum Einfügen eines Gens von Interesse werden üblicherweise als effizientes Pflanzentransformationssystemverwendet 1. Viele Modellarten und -kulturen sind jedoch resistent gegen Blütendip oder In-vitro-Pflanzenregeneration oder haben lange Wachstumszyklen, was sich auf die Effizienz dieses Transformationssystems auswirkt.
Agrobacterium rhizogenes induziert die Bildung von Adventivwurzeln oder Haarwurzeln an der Wundstelle nach der Infektion einer Wirtspflanze. Ähnlich wie A. tumefaciens überträgt A. rhizogenes eine T-DNA von einem wurzelinduzierenden (Ri) Plasmid auf das Genom der Wirtspflanze, was zur Entwicklung transgener Haarwurzeln führt. Dieser Prozess wird hauptsächlich durch die Gene der onkogenen Wurzelloci (rol)gesteuert 2,3. Unter Verwendung von Agrobakterienstämmen, die sowohl das Ri-Plasmid als auch einen künstlichen binären Vektor tragen, der für ein Gen von Interesse kodiert, wurden Haarwurzelkulturen verwendet, um rekombinante Proteine herzustellen, die Funktion von Promotoren oder Genen zu analysieren oder Genome mit Clustered Regularly Interspaced Short Palindromic Repeats (CRISPRs)/CRISPR-assoziiertem Protein 9 (Cas9)4,5,6 zu bearbeiten.
Unser Protokoll verwendet den transkonjuganten Stamm Ti-less A. tumefaciens C58C1, der das Ri-Plasmid pRiA4b7 trägt. Die T-DNA des Ri-Plasmids besteht aus zwei Regionen, der rechten und linken T-DNA (TR-DNA bzw. TL-DNA), die sich unabhängig voneinander in das Pflanzengenom integrieren können8. Unter Ausnutzung dieses Systems wurde der langwierige Explantat-Transformationsprozess in der Brassica napus DH12075-Sorte optimiert9. Das unten beschriebene Protokoll ermöglicht die Regeneration ausgewählter behaarter Wurzellinien und die Gewinnung von T1-Pflanzen, die das gewünschte Transgen tragen und frei von Rol-Genen sind, in etwa 1 Jahr. Die injektionsbasierte Haarwurzeltransformation kann bei anderen Brassicaceae-Arten angewendet werden, wie die Transformation von Arabidopsis thaliana Col-0 zeigt. Während Hypokotyl zur Transformation von B. napus verwendet wird, wird A. thaliana in den primären Blütenstandsstamm injiziert.
Protokoll
1. Vorbereitung von Medien und Lösungen
- Bereiten Sie die Hormonstammlösungen vor.
- Zur Herstellung von 50 ml 1-Naphthalinessigsäure (NAA), 6-Benzylaminopurin (BAP) und Indol-3-buttersäure (IBA)-Stammlösung mit einer Konzentration von 5 mg/ml lösen Sie 250 mg des pulverförmigen Hormons in 2 ml 1 M Natriumhydroxid (NaOH) und stellen Sie das Volumen mit Reinstwasser auf 50 ml ein.
- Um 50 ml Gibberellinsäure (GA3) mit einer Konzentration von 1 mg/ml herzustellen, lösen Sie 50 mg des pulverförmigen Hormons in 2 ml Ethanol auf und stellen Sie das Volumen auf 50 ml Reinstwasser ein.
- Filtern Sie die Lösung mit einem sterilen Spritzenvorsatzfilter mit einer Porengröße von 0,22 μm und verteilen Sie sie zur Lagerung in sterile 2-ml-Röhrchen. Lagern Sie die Lösung bei -20 °C oder 4 °C, je nach Empfehlung des Herstellers.
- Bereiten Sie antibiotische Stammlösungen vor. Für 50 ml Cefotaxim- und Ticarcillin-Dinatrium-Stammlösung mit einer Konzentration von 100 mg/ml werden 0,5 g des pulverförmigen Antibiotikums in 40 ml Reinstwasser gelöst und auf ein Endvolumen von 50 ml eingestellt. Filtern Sie die Lösung mit einem sterilen Spritzenvorsatzfilter mit einer Porengröße von 0,22 μm und verteilen Sie sie zur Lagerung in sterile 2-ml-Röhrchen. Lagern Sie die Lösung bei -20 °C.
HINWEIS: Antibiotika und Hormone werden immer in das gekühlte Medium gegeben. - Bereiten Sie 1 l Luria-Bouillon (LB)-Medium vor, indem Sie 10 g Bacto-Trypton, 5 g Hefeextrakt und 5 g Natriumchlorid (NaCl) in einen 1-Liter-Messzylinder geben und das Volumen mit doppelt destilliertem Wasser auf 1 l einstellen. Stellen Sie den pH-Wert mit KOH mit einem pH-Messgerät auf 7,0 ein (gemäß den Anweisungen des Herstellers). Die Lösung in eine 1-Liter-Flasche umfüllen und 15 g bakteriologischen Agar (1,5%) hinzufügen, wenn ein festes Medium hergestellt wird, und das Medium autoklavieren. Geben Sie bei Bedarf die entsprechenden Antibiotika (bakterielle Resistenz wird auf dem binären Vektor übertragen) in das gekühlte Medium.
HINWEIS: Verwenden Sie einen Autoklaven, um die Lösung zu sterilisieren. Legen Sie die Flasche in den Korb, schließen Sie den Deckel und sterilisieren Sie sie 20 Minuten lang bei 121 °C und 98,9 kPa. Dieses Protokoll wird in weiteren Schritten immer für Autoklavierlösungen verwendet. - Bereiten Sie 1 l Hefeextrakt-Rindfleischmedium (YEB) zu, indem Sie 5 g Rindfleischextrakt, 1 g Hefeextrakt, 5 g Pepton, 5 g Saccharose und 0,5 g Magnesiumchlorid (MgCl2) in doppelt destilliertes Wasser mischen. Stellen Sie das Volumen auf 1 l ein. Füllen Sie die Lösung in eine 1-Liter-Flasche um. Autoklavieren Sie das Medium.
- Bereiten Sie 1 l Medium für die Samenkeimung vor, indem Sie 2,2 g Murashige- und Skoog (MS)-Pulver, 10 g Saccharose (1%) und 0,5 g 2-(N-Morpholino)ethansulfonsäure (MES)-Natriumsalze in doppelt destilliertes Wasser mischen. Stellen Sie das Volumen auf 1 l ein, mischen Sie und stellen Sie den pH-Wert mit KOH auf 5,8 ein. Die Lösung in eine 1-Liter-Flasche umfüllen und 8 g Pflanzenagar (0,8%) hinzufügen. Autoklavieren Sie das Medium.
- Bereiten Sie 1 l Pflanzenwachstumsmedium vor, indem Sie 2,2 g MS-Pulver, 5 g Saccharose (0,5%) und 0,5 g MES-Salze in doppelt destilliertes Wasser mischen. Stellen Sie das Volumen auf 1 l ein, mischen Sie und stellen Sie den pH-Wert mit KOH auf 5,8 ein. Die Lösung in eine 1-Liter-Flasche umfüllen und 8 g Pflanzenagar (0,8 %) hinzufügen. Autoklavieren Sie das Medium.
- Bereiten Sie 1 l Haarwurzelwachstumsmedium vor, indem Sie 4,4 g MS + B5-Vitaminpulver, 30 g Saccharose (3%) und 0,5 g MES-Salze in doppelt destilliertes Wasser mischen. Stellen Sie das Volumen auf 1 l ein, mischen Sie und stellen Sie den pH-Wert mit KOH auf 5,8 ein und füllen Sie die Lösung in eine 1-Liter-Flasche um. 3 g Geliermittel (0,3%) zugeben und das Medium autoklavieren. Cefotaxim und Ticarcillin-Dinatrium bis zu einer Endkonzentration von 100 - 200 mg/l bzw. 100 - 500 mg/l hinzufügen. Fügen Sie bei Bedarf die entsprechenden Antibiotika hinzu (die Resistenz ist auf die T-DNA eines binären Vektors zurückzuführen).
- Bereiten Sie 1 l zusammengesetztes Pflanzenwachstumsmedium vor, indem Sie 2,2 g MS + B5-Vitaminpulver, 10 g Saccharose (1%) und 0,5 g MES-Salze in doppelt destilliertes Wasser mischen. Stellen Sie das Volumen auf 1 l ein, mischen Sie und stellen Sie den pH-Wert mit KOH auf 5,8 ein und füllen Sie die Lösung in eine 1-Liter-Flasche um. 6 g Geliermittel (0,6%) zugeben und das Medium autoklavieren. Cefotaxim und Ticarcillin-Dinatrium bis zu einer Endkonzentration von 200 mg/l bzw. 500 mg/l zugeben. Fügen Sie bei Bedarf die entsprechenden Antibiotika hinzu (die Resistenz ist auf die T-DNA eines binären Vektors zurückzuführen).
- Bereiten Sie 1 l Regenerationsmedium vor, indem Sie 4,4 g MS + B5-Vitaminpulver, 30 g Saccharose (3%) und 0,5 g MES-Salze in doppelt destilliertes Wasser mischen. Stellen Sie das Volumen auf 1 l ein, mischen Sie und stellen Sie den pH-Wert mit KOH auf 5,8 ein. Die Lösung in eine 1-Liter-Flasche umfüllen und 3 g Geliermittel (0,3 %) hinzufügen. Autoklavieren Sie das Medium. NAA und BAP bis zu einer Endkonzentration von 8 mg/l bzw. 5 mg/l und Ticarcillin-Dinatrium bis zu einer Endkonzentration von 100 mg/l hinzufügen.
- Bereiten Sie 1 l Sprossverlängerungsmedium vor, indem Sie 4,4 g MS + B5-Vitaminpulver, 20 g Saccharose (2%) und 0,5 g MES-Salze in doppelt destilliertes Wasser mischen. Stellen Sie das Volumen auf 1 l ein, mischen Sie und stellen Sie den pH-Wert mit KOH auf 5,8 ein. Die Lösung in eine 1-Liter-Flasche umfüllen und 3 g Pflanzenagar (0,3%) hinzufügen. Autoklavieren Sie das Medium. BAP und GA3 bis zu einer Endkonzentration von 0,5 mg/l bzw. 0,03 mg/l und Cefotaxim bis zu einer Endkonzentration von 100 mg/l hinzufügen.
- Bereiten Sie 1 l Wurzelinduktionsmedium vor, indem Sie 2,2 g MS + B5-Vitaminpulver, 10 g Saccharose (1%) und 0,5 g MES-Salze in doppelt destilliertes Wasser mischen. Stellen Sie das Volumen auf 1 l ein, mischen Sie und stellen Sie den pH-Wert mit KOH auf 5,8 ein. Die Lösung in eine 1-Liter-Flasche umfüllen und 3 g Geliermittel (0,3%) hinzufügen. Autoklavieren Sie das Medium. IBA und Cefotaxim werden in einer Endkonzentration von 0,5 mg/l bzw. 100 mg/l zugegeben.
- Bereiten Sie 1 l Cetyltrimethylammoniumbromid (CTAB)-Puffer vor, indem Sie 20 g CTAB (2 % w/v final), 100 ml 1 M Tris-HCl, pH 8,0 (100 mM endgültig), 40 ml 0,5 M EDTA, pH 8,0 (20 mM endgültig), 81,8 g NaCl (1,4 M endgültig) und 5 g PVP40 (0,5 % w/v endgültig) hinzufügen. Mit doppelt destilliertem Wasser auf 1 l einstellen. Autoklavieren Sie die Lösung. Lagern Sie die Lösung bis zu 1 Jahr bei Raumtemperatur.
2. Transformation von Agrobacterium mit einem binären Vektor
- Bereiten Sie die DNA eines verifizierten binären Plasmids vor, das die T-DNA-Kassette enthält, die in das Pflanzengenom integriert werden soll. Stellen Sie sicher, dass die Plasmid-DNA niedrige Salze enthält, um elektrische Funken bei der Elektroporation zu vermeiden. Die Verwendung eines Plasmid-DNA-Extraktionskits Ihrer Wahl wird empfohlen.
- Bereiten Sie elektrokompetente Agrobacterium tumefaciens C58C1-Zellen vor, die das Haarwurzel-induzierende Plasmid pRiA4b enthalten, indem Sie 200 ml vorgewärmtes (28 °C) YEB mit 8 ml einer frischen Übernachtkultur beimpfen. Die Kultur wird bei 28 °C unter Schütteln inkubiert, bis die optische Dichte bei 600 nm (OD600) etwa 0,5 beträgt, was der Mid-Log-Phase entspricht. Es dauert ca. 4 - 5 h.
- Teilen Sie die Agrobacterium-Kultur in vier vorgekühlte sterile 50-ml-Zentrifugenröhrchen auf. 15 min bei 4 °C bei 3.200 x g zentrifugieren.
HINWEIS: Die Zellen sollten ab diesem Schritt kalt gehalten werden. - Entfernen Sie den Überstand und resuspendieren Sie das Pellet vorsichtig in (4x) 2,5 ml kaltem (4 °C) 10%igem Glycerin. Fügen Sie weitere 47,5 ml kaltes 10%iges Glycerin hinzu und mischen Sie vorsichtig.
- Pelletzellen bei 3.200 x g für 15 min bei 4 °C. Überstand entsorgen und Zellen in (4x) 10 ml kaltem 10%igem Glycerin resuspendieren.
- Pelletieren Sie die Zellen erneut und resuspendieren Sie sie in (4x) 0,75 ml kaltem 10%igem Glycerin. Fassen Sie den Inhalt aller vier Röhrchen in einem zusammen (Gesamtvolumen = 3 ml).
- Teilen Sie die agrobakterielle Lösung in 50 μl Aliquote in vorgekühlten sterilen 1,5-ml-Mikroröhrchen. Frieren Sie die Aliquots auf Trockeneis oder flüssigem Stickstoff ein. Lagern Sie die Röhrchen bei -80 °C für die zukünftige Verwendung.
- Ein Röhrchen mit kompetenten Zellen (50 μl) auf Eis legen, mit 5 μl Plasmid-DNA (insgesamt 1 μg, aus Schritt 2.1) mischen, die Mischung in eine Elektroporationsküvette (0,2 cm Abstand) geben und 5 Minuten auf Eis inkubieren.
- Legen Sie die Küvette in den Elektroporator und elektropolieren Sie die Zellen mit folgenden Einstellungen: Kapazität 25 μFD, Widerstand 400 Ω, elektrische Spannung 2,5 kV, Impulsdauer 9,7 ms.
- Geben Sie 950 μl flüssiges LB-Medium zu den Zellen, die dann bei 28 °C für 2 h bei 300 U/min in einem Thermomixer kultiviert werden. Platte 50 μl der Zellkultur auf ein festes LB-Medium mit dem entsprechenden selektiven Antibiotikum. Die Platten 2 Tage lang bei 28 °C kultivieren.
HINWEIS: Es wird empfohlen, eine Reihe von Zellkulturen (10 μl - 100 μl) pro Platte zu plattieren, um ein geeignetes Kulturvolumen zu bestimmen und ein Überwachsen von Bakterien zu vermeiden. - Bereiten Sie Flüssigkulturen aus einigen ausgewählten Kolonien in 5 ml LB-Flüssigmedium mit Antibiotika vor. Züchten Sie die Bakterien über Nacht bei 28 °C unter Schütteln. Verwenden Sie diese Kulturen für Glycerinbestände, indem Sie 0,5 ml flüssige Bakterienkultur und 0,5 ml 40% Glycerin mischen.
HINWEIS: Diese Kolonien werden durch Kolonie-PCR auf das Vorhandensein des Transgens überprüft. Fügen Sie zu diesem Zweck eine kleine Menge einer Kolonie von einer Platte in den PCR-Mastermix hinzu, der Puffer, dNTP und Taq-Polymerase Ihrer Wahl enthält, zusammen mit Primern, die einen Teil der T-DNA aus einem binären Vektor amplifizieren. Inokulum aus den Glycerinbeständen wird für die Umwandlung der Pflanzen verwendet.
3. Haarwurzeltransformation von Brassica napus DH12075
- Geben Sie die Samen von Brassica napus DH12075 in Mikroröhrchen und sterilisieren Sie sie in einer Flowbox. Zuerst die Samen mit Wasser und 0,1% Reinigungsmittel entfetten und dabei 60 s lang schütteln. Spülen Sie dann die Samen mit Wasser ab, gefolgt von 70% Ethanol, beides für 60 s.
- Sterilisieren Sie die Samen mit einer 10%igen Lösung aus handelsüblichem Bleichmittel, das Natriumhypochlorit enthält. Schütteln Sie die Samen in dieser Lösung 20 Minuten lang.
- Die Samen 4x mit sterilem Wasser für je 60 s waschen. Legen Sie sie auf Petrischalen mit dem Keimmedium der Samen. Die Samen über Nacht bei 4 °C kalt schichten und die Platten in einen Anbauraum (21 °C, 16 h hell / 8 h dunkel) stellen.
- Übertragen Sie 5 Tage alte Sämlinge in Pflanzenkulturboxen, die ein Pflanzenwachstumsmedium enthalten.
HINWEIS: Die beste Transformationseffizienz in DH12075 wurde für 18 Tage alte Sämlinge identifiziert. Das Sämlingsalter kann für die lokalen Wachstumsbedingungen oder andere Sorten optimiert werden. - Eine Flüssigkultur von Agrobacterium tumefaciens C58C1 mit einem haarwurzelinduzierenden Plasmid pRiA4b und dem binären Vektor für die Transformation (aus Schritt 2.11) wird mit einer Impfschleife beimpft. Verwenden Sie 5 ml LB-Medium. Bauen Sie diese Kultur über Nacht bei 28 °C an, bis sie OD600 = 0,9 - 1 erreicht.
HINWEIS: Agrobacterium, das nur das Ri-Plasmid enthält, wird verwendet, wenn Wildtyp-Haarwurzeln produziert werden. - Injizieren Sie eine kleine Menge Kultur (ca. 50 μl) mit einer Insulinspritze in das Hypokotyl eines 18 Tage alten Sämlings (aus Schritt 3.4.). Das Hypokotyl mit einer 26G-Nadel, die etwa 1 cm über der Oberfläche des Mediums auf der Spritze angebracht ist, durchstechen. Injizieren Sie die Flüssigkeit in die Wunde. Auch das Gewebe auf der Oberfläche des Hypokotyls kann durch die Spritze zerkratzt werden.
HINWEIS: Die Anzahl der geimpften Sämlinge muss an die Bedürfnisse des Experimentators angepasst werden. - Die Pflanzen für 2 bis 4 Wochen bei 21 °C in den Kulturraum zurückbringen, bis sich an der Wundstelle eine Hornhaut und behaarte Wurzeln bilden.
- Schneiden Sie die Hornhaut mit den ausgetretenen Haarwurzeln vom Hypokotyl ab und legen Sie sie auf eine Petrischale mit dem Haarwurzelwachstumsmedium, das selektive Antibiotika (getragen von der T-DNA) und Cefotaxim (200 mg/L) und Ticarcillin (500 mg/L) enthält, um das Wachstum von Agrobakterien zu unterdrücken. Verschließen Sie die Petrischalen mit gasdurchlässigem Klebeband. Kultivieren Sie die behaarten Wurzeln bei 24 °C im Dunkeln.
HINWEIS: Die richtige Konzentration spezifischer Antibiotika, die für die funktionelle Selektion verwendet werden, muss mit Wildtyp-Haarwurzeln getestet werden. Für B. napus DH12075 behaarten Wurzeln, die eine Resistenz gegen Kanamycin tragen, wird eine Konzentration von 25 mg/L Kanamycin verwendet.
HINWEIS: In diesem Schritt ist es möglich, eine Mischpflanze zu erzeugen, die aus dem Wildtyp-Spross und transgenen Haarwurzeln besteht, die das Wachstum einer solchen Pflanze unterstützen. Anstatt die behaarten Wurzeln von einem Stängel abzuschneiden, werden die einheimischen Wurzeln der Pflanze entfernt. Die Pflanze mit den aufkommenden Haarwurzeln wird in eine Pflanzenkulturbox mit einem zusammengesetzten Pflanzenwachstumsmedium überführt, das Cefotaxim (200 mg/L) und Ticarcillin (500 mg/L) enthält, um das Wachstum von Agrobakterien zu unterdrücken, und das selektive Antibiotikum (das von der T-DNA getragen wird). - Nach 1 - 2 Wochen isolieren Sie die Haarwurzeln auf der Petrischale von der Hornhaut und individualisieren sie auf Platten mit dem gleichen Nährmedium. Übertragen Sie die Kultur alle 4 bis 5 Wochen auf einen frischen Teller. Fügen Sie 0,25 mg/l IBA hinzu, um die Wurzelverzweigung zu erhöhen.
- Die Konzentrationen von Cefotaxim und Ticarcillin werden bei jedem Transfer schrittweise um 100 mg/l reduziert (d. h. das Medium für den ersten Transfer enthält 100 mg/l Cefotaxim und 400 mg/l Ticarcillin; für den zweiten Transfer 300 mg/l Ticarcillin usw.). Nach 3 - 4 Monaten kultivieren Sie die Haarwurzeln auf einem Haarwurzelwachstumsmedium mit 100 mg/L Ticarcillin und dem selektiven Antibiotikum.
4. Regeneration von Brassica napus DH12075 behaarten Wurzeln
- Übertragen Sie unabhängige Haarwurzellinien unter sterilen Bedingungen mit einer Pinzette, die vor Gebrauch geflammt wird, auf Platten mit Regenerationsmedium. 5 - 10 Wurzeln pro Petrischale umfüllen und bei 21 °C in einer langtägigen Photoperiode (16 h hell / 8 h dunkel) kultivieren. Verschließen Sie die Petrischalen mit gasdurchlässigem Klebeband.
- Übertragen Sie die Haarwurzeln alle 3 bis 4 Wochen auf Platten mit frischem Regenerationsmedium. Beachten Sie, dass sich nach ca. 2 Wochen Calli bilden. Die Hornhaut beginnt nach weiteren 2 Wochen bis 8 - 9 Wochen nach der Hornhautbildung zu schießen.
- Individualisieren Sie die Triebe und setzen Sie sie für 2 bis 3 Wochen in Pflanzenkulturboxen mit Triebverlängerungsmedium um, um die Verlängerung der Triebe zu fördern.
- Übertragen Sie die länglichen Triebe in Pflanzenkulturboxen mit einem Wurzelinduktionsmedium. Aktualisieren Sie die Kultur alle 3 - 4 Wochen. Die Bewurzelungseffizienz in DH12075 beträgt 87 % nach 30 Tagen und bis zu 100 % nach 60 Tagen.
- Übertragen Sie die bewurzelten Pflanzen in den Boden, nachdem Sie alle Spuren des Geliermittels entfernt haben, um eine Pilzinfektion zu verhindern. Stellen Sie sicher, dass sich die Pflanzen zuerst an die Phytotrone (21 °C, Langzeitphotoperiode, 150 μE) akklimatisieren und dann zur Blüte in ein Gewächshaus (21 °C / 18 °C, Langzeitphotoperiode, 150 μE) umsiedeln.
5. Auswahl von Regeneriermittel und T1-Pflanzen
HINWEIS: Die behaarten Wurzellinien können ausgewählt werden, bevor Sie in den Regenerationsprozess gehen. Die Art der Selektion hängt vom Inhalt des Transgens ab. Die behaarten Wurzeln können für die DNA-Extraktion und Genotypisierung oder den Mutationsnachweis, die RNA-Extraktion mit anschließender cDNA-Synthese und RT-qPCR für die Analyse auf Expressionsebene des Gens der Wahl, die Mikroskopie für den Fluoreszenznachweis oder die Behandlung für die GUS-Färbung entnommen werden.
- Nach dem Transfer in den Boden werden die T0-Regenerierpflanzen (und T1-Sämlinge) erneut genotypisiert, um ein Entweichen aus den Auswahlverfahren zu vermeiden. T0-Pflanzen weisen einen veränderten Phänotyp auf, der als Ri-Phänotyp bezeichnet wird: ausgedehntes Wurzelwachstum, lockige Blätter und Zwergtriebe, die durch das Vorhandensein der TL- und/oder TR-DNA des in das Pflanzengenom eingefügten Ri-Plasmids verursacht werden.
- Um die T1-Selektion zu beschleunigen, verwenden Sie die Samen mit grünen, reifen Embryonen (ca. 21 - 28 Tage nach der Bestäubung für DH12075 für einen Torpedoembryo oder älter) von T0-Regenerierpflanzen für die Embryorettung.
- Arbeiten Sie in der sterilen Flowbox. Sammeln Sie die Siliques und sterilisieren Sie sie mit 70% Ethanol.
- Legen Sie sie auf ein doppelseitiges Klebeband, das auf einen Tellerdeckel oder eine Rutsche geklebt ist.
- Schneiden Sie die Silique mit einem Stereo-Fernglas mit einer 26G-Nadel entlang der Ventilränder auf. Achten Sie darauf, dass der Schnitt die Samen nicht beschädigt. Montieren Sie die Nadel für einen einfachen Griff auf eine 1-ml-Spritze.
- Öffnen Sie die Fruchtblätter und kleben Sie sie auf das Klebeband. Sammeln Sie die unreifen Samen und geben Sie sie auf Platten mit Medium für die Samenkeimung. Verschließen Sie die Platten mit gasdurchlässigem Klebeband.
- Stellen Sie die Platten bis zur Keimung in einen Kultivierungsraum (21 °C, 16 h hell / 8 h dunkel).
- Genotypisieren Sie die T1-Sämlinge für das Vorhandensein des interessierenden Transgens und das Fehlen des Ri TR/TL (Abbildung 1). Sammeln Sie Blattmaterial und extrahieren Sie ihre DNA mit der Methode Ihrer Wahl. Die CTAB-Methode wird hier beschrieben:
- Sammeln Sie das Blattmaterial in einem 2-ml-Mikroröhrchen mit zwei Keramikperlen. Frieren Sie das Rohr in flüssigem Stickstoff ein.
- Mahlen Sie das Material mit einer Kugelmühle. Alternativ können Stößel und Mörser verwendet werden.
- Nach einem kurzen Schleudern fügen Sie dem Pulver 400 μl CTAB-Puffer hinzu. Kurz vortexen, herunterschleudern und bei 60 °C mindestens 50 min inkubieren.
- Die Lösung 15 Minuten lang auf Raumtemperatur abkühlen lassen. Fügen Sie ein Volumen Chloroform hinzu und mischen Sie vorsichtig.
ACHTUNG: Arbeiten Sie bei der Verwendung von Chloroform unter dem chemischen Fluss und verwenden Sie zum Schutz Handschuhe. Jede chloroformhaltige Lösung sollte in den entsprechenden Abfallbehälter geworfen werden. - Zentrifugieren Sie 5 Minuten lang bei 18.400 x g mit einer Tischzentrifuge. 250 - 350 μl der oberen wässrigen Phase in ein neues Mikroröhrchen überführen. Lassen Sie die Zwischenphase weg.
- Fügen Sie ein Volumen Isopropanol hinzu, mischen Sie es gut und inkubieren Sie es 5 Minuten lang bei Raumtemperatur. 40 min bei 18.400 x g zentrifugieren.
- Entsorgen Sie die Flüssigkeit und fügen Sie 200 μl 70%iges Ethanol hinzu. Waschen Sie das Pellet und zentrifugieren Sie es 15 Minuten lang bei 18.400 x g.
- Entsorgen Sie die Flüssigkeit. Trocknen Sie das Pellet an der Luft und fügen Sie 50 - 100 μl Reinstwasser hinzu. Lassen Sie die DNA 1 h bis über Nacht im Kühlschrank auflösen.
- Führen Sie eine Genotypisierung durch PCR für das rolA-Gen (TL), das aux1-Gen (TR) und den virC-Locus (Agrobacterium) durch. Bereiten Sie die PCR-Reaktion mit der vorbereiteten DNA (aus Schritt 5.3), Primern, Puffer, dNTP und Taq-Polymerase gemäß dem Protokoll des Herstellers vor. Die amplifizierten Fragmente sind 200 - 500 bp lang.
Primer spezifisch für rolA:
Weiter: GTTAGGCGTGCAAAGGCCAAG
Rückseite: TGCGTATTAATCCCGTAGGTC
Primer speziell für aux1:
Weiter: CATAGGATCGCCTCACAGGT
Rückseite: CGTTGCTTGATGTCAGGAGA
Primer spezifisch für virC:
Weiter: AATGCGTCTCTCTCGTGCAT
Rückseite: AAACCGACCACTAACGCGAT
HINWEIS: Der T-DNA-Transfer und die Integration können teilweise sein, und nur Teile von TL und/oder TR können in das Genom integriert werden. Daher wird empfohlen, das Vorhandensein anderer ORFs von TL (z. B. rolB und rolC) und TR (aux2, mas1, ags1) in T1-Sämlingen zu analysieren. Primersequenzen, die für diese Loci spezifisch sind, sind in Jedličková et al.9 aufgeführt. - PCR-Reaktionen durch Gelelektrophorese bewerten.
HINWEIS: Es wird empfohlen, eine Positivkontrolle in diese Analyse einzubeziehen, um sicherzustellen, dass DNA in PCR-Qualität vorhanden ist. - Wählen Sie nach dem Vorhandensein (oder Fehlen) des Transgens gemäß den Protokollen, die auf dem Inhalt dieses Transgens basieren.
- Übertragen Sie ausgewählte Sämlinge in den Boden.
6. Haarwurzeltransformation und -regeneration in Arabidopsis thaliana Col-0
- Oberflächensterilisieren Sie A . thaliana-Samen mit einer Methode Ihrer Wahl (Bleichmittel, Ethanol oder Chlorgas).
- Sterile Samen für die Keimung der Samen auf einem Medium plattieren. Nach 2 Tagen kalter Schichtung die Platten in einen Kultivierungsraum (21 °C mit langtägiger Photoperiode und 50 % Luftfeuchtigkeit) bringen.
- Übertragen Sie 1 Woche alte Sämlinge in eine Pflanzenkulturbox mit Pflanzenwachstumsmedium.
- Bereiten Sie Agrobacterium-Kulturen wie in Schritt 3.5 angegeben vor.
- Injizieren Sie eine kleine Menge Kultur (ca. 50 μl) mit einer Nadel, die auf einer Insulinspritze an der Basis des primären Blütenstandsstamms (ca. 1 - 2 cm über der Rosette) von 1 Monat alten Arabidopsis-Pflänzchen angebracht ist. Auch das Gewebe auf der Oberfläche des Primärstamms kann durch die Spritze zerkratzt werden.
- Entfernen Sie 2-4 Wochen nach der Injektion die entstehenden Haarwurzeln und kultivieren Sie sie auf Petrischalen mit dem behaarten Wurzelwachstumsmedium, das mit dem selektiven Antibiotikum (das von der T-DNA getragen wird) und Cefotaxim (200 mg/L) und Ticarcillin (500 mg/L) ergänzt wird, um das Wachstum von Agrobakterien zu unterdrücken. Inkubieren Sie die Platten bei 24 °C im Dunkeln.
- Nach 1 - 2 Wochen individualisieren Sie die Haarwurzeln auf Platten mit dem gleichen Nährmedium. Übertragen Sie die ausgewählten Haarwurzellinien alle 4 - 5 Wochen auf ein frisches Medium.
HINWEIS: Die Haarwurzeln von A. thaliana sind dünner als die von B. napus, und beim Umfüllen auf frische Medien ist Vorsicht geboten. - Übertragen Sie die Haarwurzeln auf Platten mit Regenerationsmedium, um die Kallusbildung zu induzieren. Die Platten werden bei 21 °C in einer langtägigen Photoperiode (16 h hell / 8 h dunkel) kultiviert.
- Die Triebe treten nach 18 - 21 Tagen Kultivierung aus der Hornhaut aus. Schneiden Sie die Triebe ab und geben Sie sie für 2 - 3 Wochen in ein Triebverlängerungsmedium, um Wachstum und Verlängerung zu fördern.
- Übertragen Sie die länglichen Triebe auf das Wurzelinduktionsmedium.
- Übertragen Sie die bewurzelten Pflanzen in die Erde. T0-Pflanzen weisen auch einen Ri-Phänotyp auf. Führen Sie die transgene Selektion durch, wie für B. napus DH12075 beschrieben (Schritt 5).
Ergebnisse
Wir haben zuvor ein Protokoll für die injektionsbasierte Haarwurzelinduktion bei drei Sorten von Brassica napus optimiert, nämlich DH12075, Topas DH4079 und Westar9. Um dieses Transformationsprotokoll auf die Modellart A. thaliana anzuwenden, wurden die primären Blütenstandsstämme von 1 Monat alten Pflänzchen mit einem agrobakteriellen Inokulum injiziert. Behaarte Wurzeln traten nach 2-4 Wochen an der Injektionsstelle auf. Behaarte Wurzeln wurden herausgeschnitten und auf dem festen Medium kultiviert. Der Vergleich der Methode bei diesen beiden Arten ist in Abbildung 1 dargestellt.
Ausgewählte behaarte Wurzellinien wurden auf das Regenerationsmedium übertragen, um die Sprossbildung zu induzieren. Bei A. thaliana wurden gelbe Calli innerhalb von 14 Tagen in allen 10 getesteten Haarwurzellinien induziert. Die ersten Sprossprimordien, die als dunkelgrüne Flecken sichtbar waren, entstanden innerhalb von 3 Wochen nach der Übertragung auf das Regenerationsmedium (Abbildung 2). Nach 4 Wochen Kultur bedeckten die Triebe die Haarwurzeln in 9 von 10 Haarwurzellinien (90% Regenerationseffizienz). In einigen Fällen wurden dem Kallus Adventivwurzeln entlockt (Abbildung 2H). Eine Linie regenerierte sich auch nach 3 Monaten auf dem Regenerationsmedium nicht (alle 4 Wochen wurden die Haarwurzeln in ein frisches Medium überführt). Somit ähnelt die Regenerationseffizienz von A. thaliana Haarwurzeln der Effizienz von B. napus DH120759.
Haarwurzelregeneriermittel von B. napus und A. thaliana weisen einen Zwergphänotyp auf (Abbildung 3), ein typisches Merkmal der aus der Haarwurzel stammenden Pflanzen2. Wir beobachteten auch dichte Wurzelsysteme, faltige Blätter und Veränderungen der Blütezeit. Dieser sogenannte Haarwurzel- (oder Ri-) Phänotyp wird durch die rol-Gene aus dem Ri-Plasmid verursacht, die in das Pflanzengenom eingefügt wurden. Die Insertion der Ri-T-DNA und des Transgens, das auf einem binären Vektor kodiert ist, kann unabhängig oder verknüpft sein. So hilft eine Segregationsanalyse von T1-Nachkommen, die durch Selbstbestäubung entstanden sind, rol-freie Pflanzen zu identifizieren, die das interessierende Transgen exprimieren. Die Genotypisierung der T1-Pflanzen erfolgt durch PCR-Primer, die spezifisch für die ORFs von TL und TR und das interessierende Transgen sind. Das Fehlen einer agrobakteriellen Kontamination wird durch das Fehlen von PCR-Produkten von virC-Primern bestätigt (Abbildung 1).
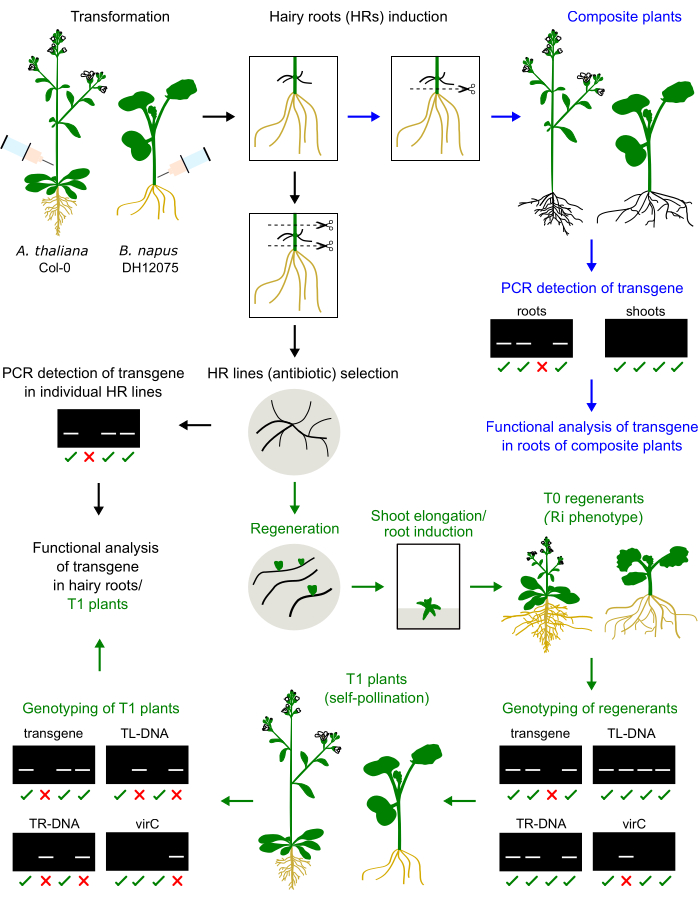
Abbildung 1: Zusammenfassung des Verfahrens bei A. thaliana und B. napus. Die Injektion des Agrobacterium-Inokulums in den Hypokotyl- oder primären Blütenstandsstamm induziert die Entwicklung von Haarwurzeln. Die behaarten Wurzeln können die einheimischen Wurzeln ersetzen, um eine zusammengesetzte Pflanze zu erzeugen, die genotypisiert und analysiert wird (blaue Pfeile). Kultivierte Haarwurzeln können zu T0-Pflanzen regeneriert, in T1-Pflanzen vermehrt und genotypisiert werden (grüne Pfeile). Die behaarten Wurzeln können auch für die Funktionsanalyse subkultiviert werden (schwarzer Pfeil). Beispiele für Genotypisierungsergebnisse werden vorgestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
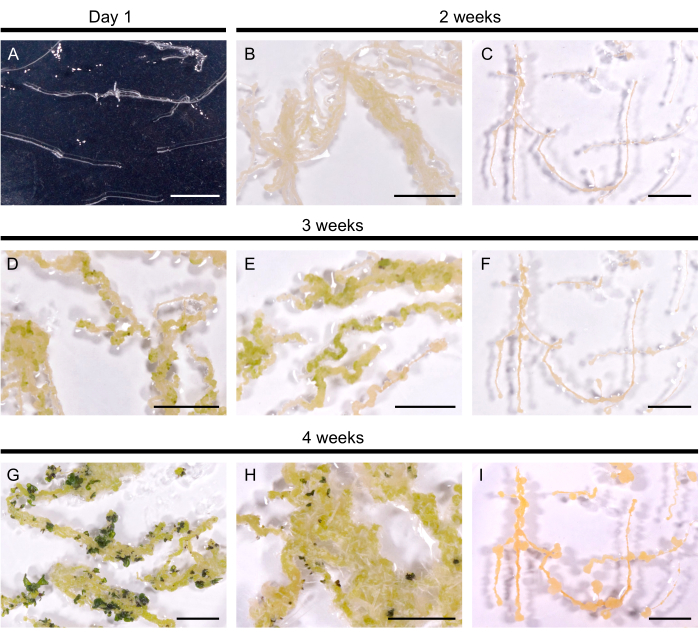
Abbildung 2: Regeneration der Haarwurzeln in A. thaliana. (A) Haarwurzelkultur 1 Tag nach der Übertragung auf die Platten. (B, C) Calli entwickelte sich innerhalb von 2 Wochen nach der Kultur auf Regenerationsmedium. (D, E) Triebprimordien entstanden nach 3 Wochen Kultur. (G, H) Die Triebe bilden sich nach 4 Wochen. (H) Adventivwurzeln, die sich aus dem Kallus entwickelt haben. (C, F, I) Nicht regenerierende Haarwurzellinie. Maßstabsleisten stellen 1 cm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Repräsentative Fotos von B . napus - und A. thaliana-Wildtyp-Pflanzen und aus Haarwurzeln gewonnenen Regenerierzien (T0-Pflanzen). Beachten Sie den Ri-Phänotyp der Regeneriermittel. Die Maßstabsbalken stellen 2 cm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir haben ein einfaches Protokoll für die Transformation der Haarwurzel und die anschließende Regeneration bei B. napus und A. thaliana entwickelt. Dieser Prozess umfasst die Induktion der Haarwurzel auf Injektionsbasis im Hypokotyl (B. napus) oder im primären Blütenstandsstamm (A. thaliana). Die Methode der Injektion des Hypokotyls mit dem agrobakteriellen Stamm C58C1, der ein Ri-Plasmid trägt, war neben den in dieser Studie vorgestellten Mitgliedern der Brassicaceae auch in der Familie der Fabaceae10,11 wirksam.
Eine Alternative zur injektionsbasierten Methode ist die immersionsbasierte Transformation, die aus dem Eintauchen der Explantat in eine Bakteriensuspension und der anschließenden Co-Kultivierung des Explantats mit Agrobakterien besteht. Der Vorteil der Injektionsmethode gegenüber der Immersionsmethode ist die Zeitersparnis durch den Wegfall einiger Protokollschritte: Explantationsvorbereitung, Test der Co-Kultivierungszeit und Kultur auf einem hormonhaltigen Medium zur Induktion von Haarwurzeln. Obwohl beide Ansätze bei der Induktion von Haarwurzeln wirksam sind, wurde bei einigen Arten mit der injektionsbasierten Methode eine höhere Transformationseffizienz im Vergleich zur Explantat-Immersionsmethode beobachtet12,13. Darüber hinaus ist die injektionsbasierte Transformation auch für die Erzeugung von Korbpflanzen (transgene Haarwurzeln und Wildtyp-Triebe) nützlich. Nach dem Abschneiden der ursprünglichen Wurzeln der transformierten Pflanze unterstützen behaarte Wurzeln das Pflanzenwachstum, und das Transgen kann im Kontext der gesamten Pflanze untersucht werden.
Der kritische Schritt der Haarwurzelinduktion ist die Injektion des Inokulums in das Hypokotyl oder den primären Blütenstandsstamm. Die Hypokotyle von B. napus sind zerbrechlich, und das Schneiden des gesamten Hypokotyls kann leicht passieren. Das Gleiche kann bei A. thaliana aufgrund der Dünnheit des Blütenstandstamms beobachtet werden. Wenn ein Vergleich der Transformationseffizienz verschiedener Arten/Sorten erforderlich ist, empfehlen wir, dass eine Person alle Experimente durchführt, um den Fehler zu vermeiden, der durch Manipulation und Geschick beim Injizieren der Pflanzen verursacht wird.
Wir haben ein wirksames Protokoll für die Regeneration von Haarwurzeln in B. napus DH12075 und A. thaliana Col-0 entwickelt. Da die Regeneration ein sehr variabler Prozess ist, können einige Protokolländerungen auf eine Art oder Sorte Ihrer Wahl angewendet werden. Zum Beispiel können die behaarten Wurzeltriebe durch ein anderes Auxin/Cytokinin-Verhältnis (1:1) in B. oleraceahervorgerufen werden 14. Alternativ kann Cytokinin Thidiazuron anstelle von BAP verwendet werden, wie im Fall von B. campestris Haarwurzeln15.
Mehrfache Insertionen der Ri-Plasmid-T-DNA in das Pflanzengenom stellen eine potenzielle Einschränkung des Transformations- und Regenerationssystems der Haarwurzel dar. In solchen Fällen werden nach einer Segregationsanalyse von T1-Sämlingen keine TL/TR-freien Pflanzen aus dem Ri-Plasmid entdeckt. Daher empfehlen wir, für jedes Transgen mehrere unabhängige Haarwurzellinien zu erzeugen.
Haarwurzelkulturen sind ein äußerst leistungsfähiges Werkzeug für genfunktionelle Studien, vor allem wegen ihrer schnellen Etablierung und kostengünstigen Wartung (keine Hormone in Kulturmedien erforderlich). Dieses Protokoll umfasst die Methoden zur Induktion und Regeneration von Haarwurzeln bei B. napus und A. thaliana, die verwendet werden können, um das interessierende Transgen direkt in Haarwurzelkulturen, im Kontext der gesamten Pflanze unter Verwendung von Mischpflanzen oder nach der Regeneration der transgenen Pflanzen zu untersuchen.
Offenlegungen
Die Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken Jiří Macas (Biologiezentrum CAS, České Budějovice, Tschechische Republik) für die Bereitstellung des agrobakteriellen Stammes. Die Core Facility Plants Sciences der CEITEC MU ist für ihre technische Unterstützung bekannt. Diese Arbeit wurde vom Ministerium für Bildung, Jugend und Sport der Tschechischen Republik mit dem Europäischen Fonds für regionale Entwicklung, dem Projekt "SINGING PLANT" (Nr. CZ.02.1.01/0.0/0.0/16_026/0008446) und das Projekt INTER-COST LTC20004.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
Referenzen
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten