Method Article
Arabidopsis thaliana와 Brassica napus의 털이 많은 뿌리 변형 및 재생
요약
이 프로토콜은 애기장대(Arabidopsis) 1차 꽃차례 줄기와 Brassica napus hypocotyls를 사용한 털이 많은 뿌리 유도를 설명합니다. 털이 많은 뿌리는 배양되어 형질 전환 식물을 재생하기 위한 이식 식물로 사용될 수 있습니다.
초록
털 뿌리 형질전환은 다양한 종의 식물 생명공학을 위한 다재다능한 도구입니다. 뿌리 유도(Ri) 플라스미드를 운반하는 아그로박테리움 균주에 의한 감염은 Ri 플라스미드에서 식물 게놈으로 T-DNA를 전달한 후 상처 부위에 털이 많은 뿌리의 형성을 유도합니다. 이 프로토콜은 Brassica napus DH12075 및 Arabidopsis thaliana Col-0에서 주사 기반 털뿌리 유도 절차를 자세히 설명합니다. 털이 많은 뿌리는 관심있는 전이 유전자를 분석하는 데 사용되거나 형질 전환 식물의 생성을 위해 처리 될 수 있습니다. 사이토키닌 6-벤질아미노퓨린(5mg/L)과 옥신 1-나프탈렌아세트산(8mg/L)을 함유한 재생 배지는 두 종 모두에서 성공적으로 싹 형성을 유도합니다. 이 프로토콜은 Ri 플라스미드에서 T-DNA가 없는 관심 전이유전을 운반하는 식물을 얻기 위한 생식제 및 T1 식물의 유전형 분석 및 선택을 다룹니다. 복합 플랜트의 형성으로 이어지는 대체 공정도 묘사되어 있습니다. 이 경우 털이 많은 뿌리는 (자연 뿌리 대신) 싹에 유지되어 전체 식물의 맥락에서 털이 많은 뿌리 배양에서 전이 유전자를 연구 할 수 있습니다.
서문
식물 형질전환은 식물 생물학의 모든 유전학 연구의 병목 현상입니다. 토양 매개 박테리아인 Agrobacterium tumefaciens는 형질전환체를 생성하기 위해 꽃 딥 또는 조직 배양에 의한 유전자 전달 수단으로 널리 사용됩니다. A. tumefaciens는 상처 부위의 식물을 감염시키고 종양 유도(Ti) 플라스미드에서 숙주 식물 게놈으로 T-DNA를 전달하고 통합하여 종양을 유발합니다. 야생형 T-DNA가 없는 변형된 Ti 플라스미드와 인공 T-DNA가 있는 이진 벡터를 가진 공학적 A. tumefaciens 균주와 관심 유전자를 삽입하기 위한 클로닝 부위가 효율적인 식물 형질전환 시스템으로 일반적으로 사용된다1. 그러나 많은 모델 종과 작물은 플로럴 딥 또는 체외 식물 재생에 소극적이거나 성장 주기가 길어 이 형질 전환 시스템의 효율성에 영향을 미칩니다.
Agrobacterium rhizogenes는 숙주 식물을 감염시킨 후 상처 부위에 우발성 뿌리 또는 털이 많은 뿌리의 형성을 유도합니다. A. tumefaciens와 유사하게, A. rhizogenes는 Root-inducing (Ri) plasmid에서 숙주 식물 게놈으로 T-DNA를 전달하여 형질전환 털이 많은 뿌리의 발달을 유발합니다. 이 과정은 주로 뿌리 발암 유전자좌(Root Oncogenic loci, rol) 유전자 2,3에 의해 제어됩니다. Ri 플라스미드와 관심 유전자를 인코딩하는 인공 이진 벡터를 모두 운반하는 농균 균주를 사용하여 털이 많은 뿌리 배양액을 사용하여 재조합 단백질을 생산하거나, 프로모터 또는 유전자의 기능을 분석하거나, CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)/CRISPR-associated protein 9 (Cas9)4,5,6을 사용하여 게놈을 편집했습니다.
당사의 프로토콜은 Ri 플라스미드 pRiA4b7을 운반하는 transconjugant 균주 Ti-less A. tumefaciens C58C1을 사용합니다. Ri 플라스미드의 T-DNA는 식물 게놈8에 독립적으로 통합될 수 있는 우측 및 좌측 T-DNA (TR-DNA 및 TL-DNA)의 두 영역으로 구성된다. 이 시스템을 활용하여 Brassica napus DH12075 품종의 긴 외식 형질 전환 과정을 최적화했습니다9. 아래에 자세히 설명된 프로토콜은 선택된 털이 많은 뿌리 계통의 재생을 허용하고 약 1년 내에 관심 있는 전이 유전자를 운반하고 rol 유전자가 없는 T1 식물을 얻을 수 있습니다. 주입 기반 털뿌리 형질전환은 애기장대(Arabidopsis thaliana Col-0)를 형질전환시킴으로써 알 수 있듯이 다른 Brassicaceae 종에서 사용할 수 있습니다. hypocotyl은 B. napus를 변형시키는 데 사용되지만 A. thaliana는 1 차 꽃차례 줄기에 주입됩니다.
프로토콜
1. 매체 및 용액 준비
- 호르몬 원액을 준비합니다.
- 5mg/mL 농도의 1-나프탈렌아세트산(NAA), 6-벤질아미노퓨린(BAP) 및 인돌-3-부티르산(IBA) 원액 50mL를 제조하기 위해 분말 호르몬 250mg을 1M 수산화나트륨(NaOH) 2mL에 용해시키고 부피를 초순수로 50mL로 조정합니다.
- 1mg/mL 농도의 지베렐릭산(GA3) 50mL를 제조하려면 분말 호르몬 50mg을 에탄올 2mL에 녹이고 부피를 초순수 50mL로 조정합니다.
- 0.22μm 공극 크기의 멸균 주사기 필터를 사용하여 용액을 여과하고 보관을 위해 멸균 2mL 튜브에 분배합니다. 제조업체의 권장 사항에 따라 -20 °C 또는 4 °C에서 용액을 보관하십시오.
- 항생제 원액을 준비합니다. 100mg/mL 농도의 세포탁심 및 티카르실린 디소듐 원액 50mL의 경우 분말 항생제 0.5g을 초순수 40mL에 용해시키고 최종 부피 50mL로 조정합니다. 0.22μm 공극 크기의 멸균 주사기 필터를 사용하여 용액을 여과하고 보관을 위해 멸균 2mL 튜브에 분배합니다. 용액을 -20°C에서 보관합니다.
알림: 항생제와 호르몬은 항상 냉각된 매체에 첨가됩니다. - 1L 측정 실린더에 박토 트립톤 10g, 효모 추출물 5g, 염화나트륨(NaCl) 5g을 넣어 루리아 육수(LB) 배지 1L를 준비하고 이중 증류수로 부피를 1L로 조정합니다. pH 측정기를 사용하여 KOH를 사용하여 pH를 7.0으로 조정합니다(제조업체의 지침에 따름). 용액을 1L 병에 옮기고 고체 배지가 준비된 경우 15g의 세균 한천(1.5%)을 추가하고 배지를 고압멸균합니다. 필요한 경우 적절한 항생제(박테리아 내성은 이원 벡터에 있음)를 냉각된 매체에 추가합니다.
알림: 오토클레이브를 사용하여 용액을 살균하십시오. 병을 바구니에 넣고 뚜껑을 닫은 다음 20°C 및 121kPa에서 98.9분 동안 살균합니다. 이 프로토콜은 항상 추가 단계에서 오토클레이브 솔루션에 사용됩니다. - 이중 증류수에 쇠고기 추출물 5g, 효모 추출물 1g, 펩톤 5g, 자당 5g, 염화마그네슘(MgCl2) 0.5g을 혼합하여 효모 추출물 쇠고기(YEB) 배지 1L를 준비합니다. 부피를 1L로 조정합니다. 용액을 1L 병에 옮깁니다. 매체를 오토클레이브합니다.
- 무라시게와 스쿠그(MS) 분말 2.2g, 자당(1%) 10g, 2-(N-모르폴리노)에탄술폰산(MES) 나트륨염 0.5g을 이중 증류수에 혼합하여 종자 발아를 위한 배지 1L를 준비합니다. 부피를 1L로 조절하고 혼합하여 KOH로 pH를 5.8로 조절한다. 용액을 1L 병에 옮기고 식물 한천 8g(0.8%)을 넣습니다. 매체를 오토클레이브합니다.
- 이중 증류수에 MS 분말 2.2g, 자당 5g(0.5%), MES 염 0.5g을 혼합하여 식물 생장 배지 1L를 준비합니다. 부피를 1L로 조절하고 혼합하여 KOH로 pH를 5.8로 조절한다. 용액을 1L 병에 옮기고 식물 한천 8g(0.8%)을 넣습니다. 매체를 오토클레이브합니다.
- MS + B5 비타민 분말 4.4g, 자당 30g(3%), MES 염 0.5g을 이중 증류수에 혼합하여 털뿌리 성장 배지 1L를 준비합니다. 부피를 1L로 조절하고 KOH로 혼합하여 pH를 5.8로 조정한 후 용액을 1L 병에 옮긴다. 겔화제 3g(0.3%)을 넣고 배지를 고압멸균한다. 세포탁심과 티카르실린 디소듐을 각각 100 - 200 mg/L 및 100 - 500 mg/L의 최종 농도로 첨가합니다. 필요한 경우 적절한 항생제를 추가합니다(내성은 이진 벡터의 T-DNA로 인한 것입니다).
- 이중 증류수에 MS + B5 비타민 분말 2.2g, 자당(1%), MES 염 10g을 혼합하여 복합 식물 성장 배지 1L를 준비합니다. 부피를 1L로 조절하고 KOH로 혼합하여 pH를 5.8로 조정하고 용액을 1L 병에 옮깁니다. 겔화제 6g(0.6%)을 넣고 배지를 고압멸균한다. 세포탁심과 티카르실린 디소듐을 각각 200mg/L 및 500mg/L의 최종 농도로 첨가합니다. 필요한 경우 적절한 항생제를 추가합니다(내성은 이진 벡터의 T-DNA로 인한 것입니다).
- MS + B5 비타민 분말 4.4g, 자당 30g(3%), MES 염 0.5g을 이중 증류수에 혼합하여 재생 배지 1L를 제조합니다. 부피를 1L로 조절하고 혼합하여 KOH로 pH를 5.8로 조절한다. 용액을 1L 병에 옮기고 겔화제 3g(0.3%)을 추가합니다. 매체를 오토클레이브합니다. NAA와 BAP를 각각 8mg/L 및 5mg/L의 최종 농도에 첨가하고 티카르실린 디소듐을 100mg/L의 최종 농도에 첨가합니다.
- 이중 증류수에 MS + B5 비타민 분말 4.4g, 자당 20g(2%), MES 염 0.5g을 혼합하여 싹 신장 배지 1L를 준비합니다. 부피를 1L로 조절하고 혼합하여 KOH로 pH를 5.8로 조절한다. 용액을 1L 병에 옮기고 식물 한천 3g(0.3%)을 넣습니다. 매체를 오토클레이브합니다. BAP와 GA3 를 각각 0.5mg/L 및 0.03mg/L의 최종 농도에 첨가하고 세포탁심(cefotaxime)을 100mg/L의 최종 농도로 첨가합니다.
- 이중 증류수에 MS + B5 비타민 분말 2.2g, 자당 1g(1%), MES 염 10g을 혼합하여 뿌리 유도 매체 1L를 준비합니다. 부피를 1L로 조절하고 혼합하여 KOH로 pH를 5.8로 조절한다. 용액을 1L 병에 옮기고 겔화제 3g(0.3%)을 추가합니다. 매체를 오토클레이브합니다. IBA와 세포탁심(cefotaxime)을 각각 0.5mg/L 및 100mg/L의 최종 농도로 첨가합니다.
- CTAB 20g(2% w/v final), 1M Tris-HCl 100mL, pH 8.0(100mM final), 40mL의 0.5M EDTA, pH 8.0(20mM final), 81.8g의 NaCl(1.4M final) 및 5g의 PVP40(0.5% w/v final)을 첨가하여 세틸트리메틸암모늄 브로마이드(CTAB) 완충액 1L를 준비합니다. 이중 증류수로 1L로 조절하십시오. 용액을 오토클레이브합니다. 용액을 실온에서 최대 1년 동안 보관하십시오.
2. 이진 벡터를 사용한 Agrobacterium의 변환
- 식물 게놈에 통합될 T-DNA 카세트를 포함하는 검증된 binary plasmid의 DNA를 준비합니다. electroporation을 사용할 때 전기 스파크를 피하기 위해 플라스미드 DNA에 저염이 포함되어 있는지 확인하십시오. 원하는 플라스미드 DNA 추출 키트를 사용하는 것이 좋습니다.
- 200mL의 예열된(28°C) 액체 YEB를 신선한 하룻밤 배양 8mL와 함께 접종하여 털뿌리 유도 플라스미드 pRiA4b를 포함하는 전기유능한 Agrobacterium tumefaciens C58C1 세포를 준비합니다. 600nm(OD600)의 광학 밀도가 중간 로그 상에 해당하는 약 0.5가 될 때까지 흔들면서 28°C에서 배양액을 배양합니다. 약 4 - 5 시간 소요됩니다.
- Agrobacterium 배양액을 4개의 사전 냉각된 멸균 50mL 원심분리 튜브로 나눕니다. 4°C, 3,200 x g에서 15분 동안 원심분리합니다.
알림: 이 단계부터 셀을 차갑게 유지해야 합니다. - 상층액을 제거하고 펠릿을 2.5mL의 저온(4°C) 10% 글리세롤에 부드럽게 재현탁시킵니다. 차가운 10% 글리세롤 47.5mL를 더 넣고 부드럽게 섞습니다.
- 4°C에서 15분 동안 3,200 x g 의 펠릿 셀. 상층액을 버리고 10mL의 차가운 10% 글리세롤에 세포를 재현탁시킵니다.
- 세포를 다시 펠렛화하고 차가운 10% 글리세롤 0.75mL(4x)에 재현탁시킵니다. 4개의 튜브의 내용물을 모두 하나로 합칩니다(총 부피 = 3mL).
- 농균 용액을 사전 냉각된 멸균 1.5mL 마이크로튜브에서 50μL 분취액으로 나눕니다. 분취액을 드라이아이스 또는 액체 질소에 얼립니다. 나중에 사용할 수 있도록 튜브를 -80°C에서 보관하십시오.
- 유능한 세포 튜브 1개(50μL)를 얼음 위에 놓고 5μL의 플라스미드 DNA(총 1μg, 2.1단계부터)와 혼합한 다음 혼합물을 전기천공법 큐벳(0.2cm 간격)으로 옮기고 얼음 위에서 5분 동안 배양합니다.
- 큐벳을 electroporator에 놓고 커패시턴스 25μFD, 저항 400 Ω, 전압 2.5kV, 펄스 지속 시간 9.7ms 설정으로 셀을 전기합니다.
- 950μL의 LB 액체 배지를 세포에 첨가한 다음 열혼합기에서 300rpm에서 2시간 동안 28°C에서 배양합니다. 세포 배양 50μL를 적절한 선택적 항생제와 함께 고체 LB 배지에 플레이트합니다. 28°C에서 2일 동안 플레이트를 배양합니다.
참고: 적절한 배양량을 결정하고 박테리아의 과잉 증식을 방지하기 위해 플레이트당 다양한 세포 배양(10μL - 100μL)을 플레이팅하는 것이 좋습니다. - 항생제와 함께 5mL의 LB 액체 배지에 선택된 몇 개의 콜로니에서 액체 배양물을 준비합니다. 흔들어서 28°C에서 밤새 박테리아를 키웁니다. 0.5mL의 액체 박테리아 배양액과 0.5mL의 40% 글리세롤을 혼합하여 글리세롤 스톡에 대해 이러한 배양액을 사용합니다.
참고: 이들 콜로니는 콜로니 PCR에 의해 전이유전자의 존재를 확인한다. 이를 위해 바이너리 벡터에서 T-DNA의 일부를 증폭하는 프라이머와 함께 선택한 완충액, dNTP 및 Taq 중합효소를 포함하는 PCR 마스터 믹스에 플레이트의 소량의 콜로니를 추가합니다. 글리세롤 주식의 접종물은 식물의 변형에 사용됩니다.
3. Brassica napus DH12075의 털이 많은 뿌리 변형
- Brassica napus DH12075의 씨앗을 마이크로 튜브에 넣고 플로우 박스에서 살균합니다. 먼저 물과 0.1% 세제를 사용하여 씨앗을 탈지하면서 60초 동안 흔듭니다. 그런 다음 씨앗을 물로 헹구고 70% 에탄올을 60초 동안 헹굽니다.
- 차아염소산나트륨을 함유한 상업용 표백제 10% 용액을 사용하여 씨앗을 살균합니다. 이 용액에 씨앗을 넣고 20분 동안 흔듭니다.
- 멸균수로 씨앗을 각각 4초 동안 60번 씻습니다. 종자 발아 배지가 들어있는 페트리 접시에 놓습니다. 밤새 4 °C에서 씨앗을 저온 층화하고 접시를 재배실(21 °C, 16시간 밝음/8시간 어두움)로 옮깁니다.
- 5 일 된 묘목을 식물 성장 배지가 들어있는 식물 배양 상자에 옮깁니다.
참고: DH12075년 최고의 변형 효율은 18일 된 묘목에서 확인되었습니다. 묘목 연령은 지역 성장 조건 또는 다른 품종에 최적화 될 수 있습니다. - 털이 많은 뿌리 유도 플라스미드 pRiA4b와 형질전환을 위한 이진 벡터(2.11단계에서)를 운반하는 Agrobacterium tumefaciens C58C1의 액체 배양액을 접종 루프로 접종합니다. 5mL의 LB 배지를 사용합니다. 이 배양액을 OD600 = 0.9 - 1에 도달할 때까지 28°C에서 밤새 성장시킵니다.
NOTE: Ri 플라스미드만을 함유한 아그로박테리움(Agrobacterium)은 야생형 털뿌리가 생성될 때 사용됩니다. - 인슐린 주사기로 소량의 배양액(약 50μL)을 18일 된 묘목의 자엽에 주입합니다(단계 3.4에서). 배지 표면에서 약 26cm 위에 주사기에 장착된 1G 바늘로 자엽을 뚫습니다. 상처에 액체를 주입하십시오. 자엽 표면의 조직도 주사기로 긁을 수 있습니다.
알림: 접종된 묘목의 수는 실험자의 필요에 맞게 조정되어야 합니다. - 상처 부위에 굳은살과 털이 많은 뿌리가 형성될 때까지 2-4주 동안 21°C의 재배실로 식물을 되돌립니다.
- 하이포코틸에서 나온 털이 많은 뿌리로 굳은살을 잘라내고 선택적 항생제(T-DNA에 의해 운반됨)와 세포탁심(200mg/L) 및 티카르실린(500mg/L)이 포함된 털이 많은 뿌리 성장 배지와 함께 페트리 접시에 올려 농균 성장을 억제합니다. 가스 투과성 테이프로 페트리 접시를 밀봉하십시오. 어두운 곳에서 24 °C에서 털이 많은 뿌리를 배양합니다.
참고: 기능 선택에 사용되는 특정 항생제의 적절한 농도는 야생형 털이 많은 뿌리로 테스트해야 합니다. 카나마이신에 대한 내성을 지닌 털이 많은 뿌리DH12075 B. napus 의 경우 25mg/L 카나마이신의 농도가 사용됩니다.
참고: 이 단계에서는 야생형 새싹과 이러한 식물의 성장을 지원하는 형질전환 털뿌리로 구성된 복합 식물을 생성할 수 있습니다. 줄기에서 털이 많은 뿌리를 자르는 대신 식물의 토착 뿌리를 제거합니다. 털이 많은 뿌리가 있는 식물은 농균 성장을 억제하기 위해 세포탁심(200mg/L)과 티카르실린(500mg/L)을 함유한 복합 식물 성장 배지와 선택적 항생제(T-DNA에 의해 운반됨)가 있는 식물 배양 상자로 옮겨집니다. - 1-2 주 후, 페트리 접시의 털이 많은 뿌리를 굳은살에서 분리하고 동일한 배양 배지로 접시에 개성화하십시오. 4-5주마다 배양액을 새 접시에 옮깁니다. 0.25mg/L IBA를 추가하여 뿌리 가지를 증가시킵니다.
- 각 전달에서 세포탁심과 티카르실린의 농도를 100mg/L씩 점진적으로 줄입니다(즉, 첫 번째 전달을 위한 배지에는 100mg/L 세포탁심과 400mg/L 티카르실린이 포함되어 있습니다. 두 번째 전달의 경우 300mg/L 티카르실린 등). 3-4개월 후, 100mg/L 티카르실린과 선택적 항생제를 사용하여 털이 많은 뿌리 성장 배지에서 털이 많은 뿌리를 배양합니다.
4. 털이 많은 뿌리DH12075 Brassica napus의 재생
- 독립적인 털이 많은 뿌리 라인을 멸균 상태에서 재생 배지가 있는 플레이트에 핀셋을 사용하여 사용하기 전에 불에 태웁니다. 페트리 접시 당 5 - 10 개의 뿌리를 옮기고 21 ° C에서 긴 하루 광주기 (16 시간 빛 / 8 시간 어두움)에서 배양합니다. 가스 투과성 테이프로 페트리 접시를 밀봉하십시오.
- 3-4주에 한 번씩 털이 많은 뿌리를 신선한 재생 배지가 있는 접시에 옮깁니다. 캘리는 약 2주 후에 형성됩니다. 굳은살은 굳은살이 형성된 후 2주 후에 8-9주 후에 싹을 틔우기 시작합니다.
- 싹을 개별화하고 싹의 신장을 촉진하기 위해 2-3주 동안 싹 신장 배지가 있는 식물 배양 상자로 옮깁니다.
- 길쭉한 싹을 뿌리 유도 배지가 있는 식물 배양 상자로 옮깁니다. 3-4주마다 문화권을 새로 고칩니다. DH12075의 발근 효율은 87일에 30%, 100일 후에는 최대 60%입니다.
- 곰팡이 감염을 방지하기 위해 겔화제의 흔적을 제거한 후 뿌리 식물을 토양으로 옮깁니다. 식물이 먼저 식물 트론 (21 °C, 장일 광주기, 150 μE)에 적응 한 다음 개화를 위해 온실로 옮깁니다 (21 °C / 18 °C, 장일 광주기, 150 μE).
5. 재생제 및 T1 플랜트 선택
알림: 털이 많은 뿌리 라인은 재생 과정에 들어가기 전에 선택할 수 있습니다. 선택의 유형은 전이유전자가 운반하는 함량에 따라 다릅니다. 털이 많은 뿌리는 DNA 추출 및 유전형 분석 또는 돌연변이 검출을 위해 샘플링할 수 있으며, 후속 cDNA 합성을 통한 RNA 추출 및 선택한 유전자의 발현 수준 분석을 위한 RT-qPCR, 형광 검출을 위한 현미경 검사 또는 GUS 염색을 위한 처리가 가능합니다.
- 토양으로 옮긴 후 T0 재생 식물(및 T1 묘목)을 다시 유전자형으로 변환하여 선택 절차에서 벗어나지 않도록 합니다. T0 식물은 Ri 표현형(Ri phenotype)이라고 불리는 변형된 표현형을 나타낸다: 식물 게놈에 삽입된 Ri 플라스미드의 TL 및/또는 TR-DNA의 존재로 인해 발생하는 광범위한 뿌리 성장, 곱슬 잎 및 왜소한 새싹.
- T1 선택 속도를 높이려면 배아 구조를 위해 T0 재생 식물에서 녹색 성숙 배아(어뢰 배아 이상의 경우 DH12075 수분 후 약 21 - 28일)를 포함하는 씨앗을 사용하십시오.
- 멸균 흐름 상자에서 작업합니다. 규사를 모아 70% 에탄올로 표면 멸균합니다.
- 접시 뚜껑이나 슬라이드에 테이프로 붙인 양면 테이프에 붙입니다.
- 스테레오 쌍안경을 사용하여 26G 바늘을 사용하여 밸브 가장자리를 따라 실리크를 슬릿합니다. 절단이 씨앗을 손상시키지 않도록하십시오. 쉽게 잡을 수 있도록 바늘을 1mL 주사기에 장착합니다.
- 심피를 열고 테이프에 붙입니다. 미성숙한 씨앗을 모아 씨앗 발아를 위해 배지가 있는 접시에 옮깁니다. 가스 투과성 테이프로 플레이트를 밀봉하십시오.
- 발아할 때까지 접시를 배양실(21°C, 16시간 밝음/8시간 어두움)에 놓습니다.
- 관심 있는 전이유전자의 존재 및 Ri TR/TL의 부재에 대한 T1 묘목의 유전자형(그림 1). 잎 물질을 수집하고 선택한 방법을 사용하여 DNA를 추출합니다. CTAB 방법은 다음과 같습니다.
- 잎 재료를 2개의 세라믹 비드가 들어 있는 2mL 마이크로튜브에 모읍니다. 튜브를 액체 질소로 얼립니다.
- 볼 밀을 사용하여 재료를 연마하십시오. 또는 유봉과 박격포를 사용할 수 있습니다.
- 빠른 스핀 다운 후 400μL의 CTAB 완충액을 분말에 추가합니다. 소용돌이를 잠깐 가라앉히고 회전을 줄인 후 60°C에서 최소 50분 동안 배양합니다.
- 용액을 실온으로 15분 동안 식힙니다. 클로로포름 1 부피를 넣고 부드럽게 섞는다.
주의 : 클로로포름을 사용할 때는 화학 물질이 흐르는 곳에서 작업하고 보호를 위해 장갑을 사용하십시오. 클로로포름이 포함된 용액은 적절한 쓰레기통에 버려야 합니다. - 탁상용 원심분리기를 사용하여 18,400 x g 에서 5분 동안 원심분리합니다. 250 - 350 μL의 상부 수성상을 새로운 마이크로튜브로 옮깁니다. 간면을 생략합니다.
- 이소프로판올 1부피를 넣고 잘 섞은 후 실온에서 5분간 배양한다. 18,400 x g에서 40분 동안 원심분리합니다.
- 액체를 버리고 200 μL의 70 % 에탄올을 첨가하십시오. 펠릿과 원심분리기를 18,400 x g에서 15분 동안 세척합니다.
- 액체를 버리십시오. 펠릿을 자연 건조시키고 50 - 100 μL의 초순수를 추가합니다. DNA를 냉장고에서 1시간에서 하룻밤 동안 녹입니다.
- rolA 유전자(TL), aux1 유전자(TR) 및 virC 유전자좌(Agrobacterium)에 대해 PCR에 의한 유전형 분석을 수행합니다. 제조자의 프로토콜에 따라 제조된 DNA(단계 5.3에서), 프라이머, 완충액, dNTP 및 Taq 중합효소를 사용하여 PCR 반응을 준비합니다. 증폭된 단편의 길이는 200 - 500 bp이다.
rolA 전용 프라이머:
전달: GTTAGGCGTGCAAAGGCCAAG
역방향: TGCGTATTAATCCCGTAGGTC
aux1 전용 프라이머:
전달: CATAGGATCGCCTCACAGGT
역방향: CGTTGCTTGATGTCAGGAGA
virC에 특정한 프라이머:
전달: AATGCGTCTCTCTCGTGCAT
역방향: AAACCGACCACTAACGCGAT
참고: T-DNA 전달 및 통합은 부분적일 수 있으며 TL 및/또는 TR의 일부만 게놈에 통합될 수 있습니다. 따라서 T1 묘목에서 TL(예: rolB 및 rolC) 및 TR(aux2, mas1, ags1)의 다른 ORF의 존재를 분석하는 것이 좋습니다. 이들 유전자좌에 특이적인 프라이머 서열은 문헌[Jedličková et al.9]에 열거되어 있다. - 겔 전기영동에 의한 PCR 반응을 평가합니다.
참고: PCR 등급 DNA를 확보하기 위해 이 분석에 양성 대조군을 포함하는 것이 좋습니다. - 이 전이유전자의 함량에 기초한 프로토콜에 따라 전이유전자의 존재(또는 부재)를 선택합니다.
- 선택한 묘목을 토양으로 옮깁니다.
6. 애기장대(Arabidopsis thaliana) Col-0의 털이 많은 뿌리 변형 및 재생
- A. thaliana 씨앗을 선택한 방법(표백제, 에탄올 또는 염소 가스)으로 표면 멸균합니다.
- 종자 발아를 위해 무균 종자를 배지에 도금합니다. 2 일간의 저온 층화 후 플레이트를 배양실로 옮깁니다 (광주기가 긴 21 ° C 및 습도 50 %).
- 1주일 된 묘목을 식물 성장 배지가 있는 식물 배양 상자에 옮깁니다.
- 3.5단계에 표시된 대로 Agrobacterium 배양을 준비합니다.
- 1개월 된 애기장대 묘목의 1차 꽃차례 줄기(로제트 위 약 1 - 2cm)의 바닥에 있는 인슐린 주사기에 장착된 바늘로 소량의 배양액(약 50μL)을 주입합니다. 1차 줄기 표면의 조직도 주사기로 긁힐 수 있습니다.
- 주사 후 2-4 주에 나오는 털이 많은 뿌리를 절제하고 선택적 항생제 (T-DNA에 의해 운반)와 세포탁심 (200 mg / L) 및 티카르실린 (500 mg / L)이 보충 된 털이 많은 뿌리 성장 배지와 함께 페트리 접시에서 재배하여 농균 성장을 억제합니다. 어두운 곳에서 24 °C의 플레이트를 배양합니다.
- 1-2주 후, 동일한 배양 배지로 접시에 털이 많은 뿌리를 개성화합니다. 선택한 털이 많은 뿌리 라인을 4-5 주마다 새로운 배지로 옮깁니다.
참고: A. thaliana 털이 많은 뿌리는 B. napus 의 뿌리보다 얇기 때문에 신선한 배지로 옮길 때 주의해야 합니다. - 굳은살 형성을 유도하기 위해 재생 배지가 있는 플레이트에 털이 많은 뿌리를 옮깁니다. 21°C에서 긴 광주기(16시간 밝음/8시간 어두움)에서 플레이트를 배양합니다.
- 싹은 18-21 일 재배 후에 굳은살에서 나옵니다. 새싹을 자르고 성장과 신장을 촉진하기 위해 2-3 주 동안 새싹 신장 배지로 옮깁니다.
- 길쭉한 새싹을 뿌리 유도 매체로 옮깁니다.
- 뿌리 식물을 토양으로 옮깁니다. T0 식물은 또한 Ri 표현형을 나타냅니다. B. napus DH12075에 대해 설명된 대로 형질전환 선택을 수행합니다(단계 5).
결과
우리는 이전에 Brassica napus의 세 가지 품종, 즉 DH12075, Topas DH4079 및 Westar9에서 주사 기반 털이 많은 뿌리 유도를 위한 프로토콜을 최적화했습니다. 이 형질 전환 프로토콜을 모델 종 A. thaliana에 적용하기 위해 1개월 된 묘목의 1차 꽃차례 줄기에 농균 접종물을 주입했습니다. 털이 많은 뿌리는 2-4 주 후에 주사 부위에 나타났습니다. 털이 많은 뿌리를 절제하고 고체 배지에서 재배했습니다. 이 두 종의 방법을 비교한 것은 그림 1에 나와 있습니다.
선택된 털이 많은 뿌리 라인을 재생 배지로 옮겨 새싹 형성을 유도했습니다. A. thaliana에서, 노란색 캘리는 14 일 이내에 10 개의 털이 많은 뿌리 계통 모두에서 유도되었습니다. 첫 번째 싹 primordia는 재생 배지로 옮긴 후 3주 이내에 짙은 녹색 반점으로 나타납니다(그림 2). 4주간의 배양 후, 싹은 10개의 털이 많은 뿌리 계통 중 9개의 털이 많은 뿌리를 덮었습니다(90% 재생 효율). 어떤 경우에는 굳은살에서 외래 뿌리가 유도되었습니다(그림 2H). 재생 배지에서 3개월이 지나도 한 줄이 재생되지 않았습니다(4주마다 털이 많은 뿌리를 새로운 배지로 옮겼습니다). 따라서 A. thaliana 털뿌리의 재생 효율은 B. napus DH120759의 효율과 유사하다.
B. napus와 A. thaliana의 털이 많은 뿌리 재생제는 왜소한 표현형을 나타내는데(그림 3), 이는 털이 많은 뿌리 유래 식물의 전형적인 특징이다2. 우리는 또한 빽빽한 뿌리 시스템, 주름진 잎, 개화 시기의 변화를 관찰했습니다. 이 소위 털이 많은 뿌리(또는 Ri) 표현형은 식물 게놈에 삽입된 Ri 플라스미드의 rol 유전자에 의해 발생합니다. 이진 벡터 상에 인코딩된 Ri T-DNA와 전이유전자의 삽입은 독립적이거나 연결될 수 있다. 따라서, 자가수분에 의해 생성된 T1 자손의 분리 분석은 관심의 전이유전자를 발현하는 롤이 없는 식물을 식별하는 데 도움이 됩니다. T1 식물의 유전형 분석은 TL 및 TR의 ORF와 관심 전이유전자에 특이적인 PCR 프라이머에 의해 수행됩니다. 농균 오염의 부재는 virC 프라이머의 PCR 산물의 부재에 의해 검증됩니다(그림 1).
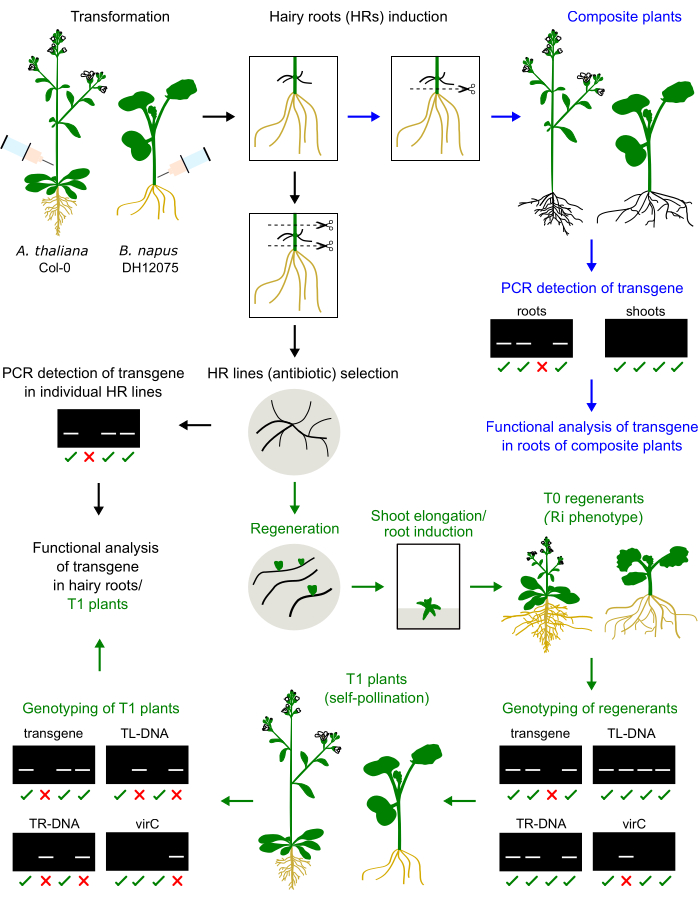
그림 1: A. thaliana 와 B. napus의 절차 요약. 자엽 또는 1차 꽃차례 줄기에 Agrobacterium 접종물을 주입하면 털이 많은 뿌리의 발달을 유도합니다. 털이 많은 뿌리는 토착 뿌리를 대체하여 유전형을 분석하고 분석할 복합 식물을 생성할 수 있습니다(파란색 화살표). 배양된 털뿌리는 T0 식물로 재생되고, T1 식물에서 번식하고, 유전자형(녹색 화살표)으로 분석될 수 있습니다. 털이 많은 뿌리는 기능 분석을 위해 하위 배양할 수도 있습니다(검은색 화살표). 유전형 분석 결과의 예가 제시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
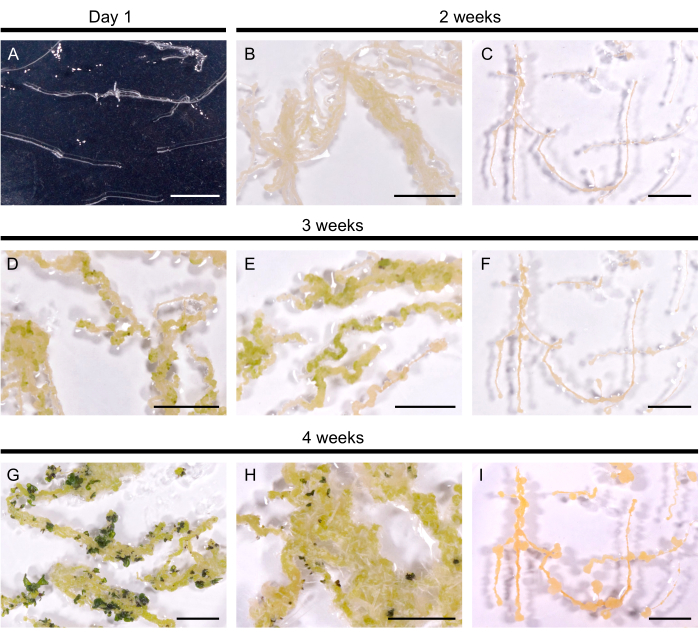
그림 2: A. thaliana의 털이 많은 뿌리의 재생. (A) 털이 많은 뿌리 배양 1 일 후 플레이트로 옮깁니다. (나, 씨) Calli는 재생 배지에서 배양 후 2주 이내에 개발되었습니다. (디, 마) 슛 프리모르디아는 3주간의 배양 끝에 등장했습니다. (지, H) 싹은 4 주 후에 형성됩니다. (H) 굳은살에서 발달한 외래 뿌리. (씨, 에프, 나) 재생되지 않는 털이 많은 뿌리 라인. 축척 막대는 1cm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: B. napus 및 A. thaliana 의 야생형 식물과 털이 많은 뿌리 유래 재생제(T0 식물)의 대표 사진. 재생제의 Ri 표현형에 주목하십시오. 축척 막대는 2cm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리는 털이 많은 뿌리 변형과 B. napus와 A. thaliana의 후속 재생을 위한 간단한 프로토콜을 개발했습니다. 이 과정에는 자엽(B. napus) 또는 1차 꽃차례 줄기(A. thaliana)에 주사 기반 털이 많은 뿌리 유도가 포함됩니다. Ri 플라스미드를 운반하는 농균 균주 C58C1을 하이포코틸에 주입하는 방법은 본 연구에서 제시된 Brassicaceae 구성원 외에도 Fabaceae계열 10,11에서도 효과적이었습니다.
주입 기반 방법의 대안은 박테리아 현탁액에 식생 침지, 그리고 농균과 외식의 공동 배양으로 구성된 침지 기반 형질전환입니다. 침지 방법에 비해 주입 기반 방법의 장점은 일부 프로토콜 단계(예: 식재 준비, 공동 재배 시간 테스트, 털이 많은 뿌리 유도를 위한 호르몬 함유 배지에 대한 배양)가 없어 시간이 절약된다는 것입니다. 두 접근법 모두 털이 많은 뿌리 유도에 효과적이지만, 일부 종에서는 주입 기반 방법을 사용하여 식물 침지12,13에 비해 더 높은 형질 전환 효율이 관찰되었습니다. 또한, 주입 기반 형질전환은 복합 식물(형질전환 털뿌리 및 야생형 새싹)을 생성하는 데에도 유용합니다. 형질전환된 식물의 원래 뿌리를 잘라낸 후, 털이 많은 뿌리는 식물의 성장을 지원하며, 전이유전자는 전체 식물의 맥락에서 연구될 수 있습니다.
털이 많은 뿌리 유도의 중요한 단계는 hypocotyl 또는 1 차 꽃차례 줄기에 접종물을 주입하는 것입니다. B. napus 의 hypocotyls는 부서지기 쉬우며 전체 hypocotyl을 쉽게 절단할 수 있습니다. 꽃차례 줄기가 얇기 때문에 A. thaliana 에서도 동일하게 관찰 할 수 있습니다. 다른 종/품종의 형질전환 효율 비교가 필요한 경우 식물 주입 시 조작 및 기술로 인한 오류를 피하기 위해 한 사람이 모든 실험을 수행하는 것이 좋습니다.
우리는 B. napus DH12075 및 A. thaliana Col-0에서 털이 많은 뿌리 재생을 위한 효과적인 프로토콜을 개발했습니다. 재생은 매우 가변적인 과정이기 때문에, 일부 프로토콜 변형은 선택한 종 또는 품종에 적용될 수 있습니다. 예를 들어, 털이 많은 뿌리 유래 새싹은 B. oleracea14에서 다른 옥신/사이토키닌 비율(1:1)에 의해 유도될 수 있습니다. 대안적으로, B. campestris 털뿌리의 경우와 같이 BAP 대신에 시토키닌 티디아주론을 사용할 수 있다15.
식물 게놈에 Ri 플라스미드 T-DNA를 여러 번 삽입하는 것은 털이 많은 뿌리 형질전환 및 재생 시스템의 잠재적 한계를 나타냅니다. 이러한 경우, T1 묘목의 분리 분석 후 Ri 플라스미드에서 TL/TR이 없는 식물은 발견되지 않습니다. 따라서 각 전이유전자에 대해 여러 개의 독립적인 털이 많은 뿌리줄기를 생성하는 것이 좋습니다.
털이 많은 뿌리 배양은 주로 빠른 설립과 저렴한 유지 관리(재배 배지에 호르몬이 필요하지 않음) 때문에 유전자 기능 연구를 위한 매우 강력한 도구입니다. 이 프로토콜은 B. napus 및 A. thaliana의 털이 많은 뿌리 유도 및 재생 방법을 다루며, 이는 복합 식물을 사용하는 전체 식물의 맥락에서 또는 형질전환 식물의 재생 후 털이 많은 뿌리 배양에서 직접 관심 있는 전이유전자를 연구하는 데 사용할 수 있습니다.
공개
저자는 이 연구가 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계 없이 수행되었음을 선언합니다.
감사의 말
우리는 농균 균주를 제공한 Jiří Macas(Biology Centre CAS, České Budějovice, Czech Republic)를 인정합니다. CEITEC MU의 핵심 시설 식물 과학은 기술 지원으로 인정 받고 있습니다. 이 작업은 체코 교육청소년체육부(Ministry of Education, Youth and Sports)의 유럽 지역 개발 기금 프로젝트 "SINGING PLANT"(no. CZ.02.1.01/0.0/0.0/16_026/0008446) 및 INTER-COST 프로젝트 LTC20004.
자료
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
참고문헌
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유