Method Article
Transformação e regeneração de raízes pilosas em Arabidopsis thaliana e Brassica napus
Neste Artigo
Resumo
O protocolo descreve indução de raízes pilosas utilizando hastes primárias de inflorescência de Arabidopsis e hipocótilos de Brassica napus . As raízes pilosas podem ser cultivadas e usadas como explantes para regenerar plantas transgênicas.
Resumo
A transformação de raízes peludas representa uma ferramenta versátil para a biotecnologia vegetal em várias espécies. A infecção por uma cepa de Agrobacterium portadora de um plasmídeo indutor de raízes (Ri) induz a formação de raízes pilosas no local da lesão após a transferência de T-DNA do plasmídeo Ri para o genoma da planta. O protocolo descreve em detalhes o procedimento de indução da raiz pilosa à base de injeção em Brassica napus DH12075 e Arabidopsis thaliana Col-0. As raízes pilosas podem ser utilizadas para analisar um transgene de interesse ou processadas para a geração de plantas transgênicas. Meio de regeneração contendo citocinina 6-benzilaminopurina (5 mg/L) e ácido auxina 1-naftalenoacético (8 mg/L) provoca com sucesso a formação de brotos em ambas as espécies. O protocolo abrange a genotipagem e seleção de plantas regenerantes e T1 para obtenção de plantas portadoras de um transgene de interesse e livres de T-DNA do plasmídeo Ri. Um processo alternativo que leva à formação de uma planta composta também é descrito. Neste caso, as raízes pilosas são mantidas na parte aérea (em vez das raízes naturais), o que permite o estudo de um transgene em culturas de raízes pilosas no contexto de toda a planta.
Introdução
A transformação vegetal é o gargalo de qualquer estudo genético em biologia vegetal. Uma bactéria transmitida pelo solo, Agrobacterium tumefaciens, é amplamente utilizada como um meio de entrega de genes por imersão floral ou cultura de tecidos para gerar transformantes. A. tumefaciens infecta plantas em um local de ferimento e causa tumores devido à transferência e integração de T-DNA de um plasmídeo indutor de tumor (Ti) no genoma da planta hospedeira. Cepas de A. tumefaciens projetadas com plasmídeo de Ti modificado sem o T-DNA selvagem e um vetor binário com T-DNA artificial e sítios de clonagem para inserção de um gene de interesse são comumente usadas como um eficiente sistema de transformação vegetal1. No entanto, muitas espécies-modelo e culturas são recalcitrantes ao mergulho floral ou à regeneração in vitro de plantas ou apresentam longos ciclos de crescimento, impactando a eficiência desse sistema de transformação.
Agrobacterium rhizogenes induz a formação de raízes adventícias, ou raízes pilosas, no local da lesão após infectar uma planta hospedeira. Semelhante a A. tumefaciens, A. rhizogenes transfere um T-DNA de um plasmídeo indutor de raízes (Ri) para o genoma da planta hospedeira, causando o desenvolvimento de raízes pilosas transgênicas. Esse processo é controlado principalmente pelos genes dos loci oncogênicos radiculares (rol)2,3. Usando linhagens de agrobactérias carregando tanto o plasmídeo Ri quanto um vetor binário artificial que codifica um gene de interesse, culturas de raízes pilosas têm sido usadas para produzir proteínas recombinantes, analisar a função de promotores ou genes, ou editar genomas usando Clustered Regularly Interspaced Short Palindromic Repeats (CRISPRs)/CRISPR-associated protein 9 (Cas9)4,5,6.
Nosso protocolo utiliza a cepa transconjugante Ti-less A. tumefaciens C58C1 portadora do plasmídeo Ri pRiA4b7. O T-DNA do plasmídeo Ri consiste de duas regiões, DNA-T direito e esquerdo (DNA-TR e DNA-TL, respectivamente), que podem se integrar independentemente ao genoma vegetal8. Explorando esse sistema, otimizou-se o longo processo de transformação de explantes em cultivares de DH12075 Brassica napus 9. O protocolo detalhado abaixo permite a regeneração de linhagens pilosas selecionadas e a obtenção de plantas T1 portadoras do transgene de interesse e livres de genes rol em aproximadamente 1 ano. A transformação de raiz pilosa à base de injeção pode ser usada em outras espécies de Brassicaceae, como mostrado pela transformação de Arabidopsis thaliana Col-0. Enquanto o hipocótilo é usado para transformar B. napus, A. thaliana é injetado no caule primário da inflorescência.
Protocolo
1. Preparação de mídias e soluções
- Prepare as soluções de estoque de hormônios.
- Para a preparação de 50 mL de solução estoque de ácido 1-naftalenoacético (ANA), 6-benzilaminopurina (BAP) e ácido indol-3-butírico (AIB) com concentração de 5 mg/mL, dissolver 250 mg do hormônio em pó em 2 mL de hidróxido de sódio (NaOH) 1 M e ajustar o volume para 50 mL com água ultrapura.
- Para preparar 50 mL de ácido giberélico (GA3) com uma concentração de 1 mg/mL, dissolver 50 mg do hormônio em pó em 2 mL de etanol e ajustar o volume para 50 mL de água ultrapura.
- Filtrar a solução utilizando um filtro de seringa estéril com poros de 0,22 μm e distribuí-la em tubos estéreis de 2 ml para armazenamento. Conservar a solução a -20 °C ou 4 °C, dependendo da recomendação do fabricante.
- Preparar soluções estoque de antibióticos. Para 50 mL de cefotaxima e solução estoque dissódica de ticarcilina com concentração de 100 mg/mL, dissolver 0,5 g do antibiótico em pó em 40 mL de água ultrapura e ajustar para um volume final de 50 mL. Filtrar a solução utilizando um filtro de seringa estéril com poros de 0,22 μm e distribuí-la em tubos estéreis de 2 ml para armazenamento. Conservar a solução a -20 °C.
NOTA: Antibióticos e hormônios são sempre adicionados ao meio resfriado. - Preparar 1 L de meio Luria Broth (LB) adicionando 10 g de bacto-triptona, 5 g de extracto de levedura e 5 g de cloreto de sódio (NaCl) num cilindro de medição de 1 L e ajustar o volume para 1 L com água bidestilada. Ajuste o pH para 7,0 com KOH com um medidor de pH (seguindo as instruções do fabricante). Transferir a solução para um frasco de 1 L e adicionar 15 g de ágar bacteriológico (1,5%), se for preparado um meio sólido e autoclavar o meio. Se necessário, adicione os antibióticos apropriados (a resistência bacteriana é transportada no vetor binário) ao meio resfriado.
NOTA: Use uma autoclave para esterilizar a solução. Coloque o frasco no cesto, feche a tampa e esterilize-o por 20 min a 121 °C e 98,9 kPa. Este protocolo é sempre utilizado para soluções de autoclavagem em etapas posteriores. - Preparar 1 L de extrato de levedura em meio bovino (YEB) misturando 5 g de extrato bovino, 1 g de extrato de levedura, 5 g de peptona, 5 g de sacarose e 0,5 g de cloreto de magnésio (MgCl2) em água bidestilada. Ajuste o volume para 1 L. Transfira a solução para um frasco de 1 L. Autoclave o meio.
- Preparar 1 L de meio para germinação das sementes misturando 2,2 g de pó de Murashige e Skoog (MS), 10 g de sacarose (1%) e 0,5 g de sais de sódio do ácido 2-(N-Morpholino)etanossulfônico (MES) em água bidestilada. Ajuste o volume para 1 L, misture e ajuste o pH para 5,8 com KOH. Transferir a solução para um frasco de 1 L e adicionar 8 g de ágar vegetal (0,8%). Autoclave o meio.
- Preparar 1 L de meio de cultura misturando 2,2 g de pó de MS, 5 g de sacarose (0,5%) e 0,5 g de sais de MES em água bidestilada. Ajuste o volume para 1 L, misture e ajuste o pH para 5,8 com KOH. Transferir a solução para um frasco de 1 L e adicionar 8 g de ágar vegetal (0,8 %). Autoclave o meio.
- Preparar 1 L de meio de crescimento de raiz pilosa misturando 4,4 g de MS + B5 vitaminas em pó, 30 g de sacarose (3%) e 0,5 g de sais MES em água bidestilada. Ajuste o volume para 1 L, misture e ajuste o pH para 5,8 com KOH e transfira a solução para um frasco de 1 L. Adicionar 3 g de gelificante (0,3%) e autoclavar o meio. Adicionar cefotaxima e ticarcilina dissódica a uma concentração final de 100 - 200 mg/L e 100 - 500 mg/L, respectivamente. Se necessário, adicione os antibióticos apropriados (a resistência é devida ao T-DNA de um vetor binário).
- Preparar 1 L de meio de crescimento vegetal composto misturando 2,2 g de MS + B5 vitaminas em pó, 10 g de sacarose (1%) e 0,5 g de sais MES em água bidestilada. Ajuste o volume para 1 L, misture e ajuste o pH para 5,8 com KOH e transfira a solução para um frasco de 1 L. Adicionar 6 g de gelificante (0,6%) e autoclavar o meio. Adicionar cefotaxima e ticarcilina dissódica a uma concentração final de 200 mg/L e 500 mg/L, respectivamente. Se necessário, adicione os antibióticos apropriados (a resistência é devida ao T-DNA de um vetor binário).
- Preparar 1 L de meio de regeneração misturando 4,4 g de MS + B5 vitaminas em pó, 30 g de sacarose (3%) e 0,5 g de sais MES em água bidestilada. Ajuste o volume para 1 L, misture e ajuste o pH para 5,8 com KOH. Transferir a solução para um frasco de 1 L e adicionar 3 g de gelificante (0,3 %). Autoclave o meio. Adicionar NAA e BAP a uma concentração final de 8 mg/L e 5 mg/L, respectivamente, e ticarcilina dissódica a uma concentração final de 100 mg/L.
- Preparar 1 L de meio de alongamento da parte aérea misturando 4,4 g de MS + B5 vitaminas em pó, 20 g de sacarose (2%) e 0,5 g de sais MES em água bidestilada. Ajuste o volume para 1 L, misture e ajuste o pH para 5,8 com KOH. Transferir a solução para um frasco de 1 L e adicionar 3 g de ágar vegetal (0,3%). Autoclave o meio. Adicionar BAP e GA3 a uma concentração final de 0,5 mg/L e 0,03 mg/L, respectivamente, e cefotaxima a uma concentração final de 100 mg/L.
- Preparar 1 L de meio de indução radicular misturando 2,2 g de MS + B5 vitaminas em pó, 10 g de sacarose (1%) e 0,5 g de sais MES em água bidestilada. Ajuste o volume para 1 L, misture e ajuste o pH para 5,8 com KOH. Transferir a solução para um frasco de 1 L e adicionar 3 g de gelificante (0,3%). Autoclave o meio. Adicionar AIB e cefotaxima a uma concentração final de 0,5 mg/L e 100 mg/L, respectivamente.
- Preparar 1 L de tampão brometo de cetiltrimetilamónio (CTAB) adicionando 20 g de CTAB (2% p/v final), 100 ml de Tris-HCl 1M, pH 8,0 (100 mM final), 40 ml de EDTA 0,5 M, pH 8,0 (20 mM final), 81,8 g de NaCl (1,4 M final) e 5 g de PVP40 (0,5% p/v final). Ajuste para 1 L com água destilada dupla. Autoclave a solução. Conservar a solução até 1 ano à temperatura ambiente.
2. Transformação de Agrobacterium com vetor binário
- Preparar o DNA de um plasmídeo binário verificado contendo o T-DNA para ser integrado ao genoma da planta. Certifique-se de que o DNA plasmidial contenha baixos sais para evitar faíscas elétricas à medida que a eletroporação é usada. Recomenda-se o uso de um kit de extração de DNA plasmidial de escolha.
- Preparar células eletrocompetentes de Agrobacterium tumefaciens C58C1 contendo o plasmídeo pRiA4b indutor de raízes pilosas inoculando 200 mL de YEB líquido pré-aquecido (28 °C) com 8 mL de uma cultura fresca durante a noite. Incubar a cultura a 28 °C enquanto agita até que a densidade óptica a 600 nm (OD600) seja de cerca de 0,5, correspondendo à fase logarítmica média. Leva cerca de 4 - 5 h.
- Divida a cultura de Agrobacterium em quatro tubos de centrífuga estéreis pré-resfriados de 50 mL. Centrifugar durante 15 min a 4 °C a 3.200 x g.
NOTA: As células devem ser mantidas frias a partir desta etapa. - Retire o sobrenadante e ressuspenda o pellet suavemente em (4x) 2,5 mL de glicerol a 10% frio (4 °C). Adicione mais 47,5 mL de glicerol 10% gelado e misture delicadamente.
- Células pellet a 3.200 x g por 15 min a 4 °C. Eliminar o sobrenadante e ressuspender as células em (4x) 10 mL de glicerol frio a 10%.
- Pastilhar novamente as células e ressuspendê-las em (4x) 0,75 mL de glicerol frio a 10%. Agrupar o conteúdo dos quatro tubos em um (volume total = 3 mL).
- Divida a solução agrobacteriana em alíquotas de 50 μL em microtubos estéreis pré-resfriados de 1,5 mL. Congelar as alíquotas em gelo seco ou nitrogênio líquido. Conservar os tubos a -80 °C para utilização futura.
- Colocar um tubo de células competentes (50 μL) no gelo, misturar com 5 μL de ADN plasmidial (1 μg no total, a partir do passo 2.1), transferir a mistura para uma cubeta de eletroporação (0,2 cm de intervalo) e incubar durante 5 minutos no gelo.
- Coloque a cubeta no eletroporator e eletropore as células com as seguintes regulagens: capacitância 25 μFD, resistência 400 Ω, tensão elétrica 2,5 kV, duração do pulso 9,7 ms.
- Adicionar 950 μL de meio líquido LB às células, que são então cultivadas a 28 °C por 2 h a 300 rpm em um termomisturador. Placa de 50 μL da cultura celular em meio LB sólido com antibiótico seletivo apropriado. Cultivar as placas por 2 dias a 28 °C.
NOTA: Recomenda-se a placa de uma gama de culturas de células (10 μL - 100 μL) por placa para determinar um volume de cultura adequado e evitar o crescimento excessivo de bactérias. - Preparar culturas líquidas de algumas colônias selecionadas em 5 mL de meio líquido LB com antibióticos. Cultivar as bactérias durante a noite a 28 °C com agitação. Use essas culturas para estoques de glicerol misturando 0,5 mL de cultura de bactérias líquidas e 0,5 mL de glicerol a 40%.
NOTA: Estas colônias são verificadas quanto à presença do transgene por PCR de colônia. Para este propósito, adicione uma pequena quantidade de uma colônia de uma placa à mistura mestre de PCR contendo tampão, dNTP e Taq polimerase de escolha, juntamente com primers amplificando uma parte do T-DNA de um vetor binário. O inóculo dos estoques de glicerol é utilizado para a transformação das plantas.
3. Transformação da raiz peluda de Brassica napus DH12075
- Coloque as sementes de Brassica napus DH12075 em microtubos e esterilize-as em uma caixa de fluxo. Primeiro, desengraxe as sementes usando água e detergente a 0,1% enquanto agita por 60 s. Em seguida, enxaguar as sementes com água seguida de etanol 70%, ambos por 60 s.
- Esterilizar as sementes com solução a 10% de água sanitária comercial contendo hipoclorito de sódio. Agite as sementes nesta solução durante 20 minutos.
- Lave as sementes 4x com água estéril por 60 s cada. Colocá-los em placas de Petri contendo o meio de germinação das sementes. Estratificar as sementes a frio a 4 °C durante a noite e mover as placas para uma sala de cultivo (21 °C, 16 h claro/8 h escuro).
- Transfira mudas de 5 dias de idade para caixas de cultura de plantas contendo um meio de crescimento vegetal.
OBS: A melhor eficiência de transformação em DH12075 foi identificada para mudas com 18 dias de idade. A idade das plântulas pode ser otimizada para as condições locais de crescimento ou outras cultivares. - Inocular uma cultura líquida de Agrobacterium tumefaciens C58C1 carregando um plasmídeo indutor de raiz pilosa pRiA4b e o vetor binário para transformação (a partir do passo 2.11) com uma alça de inoculação. Use 5 mL de meio LB. Cultivar esta cultura durante a noite a 28 °C até atingir OD600 = 0,9 - 1.
NOTA: Agrobacterium contendo apenas o plasmídeo Ri é usado se raízes pilosas selvagens são produzidas. - Injetar uma pequena quantidade de cultura (aproximadamente 50 μL) com uma seringa de insulina no hipocótilo de uma plântula com 18 dias de idade (a partir do passo 3.4.). Puncione o hipocótilo com uma agulha 26G montada na seringa a cerca de 1 cm acima da superfície do meio. Injete o líquido na ferida. O tecido na superfície do hipocótilo também pode ser arranhado pela seringa.
OBS: O número de mudas inoculadas deve ser adaptado às necessidades do experimentador. - Retornar as plantas à sala de cultivo a 21 °C por 2 a 4 semanas até que um calo e raízes pilosas sejam formados no local da ferida.
- Cortar o calo com as raízes pilosas emergidas do hipocótilo e colocá-lo em uma placa de Petri com o meio de crescimento radicular piloso contendo antibióticos seletivos (transportados pelo T-DNA) e cefotaxima (200 mg/L) e ticarcilina (500 mg/L) para suprimir o crescimento agrobacteriano. Sele as placas de Petri com fita métrica permeável a gás. Cultivar as raízes pilosas a 24 °C no escuro.
NOTA: A concentração adequada de antibióticos específicos usados para seleção funcional deve ser testada com raízes peludas selvagens. Para B. napus DH12075 raízes pilosas que carregam resistência à canamicina, uma concentração de 25 mg/L de canamicina é usada.
OBS: Nesta etapa, é possível gerar uma planta composta por parte aérea selvagem e raízes peludas transgênicas que sustentam o crescimento dessa planta. Em vez de cortar as raízes peludas de um caule, as raízes nativas da planta são removidas. A planta com raízes pilosas emergentes é transferida para uma caixa de cultura de plantas com um meio de crescimento composto contendo cefotaxima (200 mg/L) e ticarcilina (500 mg/L) para suprimir o crescimento de agrobactérias, e o antibiótico seletivo (carreado pelo T-DNA). - Após 1 a 2 semanas, isole as raízes pilosas da placa de Petri do calo e individualize-as em placas com o mesmo meio de cultura. Transfira a cultura para um prato fresco a cada 4 a 5 semanas. Adicionar 0,25 mg/L de AIB para aumentar a ramificação radicular.
- Reduzir as concentrações de cefotaxima e ticarcilina gradualmente em cada transferência em 100 mg/L (ou seja, o meio para a primeira transferência contém 100 mg/L de cefotaxima e 400 mg/L de ticarcilina; para a segunda transferência, 300 mg/L de ticarcilina, etc.). Após 3 a 4 meses, cultivar as raízes pilosas em meio de crescimento de raízes pilosas com 100 mg/L de ticarcilina e antibiótico seletivo.
4. Regeneração de Brassica napus DH12075 raízes peludas
- Transfira linhas de raízes pilosas independentes para placas com meio de regeneração em condições estéreis usando pinças, com chama antes do uso. Transferir 5 - 10 raízes por placa de Petri e cultivá-las a 21 °C em um fotoperíodo de dias longos (16 h claro / 8 h escuro). Sele as placas de Petri com fita métrica permeável a gás.
- A cada 3 a 4 semanas, transfira as raízes pilosas para placas com meio de regeneração fresco. Note que os calos são formados após aproximadamente 2 semanas. O calo começa a disparar após mais 2 semanas até 8 - 9 semanas após a formação do calo.
- Individualizar os brotos e transferi-los para caixas de cultura de plantas com meio de alongamento da parte aérea por 2 a 3 semanas para promover o alongamento dos brotos.
- Transfira os brotos alongados para caixas de cultura de plantas com meio de indução radicular. Atualize a cultura a cada 3 - 4 semanas. A eficiência de enraizamento em DH12075 é de 87% aos 30 dias e de até 100% aos 60 dias.
- Transfira as plantas enraizadas para o solo após remover quaisquer vestígios de agente gelificante para evitar a infecção fúngica. Certifique-se de que as plantas são primeiro aclimatadas nos fitótrons (21 °C, fotoperíodo de dias longos, 150 μE) e, em seguida, transferi-las para uma estufa para floração (21 °C / 18 °C, fotoperíodo de dias longos, 150 μE).
5. Seleção de plantas regenerativas e T1
NOTA: As linhas de raiz peludas podem ser selecionadas antes de entrar no processo de regeneração. O tipo de seleção depende do conteúdo transportado pelo transgene. As raízes pilosas podem ser amostradas para extração de DNA e genotipagem ou detecção de mutação, extração de RNA com subsequente síntese de cDNA e RT-qPCR para análise do nível de expressão do gene de escolha, microscopia para detecção de fluorescência ou tratadas para coloração de GUS.
- Após a transferência para o solo, genotipar novamente as plantas regeneradoras T0 (e as plântulas T1) para evitar escapes dos procedimentos de seleção. As plantas T0 exibem um fenótipo alterado denominado fenótipo Ri: crescimento extenso das raízes, folhas crespas e brotações anãs causadas pela presença do TL e/ou TR-DNA do plasmídeo Ri inserido no genoma da planta.
- Para acelerar a seleção de T1, utilizar as sementes contendo embriões verdes maduros (aprox. 21 - 28 dias após a polinização para DH12075 para um embrião de torpedo ou mais velho) de plantas regenerantes T0 para resgate de embriões.
- Trabalhe na caixa de fluxo estéril. Recolher as sílicas e esterilizá-las superficialmente com etanol 70%.
- Coloque-os em uma fita dupla face colada em uma tampa de placa ou um slide.
- Usando um estereobinóculo, corte a silique ao longo das margens da válvula usando uma agulha 26G. Certifique-se de que o corte não danifique as sementes. Para facilitar a aderência, monte a agulha em uma seringa de 1 mL.
- Abra os carpelos e cole-os na fita. Coletar as sementes imaturas e transferi-las para placas com meio para germinação das sementes. Sele as placas com fita adesiva permeável a gás.
- Colocar as placas numa sala de cultivo (21 °C, 16 h claro/8 h escuro) até à germinação.
- Genótipo das plântulas T1 quanto à presença do transgene de interesse e ausência do Ri TR/TL (Figura 1). Coletar material foliar e extrair seu DNA usando o método de escolha. O método CTAB é descrito aqui:
- Recolher o material foliar num microtubo de 2 mL contendo duas esferas cerâmicas. Congelar o tubo em nitrogênio líquido.
- Triture o material usando um moinho de bolas. Alternativamente, pilão e argamassa podem ser usados.
- Depois de uma rotação rápida para baixo, adicione 400 μL de tampão CTAB ao pó. Vórtice brevemente, gire para baixo e incube a 60 °C por pelo menos 50 min.
- Arrefecer a solução à temperatura ambiente durante 15 minutos. Adicione um volume de clorofórmio e misture delicadamente.
CUIDADO: Ao usar clorofórmio, trabalhe sob o fluxo químico e use luvas para proteção. Qualquer solução que contenha clorofórmio deve ser eliminada no contentor de resíduos adequado. - Centrifugar por 5 min a 18.400 x g usando uma centrífuga de mesa. Transferir 250 - 350 μL da fase aquosa superior para um novo microtubo. Omitir a interfase.
- Adicione um volume de isopropanol, misture bem e incube por 5 min à temperatura ambiente. Centrifugar por 40 min a 18.400 x g.
- Descarte o líquido e adicione 200 μL de etanol 70%. Lave o pellet e a centrífuga por 15 min a 18.400 x g.
- Descarte o líquido. Seque o pellet ao ar e adicione 50 - 100 μL de água ultrapura. Deixe o DNA dissolver por 1 h para passar a noite na geladeira.
- Realizar uma genotipagem por PCR para o gene rolA (TL), o gene aux1 (TR) e o locus virC (Agrobacterium). Preparar a reação de PCR usando o DNA preparado (da etapa 5.3.), primers, tampão, dNTP e Taq polimerase de acordo com o protocolo do fabricante. Os fragmentos amplificados têm de 200 a 500 pb de comprimento.
Primers específicos para rolA:
Avante: GTTAGGCGTGCAAAGGCCAAG
Reverso: TGCGTATTAATCCCGTAGGTC
Primers específicos para aux1:
Avante: CATAGGATCGCCTCACAGGT
Reverso: CGTTGCTTGATGTCAGGAGA
Primers específicos para virC:
Avante: AATGCGTCTCTCTCGTGCAT
Reverso: AAACCGACCACTAACGCGAT
NOTA: A transferência e integração do DNA-T podem ser parciais, e apenas partes de TL e/ou TR podem se integrar ao genoma. Assim, recomenda-se analisar a presença de outras ORFs de CT (e.g., rolB e rolC) e TR (aux2, mas1, ags1) em plântulas T1. Sequências de primers específicas para esses loci estão listadas em Jedličková et al.9. - Avaliar reações de PCR por eletroforese em gel.
NOTA: Recomenda-se incluir um controle positivo nesta análise para garantir ter DNA de grau PCR. - Selecionar para a presença (ou ausência) do transgene de acordo com os protocolos baseados no conteúdo deste transgene.
- Transfira mudas selecionadas para o solo.
6. Transformação e regeneração de raízes pilosas em Arabidopsis thaliana Col-0
- Esterilizar superficialmente sementes de A. thaliana com um método de escolha (água sanitária, etanol ou gás cloro).
- Sementes estéreis em placa em meio para germinação das sementes. Após 2 dias de estratificação fria, mover as placas para uma sala de cultivo (21 °C com fotoperíodo de dias longos e 50% de umidade).
- Transfira as mudas com 1 semana de idade para uma caixa de cultura de plantas com meio de crescimento vegetal.
- Preparar culturas de Agrobacterium conforme indicado na etapa 3.5.
- Injetar uma pequena quantidade de cultura (aproximadamente 50 μL) com uma agulha montada em uma seringa de insulina na base do caule primário da inflorescência (aproximadamente 1 - 2 cm acima da roseta) de plântulas de Arabidopsis com 1 mês de idade. O tecido na superfície da haste primária também pode ser riscado pela seringa.
- Em 2-4 semanas após a injeção, excisar as raízes pilosas emergentes e cultivá-las em placas de Petri com o meio de crescimento da raiz pilosa suplementado com o antibiótico seletivo (transportado pelo T-DNA) e cefotaxima (200 mg/L) e ticarcilina (500 mg/L) para suprimir o crescimento agrobacteriano. Incubar as placas a 24 °C no escuro.
- Após 1 a 2 semanas, individualizar as raízes pilosas em placas com o mesmo meio de cultura. Transfira as linhas de raiz peludas selecionadas para um meio fresco a cada 4 - 5 semanas.
NOTA: As raízes pilosas de A. thaliana são mais finas que as de B. napus, e deve-se ter cautela ao transferir para meios frescos. - Transfira as raízes pilosas para placas com meio de regeneração para induzir a formação de calos. Cultivar as placas a 21 °C em fotoperíodo de dias longos (16 h claro / 8 h escuro).
- Os brotos emergem do calo após 18 - 21 dias de cultivo. Corte os brotos e transfira-os para um meio de alongamento dos brotos por 2 a 3 semanas para promover o crescimento e alongamento.
- Transfira os brotos alongados para o meio de indução radicular.
- Transfira as plantas enraizadas para o solo. As plantas T0 também apresentam fenótipo de Ri. Realizar a seleção transgênica, conforme descrito para B. napus DH12075 (etapa 5).
Resultados
Previamente otimizamos um protocolo de indução de raízes pilosas à base de injeção em três cultivares de Brassica napus: DH12075, Topas DH4079 e Westar9. Para aplicar este protocolo de transformação à espécie-modelo A. thaliana, as hastes primárias da inflorescência de plântulas com 1 mês de idade foram injetadas com inóculo agrobacteriano. Raízes pilosas emergiram no local da injeção após 2-4 semanas. Raízes pilosas foram excisadas e cultivadas em meio sólido. A comparação do método nessas duas espécies está representada na Figura 1.
Linhas radiculares pilosas selecionadas foram transferidas para o meio de regeneração para induzir a formação da parte aérea. Em A. thaliana, calos amarelos foram induzidos dentro de 14 dias em todas as 10 linhagens de raízes pilosas testadas. Os primórdios da primeira parte aérea, visíveis como manchas verde-escuras, emergiram dentro de 3 semanas após a transferência para o meio de regeneração (Figura 2). Após 4 semanas de cultivo, a parte aérea cobriu as raízes pilosas em 9 de 10 linhas de raízes pilosas (90% de eficiência de regeneração). Em alguns casos, raízes adventícias foram eliciadas do calo (Figura 2H). Uma linhagem não se regenerou mesmo após 3 meses no meio de regeneração (a cada 4 semanas, as raízes pilosas foram transferidas para um meio fresco). Assim, a eficiência de regeneração das raízes pilosas de A. thaliana assemelha-se à eficiência de B. napus DH120759.
Os regenerantes de raízes pilosas de B. napus e A. thaliana apresentam fenótipo anão (Figura 3), característica típica das plantas derivadas de raízes pilosas2. Também foram observados sistemas radiculares densos, folhas enrugadas e mudanças no tempo de floração. Esse fenótipo chamado de raiz pilosa (ou Ri) é causado pelos genes rol do plasmídeo Ri inseridos no genoma da planta. A inserção do T-DNA de Ri e do transgene codificado em um vetor binário pode ser independente ou ligada. Assim, uma análise de segregação da progênie T1 criada pela autopolinização ajuda a identificar plantas rol-free expressando o transgene de interesse. A genotipagem das plantas T1 é realizada por PCR primers específicos para as ORFs de TL e TR e o transgene de interesse. A ausência de contaminação por agrobactérias é verificada pela ausência de produtos de PCR dos primers virC (Figura 1).
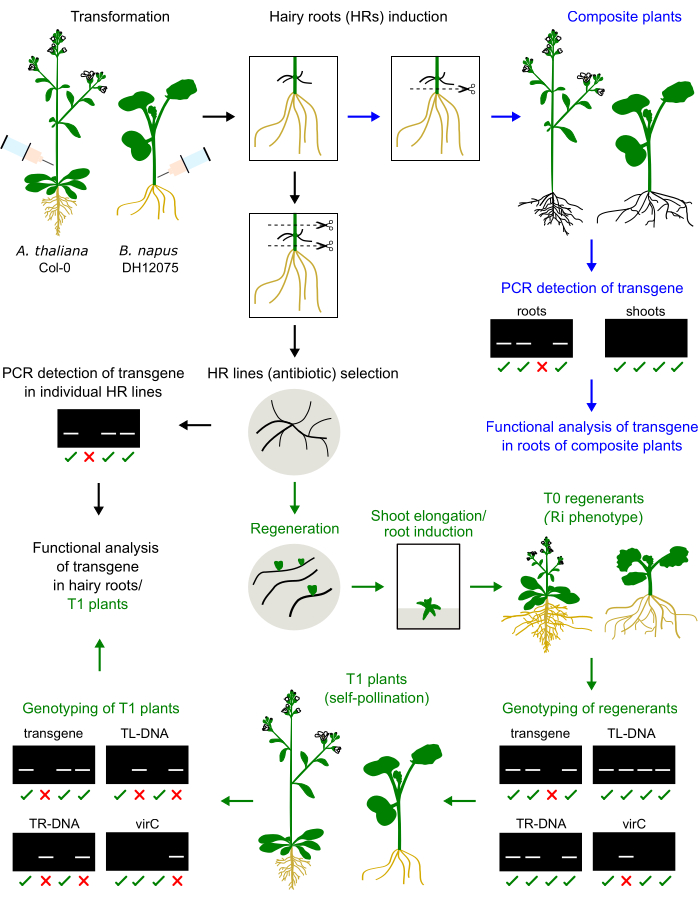
Figura 1: Resumo do procedimento em A. thaliana e B. napus. A injeção do inóculo de Agrobacterium no caule do hipocótilo ou inflorescência primária induz o desenvolvimento de raízes pilosas. As raízes pilosas podem substituir as raízes nativas para gerar uma planta composta que será genotipada e analisada (setas azuis). Raízes pilosas cultivadas podem ser regeneradas em plantas T0, propagadas em plantas T1 e genotipadas (setas verdes). As raízes pilosas também podem ser subcultivadas para análise funcional (seta preta). Exemplos de resultados de genotipagem são apresentados. Clique aqui para ver uma versão maior desta figura.
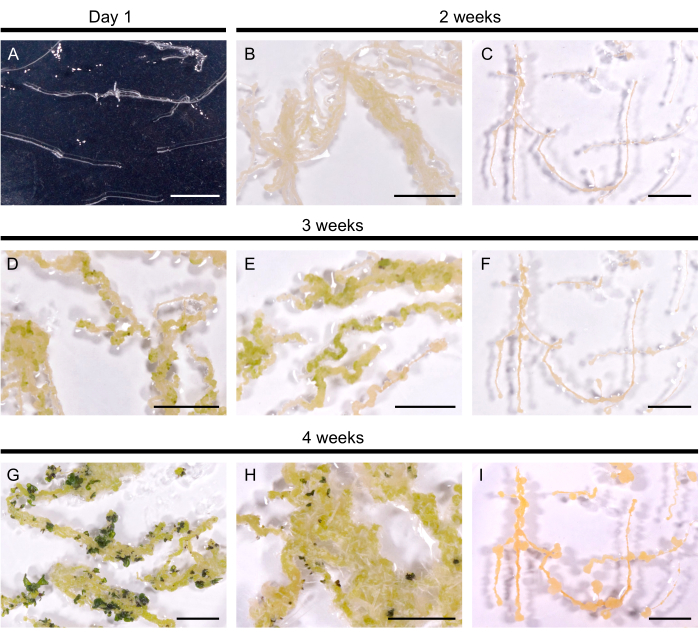
Figura 2: Regeneração de raízes pilosas em A. thaliana. (A) Cultivo de raízes pilosas 1 dia após sua transferência para placas. (B, C) Calli desenvolveu-se dentro de 2 semanas de cultura em meio de regeneração. (D, E) Os primórdios dos brotos emergiram após 3 semanas de cultura. (G, H) Os brotos são formados após 4 semanas. (H) As raízes adventícias desenvolveram-se a partir do calo. (C, F, I) Linha radicular pilosa não regenerante. As barras de escala representam 1 cm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Fotos representativas de plantas silvestres de B. napus e A. thaliana e regenerantes derivados de raízes peludas (plantas T0). Observe o fenótipo Ri dos regenerantes. As barras de escala representam 2 cm. Clique aqui para ver uma versão maior desta figura.
Discussão
Desenvolvemos um protocolo simples para transformação de raízes pilosas e posterior regeneração em B. napus e A. thaliana. Esse processo inclui a indução de raízes pilosas à base de injeção no caule do hipocótilo (B. napus) ou da inflorescência primária (A. thaliana). O método de injeção do hipocótilo com a linhagem C58C1 da agrobactéria portadora de um plasmídeo Ri também foi eficaz na família Fabaceae10,11, além dos membros de Brassicaceae apresentados neste estudo.
Uma alternativa ao método baseado em injeção é a transformação baseada em imersão que consiste na imersão do explante em uma suspensão bacteriana, seguida do co-cultivo do explante com agrobactérias. A vantagem do método injetável sobre o método de imersão é a economia de tempo pela ausência de algumas etapas do protocolo: preparo do explante, teste do tempo de co-cultivo e cultivo em meio contendo hormônio para indução de raízes pilosas. Embora ambas as abordagens sejam eficazes para a indução de raízes pilosas, maior eficiência de transformação foi observada em algumas espécies com o método baseado em injeção em comparação com o método de imersão em explante12,13. Além disso, a transformação baseada em injeção também é útil para gerar plantas compostas (raízes pilosas transgênicas e brotos selvagens). Depois de cortar as raízes originais da planta transformada, as raízes pilosas suportam o crescimento da planta, e o transgene pode ser estudado no contexto de toda a planta.
A etapa crítica da indução da raiz pilosa é a injeção do inóculo no hipocótilo, ou caule primário da inflorescência. Os hipocótilos de B. napus são quebráveis, e o corte de todo o hipocótilo pode facilmente acontecer. O mesmo pode ser observado com A. thaliana devido à finura do caule da inflorescência. Se for necessária uma comparação da eficiência de transformação de diferentes espécies/cultivares, recomendamos que uma pessoa realize todos os experimentos para evitar o erro causado pela manipulação e habilidade em injetar as plantas.
Desenvolvemos um protocolo eficaz para regeneração radicular pilosa em B. napus DH12075 e A. thaliana Col-0. Como a regeneração é um processo altamente variável, algumas modificações de protocolo podem ser aplicadas a uma espécie ou cultivar de escolha. Por exemplo, os brotos derivados de raízes pilosas podem ser eliciados por uma relação auxina/citocinina diferente (1:1) em B. oleracea14. Alternativamente, pode-se utilizar citocinina thidiazuron em substituição à BAP, como no caso das raízes pilosas de B. campestris 15.
Múltiplas inserções do T-DNA plasmidial de Ri no genoma da planta representam uma limitação potencial do sistema de transformação e regeneração de raízes pilosas. Nesses casos, nenhuma planta isenta de LT/TR do plasmídeo Ri é descoberta após análise de segregação de plântulas T1. Assim, recomendamos gerar várias linhas radiculares pilosas independentes para cada transgene.
As culturas de raízes pilosas são uma ferramenta extremamente poderosa para estudos funcionais de genes, principalmente devido ao seu rápido estabelecimento e manutenção barata (sem necessidade de hormônios nos meios de cultivo). Este protocolo abrange os métodos de indução e regeneração de raízes pilosas em B. napus e A. thaliana, que podem ser utilizados para estudar o transgene de interesse diretamente em culturas de raízes pilosas, no contexto da planta inteira utilizando plantas compostas, ou após a regeneração das plantas transgênicas.
Divulgações
Os autores declaram que a pesquisa foi conduzida sem quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Agradecemos a Jiří Macas (Centro de Biologia CAS, České Budějovice, República Tcheca) por fornecer a cepa agrobacteriana. O Core Facility Plants Sciences da CEITEC MU é reconhecido por seu suporte técnico. Este trabalho foi apoiado pelo Ministério da Educação, Juventude e Desportos da República Checa com o Fundo Europeu de Desenvolvimento Regional-Projecto "SINGING PLANT" (nº. CZ.02.1.01/0.0/0.0/16_026/0008446) e o projeto INTER-COST LTC20004.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
Referências
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados