Method Article
Arabidopsis thaliana ve Brassica napus'ta Tüylü Kök Dönüşümü ve Rejenerasyonu
Bu Makalede
Özet
Protokol , Arabidopsis birincil çiçeklenme sapları ve Brassica napus hipokotilleri kullanılarak tüylü kök indüksiyonunu açıklar. Tüylü kökler kültürlenebilir ve transgenik bitkileri yenilemek için eksplant olarak kullanılabilir.
Özet
Tüylü kök dönüşümü, çeşitli türlerde bitki biyoteknolojisi için çok yönlü bir araçtır. Kök indükleyici (Ri) plazmid taşıyan bir Agrobacterium suşu tarafından enfeksiyon, T-DNA'nın Ri plazmidinden bitki genomuna aktarılmasından sonra yaralama bölgesinde tüylü köklerin oluşumunu indükler. Protokol, Brassica napus DH12075 ve Arabidopsis thaliana Col-0'da enjeksiyon bazlı tüylü kök indüksiyonunun prosedürünü ayrıntılı olarak açıklamaktadır. Tüylü kökler, ilgilenilen bir transgeni analiz etmek için kullanılabilir veya transgenik bitkilerin üretimi için işlenebilir. Sitokinin 6-benzilaminopurin (5 mg/L) ve oksin 1-naftalinasetik asit (8 mg/L) içeren rejenerasyon ortamı, her iki türde de başarılı bir şekilde sürgün oluşumunu ortaya çıkarır. Protokol, ilgilenilen bir transgen taşıyan ve Ri plazmidinden T-DNA içermeyen bitkiler elde etmek için rejenerantların ve T1 bitkilerinin genotiplenmesini ve seçimini kapsar. Kompozit bir tesisin oluşumuna yol açan alternatif bir süreç de tasvir edilmiştir. Bu durumda, tüylü kökler sürgünde tutulur (doğal kökler yerine), bu da tüylü kök kültürlerinde bir transgenin tüm bitki bağlamında incelenmesini sağlar.
Giriş
Bitki dönüşümü, bitki biyolojisindeki herhangi bir genetik çalışmanın darboğazıdır. Toprak kaynaklı bir bakteri olan Agrobacterium tumefaciens, transformantlar üretmek için çiçek daldırma veya doku kültürü yoluyla gen iletimi için bir araç olarak yaygın olarak kullanılmaktadır. A. tumefaciens, bir yaralama bölgesindeki bitkileri enfekte eder ve T-DNA'nın bir Tümör indükleyici (Ti) plazmidden konakçı bitki genomuna aktarılması ve entegrasyonu nedeniyle tümörlere neden olur. Yabani tip T-DNA içermeyen modifiye Ti plazmidli tasarlanmış A. tumefaciens suşları ve ilgilenilen bir geni eklemek için yapay T-DNA ve klonlama bölgelerine sahip bir ikili vektör, verimli bir bitki dönüşüm sistemi olarak yaygın olarak kullanılır1. Bununla birlikte, birçok model tür ve mahsul, çiçek daldırmasına veya in vitro bitki rejenerasyonuna karşı inatçıdır veya bu dönüşüm sisteminin verimliliğini etkileyen uzun büyüme döngülerine sahiptir.
Agrobacterium rhizogenes, bir konakçı bitkiyi enfekte ettikten sonra yaralama bölgesinde maceracı köklerin veya tüylü köklerin oluşumunu indükler. A. tumefaciens'e benzer şekilde, A. rhizogenes, bir T-DNA'sını Kök indükleyici (Ri) bir plazmitten konakçı bitki genomuna aktararak transgenik tüylü köklerin gelişmesine neden olur. Bu süreç esas olarak kök onkojenik lokus (rol) genleri 2,3 tarafından kontrol edilir. Hem Ri plazmidini hem de ilgilenilen bir geni kodlayan yapay bir ikili vektörü taşıyan agrobakteriyel suşlar kullanılarak, rekombinant proteinler üretmek, promotörlerin veya genlerin işlevini analiz etmek veya Kümelenmiş Düzenli Aralıklı Kısa Palindromik Tekrarlar (CRISPR'ler)/CRISPR ile ilişkili protein 9 (Cas9)4,5,6.
Protokolümüz, Ri plazmidi pRiA4b7'yi taşıyan transkonjugan Ti-less A. tumefaciens C58C1 suşunu kullanır. Ri plazmidinin T-DNA'sı, bitki genomuna bağımsız olarak entegre olabilen sağ ve sol T-DNA (SIRASIYLA TR-DNA ve TL-DNA) olmak üzere iki bölgeden oluşur8. Bu sistemden yararlanılarak, Brassica napus DH12075 çeşidindeki uzun eksplant dönüşüm süreci optimize edildi9. Aşağıda ayrıntıları verilen protokol, seçilen tüylü kök hatlarının yenilenmesine ve ilgilenilen transgeni taşıyan ve rol genlerinden arınmış T1 bitkilerinin yaklaşık 1 yıl içinde elde edilmesine izin verir. Enjeksiyon bazlı tüylü kök dönüşümü, Arabidopsis thaliana Col-0'ın dönüştürülmesiyle gösterildiği gibi diğer Brassicaceae türlerinde kullanılabilir. Hipokotil, B. napus'u dönüştürmek için kullanılırken, A. thaliana birincil çiçeklenme gövdesine enjekte edilir.
Protokol
1. Ortam ve çözümlerin hazırlanması
- Hormon stok çözeltilerini hazırlayın.
- 5 mg / mL konsantrasyonda 50 mL 1-naftalinasetik asit (NAA), 6-benzilaminopurin (BAP) ve indol-3-bütirik asit (IBA) stok çözeltisinin hazırlanması için, 250 mg toz hormonu 2 mL 1 M sodyum hidroksit (NaOH) içinde çözün ve hacmi ultra saf su ile 50 mL'ye ayarlayın.
- 1 mg / mL konsantrasyonda 50 mL gibberellik asit (GA3) hazırlamak için, 50 mg toz hormonu 2 mL etanol içinde çözün ve hacmi 50 mL ultra saf suya ayarlayın.
- Çözeltiyi 0.22 μm gözenek boyutuna sahip steril bir şırınga filtresi kullanarak filtreleyin ve saklama için steril 2 mL'lik tüplere dağıtın. Çözeltiyi üreticinin tavsiyesine bağlı olarak -20 °C veya 4 °C'de saklayın.
- Antibiyotik stok çözeltileri hazırlayın. 100 mg/mL konsantrasyonlu 50 mL sefotaksim ve tikarkilin disodyum stok çözeltisi için, 0.5 g toz antibiyotiği 40 mL ultra saf suda çözün ve 50 mL'lik bir nihai hacme ayarlayın. Çözeltiyi 0.22 μm gözenek boyutuna sahip steril bir şırınga filtresi kullanarak filtreleyin ve saklama için steril 2 mL'lik tüplere dağıtın. Çözeltiyi -20 °C'de saklayın.
NOT: Antibiyotikler ve hormonlar her zaman soğutulmuş ortama eklenir. - 1 L'lik bir ölçüm silindirine 10 g bakto-tripton, 5 g maya özü ve 5 g sodyum klorür (NaCl) ekleyerek 1 L Luria Suyu (LB) ortamı hazırlayın ve hacmi çift damıtılmış su ile 1 L'ye ayarlayın. Bir pH metre ile KOH ile pH'ı 7.0'a ayarlayın (üreticinin talimatlarını izleyerek). Çözeltiyi 1 L'lik bir şişeye aktarın ve katı bir ortam hazırlanırsa 15 g bakteriyolojik agar (% 1.5) ekleyin ve ortamı otoklavlayın. Gerekirse, soğutulmuş ortama uygun antibiyotikleri (ikili vektör üzerinde bakteri direnci taşınır) ekleyin.
NOT: Solüsyonu sterilize etmek için bir otoklav kullanın. Şişeyi sepete koyun, kapağı kapatın ve 121 °C ve 98,9 kPa'da 20 dakika sterilize edin. Bu protokol her zaman sonraki adımlarda çözümleri otoklavlamak için kullanılır. - 5 g sığır eti özü, 1 g maya özü, 5 g pepton, 5 g sakaroz ve 0.5 g magnezyum klorürü (MgCl2) çift damıtılmış suya karıştırarak 1 L Maya Özü Sığır Eti (YEB) ortamı hazırlayın. Hacmi 1 L'ye ayarlayın Çözeltiyi 1 L'lik bir şişeye aktarın. Ortamı otoklavlayın.
- 2.2 g Murashige ve Skoog (MS) tozu, 10 g sükroz (% 1) ve 0.5 g 2- (N-Morfolino) etansülfonik asit (MES) sodyum tuzlarını çift damıtılmış suya karıştırarak tohum çimlenmesi için 1 L ortam hazırlayın. Hacmi 1 L'ye ayarlayın, karıştırın ve pH'ı KOH ile 5.8'e ayarlayın. Çözeltiyi 1 L'lik bir şişeye aktarın ve 8 g bitki agar (% 0.8) ekleyin. Ortamı otoklavlayın.
- 2.2 g MS tozu, 5 g sükroz (% 0.5) ve 0.5 g MES tuzunu çift damıtılmış suya karıştırarak 1 L bitki büyüme ortamı hazırlayın. Hacmi 1 L'ye ayarlayın, karıştırın ve pH'ı KOH ile 5.8'e ayarlayın. Çözeltiyi 1 L'lik bir şişeye aktarın ve 8 g bitki agar (% 0.8) ekleyin. Ortamı otoklavlayın.
- 4.4 g MS + B5 vitamin tozu, 30 g sükroz (% 3) ve 0.5 g MES tuzunu çift damıtılmış suya karıştırarak 1 L tüylü kök büyüme ortamı hazırlayın. Hacmi 1 L'ye ayarlayın, karıştırın ve pH'ı KOH ile 5.8'e ayarlayın ve çözeltiyi 1 L'lik bir şişeye aktarın. 3 g jelleştirici ajan (% 0.3) ekleyin ve ortamı otoklavlayın. Sırasıyla 100 - 200 mg / L ve 100 - 500 mg / L'lik bir nihai konsantrasyona sefotaksim ve tikarkilin disodyum ekleyin. Gerekirse, uygun antibiyotikleri ekleyin (direnç, bir ikili vektörün T-DNA'sından kaynaklanır).
- 2.2 g MS + B5 vitamin tozu, 10 g sükroz (% 1) ve 0.5 g MES tuzunu çift damıtılmış suya karıştırarak 1 L kompozit bitki büyüme ortamı hazırlayın. Hacmi 1 L'ye ayarlayın, karıştırın ve pH'ı KOH ile 5.8'e ayarlayın ve çözeltiyi 1 L'lik bir şişeye aktarın. 6 g jelleştirici ajan (% 0.6) ekleyin ve ortamı otoklavlayın. Sırasıyla 200 mg / L ve 500 mg / L'lik bir nihai konsantrasyona sefotaksim ve tikarkilin disodyum ekleyin. Gerekirse, uygun antibiyotikleri ekleyin (direnç, bir ikili vektörün T-DNA'sından kaynaklanır).
- 4.4 g MS + B5 vitamin tozu, 30 g sükroz (% 3) ve 0.5 g MES tuzunu çift damıtılmış suya karıştırarak 1 L rejenerasyon ortamı hazırlayın. Hacmi 1 L'ye ayarlayın, karıştırın ve pH'ı KOH ile 5.8'e ayarlayın. Çözeltiyi 1 L'lik bir şişeye aktarın ve 3 g jelleştirici madde (% 0.3) ekleyin. Ortamı otoklavlayın. Sırasıyla 8 mg / L ve 5 mg / L'lik bir nihai konsantrasyona NAA ve BAP ve 100 mg / L'lik bir nihai konsantrasyona tikarkilin disodyum ekleyin.
- 4.4 g MS + B5 vitamin tozu, 20 g sükroz (% 2) ve 0.5 g MES tuzlarını çift damıtılmış suya karıştırarak 1 L sürgün uzama ortamı hazırlayın. Hacmi 1 L'ye ayarlayın, karıştırın ve pH'ı KOH ile 5.8'e ayarlayın. Çözeltiyi 1 L'lik bir şişeye aktarın ve 3 g bitki agar (% 0.3) ekleyin. Ortamı otoklavlayın. BAP veGA3'ü sırasıyla 0.5 mg / L ve 0.03 mg / L'lik bir nihai konsantrasyona ve 100 mg / L'lik bir nihai konsantrasyona sefotaksim ekleyin.
- 2.2 g MS + B5 vitamin tozu, 10 g sükroz (% 1) ve 0.5 g MES tuzunu çift damıtılmış suya karıştırarak 1 L kök indüksiyon ortamı hazırlayın. Hacmi 1 L'ye ayarlayın, karıştırın ve pH'ı KOH ile 5.8'e ayarlayın. Çözeltiyi 1 L'lik bir şişeye aktarın ve 3 g jelleştirici madde (% 0.3) ekleyin. Ortamı otoklavlayın. Sırasıyla 0.5 mg / L ve 100 mg / L'lik bir nihai konsantrasyona IBA ve sefotaksim ekleyin.
- 20 g CTAB (% 2 w / v final), 100 mL 1M Tris-HCl, pH 8.0 (100 mM final), 40 mL 0.5 M EDTA, pH 8.0 (20 mM final), 81.8 g NaCl (1.4 M final) ve 5 g PVP40 (% 0.5 w / v final). Çift damıtılmış su ile 1 L'ye ayarlayın. Çözeltiyi otoklavlayın. Çözeltiyi oda sıcaklığında 1 yıla kadar saklayın.
2. Agrobacterium'un ikili vektör ile dönüşümü
- Bitki genomuna entegre edilecek T-DNA kasetini içeren doğrulanmış bir ikili plazmidin DNA'sını hazırlayın. Elektroporasyon kullanılırken elektrik kıvılcımlarını önlemek için plazmit DNA'nın düşük tuzlar içerdiğinden emin olun. Tercih edilen bir plazmit DNA ekstraksiyon kitinin kullanılması önerilir.
- 200 mL sıvı önceden ısıtılmış (28 °C) YEB'yi 8 mL taze gece kültürü ile aşılayarak tüylü kök indükleyen plazmid pRiA4b içeren elektroyetkin Agrobacterium tumefaciens C58C1 hücrelerini hazırlayın. 600 nm'de (OD600) optik yoğunluk orta log fazına karşılık gelen yaklaşık 0,5 olana kadar çalkalarken kültürü 28 °C'de inkübe edin. Yaklaşık 4 - 5 saat sürer.
- Agrobacterium kültürünü dört adet önceden soğutulmuş steril 50 mL santrifüj tüpüne bölün. 3.200 x g'da 4 °C'de 15 dakika santrifüjleyin.
NOT: Hücreler bu adımdan itibaren soğuk tutulmalıdır. - Süpernatanı çıkarın ve peleti (4x) 2.5 mL soğuk (4 °C)% 10 gliserol içinde hafifçe yeniden süspanse edin. 47.5 mL daha soğuk% 10 gliserol ekleyin ve hafifçe karıştırın.
- 4 ° C'de 15 dakika boyunca 3.200 x g'da pelet hücreleri. Süpernatanı atın ve hücreleri (4x) 10 mL soğuk% 10 gliserol içinde yeniden süspanse edin.
- Hücreleri tekrar pelet haline getirin ve (4x) 0.75 mL soğuk% 10 gliserol içinde yeniden süspanse edin. Dört tüpün içeriğini bir araya getirin (toplam hacim = 3 mL).
- Agrobakteriyel çözeltiyi önceden soğutulmuş steril 1.5 mL mikrotüplerde 50 μL'lik alikotlara bölün. Alikotları kuru buz veya sıvı nitrojen üzerinde dondurun. Tüpleri ileride kullanmak üzere -80 °C'de saklayın.
- Bir tüp yetkin hücre (50 μL) buzun üzerine yerleştirin, 5 μL plazmit DNA (adım 2.1'den itibaren toplam 1 μg) ile karıştırın, karışımı bir elektroporasyon küvetine (0,2 cm boşluk) aktarın ve buz üzerinde 5 dakika inkübe edin.
- Küveti elektroporatöre yerleştirin ve hücreleri aşağıdaki ayarlarla elektroporatöre bağlayın: kapasitans 25 μFD, direnç 400 Ω, elektrik voltajı 2,5 kV, darbe süresi 9,7 ms.
- Hücrelere 950 μL LB sıvı ortam ekleyin, bunlar daha sonra bir termomikserde 300 rpm'de 2 saat boyunca 28 ° C'de kültürlenir. Hücre kültürünün 50 μL'sini uygun seçici antibiyotik ile katı bir LB ortamına yerleştirin. Plakaları 28 °C'de 2 gün boyunca kültürleyin.
NOT: Uygun bir kültür hacmini belirlemek ve bakterilerin aşırı üremesini önlemek için plaka başına bir dizi hücre kültürünün (10 μL - 100 μL) kaplanması önerilir. - Antibiyotikli 5 mL LB sıvı ortamda seçilen birkaç koloniden sıvı kültürler hazırlayın. Bakterileri gece boyunca 28 °C'de çalkalayarak büyütün. Bu kültürleri, 0.5 mL sıvı bakteri kültürü ve 0.5 mL %40 gliserol karıştırarak gliserol stokları için kullanın.
NOT: Bu koloniler, koloni PCR ile transgenin varlığı için doğrulanır. Bu amaçla, bir ikili vektörden T-DNA'nın bir kısmını çoğaltan primerlerle birlikte, tercih edilen tampon, dNTP ve Taq polimeraz içeren PCR ana karışımına bir plakadan az miktarda koloni ekleyin. Bitkilerin dönüşümü için gliserol stoklarından elde edilen aşı kullanılır.
3. Brassica napus'un tüylü kök dönüşümü DH12075
- Brassica napus DH12075 tohumlarını mikrotüplere koyun ve bir akış kutusunda sterilize edin. İlk olarak, 60 saniye çalkalarken su ve% 0,1 deterjan kullanarak tohumları yağdan arındırın. Daha sonra tohumları suyla ve ardından %70 etanol ile her ikisi de 60 saniye durulayın.
- Tohumları, sodyum hipoklorit içeren% 10'luk bir ticari ağartıcı çözeltisi kullanarak sterilize edin. Tohumları bu solüsyonda 20 dakika çalkalayın.
- Tohumları 4x steril suyla her biri 60 saniye yıkayın. Bunları tohum çimlenme ortamını içeren Petri kaplarına yerleştirin. Tohumları gece boyunca 4 °C'de soğuk tabakalandırın ve plakaları bir yetiştirme odasına (21 °C, 16 saat aydınlık / 8 saat koyu) taşıyın.
- 5 günlük fideleri, bitki büyüme ortamı içeren bitki kültürü kutularına aktarın.
NOT: DH12075'deki en iyi dönüşüm verimliliği 18 günlük fidanlarda tespit edilmiştir. Fide yaşı, yerel büyüme koşulları veya diğer çeşitler için optimize edilebilir. - Tüylü, kök indükleyen bir plazmid pRiA4b ve dönüşüm için ikili vektör (adım 2.11'den itibaren) taşıyan sıvı bir Agrobacterium tumefaciens C58C1 kültürünü bir aşılama döngüsü ile aşılayın. 5 mL LB ortamı kullanın. Bu kültürü gece boyunca 28 °C'de OD600 = 0.9 - 1'e ulaşana kadar büyütün.
NOT: Yabani tip tüylü kökler üretiliyorsa sadece Ri plazmidi içeren agrobakteri kullanılır. - 18 günlük bir fidenin hipokotiline bir insülin şırıngası ile az miktarda kültür (yaklaşık 50 μL) enjekte edin (adım 3.4'ten itibaren). Hipokotili, ortam yüzeyinden yaklaşık 1 cm yükseklikte şırıngaya monte edilmiş 26G'lik bir iğne ile delin. Sıvıyı yaraya enjekte edin. Hipokotilin yüzeyindeki doku da şırınga tarafından çizilebilir.
NOT: Aşılanan fide sayısı, deneycinin ihtiyaçlarına göre uyarlanmalıdır. - Bitkileri, yara bölgesinde nasır ve tüylü kökler oluşana kadar 2 ila 4 hafta boyunca 21 °C'de yetiştirme odasına geri koyun.
- Hipokotilden çıkan tüylü köklerle birlikte nasırı kesin ve seçici antibiyotikler (T-DNA tarafından taşınır) ve sefotaksim (200 mg / L) ve tikarsilin (500 mg / L) içeren tüylü kök büyüme ortamı ile bir Petri kabına yerleştirin. Petri kaplarını gaz geçirgen bantla kapatın. Tüylü kökleri 24 °C'de karanlıkta kültürleyin.
NOT: Fonksiyonel seçim için kullanılan spesifik antibiyotiklerin uygun konsantrasyonu, vahşi tip tüylü köklerle test edilmelidir. Kanamisine direnç taşıyan B. napus DH12075 tüylü kökler için 25 mg/L kanamisin konsantrasyonu kullanılır.
NOT: Bu adımda, yabani tip sürgün ve bu bitkinin büyümesini destekleyen transgenik tüylü köklerden oluşan kompozit bir bitki oluşturmak mümkündür. Tüylü kökleri bir gövdeden kesmek yerine, bitkinin doğal kökleri çıkarılır. Ortaya çıkan tüylü köklere sahip bitki, agrobakteriyel büyümeyi baskılamak için sefotaksim (200 mg/L) ve tikarsilin (500 mg/L) ve seçici antibiyotik (T-DNA tarafından taşınır) içeren kompozit bir bitki büyüme ortamı içeren bir bitki kültürü kutusuna aktarılır. - 1-2 hafta sonra, Petri kabındaki tüylü kökleri nasırdan izole edin ve aynı kültür ortamına sahip plakalarda bireyselleştirin. Kültürü her 4 ila 5 haftada bir taze bir tabağa aktarın. Kök dallanmasını artırmak için 0,25 mg/L IBA ekleyin.
- Her transferde sefotaksim ve tikarisilin konsantrasyonlarını kademeli olarak 100 mg / L azaltın (yani, ilk transfer için ortam 100 mg / L sefotaksim ve 400 mg / L tikarisilin içerir; ikinci transfer için 300 mg / L tikarisilin, vb.). 3-4 ay sonra, tüylü kökleri 100 mg / L tikarisilin ve seçici antibiyotik ile tüylü bir kök büyüme ortamında kültürleyin.
4. Brassica napus'un tüylü kökler DH12075 yenilenmesi
- Bağımsız tüylü kök hatlarını, kullanmadan önce alevli cımbız kullanarak steril koşullarda rejenerasyon ortamı olan plakalara aktarın. Petri kabı başına 5 - 10 kök aktarın ve bunları uzun bir gün fotoperiyodunda (16 saat aydınlık / 8 saat karanlık) 21 ° C'de kültürleyin. Petri kaplarını gaz geçirgen bantla kapatın.
- Her 3 ila 4 haftada bir, tüylü kökleri taze rejenerasyon ortamı olan plakalara aktarın. Calli'lerin yaklaşık 2 hafta sonra oluştuğunu unutmayın. Nasır oluşumundan 2 hafta sonra 8-9 hafta sonrasına kadar kallus çekime başlar.
- Sürgünleri bireyselleştirin ve sürgünlerin uzamasını teşvik etmek için 2 ila 3 hafta boyunca sürgün uzama ortamı olan bitki kültürü kutularına aktarın.
- Uzatılmış sürgünleri, bir kök indüksiyon ortamı olan bitki kültürü kutularına aktarın. Kültürü her 3-4 haftada bir yenileyin. DH12075'de köklenme verimliliği 30 günde %87, 60 gün sonra %100'e kadardır.
- Mantar enfeksiyonunu önlemek için jelleştirici madde kalıntılarını giderdikten sonra köklü bitkileri toprağa aktarın. Bitkilerin önce fitotronlara alıştığından emin olun (21 °C, uzun gün fotoperiyot, 150 μE) ve ardından çiçeklenme için bir seraya aktarın (21 °C / 18 °C, uzun gün fotoperiyot, 150 μE).
5. Rejenerant ve T1 bitki seçimi
NOT: Saçlı kök çizgileri rejenerasyon sürecine girmeden önce seçilebilir. Seçim türü, transgen tarafından taşınan içeriğe bağlıdır. Tüylü kökler, DNA ekstraksiyonu ve genotipleme veya mutasyon tespiti için örneklenebilir, müteakip cDNA sentezi ile RNA ekstraksiyonu ve tercih edilen genin ekspresyon seviyesi analizi için RT-qPCR, floresan tespiti için mikroskopi veya GUS boyama için tedavi edilebilir.
- Toprağa aktarıldıktan sonra, seçim prosedürlerinden kaçışları önlemek için T0 rejenerant bitkileri (ve T1 fidelerini) tekrar genotipleyin. T0 bitkileri, Ri fenotip adı verilen değiştirilmiş bir fenotip sergiler: bitki genomuna eklenen Ri plazmidinin TL ve/veya TR-DNA'sının varlığından kaynaklanan geniş kök büyümesi, kıvırcık yapraklar ve cüce sürgünler.
- T1 seçimini hızlandırmak için, embriyo kurtarma için T0 rejenerant bitkilerden yeşil olgun embriyolar içeren tohumları (tozlaşmadan yaklaşık 21 - 28 gün sonra DH12075 bir torpido embriyosu veya daha eski için) kullanın.
- Steril akış kutusunda çalışın. Silisleri toplayın ve %70 etanol ile yüzeysel olarak sterilize edin.
- Bunları bir tabak kapağına veya bir sürgüye bantlanmış çift taraflı bir bant üzerine yerleştirin.
- Bir stereo dürbün kullanarak, 26G'lik bir iğne kullanarak siliği valf kenarları boyunca kesin. Kesimin tohumlara zarar vermediğinden emin olun. Kolay tutuş için iğneyi 1 mL'lik bir şırıngaya monte edin.
- Karpelleri açın ve banda yapıştırın. Olgunlaşmamış tohumları toplayın ve tohum çimlenmesi için orta dereceli plakalara aktarın. Plakaları gaz geçirgen bantla kapatın.
- Plakaları çimlenene kadar bir yetiştirme odasına (21 °C, 16 saat aydınlık / 8 saat karanlık) yerleştirin.
- İlgilenilen transgenin varlığı ve Ri TR/TL'nin yokluğu için T1 fidelerini genotipleyin (Şekil 1). Yaprak materyalini toplayın ve tercih ettiğiniz yöntemi kullanarak DNA'larını çıkarın. CTAB yöntemi burada açıklanmıştır:
- Yaprak malzemesini iki seramik boncuk içeren 2 mL'lik bir mikrotüpe toplayın. Tüpü sıvı nitrojen içinde dondurun.
- Malzemeyi bir bilyalı değirmen kullanarak öğütün. Alternatif olarak, havan tokmağı ve harç kullanılabilir.
- Hızlı bir sıkma işleminden sonra, toza 400 μL CTAB tamponu ekleyin. Kısa bir süre girdap yapın, döndürün ve 60 °C'de en az 50 dakika inkübe edin.
- Çözeltiyi 15 dakika oda sıcaklığına soğutun. Bir hacim kloroform ekleyin ve hafifçe karıştırın.
DİKKAT: Kloroform kullanırken, kimyasal akış altında çalışın ve koruma için eldiven kullanın. Kloroform içeren herhangi bir çözelti uygun çöp kutusuna atılmalıdır. - Bir masa üstü santrifüj kullanarak 18.400 x g'da 5 dakika santrifüjleyin. Üst sulu fazın 250 - 350 μL'sini yeni bir mikrotüpe aktarın. İnterfazı atlayın.
- Bir hacim izopropanol ekleyin, iyice karıştırın ve oda sıcaklığında 5 dakika inkübe edin. 18.400 x g'da 40 dakika santrifüjleyin.
- Sıvıyı atın ve 200 μL% 70 etanol ekleyin. Peleti yıkayın ve 18.400 x g'da 15 dakika santrifüjleyin.
- Sıvıyı atın. Peleti havayla kurutun ve 50 - 100 μL ultra saf su ekleyin. DNA'nın buzdolabında 1 saat ila bir gece çözünmesine izin verin.
- rolA geni (TL), aux1 geni (TR) ve virC lokusu (Agrobacterium) için PCR ile bir genotipleme gerçekleştirin. Hazırlanan DNA'yı (adım 5.3'ten itibaren), primerleri, tamponu, dNTP'yi ve Taq polimerazı üreticinin protokolüne göre kullanarak PCR reaksiyonunu hazırlayın. Güçlendirilmiş parçalar 200 - 500 bp uzunluğundadır.
rolA'ya özel primerler:
İleri: GTTAGGCGTGCAAAGGCCAAG
Ters: TGCGTATTAATCCCGTAGGTC
aux1'e özel astarlar:
Forvet: CATAGGATCGCCTCACAGGT
Ters: CGTTGCTTGATGTCAGGAGA
virC'ye özgü primerler:
İleri: AATGCGTCTCTCTCGTGCAT
Ters: AAACCGACCACTAACGCGAT
NOT: T-DNA transferi ve entegrasyonu kısmi olabilir ve sadece TL ve/veya TR'nin bazı kısımları genoma entegre olabilir. Bu nedenle, T1 fidelerinde TL'nin diğer ORF'lerinin (örneğin, rolB ve rolC) ve TR'nin (aux2, mas1, ags1) varlığının analiz edilmesi önerilir. Bu lokuslara özgü primer diziler Jedličková ve ark.9'da listelenmiştir. - Jel elektroforezi ile PCR reaksiyonlarını değerlendirin.
NOT: PCR dereceli DNA'ya sahip olduğunuzdan emin olmak için bu analize pozitif bir kontrolün dahil edilmesi önerilir. - Bu transgenin içeriğine dayalı protokollere göre transgenin varlığını (veya yokluğunu) seçin.
- Seçilen fideleri toprağa aktarın.
6. Arabidopsis thaliana Col-0'da tüylü kök dönüşümü ve rejenerasyonu
- A. thaliana tohumlarını tercih edilen bir yöntemle (ağartıcı, etanol veya klor gazı) yüzey sterilize edin.
- Tohum çimlenmesi için steril tohumları bir ortama koyun. 2 günlük soğuk tabakalaşmadan sonra, plakaları bir yetiştirme odasına taşıyın (uzun gün fotoperiyodu ve% 50 nem ile 21 ° C).
- 1 haftalık fideleri bitki yetiştirme ortamı olan bir bitki kültürü kutusuna aktarın.
- Agrobacterium kültürlerini adım 3.5'te belirtildiği gibi hazırlayın.
- 1 aylık Arabidopsis bitkiciklerinin birincil çiçeklenme sapının tabanına (rozetin yaklaşık 1-2 cm yukarısında) bir insülin şırıngasına monte edilmiş bir iğne ile az miktarda kültür (yaklaşık 50 μL) enjekte edin. Birincil sapın yüzeyindeki doku da şırınga tarafından çizilebilir.
- Enjeksiyondan 2-4 hafta sonra, ortaya çıkan tüylü kökleri eksize edin ve seçici antibiyotik (T-DNA tarafından taşınır) ve sefotaksim (200 mg / L) ve tikarsilin (500 mg / L) ile desteklenmiş tüylü kök büyüme ortamı ile Petri kaplarında yetiştirin agrobakteriyel büyümeyi baskılamak için. Plakaları karanlıkta 24 °C'de inkübe edin.
- 1-2 hafta sonra, tüylü kökleri aynı kültür ortamına sahip plakalarda bireyselleştirin. Seçilen tüylü kök çizgilerini her 4 - 5 haftada bir taze bir ortama aktarın.
NOT: A. thaliana tüylü kökleri B. napus'unkinden daha incedir ve taze besiyerine aktarırken dikkatli olunmalıdır. - Nasır oluşumunu indüklemek için tüylü kökleri rejenerasyon ortamı olan plakalara aktarın. Plakaları 21 °C'de uzun bir gün fotoperiyodunda (16 saat aydınlık / 8 saat karanlık) kültürleyin.
- Sürgünler 18-21 günlük ekimden sonra nasırdan çıkar. Sürgünleri kesin ve büyümeyi ve uzamayı teşvik etmek için 2-3 hafta boyunca bir sürgün uzama ortamına aktarın.
- Uzatılmış sürgünleri kök indüksiyon ortamına aktarın.
- Köklenen bitkileri toprağa aktarın. T0 bitkileri ayrıca bir Ri fenotipi sunar. B. napus DH12075 için tarif edildiği gibi transgenik seçimi gerçekleştirin (adım 5).
Sonuçlar
Daha önce Brassica napus'un üç çeşidinde, yani DH12075, Topas DH4079 ve Westar9'da enjeksiyon bazlı tüylü kök indüksiyonu için bir protokolü optimize etmiştik. Bu dönüşüm protokolünü model tür A. thaliana'ya uygulamak için, 1 aylık bitkiciklerin birincil çiçeklenme saplarına bir agrobakteriyel aşı enjekte edildi. Saçlı kökler 2-4 hafta sonra enjeksiyon bölgesinde ortaya çıktı. Tüylü kökler eksize edildi ve katı ortamda eksize edildi. Yöntemin bu iki türdeki karşılaştırması Şekil 1'de gösterilmiştir.
Seçilen tüylü kök hatları, sürgün oluşumunu indüklemek için rejenerasyon ortamına aktarıldı. A. thaliana'da, test edilen 10 tüylü kök hattının hepsinde 14 gün içinde sarı calli indüklendi. Rejenerasyon ortamına aktarıldıktan sonraki 3 hafta içinde koyu yeşil lekeler olarak görülebilen ilk sürgün primordia ortaya çıkmıştır (Şekil 2). 4 haftalık kültürden sonra, sürgünler 10 tüylü kök hattının 9'unda (% 90 rejenerasyon verimi) tüylü kökleri kapladı. Bazı durumlarda, nasırdan adventif kökler ortaya çıkmıştır (Şekil 2H). Rejenerasyon besiyerinde 3 ay geçmesine rağmen bir hat yenilenmedi (her 4 haftada bir tüylü kökler taze bir besiyerine aktarıldı). Bu nedenle, A. thaliana tüylü köklerin rejenerasyon etkinliği, B. napus DH120759'un etkinliğine benzer.
B. napus ve A. thaliana'nın tüylü kök rejenerantları, tüylü kök kaynaklı bitkilerin tipik bir özelliği olan bir cüce fenotipi sergiler (Şekil 3)2. Ayrıca yoğun kök sistemleri, buruşuk yapraklar ve çiçeklenme zamanındaki değişiklikleri gözlemledik. Bu sözde tüylü kök (veya Ri) fenotipi, bitki genomuna eklenen Ri plazmidinden gelen rol genlerinden kaynaklanır. Ri T-DNA'nın ve bir ikili vektör üzerinde kodlanan transgenin eklenmesi bağımsız veya bağlantılı olabilir. Bu nedenle, kendi kendine tozlaşma ile oluşturulan T1 dölünün bir ayrışma analizi, ilgilenilen transgeni ifade eden rolsüz bitkilerin belirlenmesine yardımcı olur. T1 bitkilerinin genotiplemesi, TL ve TR'nin ORF'lerine ve ilgilenilen transgene özgü PCR primerleri ile gerçekleştirilir. Agrobakteriyel kontaminasyonun yokluğu, virC primerlerinin PCR ürünlerinin yokluğu ile doğrulanır (Şekil 1).
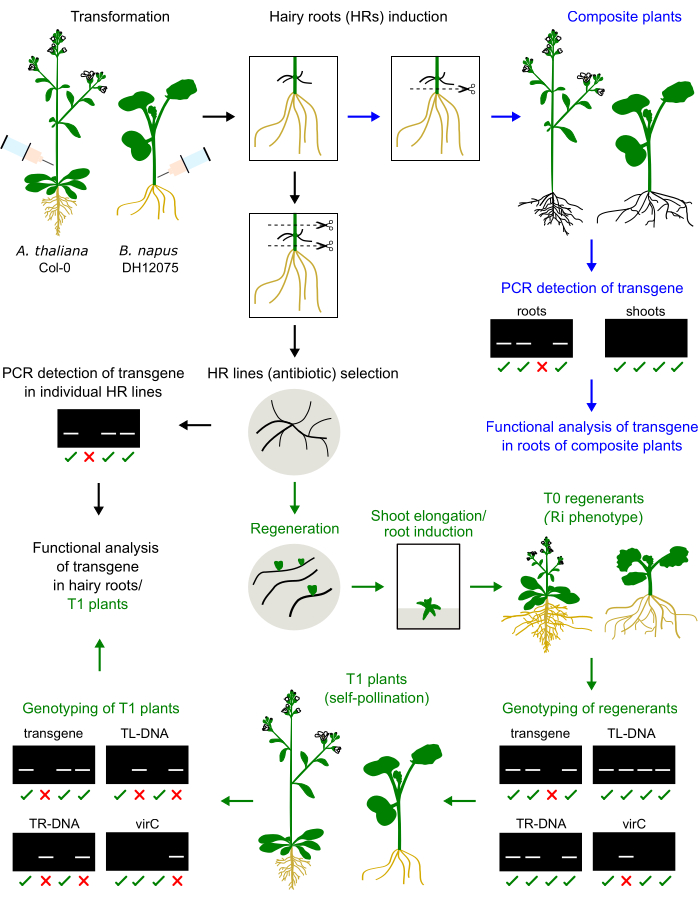
Şekil 1: A. thaliana ve B. napus'taki prosedürün özeti. Agrobacterium inokulumunun hipokotil veya birincil çiçeklenme gövdesine enjeksiyonu, tüylü köklerin gelişimini indükler. Tüylü kökler, genotiplenecek ve analiz edilecek kompozit bir bitki oluşturmak için doğal köklerin yerini alabilir (mavi oklar). Kültürlenmiş tüylü kökler T0 bitkilerine dönüştürülebilir, T1 bitkilerinde çoğaltılabilir ve genotiplenebilir (yeşil oklar). Tüylü kökler ayrıca fonksiyonel analiz için alt kültüre alınabilir (siyah ok). Genotipleme sonuçlarına örnekler sunulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
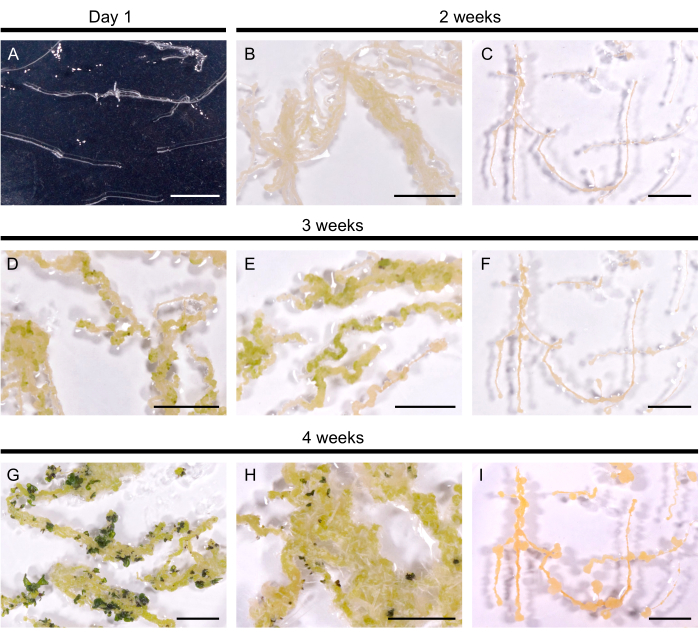
Şekil 2: A. thaliana'da tüylü köklerin yenilenmesi. (A) Tüylü kök kültürü plakalara aktarıldıktan 1 gün sonra. (B, C) Çallı, rejenerasyon ortamında kültürden 2 hafta sonra gelişti. (D, E) Shoot primordia 3 haftalık kültürden sonra ortaya çıktı. (G, H) Sürgünler 4 hafta sonra oluşur. (H) Nasırdan gelişen maceracı kökler. (C, F, I) Yenileyici olmayan tüylü kök çizgisi. Ölçek çubukları 1 cm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: B. napus ve A. thaliana yabani tip bitkilerin ve tüylü kök kaynaklı rejenerantların (T0 bitkileri) temsili fotoğrafları. Rejenerantların Ri fenotipine dikkat edin. Ölçek çubukları 2 cm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
B. napus ve A. thaliana'da tüylü kök transformasyonu ve ardından rejenerasyon için basit bir protokol geliştirdik. Bu işlem, hipokotil (B. napus) veya birincil çiçeklenme sapında (A. thaliana) enjeksiyon bazlı tüylü kök indüksiyonunu içerir. Bu çalışmada sunulan Brassicaceae üyelerinin yanı sıra, hipokotilin bir Ri plazmidi taşıyan agrobakteriyel suşu C58C1 ile enjekte edilmesi yöntemi, Fabaceae familyasında10,11 de etkili olmuştur.
Enjeksiyon bazlı yönteme bir alternatif, eksplantın bir bakteri süspansiyonuna daldırılmasından ve ardından eksplantın agrobakterilerle birlikte yetiştirilmesinden oluşan daldırma bazlı dönüşümdür. Enjeksiyon bazlı yöntemin daldırma yöntemine göre avantajı, bazı protokol adımlarının yokluğundan tasarruf edilen zamandır: eksplant hazırlama, birlikte yetiştirme süresinin bir testi ve tüylü köklerin indüksiyonu için hormon içeren bir ortam üzerinde kültür. Her iki yaklaşım da tüylü kök indüksiyonu için etkili olmakla birlikte, enjeksiyon bazlı yöntemle bazı türlerde eksplant daldırmaya göre daha yüksek transformasyon etkinliği gözlenmiştir12,13. Ayrıca, enjeksiyona dayalı dönüşüm, kompozit bitkiler (transgenik tüylü kökler ve yabani tip sürgünler) üretmek için de yararlıdır. Dönüştürülen bitkinin orijinal kökleri kesildikten sonra, tüylü kökler bitki büyümesini destekler ve transgen tüm bitki bağlamında incelenebilir.
Tüylü kök indüksiyonunun kritik adımı, inokulumun hipokotil veya birincil çiçeklenme sapına enjekte edilmesidir. B. napus'un hipokotilleri kırılabilir ve tüm hipokotilin kesilmesi kolayca gerçekleşebilir. Aynısı, çiçeklenme sapı inceliği nedeniyle A. thaliana ile de gözlemlenebilir. Farklı türlerin/çeşitlerin dönüşüm verimliliğinin karşılaştırılması gerekiyorsa, bitkileri enjekte etmede manipülasyon ve becerinin neden olduğu hatayı önlemek için tüm deneyleri bir kişinin yapmasını öneririz.
B. napus DH12075 ve A. thaliana Col-0'da tüylü kök rejenerasyonu için etkili bir protokol geliştirdik. Rejenerasyon oldukça değişken bir süreç olduğundan, tercih edilen bir türe veya çeşide bazı protokol değişiklikleri uygulanabilir. Örneğin, tüylü kök kaynaklı sürgünler, B. oleracea14'te farklı bir oksin/sitokinin oranı (1:1) ile ortaya çıkarılabilir. Alternatif olarak, B. campestris tüylü köklerdeolduğu gibi BAP yerine sitokinin tidiazuron kullanılabilir 15.
Ri plazmid T-DNA'nın bitki genomuna çoklu eklenmesi, tüylü kök transformasyonu ve rejenerasyon sisteminin potansiyel bir sınırlamasını temsil eder. Bu gibi durumlarda, T1 fidelerinin segregasyon analizinden sonra Ri plazmidinden TL/TR içermeyen hiçbir bitki ortaya çıkarılmaz. Bu nedenle, her transgen için birkaç bağımsız tüylü kök hattı oluşturmanızı öneririz.
Tüylü kök kültürleri, hızlı kurulumları ve ucuz bakımları nedeniyle (yetiştirme ortamında hormon gerekmez) gen fonksiyonel çalışmaları için son derece güçlü bir araçtır. Bu protokol, B. napus ve A. thaliana'da tüylü kök indüksiyonu ve rejenerasyonu için yöntemleri kapsar ve bu, ilgilenilen transgeni doğrudan tüylü kök kültürlerinde, kompozit bitkiler kullanılarak tüm bitki bağlamında veya transgenik bitkilerin rejenerasyonundan sonra incelemek için kullanılabilir.
Açıklamalar
Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişki olmaksızın yürütüldüğünü beyan ederler.
Teşekkürler
Jiří Macas'a (Biyoloji Merkezi CAS, České Budějovice, Çek Cumhuriyeti) agrobakteriyel suşu sağladığı için teşekkür ederiz. CEITEC MU'nun Çekirdek Tesis Bitki Bilimleri, teknik desteği için kabul edilmektedir. Bu çalışma, Çek Cumhuriyeti Eğitim, Gençlik ve Spor Bakanlığı tarafından Avrupa Bölgesel Kalkınma Fonu-Projesi "SINGING PLANT" ile desteklenmiştir. CZ.02.1.01/0.0/0.0/16_026/0008446) ve INTER-COST projesi LTC20004.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
Referanslar
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır