Method Article
טרנספורמציה והתחדשות של שורשים שעירים ב-Arabidopsis thaliana וב-Brassica napus
In This Article
Summary
הפרוטוקול מתאר השראת שורשים שעירים באמצעות גבעולי תפרחת ראשוניים Arabidopsis והיפוקוטיל Brassica napus . ניתן לגדל את השורשים השעירים ולהשתמש בהם כצמחים להתחדשות צמחים טרנסגניים.
Abstract
טרנספורמציית שורשים שעירים מהווה כלי רב-תכליתי לביוטכנולוגיה של צמחים במינים שונים. זיהום על ידי זן אגרובקטריום הנושא פלסמיד השראת שורש (Ri) גורם להיווצרות שורשים שעירים באתר הפציעה לאחר העברת T-DNA מפלזמיד Ri לגנום הצמח. הפרוטוקול מתאר בפירוט את הליך השראת השורש השעיר מבוסס ההזרקה ב - Brassica napus DH12075 ו - Arabidopsis thaliana Col-0. השורשים השעירים עשויים לשמש לניתוח טרנסגן מעניין או מעובד ליצירת צמחים טרנסגניים. מדיום רגנרציה המכיל ציטוקינין 6-בנזילאמינופורין (5 מ"ג/ליטר) וחומצה אוקסין 1-נפתלנאצטית (8 מ"ג/ליטר) מעורר בהצלחה היווצרות נבטים בשני המינים. הפרוטוקול מכסה את הגנוטיפ והבחירה של רגנרנטים וצמחי T1 כדי להשיג צמחים הנושאים טרנסגן מעניין וללא T-DNA מפלסמיד Ri . מתואר גם תהליך חלופי המוביל להיווצרות צמח מרוכב. במקרה זה, שורשים שעירים נשמרים על הנבטה (במקום השורשים הטבעיים), מה שמאפשר לחקור טרנסגן בתרביות שורשים שעירים בהקשר של הצמח כולו.
Introduction
טרנספורמציה של צמחים היא צוואר הבקבוק של כל מחקר גנטי בביולוגיה של הצמח. חיידק הנישא בקרקע, Agrobacterium tumefaciens, נמצא בשימוש נרחב כאמצעי להעברת גנים על ידי טבילת פרחים או תרבית רקמות ליצירת טרנספורמנטים. A. tumefaciens מדביק צמחים באתר פציעה וגורם לגידולים עקב העברה ואינטגרציה של T-DNA מפלסמיד גורם גידול (Ti) לגנום הצמח המארח. זני A. tumefaciens מהונדסים עם פלסמיד Ti שונה ללא T-DNA מסוג פראי ווקטור בינארי עם T-DNA מלאכותי ואתרי שיבוט להחדרת גן מעניין משמשים בדרך כלל כמערכת טרנספורמציה יעילה של צמחים1. עם זאת, מינים וגידולי מודל רבים עקשנים לטבילה פרחונית או התחדשות צמחים במבחנה או שיש להם מחזורי צמיחה ארוכים, מה שמשפיע על היעילות של מערכת טרנספורמציה זו.
קנה שורש אגרובקטריום גורם להיווצרות שורשים הרפתקניים, או שורשים שעירים, באתר הפציעה לאחר הדבקת צמח פונדקאי. בדומה ל- A. tumefaciens, A. rhizogenes מעביר T-DNA מפלסמיד השראת שורש (Ri) לגנום הצמח המארח, וגורם להתפתחות שורשים שעירים טרנסגניים. תהליך זה נשלט בעיקר על ידי הגנים השורשיים האונקוגניים (rol) 2,3. באמצעות זנים אגרובקטריאליים הנושאים הן את פלסמיד Ri והן וקטור בינארי מלאכותי המקודד גן מעניין, תרביות שורש שעירות שימשו לייצור חלבונים רקומביננטיים, ניתוח תפקודם של מקדמים או גנים, או עריכת גנומים באמצעות Clustered Regular Interspaced Short Palindromic Repeats (CRISPR)/CRISPR-associated protein 9 (Cas9)4,5,6.
הפרוטוקול שלנו משתמש בזן טרנס-מצומד Ti-less A. tumefaciens C58C1 הנושא את פלסמיד Ri pRiA4b7. T-DNA של פלסמיד Ri מורכב משני אזורים, T-DNA ימין ושמאל (TR-DNA ו- TL-DNA, בהתאמה), שיכולים להשתלב באופן עצמאי בגנום הצמח8. תוך ניצול מערכת זו, תהליך הטרנספורמציה הארוך של explant ב-Brassica napus DH12075 cultivar עבר אופטימיזציה9. הפרוטוקול המפורט להלן מאפשר התחדשות של קווי שורשים שעירים נבחרים וקבלת צמחי T1 הנושאים את הטרנסגן המעניין וללא גנים של רול תוך כשנה. ניתן להשתמש בטרנספורמציית שורש שעיר מבוססת הזרקה במינים אחרים של Brassicaceae, כפי שמוצג על ידי שינוי Arabidopsis thaliana Col-0. בעוד hypocotyl משמש כדי להפוך B. napus, A. thaliana מוזרק לתוך גזע התפרחת הראשוני.
Protocol
1. הכנת מדיה ופתרונות
- הכינו את תמיסות מלאי ההורמונים.
- להכנת 50 מ"ל של חומצה 1-נפתלנאצטית (NAA), 6-בנזילאמינופורין (BAP) ותמיסת מלאי אינדול-3-חומצה בוטירית (IBA) בריכוז של 5 מ"ג/מ"ל, יש להמיס 250 מ"ג של אבקת ההורמון ב-2 מ"ל של 1 מ"ל נתרן הידרוקסידי (NaOH) ולהתאים את הנפח ל-50 מ"ל עם מים טהורים במיוחד.
- כדי להכין 50 מ"ל של חומצה gibberellic (GA3) עם ריכוז של 1 מ"ג / מ"ל, להמיס 50 מ"ג של הורמון אבקת ב 2 מ"ל של אתנול ולהתאים את נפח ל 50 מ"ל של מים טהורים במיוחד.
- סנן את התמיסה באמצעות מסנן מזרק סטרילי בגודל נקבוביות 0.22 מיקרומטר והפץ אותה לצינורות סטריליים של 2 מ"ל לאחסון. אחסנו את התמיסה בטמפרטורה של -20°C או 4°C, בהתאם להמלצת היצרן.
- הכינו תמיסות מלאי אנטיביוטיות. עבור 50 מ"ל של cefotaxime ו ticarcillin דיסודיום תמיסת מלאי עם ריכוז של 100 מ"ג / מ"ל, להמיס 0.5 גרם של אבקת אנטיביוטיקה ב 40 מ"ל של מים טהורים במיוחד ולהתאים נפח סופי של 50 מ"ל. סנן את התמיסה באמצעות מסנן מזרק סטרילי בגודל נקבוביות 0.22 מיקרומטר והפץ אותה לצינורות סטריליים של 2 מ"ל לאחסון. אחסנו את התמיסה בטמפרטורה של -20°C.
הערה: אנטיביוטיקה והורמונים מתווספים תמיד למדיום המקורר. - הכינו 1 ליטר של ציר לוריא (LB) בינוני על ידי הוספת 10 גרם של בקטו-טריפטון, 5 גרם של תמצית שמרים, ו 5 גרם של נתרן כלורי (NaCl) בגליל מדידה 1 L ולהתאים את נפח ל 1 L עם מים מזוקקים כפול. התאם את ה- pH ל- 7.0 עם KOH עם מד pH (בהתאם להוראות היצרן). מעבירים את התמיסה לבקבוק 1 ליטר ומוסיפים 15 גרם אגר בקטריולוגי (1.5%), אם מכינים מדיום מוצק ומבצעים אוטוקלאבים למדיום. במידת הצורך, הוסף את האנטיביוטיקה המתאימה (עמידות חיידקית נישאת על הווקטור הבינארי) למדיום המקורר.
הערה: השתמש autoclave כדי לעקר את הפתרון. הכניסו את הבקבוק לסלסלה, סגרו את המכסה ועקרו אותו למשך 20 דקות בטמפרטורה של 121°C ו-98.9 kPa. פרוטוקול זה משמש תמיד לפתרונות autoclaving בשלבים נוספים. - הכינו 1 ליטר של תמצית שמרים בשר בקר (YEB) בינוני על ידי ערבוב 5 גרם תמצית בקר, 1 גרם תמצית שמרים, 5 גרם פפטון, 5 גרם סוכרוז ו-0.5 גרם מגנזיום כלורי (MgCl2) למים מזוקקים כפול. כוונן את עוצמת הקול ל -1 ליטר. העבר את התמיסה לבקבוק 1 ליטר. Autoclave המדיום.
- הכינו 1 ליטר מדיום לנביטת זרעים על ידי ערבוב 2.2 גרם אבקת Murashige ו-Skoog (MS), 10 גרם סוכרוז (1%) ו-0.5 גרם מלחי נתרן 2-(N-Morpholino)ethanesulfonic acid (MES) למים מזוקקים כפול. כוונן את עוצמת הקול ל-1 ליטר, ערבב וכוונן את ה-pH ל-5.8 עם KOH. מעבירים את התמיסה לבקבוק 1 ליטר ומוסיפים 8 גרם אגר צמחי (0.8%). Autoclave המדיום.
- הכינו 1 ליטר של מדיום גידול צמחי על ידי ערבוב 2.2 גרם אבקת טרשת נפוצה, 5 גרם סוכרוז (0.5%) ו-0.5 גרם מלחי MES למים מזוקקים כפולים. כוונן את עוצמת הקול ל-1 ליטר, ערבב וכוונן את ה-pH ל-5.8 עם KOH. מעבירים את התמיסה לבקבוק 1 ליטר ומוסיפים 8 גרם אגר צמחי (0.8%). Autoclave המדיום.
- הכינו 1 ליטר של מדיום צמיחת שורשים שעיר על ידי ערבוב של 4.4 גרם אבקת ויטמינים MS + B5, 30 גרם סוכרוז (3%) ו-0.5 גרם מלחי MES למים מזוקקים כפולים. כוונן את עוצמת הקול ל -1 ליטר, ערבב וכוונן את ה- pH ל -5.8 עם KOH, והעבר את התמיסה לבקבוק 1 ליטר. מוסיפים 3 גרם של סוכן gelling (0.3%) ו autoclave את המדיום. הוסף cefotaxime ו ticarcillin דיסודיום לריכוז סופי של 100 - 200 מ"ג / ליטר ו 100 - 500 מ"ג / ליטר, בהתאמה. במידת הצורך, הוסף את האנטיביוטיקה המתאימה (עמידות נובעת T-DNA של וקטור בינארי).
- הכינו 1 ליטר של מדיום גידול צמחים מרוכבים על ידי ערבוב 2.2 גרם אבקת ויטמינים MS + B5, 10 גרם סוכרוז (1%) ו -0.5 גרם מלחי MES למים מזוקקים כפולים. כוונן את עוצמת הקול ל -1 ליטר, ערבב וכוונן את ה- pH ל -5.8 עם KOH והעבר את התמיסה לבקבוק 1 ליטר. מוסיפים 6 גרם של סוכן gelling (0.6%) ו autoclave המדיום. הוסף cefotaxime ו ticarcillin דיסודיום לריכוז סופי של 200 מ"ג / ליטר ו 500 מ"ג / ליטר, בהתאמה. במידת הצורך, הוסף את האנטיביוטיקה המתאימה (עמידות נובעת T-DNA של וקטור בינארי).
- הכן 1 ליטר של מדיום התחדשות על ידי ערבוב 4.4 גרם של אבקת ויטמינים MS + B5, 30 גרם סוכרוז (3%), ו 0.5 גרם של מלחי MES לתוך מים מזוקקים כפול. כוונן את עוצמת הקול ל-1 ליטר, ערבב וכוונן את ה-pH ל-5.8 עם KOH. מעבירים את התמיסה לבקבוק 1 ליטר ומוסיפים 3 גרם של חומר ג'לינג (0.3%). Autoclave המדיום. הוסף NAA ו- BAP לריכוז סופי של 8 מ"ג / ליטר ו -5 מ"ג / ליטר, בהתאמה, וטיקרצילין דיסודיום לריכוז סופי של 100 מ"ג / ליטר.
- הכן 1 ליטר של מדיום התארכות יורה על ידי ערבוב 4.4 גרם של אבקת ויטמינים MS + B5, 20 גרם סוכרוז (2%) ו 0.5 גרם של מלחי MES לתוך מים מזוקקים כפול. כוונן את עוצמת הקול ל-1 ליטר, ערבב וכוונן את ה-pH ל-5.8 עם KOH. מעבירים את התמיסה לבקבוק 1 ליטר ומוסיפים 3 גרם אגר צמחי (0.3%). Autoclave המדיום. הוסף BAP ו- GA3 לריכוז סופי של 0.5 מ"ג / ליטר ו 0.03 מ"ג / ליטר, בהתאמה, ו cefotaxime לריכוז סופי של 100 מ"ג / ליטר.
- הכינו 1 ליטר של מדיום השראת שורש על ידי ערבוב 2.2 גרם אבקת ויטמינים MS + B5, 10 גרם סוכרוז (1%) ו 0.5 גרם מלחי MES למים מזוקקים כפולים. כוונן את עוצמת הקול ל-1 ליטר, ערבב וכוונן את ה-pH ל-5.8 עם KOH. מעבירים את התמיסה לבקבוק 1 ליטר ומוסיפים 3 גרם של חומר ג'לינג (0.3%). Autoclave המדיום. הוסף IBA ו cefotaxime לריכוז סופי של 0.5 מ"ג / ליטר ו 100 מ"ג / ליטר, בהתאמה.
- הכן 1 ליטר של חיץ Cetyltrimethylammonium bromide (CTAB) על ידי הוספת 20 גרם של CTAB (2% w/v סופי), 100 מ"ל של 1M Tris-HCl, pH 8.0 (100 mM סופי), 40 מ"ל של 0.5 M EDTA, pH 8.0 (20 mM סופי), 81.8 גרם של NaCl (1.4 M סופי) ו 5 גרם של PVP40 (0.5% w/v סופי). יש לכוונן ל-1 ליטר עם מים מזוקקים כפול. Autoclave את הפתרון. אחסנו את התמיסה עד שנה בטמפרטורת החדר.
2. טרנספורמציה של אגרובקטריום עם וקטור בינארי
- הכינו את הדנ"א של פלסמיד בינארי מאומת המכיל את קלטת T-DNA לשילוב בגנום הצמח. ודא כי DNA פלסמיד מכיל מלחים נמוכים כדי למנוע ניצוצות חשמליים כמו electroporation משמש. מומלץ להשתמש בערכת מיצוי DNA פלסמיד לפי בחירה.
- הכינו תאי Agrobacterium tumefaciens C58C1 אלקטרו-מוכשרים המכילים את הפלסמיד pRiA4b מעורר השורש השעיר על ידי חיסון 200 מ"ל של נוזל מחומם מראש (28 מעלות צלזיוס) YEB עם 8 מ"ל של תרבית לילה טרייה. יש לדגור על תרבית בטמפרטורה של 28°C תוך כדי רעידה, עד שהצפיפות האופטית ב-600 ננומטר (OD600) היא כ-0.5, בהתאם לשלב אמצע הלוג. זה לוקח בערך 4 - 5 שעות.
- חלקו את תרבית האגרובקטריום לארבעה צינורות צנטריפוגות סטריליות של 50 מ"ל מקוררות מראש. צנטריפוגה למשך 15 דקות ב-4°C ב-3,200 x גרם.
הערה: התאים צריכים להישמר קרים משלב זה ואילך. - הסר את supernatant והשהה מחדש את הגלולה בעדינות לתוך (4x) 2.5 מ"ל של קר (4 ° C) 10% גליצרול. מוסיפים עוד 47.5 מ"ל גליצרול קר 10% ומערבבים בעדינות.
- תאי גלולה ב 3,200 x גרם במשך 15 דקות ב 4 ° C. יש להשליך את תאי העל-נאטנט ולהשהות מחדש ב-(4x) 10 מ"ל של גליצרול קר 10%.
- גלול את התאים שוב להשעות אותם מחדש (4x) 0.75 מ"ל של קר 10% גליצרול. אסוף את התוכן של כל ארבעת הצינורות לאחד (נפח כולל = 3 מ"ל).
- מחלקים את התמיסה האגרובקטריאלית לאליציטוטים של 50 μL במיקרו-צינוריות סטריליות מקוררות מראש של 1.5 מ"ל. מקפיאים את האליציטוטים על קרח יבש או חנקן נוזלי. אחסנו את הצינורות בטמפרטורה של -80°C לשימוש עתידי.
- מניחים צינור אחד של תאים מוסמכים (50 μL) על קרח, מערבבים עם 5 μL של DNA פלסמיד (1 מיקרוגרם בסך הכל, משלב 2.1), מעבירים את התערובת לקובט אלקטרופורציה (רווח של 0.2 ס"מ), ודגרים במשך 5 דקות על קרח.
- מקם את cuvette ב electroporator ו electroporate את התאים עם ההגדרות הבאות: קיבוליות 25 μFD, התנגדות 400 Ω, מתח חשמלי 2.5 kV, משך הדופק 9.7 ms.
- הוסף 950 μL של מדיום נוזלי LB לתאים, אשר לאחר מכן בתרבית ב 28 ° C במשך 2 שעות ב 300 סל"ד ב thermomixer. צלחת 50 μL של תרבית התא על מדיום LB מוצק עם אנטיביוטיקה סלקטיבית מתאימה. תרבית את הצלחות במשך 2 ימים ב 28 ° C.
הערה: מומלץ לצלוח מגוון תרביות תאים (10 μL - 100 μL) לכל צלחת כדי לקבוע נפח תרבית תקין ולמנוע צמיחת יתר של חיידקים. - הכינו תרביות נוזליות מכמה מושבות נבחרות ב-5 מ"ל של מדיום נוזלי LB עם אנטיביוטיקה. לגדל את החיידקים לילה ב 28 ° C עם רעיד. השתמש בתרביות אלה עבור מלאי גליצרול על ידי ערבוב 0.5 מ"ל של תרבית חיידקים נוזלית ו 0.5 מ"ל של 40% גליצרול.
הערה: מושבות אלה מאומתות לנוכחות הטרנסגן על ידי PCR מושבה. למטרה זו, הוסף כמות קטנה של מושבה מצלחת לתערובת האב PCR המכילה חיץ, dNTP ופולימראז Taq לפי בחירה, יחד עם פריימרים המגבירים חלק מה- T-DNA מווקטור בינארי. Inoculum ממלאי גליצרול משמש לשינוי של הצמחים.
3. טרנספורמציית שורש שעיר של Brassica napus DH12075
- מניחים זרעים של Brassica napus DH12075 במיקרו-צינוריות ומעקרים אותם בקופסת זרימה. ראשית, מסירים את השומן מהזרעים באמצעות מים ו-0.1% חומר ניקוי תוך כדי ניעור במשך 60 שניות. לאחר מכן, לשטוף את הזרעים עם מים ואחריו 70% אתנול, שניהם במשך 60 שניות.
- לעקר את הזרעים באמצעות תמיסה 10% של אקונומיקה מסחרית המכילה hypochlorite נתרן. נערו את הזרעים בתמיסה זו במשך 20 דקות.
- לשטוף את הזרעים 4x עם מים סטריליים במשך 60 s כל אחד. הניחו אותם על צלחות פטרי המכילות את מצע נביטת הזרעים. ריבוד קר של הזרעים ב 4 ° C במשך הלילה ולהעביר את הצלחות לחדר טיפוח (21 ° C, 16 שעות אור / 8 שעות כהה).
- מעבירים שתילים בני 5 ימים לקופסאות לתרבית צמחים המכילות מצע גידול צמחים.
הערה: יעילות הטרנספורמציה הטובה ביותר DH12075 זוהתה עבור שתילים בני 18 יום. גיל השתיל עשוי להיות מותאם לתנאי הגידול המקומיים או לזנים אחרים. - חסן תרבית נוזלית של Agrobacterium tumefaciens C58C1 הנושא פלסמיד pRiA4b שעיר המשרה שורשים ואת הווקטור הבינארי לצורך טרנספורמציה (משלב 2.11) עם לולאת חיסון. השתמש 5 מ"ל של LB בינוני. גדל תרבית זו בן לילה ב 28 ° C עד שהוא מגיע OD600 = 0.9 - 1.
הערה: אגרובקטריום המכיל רק את פלסמיד Ri משמש אם שורשים שעירים מסוג בר מיוצרים. - להזריק כמות קטנה של תרבית (כ 50 μL) עם מזרק אינסולין לתוך hypocotyl של שתיל בן 18 יום (משלב 3.4). נקב את hypocotyl דרך עם מחט 26G רכוב על מזרק בערך 1 ס"מ מעל פני השטח של המדיום. להזריק את הנוזל לתוך הפצע. הרקמה על פני השטח של hypocotyl יכול גם להיות שרוט על ידי מזרק.
הערה: יש להתאים את מספר השתילים המחוסנים לצרכי הנסיין. - החזירו את הצמחים לחדר הטיפוח בטמפרטורה של 21°C למשך שבועיים עד 4 שבועות עד להיווצרות יבלת ושורשים שעירים באתר הפציעה.
- חתכו את היבלת עם השורשים השעירים שיצאו מההיפוקוטיל והניחו אותה על צלחת פטרי עם מדיום צמיחת השורש השעיר המכיל אנטיביוטיקה סלקטיבית (נישאת על ידי T-DNA) וצפוטקסים (200 מ"ג / ליטר) וטיקרצילין (500 מ"ג / ליטר) כדי לדכא צמיחה אגרובקטריאלית. אטמו את צלחות הפטרי בנייר דבק חדיר לגז. תרבית את השורשים השעירים ב 24 ° C בחושך.
הערה: ריכוז תקין של אנטיביוטיקה ספציפית המשמשת לברירה פונקציונלית חייב להיבדק עם שורשים שעירים מסוג בר. עבור B. napus DH12075 שורשים שעירים הנושאים עמידות לקנמיצין, נעשה שימוש בריכוז של 25 מ"ג/ליטר קנמיצין.
הערה: בשלב זה, ניתן ליצור צמח מרוכב המורכב מנבטה מסוג בר ושורשים שעירים טרנסגניים התומכים בצמיחתו של צמח כזה. במקום לחתוך את השורשים השעירים מגבעול, מסירים את השורשים המקומיים של הצמח. הצמח בעל שורשים שעירים מתפתחים מועבר לקופסת תרבית צמחים עם מצע גידול מרוכב המכיל cefotaxime (200 מ"ג / ליטר) ו ticarcillin (500 מ"ג / L) כדי לדכא צמיחה אגרובקטריאלית, ואת אנטיביוטיקה סלקטיבית (נישא על ידי T-DNA). - לאחר שבוע - שבועיים, בודדו את השורשים השעירים על צלחת הפטרי מהיבלת והפכו אותם לאינדיבידואליים על צלחות עם אותו מדיום תרבית. מעבירים את התרבית לצלחת טרייה כל 4 עד 5 שבועות. הוסף 0.25 מ"ג/ליטר IBA כדי להגדיל את הסתעפות השורש.
- להפחית את הריכוזים של cefotaxime ו ticarcillin בהדרגה בכל העברה על ידי 100 מ"ג / ליטר (כלומר, המדיום עבור ההעברה הראשונה מכיל 100 מ"ג / L cefotaxime ו 400 מ"ג / L ticarcillin; עבור ההעברה השנייה, 300 מ"ג / L ticarcillin, וכו '). לאחר 3 - 4 חודשים, תרבית את השורשים השעירים על מדיום צמיחת שורש שעיר עם 100 מ"ג / ליטר טיקרצילין ואת האנטיביוטיקה הסלקטיבית.
4. התחדשות של Brassica napus DH12075 שורשים שעירים
- מעבירים קווי שורש שעירים עצמאיים לצלחות עם מדיום התחדשות בתנאים סטריליים באמצעות פינצטה, בלהבה לפני השימוש. מעבירים 5 - 10 שורשים לכל צלחת פטרי ומגדלים אותם בטמפרטורה של 21 מעלות צלזיוס בפוטופריוד של יום ארוך (16 שעות אור / 8 שעות כהות). אטמו את צלחות הפטרי בנייר דבק חדיר לגז.
- כל 3 עד 4 שבועות, מעבירים את השורשים השעירים לצלחות עם מדיום התחדשות טרי. שים לב כי calli נוצרים לאחר כשבועיים. היבלת מתחילה לירות לאחר שבועיים נוספים עד 8 - 9 שבועות לאחר היווצרות היבלות.
- התאימו אישית את הנבטים והעבירו אותם לקופסאות תרבית צמחים עם מדיום הארכת הנבטים למשך שבועיים עד שלושה שבועות כדי לקדם את התארכות הנבטים.
- מעבירים את הנבטים המוארכים לקופסאות תרבית צמחים עם מדיום השראת שורשים. רענן את התרבות כל 3 - 4 שבועות. יעילות ההשתרשות DH12075 היא 87% לאחר 30 יום ועד 100% לאחר 60 יום.
- העבר את הצמחים המושרשים לאדמה לאחר הסרת עקבות של סוכן ג'לינג כדי למנוע זיהום פטרייתי. ודא כי הצמחים הם התאקלמו תחילה phytotrons (21 ° C, photoperiod יום ארוך, 150 μE) ולאחר מכן להעביר אותם לחממה לפריחה (21 ° C / 18 ° C, photoperiod יום ארוך, 150 μE).
5. בחירת צמחים מתחדשים ו-T1
הערה: ניתן לבחור את קווי השורש השעירים לפני שנכנסים לתהליך ההתחדשות. סוג הבחירה תלוי בתוכן הנישא על ידי הטרנסגן. ניתן לדגום את השורשים השעירים לצורך מיצוי DNA וגנוטיפ או זיהוי מוטציות, מיצוי RNA עם סינתזת cDNA עוקבת ו-RT-qPCR לניתוח רמת ביטוי של הגן הנבחר, מיקרוסקופיה לזיהוי פלואורסצנטיות, או טיפול בצביעת GUS.
- לאחר ההעברה לקרקע, גנוטיפ הצמחים המתחדשים T0 (ושתילי T1) שוב כדי למנוע בריחות מהליכי הבחירה. צמחי T0 מציגים פנוטיפ שונה שנקרא פנוטיפ Ri: צמיחת שורשים נרחבת, עלים מסולסלים ונבטים ננסיים הנגרמים על ידי נוכחות TL ו / או TR-DNA של פלסמיד Ri שהוחדר לגנום הצמח.
- כדי לזרז את בחירת T1, השתמש בזרעים המכילים עוברים בוגרים ירוקים (כ 21 - 28 ימים לאחר האבקה עבור DH12075 עבור עובר טורפדו ומעלה) מצמחים מתחדשים T0 להצלת עוברים.
- עבודה בתיבת הזרימה הסטרילית. אספו את הסיליקים ועקרו אותם על פני השטח עם 70% אתנול.
- הניחו אותם על סרט דו-צדדי המודבק על מכסה צלחת או שקופית.
- באמצעות משקפת סטריאו, חתכו את הסיליק לאורך שולי השסתום באמצעות מחט 26G. ודא כי לחתוך אינו פוגע בזרעים. לאחיזה קלה, הרכיבו את המחט על מזרק בנפח 1 מ"ל.
- פתחו את הקרפלים והדביקו אותם לקלטת. לאסוף את הזרעים בוסר ולהעביר אותם צלחות עם בינוני עבור נביטת זרעים. אטמו את הצלחות בסרט חדיר לגז.
- מניחים את הצלחות בחדר טיפוח (21 מעלות צלזיוס, 16 שעות אור / 8 שעות כהות) עד לנביטה.
- גנוטיפ שתילי T1 לנוכחות טרנסגן מעניין והיעדר Ri TR/TL (איור 1). לאסוף את חומר העלים ולחלץ את הדנ"א שלהם בשיטה הנבחרת. שיטת CTAB מתוארת כאן:
- אספו את חומר העלה לתוך מיקרו-צינור בנפח 2 מ"ל המכיל שני חרוזים קרמיים. מקפיאים את הצינור בחנקן נוזלי.
- טוחנים את החומר באמצעות טחנת כדורים. לחילופין, ניתן להשתמש במזיק ובטיט.
- לאחר סיבוב מהיר כלפי מטה, הוסיפו 400 מיקרוליטר של חיץ CTAB לאבקה. מערבלים לזמן קצר, מסתובבים כלפי מטה ודגרים בטמפרטורה של 60 מעלות צלזיוס למשך 50 דקות לפחות.
- מצננים את התמיסה לטמפרטורת החדר למשך 15 דקות. מוסיפים נפח אחד של כלורופורם ומערבבים בעדינות.
אזהרה: בעת השימוש בכלורופורם, יש לעבוד מתחת לזרם הכימי ולהשתמש בכפפות להגנה. כל תמיסה המכילה כלורופורם יש להשליך לפח האשפה המתאים. - צנטריפוגה למשך 5 דקות במהירות של 18,400 x גרם באמצעות צנטריפוגה שולחנית. העברה 250 - 350 μL של השלב המימי העליון למיקרו-צינור חדש. השמט את שלב הביניים.
- מוסיפים נפח אחד של איזופרופנול, מערבבים היטב ודגרים במשך 5 דקות בטמפרטורת החדר. צנטריפוגה למשך 40 דקות במהירות של 18,400 x גרם.
- יש להשליך את הנוזל ולהוסיף 200 μL של 70% אתנול. שטפו את הגלולה והצנטריפוגה במשך 15 דקות במהירות של 18,400 x גרם.
- יש להשליך את הנוזל. אוויר לייבש את הגלולה ולהוסיף 50 - 100 μL של מים טהורים במיוחד. תנו לדנ"א להתמוסס במשך שעה עד לילה במקרר.
- ביצוע גנוטיפ על ידי PCR עבור הגן rolA (TL), הגן aux1 (TR), ואת מוקד virC (Agrobacterium). הכן את תגובת ה- PCR באמצעות ה- DNA המוכן (משלב 5.3.), פריימרים, חיץ, dNTP ופולימראז Taq בהתאם לפרוטוקול היצרן. השברים המוגברים הם באורך 200 - 500 bp.
פריימרים ספציפיים ל-rolA:
קדימה: GTTAGGCGTGCAAAGGCCAAG
הפוך: TGCGTATTAATCCCGTAGGTC
פריימרים ספציפיים ל-aux1:
קדימה: CATAGGATCGCCTCACAGGT
הפוך: CGTTGCTTGATGTCAGGAGA
פריימרים ספציפיים ל-virC:
קדימה: AATGCGTCTCTCTCGTGCAT
הפוך: AAACCGACCACTAACGCGAT
הערה: העברה ואינטגרציה של T-DNA עשויות להיות חלקיות, ורק חלקים של TL ו/או TR עשויים להשתלב בגנום. לכן, מומלץ לנתח את נוכחותם של ORFs אחרים של TL (למשל, rolB ו - rolC) ו- TR (aux2, mas1, ags1) בשתילי T1. רצפי פריימר ספציפיים לאתרים אלה מפורטים ב- Jedličková et al.9. - להעריך תגובות PCR על ידי אלקטרופורזה ג'ל.
הערה: מומלץ לכלול בקרה חיובית בניתוח זה כדי להבטיח שיש DNA ברמת PCR. - בחר את נוכחותו (או היעדרו) של הטרנסגן על פי הפרוטוקולים המבוססים על התוכן של טרנסגן זה.
- מעבירים שתילים נבחרים לאדמה.
6. טרנספורמציה והתחדשות שורש שעיר ב- Arabidopsis thaliana Col-0
- עיקור פני השטח של זרעי A. thaliana בשיטה לבחירה (אקונומיקה, אתנול או גז כלור).
- צלחת זרעים סטריליים על מדיום לנביטת זרעים. לאחר יומיים של ריבוד קר, העבירו את הצלחות לחדר טיפוח (21 מעלות צלזיוס עם פוטופריוד של יום ארוך ו-50% לחות).
- מעבירים שתילים בני שבוע לקופסת תרבית צמחים עם מדיום גידול צמחים.
- הכינו תרביות אגרובקטריום כפי שמצוין בשלב 3.5.
- יש להזריק כמות קטנה של תרבית (כ-50 מיקרוליטר) בעזרת מחט המורכבת על מזרק אינסולין בבסיס גזע התפרחת הראשוני (כ-1-2 ס"מ מעל הרוזטה) של צמחי ארבידופסיס בני חודש. הרקמה על פני השטח של הגבעול הראשוני יכולה גם להישרט על ידי המזרק.
- לאחר 2-4 שבועות לאחר ההזרקה, הוציאו את השורשים השעירים המתעוררים וטפחו אותם על צלחות פטרי עם מדיום צמיחת השורש השעיר בתוספת אנטיביוטיקה סלקטיבית (נישאת על ידי T-DNA) וצפוטקסים (200 מ"ג / ליטר) וטיקרצילין (500 מ"ג / ליטר) כדי לדכא צמיחה אגרובקטריאלית. לדגור את הצלחות ב 24 ° C בחושך.
- לאחר שבוע - שבועיים, להתאים אישית את השורשים השעירים על צלחות עם אותו מדיום תרבית. מעבירים את קווי השורש השעירים שנבחרו למדיום טרי כל 4 - 5 שבועות.
הערה: שורשי A. thaliana שעירים דקים יותר מאלה של B. napus, ויש לנקוט משנה זהירות בעת העברה למצע טרי. - מעבירים את השורשים השעירים לצלחות עם מדיום התחדשות כדי לגרום להיווצרות יבלות. תרבית את הצלחות ב 21 ° C ב photoperiod יום ארוך (16 שעות אור / 8 שעות כהה).
- יורה יוצא מן היבלת לאחר 18 - 21 ימים של טיפוח. חותכים את הנבטים ומעבירים אותם למדיום הארכת יורה למשך 2-3 שבועות כדי לקדם צמיחה והתארכות.
- מעבירים את הנבטים המוארכים למדיום השראת השורש.
- מעבירים את הצמחים המושרשים לאדמה. צמחי T0 מציגים גם פנוטיפ Ri. בצע את הבחירה המהונדסת, כמתואר עבור B. napus DH12075 (שלב 5).
תוצאות
בעבר ביצענו אופטימיזציה של פרוטוקול להשראת שורשים שעירים מבוססי הזרקה בשלושה זנים של Brassica napus, כלומר DH12075, Topas DH4079 ו-Westar9. כדי ליישם פרוטוקול טרנספורמציה זה על מין המודל A. thaliana, גבעולי התפרחת העיקריים של צמחים בני חודש הוזרקו עם חיסון אגרובקטריאלי. שורשים שעירים הופיעו במקום ההזרקה לאחר 2-4 שבועות. שורשים שעירים נכרתו וטופחו על התווך המוצק. השוואת השיטה בשני המינים האלה מתוארת באיור 1.
קווי שורש שעירים נבחרים הועברו למדיום ההתחדשות כדי לגרום להיווצרות נבטים. ב- A. thaliana, קלי צהוב הושרה תוך 14 יום בכל 10 קווי השורש השעירים שנבדקו. פרימורדיה ראשונית שנראתה ככתמים ירוקים כהים הופיעה תוך 3 שבועות לאחר העברתה למדיום ההתחדשות (איור 2). לאחר 4 שבועות של תרבית, הנבטים כיסו את השורשים השעירים ב-9 מתוך 10 קווי שורש שעירים (יעילות התחדשות של 90%). במקרים מסוימים, שורשים הרפתקניים נבעו מהיבלת (איור 2H). קו אחד לא התחדש גם לאחר 3 חודשים במדיום ההתחדשות (כל 4 שבועות הועברו השורשים השעירים למדיום טרי). לפיכך, יעילות ההתחדשות של שורשים שעירים A. thaliana דומה ליעילות של B. napus DH120759.
מחדשים שורשים שעירים של B. napus ו-A. thaliana מציגים פנוטיפ ננסי (איור 3), מאפיין אופייני של צמחים שמקורם בשורש שעיר2. ראינו גם מערכות שורשים צפופות, עלים מקומטים ושינויים בזמן הפריחה. הפנוטיפ הזה שנקרא שורש שעיר (או Ri) נגרם על ידי הגנים רול מפלסמיד Ri המוחדרים לגנום הצמח. החדרת ה-T-DNA של Ri והטרנסגן המקודד על וקטור בינארי עשויים להיות עצמאיים או מקושרים. לפיכך, ניתוח הפרדה של צאצאי T1 שנוצרו על ידי האבקה עצמית מסייע לזהות צמחים נטולי רול המבטאים את הטרנסגן המעניין. גנוטיפ של צמחי T1 מבוצע על ידי פריימרים PCR ספציפיים עבור ORFs של TL ו- TR ואת הטרנסגן של עניין. היעדר זיהום אגרובקטריאלי מאומת על-ידי היעדר מוצרי PCR של פריימרים virC (איור 1).
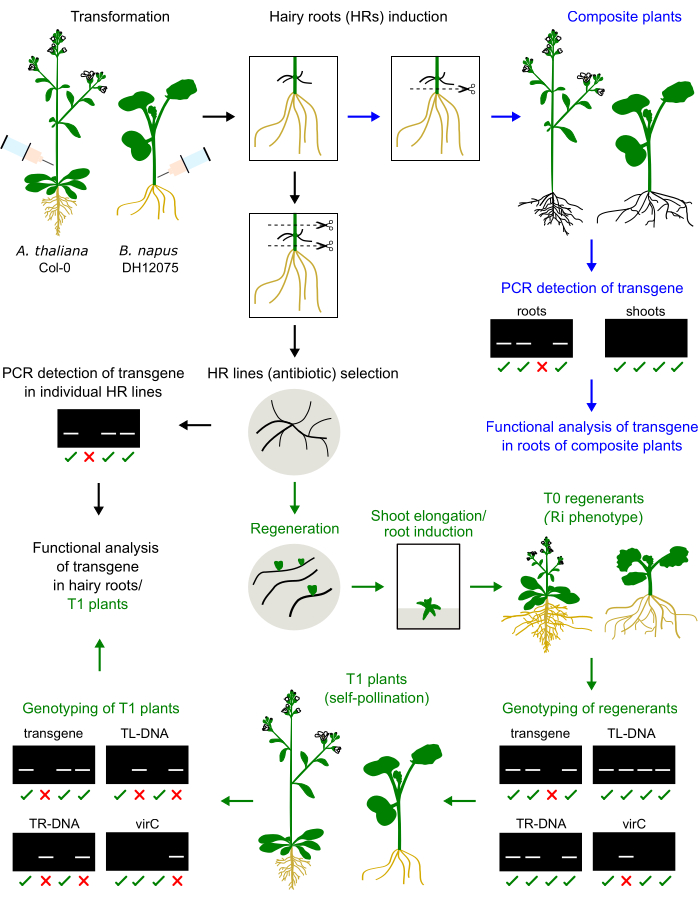
איור 1: סיכום ההליך ב-A. thaliana וב-B. napus. הזרקת Agrobacterium inoculum בגזע היפוקוטיל או תפרחת ראשונית גורמת להתפתחות שורשים שעירים. השורשים השעירים יכולים להחליף את השורשים המקומיים וליצור צמח מרוכב שיעבור גנוטיפ וינותח (חיצים כחולים). שורשים שעירים מתורבתים יכולים להתחדש לצמחי T0, להתפשט בצמחי T1 ולבצע גנוטיפ (חיצים ירוקים). השורשים השעירים יכולים גם להיות תת-תרבית לצורך ניתוח פונקציונלי (חץ שחור). מוצגות דוגמאות לתוצאות גנוטיפ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
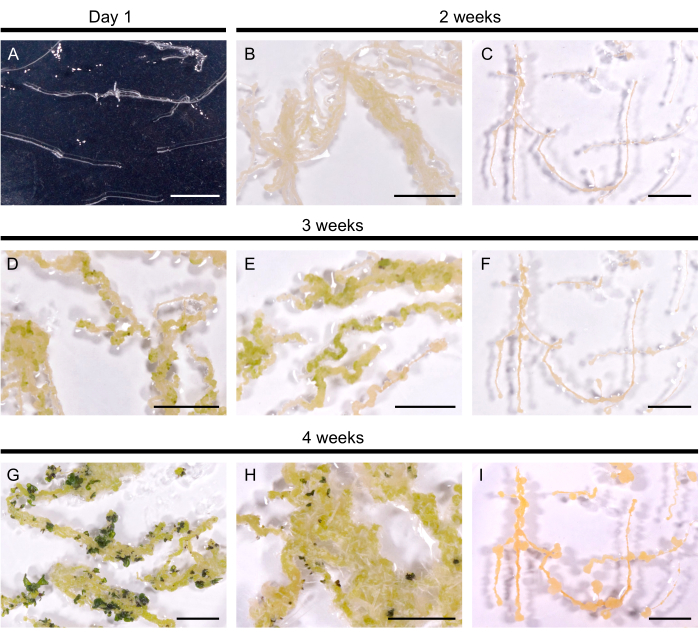
איור 2: התחדשות שורשים שעירים ב-A. thaliana. (A) תרבית שורשים שעירים יום אחד לאחר העברתה לצלחות. (ב, ג) קאלי התפתחה תוך שבועיים מהתרבית במדיום ההתחדשות. (ד, ה) Shoot primordia יצא לאחר 3 שבועות של תרבות. (ז, ח) יורה נוצרים לאחר 4 שבועות. (H) שורשים הרפתקניים התפתחו מהיבלת. (ג, ו, ט) קו שורש שעיר שאינו מתחדש. פסי קנה מידה מייצגים 1 ס"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: תמונות מייצגות של צמחי בר מסוג B. napus ו-A. thaliana ומחדשים שמקורם בשורשים שעירים (צמחי T0). שימו לב לפנוטיפ Ri של הרגנרנטים. פסי קנה מידה מייצגים 2 ס"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
פיתחנו פרוטוקול פשוט להתמרת שורשים שעירים והתחדשות לאחר מכן ב-B. napus וב-A. thaliana. תהליך זה כולל השראת שורש שעיר על בסיס הזרקה בהיפוקוטיל (B. napus) או בגזע התפרחת הראשוני (A. thaliana). השיטה של הזרקת hypocotyl עם זן אגרובקטריאלי C58C1 הנושא פלסמיד Ri היה יעיל גם במשפחת Fabaceae10,11, מלבד חברי Brassicaceae שהוצגו במחקר זה.
חלופה לשיטה מבוססת הזרקה היא טרנספורמציה מבוססת טבילה המורכבת מטבילה explant בתרחיף חיידקי, ואחריו טיפוח משותף של explant עם אגרובקטריה. היתרון של השיטה מבוססת ההזרקה על פני שיטת הטבילה הוא הזמן שנחסך על ידי היעדר כמה שלבי פרוטוקול: הכנת אקספלנט, בדיקת זמן הטיפוח המשותף, ותרבית על מדיום המכיל הורמון להשראת שורשים שעירים. למרות ששתי הגישות יעילות להשראת שורשים שעירים, יעילות טרנספורמציה גבוהה יותר נצפתה במינים מסוימים בשיטה מבוססת הזרקה בהשוואה לטבילה בצמח12,13. יתר על כן, טרנספורמציה מבוססת הזרקה שימושית גם ליצירת צמחים מרוכבים (שורשים שעירים טרנסגניים ונבטים מסוג בר). לאחר כריתת השורשים המקוריים של הצמח שעבר טרנספורמציה, שורשים שעירים תומכים בצמיחת הצמח, וניתן לחקור את הטרנסגן בהקשר של הצמח כולו.
השלב הקריטי של השראת שורש שעיר הוא הזרקת האינקולום לתוך ההיפוקוטיל או גזע התפרחת הראשוני. ההיפוקוטיל של B. napus ניתן לשבירה, וחיתוך ההיפוקוטיל כולו יכול לקרות בקלות. אותו הדבר ניתן לראות עם A. thaliana בגלל דקיקות גזע התפרחת. אם נדרשת השוואה של יעילות הטרנספורמציה של זנים / זנים שונים, אנו ממליצים לאדם אחד לבצע את כל הניסויים כדי למנוע את השגיאה הנגרמת על ידי מניפולציה ומיומנות בהזרקת הצמחים.
פיתחנו פרוטוקול יעיל להתחדשות שורשים שעירים ב-B. napus DH12075 וב-A. thaliana Col-0. מכיוון שהתחדשות היא תהליך משתנה מאוד, כמה שינויי פרוטוקול עשויים להיות מיושמים על מין או זן לפי בחירה. לדוגמה, הנבטים השעירים שמקורם בשורש יכולים להיווצר על ידי יחס אוקסין/ציטוקינין שונה (1:1) ב-B. oleracea14. לחלופין, ניתן להשתמש בציטוקינין תידיאזורון במקום BAP, כמו במקרה של B. campestris שורשים שעירים15.
החדרות מרובות של T-DNA פלסמיד Ri לגנום הצמח מייצגות מגבלה פוטנציאלית של מערכת הטרנספורמציה וההתחדשות של השורש השעיר. במקרים כאלה, צמחים ללא TL/TR מפלסמיד Ri אינם נחשפים לאחר ניתוח הפרדה של שתילי T1. לכן, אנו ממליצים ליצור מספר קווי שורש שעירים עצמאיים עבור כל טרנסגן.
תרביות שורשים שעירים הן כלי רב עוצמה למחקרים תפקודיים גנטיים בעיקר בגלל התבססותן המהירה ותחזוקתן הזולה (אין צורך בהורמונים באמצעי הטיפוח). פרוטוקול זה מכסה את השיטות להשראת שורשים שעירים והתחדשות ב- B. napus ו- A. thaliana, שניתן להשתמש בהן כדי לחקור את הטרנסגן המעניין ישירות בתרביות שורשים שעירים, בהקשר של הצמח כולו באמצעות צמחים מרוכבים, או לאחר התחדשות הצמחים הטרנסגניים.
Disclosures
המחברים מצהירים כי המחקר נערך ללא כל יחסים מסחריים או פיננסיים שיכולים להתפרש כניגוד עניינים פוטנציאלי.
Acknowledgements
אנו מודים ל-Jiří Macas (המרכז הביולוגי CAS, České Budějovice, צ'כיה) על אספקת הזן האגרובקטריאלי. מדעי צמחי מתקן הליבה של CEITEC MU מוכרים בזכות התמיכה הטכנית שלהם. עבודה זו נתמכה על ידי משרד החינוך, הנוער והספורט של הרפובליקה הצ'כית עם הקרן האירופית לפיתוח אזורי - פרויקט "SINGING PLANT" (לא. CZ.02.1.01/0.0/0.0/16_026/0008446) ופרויקט INTER-COST LTC20004.
Materials
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
References
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved