Method Article
Transformation et régénération des racines velues chez Arabidopsis thaliana et Brassica napus
Dans cet article
Résumé
Le protocole décrit l’induction des racines poilues à l’aide de tiges d’inflorescence primaires d’Arabidopsis et d’hypocotyles de Brassica napus . Les racines velues peuvent être cultivées et utilisées comme explants pour régénérer les plantes transgéniques.
Résumé
La transformation des racines poilues représente un outil polyvalent pour la biotechnologie végétale chez diverses espèces. L’infection par une souche d’Agrobacterium porteuse d’un plasmide inducteur de racines (Ri) induit la formation de racines poilues sur le site de blessure après le transfert de l’ADN-T du plasmide Ri dans le génome de la plante. Le protocole décrit en détail la procédure d’induction des racines poilues par injection chez Brassica napus DH12075 et Arabidopsis thaliana Col-0. Les racines poilues peuvent être utilisées pour analyser un transgène d’intérêt ou traitées pour la génération de plantes transgéniques. Le milieu de régénération contenant de la cytokinine 6-benzylaminopurine (5 mg/L) et de l’acide auxine-1-naphtalèneacétique (8 mg/L) provoque avec succès la formation de pousses chez les deux espèces. Le protocole couvre le génotypage et la sélection de régénérants et de plantes T1 pour obtenir des plantes porteuses d’un transgène d’intérêt et exemptes d’ADN-T à partir du plasmide Ri . Un processus alternatif conduisant à la formation d’une plante composite est également décrit. Dans ce cas, les racines velues sont conservées sur la pousse (à la place des racines naturelles), ce qui permet d’étudier un transgène dans les cultures de racines poilues dans le contexte de la plante entière.
Introduction
La transformation des plantes est le goulot d’étranglement de toute étude génétique en biologie végétale. Une bactérie du sol, Agrobacterium tumefaciens, est largement utilisée comme moyen d’administration de gènes par trempage floral ou culture tissulaire pour générer des transformants. A. tumefaciens infecte les plantes sur un site de blessure et provoque des tumeurs dues au transfert et à l’intégration de l’ADN-T d’un plasmide inducteur de tumeur (Ti) dans le génome de la plante hôte. Les souches d’A. tumefaciens modifiées avec un plasmide Ti modifié sans l’ADN T de type sauvage et un vecteur binaire avec de l’ADN T artificiel et des sites de clonage pour insérer un gène d’intérêt sont couramment utilisées comme système efficace de transformation des plantes1. Cependant, de nombreuses espèces et cultures modèles sont récalcitrantes au trempage floral ou à la régénération des plantes in vitro ou ont de longs cycles de croissance, ce qui a un impact sur l’efficacité de ce système de transformation.
Agrobacterium rhizogenes induit la formation de racines adventives, ou racines poilues, sur le site de blessure après avoir infecté une plante hôte. Comme A. tumefaciens, A. rhizogenes transfère un ADN-T d’un plasmide inducteur racinaire (Ri) au génome de la plante hôte, provoquant le développement de racines poilues transgéniques. Ce processus est contrôlé principalement par les gènes 2,3 des loci oncogéniques racinaires (rol). En utilisant des souches agrobactériennes portant à la fois le plasmide Ri et un vecteur binaire artificiel codant pour un gène d’intérêt, des cultures de racines poilues ont été utilisées pour produire des protéines recombinantes, analyser la fonction des promoteurs ou des gènes, ou modifier des génomes à l’aide de répétitions palindromiques courtes en grappes régulièrement espacées (CRISPR)/protéine associée à CRISPR 9 (Cas9)4,5,6.
Notre protocole utilise la souche transconjuguée Ti-less A. tumefaciens C58C1 portant le plasmide Ri pRiA4b7. L’ADN-T du plasmide Ri se compose de deux régions, l’ADN-T droit et l’ADN-gauche (ADN-TR et ADN-TL, respectivement), qui peuvent s’intégrer indépendamment dans le génome de la plante8. En exploitant ce système, le long processus de transformation de l’explant dans le cultivar DH12075 Brassica napus a été optimisé9. Le protocole détaillé ci-dessous permet la régénération de lignées racinaires poilues sélectionnées et l’obtention de plantes T1 porteuses du transgène d’intérêt et exemptes de gènes rol en environ 1 an. La transformation par injection de racines poilues peut être utilisée chez d’autres espèces de Brassicaceae, comme le montre la transformation d’Arabidopsis thaliana Col-0. Alors que l’hypocotyle est utilisé pour transformer B. napus, A. thaliana est injecté dans la tige primaire de l’inflorescence.
Protocole
1. Préparation des milieux et des solutions
- Préparez les solutions mères d’hormones.
- Pour la préparation de 50 mL d’acide 1-naphtalèneacétique (NAA), de 6-benzylaminopurine (BAP) et d’acide indole-3-butyrique (IBA) à une concentration de 5 mg/mL, dissoudre 250 mg de l’hormone en poudre dans 2 mL d’hydroxyde de sodium (NaOH) 1 M et ajuster le volume à 50 mL avec de l’eau ultrapure.
- Pour préparer 50 mL d’acide gibbérellique (GA3) à une concentration de 1 mg/mL, dissoudre 50 mg de l’hormone en poudre dans 2 mL d’éthanol et ajuster le volume à 50 mL d’eau ultrapure.
- Filtrer la solution à l’aide d’un filtre à seringue stérile avec des pores de 0,22 μm et la répartir dans des tubes stériles de 2 mL pour le stockage. Conservez la solution à -20 °C ou 4 °C, selon la recommandation du fabricant.
- Préparez des solutions mères antibiotiques. Pour 50 mL de solution mère de céfotaxime et de ticarcilline disodique à une concentration de 100 mg/mL, dissoudre 0,5 g de l’antibiotique en poudre dans 40 mL d’eau ultrapure et ajuster jusqu’à un volume final de 50 mL. Filtrer la solution à l’aide d’un filtre à seringue stérile avec des pores de 0,22 μm et la répartir dans des tubes stériles de 2 mL pour le stockage. Conserver la solution à -20 °C.
REMARQUE : Des antibiotiques et des hormones sont toujours ajoutés au milieu refroidi. - Préparez 1 L de milieu Luria Broth (LB) en ajoutant 10 g de bacto-tryptone, 5 g d’extrait de levure et 5 g de chlorure de sodium (NaCl) dans un cylindre doseur de 1 L et ajustez le volume à 1 L avec de l’eau distillée doublement. Ajustez le pH à 7,0 avec KOH avec un pH-mètre (en suivant les instructions du fabricant). Transvaser la solution dans un flacon de 1 L et ajouter 15 g de gélose bactériologique (1,5 %), si un milieu solide est préparé et autoclaver le milieu. Si nécessaire, ajoutez les antibiotiques appropriés (la résistance bactérienne est portée par le vecteur binaire) au milieu refroidi.
REMARQUE : Utilisez un autoclave pour stériliser la solution. Mettez le biberon dans le panier, fermez le couvercle et stérilisez-le pendant 20 min à 121 °C et 98,9 kPa. Ce protocole est toujours utilisé pour les solutions d’autoclave dans les étapes suivantes. - Préparez 1 L de milieu d’extrait de levure de bœuf (YEB) en mélangeant 5 g d’extrait de bœuf, 1 g d’extrait de levure, 5 g de peptone, 5 g de saccharose et 0,5 g de chlorure de magnésium (MgCl2) dans de l’eau doublement distillée. Réglez le volume à 1 L. Transférez la solution dans un flacon de 1 L. Autoclave le médium.
- Préparez 1 L de milieu pour la germination des graines en mélangeant 2,2 g de poudre de Murashige et Skoog (MS), 10 g de saccharose (1 %) et 0,5 g de sels sodiques d’acide 2-(N-morpholino)éthanesulfonique (MES) dans de l’eau doublement distillée. Réglez le volume à 1 L, mélangez et ajustez le pH à 5,8 avec KOH. Transvaser la solution dans un flacon de 1 L et ajouter 8 g de gélose végétale (0,8%). Autoclave le médium.
- Préparez 1 L de milieu de culture en mélangeant 2,2 g de poudre MS, 5 g de saccharose (0,5 %) et 0,5 g de sels MES dans de l’eau distillée deux fois. Réglez le volume à 1 L, mélangez et ajustez le pH à 5,8 avec KOH. Transvaser la solution dans un flacon de 1 L et ajouter 8 g de gélose végétale (0,8 %). Autoclave le médium.
- Préparez 1 L de milieu de croissance des racines poilues en mélangeant 4,4 g de poudre de vitamines MS + B5, 30 g de saccharose (3 %) et 0,5 g de sels MES dans de l’eau doublement distillée. Réglez le volume à 1 L, mélangez et ajustez le pH à 5,8 avec KOH, puis transférez la solution dans un flacon de 1 L. Ajouter 3 g de gélifiant (0,3%) et autoclaver le milieu. Ajouter le céfotaxime et la ticarcilline disodique à une concentration finale de 100 à 200 mg/L et de 100 à 500 mg/L, respectivement. Si nécessaire, ajoutez les antibiotiques appropriés (la résistance est due à l’ADN-T d’un vecteur binaire).
- Préparez 1 L de milieu de croissance végétal composite en mélangeant 2,2 g de poudre de vitamines MS + B5, 10 g de saccharose (1 %) et 0,5 g de sels MES dans de l’eau doublement distillée. Réglez le volume à 1 L, mélangez et ajustez le pH à 5,8 avec du KOH et transférez la solution dans un flacon de 1 L. Ajouter 6 g de gélifiant (0,6%) et autoclaver le milieu. Ajouter le céfotaxime et la ticarcilline disodique à une concentration finale de 200 mg/L et 500 mg/L, respectivement. Si nécessaire, ajoutez les antibiotiques appropriés (la résistance est due à l’ADN-T d’un vecteur binaire).
- Préparez 1 L de milieu de régénération en mélangeant 4,4 g de poudre de vitamines MS + B5, 30 g de saccharose (3 %) et 0,5 g de sels MES dans de l’eau doublement distillée. Réglez le volume à 1 L, mélangez et ajustez le pH à 5,8 avec KOH. Transférer la solution dans un flacon de 1 L et ajouter 3 g de gélifiant (0,3 %). Autoclave le médium. Ajouter l’ANA et le BAP à une concentration finale de 8 mg/L et 5 mg/L, respectivement, et la ticarcilline disodique à une concentration finale de 100 mg/L.
- Préparez 1 L de milieu d’allongement des pousses en mélangeant 4,4 g de poudre de vitamines MS + B5, 20 g de saccharose (2 %) et 0,5 g de sels de MES dans de l’eau doublement distillée. Réglez le volume à 1 L, mélangez et ajustez le pH à 5,8 avec KOH. Transvaser la solution dans un flacon de 1 L et ajouter 3 g de gélose végétale (0,3%). Autoclave le médium. Ajouter le BAP et le GA3 à une concentration finale de 0,5 mg/L et 0,03 mg/L, respectivement, et le céfotaxime à une concentration finale de 100 mg/L.
- Préparez 1 L de milieu d’induction racinaire en mélangeant 2,2 g de poudre de vitamines MS + B5, 10 g de saccharose (1 %) et 0,5 g de sels de MES dans de l’eau doublement distillée. Réglez le volume à 1 L, mélangez et ajustez le pH à 5,8 avec KOH. Transvaser la solution dans un flacon de 1 L et ajouter 3 g de gélifiant (0,3%). Autoclave le médium. Ajouter l’IBA et le céfotaxime à une concentration finale de 0,5 mg/L et 100 mg/L, respectivement.
- Préparer 1 L de tampon de bromure de cétyltriméthylammonium (CTAB) en ajoutant 20 g de CTAB (2 % p/v final), 100 mL de 1M Tris-HCl, pH 8,0 (100 mM final), 40 mL d’EDTA 0,5 M, pH 8,0 (20 mM final), 81,8 g de NaCl (1,4 M final) et 5 g de PVP40 (0,5 % p/v final). Ajustez à 1 L avec de l’eau distillée doublement. Autoclave la solution. Conservez la solution jusqu’à 1 an à température ambiante.
2. Transformation d’Agrobacterium avec un vecteur binaire
- Préparez l’ADN d’un plasmide binaire vérifié contenant la cassette d’ADN-T à intégrer dans le génome de la plante. Assurez-vous que l’ADN plasmidique contient peu de sels pour éviter les étincelles électriques lors de l’utilisation de l’électroporation. L’utilisation d’un kit d’extraction d’ADN plasmidique de votre choix est recommandée.
- Préparer des cellules électrocompétentes d’Agrobacterium tumefaciens C58C1 contenant le plasmide inducteur de racines velues pRiA4b en inoculant 200 mL de YEB liquide préchauffé (28 °C) avec 8 mL d’une culture fraîche de nuit. Incuber la culture à 28 °C en agitant jusqu’à ce que la densité optique à 600 nm (OD600) soit d’environ 0,5, correspondant à la phase mi-logarithmique. Cela prend environ 4 à 5 h.
- Diviser la culture d’Agrobacterium dans quatre tubes à centrifuger stériles pré-réfrigérés de 50 ml. Centrifuger pendant 15 min à 4 °C à 3 200 x g.
REMARQUE : Les cellules doivent être maintenues froides à partir de cette étape. - Retirer le surnageant et remettre délicatement la pastille en suspension dans (4x) 2,5 mL de glycérol à froid (4 °C) à 10 %. Ajouter 47,5 ml de glycérol à 10 % froid et mélanger délicatement.
- Cellules à granulés à 3 200 x g pendant 15 min à 4 °C. Jeter le surnageant et remettre les cellules en suspension dans (4x) 10 mL de glycérol froid à 10 %.
- Granulez à nouveau les cellules et mettez-les en suspension dans (4x) 0,75 mL de glycérol froid à 10 %. Regrouper le contenu des quatre tubes en un seul (volume total = 3 ml).
- Diviser la solution agrobactérienne en aliquotes de 50 μL dans des microtubes stériles de 1,5 mL pré-réfrigérés. Congelez les aliquotes sur de la glace carbonique ou de l’azote liquide. Stockez les tubes à -80 °C pour une utilisation future.
- Placer un tube de cellules compétentes (50 μL) sur de la glace, mélanger avec 5 μL d’ADN plasmidique (1 μg au total, à partir de l’étape 2.1), transférer le mélange dans une cuvette d’électroporation (espace de 0,2 cm) et incuber pendant 5 min sur de la glace.
- Placez la cuvette dans l’électroporateur et électroporez les cellules avec les réglages suivants : capacité 25 μFD, résistance 400 Ω, tension électrique 2,5 kV, durée d’impulsion 9,7 ms.
- Ajouter 950 μL de milieu liquide LB dans les cellules, qui sont ensuite cultivées à 28 °C pendant 2 h à 300 tr/min dans un thermomélangeur. Déposer 50 μL de culture cellulaire sur un milieu solide LB avec l’antibiotique sélectif approprié. Cultiver les plaques pendant 2 jours à 28 °C.
REMARQUE : Il est recommandé de mettre en plaque une gamme de cultures cellulaires (10 μL - 100 μL) par plaque pour déterminer un volume de culture approprié et éviter la prolifération des bactéries. - Préparez des cultures liquides à partir de quelques colonies sélectionnées dans 5 mL de milieu liquide LB avec des antibiotiques. Cultivez les bactéries pendant la nuit à 28 °C en secouant. Utilisez ces cultures pour les stocks de glycérol en mélangeant 0,5 mL de culture bactérienne liquide et 0,5 mL de glycérol à 40 %.
REMARQUE : La présence du transgène dans ces colonies est vérifiée par PCR de colonie. À cette fin, ajoutez une petite quantité d’une colonie d’une plaque au mélange maître PCR contenant le tampon, le dNTP et la polymérase Taq de votre choix, ainsi que des amorces amplifiant une partie de l’ADN-T à partir d’un vecteur binaire. L’inoculum des stocks de glycérol est utilisé pour la transformation des plantes.
3. Transformation des racines velues de Brassica napus DH12075
- Placez les graines de Brassica napus DH12075 dans des microtubes et stérilisez-les dans une boîte à flux. Tout d’abord, dégraissez les graines avec de l’eau et 0,1% de détergent tout en secouant pendant 60 s. Ensuite, rincez les graines avec de l’eau suivie de 70% d’éthanol, les deux pendant 60 s.
- Stérilisez les graines à l’aide d’une solution à 10 % d’eau de Javel commerciale contenant de l’hypochlorite de sodium. Agitez les graines dans cette solution pendant 20 min.
- Lavez les graines 4 fois avec de l’eau stérile pendant 60 s chacune. Placez-les sur des boîtes de Pétri contenant le milieu de germination des graines. Stratification à froid des graines à 4 °C pendant la nuit et déplacement des plaques dans une salle de culture (21 °C, 16 h de lumière / 8 h d’obscurité).
- Transférer les plants de 5 jours dans des boîtes de culture contenant un milieu de croissance des plantes.
REMARQUE : La meilleure efficacité de transformation en DH12075 a été identifiée pour les semis de 18 jours. L’âge des semis peut être optimisé en fonction des conditions de croissance locales ou d’autres cultivars. - Inoculer une culture liquide d’Agrobacterium tumefaciens C58C1 portant un plasmide velu inducteur racinaire pRiA4b et le vecteur binaire de transformation (à partir de l’étape 2.11) avec une boucle d’inoculation. Utilisez 5 ml de milieu LB. Cultivez cette culture pendant une nuit à 28 °C jusqu’à ce qu’elle atteigneOD 600 = 0,9 - 1.
NOTE : Agrobacterium contenant uniquement le plasmide Ri est utilisé si des racines velues de type sauvage sont produites. - Injecter une petite quantité de culture (environ 50 μL) avec une seringue à insuline dans l’hypocotyle d’un plant de 18 jours (à partir de l’étape 3.4.). Percer l’hypocotyle avec une aiguille 26G montée sur la seringue à environ 1 cm au-dessus de la surface du milieu. Injectez le liquide dans la plaie. Le tissu à la surface de l’hypocotyle peut également être rayé par la seringue.
REMARQUE : Le nombre de plants inoculés doit être adapté aux besoins de l’expérimentateur. - Remettre les plantes dans la salle de culture à 21 °C pendant 2 à 4 semaines jusqu’à ce qu’un cal et des racines velues se forment à l’endroit de la blessure.
- Coupez le cal avec les racines poilues émergées de l’hypocotyle et placez-le sur une boîte de Pétri avec le milieu de croissance des racines poilues contenant des antibiotiques sélectifs (portés par l’ADN-T) et du céfotaxime (200 mg/L) et de la ticarcilline (500 mg/L) pour supprimer la croissance agrobactérienne. Scellez les boîtes de Pétri avec du ruban adhésif perméable aux gaz. Cultivez les racines velues à 24 °C dans l’obscurité.
REMARQUE : La concentration appropriée d’antibiotiques spécifiques utilisés pour la sélection fonctionnelle doit être testée avec des racines velues de type sauvage. Pour B. napus DH12075 racines velues résistantes à la kanamycine, une concentration de 25 mg/L de kanamycine est utilisée.
REMARQUE : Dans cette étape, il est possible de générer une plante composite composée de la pousse de type sauvage et des racines poilues transgéniques soutenant la croissance de cette plante. Au lieu de couper les racines poilues d’une tige, les racines indigènes de la plante sont enlevées. La plante aux racines velues émergentes est transférée dans une boîte de culture végétale avec un milieu de croissance végétal composite contenant du céfotaxime (200 mg/L) et de la ticarcilline (500 mg/L) pour supprimer la croissance agrobactérienne, et l’antibiotique sélectif (porté par l’ADN-T). - Après 1 à 2 semaines, isolez les racines poilues de la boîte de Pétri du cal et individualisez-les sur des plaques avec le même milieu de culture. Transférez la culture dans une nouvelle assiette toutes les 4 à 5 semaines. Ajouter 0,25 mg/L de ZICO pour augmenter la ramification des racines.
- Réduire graduellement les concentrations de céfotaxime et de ticarcilline à chaque transfert de 100 mg/L (c.-à-d. que le milieu pour le premier transfert contient 100 mg/L de céfotaxime et 400 mg/L de ticarcilline ; pour le deuxième transfert, 300 mg/L de ticarcilline, etc.). Après 3 à 4 mois, cultivez les racines poilues sur un milieu de croissance des racines velues avec 100 mg/L de ticarcilline et l’antibiotique sélectif.
4. Régénération de Brassica napus DH12075 racines velues
- Transférer les lignes racinaires poilues indépendantes sur des plaques avec un milieu de régénération dans des conditions stériles à l’aide d’une pince à épiler, flammée avant utilisation. Transférez 5 à 10 racines par boîte de Pétri et cultivez-les à 21 °C lors d’une photopériode de jours longs (16 h de lumière / 8 h d’obscurité). Scellez les boîtes de Pétri avec du ruban adhésif perméable aux gaz.
- Toutes les 3 à 4 semaines, transférez les racines poilues dans des assiettes avec un milieu de régénération frais. Notez que les calli se forment après environ 2 semaines. Le cal commence à tirer après 2 semaines supplémentaires jusqu’à 8 à 9 semaines après la formation du callosité.
- Individualisez les pousses et transférez-les dans des bacs de culture végétale avec un milieu d’élongation des pousses pendant 2 à 3 semaines pour favoriser l’allongement des pousses.
- Transférez les pousses allongées dans des bacs de culture avec un milieu d’induction racinaire. Rafraîchissez la culture toutes les 3 à 4 semaines. L’efficacité d’enracinement dans DH12075 est de 87 % à 30 jours et jusqu’à 100 % après 60 jours.
- Transférez les plantes enracinées dans le sol après avoir éliminé toute trace d’agent gélifiant pour éviter les infections fongiques. Assurez-vous que les plantes sont d’abord acclimatées dans les phytotrons (21 °C, photopériode de jours longs, 150 μE) puis transférez-les dans une serre pour la floraison (21 °C / 18 °C, photopériode de jours longs, 150 μE).
5. Sélection des plantes régénérantes et T1
REMARQUE : Les lignes de racines poilues peuvent être sélectionnées avant d’entrer dans le processus de régénération. Le type de sélection dépend du contenu porté par le transgène. Les racines poilues peuvent être échantillonnées pour l’extraction de l’ADN et le génotypage ou la détection de mutations, l’extraction de l’ARN avec synthèse ultérieure de l’ADNc et la RT-qPCR pour l’analyse du niveau d’expression du gène de choix, la microscopie pour la détection de fluorescence ou traitées pour la coloration GUS.
- Après le transfert dans le sol, génotyper à nouveau les plantes régénérantes T0 (et les plantules T1) pour éviter les échappées aux procédures de sélection. Les plantes T0 présentent un phénotype altéré appelé phénotype Ri : croissance extensive des racines, feuilles bouclées et pousses naines causées par la présence de l’ADN TL et/ou TR du plasmide Ri inséré dans le génome de la plante.
- Pour accélérer la sélection T1, utilisez les graines contenant des embryons matures verts (environ 21 à 28 jours après la pollinisation pour DH12075 pour un embryon de torpille ou plus) de plantes régénératrices T0 pour le sauvetage des embryons.
- Travaillez dans la boîte de flux stérile. Récupérez les siliques et stérilisez-les en surface avec de l’éthanol à 70 %.
- Placez-les sur un ruban adhésif double face collé sur un couvercle d’assiette ou une diapositive.
- À l’aide d’une stéréo-jumelle, fendez la silique le long des bords de la valve à l’aide d’une aiguille 26G. Assurez-vous que la coupe n’endommage pas les graines. Pour une prise en main facile, montez l’aiguille sur une seringue de 1 ml.
- Ouvrez les carpelles et collez-les sur le ruban adhésif. Récupérez les graines immatures et transférez-les dans des assiettes avec un milieu pour la germination des graines. Scellez les plaques avec du ruban adhésif perméable aux gaz.
- Placez les plaques dans une salle de culture (21 °C, 16 h de lumière / 8 h d’obscurité) jusqu’à la germination.
- Génotyper les plantules T1 pour la présence du transgène d’intérêt et l’absence du TR/TL Ri (Figure 1). Collectez du matériel foliaire et extrayez leur ADN en utilisant la méthode de votre choix. La méthode CTAB est décrite ici :
- Recueillir la matière foliaire dans un microtube de 2 mL contenant deux billes de céramique. Congelez le tube dans de l’azote liquide.
- Broyer le matériau à l’aide d’un broyeur à boulets. Alternativement, un pilon et un mortier peuvent être utilisés.
- Après un essorage rapide, ajoutez 400 μL de tampon CTAB à la poudre. Vortex brièvement, tournez vers le bas et incubez à 60 °C pendant au moins 50 min.
- Refroidir la solution à température ambiante pendant 15 min. Ajouter un volume de chloroforme et mélanger délicatement.
ATTENTION : Lorsque vous utilisez du chloroforme, travaillez sous le flux chimique et utilisez des gants pour vous protéger. Toute solution contenant du chloroforme doit être jetée dans la poubelle appropriée. - Centrifuger pendant 5 min à 18 400 x g à l’aide d’une centrifugeuse de table. Transférer 250 à 350 μL de la phase aqueuse supérieure dans un nouveau microtube. Omettez l’interphase.
- Ajouter un volume d’isopropanol, bien mélanger et incuber 5 min à température ambiante. Centrifuger pendant 40 min à 18 400 x g.
- Jeter le liquide et ajouter 200 μL d’éthanol à 70 %. Lavez le granulé et centrifugez-le pendant 15 min à 18 400 x g.
- Jeter le liquide. Séchez le granulé à l’air libre et ajoutez 50 à 100 μL d’eau ultrapure. Laissez l’ADN se dissoudre pendant 1 h à toute la nuit au réfrigérateur.
- Effectuer un génotypage par PCR pour le gène rolA (TL), le gène aux1 (TR) et le locus virC (Agrobacterium). Préparez la réaction PCR en utilisant l’ADN préparé (à partir de l’étape 5.3.), les amorces, le tampon, le dNTP et la Taq polymérase selon le protocole du fabricant. Les fragments amplifiés mesurent 200 à 500 pb de long.
Apprêts spécifiques pour rolA :
Avant : GTTAGGCGTGCAAAGGCCAAG
Revers : TGCGTATTAATCCCGTAGGTC
Amorces spécifiques pour aux1 :
Attaquant : CATAGGATCGCCTCACAGGT
Revers : CGTTGCTTGATGTCAGGAGA
Amorces spécifiques pour virC :
Avant : AATGCGTCTCTCTCTCGTGCAT
Revers : AAACCGACCACTAACGCGAT
REMARQUE : Le transfert et l’intégration de l’ADN-T peuvent être partiels, et seules des parties de TL et/ou de TR peuvent s’intégrer dans le génome. Il est donc recommandé d’analyser la présence d’autres ORF de TL (par exemple, rolB et rolC) et TR (aux2, mas1, ags1) dans les plantules T1. Les séquences d’amorces spécifiques à ces loci sont répertoriées dans Jedličková et al.9. - Évaluer les réactions PCR par électrophorèse sur gel.
REMARQUE : Il est recommandé d’inclure un témoin positif dans cette analyse pour s’assurer d’avoir un ADN de qualité PCR. - Sélectionner la présence (ou l’absence) du transgène selon les protocoles en fonction du contenu de ce transgène.
- Transférer les plants sélectionnés dans le sol.
6. Transformation et régénération des racines poilues chez Arabidopsis thaliana Col-0
- Stérilisez les graines d’A. thaliana en surface avec la méthode de votre choix (eau de Javel, éthanol ou chlore gazeux).
- Placez les graines stériles sur un milieu pour la germination des graines. Après 2 jours de stratification à froid, déplacez les plaques dans une salle de culture (21 °C avec photopériode de jour long et 50 % d’humidité).
- Transférer les plants âgés de 1 semaine dans une boîte de culture végétale avec un milieu de croissance pour plantes.
- Préparer les cultures d’Agrobacterium comme indiqué à l’étape 3.5.
- Injecter une petite quantité de culture (environ 50 μL) à l’aide d’une aiguille montée sur une seringue à insuline à la base de la tige de l’inflorescence primaire (environ 1 à 2 cm au-dessus de la rosette) de plantules d’Arabidopsis âgées de 1 mois. Le tissu à la surface de la tige primaire peut également être rayé par la seringue.
- 2 à 4 semaines après l’injection, exciser les racines velues émergentes et les cultiver sur des boîtes de Pétri avec le milieu de croissance des racines poilues complété par l’antibiotique sélectif (porté par l’ADN-T) et le céfotaxime (200 mg/L) et la ticarcilline (500 mg/L) pour supprimer la croissance des agrobactéries. Incuber les plaques à 24 °C dans l’obscurité.
- Après 1 à 2 semaines, individualisez les racines poilues sur des plaques avec le même milieu de culture. Transférez les lignes de racines poilues sélectionnées dans un milieu frais toutes les 4 à 5 semaines.
REMARQUE : Les racines velues d’A. thaliana sont plus minces que celles de B. napus, et des précautions doivent être prises lors du transfert dans un milieu frais. - Transférez les racines poilues dans des plaques avec un milieu de régénération pour induire la formation de callosités. Cultiver les plaques à 21 °C en photopériode de jours longs (16 h de lumière / 8 h d’obscurité).
- Les pousses émergent du cal après 18 à 21 jours de culture. Coupez les pousses et transférez-les dans un milieu d’élongation des pousses pendant 2 à 3 semaines pour favoriser la croissance et l’allongement.
- Transférez les pousses allongées dans le milieu d’induction racinaire.
- Transférez les plantes enracinées dans le sol. Les plantes T0 présentent également un phénotype Ri. Effectuez la sélection transgénique, comme décrit pour B. napus DH12075 (étape 5).
Résultats
Nous avons précédemment optimisé un protocole d’induction des racines poilues par injection chez trois cultivars de Brassica napus, à savoir DH12075, Topas DH4079 et Westar9. Pour appliquer ce protocole de transformation à l’espèce modèle A. thaliana, les tiges d’inflorescence primaires des plantules de 1 mois ont été injectées avec un inoculum agrobactérien. Des racines velues sont apparues au site d’injection après 2 à 4 semaines. Les racines velues ont été excisées et cultivées sur le milieu solide. La comparaison de la méthode chez ces deux espèces est illustrée à la figure 1.
Des lignes racinaires velues sélectionnées ont été transférées dans le milieu de régénération pour induire la formation de pousses. Chez A. thaliana, des cals jaunes ont été induits en 14 jours dans les 10 lignées racinaires poilues testées. Les premières pousses sont visibles sous forme de taches vert foncé dans les 3 semaines suivant le transfert dans le milieu de régénération (figure 2). Après 4 semaines de culture, les pousses ont recouvert les racines poilues dans 9 des 10 lignes de racines poilues (efficacité de régénération de 90%). Dans certains cas, des racines adventives ont été provoquées à partir du cal (figure 2H). Une ligne ne s’est pas régénérée même après 3 mois sur le milieu de régénération (toutes les 4 semaines, les racines poilues ont été transférées dans un milieu frais). Ainsi, l’efficacité de régénération des racines poilues d’A. thaliana ressemble à l’efficacité de B. napus DH120759.
Les régénérants des racines velues de B. napus et d’A. thaliana présentent un phénotype nain (figure 3), une caractéristique typique des plantes dérivées des racines velues2. Nous avons également observé des systèmes racinaires denses, des feuilles ridées et des changements dans la période de floraison. Ce phénotype dit de racine poilue (ou Ri) est causé par les gènes rol du plasmide Ri insérés dans le génome de la plante. L’insertion de l’ADN-T Ri et du transgène codé sur un vecteur binaire peut être indépendante ou liée. Ainsi, une analyse de ségrégation de la descendance T1 créée par autopollinisation permet d’identifier les plantes sans rol exprimant le transgène d’intérêt. Le génotypage des plantes T1 est réalisé par des amorces PCR spécifiques pour les ORF de TL et TR et le transgène d’intérêt. L’absence de contamination agrobactérienne est vérifiée par l’absence de produits PCR des amorces virC (Figure 1).
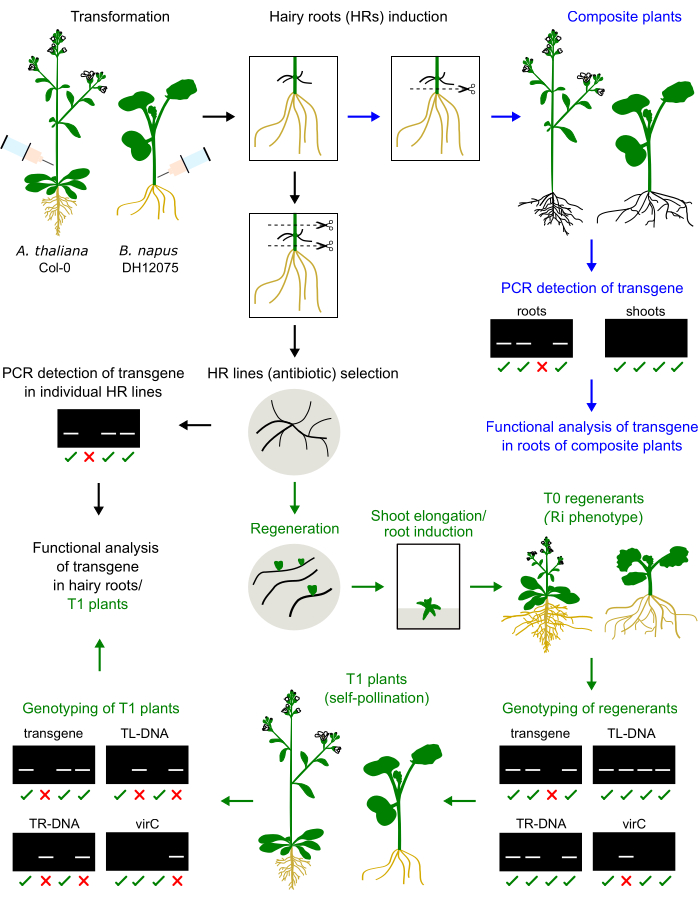
Figure 1 : Résumé de la procédure chez A. thaliana et B. napus. L’injection de l’inoculum d’Agrobacterium dans l’hypocotyle ou la tige d’inflorescence primaire induit le développement de racines velues. Les racines poilues peuvent remplacer les racines indigènes pour générer une plante composite qui sera génotypée et analysée (flèches bleues). Les racines poilues cultivées peuvent être régénérées en plantes T0, propagées en plantes T1 et génotypées (flèches vertes). Les racines velues peuvent également être sous-cultivées pour une analyse fonctionnelle (flèche noire). Des exemples de résultats de génotypage sont présentés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
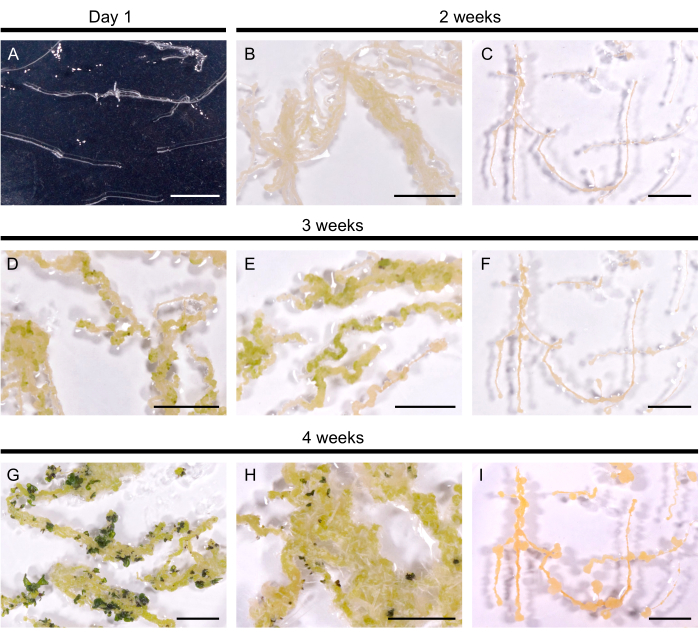
Figure 2 : Régénération des racines poilues chez A. thaliana. (A) Culture de racines poilues 1 jour après son transfert dans les plaques. (B, C) Les Calli se sont développés en 2 semaines de culture sur milieu de régénération. (D, E) Les primordia des pousses ont émergé après 3 semaines de culture. (G, H) Les pousses se forment après 4 semaines. (H) Des racines adventives se sont développées à partir du durillon. (C, F, I) Ligne racinaire poilue non régénérante. Les barres d’échelle représentent 1 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Photos représentatives de plantes de type sauvage de B. napus et d’A. thaliana et de régénérants dérivés de racines velues (plantes T0). Notez le phénotype Ri des régénérants. Les barres d’échelle représentent 2 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Nous avons développé un protocole simple pour la transformation des racines velues et la régénération ultérieure chez B. napus et A. thaliana. Ce processus comprend l’induction de racines poilues par injection dans l’hypocotyle (B. napus) ou la tige d’inflorescence primaire (A. thaliana). La méthode d’injection de l’hypocotyle avec la souche agrobactérienne C58C1 portant un plasmide Ri a également été efficace dans la famille des Fabaceae10,11, en plus des membres des Brassicaceae présentés dans cette étude.
Une alternative à la méthode par injection est la transformation par immersion consistant en une immersion de l’explant dans une suspension bactérienne, suivie d’une co-culture de l’explant avec des agrobactéries. L’avantage de la méthode par injection par rapport à la méthode par immersion est le gain de temps par l’absence de certaines étapes du protocole : préparation de l’explantation, test du temps de co-culture, et culture sur un milieu contenant de l’hormone pour l’induction des racines velues. Bien que les deux approches soient efficaces pour l’induction des racines velues, une efficacité de transformation plus élevée a été observée chez certaines espèces avec la méthode basée sur l’injection par rapport à l’immersion dans les explants12,13. De plus, la transformation par injection est également utile pour générer des plantes composites (racines poilues transgéniques et pousses de type sauvage). Après avoir coupé les racines d’origine de la plante transformée, les racines velues soutiennent la croissance de la plante et le transgène peut être étudié dans le contexte de la plante entière.
L’étape critique de l’induction de la racine poilue consiste à injecter l’inoculum dans l’hypocotyle, ou tige d’inflorescence primaire. Les hypocotyles de B. napus sont cassables et la coupe de l’hypocotyle entier peut facilement se produire. La même chose peut être observée avec A. thaliana en raison de l’amincissement de la tige de l’inflorescence. Si une comparaison de l’efficacité de transformation de différentes espèces/cultivars est nécessaire, nous recommandons qu’une seule personne effectue toutes les expériences pour éviter l’erreur causée par la manipulation et l’habileté à injecter les plantes.
Nous avons développé un protocole efficace pour la régénération des racines poilues chez B. napus DH12075 et A. thaliana Col-0. Comme la régénération est un processus très variable, certaines modifications du protocole peuvent être appliquées à une espèce ou à un cultivar de choix. Par exemple, les pousses poilues dérivées de racines peuvent être provoquées par un rapport auxine/cytokinine différent (1 :1) chez B. oleracea14. Alternativement, la cytokinine thidiazuron peut être utilisée à la place du BAP, comme dans le cas des racines poilues de B. campestris 15.
Les insertions multiples de l’ADN-T du plasmide Ri dans le génome de la plante représentent une limitation potentielle du système de transformation et de régénération des racines poilues. Dans de tels cas, aucune plante exempte de TL/TR du plasmide Ri n’est découverte après une analyse de ségrégation des plantules T1. Ainsi, nous recommandons de générer plusieurs lignées racinaires poilues indépendantes pour chaque transgène.
Les cultures de racines velues sont un outil extrêmement puissant pour les études fonctionnelles des gènes, principalement en raison de leur établissement rapide et de leur entretien peu coûteux (aucune hormone n’est nécessaire dans les milieux de culture). Ce protocole couvre les méthodes d’induction et de régénération des racines velues chez B. napus et A. thaliana, qui peuvent être utilisées pour étudier le transgène d’intérêt directement dans les cultures de racines velues, dans le contexte de la plante entière à l’aide de plantes composites, ou après la régénération des plantes transgéniques.
Déclarations de divulgation
Les auteurs déclarent que la recherche a été menée sans aucune relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Jiří Macas (Centre de biologie CAS, České Budějovice, République tchèque) pour avoir fourni la souche agrobactérienne. La plateforme Sciences des plantes du CEITEC MU est reconnue pour son soutien technique. Ce travail a été soutenu par le ministère de l’Éducation, de la Jeunesse et des Sports de la République tchèque avec le projet du Fonds européen de développement régional « SINGING PLANT » (no. CZ.02.1.01/0.0/0.0/16_026/0008446) et le projet INTER-COST LTC20004.
matériels
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
Références
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon