Method Article
Desenredando las interacciones glicano-proteína: la resonancia magnética nuclear (RMN) al rescate
En este artículo
Resumen
Aquí, presentamos un protocolo que detalla la adquisición, el procesamiento y el análisis de una serie de experimentos de RMN destinados a caracterizar las interacciones proteína-glicano en solución. Se describen las metodologías más comunes basadas en ligandos y proteínas, que sin duda contribuyen a los campos de la glicobiología estructural y los estudios de reconocimiento molecular.
Resumen
Las interacciones de los glicanos con las proteínas modulan muchos eventos relacionados con la salud y la enfermedad. De hecho, el establecimiento de estos eventos de reconocimiento y sus consecuencias biológicas están íntimamente relacionados con las estructuras tridimensionales de ambos socios, así como con sus características dinámicas y su presentación en los compartimentos celulares correspondientes. Las técnicas de RMN son únicas para desentrañar estas características y, de hecho, se han desarrollado y aplicado diversas metodologías basadas en RMN para monitorear los eventos de unión de los glicanos con sus receptores asociados. Este protocolo describe los procedimientos para adquirir, procesar y analizar dos de las metodologías de RMN más potentes empleadas en el campo de la RMN-glicobiología, los experimentos de valoración de diferencia de transferencia de saturación (STD) de 1H-saturación (STD) y 1 H,15N-Heteronuclear de coherencia cuántica simple (HSQC), que ofrecen información complementaria desde la perspectiva de glicanos y proteínas, respectivamente. De hecho, cuando se combinan, ofrecen un poderoso conjunto de herramientas para dilucidar los aspectos estructurales y dinámicos de los procesos de reconocimiento molecular. Este enfoque integral mejora nuestra comprensión de las interacciones glicano-proteína y contribuye al avance de la investigación en el campo de la glicobiología química.
Introducción
El reconocimiento molecular de los glicanos es esencial para muchos procesos relacionados con la salud y la enfermedad. La especificidad y selectividad de los receptores biológicos (lectinas, anticuerpos, enzimas) para los glicanos depende en gran medida del ajuste del precario equilibrio entre los diversos componentes de la entalpía (CH-π y van der Waals, enlaces de hidrógeno, electrostáticos) y la entropía (hidrofobicidad, dinámica, solvatación-desolvatación)1.
Dada la gran diversidad química y la naturaleza dinámica de los glicanos, los métodos de RMN se han empleado ampliamente para diseccionar las interacciones de los glicanos durante más de 25 años2, ya que estas metodologías proporcionan una excelente información sobre los eventos de reconocimiento molecular con detalles precisos, a una resolución atómica 3,4, incluso cuando la evidencia de interacción requerida no se puede recuperar empleando otras metodologías. Como punto clave, la RMN es versátil y permite estudiar eventos dinámicos, a nivel atómico, a diferentes escalas de tiempo, constituyendo la mejor técnica hasta ahora para estudiar la estructura, conformación y dinámica de los glicanos en solución. Sin embargo, desentrañar esta información puede ser un proceso bastante complejo que requiere el empleo de estrategias bien definidas junto con un análisis cuidadoso de los datos5.
Las técnicas de RMN son diversas y, de hecho, hay muchas metodologías que se pueden emplear para desentrañar las interacciones glicano-proteína6. En este trabajo describimos dos enfoques básicos de RMN que se emplean actualmente para descifrar las interacciones glicano-receptor 7,8, haciendo hincapié en cómo desentrañar la presentación del epítopo clave del glicano, así como el sitio de unión de la proteína9.
En cualquier evento de reconocimiento molecular, cuando un receptor se une a un ligando dado, se produce un proceso de intercambio químico que afecta a muchos parámetros de RMN de los participantes en la unión10. Por lo tanto, desde la perspectiva de la RMN, la interacción se puede monitorizar desde el punto de vista del ligando glicano o desde el del receptor de la proteína11. En términos generales, el receptor de la proteína es una biomolécula grande (movimiento de rotación lento, con tasas en la escala de tiempo ns y, por lo tanto, relajación transversal rápida), mientras que el glicano que interactúa puede considerarse como una molécula de tamaño pequeño-mediano (movimiento de rotación rápido, con tasas en la escala de tiempo ps y relajación transversal lenta)12. Desde una perspectiva estándar, las señales de RMN del glicano son estrechas, mientras que las del receptor son amplias13.
Los métodos de RMN basados en ligandos se basan en el cambio drástico que experimentan muchos parámetros de RMN de glicanos al pasar del estado libre al estado unido14. La RMN-STD es la técnica experimental de RMN más empleada para evaluar diversas características de unión a glicanos15, desde la deducción de la existencia de unión en el estado de solución hasta la determinación del epítopo de unión al glicano; es decir, los átomos del ligando que están en contacto con el receptor de la proteína16.
Alternativamente, los métodos de RMN basados en receptores monitorean los cambios que tienen lugar en las señales del receptor de proteínas en presencia del glicano con respecto a los registrados para el estado apo17. Estos se centran principalmente en el cribado de las perturbaciones de cambio químico de las señales de las proteínas entre ambos estados. El experimento más comúnmente empleado es el 1 H-15N HSQC, o sus alternativas TROSY18.
La combinación de ambos enfoques permite aplicar la RMN a muchos sistemas diversos que muestran una amplia gama de afinidades. Sin embargo, para los métodos de RMN basados en receptores, a diferencia de los basados en el ligando, se debe disponer de una cantidad relativamente grande de proteína soluble, no agregada y marcada con isótopos estables (15N).
En este trabajo describimos ambos métodos, destacando sus fortalezas y debilidades. Tenga en cuenta que los pasos básicos descritos en el protocolo sirven como ejemplos para el uso de espectrómetros Bruker. En consecuencia, los nombres de los comandos y parámetros se alinean con los utilizados en TopSpin (el software de control de espectrómetros de Bruker).
Protocolo
1. Diferencia de transferencia de saturación NMR (STD-NMR)
NOTA: Las líneas siguientes describen los procedimientos fundamentales para adquirir, procesar y analizar experimentos de ETS-RMN. Estos pasos sirven para ejemplificar la utilidad de la técnica para detectar la unión del ligando y para dilucidar el epítopo de unión del ligando. Para una comprensión más profunda del diseño y la adquisición de experimentos de RMN, consulte el manual del fabricante correspondiente proporcionado con el instrumento de RMN.
- Adquisición
- Preparar la muestra con el complejo proteína-ligando. Emplee proporciones molares de glicano:lectina entre 10:1 y 100:1 con concentraciones de proteínas que oscilar entre 0,01 y 0,2 mM. Para la interacción de hGalectin-7 con LacNAc, utilice una relación proteína:ligando de 50:1 en solución salina tamponada con fosfato deuterado a pH 7,4.
NOTA: El receptor de la proteína debe ser puro y soluble en el tampón de elección (en el caso de los experimentos de RMN-ETS, son preferibles las versiones deuteradas del tampón correspondiente para reducir la posible interferencia de la señal de RMN de 1H). La concentración de la proteína se comprueba previamente utilizando un espectrofotómetro para medir la absorbancia a 280 nm. - A partir de la solución preparada, transfiera un volumen total de 0,6 mL a un tubo de RMN de 5 mm utilizando una pipeta.
- Prepare el instrumento de RMN a la temperatura requerida (las temperaturas comunes de los experimentos oscilan entre 10 °C y 45 °C). Abra el monitor de control de temperatura con el comando edte y configure la temperatura deseada. Para el estudio de hGalectin-7/LacNAc, la temperatura se fijó en 25 °C.
- Genere un nuevo conjunto de datos que contenga la secuencia de pulsos zg.
- Para una operación sencilla, abra un experimento existente y escriba el comando edc . Aparece un cuadro de diálogo, define el título, las características (especificaciones de la muestra, disolvente) y algunos parámetros del experimento.
- Si se requiere un cambio de la secuencia de impulsos original, navegue a través de las ventanas ased (parámetros) y AcquPars (parámetros de adquisición). En este punto, elija el programa de pulso deseado de la biblioteca del espectrómetro.
- Para un espectro de RMN estándar de 1H, seleccione la secuencia de pulsos zg de la lista disponible.
NOTA: En el caso de muestras con mayor contenido de agua, puede ser necesario el uso de esquemas de supresión de agua para aumentar la relación señal-ruido. Es deseable el uso de secuencias de pulsos como zgesgp, que estimulan módulos que ofrecen una excelente supresión pero que controlan la fase de las señales restantes. Consulte el tutorial de RMN del fabricante para obtener información adicional sobre los tipos de esquemas de supresión de agua y sus principales características.
- Inserte la muestra de RMN en la sonda activando el aire de elevación de la muestra. Utilice el comando ej, coloque la muestra en la parte superior del imán y desactive la elevación de la muestra mediante el comando ij.
NOTA: Para inyectar la muestra en el imán utilizando un muestreador automático, utilice el comando sx seguido del número de posición, n, correspondiente a la posición del tubo de RMN en la bandeja del muestreador automático. - Bloquee la señal de disolvente escribiendo el comando lock y, a continuación, seleccionando el disolvente adecuado en el menú.
- Una vez que la muestra se inserta en la sonda, complete el proceso de ajuste y coincidencia utilizando el módulo automático atma o el módulo manual atmm.
- Inicie la calzada automática a través del comando GUI de topshim. Esto abrirá una interfaz gráfica donde se seleccionará e iniciará la cota de cuña 1D.
NOTA: Para minimizar las inestabilidades de la calce debido a sutiles variaciones de campo o temperatura, la corrección automática de la compatibilidad se puede activar para la adquisición del experimento. Esto se puede realizar accediendo a la ventana de control de BSMS y haciendo clic en autocorrección. El hecho de que se convierta en un resaltado verde indica que se ha activado la corrección automática de la corrección. Tenga en cuenta que al utilizar la corrección automática, los posibles problemas de inestabilidad de la muestra deben pasar desapercibidos. Por lo tanto, se recomienda precaución cuando se emplea autoshim. - Determine el pulso de 1H 90°. Esto se puede llevar a cabo automáticamente a través del comando pulsecal .
- Modifique varios parámetros en la ventana AcquPars. Para un espectro de RMN regular de 1H, establezca el número de exploraciones (NS) en 32 y la ventana espectral deseada (SW) en aprox. 12 ppm.
NOTA: La secuencia de pulsos zgesgp incluye un módulo para la supresión de solventes para eliminar la señal HDO residual, que debe estar centrada en el centro del espectro. Para ello, O1 debe definirse con precisión en AcquPars. - Ajuste la ganancia del receptor para evitar el desbordamiento con el comando automático rga.
- Ahora, adquiera el espectro de RMN estándar de 1H usando el comando zg.
- Una vez finalizada la adquisición, procese el espectro a través del comando efp. Aplique las correcciones de línea de base y fase utilizando la barra de menú TopSpin.
NOTA: Se observan señales de RMN de 1H derivadas del glicano y la proteína (Figura 1). Se recomienda el análisis detallado del espectro de RMN adquirido para la implementación del experimento de RMN de ETS, como se describe en la sección 1.1.14. - Cree un nuevo conjunto de datos y cargue la secuencia de impulsos de RMN de ETS que se empleará de la misma manera descrita para el experimento de RMN de 1H en la sección 1.1.4. En los instrumentos Bruker, hay diferentes secuencias de pulsos disponibles en el catálogo del programa de pulsos, todas denominadas stddiffXXX. El más simple (stddiff) no incluye ningún esquema de supresión de agua ni filtro de supresión de proteínas.
- Para muestras con un contenido significativo deH2O, seleccione las secuencias stddiffgp19 o stddiffesgp, que incluyen un módulo de escultura de watergate o excitación. En el caso de un espectro con intensas señales de RMN de proteínas como fondo, seleccione las secuencias stddiffXXX.3. En cada caso, optimice los parámetros específicos correspondientes para cada módulo de supresión de agua (es decir, d19 en los esquemas de watergate).
- Defina las frecuencias de resonancia de encendido y apagado para el experimento de RMN de ETS. Encuentre la lista de frecuencias en los parámetros AcquPars de la ventana ased en la entrada FQ2LIST. Las frecuencias de resonancia y resonancia definidas en hercios deben escribirse manualmente en la lista y guardarse con un nuevo nombre. Esta nueva lista se utilizará en el experimento de STD-RMN.
- Elija la frecuencia de resonancia en una región espectral desprovista de señales de glicanos, generalmente alrededor de δ(1H) 0 o 6,6 ppm, para glicanos típicos (Figura 1). Establezca la frecuencia fuera de resonancia en una región que no muestre ningún ligando o protón de proteína. Se puede ajustar de forma segura a +18000 o -18000 Hz.
- Defina el pulso con forma que se utilizará durante el tiempo de saturación en los parámetros AcquPars de la ventana ased .
NOTA: Hay muchas posibilidades. Las formas Gaussiana o Eburp se pueden emplear de forma segura, con un ancho de 90° del pulso selectivo de 50 ms. - Establezca los parámetros correspondientes en la sección AcquPars.
- Ajuste la longitud del pulso de 1H 90°.
- Establezca el valor de potencia para el pulso con forma (estimado a través de la herramienta de forma).
- Establezca el tiempo total de saturación. Se pueden emplear regularmente valores entre 1 s y 4 s.
- Ajuste el retardo de relajación a 3 s.
- Establezca el número de exámenes (NS) en un múltiplo de 8. Por lo general, se establece en 256, 512 o 1024 para obtener la relación señal-ruido adecuada en conjuntos de 2 en cada frecuencia.
- Establezca el número de exploraciones ficticias (DS) en 8.
- Establezca el número de puntos en F2 en 16k, 32k o 64k.
NOTA: Un mayor número de puntos en F2 dará como resultado una mejora en la resolución y la relación señal-ruido. Por esa razón, es muy recomendable utilizar un mínimo de 16k puntos de datos. - Establece el número de puntos en F1. Este es el número de frecuencias a utilizar, en este caso, 2 (la on-resonancia y la off-resonancia).
NOTA: Por convención, F2 se refiere a la dimensión directa, la dimensión a lo largo de la cual se muestrea directamente el decaimiento por inducción libre (FID), mientras que F1 denota la dimensión indirecta. - Ajuste la ganancia del receptor (RG) para evitar el desbordamiento con el comando automático rga.
- Calcule el tiempo del experimento total usando el comando expt.
- Envíe el experimento para su adquisición a través del comando zg.
- Compruebe siempre que el experimento se está ejecutando correctamente después de unos minutos.
- Preparar la muestra con el complejo proteína-ligando. Emplee proporciones molares de glicano:lectina entre 10:1 y 100:1 con concentraciones de proteínas que oscilar entre 0,01 y 0,2 mM. Para la interacción de hGalectin-7 con LacNAc, utilice una relación proteína:ligando de 50:1 en solución salina tamponada con fosfato deuterado a pH 7,4.
- Tratamiento
NOTA: Se obtiene un espectro pseudo-2D después de aplicar el protocolo descrito anteriormente. El número de filas corresponde al número de frecuencias empleadas, normalmente dos: la on-resonancia y la off-resonancia.- Procese el fid para el primer experimento.
- Realice la transformada de Fourier del número fid 1 (a través del comando efp) y seleccione el destino de los espectros procesados (seleccione el número procno). Alternativamente, use el comando rser 1 para leer el primer fid.
- Luego, ajuste el factor de ensanchamiento de línea a través del comando lb (generalmente 3-5 Hz) y la fase. Para fasear manualmente, haga clic en la pestaña Proceso y luego en el submenú Ajustar fase . Realice correcciones de cero y de primer orden haciendo clic y arrastrando el botón correspondiente. Guarde los resultados de la fase. Además, realice la corrección de la línea de base a través del comando abs.
- Lee el fid del segundo experimento y haz la transformada de Fourier (a través del comando efp) con el mismo factor de ensanchamiento de línea. Ajuste la fase con los mismos parámetros de fase y corrección de línea de base y guarde el espectro procesado con un código diferente.
- Lea los dos espectros procesados con la función múltiple (comando: .md) y réstelos (off-resonance - on-resonancia) utilizando el botón disponible en la visualización múltiple (Δ). El nuevo espectro es el espectro de RMN de ETS, que se guarda con un código diferente.
- Realice una superposición del espectro de RMN de ETS con el espectro fuera de resonancia.
- Abra el espectro fuera de resonancia (fid 1) y escriba el comando .md para abrir la ventana de visualización múltiple. A continuación, cargue el espectro de ETS.
- Compare las frecuencias e intensidades (que se muestran automáticamente en la parte superior derecha) de las señales en el espectro de RMN STD. Esto proporciona la información deseada sobre los protones que están cerca de la proteína y su proximidad relativa. Cuanto mayor es la intensidad relativa, más cerca de la proteína están (Figura 2).
- Mida las intensidades (integrales) en el experimento de fuera de resonancia utilizando el software correspondiente. En TopSpin, vaya a Analizar > Integrar. Defina las regiones y escriba las integrales en un archivo (I0).
- Mida las intensidades (integrales) en el experimento de RMN de STD utilizando los mismos parámetros y escríbalas en un archivo (ISTD).
- Calcule el valor STD para cada señal de protones utilizando la siguiente ecuación:
STD = (ISTD)/I0.
NOTA: NOTA: El uso de la integración de señales para calcular los valores de STD requiere que las señales de protones estén suficientemente separadas. Cuando se produce una superposición de señales, como en el caso de los oligosacáridos, los valores de STD pueden determinarse evaluando la relación de intensidad de la señal entre los espectros de STD y fuera de resonancia. - Calcule el STD relativo como un porcentaje. Para hacer esto, dé un valor del 100% al protón que exhibe la diferencia máxima entre las intensidades en el espectro de resonancia fuera y el espectro de RMN STD. Calcule las intensidades STD relativas para los otros protones en consecuencia.
NOTA: El análisis adecuado de los datos de ETS, especialmente para determinar el epítopo de uniónal ligando, requiere la asignación completa de señales 1 H del ligando. Por lo tanto, se recomienda encarecidamente que esta tarea se complete antes de la adquisición de los espectros STD.
- Procese el fid para el primer experimento.
2. 1Experimentos H-15N HSQC
NOTA: Las siguientes líneas detallan el empleo de experimentosHSQC 1 H-15N para monitorear los cambios en los cambios químicos de lasresonancias de RMN 1 H y 15N del receptor (lectina) en respuesta a la presencia de cantidades crecientes del ligando (oligosacárido)19. El análisis de perturbación por desplazamiento químico (CSP) basado en los datos extraídos es muy valioso para la identificación de socios de unión, pero también para mapear la interfaz de unión a proteínas y determinar las afinidades de unión. Para una comprensión más profunda del diseño y la adquisición de experimentos de RMN, consulte el manual del fabricante correspondiente proporcionado con el instrumento de RMN.
- Adquisición y procesamiento
- Prepare la muestra con la lectina de interés. Asegúrese de que el receptor esté completamente marcado con 15N en cada residuo de aminoácidos, tanto en la columna vertebral como en las cadenas laterales. Por lo general, para detectar los picos cruzados de HN intercambiables por agua en el espectro, emplee una mezcla 90:10 de H2O: D2O para preparar la solución tamponada. Las concentraciones de lectina requeridas oscilan entre 0,05 y 0,2 mM, dependiendo de la disponibilidad del receptor marcado con 15N y de la relación señal-ruido necesaria.
NOTA: La proteína debe ser estable durante todo el tiempo experimental sin generación visible de precipitado en el tubo de RMN. Además, debe ser puro y soluble en el tampón seleccionado. La asignación completa de 1H y 15N de los picos transversales de HSQC debe haberse realizado previamente de modo que cada pico cruzado en el espectro de HSQC se identifique con una etiqueta correspondiente al residuo de aminoácido específico. - A partir de esta preparación, transfiera un volumen total de 0,6 mL a un tubo de RMN de 5 mm.
- Ajuste el instrumento de RMN a la temperatura requerida. Consulte el paso 1.1.3 y siga las mismas operaciones.
- Cree un nuevo conjunto de datos. Consulte el paso 1.1.4 y repita las operaciones.
- Inserte la muestra de RMN en la sonda como se describe en el paso 1.1.5.
- Bloquee la señal de solvente. Para iniciar el procedimiento de bloqueo, utilice el comando bloqueo y seleccione el disolvente adecuado en el menú. La señal de bloqueo se puede rastrear en la ventana de bloqueo. Ajuste la ganancia de bloqueo para que la señal de bloqueo sea visible en la ventana de bloqueo.
- Complete el proceso de ajuste y emparejamiento automáticamente (a través del comando atma) o manualmente (el comando atmm abrirá la ventana de control ATM para ajustar la curva de oscilación).
- Establezca las cuñas óptimas mediante la herramienta TopShim. Utilice el comando topshim gui. Consulte las instrucciones en el paso 1.1.8.
- Determine la longitud de pulso de 1H 90° (como se describe en el paso 1.1.9) y la frecuencia de compensación (el comando o1calib ejecutará una rutina interactiva de calibración de O1, recuperando la frecuencia de compensación). Este último parámetro es extremadamente importante cuando se emplean experimentos con esquemas de supresión de solventes.
- Cree un nuevo conjunto de datos como se describe en la sección 1.1.4. Para reducir o eliminar la interferencia de la señal H2O, utilice la secuencia de pulsos zgesgp.
- Configure el experimento modificando varios parámetros en la ventana AcquPars.
- Introduzca la longitud de pulso de 1H 90° y el desplazamiento (o1) como se determinó anteriormente, y establezca el número de escaneos (NS) en 32 y la ventana espectral (SW) en alrededor de 12 ppm.
- Determine el nivel de potencia del pulso con forma utilizando la herramienta Forma disponible en la barra de menú Topspin.
- Ajuste la ganancia del receptor con el comando automático rga.
- Adquiera el experimento utilizando el comando zg y procese el FID resultante para obtener el espectro de RMN de 1H.
- Cree un nuevo conjunto de datos que se utilizará para adquirir el experimento1 H-15 N HSQC NMR. En la pestaña AcquPars, seleccione el programa de pulsos hsqcetfpf3gp disponible en el catálogo de programas de pulsos.
- Configura el experimento. Cargue las formas, potencias y tiempos predeterminados usando el comando getprosol. A continuación, actualice los valores de la longitud de pulso de 1H 90° y el desplazamiento.
- Defina los siguientes parámetros.
- Ajuste el retardo de relajación entre 1 y 5 s.
- Establezca el número de exámenes en un múltiplo de 4. Por lo general, se establece en 8, 16, 32 o 64 para obtener la relación señal-ruido adecuada.
- Establezca el número de escaneos ficticios en 128.
- Establezca el número de puntos en F2 en 1k, 2k o 4k.
- Establezca el número de puntos en F1: el número de incrementos t1 que se utilizarán. Dependiendo de la ventana espectral, esto está entre 128 y 256.
- Ajuste el centro de la ventana espectral en la dimensión 15N a δ 117 ppm y configure el ancho espectral correspondiente a 36 ppm. Estos valores deben optimizarse para cada sistema en particular.
- Ajuste la ganancia del receptor para evitar el desbordamiento (mediante el comando rga )
- Calcula el tiempo total del experimento. Un tiempo experimental típico es de aproximadamente 1 h.
- Escriba zg para enviar el experimento para su adquisición.
NOTA: Compruebe siempre que el experimento se está ejecutando correctamente después de unos minutos. - Procese el FID utilizando el comando xfb. Lleve a cabo la corrección de línea base utilizando el comando abs2 y correcciones de fase en la pestaña Proceso. Para fasear manualmente, haga clic en el submenú de ajuste de fase y luego seleccione varios picos cruzados de los espectros 2D. A continuación, aplique secuencialmente correcciones de cero y de primer orden tanto a las filas como a las columnas haciendo clic y arrastrando el botón correspondiente. Guarde los resultados de la fase.
- Guarde el espectro 2D resultante.
- Prepare una solución madre altamente concentrada del ligando. Los valores típicos son 50-100 mM.
- A partir de la solución madre altamente concentrada del glicano, transfiera el volumen correspondiente (unos pocos microlitros) al tubo de RMN que contiene el receptor para obtener la relación molar proteína-ligando deseada y registrar los espectros.
NOTA: Este paso inicia la serie de valoración, en la que el ligando se valora en la muestra de proteína. Se deben determinar las proporciones proteína-ligando adecuadas para cada caso particular. Si la afinidad de unión es completamente desconocida, se recomienda utilizar cantidades subestequiométricas del ligando en los puntos iniciales. - Realice los pasos 2.1.1 a 2.1.19 para la muestra recién preparada.
- Repita los pasos 2.1.21 y 2.1.22 para muestras con proporciones proteína-ligando crecientes.
NOTA: El ajuste preciso de los datos de la serie de valoración requiere la adquisición de múltiples experimentos de 1 H-15N-HSQC, que cubren una amplia gama de proporciones proteína-ligando, incluidas las necesarias para lograr la saturación de proteína.
- Prepare la muestra con la lectina de interés. Asegúrese de que el receptor esté completamente marcado con 15N en cada residuo de aminoácidos, tanto en la columna vertebral como en las cadenas laterales. Por lo general, para detectar los picos cruzados de HN intercambiables por agua en el espectro, emplee una mezcla 90:10 de H2O: D2O para preparar la solución tamponada. Las concentraciones de lectina requeridas oscilan entre 0,05 y 0,2 mM, dependiendo de la disponibilidad del receptor marcado con 15N y de la relación señal-ruido necesaria.
- Análisis
- Visualice el espectro HSQC 2D procesado para las especies apo utilizando el software adecuado: TopSpin, MestReNova y CCPNMR son programas adecuados para manejar datos de RMN.
NOTA: Este es el espectro de huellas dactilares de la proteína. Los cambios químicos observados de 1H y 15N dependen del entorno químico correspondiente de cada aminoácido, que depende en gran medida de la estructura 3D de la proteína. Este espectro se denomina espectro de huellas dactilares de proteínas. Un espectro HSQC 2D 1 H-15N bien disperso en el que todos los picos cruzados muestran intensidades uniformes sugiere fuertemente la presencia de una proteína19 bien plegada. - Genere la lista de frecuencias de 1H y 15N para todos los picos cruzados. El uso de programas informáticos complementarios, como el programa20 del CCPNMR, puede ayudar en el proceso.
- Superponga el espectro de los primeros o segundos puntos de valoración al de la proteína apo.
- Para hacer eso, abra el espectro 2D correspondiente al estado apo, haga clic en la pestaña Visualización múltiple y luego agregue el segundo espectro 2D. La inspección visual de ambos espectros proporciona información sobre la existencia de interacción entre el ligando y la proteína.
NOTA: Desde la perspectiva de la proteína, la existencia de unión proporciona cambios en el entorno químico de los aminoácidos directamente involucrados en el evento de reconocimiento, con las perturbaciones de cambio químico concomitantes (CSP).
- Para hacer eso, abra el espectro 2D correspondiente al estado apo, haga clic en la pestaña Visualización múltiple y luego agregue el segundo espectro 2D. La inspección visual de ambos espectros proporciona información sobre la existencia de interacción entre el ligando y la proteína.
- Repita los pasos 2.2.2 y 2.2.3 para cada punto de valoración, generando listas de las frecuencias 1H y 15N para todos los picos cruzados en los diferentes espectros, correspondientes a diferentes relaciones molares proteína-ligando.
NOTA: Los cambios químicos en cada punto de valoración se pueden medir sin necesidad de realizar ninguna nueva asignación de picos cruzados. En el caso del régimen de intercambio rápido, comúnmente observado en las interacciones lectina:glicano, simplemente se puede seguir el movimiento progresivo de los picos a lo largo de la valoración. - Compruebe que, para el último punto de valoración, básicamente no haya perturbaciones de desplazamiento químico con respecto a la adición anterior. Este hecho es indicativo de que el sitio de unión a la proteína ha sido saturado con el ligando, que se encuentra en alto exceso.
- Calcule las perturbaciones máximas de desplazamiento químico (maxCSP) utilizando la siguiente ecuación:
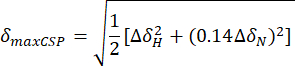
ΔH y ΔδN son las diferencias de desplazamiento químico en las frecuencias 1H y 15N entre el estado apo y el último punto de valoración, respectivamente. - Represente las perturbaciones máximas de desplazamiento químico (maxCSP) en el eje y vertical de una gráfica 2D frente al residuo de aminoácidos correspondiente (en el eje x horizontal).
- Realice una inspección visual de los residuos de aminoácidos que muestran la CSP máxima entre los estados unidos y apo de la proteína. Es muy probable que pertenezcan al sitio de unión o sean vecinos de él.
- Si la estructura 3D de la proteína está disponible, abra el PDB correspondiente con el software adecuado, como PyMOL o BIOVIA Discovery studio. Estos programas de visualización molecular son ampliamente utilizados en aplicaciones de biología estructural. Seleccione los residuos que muestren el maxCSP más alto (por encima del doble de la desviación estándar) con un color determinado para localizar el sitio de unión putativo.
- En el caso de un régimen de intercambio rápido, estime la constante de disociación (KD) a partir de un ajuste de mínimos cuadrados no lineal de la CSP observada para los picos cruzados de HSQC 1 H-15N en cada punto (Δδobs) frente a la concentración particular de proteína [P] y ligando [L] en ese punto:
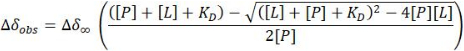
NOTA: Esta ecuación se puede aplicar a aquellos picos cruzados que muestran señales aisladas claras. Los valores obtenidos se promedian para proporcionar la estimación de KD.
- Visualice el espectro HSQC 2D procesado para las especies apo utilizando el software adecuado: TopSpin, MestReNova y CCPNMR son programas adecuados para manejar datos de RMN.
Resultados
En este trabajo, presentamos un protocolo para la explotación de experimentos de 1H-STD NMR y 1 H-15N HSQC para desentrañar los detalles de la interacción de unión entre lectinas y pequeños oligosacáridos. Se incluyen los resultados obtenidos en el análisis del reconocimiento molecular de LacNAc por hGalectina-7 (hGal-7), que sirven como ejemplo ilustrativo de la implementación exitosa del protocolo y la efectividad de estas metodologías de RMN para estudiar los detalles finos del proceso de reconocimiento molecular. La Figura 3 muestra el espectro de RMN de 1H-STD para la interacción de LacNAc con hGal-7. La existencia de señales de RMN de ETS indica unión (Figura 3A). Además, solo aparecen las señales que pertenecen a los protones en estrecho contacto con la proteína, lo que permite delinear el epítopo de unión (Figura 3B). La Figura 4 destaca cómo el espectro HSQC 1 H-15N de una proteína se puede utilizar como su huella dactilar, y la Figura 5 ilustra la aplicación de experimentosde titulación de coherencia cuántica única heteronuclear (HSQC) 1 H-15 N para definir la perturbación del desplazamiento químico de los grupos amida de la columna vertebral de hGalectina-7 tras la unión de LacNAc. Estos datos no solo revelan la existencia de interacción, sino que también delinean la interfaz de unión de la lectina. La Figura 6 demuestra cómo el análisis de los datos de titulación permite estimar la afinidad de unión de LacNAc por hGalectin-7, que se encuentra en el rango micromolar alto. Este hallazgo es consistente con los resultados obtenidos con técnicas alternativas.
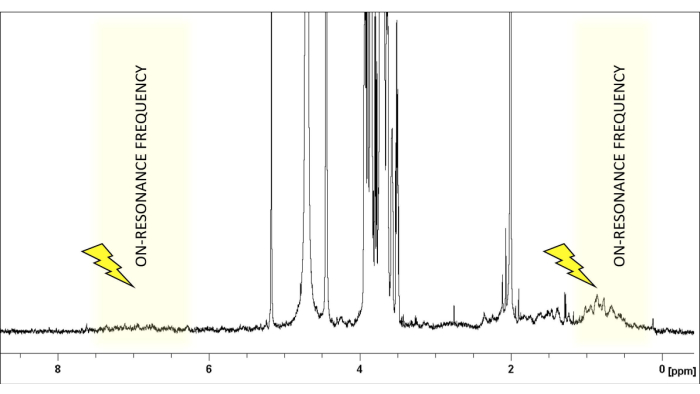
Figura 1: La selección de la frecuencia de resonancia. Se muestra el espectro de RMN-H de LacNAc:hGal-7 con una relación 50:1 en solución salina tamponada con fosfato deuterado a pH 7,4. Las señales del ligando (LacNAc) están confinadas en la región entre 2,0 y 5,2 ppm. La frecuencia de saturación se selecciona cuidadosamente para garantizar la ausencia de protones ligandos dentro de un rango de 1-2 ppm, lo que permite la irradiación selectiva de los protones de la proteína. Haga clic aquí para ver una versión más grande de esta figura.
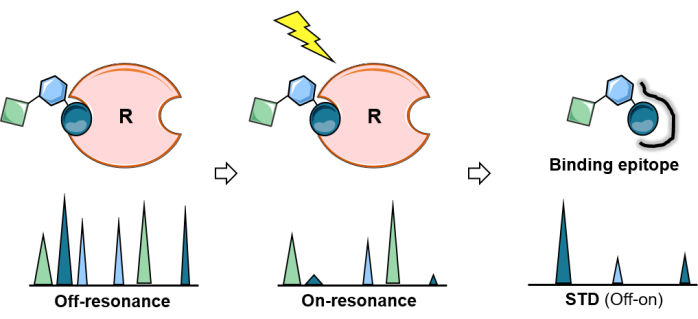
Figura 2: El experimento de RMN de ETS. Representación esquemática del experimento STD: el primer espectro (off-resonancia) sirve de referencia mientras que en el segundo (on-resonancia) se realiza la saturación de proteínas. La saturación se propaga eficientemente a través de toda la proteína y se transfiere a los protones del ligando en estrecho contacto con la proteína. El espectro de diferencia resultante (espectro STD) produce solo aquellas resonancias que han experimentado saturación. El análisis del experimento STD permite el mapeo de epítopos del azúcar aglutinante. Haga clic aquí para ver una versión más grande de esta figura.
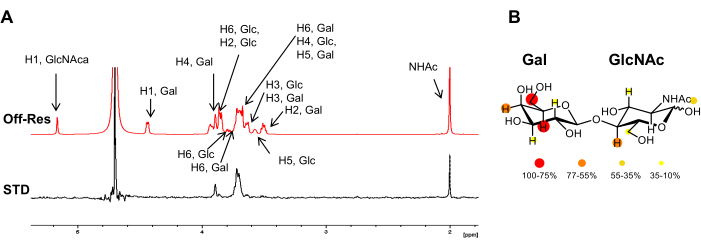
Figura 3: Análisis de unión desde la perspectiva del ligando. (A) Superposición de los espectros de off-resonancia y 1h STD-NMR para la interacción de LacNAc con hGal-7. En el espectro de las ETS, solo aparecen las señales que pertenecen a los protones en contacto cercano con la proteína. La anotación de las resonancias 1H del ligando se informa en el espectro fuera de resonancia. (B) Las intensidades relativas de STD se mapearon en color en la estructura química de LacNAc. Haga clic aquí para ver una versión más grande de esta figura.
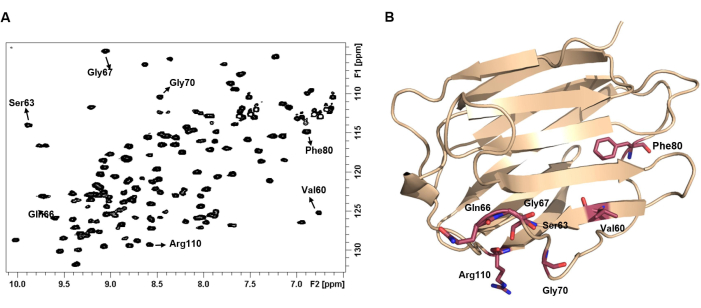
Figura 4: El espectro HSQC 1 H-15N de una proteína representa su huella dactilar. (A) 1espectro HSQC H-15N de 100 μM de hGal-7 en forma apo. El espectro se registró a 25 °C. Algunos picos cruzados de NH se anotaron con la etiqueta de su aminoácido correspondiente. (B) Cada par NH muestra un cambio químico único que depende del entorno químico y, en consecuencia, de la estructura 3D de la proteína. Haga clic aquí para ver una versión más grande de esta figura.
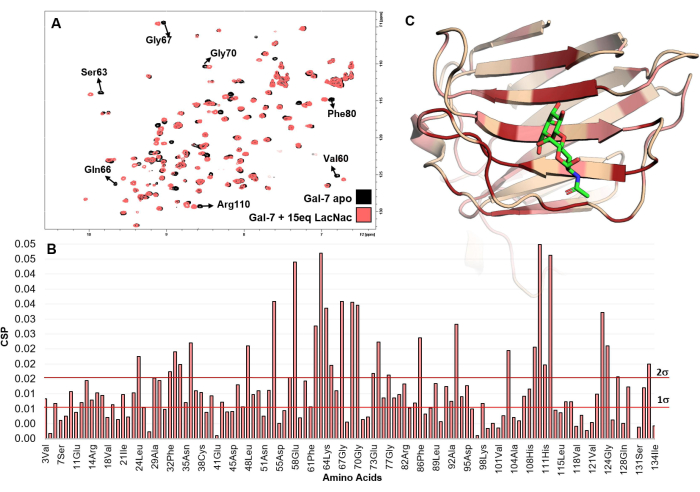
Figura 5: Análisis de unión desde la perspectiva de la proteína. (A) Se muestra la superposición de los espectros HSQC de 1 H-15N registrados para la valoración de LacNAc en una solución de hGal-7. La inspección de los espectros, donde varios picos cruzados experimentan cambios en el desplazamiento químico, indica claramente la interacción. (B) El gráfico de las perturbaciones máximas de desplazamiento químico (maxCSP) de las señales de amida de la columna vertebral deducidas de la titulación de LacNAc (15 equivalentes) con hGal-7. (C) Los aminoácidos más perturbados de hGal-7, de acuerdo con el análisis CSP, se mapean en la estructura PDB de 5 gal. En el modelo 3D, la coloración roja se refiere al valor de CSP superior a 2σ, mientras que la rosa a valores entre 1σ y 2σ. Es probable que la región coloreada represente el sitio de unión. Haga clic aquí para ver una versión más grande de esta figura.
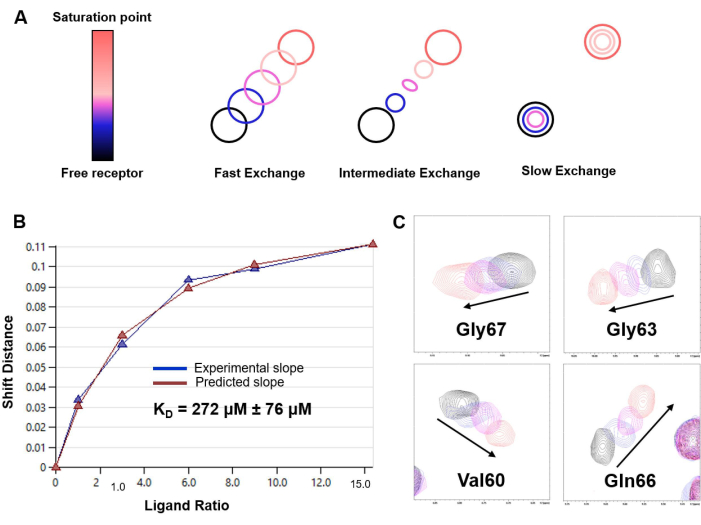
Figura 6: Determinación de KD basada en experimentos de valoración de HSQC 1 H-15N. (A) Representación del patrón de valoración basada en HSQC de 1 H-15N en función de la tasa de intercambio químico en la escala de tiempo de RMN del sistema en el estudio (rápido, intermedio o lento). Se observó un régimen de intercambio rápido en el caso de la interacción LacNAc/hGal-7. (B) Curva de ajuste y estimación de KD obtenida a partir del análisis de CSP a diferentes concentraciones de ligandos para el sistema modelo de hGal-7 y disacárido de LacNAc. El KD estimado se reporta con el error correspondiente como un promedio de los datos para 20 aminoácidos diferentes; (C) Fragmentos de los espectros N-HSQC de 1 H,15que muestran el desplazamiento de los picos cruzados seleccionados durante la valoración. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La RMN de diferencia de transferencia de saturación (STD-RMN) se ha convertido en el método de RMN más utilizado y versátil para estudiar las interacciones ligando-proteína. Como se muestra arriba, se basa en el fenómeno de transferencia de saturación, y la configuración experimental implica la adquisición de dos espectros unidimensionales (1D) 1H: el espectro de resonancia de entrada y el espectro de resonancia de apagado. Durante el experimento de resonancia, la saturación de protones específicos de la proteína se logra mediante la aplicación de un tren de pulsos de radiofrecuencia de baja potencia durante un cierto período (el tiempo de saturación suele oscilar entre 1 y 3 s). Para evitar la saturación directa del ligando, la frecuencia y la longitud de los pulsos de saturación están optimizadas para irradiar selectivamente protones específicos de la proteína; es decir, deben aplicarse a una frecuencia vacante de cualquier señal de ligando y con una longitud adecuada (Figura 1). Como regla general para pulsos de saturación de 50 ms, se debe mantener una diferencia de 1 ppm desde la región de saturación hasta las señales de ligando más cercanas. Generalmente, los pulsos de saturación selectiva aplicados en la región alifática de la proteína proporcionan mayores efectos de saturación. Alternativamente, los protones aromáticos (6-7 ppm) también se pueden irradiar si la molécula del ligando no contiene ninguna señal aromática. Esto es muy útil para los glicanos naturales, ya que no tienen grupos aromáticos. Una vez que una determinada región de la proteína se irradia selectivamente, la saturación se propaga a lo largo de la proteína a través de la relajación cruzada dipolar 1 H-1H (difusión de espín). Eventualmente, la saturación alcanza los protones de la proteína en el sitio de unión, que luego se transfiere a los protones de azúcar que están en contacto cercano (r < 5 Å) con el receptor a través de NOE intermoleculares 1 H-1H. Obviamente, la intensidad de las señales de los protones del ligando saturado disminuye. Después de recibir la saturación, debido a la cinética de unión, los ligandos unidos transitoriamente (se requiere un intercambio rápido) se disocian y la información de saturación se acumula en el estado libre. Debido a este proceso, los espectros de resonancia de RMN presentan señales disminuidas (Figura 2).
Para exhibir claramente esta perturbación de intensidad de los núcleos 1H de un glicano de unión, se adquiere un espectro de RMN de protones de control (fuera de resonancia) en el que la saturación se aplica lejos de cualquier receptor o señal de carbohidratos (generalmente entre 40-100 ppm), en las mismas condiciones. El espectro 1D sustraído entre la off-resonancia y la on-resonancia muestra exclusivamente las señales de los núcleos 1H del ligando que tienen intensidades modificadas: aquellos que estaban lo suficientemente cerca del sitio de unión del receptor para recibir la magnetización (Figura 2).
Sin embargo, no todos los núcleos 1H del carbohidrato unido reciben la misma cantidad de saturación. Teóricamente, la transferencia de magnetización del receptor al ligando unido depende de la distancia (1/r6). Esto significa que las intensidades de saturación transferida entre los núcleos de glicano 1H contienen información sobre las proximidades espaciales entre los protones del ligando y los del receptor, y las intensidades de RMN de STD son mayores para aquellos protones que están más cerca del receptor. En consecuencia, el experimento de RMN de ETS también permite determinar el epítopo de unión del carbohidrato (Figura 2 y Figura 3) ya que los protones del ligando que se encuentran más cerca de la superficie de la proteína muestran intensidades más altas que aquellos que no participan directamente en la unión.
El experimento se puede aplicar a sistemas con afinidad débil-media, raramente a sistemas con afinidades fuertes en el rango bajo de μM o nM. De hecho, requiere que la tasa de disociación sea rápida en la escala de tiempo de relajación. De lo contrario, la información de transferencia de saturación se pierde a través de la relajación antes de que el ligando se disocie.
Por otro lado, los experimentos de RMN basados en proteínas son únicos para desentrañar la interacción ligando-proteína con precisión a nivel de aminoácidos sin resolver las estructuras de resolución atómica. Examina directamente los fenómenos de reconocimiento molecular en solución sin necesidad de cocristalización. El mapeo del análisis CSP es excepcionalmente potente para descubrir ligandos y mapear el sitio de unión a proteínas (Figura 4 y Figura 5). Este método es aplicable a cualquier rango de afinidades entre el rango de mM y nM, incluso para sistemas donde la tasa de cambio es lenta en la escala de tiempo de cambio químico21.
Sin embargo, es probable que este enfoque no funcione para proteínas con pesos moleculares superiores a 30-40 kDa debido a problemas de relajación. A continuación, se puede utilizar la alternativaTROSY 18 , que es especialmente potente cuando se combina con la deuteración de proteínas. Además, la proteína debe marcarse uniformemente con 15N (y otra muestra doblemente marcada con 13C y 15N para poder completar la asignación de la columna vertebral requerida). Por lo tanto, las condiciones de expresión de proteínas, incluido el sistema de expresión correspondiente, deben optimizarse para poder obtener cantidades de miligramos de proteína. Las proteínas que muestran una tendencia a oligomerizarse o agregarse tampoco son adecuadas para este análisis. El instrumento utilizado en este documento para registrar los datos de RMN es un espectrómetro Bruker de 800 MHz equipado con una criosonda TCI. Sería muy difícil utilizar esta metodología utilizando instrumentos por debajo de 600 MHz o sin una sonda criogénica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a la Agencia Estatal de Investigación de España por la Acreditación del Centro de Excelencia Severo Ochoa CEX2021-001136-S, financiada por MCIN/AEI/10.13039/ 501100011033, y al CIBERES, una iniciativa del Instituto de Salud Carlos III (ISCIII, Madrid, España). También agradecemos a la Comisión Europea por el proyecto GLYCOTWINNING.
Materiales
| Name | Company | Catalog Number | Comments |
| 5 mm Shigemi microtube set mat | CortecNet SAS | S30BMS-005B | |
| Alpha-Lactose-Agarose | Sigma-Aldrich Química S.L. | 7634-5ML | |
| Ammonium chloride (15 N, 99%) | LC-0179-N-50G | Tracer Tecnologías Analíticas S.L | |
| Ampicillin (Sodium Salt) | Melford Laboratories LTD | A40040 | |
| BIOVIA Discovery studio | BIOVIA, Dassault Systèmes | ||
| BL21(DE3) Chemically Competent Cells | Merck Life Science, S.L.U. | CMC0014-40X40UL | |
| Centrifuge | Beckman Coulter | Allegra X-22R | |
| D2O | Cambridge Isotope Laboratories, Inc. | DLM-4-1000 | |
| Incubator | Eppendorf | Innova 42 | |
| IPTG (Isopropyl ß-D-1-thiogalactopyranoside) | VWR International Eurolab S.L. | VW437144N | |
| LacNAc | Elicityl | GLY008 | |
| Luria Bertani (LB) Broth | Merck Life Science, S.L.U. | 3397-1KG | |
| Matraz Erlenmeyer B N 5000 CC | VWR International Eurolab S.L. | 214-1137 | |
| PBS 10x | Bio-Rad | 1610780 | |
| PyMOL | PyMOL Molecular Graphics System | Version 2.0 Schrödinger | |
| Sonicator | Sonics & Materials, Inc. | VC 505 | |
| Superconducting NMR magnet | Bruker | 600 MHz AVANCE III | |
| Superconducting NMR magnet | Bruker | 800 MHz AVANCE III |
Referencias
- Solís, D., et al. A guide into glycosciences: How chemistry, biochemistry and biology cooperate to crack the sugar code. Biochim Biophys Acta. 1850 (1), 186-235 (2015).
- Poveda, A., Jimenez-Barbero, J. NMR studies of carbohydrate-protein interactions in solution. Chem Soc Rev. 27, 133-144 (1998).
- Kogelberg, H., Solís, D., Jiménez-Barbero, J. New structural insights into carbohydrate-protein interactions from NMR spectroscopy. Curr Opin Struct Biol. 13 (5), 646-653 (2003).
- Widmalm, G. Glycan shape, motions, and interactions explored by NMR spectroscopy. JACS Au. 4 (1), 20-39 (2024).
- Marchetti, R., et al. 34;Rules of Engagement" of protein-glycoconjugate interactions: A molecular view achievable by using NMR spectroscopy and molecular modeling. ChemistryOpen. 5 (4), 274-296 (2016).
- Ardá, A., Jiménez-Barbero, J. The recognition of glycans by protein receptors. Insights from NMR spectroscopy. Chem Commun. 54 (38), 4761-4769 (2018).
- Gimeno, A., Valverde, P., Ardá, A., Jiménez-Barbero, J. Glycan structures and their interactions with proteins. A NMR view. Curr Opin Struct Biol. 62, 22-30 (2020).
- Cañada, F. J., et al. Conformational and structural characterization of carbohydrates and their interactions studied by NMR. Curr Med Chem. 29 (7), 1147-1172 (2022).
- Valverde, P., Quintana, J. I., Santos, J. I., Ardá, A., Jiménez-Barbero, J. Novel NMR avenues to explore the conformation and interactions of glycans. ACS Omega. 4, 13618-13630 (2019).
- Jiménez-Barbero, J., Asensio, J. L., Cañada, F. J., Poveda, A. Free and protein-bound carbohydrate structures. Curr Opin Struct Biol. 9 (5), 549-555 (1999).
- Quintana, J. I., Atxabal, U., Unione, L., Ardá, A., Jiménez-Barbero, J. Exploring multivalent carbohydrate-protein interactions by NMR. Chem Soc Rev. 52 (5), 1591-1613 (2023).
- Roldós, V., Cañada, F. J., Jiménez-Barbero, J. Carbohydrate-protein interactions: a 3D view by NMR. Chembiochem. 12 (7), 990-1005 (2011).
- Unione, L., Ardá, A., Jiménez-Barbero, J., Millet, O. NMR of glycoproteins: profiling, structure, conformation, and interactions. Curr Opin Struct Biol. 68, 9-17 (2021).
- del Carmen Fernández-Alonso, M., Díaz, D., Berbis, M. A., Marcelo, F., Cañada, J., Jiménez-Barbero, J. Protein-carbohydrate interactions studied by NMR: from molecular recognition to drug design. Curr Protein Pept Sci. 13 (8), 816-830 (2012).
- Angulo, J., Nieto, P. M. STD-NMR: application to transient interactions between biomolecules-a quantitative approach. Eur Biophys J. 40 (12), 1357-1369 (2012).
- Mayer, M., Meyer, B. Group epitope mapping by saturation transfer difference NMR to identify segments of a ligand in direct contact with a protein receptor. J Am Chem Soc. 123 (25), 6108-6117 (2001).
- Williamson, M. P. Using chemical shift perturbation to characterise ligand binding. Prog Nucl Magn Reson Spectrosc. 73, 1-16 (2013).
- Fernández, C., Adeishvili, K., Wüthrich, K. Transverse relaxation-optimized NMR spectroscopy with the outer membrane protein OmpX in dihexanoyl phosphatidylcholine micelles. Proc Natl Acad Sci U S A. 98 (5), 2358-2363 (2001).
- Yee, A., Gutmanas, A., Arrowsmith, C. H. Solution NMR in structural genomics. Curr Opin Struct Biol. 16 (5), 611-617 (2006).
- Skinner, S. P., Fogh, R. H., Boucher, W., Ragan, T. J., Mureddu, L. G., Vuister, G. W. CCPNMR AnalysisAssign: a flexible platform for integrated NMR analysis. J Biomol NMR. 66 (2), 111-124 (2016).
- Gimeno, A., et al. Minimizing the entropy penalty for ligand binding: Lessons from the molecular recognition of the histo blood-group antigens by human Galectin-3. Angew Chem Int Ed Engl. 58 (22), 7268-7272 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados