Method Article
Glikan-Protein Etkileşimlerinin Çözülmesi: Kurtarmaya Nükleer Manyetik Rezonans (NMR)
Bu Makalede
Özet
Burada, çözeltideki protein-glikan etkileşimlerini karakterize etmeyi amaçlayan bir dizi NMR deneyinin elde edilmesini, işlenmesini ve analizini detaylandıran bir protokol sunuyoruz. En yaygın ligand bazlı ve protein bazlı metodolojiler ana hatlarıyla belirtilmiştir ve bu da şüphesiz yapısal glikobiyoloji ve moleküler tanıma çalışmaları alanlarına katkıda bulunmaktadır.
Özet
Glikanların proteinlerle etkileşimleri, sağlık ve hastalıkla ilgili birçok olayı modüle eder. Aslında, bu tanıma olaylarının kurulması ve biyolojik sonuçları, her iki partnerin üç boyutlu yapılarının yanı sıra, dinamik özellikleri ve karşılık gelen hücre bölmeleri üzerindeki sunumları ile yakından ilgilidir. NMR teknikleri, bu özellikleri çözmek için benzersizdir ve aslında, glikanların ortak reseptörleri ile bağlanma olaylarını izlemek için çeşitli NMR tabanlı metodolojiler geliştirilmiş ve uygulanmıştır. Bu protokol, NMR-glikobiyoloji alanında kullanılan en güçlü NMR metodolojilerinden ikisini, 1H-Doygunluk transfer farkı (STD) ve 1 H,15N-Heteronükleer tek kuantum tutarlılık (HSQC) titrasyon deneylerini elde etmek, işlemek ve analiz etmek için prosedürleri ana hatlarıyla belirtir. Gerçekten de, bir araya getirildiklerinde, moleküler tanıma süreçlerinin hem yapısal hem de dinamik yönlerini aydınlatmak için güçlü bir araç seti sunarlar. Bu kapsamlı yaklaşım, glikan-protein etkileşimleri hakkındaki anlayışımızı geliştirir ve kimyasal glikobiyoloji alanındaki araştırmaların ilerlemesine katkıda bulunur.
Giriş
Glikanların moleküler olarak tanınması, sağlık ve hastalıkla ilgili birçok süreç için gereklidir. Glikanlar için biyolojik reseptörlerin (lektinler, antikorlar, enzimler) özgüllüğü ve seçiciliği, büyük ölçüde entalpi (CH-π ve van der Waals, hidrojen bağları, elektrostatik) ve entropinin (hidrofobiklik, dinamik, çözünme-çözünme) çeşitli bileşenleri arasındaki istikrarsız dengenin ayarlanmasına bağlıdır1.
Glikanların büyük kimyasal çeşitliliği ve dinamik doğası göz önüne alındığında, NMR yöntemleri 25 yıldan fazla bir süredir glikan etkileşimlerini incelemek için yaygın olarak kullanılmaktadır2, çünkü bu metodolojiler, gerekli etkileşim kanıtları diğer metodolojiler kullanılarak elde edilemese bile, atomik çözünürlükte 3,4 kesin ayrıntılara sahip moleküler tanıma olayları hakkında mükemmel bilgiler sağlar. Kilit nokta olarak, NMR çok yönlüdür ve dinamik olayların atomik düzeyde, farklı zaman ölçeklerinde incelenmesine izin verir, bu da çözeltideki glikanların yapısını, konformasyonunu ve dinamiklerini incelemek için açık ara en iyi tekniği oluşturur. Bununla birlikte, bu bilgilerin çözülmesi, dikkatli veri analizi ile birlikte iyi tanımlanmış stratejilerin kullanılmasını gerektiren oldukça karmaşık bir süreç olabilir5.
NMR teknikleri çeşitlidir ve gerçekten de glikan-protein etkileşimlerini çözmek için kullanılabilecek birçok metodoloji vardır6. Burada, glikan-reseptör etkileşimlerini 7,8 deşifre etmek için şu anda kullanılan iki temel NMR yaklaşımını açıklıyoruz ve anahtar glikan epitopunun yanı sıra protein bağlanma bölgesinin9 sunumunun nasıl çözüleceğine vurgu yapıyoruz.
Herhangi bir moleküler tanıma olayında, bir reseptör belirli bir ligand'a bağlandığında, bağlanma10'daki katılımcıların birçok NMR parametresini etkileyen bir kimyasal değişim süreci vardır. Bu nedenle, NMR perspektifinden bakıldığında, etkileşim ya glikan ligandının bakış açısından ya da protein reseptörü11'in bakış açısından izlenebilir. Genel olarak konuşursak, protein reseptörü büyük bir biyomoleküldür (ns zaman ölçeğindeki oranlarla yavaş dönme hareketi ve dolayısıyla hızlı enine gevşeme), etkileşen glikan ise küçük-orta büyüklükte bir molekül olarak düşünülebilir (hızlı dönme hareketi, ps zaman ölçeğindeki oranlarla ve yavaş enine gevşeme)12. Standart bir perspektiften bakıldığında, glikanın NMR sinyalleri dar, reseptörünkiler ise geniştir13.
Ligand bazlı NMR yöntemleri, serbest durumdan bağlı durumageçerken birçok glikan NMR parametresinin yaşadığı dramatik değişime dayanır 14. STD-NMR, çözelti durumunda bağlanmanın varlığının çıkarılmasından glikan bağlayıcı epitopun belirlenmesine kadar çeşitli glikan bağlanma özelliklerini15 değerlendirmek için en çok kullanılan deneysel NMR tekniğidir; yani, protein reseptörü16 ile temas halinde olan ligand atomları.
Alternatif olarak, reseptör bazlı NMR yöntemleri, apo durumu17 için kaydedilenlere göre glikan varlığında protein reseptörünün sinyallerinde meydana gelen değişiklikleri izler. Bunlar esas olarak, her iki durum arasındaki protein sinyallerinin kimyasal kayma bozulmalarını taramaya odaklanmıştır. En yaygın olarak kullanılan deney 1 H-15N HSQC veya TROSY alternatifleri18'dir.
Her iki yaklaşımın kombinasyonu, NMR'nin çok çeşitli afiniteler gösteren birçok farklı sisteme uygulanmasına izin verir. Bununla birlikte, reseptör bazlı NMR yöntemleri için, liganda dayalı olanların aksine, nispeten büyük miktarda çözünür, toplanmamış, kararlı izotop etiketli (15N) protein mevcut olmalıdır.
Burada her iki yöntemi de güçlü ve zayıf yönlerini vurgulayarak açıklıyoruz. Protokolde açıklanan temel adımların Bruker spektrometrelerinin kullanımı için örnek teşkil ettiğini unutmayın. Sonuç olarak, komutlar ve parametre adları TopSpin'de (Bruker'in spektrometreleri kontrol yazılımı) kullanılanlarla uyumludur.
Protokol
1. Doygunluk transfer farkı NMR (STD-NMR)
NOT: Sonraki satırlar, STD-NMR deneylerini elde etmek, işlemek ve analiz etmek için temel prosedürleri özetlemektedir. Bu adımlar, tekniğin ligand bağlanmasını tespit etmek ve ligand bağlama epitopunu aydınlatmak için faydasını örneklendirmeye hizmet eder. NMR deneylerinin tasarımı ve edinimi hakkında daha derin bir anlayış için lütfen NMR cihazıyla birlikte verilen ilgili üretici kılavuzuna bakın.
- Edinim
- Numuneyi protein-ligand kompleksi ile hazırlayın. 0.01 ile 0.2 mM arasında değişen protein konsantrasyonları ile 10: 1 ile 100: 1 arasında glikan: lektin molar oranları kullanın. HGalectin-7'nin LacNAc ile etkileşimi için, pH 7.4'te döteryumlu fosfat tamponlu salin içinde 50: 1 protein: ligand oranı kullanın.
NOT: Protein reseptörü saf olmalı ve tercih edilen tamponda çözünür olmalıdır (STD-NMR deneyleri durumunda, olası 1H NMR sinyal girişimini azaltmak için karşılık gelen tamponun döteryumlu versiyonları tercih edilir). Proteinin konsantrasyonu, 280 nm'de absorbansı ölçmek için bir spektrofotometre kullanılarak önceden kontrol edilir. - Hazırlanan çözeltiden, bir pipet kullanarak toplam 0.6 mL'lik bir hacmi 5 mm'lik bir NMR tüpüne aktarın.
- NMR cihazını gerekli sıcaklıkta hazırlayın (yaygın deney sıcaklıkları 10 °C ile 45 °C arasındadır). edte komutunu kullanarak sıcaklık kontrol monitörünü açın ve istenen sıcaklığı ayarlayın. HGalectin-7 / LacNAc çalışması için sıcaklık 25 ° C'ye ayarlandı.
- zg darbe dizisini içeren yeni bir veri kümesi oluşturun.
- Basit bir işlem için, mevcut bir denemeyi açın ve edc komutunu yazın. Bir iletişim kutusu belirir, başlığı, özellikleri (numune özellikleri, çözücü) ve deneyin bazı parametrelerini tanımlayın.
- Orijinal darbe dizisinden bir değişiklik gerekiyorsa, ased (parametreler) ve AcquPars (alma parametreleri) pencerelerinde gezinin. Bu noktada, spektrometrenin kitaplığından istediğiniz darbe programını seçin.
- Standart bir 1H NMR spektrumu için, mevcut listeden zg darbe dizisini seçin.
NOT: Artan su içeriğine sahip numuneler söz konusu olduğunda, sinyal-gürültü oranını artırmak için su bastırma şemalarının kullanılması gerekebilir. Mükemmel bastırma sağlayan ancak kalan sinyallerin fazını kontrol eden uyarma şekillendirme modüllerini çıkaran zgesgp gibi darbe dizilerinin kullanılması arzu edilir. Su söndürme şemalarının türleri ve temel özellikleri hakkında ek bilgi için lütfen üreticilerin NMR eğitimine bakın.
- Numune kaldırma havasını etkinleştirerek NMR numunesini proba yerleştirin. ej komutunu kullanın, numuneyi mıknatısın üstüne yerleştirin ve ij komutunu kullanarak numune kaldırmayı devre dışı bırakın.
NOT: Numuneyi bir otomatik numune alma cihazı kullanarak mıknatısa enjekte etmek içinample, sx komutunu ve ardından NMR tüpünün otomatik sampile tepsisindeki konumuna karşılık gelen konum numarasını, n'yi kullanın. - lock komutunu yazarak ve ardından menüden uygun solventi seçerek solvent sinyalini kilitleyin.
- Numune proba yerleştirildikten sonra, otomatik modül atma veya manuel modül atmm'yi kullanarak ayarlama ve eşleştirme işlemini tamamlayın.
- topshim gui komutuyla otomatik şimlemeyi başlatın. Bu, şim boyutu 1D'nin seçileceği ve başlatılacağı bir grafik arayüz açacaktır.
NOT: İnce alan veya sıcaklık değişimlerinden kaynaklanan şim kararsızlıklarını en aza indirmek için, deney alımı için otomatik şim etkinleştirilebilir. Bu, BSMS kontrol penceresine erişerek ve autoshim'e tıklayarak gerçekleştirilebilir. Yeşil vurguya dönüşme, otomatik altimin etkinleştirildiğini gösterir. Autoshim kullanırken, potansiyel numune kararsızlık sorunlarının fark edilmemesi gerektiğini lütfen unutmayın. Bu nedenle, otomatik şim kullanıldığında dikkatli olunması önerilir. - 1H 90° darbeyi belirleyin. Bu, pulsecal komutu ile otomatik olarak gerçekleştirilebilir.
- AcquPars penceresindeki çeşitli parametreleri değiştirin. Düzenli bir 1H NMR spektrumu için, tarama sayısını (NS) 32'ye ve istenen spektral pencereyi (SW) ca'ya ayarlayın. 12 sayfa/dk.
NOT: zgesgp darbe dizisi, spektrumun ortasında merkezlenmesi gereken artık HDO sinyalini ortadan kaldırmak için çözücü bastırma için bir modül içerir. Bunun için AcquPars'ta O1'in doğru bir şekilde tanımlanması gerekir. - Otomatik rga komutuyla taşmayı önlemek için alıcı kazancını ayarlayın.
- Şimdi, zg komutunu kullanarak standart 1H NMR spektrumunu elde edin.
- Alım tamamlandıktan sonra, spektrumu efp komutu aracılığıyla işleyin. TopSpin menü çubuğunu kullanarak taban çizgisi ve faz düzeltmelerini uygulayın.
NOT: Glikanve proteinden türetilen 1 H NMR sinyalleri gözlenir (Şekil 1). Elde edilen NMR spektrumunun ayrıntılı analizi, bölüm 1.1.14'te belirtildiği gibi STD NMR deneyinin uygulanması için önerilir. - Yeni bir veri seti oluşturun ve bölüm 1.1.4'teki 1H NMR deneyi için açıklandığı şekilde kullanılacak STD NMR darbe dizisini yükleyin. Bruker cihazlarında, darbe programı kataloğunda tümü stddiffXXX olarak adlandırılan farklı darbe dizileri mevcuttur. En basit olanı (stddiff) herhangi bir su bastırma şeması veya protein bastırma filtresi içermez.
- Önemli H2O içeriğine sahip numuneler için, bir su kapısı veya uyarma şekillendirme modülü içeren stddiffgp19 veya stddiffesgp dizilerini seçin. Arka plan olarak yoğun protein NMR sinyallerine sahip bir spektrum olması durumunda, stddiffXXX.3 dizilerini seçin. Her durumda, her bir su söndürme modülü için karşılık gelen spesifik parametreleri optimize edin (yani, watergate şemalarında d19).
- STD NMR deneyi için kapalı ve açık rezonans frekanslarını tanımlayın. FQ2LIST girişinin altındaki ased penceresinin AcquPars parametrelerinde frekans listesini bulun. Hertz'de tanımlanan rezonans ve rezonans dışı frekanslar listeye manuel olarak yazılmalı ve yeni bir ad altında kaydedilmelidir. Bu yeni liste STD-NMR deneyinde kullanılacaktır.
- Tipik glikanlar için genellikle δ (1H) 0 veya 6.6 ppm civarında, glikan sinyallerinden yoksun bir spektral bölgede rezonans frekansını seçin (Şekil 1). Rezonans dışı frekansı herhangi bir ligand veya protein protonu göstermeyen bir bölgeye ayarlayın. +18000 veya -18000 Hz'e güvenle ayarlanabilir.
- Ased penceresinin AcquPars parametrelerinde doygunluk süresi boyunca kullanılacak şekilli darbeyi tanımlayın.
NOT: Birçok olasılık vardır. Gauss veya Eburp şekilleri, 50 ms'lik seçici darbenin 90° genişliği ile güvenli bir şekilde kullanılabilir. - AcquPars bölümünde ilgili parametreleri ayarlayın.
- 1H 90° darbe uzunluğunu ayarlayın.
- Şekillendirilmiş darbenin güç değerini ayarlayın ( şekil aracı aracılığıyla tahmin edilir).
- Toplam doygunluk süresini ayarlayın. 1 sn ile 4 sn arasındaki değerler düzenli olarak kullanılabilir.
- Gevşeme gecikmesini 3 s'ye ayarlayın.
- Tarama sayısını (NS) 8'in katları olarak ayarlayın. Genellikle, her frekansta 2'li setler halinde uygun sinyal-gürültü oranını elde etmek için 256, 512 veya 1024 olarak ayarlanır.
- Sahte tarama (DS) sayısını 8 olarak ayarlayın.
- F2'deki nokta sayısını 16k, 32k veya 64k olarak ayarlayın.
NOT: F2'de artan nokta sayısı, çözünürlüğün ve sinyal-gürültü oranının artmasına neden olur. Bu nedenle, en az 16k veri noktası kullanılması şiddetle tavsiye edilir. - F1'de puan sayısını ayarlayın. Bu, kullanılacak frekansların sayısıdır, bu durumda 2 (rezonans açık ve kapalı rezonans).
NOT: Konvansiyonel olarak, F2 doğrudan boyutu, serbest indüksiyon bozunmasının (FID) doğrudan örneklendiği boyutu ifade ederken, F1 dolaylı boyutu ifade eder. - rga otomatik komutuyla taşmayı önlemek için alıcı kazancını (RG) ayarlayın.
- expt komutunu kullanarak toplam deneyin süresini hesaplayın.
- Deneyi zg komutu aracılığıyla edinilmesi için gönderin.
- Her zaman birkaç dakika sonra denemenin düzgün çalışıp çalışmadığını kontrol edin.
- Numuneyi protein-ligand kompleksi ile hazırlayın. 0.01 ile 0.2 mM arasında değişen protein konsantrasyonları ile 10: 1 ile 100: 1 arasında glikan: lektin molar oranları kullanın. HGalectin-7'nin LacNAc ile etkileşimi için, pH 7.4'te döteryumlu fosfat tamponlu salin içinde 50: 1 protein: ligand oranı kullanın.
- Işleme
NOT: Yukarıda açıklanan protokol uygulandıktan sonra bir yalancı 2D spektrumu elde edilir. Satır sayısı, kullanılan frekansların sayısına karşılık gelir, tipik olarak iki: rezonans açık ve kapalı rezonans.- İlk deney için fid'yi işleyin.
- Fid numarası 1'in Fourier dönüşümünü yapın ( efp komutu aracılığıyla) ve işlenen spektrumun hedefini seçin (procno numarasını seçin). Alternatif olarak, ilk fid'yi okumak için rser 1 komutunu kullanın.
- Ardından, lb komutu (genellikle 3-5 Hz) ile satır genişletme faktörünü ve fazı ayarlayın. Manuel olarak aşama yapmak için İşlem sekmesine tıklayın ve ardından aşama alt menüsünü ayarlayın . İlgili düğmeye tıklayıp sürükleyerek sıfır ve birinci dereceden düzeltmeler yapın. Aşama sonuçlarını kaydedin. Ek olarak, abs komutu aracılığıyla temel düzeltme gerçekleştirin.
- İkinci deney için fid'i okuyun ve aynı satır genişletme faktörü ile Fourier dönüşümünü ( efp komutu aracılığıyla) yapın. Fazı aynı faz parametreleri ve temel düzeltme ile ayarlayın ve işlenen spektrumu farklı bir kodla kaydedin.
- İşlenmiş iki spektrumu çoklu fonksiyonla (komut: .md) okuyun ve çoklu görselleştirmede (Δ) bulunan düğmeyi kullanarak bunları çıkarın (rezonans dışı - rezonans açık). Yeni spektrum, farklı bir kodla kaydedilen STD NMR spektrumudur.
- STD NMR spektrumunun rezonans dışı spektrum ile üst üste bindirilmesini sağlayın.
- Kapalı rezonans spektrumunu (fid 1) açın ve çoklu ekran penceresini açmak için .md komutunu yazın. Ardından, STD spektrumunu yükleyin.
- STD NMR spektrumundaki sinyallerin frekanslarını ve yoğunluklarını (otomatik olarak sağ üst tarafta görüntülenir) karşılaştırın. Bu, proteine yakın olan protonlar ve göreceli yakınlıkları hakkında istenen bilgiyi sağlar. Bağıl yoğunluk ne kadar yüksek olursa, proteine o kadar yakındırlar (Şekil 2).
- İlgili yazılımı kullanarak rezonans dışı deneydeki yoğunlukları (integraller) ölçün. TopSpin'de Analiz Et > Bütünleştir'e gidin. Bölgeleri tanımlayın ve integralleri bir dosyaya yazın (I,0).
- Aynı parametreleri kullanarak STD NMR deneyindeki yoğunlukları (integralleri) ölçün ve bunları bir dosyaya yazın (ISTD).
- Aşağıdaki denklemi kullanarak her proton sinyali için STD değerini hesaplayın:
STD = (ISTD)/I0.
NOT: NOT: STD değerlerini hesaplamak için sinyal entegrasyonunun kullanılması, proton sinyallerinin yeterince ayrılmasını gerektirir. Oligosakkaritlerde olduğu gibi sinyal örtüşmesi meydana geldiğinde, STD değerleri, STD ve rezonans dışı spektrumlar arasındaki sinyal yoğunluğu oranı değerlendirilerek belirlenebilir. - Göreli STD'yi yüzde olarak hesaplayın. Bunu yapmak için, rezonans dışı yoğunluklar ile STD NMR spektrumundaki maksimum farkı gösteren protona %100'lük bir değer verin. Diğer protonlar için bağıl STD yoğunluklarını buna göre hesaplayın.
NOT: STD verilerinin uygun analizi, özellikle ligand bağlanma epitopunun belirlenmesi için, ligandın 1H sinyallerinin tam olarak atanmasını gerektirir. Bu nedenle, bu görevin STD spektrumlarının edinilmesinden önce tamamlanması şiddetle tavsiye edilir.
- İlk deney için fid'yi işleyin.
2. 1 H-15N HSQC deneyleri
NOT: Aşağıdaki satırlar, artan miktarlarda ligandın (oligosakkarit) varlığına yanıt olarak reseptörün (lektin) 1 H ve 15 N NMR rezonanslarının kimyasal kaymalarındaki değişiklikleri izlemek için 1 H-15N HSQC deneylerinin kullanımını detaylandırmaktadır19. Ekstrakte edilen verilere dayanan Kimyasal Kayma Pertürbasyonu (CSP) analizi, bağlanma ortaklarının tanımlanması için değil, aynı zamanda protein bağlanma arayüzünün haritalanması ve bağlanma afinitelerinin belirlenmesi için de oldukça değerlidir. NMR deneylerinin tasarımı ve edinimi hakkında daha derin bir anlayış için lütfen NMR cihazıyla birlikte verilen ilgili üretici kılavuzuna bakın.
- Edinme ve işleme
- Numuneyi ilgilenilen lektin ile hazırlayın. Reseptörün, hem omurga hem de yan zincirlerdeki her amino asit kalıntısında tam olarak 15N etiketli olduğundan emin olun. Tipik olarak, spektrumdaki su ile değiştirilebilir HN çapraz tepe noktalarını tespit etmek için, tamponlu çözeltiyi hazırlamak için 90:10 H2O: D2O karışımı kullanın. Gerekli lektin konsantrasyonları, 15 N etiketli reseptörün mevcudiyetine ve gerekli sinyal-gürültü oranına bağlı olarak 0.05ile 0.2 mM arasında değişir.
NOT: Protein, NMR tüpünde görünür bir çökelti oluşumu olmaksızın tüm deney süresi boyunca stabil olmalıdır. Ayrıca, seçilen tamponda saf ve çözünür olmalıdır. HSQC çapraz tepe noktalarının tam 1H ve 15N ataması, HSQC spektrumundaki her çapraz tepe noktasının spesifik amino asit kalıntısına karşılık gelen bir etiketle tanımlanması için daha önce gerçekleştirilmiş olmalıdır. - Bu hazırlıktan, toplam 0.6 mL'lik bir hacmi 5 mm'lik bir NMR tüpüne aktarın.
- NMR cihazını gerekli sıcaklığa ayarlayın. Adım 1.1.3'e bakın ve aynı işlemleri izleyin.
- Yeni bir veri kümesi oluşturun. Adım 1.1.4'e bakın ve işlemleri tekrarlayın.
- NMR örneğini adım 1.1.5'te açıklandığı gibi proba yerleştirin.
- Solvent sinyalini kilitleyin. Kilitleme prosedürünü başlatmak için komut kilidini kullanın ve menüden uygun çözücüyü seçin. Kilit sinyali, kilit penceresinde izlenebilir. Kilit kazancını, kilit sinyali kilit penceresinde görünecek şekilde ayarlayın.
- Ayarlama ve eşleştirme işlemini otomatik olarak ( atma komutu aracılığıyla) veya manuel olarak ( atmm komutu, yalpalama eğrisini ayarlamak için ATM kontrol penceresini açacaktır) tamamlayın.
- TopShim aracını kullanarak en uygun dolguları ayarlayın. Topshim gui komutunu kullanın. Adım 1.1.8'deki talimatlara bakın.
- 1H 90° darbe uzunluğunu (adım 1.1.9'da açıklandığı gibi) ve ofset frekansını (o1calib komutu, ofset frekansını alarak etkileşimli bir O1 kalibrasyon rutini çalıştıracaktır) belirleyin. Bu sonraki parametre, solvent bastırma şemaları ile yapılan deneyler kullanıldığında son derece önemlidir.
- Bölüm 1.1.4'te açıklandığı gibi yeni bir veri kümesi oluşturun. H2O sinyalinin parazitini azaltmak veya ortadan kaldırmak için zgesgp darbe dizisini kullanın.
- AcquPars penceresindeki çeşitli parametreleri değiştirerek denemeyi ayarlayın.
- Daha önce belirlendiği gibi 1H 90° darbe uzunluğunu ve ofsetini (o1) tanıtın ve tarama sayısını (NS) 32'ye ve spektral pencereyi (SW) yaklaşık 12 ppm'ye ayarlayın.
- Topspin menü çubuğunda bulunan Şekil aracını kullanarak şekillendirilmiş darbenin güç seviyesini belirleyin.
- Otomatik rga komutu ile alıcı kazancını ayarlayın.
- zg komutunu kullanarak deneyi elde edin ve 1H NMR spektrumunu elde etmek için elde edilen FID'yi işleyin.
- 1 H-15N HSQC NMR deneyini elde etmek için kullanılacak yeni bir veri kümesi oluşturun. AcquPars sekmesinde, darbe programı kataloğunda bulunan darbe programı hsqcetfpf3gp'yi seçin.
- Denemeyi ayarlayın. getprosol komutunu kullanarak varsayılan şekilleri, güçleri ve saatleri yükleyin. Ardından, 1H 90° darbe uzunluğu ve ofset değerlerini güncelleyin.
- Aşağıdaki parametreleri tanımlayın.
- Gevşeme gecikmesini 1-5 s'ye ayarlayın.
- Tarama sayısını 4'ün katları olarak ayarlayın. Genellikle, uygun sinyal-gürültü oranını elde etmek için 8, 16, 32 veya 64 olarak ayarlanır.
- Sahte tarama sayısını 128 olarak ayarlayın.
- F2'deki nokta sayısını 1k, 2k veya 4k olarak ayarlayın.
- F1'deki nokta sayısını ayarlayın: kullanılacak t1 artışlarının sayısı. Spektral pencereye bağlı olarak, bu 128 ile 256 arasındadır.
- 15N boyutundaki spektral pencerenin merkezini δ 117 ppm'ye ayarlayın ve karşılık gelen spektral genişliği 36 ppm'ye ayarlayın. Bu değerlerin her bir sistem için optimize edilmesi gerekir.
- Taşmayı önlemek için alıcı kazancını ayarlayın ( rga komutunu kullanarak)
- Toplam denemenin süresini hesaplayın. Tipik bir deney süresi yaklaşık 1 saattir.
- Denemeyi alınmak üzere göndermek için zg yazın.
NOT: Deneyin düzgün çalışıp çalışmadığını her zaman birkaç dakika sonra kontrol edin. - xfb komutunu kullanarak FID'yi işleyin. İşlem sekmesinde abs2 komutunu ve faz düzeltmelerini kullanarak temel düzeltmeyi gerçekleştirin. Manuel olarak faz yapmak için, fazı ayarla alt menüsüne tıklayın ve ardından 2D spektrumun birkaç çapraz tepe noktasını seçin. Daha sonra, ilgili düğmeye tıklayıp sürükleyerek hem satırlara hem de sütunlara sırayla sıfır ve birinci dereceden düzeltmeler uygulayın. Aşama sonuçlarını kaydedin.
- Elde edilen 2B spektrumu kaydedin.
- Ligandın yüksek konsantrasyonlu bir stok çözeltisini hazırlayın. Tipik değerler 50-100 mM'dir.
- Glikanın yüksek konsantrasyonlu stok çözeltisinden, istenen proteini elde etmek için karşılık gelen hacmi (birkaç mikrolitre) reseptörü içeren NMR tüpüne aktarın: ligand molar oranı ve spektrumları kaydedin.
NOT: Bu adım, ligandın protein numunesine titre edildiği titrasyon serisini başlatır. Her bir özel durum için uygun protein-ligand oranları belirlenmelidir. Bağlanma afinitesi tamamen bilinmiyorsa, başlangıç noktalarında ligandın substokiyometrik miktarlarının kullanılması önerilir. - Yeni hazırlanan numune için 2.1.1 ila 2.1.19 arasındaki adımları gerçekleştirin.
- Protein-ligand oranları artan numuneler için 2.1.21 ve 2.1.22 adımlarını tekrarlayın.
NOT: Titrasyon serisi verilerinin doğru bir şekilde takılması, protein doygunluğuna ulaşmak için gerekli olanlar da dahil olmak üzere çok çeşitli protein-ligand oranlarını kapsayan birden fazla 1 H-15N-HSQC deneyinin elde edilmesini gerektirir.
- Numuneyi ilgilenilen lektin ile hazırlayın. Reseptörün, hem omurga hem de yan zincirlerdeki her amino asit kalıntısında tam olarak 15N etiketli olduğundan emin olun. Tipik olarak, spektrumdaki su ile değiştirilebilir HN çapraz tepe noktalarını tespit etmek için, tamponlu çözeltiyi hazırlamak için 90:10 H2O: D2O karışımı kullanın. Gerekli lektin konsantrasyonları, 15 N etiketli reseptörün mevcudiyetine ve gerekli sinyal-gürültü oranına bağlı olarak 0.05ile 0.2 mM arasında değişir.
- Analiz
- Uygun yazılımı kullanarak apo türleri için işlenmiş 2D HSQC spektrumunu görselleştirin: TopSpin, MestReNova ve CCPNMR, NMR verilerini işlemek için uygun programlardır.
NOT: Bu, proteinin parmak izi spektrumudur. Gözlenen 1H ve 15N kimyasal kaymalar, proteinin 3D yapısına büyük ölçüde bağlı olan her amino asidin karşılık gelen kimyasal ortamına bağlıdır. Bu spektruma protein parmak izi spektrumu denir. Tüm çapraz tepelerin eşit yoğunluklar gösterdiği iyi dağılmış bir 2D 1 H-15N HSQC spektrumu, iyi katlanmış bir protein19'un varlığını güçlü bir şekilde düşündürür. - Tüm çapraz tepe noktaları için 1H ve 15N frekanslarının listesini oluşturun. CCPNMR programı20 gibi ek yazılımların kullanılması bu süreçte yardımcı olabilir.
- Birinci veya ikinci titrasyon noktaları için spektrumu apo proteini için olanın üzerine yerleştirin.
- Bunu yapmak için, apo durumuna karşılık gelen 2B spektrumu açın, Çoklu ekran sekmesine tıklayın ve ardından ikinci 2B spektrumu ekleyin. Her iki spektrumun görsel olarak incelenmesi, ligand ve protein arasındaki etkileşimin varlığı hakkında bilgi sağlar.
NOT: Proteinin bakış açısına göre, bağlanmanın varlığı, tanıma olayına doğrudan dahil olan amino asitlerin kimyasal ortamında, eşlik eden kimyasal kayma pertürbasyonları (CSP) ile değişiklikler sağlar.
- Bunu yapmak için, apo durumuna karşılık gelen 2B spektrumu açın, Çoklu ekran sekmesine tıklayın ve ardından ikinci 2B spektrumu ekleyin. Her iki spektrumun görsel olarak incelenmesi, ligand ve protein arasındaki etkileşimin varlığı hakkında bilgi sağlar.
- Her titrasyon noktası için 2.2.2 ve 2.2.3 adımlarını tekrarlayın, farklı protein-ligand molar oranlarına karşılık gelen farklı spektrumlardaki tüm çapraz pikler için 1H ve 15N frekanslarının listelerini oluşturun.
NOT: Her titrasyon noktasındaki kimyasal kaymalar, herhangi bir yeni çapraz tepe ataması yapmaya gerek kalmadan ölçülebilir. Lektin:glikan etkileşimlerinde yaygın olarak gözlenen hızlı değişim rejimi durumunda, titrasyon boyunca piklerin ilerleyici hareketi basitçe takip edilebilir. - Son titrasyon noktası için, önceki eklemeye göre temelde herhangi bir kimyasal kayma bozulması olmadığını kontrol edin. Bu gerçek, protein bağlanma bölgesinin, yüksek miktarda olan ligand ile doymuş olduğunun göstergesidir.
- Aşağıdaki denklemi kullanarak maksimum kimyasal kayma bozulmalarını (maxCSP) hesaplayın:
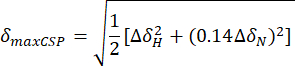
ΔH ve ΔδN , apo durumu ile son titrasyon noktası arasındaki sırasıyla 1H ve 15N frekanslarındaki kimyasal kayma farklarıdır. - Bir 2B grafiğin dikey y ekseninde karşılık gelen amino asit kalıntısına (yatay x ekseninde) karşı maksimum kimyasal kayma bozulmalarını (maxCSP) çizin.
- Proteinin bağlı ve apo durumları arasındaki maksimum CSP'yi gösteren amino asit kalıntılarının görsel bir incelemesini yapın. Bağlanma yerine ait olmaları veya ona komşu olmaları kuvvetle muhtemeldir.
- Proteinin 3D yapısı mevcutsa, ilgili PDB'yi PyMOL veya BIOVIA Discovery studio gibi uygun bir yazılımla açın. Bu moleküler görselleştirme programları, yapısal biyoloji uygulamalarında yaygın olarak kullanılmaktadır. Varsayılan bağlanma bölgesini lokalize etmek için belirli bir renkle en yüksek maxCSP'yi (standart sapmanın iki katının üzerinde) gösteren kalıntıları seçin.
- Hızlı bir değişim rejimi durumunda, her noktada (Δδ obs) 1 H-15N HSQC çapraz zirveleri için gözlemlenen CSP'nin doğrusal olmayan en küçük kareler uyumundan ayrışma sabitini (KD) tahmin edin ve bu noktadaki belirli protein [P] ve ligand [L] konsantrasyonuna karşı:
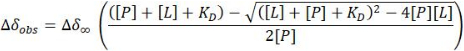
NOT: Bu denklem, net izole sinyaller gösteren çapraz tepe noktalarına uygulanabilir. Elde edilen değerlerin ortalaması alınarak KD tahmini sağlanmıştır.
- Uygun yazılımı kullanarak apo türleri için işlenmiş 2D HSQC spektrumunu görselleştirin: TopSpin, MestReNova ve CCPNMR, NMR verilerini işlemek için uygun programlardır.
Sonuçlar
Burada, lektinler ve küçük oligosakkaritler arasındaki bağlanma etkileşiminin ayrıntılarını çözmek için 1H-STD NMR ve 1 H-15N HSQC deneylerinin kullanılması için bir protokol sunuyoruz. LacNAc'in hGalectin-7 (hGal-7) tarafından moleküler tanınmasının analizinde elde edilen sonuçlar, protokolün başarılı bir şekilde uygulanmasının ve moleküler tanıma sürecinin ince ayrıntılarını incelemek için bu NMR metodolojilerinin etkinliğinin açıklayıcı bir örneği olarak hizmet vermektedir. Şekil 3, LacNAc'nin hGal-7 ile etkileşimi için 1H-STD NMR spektrumunu göstermektedir. STD NMR sinyallerinin varlığı bağlanmayı gösterir (Şekil 3A). Ayrıca, sadece protein ile yakın temas halinde olan protonlara ait sinyaller ortaya çıkar ve bağlayıcı epitopun tanımlanmasına izin verir (Şekil 3B). Şekil 4, bir proteinin 1 H-15N HSQC spektrumunun parmak izi olarak nasıl kullanılabileceğini vurgulamaktadır ve Şekil 5, hGalectin-7 omurga amid gruplarının kimyasal kayma bozulmasını tanımlamak için 1 H-15N heteronükleer tek kuantum tutarlılık (HSQC) titrasyon deneylerinin uygulanmasını göstermektedir. Bu veriler sadece etkileşimin varlığını ortaya çıkarmakla kalmaz, aynı zamanda lektinin bağlanma arayüzünü de tanımlar. Şekil 6, titrasyon verilerinin analizinin, yüksek mikromolar aralıkta yer alan hGalectin-7 ile LacNAc'nin bağlanma afinitesinin tahminini nasıl sağladığını göstermektedir. Bu bulgu, alternatif teknikler kullanılarak elde edilen sonuçlarla tutarlıdır.
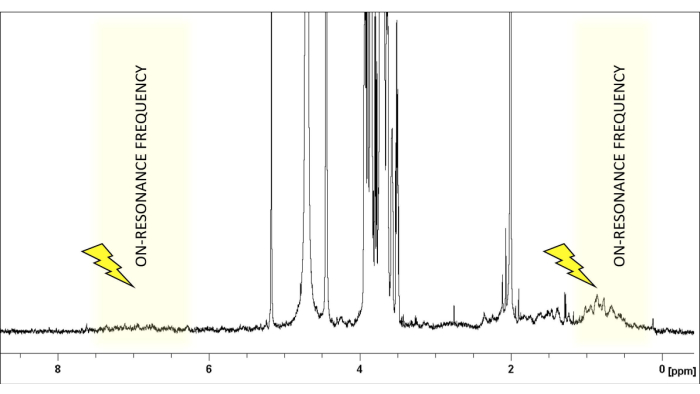
Şekil 1: Rezonans frekansının seçimi. pH7.4'te döteryumlu fosfat tamponlu salin içinde LacNAc:hGal-7 50:1 oranının 1 H-NMR spektrumu gösterilmiştir. Ligandın (LacNAc) sinyalleri 2.0-5.2 ppm arasındaki bölgede sınırlıdır. Doyma frekansı, proteinin protonlarının seçici ışınlanmasına izin vererek, 1-2 ppm aralığında ligand protonlarının yokluğunu sağlamak için dikkatlice seçilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
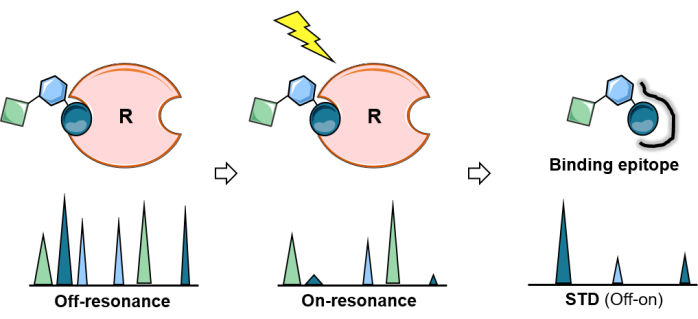
Resim 2: STD NMR deneyi. STD deneyinin şematik gösterimi: ilk spektrum (rezonans dışı) referans görevi görürken, ikincisinde (rezonans üzerinde) protein doygunluğu gerçekleştirilir. Doygunluk, tüm protein boyunca verimli bir şekilde yayılır ve protein ile yakın temas halinde ligand protonlarına aktarılır. Ortaya çıkan fark spektrumu (STD spektrumu) yalnızca doygunluk yaşamış rezonansları verir. STD deneyinin analizi, bağlayıcı şekerin epitop haritalamasına izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
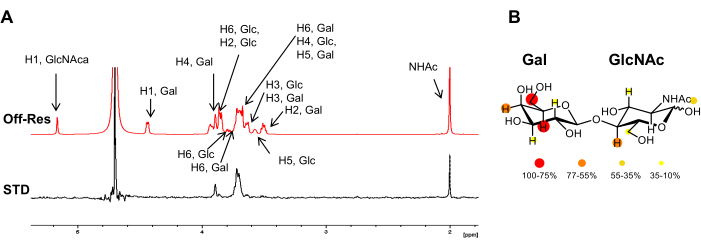
Şekil 3: Ligandın perspektifinden bağlanma analizi. (A) LacNAc'nin h Gal-7ile etkileşimi için kapalı rezonans ve 1 H STD-NMR spektrumunun üst üste bindirilmesi. STD spektrumunda, sadece protein ile yakın temas halinde olan protonlara ait sinyaller ortaya çıkar. Ligandın 1H rezonanslarının notasyonu, rezonans dışı spektrumda rapor edilir. (B) Bağıl STD yoğunlukları, LacNAc'nin kimyasal yapısına renkli olarak haritalandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
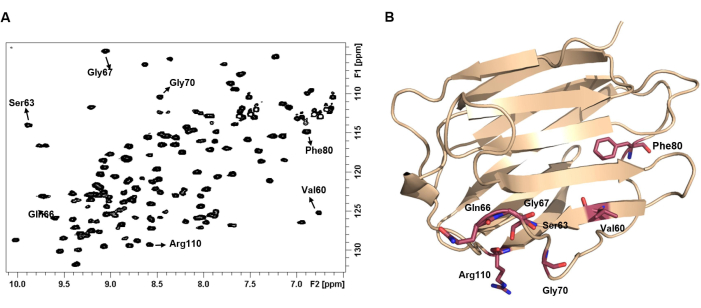
Şekil 4: Bir proteinin 1 H-15N HSQC spektrumu parmak izini temsil eder. (A) 1 H-15N HSQC spektrumu 100 μM hGal-7 apo formunda. Spektrum 25 °C'de kaydedildi. Bazı NH çapraz zirveleri, karşılık gelen amino asitlerinin etiketi ile açıklandı. (B) Her NH çifti, kimyasal ortama ve sonuç olarak proteinin 3 boyutlu yapısına bağlı olan benzersiz bir kimyasal kayma gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
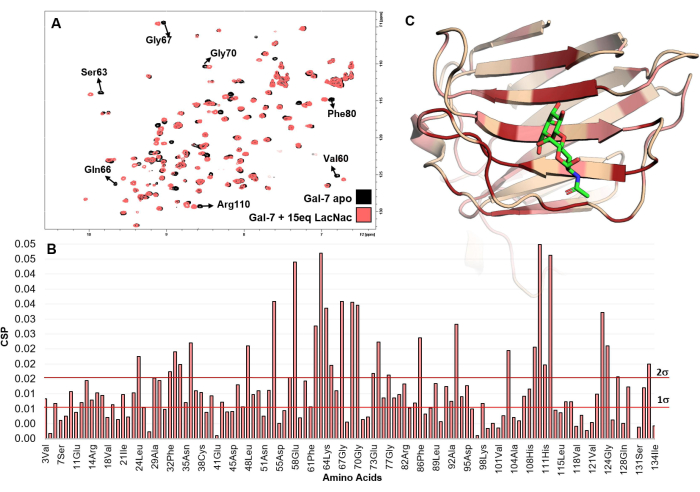
Şekil 5: Proteinin perspektifinden bağlanma analizi. (A) LacNAc'nin hGal-7 çözeltisine titrasyonu için kaydedilen 1 H-15N HSQC spektrumunun üst üste bindirilmesi gösterilmiştir. Birkaç çapraz tepe noktasının kimyasal kayma değişiklikleri yaşadığı spektrumların incelenmesi, etkileşimi açıkça gösterir. (B) LacNAc'nin (15 eşdeğer) hGal-7 ile titrasyonundan çıkarılan omurga amid sinyallerinin maksimum kimyasal kayma bozulmalarının (maxCSP) grafiği. (C) CSP analizine göre hGal-7'nin en rahatsız edici amino asitleri 5gal PDB yapısına eşlenir. 3D modelde kırmızı renklendirme 2σ üzerindeki CSP değerini, pembe olanlar ise 1σ ile 2σ arasındaki değerleri ifade eder. Renkli bölge muhtemelen bağlanma bölgesini temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
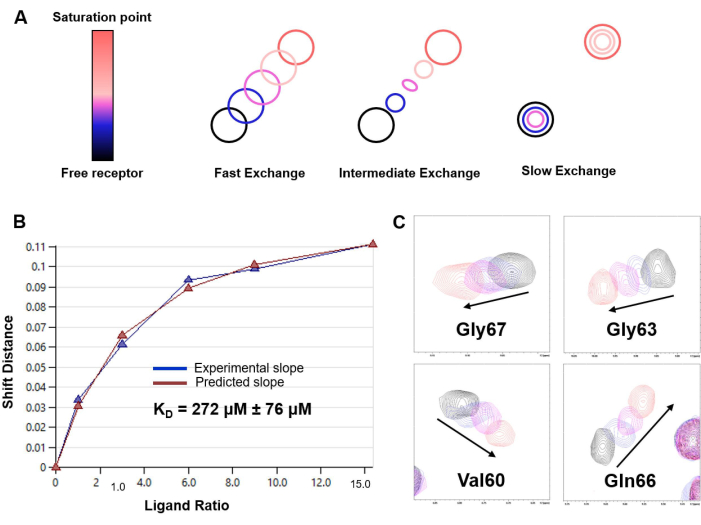
Şekil 6: 1 H-15N HSQC titrasyon deneylerine dayalı KD tayini. (A) Çalışmadaki sistemin NMR zaman ölçeğindeki kimyasal değişim oranına bağlı olarak 1 H-15N HSQC bazlı titrasyon modelinin temsili (hızlı, orta veya yavaş). LacNAc/hGal-7 etkileşimi durumunda hızlı bir değişim rejimi gözlendi. (B) hGal-7ve LacNAc disakkarit model sistemi için değişen ligand konsantrasyonlarında CSP analizinden elde edilen uydurma eğrisi ve KD tahmini. Tahmini KD, 20 farklı amino asit için verilerin ortalaması olarak karşılık gelen hatayla birlikte rapor edilir; (C) Titrasyon sırasında seçilen çapraz tepe noktalarının kaymasını gösteren 1 H,15N-HSQC spektrumlarının parçacıkları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Doygunluk transfer farkı NMR (STD-NMR), ligand-protein etkileşimlerini incelemek için en çok kullanılan ve çok yönlü NMR yöntemi haline gelmiştir. Yukarıda gösterildiği gibi, doygunluk transfer fenomenine dayanır ve deney düzeneği, iki tek boyutlu (1D) 1H spektrumunun elde edilmesini içerir: rezonans açık" ve "rezonans dışı spektrumlar". Rezonans deneyi sırasında, proteinin spesifik protonlarının doygunluğu, belirli bir süre boyunca (doyma süresi tipik olarak 1-3 s arasında değişir) düşük güçlü radyofrekans darbelerinin bir dizisi uygulanarak elde edilir. Ligandın doğrudan doygunluğunu önlemek için, doygunluk darbelerinin frekansı ve uzunluğu, proteinin spesifik protonlarını seçici olarak ışınlamak için optimize edilmiştir; yani, herhangi bir ligand sinyalinin boş olduğu bir frekansta ve uygun bir uzunlukta uygulanmalıdırlar (Şekil 1). Genel bir kural olarak, 50 ms doygunluk darbeleri için, doygunluk bölgesinden en yakın ligand sinyallerine kadar 1 ppm'lik fark korunmalıdır. Genel olarak, proteinin alifatik bölgesine uygulanan seçici doygunluk darbeleri, doygunluk etkilerinin artmasını sağlar. Alternatif olarak, ligand molekülü herhangi bir aromatik sinyal içermiyorsa aromatik protonlar (6-7 ppm) da ışınlanabilir. Bu, aromatik gruplar taşımadıkları için doğal olarak oluşan glikanlar için çok faydalıdır. Proteinin belirli bir bölgesi seçici olarak ışınlandıktan sonra, doygunluk, dipolar 1 H-1H çapraz gevşeme (spin difüzyonu) yoluyla protein boyunca yayılır. Sonunda, doygunluk, bağlanma bölgesindeki protein protonlarına ulaşır, bu daha sonra moleküller arası 1 H-1H NOE'ler yoluyla reseptör ile yakın temas halinde olan şeker protonlarına (r < 5 Å) aktarılır. Açıkçası, doymuş ligand protonlarının sinyallerinin yoğunluğu azalır. Doygunluğu aldıktan sonra, bağlanma kinetiği nedeniyle, geçici olarak bağlı ligandlar (hızlı değişim gereklidir) ayrışır ve doygunluk bilgisi serbest durumda toplanır. Bu işlem nedeniyle, NMR rezonans spektrumları azalmış sinyaller sunar (Şekil 2).
Bağlayıcı bir glikanın 1H çekirdeğinin bu yoğunluk bozulmasını açıkça göstermek için, doygunluğun herhangi bir reseptör veya karbonhidrat sinyalinden (genellikle 40-100 ppm arasında) çok uzağa uygulandığı bir kontrol protonu NMR spektrumu (rezonans dışı) elde edilir. Kapalı rezonans ve rezonans açık arasındaki çıkarılan 1D spektrumu, yalnızca ligandın değiştirilmiş yoğunluklara sahip 1H çekirdeklerinin sinyallerini gösterir: manyetizasyonu almak için reseptör bağlanma bölgesine yeterince yakın olanlar (Şekil 2).
Bununla birlikte, bağlı karbonhidratın tüm 1H çekirdekleri aynı miktarda doygunluk almaz. Teorik olarak, reseptörden bağlı liganda manyetizasyon transferi mesafeye bağlıdır (1/r6). Bu, glikan 1H çekirdekleri arasında aktarılan doygunluğun yoğunluklarının, ligandın protonları ile reseptörün protonları arasındaki uzamsal yakınlıklar hakkında bilgi içerdiği ve STD NMR yoğunluklarının reseptöre daha yakın olan protonlar için daha büyük olduğu anlamına gelir. Buna göre, STD NMR deneyi aynı zamanda karbonhidratın bağlanma epitopunun belirlenmesine de izin verir (Şekil 2 ve Şekil 3), çünkü protein yüzeyine daha yakın oturan ligandın protonları, bağlanmaya doğrudan katılmayanlardan daha yüksek yoğunluklar gösterir.
Deney, zayıf-orta afiniteye sahip sistemlere, nadiren düşük μM veya nM aralığında güçlü afiniteye sahip sistemlere uygulanabilir. Gerçekten de, gevşeme zaman ölçeğinde ayrışma oranının hızlı olmasını gerektirir. Aksi takdirde, doygunluk transfer bilgisi, ligand ayrışmadan önce gevşeme yoluyla kaybolur.
Öte yandan, protein bazlı NMR deneyleri, atomik çözünürlük yapılarını çözmeden ligand-protein etkileşimini amino asit seviyesi doğruluğu ile çözmek için benzersizdir. Birlikte kristalleşmeye ihtiyaç duymadan çözelti içindeki moleküler tanıma olaylarını doğrudan inceler. CSP analiz haritalaması, ligandları keşfetmek ve protein bağlanma bölgesini haritalamak için son derece güçlüdür (Şekil 4 ve Şekil 5). Bu yöntem, kimyasal kayma zaman ölçeğinde21 değişim kurunun yavaş olduğu sistemler için bile, mM ve nM aralığı arasındaki herhangi bir afinite aralığına uygulanabilir.
Bununla birlikte, bu yaklaşım, gevşeme sorunları nedeniyle moleküler ağırlıkları 30-40 kDa'nın üzerinde olan proteinler için muhtemelen işe yaramayacaktır. TROSY alternatifi18 daha sonra kullanılabilir, protein döterasyonu ile birleştirildiğinde özellikle güçlüdür. Ayrıca, protein 15N ile eşit şekilde etiketlenmelidir (ve gerekli omurga atamasını tamamlayabilmek için 13C ve 15N ile çift etiketlenmiş başka bir numune). Bu nedenle, karşılık gelen ekspresyon sistemi de dahil olmak üzere protein ekspresyon koşulları, miligram miktarlarda protein elde edebilmek için optimize edilmelidir. Oligomerleşme veya toplanma eğilimi gösteren proteinler de bu analiz için uygun değildir. Burada NMR verilerini kaydetmek için kullanılan cihaz, bir TCI kriyoprob ile donatılmış bir Bruker 800 MHz spektrometresidir. Bu metodolojiyi 600 MHz'in altındaki aletler kullanarak veya kriyojenik prob olmadan kullanmak oldukça zor olacaktır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
MCIN/AEI/10.13039/501100011033 tarafından finanse edilen Severo Ochoa Mükemmeliyet Merkezi Akreditasyonu CEX2021-001136-S ve Instituto de Salud Carlos III'ün (ISCIII, Madrid, İspanya) bir girişimi olan CIBERES için İspanya'dan Agencia Estatal de Investigación'a teşekkür ederiz. GLYCOTWINNING projesi için Avrupa Komisyonu'na da teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5 mm Shigemi microtube set mat | CortecNet SAS | S30BMS-005B | |
| Alpha-Lactose-Agarose | Sigma-Aldrich Química S.L. | 7634-5ML | |
| Ammonium chloride (15 N, 99%) | LC-0179-N-50G | Tracer Tecnologías Analíticas S.L | |
| Ampicillin (Sodium Salt) | Melford Laboratories LTD | A40040 | |
| BIOVIA Discovery studio | BIOVIA, Dassault Systèmes | ||
| BL21(DE3) Chemically Competent Cells | Merck Life Science, S.L.U. | CMC0014-40X40UL | |
| Centrifuge | Beckman Coulter | Allegra X-22R | |
| D2O | Cambridge Isotope Laboratories, Inc. | DLM-4-1000 | |
| Incubator | Eppendorf | Innova 42 | |
| IPTG (Isopropyl ß-D-1-thiogalactopyranoside) | VWR International Eurolab S.L. | VW437144N | |
| LacNAc | Elicityl | GLY008 | |
| Luria Bertani (LB) Broth | Merck Life Science, S.L.U. | 3397-1KG | |
| Matraz Erlenmeyer B N 5000 CC | VWR International Eurolab S.L. | 214-1137 | |
| PBS 10x | Bio-Rad | 1610780 | |
| PyMOL | PyMOL Molecular Graphics System | Version 2.0 Schrödinger | |
| Sonicator | Sonics & Materials, Inc. | VC 505 | |
| Superconducting NMR magnet | Bruker | 600 MHz AVANCE III | |
| Superconducting NMR magnet | Bruker | 800 MHz AVANCE III |
Referanslar
- Solís, D., et al. A guide into glycosciences: How chemistry, biochemistry and biology cooperate to crack the sugar code. Biochim Biophys Acta. 1850 (1), 186-235 (2015).
- Poveda, A., Jimenez-Barbero, J. NMR studies of carbohydrate-protein interactions in solution. Chem Soc Rev. 27, 133-144 (1998).
- Kogelberg, H., Solís, D., Jiménez-Barbero, J. New structural insights into carbohydrate-protein interactions from NMR spectroscopy. Curr Opin Struct Biol. 13 (5), 646-653 (2003).
- Widmalm, G. Glycan shape, motions, and interactions explored by NMR spectroscopy. JACS Au. 4 (1), 20-39 (2024).
- Marchetti, R., et al. 34;Rules of Engagement" of protein-glycoconjugate interactions: A molecular view achievable by using NMR spectroscopy and molecular modeling. ChemistryOpen. 5 (4), 274-296 (2016).
- Ardá, A., Jiménez-Barbero, J. The recognition of glycans by protein receptors. Insights from NMR spectroscopy. Chem Commun. 54 (38), 4761-4769 (2018).
- Gimeno, A., Valverde, P., Ardá, A., Jiménez-Barbero, J. Glycan structures and their interactions with proteins. A NMR view. Curr Opin Struct Biol. 62, 22-30 (2020).
- Cañada, F. J., et al. Conformational and structural characterization of carbohydrates and their interactions studied by NMR. Curr Med Chem. 29 (7), 1147-1172 (2022).
- Valverde, P., Quintana, J. I., Santos, J. I., Ardá, A., Jiménez-Barbero, J. Novel NMR avenues to explore the conformation and interactions of glycans. ACS Omega. 4, 13618-13630 (2019).
- Jiménez-Barbero, J., Asensio, J. L., Cañada, F. J., Poveda, A. Free and protein-bound carbohydrate structures. Curr Opin Struct Biol. 9 (5), 549-555 (1999).
- Quintana, J. I., Atxabal, U., Unione, L., Ardá, A., Jiménez-Barbero, J. Exploring multivalent carbohydrate-protein interactions by NMR. Chem Soc Rev. 52 (5), 1591-1613 (2023).
- Roldós, V., Cañada, F. J., Jiménez-Barbero, J. Carbohydrate-protein interactions: a 3D view by NMR. Chembiochem. 12 (7), 990-1005 (2011).
- Unione, L., Ardá, A., Jiménez-Barbero, J., Millet, O. NMR of glycoproteins: profiling, structure, conformation, and interactions. Curr Opin Struct Biol. 68, 9-17 (2021).
- del Carmen Fernández-Alonso, M., Díaz, D., Berbis, M. A., Marcelo, F., Cañada, J., Jiménez-Barbero, J. Protein-carbohydrate interactions studied by NMR: from molecular recognition to drug design. Curr Protein Pept Sci. 13 (8), 816-830 (2012).
- Angulo, J., Nieto, P. M. STD-NMR: application to transient interactions between biomolecules-a quantitative approach. Eur Biophys J. 40 (12), 1357-1369 (2012).
- Mayer, M., Meyer, B. Group epitope mapping by saturation transfer difference NMR to identify segments of a ligand in direct contact with a protein receptor. J Am Chem Soc. 123 (25), 6108-6117 (2001).
- Williamson, M. P. Using chemical shift perturbation to characterise ligand binding. Prog Nucl Magn Reson Spectrosc. 73, 1-16 (2013).
- Fernández, C., Adeishvili, K., Wüthrich, K. Transverse relaxation-optimized NMR spectroscopy with the outer membrane protein OmpX in dihexanoyl phosphatidylcholine micelles. Proc Natl Acad Sci U S A. 98 (5), 2358-2363 (2001).
- Yee, A., Gutmanas, A., Arrowsmith, C. H. Solution NMR in structural genomics. Curr Opin Struct Biol. 16 (5), 611-617 (2006).
- Skinner, S. P., Fogh, R. H., Boucher, W., Ragan, T. J., Mureddu, L. G., Vuister, G. W. CCPNMR AnalysisAssign: a flexible platform for integrated NMR analysis. J Biomol NMR. 66 (2), 111-124 (2016).
- Gimeno, A., et al. Minimizing the entropy penalty for ligand binding: Lessons from the molecular recognition of the histo blood-group antigens by human Galectin-3. Angew Chem Int Ed Engl. 58 (22), 7268-7272 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır