Method Article
Adquisición de señales, interpretación de puntuaciones y economía de una prueba no invasiva en el punto de atención para la enfermedad de las arterias coronarias
En este artículo
Resumen
Se presenta la metodología para adquirir la señal fisiológica para una prueba de Enfermedad de las Arterias Coronarias (EAC). Se propone un método para interpretar la puntuación CAD en relación con la positividad y la negatividad de las pruebas, incluyendo las granularidades de cada una. Los aspectos económicos de la prueba se discuten en el contexto del estándar de atención actual.
Resumen
Se ha desarrollado y validado previamente una prueba no invasiva en el punto de atención para la enfermedad de las arterias coronarias (CAD) (POC-CAD). La prueba requiere la adquisición simultánea de señales de gradiente de voltaje ortogonal (OVG) y fotopletismografía, que es la metodología principal descrita en este artículo. La adquisición de la OVG, una señal biopotencial, requiere la colocación de electrodos en la piel preparada del tórax del paciente (dispuestos de manera similar a la configuración de derivación Frank, que comprende seis electrodos bipolares y un electrodo de referencia) y un sensor hemodinámico en el dedo (utilizando una modalidad de transmisión estándar). La señal se carga en un sistema basado en la nube, donde las características de ingeniería se extraen de la señal y se suministran a un algoritmo de aprendizaje automático para producir la puntuación CAD. A continuación, el médico debe interpretar el valor de la puntuación CAD en el contexto de la probabilidad de EAC previa a la prueba de su paciente, lo que da como resultado una probabilidad de EAC posterior a la prueba. Esta interpretación se puede realizar a nivel de positividad y negatividad de la prueba o a un nivel más fino de granularidad; Aquí se proponen metodologías para cada uno de ellos basadas en cocientes de probabilidad. Utilizando la probabilidad posterior a la prueba, el médico debe determinar el siguiente paso apropiado en el tratamiento de su paciente; Se utilizan varios escenarios para ilustrar este proceso. La adopción de la prueba solo es factible si es económicamente viable; se ofrece un análisis de la integración de la prueba en el flujo de diagnóstico CAD y el consiguiente ahorro de costes para el sistema sanitario. El modelo económico demuestra que se pueden lograr ahorros de costos para el sistema de salud evitando el retraso en el tratamiento, que, si no se aborda, resulta en la progresión de la enfermedad que requiere una atención más avanzada (y costosa).
Introducción
La cardiopatía isquémica (IHD) es actualmente la principal causa de muerte a nivel mundial1. La enfermedad arterial coronaria (EAC) es el precursor anatómico de la EIC, caracterizada por la presencia de lesiones significativas dentro de las arterias coronarias. La significación puede definirse anatómicamente por una oclusión de al menos el 70%, o el 50% en la arteria principal izquierda2. La significación también se puede definir en función del impacto funcional de la lesión midiendo su efecto sobre el flujo sanguíneo. En concreto, la reserva fraccional de flujo (FFR) y la reserva de flujo instantánea (iFR) evalúan el cambio de flujo causado por la lesión, y las lesiones se definen como significativas con FFR < 0,80 o iFR < 0,892. El estándar de oro para confirmar la presencia de EAC significativa es la angiografía coronaria invasiva (ACI) mediante cateterismo cardíaco izquierdo (LHC). La EAC significativa justifica la revascularización mediante la colocación de un stent o un injerto de revascularización coronaria, que alivia la isquemia miocárdica y los síntomas anginosos correspondientes y estabiliza la placa (en el caso de la colocación de stents).
Las pruebas no invasivas actuales para la EAC a menudo requieren exposición a la radiación, estrés e inyección de contraste (con impactos renales)1. Las pruebas diagnósticas más utilizadas son la imagen de perfusión miocárdica (MPI), también conocida como tomografía computarizada por emisión de fotón único (SPECT), y la angiografía coronaria por tomografía computarizada (ATCC). La SPECT consiste en la inyección de un radioisótopo para rastrear la perfusión durante el descanso y el estrés (ejercicio o farmacéutico). La ATCC toma de imágenes de las arterias coronarias mediante múltiples radiografías. La tomografía por emisión de positrones (PET) y la resonancia magnética cardíaca (RMC) también se utilizan ocasionalmente para las pruebas de CAD1. Todas estas modalidades requieren una importante inversión de capital en equipo, personal capacitado para realizar las pruebas y, en algunos casos, la disponibilidad de isótopos médicos. Debido a estos requisitos, estas modalidades a menudo no están ampliamente disponibles, especialmente en entornos rurales, lo que introduce retrasos en la atención al paciente y aumenta los riesgos asociados.
Por lo tanto, el objetivo era diseñar una prueba no invasiva en el punto de atención para CAD (POC-CAD): el sistema CorVista3. Este sistema es una prueba aprobada por la FDA para CAD funcionalmente significativa, con un rendimiento comparable al CCTA4. La prueba se puede utilizar sin el estrés del paciente y sin necesidad de inversión de capital en equipos o personal especializado. Es ideal para su uso en entornos rurales y con recursos limitados donde el acceso a las tecnologías de imagen actuales a menudo no está disponible.
El desarrollo3 y la validación4 de POC-CAD han sido publicados previamente. En resumen, POC-CAD comienza con la adquisición simultánea de señales de gradiente de voltaje ortogonal y fotopletismografía utilizando el dispositivo de captura, como se describe en el paso 1 del protocolo. El gradiente de voltaje ortogonal es una señal biopotencial adquirida utilizando una colocación de cable similar a la configuración de cable Frank5, que comprende seis electrodos bipolares y un electrodo de referencia conectado al torso. El fotopletismografía se obtiene utilizando la modalidad de transmisión estándar, en la que la luz roja e infrarroja se transmite a través de la yema del dedo e incide en un sensor6. Una vez que se adquiere la señal, se carga automáticamente en el sistema basado en la nube, donde las características de ingeniería se extraen de la señal y se suministran a un algoritmo de aprendizaje automático para producir la puntuación CAD, que se presenta en el portal web. En los pasos 2 y 3 del protocolo, se describe la metodología para interpretar la puntuación CAD devuelta por la prueba. Específicamente, se pueden utilizar datos publicados u otras fuentes relevantes para el médico para estimar la probabilidad de EAC antes de que el paciente realice la prueba. Los cocientes de probabilidad se pueden calcular a partir del rendimiento de la prueba y se pueden utilizar para actualizar la probabilidad de CAD desde la prueba previa hasta la prueba posterior, utilizando el resultado de la prueba binaria (paso 2) o valores más granulares de la puntuación CAD (paso 3). Finalmente, se discute el modelado de la economía de POC-CAD en comparación con el estándar de atención actual.
Protocolo
El estudio fue aprobado por la Junta de Revisión Institucional Occidental y se llevó a cabo de conformidad con la Declaración de Helsinki. Se obtuvo el consentimiento informado por escrito de todos los sujetos para participar. Brevemente, para ser incluidos, los sujetos deben haber tenido al menos 18 años de edad con síntomas cardiovasculares pero sin enfermedad arterial coronaria conocida y programados para someterse a ICA o CCTA. Los criterios de exclusión incluyeron antecedentes documentados de infarto de miocardio, injerto previo de revascularización coronaria y reemplazo valvular cardíaco previo, entre otros. Los criterios completos de inclusión y exclusión del estudio se pueden encontrar en clinicaltrials.gov, bajo el número NCT03864081 de National Clinical Trial (NCT). El equipo y el software utilizado se enumeran en la Tabla de Materiales.
1. Adquisición de señales
- Prepare la piel afeitando el vello del sitio del electrodo. Asegúrese de que no queden residuos en la piel limpiándola con agua y jabón y empleando una gasa limpia y seca o una toallita sin alcohol si es necesario.
- Conecte los cables a los electrodos y colóquelos de acuerdo con la Tabla 1.
NOTA: La calidad del electrodo puede afectar la calidad de la señal; Se recomienda utilizar electrodos de calidad diagnóstica o de alto rendimiento. - Coloque el sensor hemodinámico (fotopletismografía, PPG) en el dedo del sujeto, asegurándose de que el dedo esté lo más adentro posible del sensor, con el cable del sensor colocado a lo largo de la parte superior de la mano.
- Utilice el dedo índice a menos que una herida u otra razón clínicamente relevante impida su uso. Aconseje al paciente que no mueva el sensor una vez colocado.
- Coloque al paciente boca arriba en una posición de descanso cómoda. Asegúrese de que el cable del sensor PPG y los cables de los electrodos no se superpongan.
- Use amortiguación (p. ej., una manta o toalla enrollada, junto con una almohada) si es necesario para evitar que el paciente ejerza presión directa sobre el electrodo azul en la espalda.
- Para limitar el ruido de la señal y maximizar la calidad de la señal, en la medida de lo posible, apague todos los dispositivos electrónicos (monitores, televisores, teléfonos celulares, etc.) o retírelos de la habitación. Apague la iluminación de la habitación.
- Ingrese la información del paciente y confirme que sea correcta: nombre del paciente, apellido del paciente, sexo al nacer, altura en pulgadas, peso en libras, fecha de nacimiento y número de registro médico (todos obligatorios, se pueden ingresar en cualquier orden).
- Asegúrese de que el paciente se sienta cómodo y recuérdele que debe estar quieto y callado (p. ej., no hablar durante la adquisición).
- Coloque el dispositivo sobre una superficie plana y confirme la colocación en la aplicación. Presione Iniciar para comenzar la adquisición de la señal.
- Supervise el dispositivo en busca de mensajes de error y, si aparecen, siga las instrucciones que aparecen en pantalla para resolverlos.
- Una vez completada la adquisición de la señal, que requiere 3 minutos y 35 segundos, el dispositivo transmitirá automáticamente los datos a la nube para evaluar la calidad de la señal. Mantenga al paciente conectado al dispositivo hasta que se reciba la confirmación de la calidad de la señal que pasa.
- Separe los electrodos del paciente y retire el sensor PPG.
- Acceda al portal para ver los resultados de la prueba (estará disponible unos 10 minutos después de que la señal se haya subido a la nube).
Tabla 1: Colocación de leads. Descripción de las ubicaciones anatómicas en las que se debe colocar cada uno de los siete electrodos. Haga clic aquí para descargar esta tabla.
2. Interpretación de los resultados de la prueba dado positivo en la prueba frente a . Resultado negativo de la prueba
- Determinar la probabilidad de enfermedad del paciente antes de la prueba (p. ej., utilizando las directrices de la Sociedad Europea de Cardiología (ESC)7).
- Determine si la prueba del paciente es positiva o negativa comparando la puntuación CAD con 0: si es mayor o igual que cero, entonces el resultado del paciente es positivo en la prueba, o si es menor que cero, entonces el resultado es negativo en la prueba.
- Lea el valor de la puntuación CAD del informe y compárelo con las distribuciones de pacientes negativos y positivos en la cohorte de validación que se muestra en la parte inferior del informe.
- Calcule la sensibilidad y la especificidad8, luego los cocientes de verosimilitud (LR) utilizando la ecuación 1 y la ecuación 29.
NOTA: Se muestra un ejemplo trabajado, dado que la sensibilidad de la prueba es del 88% (calculada con sujetos positivos de ICA, que es el único grupo de sujetos con enfermedad) y la especificidad es del 51% (calculada con sujetos negativos de CCTA con un peso del 94% y sujetos negativos de ICA con un peso del 6%, para representar a la población total a través del estudio PROMISE10).
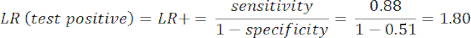 (EQN 1)
(EQN 1)
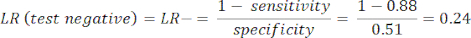 (EQN 2)
(EQN 2) - Calcule la probabilidad post-test del paciente dadas las siguientes ecuaciones 3-511, donde LR+ se utiliza en el caso de una prueba positiva y LR- se utiliza en el caso de una prueba negativa:
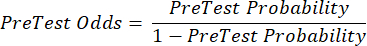 (EQN 3)
(EQN 3)
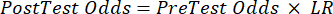 (EQN 4)
(EQN 4)
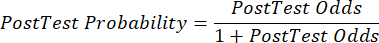 (EQN 5)
(EQN 5) - Con la probabilidad actualizada de EAC, dados los resultados de la prueba, determine el siguiente paso apropiado en la atención al paciente (p. ej., utilizando las recomendaciones de la guía7 de la ESC que se muestran en la Tabla 2).
Tabla 2: Directrices ESC por probabilidad de CAD. Para cuatro niveles de probabilidad de EAC, las directrices de la Sociedad Europea de Cardiología son para la interpretación adecuada de esa probabilidad, incluida la siguiente prueba (si es necesario). Haga clic aquí para descargar esta tabla.
3. Interpretación de los resultados de las pruebas con mayor granularidad
- Aumentar la granularidad de los resultados de la prueba positiva y negativa considerando los rangos de la puntuación CAD observada en la población utilizada para validar la prueba, específicamente la división en terciles (igual número de sujetos en tres intervalos) en los rangos de prueba positiva y negativa, como se muestra en la Tabla 3.
NOTA: Para simplificar los cálculos, se excluye de este análisis la contribución del 6% de los sujetos negativos del cateterismo, cuya inclusión no cambiará significativamente los resultados. - Dentro de cada tercil en el rango de prueba negativa, calcule el número de Verdaderos Negativos (TN), que son sujetos que realmente no tienen la enfermedad, y el número de Falsos Negativos (FN), sujetos que realmente tienen la enfermedad.
- Aplique las siguientes ecuaciones 6-811 para determinar el LR- de cada tercil negativo (LR+ de terciles negativos no es relevante).
NOTA: Las ecuaciones asumen que el perfil de rendimiento del tercil representa el rango completo de prueba negativa para calcular las estadísticas de rendimiento (lo que requiere el factor de corrección de tres, correspondiente al número de terciles, para lograr la frecuencia de negatividad de la prueba original con respecto a la positividad de la prueba).
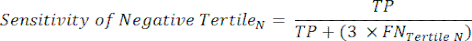 (EQN 6)
(EQN 6)
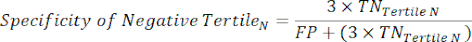 (EQN 7)
(EQN 7)
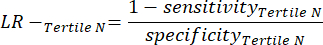 (EQN 8)
(EQN 8)
- Aplique las siguientes ecuaciones 6-811 para determinar el LR- de cada tercil negativo (LR+ de terciles negativos no es relevante).
- Dentro de cada tercil en el rango de prueba positiva, calcule el número de Verdaderos Positivos (TP), que son sujetos que realmente tienen la enfermedad, y el número de Falsos Positivos (FP), sujetos que realmente no tienen la enfermedad.
- Aplique las ecuaciones 9-11 para determinar el LR+ de cada tercil positivo (LR- de terciles positivos no relevantes)11.
NOTA: Las ecuaciones asumen que el perfil de rendimiento del tercil representa el rango completo de pruebas positivas con el fin de calcular las estadísticas de rendimiento (lo que requiere el factor de corrección de tres, correspondiente al número de terciles, para lograr la frecuencia de positividad de la prueba original con respecto a la negatividad de la prueba).
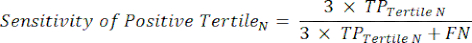 (EQN 9)
(EQN 9)
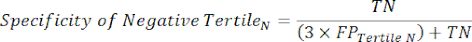 (EQN 10)
(EQN 10)
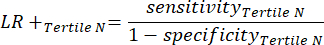 (EQN 11)
(EQN 11)
- Aplique las ecuaciones 9-11 para determinar el LR+ de cada tercil positivo (LR- de terciles positivos no relevantes)11.
- Determine en qué tercil se encuentra la puntuación CAD del paciente y, dados los LR de la Tabla 3, calcule la probabilidad posterior a la prueba dado el procedimiento que se muestra en el paso 2.
NOTA: Como es de esperar, los valores de LR- disminuyen con más puntuaciones CAD negativas, y los valores de LR+ aumentan con puntuaciones CAD más positivas, lo que significa que una puntuación CAD más negativa reduce más eficazmente la probabilidad previa a la prueba, y una puntuación CAD más positiva aumenta más eficazmente la probabilidad previa a la prueba. - Como alternativa a la realización de los cálculos enumerados en los pasos 2.4-3.4, utilice la Tabla 4 para traducir la probabilidad previa a la prueba en una probabilidad posterior a la prueba utilizando la puntuación CAD7 del paciente.
Tabla 3: Razones de verosimilitud. Para tres rangos de puntuaciones dentro de la prueba positiva y la prueba negativa, los correspondientes cocientes de probabilidad positivos y cocientes de probabilidad negativos, respectivamente. Haga clic aquí para descargar esta tabla.
Tabla 4: Mapeo de probabilidades pre-test a post-test. Para 10 niveles de probabilidad previa a la prueba, la probabilidad posterior a la prueba correspondiente dada una puntuación CAD en cada uno de los tres terciles negativos y en cada uno de los terciles positivos. El color verde corresponde a una probabilidad de enfermedad del <15% (la directriz de la ESC establece que se puede descartar la EAC); el color amarillo corresponde a un 15%-65% de probabilidad de enfermedad (las directrices de la ESC establecen que es preferible realizar pruebas no invasivas basadas en imágenes); el naranja corresponde a un 66%-85% de probabilidad de enfermedad (las directrices de la ESC establecen que se deben realizar pruebas no invasivas basadas en imágenes); el rojo corresponde a una probabilidad de enfermedad del >85% (la directriz de la ESC establece que se puede determinar la EAC). Consulte la Tabla 2 para obtener más información sobre las directrices. Tenga en cuenta que una puntuación CAD de 0 se considera positiva en la prueba. Haga clic aquí para descargar esta tabla.
Resultados
Un ejemplo de señal se puede ver en la Figura 1 y se informa en la Figura 2, tal como le parecería a un médico que usa la prueba. A continuación se presentan varios casos de pacientes que demuestran la aplicación de la metodología en la interpretación de la importancia de la puntuación CAD.
Caso 1
Un hombre de 67 años se presentó quejándose de síntomas de dolor torácico en reposo, con dolor irradiado en el brazo, junto con diaforesis y náuseas. Con base en las pautas de la ESC7, su edad, sexo y síntomas son consistentes con una probabilidad inicial de enfermedad del 84%. Las guías de la ESC sugieren que este paciente requiere pruebas no invasivas para hacer un diagnóstico de EAC que justifique la derivación a cateterismo cardíaco y cualquier intervención necesaria (Tabla 2). Se realizó POC-CAD, arrojando una puntuación CAD de 0,32, que es un resultado positivo y se encuentra en el tercil más alto de las puntuaciones CAD positivas, con un LR+ de 2,888 (Tabla 3). Por lo tanto, la probabilidad del paciente después de la prueba es del 94% y, según las pautas de la ESC (Tabla 2), se puede asumir con seguridad que el paciente tiene EAC y que el cateterismo cardíaco invasivo es un curso de acción adecuado.
Caso 2
Mujer de 39 años que presenta dolor torácico en reposo, irradiado tanto al lado izquierdo como al derecho. Con base en las directrices de la ESC7, su edad, sexo y síntomas son consistentes con una probabilidad inicial de enfermedad del 28%, y las directrices sugieren que una prueba no invasiva sería el siguiente paso preferible para obtener una mayor comprensión de la probabilidad de EAC. Sin embargo, las directrices también establecen que en pacientes jóvenes (como esta mujer de 39 años), el médico debe ser consciente de la exposición a la radiación, que es necesaria para administrar una prueba como la SPECT, que requiere un radioisótopo inyectado. Otra opción para una prueba de este tipo es la CCTA, pero requiere muchas radiografías. Por lo tanto, POC-CAD es una opción lógica, ya que no requiere radiación. Se realizó la prueba, devolviendo un valor de -0,12, dentro de los límites del primer tercil del rango negativo, con un LR- de 0,129 (Tabla 3). La probabilidad resultante después de la prueba es del 4%, que cae al nivel en el que la CAD se puede descartar con seguridad según las pautas de la ESC, sin que se requieran más pruebas para la CAD.
Caso 3
Mujer de 74 años que presenta dolor torácico no anginoso y disnea. Con base en las guías de la ESC7, su edad, sexo y síntomas son consistentes con una probabilidad inicial de enfermedad del 24%, y las pautas sugieren que una prueba no invasiva sería el siguiente paso preferible para obtener una mayor comprensión de la probabilidad de EAC. La paciente duda en viajar desde la clínica rural donde está siendo tratada hasta el gran centro urbano donde todas las modalidades de prueba (PET, SPECT, CCTA, CMR) están disponibles, por lo que el médico ofrece POC-CAD. La puntuación CAD es de 0,07, situándose en el primer tercil del rango positivo con un LR+ de 1,446, lo que da como resultado una probabilidad post-test del 33%. Sobre la base del resultado positivo y el aumento en la probabilidad de enfermedad, el paciente acepta viajar a la ciudad para una tomografía por emisión de positrones. La PET también fue indicativa de enfermedad, con un LR+ de 6,0412, y aumenta el 33% al 75% post-PET.
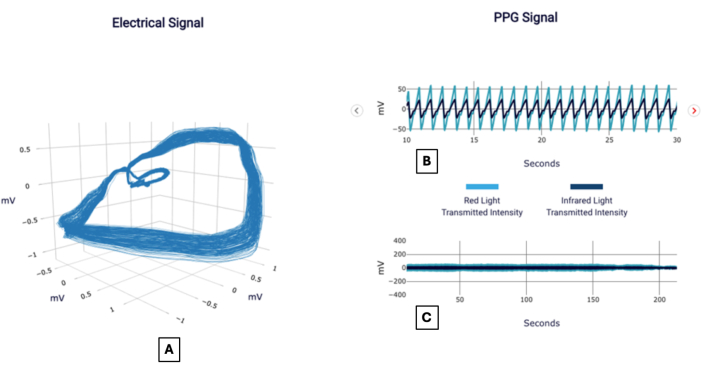
Figura 1: Ejemplos de señales. Informe ejemplar POC-CAD que muestra visualizaciones del gradiente de voltaje ortogonal, también conocido como señal eléctrica (A), y la señal del fotopletismograma enfocada en un intervalo de 20 s (B) y duración completa (C). Haga clic aquí para ver una versión más grande de esta figura.
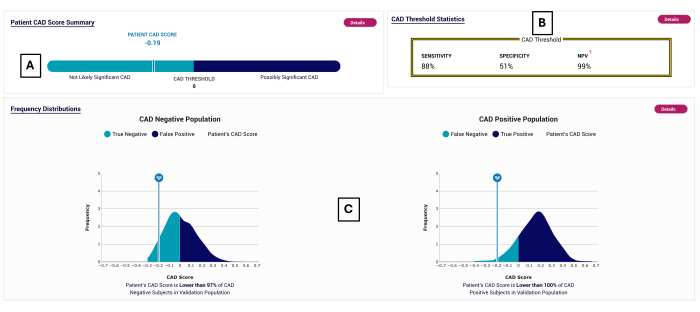
Figura 2: Ejemplo de informe CAD. Informe POC-CAD ejemplar, que muestra una puntuación CAD de -0,19 (A), que se encuentra en el rango de prueba negativa (<0). El rendimiento de la prueba se muestra en (B). La distribución de las puntuaciones CAD se muestra para los sujetos en los que se validó POC-CAD en (C). Haga clic aquí para ver una versión más grande de esta figura.
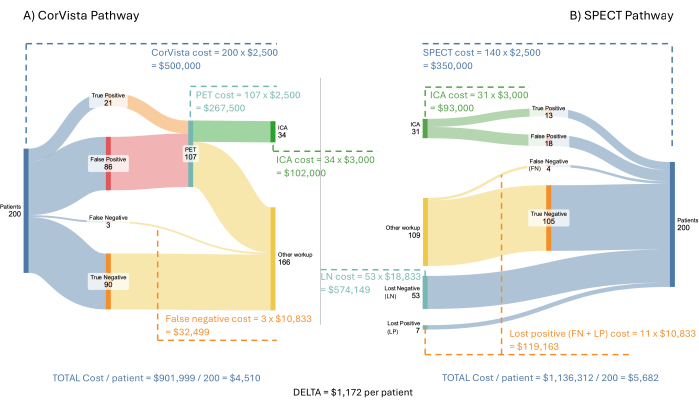
Figura 3: Flujo del modelo económico de costos. Una población hipotética entrante de 200 pacientes se ejecuta a través de la vía POC-CAD>PET (A) y la vía SPECT (B). Se muestran los costes para el sistema sanitario para cada rama de cada vía, junto con el ahorro medio por paciente cuando se implementa la vía POC-CAD>PET. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El enfoque principal de esta sección es la economía de la prueba; sin embargo, es útil discutir primero los aspectos de la evaluación de la probabilidad previa a la prueba para la EAC. Como se describe en los pasos 2 y 3 del protocolo, la estimación de la probabilidad de EAC antes de la prueba es un paso crítico para contextualizar la puntuación de CAD y determinar la probabilidad de EAC después de la prueba. Hemos utilizado las guías de la ESC 2013, que basan la probabilidad de EAC en tres características: sexo, edad y síntomas (dentro de los grupos de angina típica, dolor atípico y no anginoso)7. Sin embargo, es importante tener en cuenta que el médico puede aplicar su juicio clínico en la selección de cualquier método cuantitativo o cualitativo. Además, existen otros métodos cuantitativos publicados disponibles para dicha estimación, incluido Diamond-Forrester13, que requiere las mismas características de entrada que ESC 2013. También se han publicado variaciones más completas, como la que se extiende14 Diamond-Forrester con el estado de estrógenos para las mujeres (para compensar la variación de la edad en la menopausia, así como cualquier histerectomía), así como diabetes, hipertensión, hiperlipidemia, tabaquismo, antecedentes familiares de enfermedad coronaria y obesidad. Sin embargo, tenga en cuenta que algunas metodologías pueden definir la CAD con un estrechamiento luminal del 50%, mientras que el 70% representa las directrices actuales del ACC (excepto la arteria principal izquierda con un 50%).
La economía de POC-CAD y la forma en que la prueba interactúa con la vía de atención representan características cruciales para determinar si la prueba es realmente adecuada para el uso clínico. Para el diagnóstico de la EAC, la prueba más utilizada es la MPI, a menudo conocida como prueba de esfuerzo nuclear o SPECT. A partir de 2019, el MPI se utilizó en aproximadamente el 85% de las evaluaciones para CAD15. Se estima que en los EE.UU. se realizan anualmente entre 7 y 8 millones de estudios SPECT-MPI16 años. En aproximadamente el 5% de los casos de pacientes, se utiliza la ATCC para diagnosticar la EAC. Se ha reconocido que la ATCC tiene un rendimiento diagnóstico superior para descartar la EAC significativa. Otras dos modalidades de imagen, la PET y la RMN cardíaca, constituyen la mayor parte de las evaluaciones restantes. Para todas estas pruebas, se requiere una cámara de imágenes y un equipo calificado para ejecutar e interpretar la prueba. Estas cámaras son piezas costosas de bienes de capital. En consecuencia, la disponibilidad de estas pruebas suele ser limitada en los entornos sanitarios urbanos, donde hay un volumen suficiente para justificar tanto el gasto inicial como los costes operativos.
En 2021, el Colegio Americano de Cardiología (ACC) publicó sus guías para pacientes sin EAC conocida o pruebas previas y con riesgo intermedio de EAC 2,17 donde tanto el MPI como el CCTA fueron reconocidos como opciones diagnósticas de primera línea. A diferencia de CCTA y MPI, POC-CAD se puede usar en cualquier entorno de punto de atención, como un consultorio médico, un hospital de acceso crítico, un centro de atención tribal y centros de atención terciaria, en lugar de estar restringido, como lo están CCTA y MPI, solo a aquellos centros con equipos de diagnóstico por imágenes costosos y los equipos necesarios para operarlos.
Por lo general, los pacientes con sospecha de EAC después de una prueba de primera línea serán remitidos a ICA; como se describe, se considera el diagnóstico de referencia para la EAC. La ACI es un procedimiento invasivo realizado en un entorno hospitalario ambulatorio por especialistas en cardiología invasiva.
Un estudio reciente sobre la tasa de asistencia a las citas para exámenes radiológicos en un gran centro académico terciario mostró que el 24% de las citas programadas no fueron atendidas por el paciente debido a la cancelación o a la no presentación18. Las modalidades radiológicas estudiadas incluyeron el diagnóstico de CAD. La cifra reportada en ese estudio se alinea con una discusión con el oficial financiero de un sistema de salud, quien asume una tasa de inasistencia del 20%. Además, en múltiples conversaciones con médicos rurales, donde se puede requerir un tiempo de viaje significativo para llegar a la prueba, es posible que hasta el 50% de los pacientes no procedan a programar una cita y asistir a la cita. En el siguiente modelo, de manera conservadora para el mercado rural, se supone que es del 30% (es decir, el 70% asiste a la cita).
Existe un impacto directo en el rendimiento diagnóstico de las pruebas posteriores en las que un número significativo de pacientes no proceden a la prueba recomendada. Suponiendo que la tasa es consistente en individuos con y sin enfermedad arterial coronaria significativa, la sensibilidad para detectar la afección en la población referida sería del 70% de la sensibilidad esperada. En el caso de la SPECT, que tiene una sensibilidad reportada para detectar EAC funcionalmente significativa del 73%, la sensibilidad efectiva es de solo el 53% (= 0,7 x 73%)12, es decir, casi la mitad de los pacientes de la población referida con EAC funcionalmente significativa pasarían desapercibidos. Estos pacientes perdidos no le cuestan cero al sistema de salud. Es probable que los pacientes positivos con EAC funcionalmente significativa se vean más tarde e incurran en costos adicionales significativos debido a la progresión de su enfermedad. Por ejemplo, si el paciente se presenta posteriormente en el servicio de urgencias, el costo promedio de la visita para un paciente con signos de síndrome coronario agudo se ha calculado en $30,00019.
Además, incluso para aquellos pacientes sin EAC significativa, si no siguen la referencia de su médico para la toma de imágenes, es menos probable que regresen a ese médico y, por lo tanto, hay pocas oportunidades para determinar qué más podría estar causando sus síntomas. Esto también puede ser costoso tanto para el paciente, en términos de la progresión de la afección subyacente, como para el sistema de atención médica. Por ejemplo, se ha demostrado que un retraso en el diagnóstico de insuficiencia cardíaca agrega un incremento de $8,000 por año al costo de tratar aese paciente.
El modelo económico de costos presentado aquí tiene como objetivo capturar estos impactos, comparando el escenario en el que se utiliza POC-CAD como prueba de primera línea para CAD significativa con un escenario en el que se utiliza SPECT. Como POC-CAD es una prueba de descarte, se espera un mayor número de resultados falsos positivos que para SPECT. No es razonable esperar que todos los positivos de la prueba procedan a la ICA. En muchos casos, sería ideal emplear una segunda prueba. Al analizar los rendimientos de entrada y exclusión de varias pruebas no invasivas para la EAC funcionalmente significativa, Knuuti et al. recomiendan seguir la CCTA con una prueba funcional, como la SPECT12. Sin embargo, de nuevo se corre el riesgo de no identificar a una proporción relativamente grande de pacientes positivos. Una mejor prueba funcional sería la PET cardíaca, que tiene una sensibilidad del 89% y una especificidad del 85%12. La PET cardíaca se utiliza cada vez más en los EE. UU., actualmente es recetada con mayor frecuencia por cardiólogos y ya se usa con más frecuencia que la CCTA15,21. En este modelo, se supone que los positivos de la PET pasan a la ICA. Dado que la sensibilidad de la PET es similar a la sensibilidad de la POC-CAD, se supone que todos los positivos de la población de PET entrante se clasifican correctamente como positivos por la PET. En el modelo en el que se utiliza la SPECT como prueba de primera línea, se supone que los positivos proceden a la ICA. Suponiendo una prevalencia entrante del 12%, esto da como resultado un rendimiento positivo en el ICA del 41%, que se acerca al observado en el estudio PROMISE10.
En la Figura 3 se muestra el modelo y los resultados utilizando una población entrante hipotética de 200 pacientes con síntomas de enfermedad cardiovascular. Se supone que cada uno de los SPECT, PET y POC-CAD serán reembolsados a la misma tarifa: $2,500 por prueba. Se supone que el ICA será reembolsado por 3.000 dólares. El costo de cualquier tratamiento durante la ICA, o posteriormente, no se incluye en el modelo, ya que está más allá de la vía diagnóstica que representa el modelo. Los costos de la pérdida de pacientes negativos y positivos perdidos son más difíciles de estimar. Dado que estos pacientes se definen como aquellos que no han seguido las indicaciones de su médico para proceder a una prueba de imagen, se supone que su próxima interacción con el sistema sanitario es acudir a un servicio de urgencias con síntomas de enfermedad cardiovascular. En un estudio de presentaciones en el servicio de urgencias con tales síntomas, Pope et al. determinaron que el 17% cumplía con los criterios de isquemia cardíaca aguda, el 6% tenía angina estable, el 21% tenía problemas cardíacos no isquémicos y el 56% tenía problemas no cardíacos22. O'Sullivan et al. han calculado los costes de la presentación inicial en el servicio de urgencias en 34.200 dólares para la isquemia miocárdica no mortal y 17.300 dólares para la angina sin revascularización coronaria23. Utilizar únicamente los costos de la presentación inicial es un enfoque conservador, ya que los costos de la fase aguda (3 años) incurridos para el evento son sustancialmente más altos, de 73.300 dólares y 36.000 dólares, respectivamente. El costo de una visita al departamento de emergencias para el 53% de las visitas por dolor torácico, pero sin ningún problema cardíaco resultante identificado, se ha estimado en $2,988 según la información reportada por United Healthcare24. Finalmente, para el 21% con un problema cardíaco no isquémico, el costo se ha estimado en $2,988, más un costo incremental causado por la demora en el tratamiento de la afección cardíaca. Como se indicó anteriormente, para un paciente con insuficiencia cardíaca, el costo anual incremental del diagnóstico tardío se ha calculado en $ 8,00020. Por lo tanto, se ha asumido que el costo para el 21% es de $10,988, asumiendo que la mayoría de estos pacientes tendrán insuficiencia cardíaca o hipertensión pulmonar y un costo de tratamiento tardío similar para ambos. Una vez más, utilizar solo un año de costo incremental es un enfoque conservador, ya que, de hecho, se aplicaría a cada año subsiguiente. En general, el promedio ponderado de estos costos, tal como se utiliza en el modelo, es de 10.833 dólares.
El modelo económico de costos demuestra un ahorro promedio potencial de $1,172 por paciente para el sistema de atención médica debido, en resumen, al costo del tratamiento tardío que resulta en la progresión de la enfermedad que requiere atención más avanzada. Además, la adopción de esta vía aumentaría el rendimiento en ICA al 62%, en comparación con el 41% observado y modelado actualmente en la vía SPECT.
Si se extrapola a la población rural entrante de 2,25 millones de pacientes que presentan síntomas de enfermedad cardiovascular por año en los EE. UU., el ahorro potencial total de la implementación de POC-CAD como prueba de primera línea para la EAC significativa sería de aproximadamente $ 2,64 mil millones. Como se ha comentado anteriormente, un gran componente de estos ahorros se deriva de que no se pasan por alto pacientes con EAC funcionalmente significativa debido a una mayor sensibilidad y un mayor rendimiento diagnóstico que la SPECT. Además, el mayor rendimiento que podría lograrse en ICA es un beneficio crucial, ya que se realizarían más ICA bajo la vía POC-CAD>PET que la vía SPECT. Un mayor rendimiento en la ACI sería beneficioso para los pacientes, que a menudo se sienten frustrados por los resultados negativos de la ACI25, para el cardiólogo intervencionista y para el sistema sanitario.
Una posible objeción a este modelo es que todo el mundo debería ser remitido directamente a la PET en lugar de utilizar primero la prueba POC-CAD. Este enfoque, especialmente cuando se considera a la población rural, podría estar plagado del mismo problema que se observa actualmente con todas las pruebas de imagen: la pérdida de seguimiento. Si se mantuvieran los mismos supuestos para el modelo, el rendimiento efectivo de la PET tendría una sensibilidad de solo el 62% (= 0,7 x 89%), por lo que todavía faltan muchos de los pacientes verdaderamente positivos en esta población. Por el contrario, se observa que tener una prueba positiva de POC-CAD puede alentar a los pacientes a realizar un seguimiento con su derivación para pruebas diagnósticas posteriores (como ICA) y, por lo tanto, no se espera que esto sea un problema en la vía POC-CAD>PET. También se podría argumentar que la SPECT es la vía predominante y, por lo tanto, es muy probable que sea la prueba utilizada en la práctica después de POC-CAD. En este caso, los ahorros de la vía POC-CAD>SPECT resultante serían ligeramente superiores a los mostrados anteriormente, pero el rendimiento efectivo en ICA sería ligeramente inferior (58%) ya que habría tres pacientes positivos perdidos adicionales (falsos negativos) de doscientos en el flujo.
En conclusión, POC-CAD proporciona una adición prometedora a la vía diagnóstica. La principal ventaja de esta prueba es que se puede utilizar en el punto de atención, sin el uso de radiación, estrés o contraste, y sin embargo, ofrece resultados comparables a los de la ATCC para descartar la EAC26 funcionalmente significativa. Además, los resultados están disponibles dentro de la misma visita, lo que permite al médico discutir los próximos pasos en la atención con el paciente sin programar otra visita. Dado que la prueba se puede administrar en el punto de atención y los resultados están disponibles rápidamente, POC-CAD aborda el problema significativo de la pérdida de seguimiento observado, especialmente en las áreas rurales, que representan aproximadamente una cuarta parte de la población de los EE. UU. Dado el sólido perfil de descarte de la prueba, con un resultado negativo, el médico puede explorar rápidamente otras explicaciones de los síntomas del paciente. Cuando se modelan los costos de la demora resultante en el diagnóstico del paciente, el uso de POC-CAD como prueba de primera línea proporcionaría ventajas significativas a los pacientes, los médicos y el pagador. Además, las modalidades de imagen existentes no verían un aumento o una disminución significativos en el volumen, lo cual es una preocupación para muchos centros de imágenes. Los ahorros de costos se logran a través de un diagnóstico y tratamiento más oportunos de la condición del paciente.
Divulgaciones
T.B., N.N., F.F., H.G., C.B., S.R. e I.S. son empleados de Analytics for Life.
Las metodologías relativas a la interpretación de la puntuación CAD de CorVista representan supuestos actuales basados en un subconjunto de la población validada y requieren una validación adicional. Consulte las instrucciones de uso del producto.
Agradecimientos
Los autores desean agradecer a Cody Wackerman y Hugh Dubberly de Dubberly Design Office (San Francisco) por su ayuda en la visualización de las rutas que se muestran en la Figura 3.
Materiales
| Name | Company | Catalog Number | Comments |
| CorVista CAD | CorVista | n/a | System comprising signal acquisition, cloud processing, and delivery of a report containing the CAD Score via a web portal |
| Electrodes | Various (see comments) | Diagnostic quality or high performance electrodes are recommended. For example: Conmed ClearTrace 1700-007 Skintact FS-TB1 Vermed A10005 |
Referencias
- World Health Organization. The top 10 causes of death [Internet]. 2020 [cited 2024 Jun 27]. , Available from: https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death (2020).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79 (2), e21-e129 (2022).
- Burton, T., et al. Development of a non-invasive machine-learned point-of-care rule-out test for coronary artery disease. Diagnostics. 14 (7), 719(2024).
- Stuckey, T. D., et al. Clinical validation of a machine-learned, point-of-care system to IDENTIFY functionally significant coronary artery disease. Diagnostics. 14 (10), 987(2024).
- Frank, E. An accurate, clinically practical system for spatial vectorcardiography. Circulation. 13 (5), 737-749 (1956).
- Park, J., Seok, H. S., Kim, S. S., Shin, H. Photoplethysmogram analysis and applications: An integrative review. Front Physiol. 12, 808451(2022).
- Montalescot, G., et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 34 (38), 2949-3003 (2013).
- Baratloo, A., Hosseini, M., Negida, A., El Ashal, G. Part 1: Simple definition and calculation of accuracy, sensitivity and specificity. Emergency. 3 (2), 48-49 (2015).
- Ranganathan, P., Aggarwal, R. Understanding the properties of diagnostic tests-Part 2: Likelihood ratios. Perspect Clin Res. 9 (2), 99-102 (2018).
- Douglas, P. S., et al. Outcomes of anatomical versus functional testing for coronary artery disease. New Eng J Med. 372 (14), 1291-1300 (2015).
- Safari, S., Baratloo, A., Elfil, M., Negida, A. Evidence based emergency medicine; part 4: Pre-test and post-test probabilities and Fagan's nomogram. Emergency. 4 (1), 48(2016).
- Knuuti, J., et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: a meta-analysis focused on post-test disease probability. Eur Heart J. 39 (35), 3322-3330 (2018).
- Diamond, G. A., Forrester, J. S. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. New Eng J Med. 300 (24), 1350-1358 (1979).
- Morise, A. P. Comparison of the Diamond-Forrester method and a new score to estimate the pre-test probability of coronary disease before exercise testing. Am Heart J. 138 (4), 740-745 (1999).
- Pelletier-Galarneau, M., Vandenbroucke, E., Lu, M., Li, O. Characteristics and key differences between patient populations receiving imaging modalities for coronary artery disease diagnosis in the US. BMC Cardiovasc Disord. 23 (1), 251(2023).
- Li, J., et al. Factors that impact a patient's experience when undergoing single-photon emission computed tomography myocardial perfusion imaging (SPECT-MPI) in the US: A survey of patients, imaging center staff, and physicians. J Nuclear Cardiol. 28 (4), 1507-1518 (2021).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79, e21-e129 (2022).
- Aijaz, A., et al. Sociodemographic factors associated with outpatient radiology no-shows versus cancellations. Acad Radiol. S1076 - 6332 (24), 00228-00229 (2024).
- Cowper, P. A., et al. Acute and 1-year hospitalization costs for acute myocardial infarction treated with percutaneous coronary intervention: Results From the TRANSLATE-ACS registry. J Am Heart Assoc. 16 (8), 8(2019).
- Thomas, A., et al. Forgone medical care associated with increased health care costs among the U.S. heart failure population. JACC Heart Fail. 9 (10), 710-719 (2021).
- Reeves, R. A., Halpern, E. J., Rao, V. M. Cardiac imaging trends from 2010 to 2019 in the Medicare population. Radiol Cardiothorac Imaging. 3 (5), (2021).
- Pope, J. H., et al. Missed diagnoses of acute cardiac ischemia in the Emergency Department. New Eng J Med. 342 (16), 1163-1170 (2000).
- OʼSullivan, A. K., et al. Cost estimation of cardiovascular disease events in the US. Pharmacoeconomics. 29 (8), 693-704 (2011).
- Corso, A. Emergency visit cost with and without insurance in 2024. Mira. , https://www.talktomira.com/post/how-much-does-an-er-visit-cost (2024).
- Patel, M. R. Low diagnostic yield of elective coronary angiography. New Eng J Med. 362 (10), 886-895 (2010).
- Browning, S. CorVista System 510(k) Summary (K232686). , U.S. Food and Drug Administration. Retrieved from https://www.accessdata.fda.gov/cdrh_docs/pdf23/K232686.pdf (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados