Method Article
Aquisição de sinal, interpretação de pontuação e economia de um teste não invasivo no local de atendimento para doença arterial coronariana
Neste Artigo
Resumo
A metodologia para adquirir o sinal fisiológico para um teste de Doença Arterial Coronariana (DAC) é apresentada. Propõe-se um método para interpretar o escore CAD em relação à positividade e negatividade do teste, incluindo as granularidades de cada um. A economia do teste é discutida no contexto do padrão atual de atendimento.
Resumo
Um teste não invasivo no local de atendimento para Doença Arterial Coronariana (DAC) (POC-CAD) foi desenvolvido e validado anteriormente. O teste requer a aquisição simultânea de sinais de gradiente de tensão ortogonal (OVG) e fotopletismograma, que é a principal metodologia descrita neste artigo. A aquisição do OVG, um sinal biopotencial, requer a colocação de eletrodos na pele preparada do tórax do paciente (dispostos de forma semelhante à configuração do eletrodo de Frank, compreendendo seis eletrodos bipolares e um eletrodo de referência) e um sensor hemodinâmico no dedo (usando uma modalidade de transmissão padrão). O sinal é carregado em um sistema baseado em nuvem, onde os recursos projetados são extraídos do sinal e fornecidos a um algoritmo de aprendizado de máquina para produzir a pontuação CAD. O médico deve então interpretar o valor do escore CAD no contexto da probabilidade pré-teste de DAC do paciente, resultando em uma probabilidade pós-teste de DAC. Essa interpretação pode ser realizada no nível de positividade do teste e negatividade do teste ou em um nível mais fino de granularidade; metodologias para cada um são propostas aqui com base em razões de verossimilhança. Usando a probabilidade pós-teste, o médico deve determinar o próximo passo apropriado no tratamento de seu paciente; Vários cenários são usados para ilustrar esse processo. A adoção do teste só é viável se for economicamente viável; é fornecida uma discussão sobre a integração do teste no fluxo de diagnóstico CAD e a economia de custos resultante para o sistema de saúde. O modelo econômico demonstra que a economia de custos para o sistema de saúde pode ser alcançada evitando o atraso no tratamento, que, se não for tratado, resulta na progressão da doença que requer cuidados mais avançados (e caros).
Introdução
A doença isquêmica do coração (DIC) é atualmente a principal causa de morte em todo o mundo1. A doença arterial coronariana (DAC) é o precursor anatômico da DIC, caracterizada pela presença de lesões significativas dentro das artérias coronárias. A significância pode ser definida anatomicamente por uma oclusão de pelo menos 70%, ou 50% no tronco da coronáriaesquerda2. A significância também pode ser definida com base no impacto funcional da lesão, medindo seu efeito no fluxo sanguíneo. Especificamente, a reserva de fluxo fracionário (FFR) e a reserva de fluxo instantâneo (iFR) avaliam a mudança no fluxo causada pela lesão, e as lesões são definidas como significativas em FFR < 0,80 ou iFR < 0,892. O padrão-ouro para confirmar a presença de DAC significativa é a angiografia coronária invasiva (ACI) por cateterismo cardíaco esquerdo (LHC). A DAC significativa justifica a revascularização por meio da colocação de um stent ou cirurgia de revascularização do miocárdio, que alivia a isquemia miocárdica e os sintomas anginosos correspondentes e estabiliza a placa (no caso de implante de stent).
Os testes não invasivos atuais para DAC geralmente requerem exposição à radiação, estresse e injeção de contraste (com impactos renais)1. Os testes diagnósticos mais comumente usados são a imagem de perfusão miocárdica (MPI), também conhecida como tomografia computadorizada por emissão de fóton único (SPECT), e a angiografia por tomografia computadorizada de coronárias (ATC). O SPECT envolve a injeção de um radioisótopo para rastrear a perfusão durante o repouso e o estresse (exercício ou farmacêutico). O CCTA faz imagens das artérias coronárias usando vários raios-X. A tomografia por emissão de pósitrons (PET) e a ressonância magnética cardíaca (RMC) também são ocasionalmente usadas para testes de DAC1. Todas essas modalidades exigem investimento de capital significativo em equipamentos, pessoal treinado para realizar os testes e, em alguns casos, a disponibilidade de isótopos médicos. Devido a esses requisitos, essas modalidades muitas vezes não estão amplamente disponíveis, especialmente em ambientes rurais, o que introduz atrasos no atendimento ao paciente e aumenta os riscos associados.
Portanto, o objetivo era projetar um teste não invasivo no local de atendimento para CAD (POC-CAD): o sistema CorVista3. Este sistema é um teste aprovado pela FDA para CAD funcionalmente significativo, com desempenho comparável ao CCTA4. O teste pode ser utilizado sem estresse do paciente e sem a necessidade de investimento de capital em equipamentos ou pessoal especializado. É ideal para uso em ambientes rurais e com recursos limitados, onde o acesso às tecnologias de imagem atuais geralmente não está disponível.
O desenvolvimento3 e a validação4 do POC-CAD foram publicados anteriormente. Resumidamente, o POC-CAD começa com a aquisição simultânea de gradiente de tensão ortogonal e sinais de fotopletismograma usando o dispositivo de captura, conforme descrito na etapa 1 do protocolo. O gradiente de tensão ortogonal é um sinal biopotencial adquirido usando uma colocação de eletrodo semelhante à configuração de eletrodo de Frank5, compreendendo seis eletrodos bipolares e um eletrodo de referência conectado ao tronco. O fotopletismograma é obtido usando a modalidade de transmissão padrão, onde a luz vermelha e infravermelha é transmitida através da ponta do dedo e atinge um sensor6. Depois que o sinal é adquirido, ele é carregado automaticamente no sistema baseado em nuvem, onde os recursos projetados são extraídos do sinal e fornecidos a um algoritmo de aprendizado de máquina para produzir a pontuação CAD, que é apresentada no portal da web. Nas etapas 2 e 3 do protocolo, é descrita a metodologia para interpretar a pontuação CAD retornada pelo teste. Especificamente, dados publicados ou outras fontes relevantes para o médico podem ser usados para estimar a probabilidade de DAC antes de o paciente fazer o teste. As razões de verossimilhança podem ser calculadas a partir do desempenho do teste e usadas para atualizar a probabilidade de DAC do pré-teste para o pós-teste, usando o resultado do teste binário (etapa 2) ou valores mais granulares da pontuação CAD (etapa 3). Finalmente, é discutida a modelagem da economia do POC-CAD em comparação com o padrão atual de atendimento.
Protocolo
O estudo foi aprovado pelo Conselho de Revisão Institucional Ocidental e conduzido de acordo com a Declaração de Helsinque. O consentimento informado por escrito foi obtido de todos os sujeitos para participação. Resumidamente, para serem incluídos, os indivíduos devem ter pelo menos 18 anos de idade com sintomas cardiovasculares, mas sem doença arterial coronariana conhecida e programados para serem submetidos a ICA ou CCTA. Os critérios de exclusão incluíram história prévia documentada de infarto do miocárdio, cirurgia prévia de revascularização do miocárdio e substituição prévia da válvula cardíaca, entre outros. Os critérios completos de inclusão e exclusão do estudo podem ser encontrados no clinicaltrials.gov, no número do National Clinical Trial (NCT) NCT03864081. O equipamento e o software utilizados estão listados na Tabela de Materiais.
1. Aquisição de sinal
- Prepare a pele raspando qualquer cabelo do local do eletrodo. Certifique-se de que não haja resíduos restantes na pele limpando com água e sabão e empregando uma gaze limpa e seca ou um lenço sem álcool, se necessário.
- Conecte os fios aos eletrodos e coloque-os de acordo com a Tabela 1.
NOTA: A qualidade do eletrodo pode afetar a qualidade do sinal; Recomenda-se o uso de eletrodos de qualidade diagnóstica ou de alto desempenho. - Coloque o sensor hemodinâmico (fotopletismograma, PPG) no dedo do sujeito, certificando-se de que o dedo esteja o mais longe possível do sensor, com o cabo do sensor posicionado ao longo da parte superior da mão.
- Utilize o dedo indicador, a menos que uma ferida ou outro motivo clinicamente relevante impeça seu uso. Aconselhe o paciente a não mover o sensor depois de colocado.
- Posicione o paciente deitado de costas em uma posição de repouso confortável. Certifique-se de que o cabo do sensor PPG e os cabos do eletrodo não se sobreponham.
- Use amortecimento (por exemplo, um cobertor enrolado ou toalha, junto com um travesseiro), se necessário, para evitar que o paciente coloque pressão direta no eletrodo azul nas costas.
- Para limitar o ruído do sinal e maximizar a qualidade do sinal, na medida do possível, desligue todos os dispositivos eletrônicos (monitores, televisores, telefones celulares, etc.) ou remova-os da sala. Desligue a iluminação da sala.
- Insira as informações do paciente e confirme a correção: nome do paciente, sobrenome do paciente, sexo ao nascer, altura em polegadas, peso em libras, data de nascimento e número do registro médico (todos necessários, podem ser inseridos em qualquer ordem).
- Certifique-se de que o paciente esteja confortável e lembre-o de ficar quieto e quieto (por exemplo, não falar durante a aquisição).
- Coloque o dispositivo em uma superfície plana e confirme o posicionamento no aplicativo. Pressione Iniciar para iniciar a aquisição do sinal.
- Monitore o dispositivo em busca de mensagens de erro e, se elas aparecerem, siga as instruções na tela para resolvê-las.
- Após a conclusão da aquisição do sinal, exigindo 3 min e 35 s, o dispositivo transmitirá automaticamente os dados para a nuvem para avaliação da qualidade do sinal. Mantenha o paciente conectado ao dispositivo até que a confirmação da qualidade do sinal de passagem seja recebida.
- Retire os eletrodos do paciente e remova o sensor PPG.
- Acesse o portal para visualizar os resultados do teste (estará disponível cerca de 10 minutos após o sinal ter sido carregado na nuvem).
Tabela 1: Colocação do eletrodo. Descrição dos locais anatômicos em que cada um dos sete eletrodos deve ser colocado. Clique aqui para baixar esta tabela.
2. Interpretando os resultados do teste dado teste positivo vs . teste negativo
- Determine a probabilidade de doença pré-teste do paciente (por exemplo, usando as diretrizes da Sociedade Europeia de Cardiologia (ESC)7).
- Determine se o teste do paciente é positivo ou negativo comparando a pontuação CAD com 0: se maior ou igual a zero, o resultado do paciente é positivo ou, se menor que zero, o resultado é negativo.
- Leia o valor da pontuação CAD do relatório e compare-o com as distribuições de pacientes negativos e positivos na coorte de validação mostrada na parte inferior do relatório.
- Calcule a sensibilidade e a especificidade8 e, em seguida, as razões de verossimilhança (LR) usando a equação 1 e a equação 29.
NOTA: Um exemplo trabalhado é mostrado, uma vez que a sensibilidade do teste é de 88% (calculada usando indivíduos positivos de ACI, que é o único grupo de indivíduos com doença) e a especificidade é de 51% (calculada usando indivíduos negativos de CCTA com um peso de 94% e indivíduos negativos de ICA com um peso de 6%, para representar a população geral por meio do estudo PROMISE10).
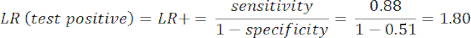 (EQN 1)
(EQN 1)
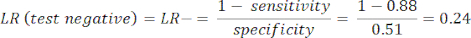 (EQN 2)
(EQN 2) - Calcule a probabilidade pós-teste do paciente dadas as seguintes equações 3-511, onde LR+ é usado no caso de um teste positivo e LR- é usado no caso de um teste negativo:
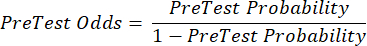 (EQN 3)
(EQN 3)
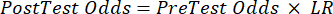 (EQN 4)
(EQN 4)
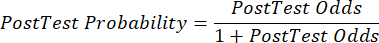 (EQN 5)
(EQN 5) - Com a probabilidade atualizada de DAC, dados os resultados do teste, determine o próximo passo apropriado no atendimento ao paciente (por exemplo, usando as recomendações da diretriz7 da ESC mostradas na Tabela 2).
Tabela 2: Diretrizes ESC por probabilidade de DAC. Para quatro níveis de probabilidade de DAC, as diretrizes da Sociedade Europeia de Cardiologia são para a interpretação apropriada dessa probabilidade, incluindo o próximo teste (se necessário). Clique aqui para baixar esta tabela.
3. Interpretando os resultados do teste fornecidos com granularidade mais fina
- Aumentar a granularidade dos resultados do teste positivo e do teste negativo, considerando as faixas do escore CAD observadas na população utilizada para validar o teste, especificamente a divisão em tercis (número igual de indivíduos em três compartimentos) nas faixas de teste positivo e teste negativo, conforme mostrado na Tabela 3.
NOTA: Para simplificar os cálculos, a contribuição de 6% dos indivíduos negativos do cateterismo é excluída desta análise, cuja inclusão não alterará significativamente os resultados. - Dentro de cada tercil na faixa de teste negativo, calcule o número de Verdadeiros Negativos (TN), que são indivíduos que realmente não têm a doença, e o número de Falsos Negativos (FN), indivíduos que realmente têm a doença.
- Aplicar as seguintes equações 6-811 para determinar o LR- de cada tercil negativo para o ensaio (LR+ de tercis negativos não relevante).
NOTA: As equações pressupõem que o perfil de desempenho do tercil representa o intervalo completo de teste negativo para calcular as estatísticas de desempenho (necessitando do fator de correção de três, correspondente ao número de tercis, para atingir a frequência original de negatividade do teste em relação à positividade do teste).
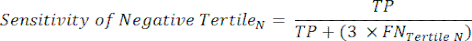 (EQN 6)
(EQN 6)
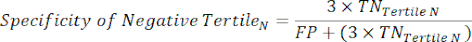 (EQN 7)
(EQN 7)
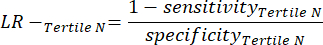 (EQN 8)
(EQN 8)
- Aplicar as seguintes equações 6-811 para determinar o LR- de cada tercil negativo para o ensaio (LR+ de tercis negativos não relevante).
- Dentro de cada tercil na faixa de teste positivo, calcule o número de Verdadeiros Positivos (TP), que são indivíduos que realmente têm a doença, e o número de Falsos Positivos (FP), indivíduos que realmente não têm a doença.
- Aplicar as equações 9-11 para determinar o RV+ de cada tercil positivo para teste (RV- de tercis positivos não relevantes)11.
NOTA: As equações assumem que o perfil de desempenho do tercil representa toda a faixa positiva do teste para fins de cálculo das estatísticas de desempenho (necessitando do fator de correção de três, correspondente ao número de tercis, para atingir a frequência original de positividade do teste em relação à negatividade do teste).
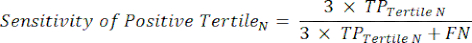 (EQN 9)
(EQN 9)
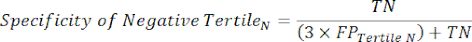 (Eqn 10)
(Eqn 10)
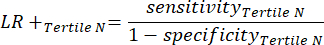 (EQN 11)
(EQN 11)
- Aplicar as equações 9-11 para determinar o RV+ de cada tercil positivo para teste (RV- de tercis positivos não relevantes)11.
- Determine em qual tercil o escore CAD do paciente está e, considerando os LRs na Tabela 3, calcule a probabilidade pós-teste dado o procedimento mostrado na etapa 2.
NOTA: Como é de se esperar, os valores de LR- diminuem com mais escores CAD negativos, e os valores de LR+ aumentam com escores CAD mais positivos, o que significa que um escore CAD mais negativo reduz de forma mais eficaz a probabilidade pré-teste, e um escore CAD mais positivo aumenta mais efetivamente a probabilidade pré-teste. - Como alternativa à realização dos cálculos listados nas etapas 2.4-3.4, use a Tabela 4 para traduzir a probabilidade pré-teste em uma probabilidade pós-teste usando o escore CAD7 do paciente.
Tabela 3: Razões de verossimilhança. Para três faixas de escores entre teste positivo e teste negativo, as razões de verossimilhança positivas e negativas correspondentes, respectivamente. Clique aqui para baixar esta tabela.
Tabela 4: Mapeamento de probabilidade pré-teste para pós-teste. Para 10 níveis de probabilidade pré-teste, a probabilidade pós-teste correspondente recebeu uma pontuação CAD em cada um dos três tercis negativos e em cada um dos tercis positivos. A coloração verde corresponde a <15% de probabilidade da doença (a diretriz ESC afirma que a DAC pode ser descartada); a coloração amarela corresponde a 15% -65% de probabilidade de doença (as diretrizes da ESC afirmam que o teste não invasivo baseado em imagem é preferível); laranja corresponde a 66% -85% de probabilidade de doença (as diretrizes da ESC afirmam que testes não invasivos baseados em imagem devem ser realizados); vermelho corresponde a >85% de probabilidade de doença (a diretriz ESC afirma que a DAC pode ser descartada). Consulte a Tabela 2 para obter mais informações sobre as diretrizes. Observe que uma pontuação CAD de 0 é considerada positiva para o teste. Clique aqui para baixar esta tabela.
Resultados
Um exemplo de sinal pode ser visto na Figura 1 e relatado na Figura 2, como pareceria a um médico usando o teste. Abaixo estão vários casos de pacientes fornecidos para demonstrar a aplicação da metodologia na interpretação do significado do escore CAD.
Caso 1
Um homem de 67 anos apresentou queixa de sintomas de dor torácica em repouso, com dor irradiada no braço, juntamente com diaforese e náuseas. Com base nas diretrizes da ESC7, sua idade, sexo e sintomas são consistentes com uma probabilidade inicial de doença de 84%. As diretrizes da ESC sugerem que esse paciente requer testes não invasivos para fazer um diagnóstico de DAC para justificar o encaminhamento para cateterismo cardíaco e qualquer intervenção necessária (Tabela 2). O POC-CAD foi realizado, retornando um escore CAD de 0,32, que é um resultado positivo do teste e cai no maior tercil de escores positivos de DAC, com RV+ de 2,888 (Tabela 3). Portanto, a probabilidade pós-teste do paciente é de 94% e, de acordo com as diretrizes da ESC (Tabela 2), pode-se presumir que o paciente tem DAC com segurança, e o cateterismo cardíaco invasivo é um curso de ação apropriado.
Caso 2
Uma mulher de 39 anos apresenta dor torácica em repouso, irradiando para o lado esquerdo e direito. Com base nas diretrizes da ESC7, sua idade, sexo e sintomas são consistentes com uma probabilidade inicial de doença de 28%, e as diretrizes sugerem que um teste não invasivo seria o próximo passo preferível para obter uma maior compreensão da probabilidade de DAC. No entanto, as diretrizes também afirmam que em pacientes jovens (como esta mulher de 39 anos), o médico deve estar ciente da exposição à radiação, que é necessária para administrar um teste como o SPECT, exigindo um radioisótopo injetado. Outra opção para esse teste é o CCTA, mas isso requer muitos raios-X. Portanto, o POC-CAD é uma escolha lógica, pois não requer radiação. O teste foi realizado retornando um valor de -0,12, dentro dos limites do primeiro tercil da faixa negativa, com RV- de 0,129 (Tabela 3). A probabilidade pós-teste resultante é de 4%, que cai para o nível em que o CAD pode ser descartado com segurança de acordo com as diretrizes da ESC, sem necessidade de testes adicionais para CAD.
Caso 3
Uma mulher de 74 anos apresenta dor torácica não anginosa e dispneia. Com base nas diretrizes da ESC7, sua idade, sexo e sintomas são consistentes com uma probabilidade inicial de doença de 24%, e as diretrizes sugerem que um teste não invasivo seria o próximo passo preferível para obter uma maior compreensão da probabilidade de DAC. A paciente hesita em viajar da clínica rural onde está sendo tratada para o grande centro urbano onde todas as modalidades de teste (PET, SPECT, CCTA, CMR) estão disponíveis, então o médico oferece POC-CAD. O escore CAD é de 0,07, caindo no primeiro tercil da faixa positiva com RV+ de 1,446, resultando em uma probabilidade pós-teste de 33%. Com base no resultado positivo e no aumento da probabilidade de doença, o paciente concorda em viajar para a cidade para um PET scan. O PET também foi indicativo de doença, com RV+ de 6,0412, e aumenta o de 33% a 75% pós-PET.
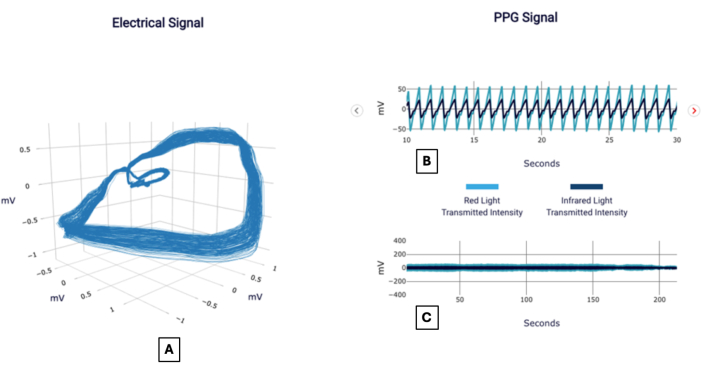
Figura 1: Exemplos de sinais. Relatório POC-CAD exemplar mostrando visualizações do gradiente de tensão ortogonal, também conhecido como sinal elétrico (A), e o sinal do fotopletismograma focado em um intervalo de 20 s (B) e duração total (C). Clique aqui para ver uma versão maior desta figura.
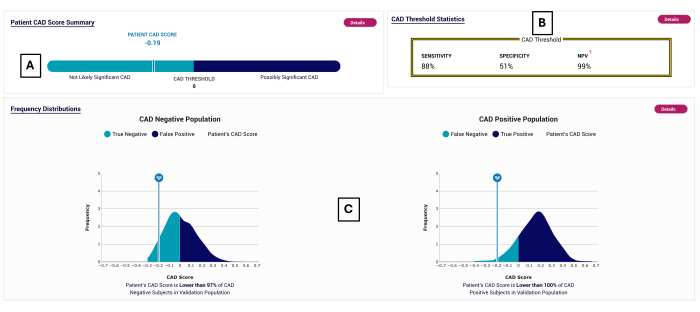
Figura 2: Exemplo de relatório CAD. Relatório POC-CAD exemplar, mostrando uma pontuação CAD de -0,19 (A), que se enquadra na faixa negativa do teste (<0). O desempenho do teste é mostrado em (B). A distribuição dos escores CAD é exibida para os sujeitos nos quais o POC-CAD foi validado em (C). Clique aqui para ver uma versão maior desta figura.
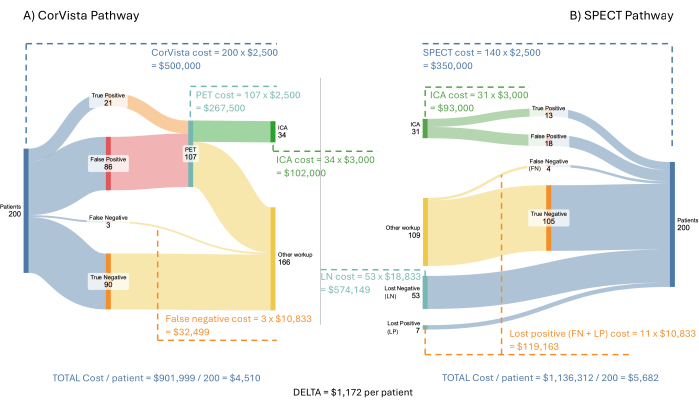
Figura 3: Fluxo do modelo econômico de custo. Uma população hipotética de 200 pacientes é executada através da via POC-CAD>PET (A) e da via SPECT (B). Os custos para o sistema de saúde são mostrados para cada ramo de cada via, juntamente com a economia média por paciente quando a via POC-CAD>PET é implementada. Clique aqui para ver uma versão maior desta figura.
Discussão
O foco principal desta seção é a economia do teste; no entanto, é útil discutir primeiro os aspectos da avaliação da probabilidade pré-teste para DAC. Conforme descrito nas etapas 2 e 3 do protocolo, a estimativa da probabilidade pré-teste de DAC é uma etapa crítica na contextualização do escore CAD e na determinação da probabilidade pós-teste de DAC. Utilizamos as diretrizes da ESC 2013, que baseiam a probabilidade de DAC em três características: sexo, idade e sintomas (dentro dos grupos de angina típica, dor atípica e não anginosa)7. No entanto, é importante notar que o médico pode aplicar seu julgamento clínico na seleção de qualquer método quantitativo ou qualitativo. Além disso, existem outros métodos quantitativos publicados disponíveis para tal estimativa, incluindo o Diamond-Forrester13, que requer as mesmas características de entrada do ESC 2013. Variações mais abrangentes também foram publicadas, como a que estende14 Diamond-Forrester com status de estrogênio para mulheres (para compensar a variação de idade na menopausa, bem como qualquer histerectomia), bem como diabetes, hipertensão, hiperlipidemia, tabagismo, história familiar de doença coronariana e obesidade. No entanto, esteja ciente de que algumas metodologias podem definir DAC em 50% de estreitamento luminal, enquanto 70% representa as diretrizes atuais do ACC (exceto o tronco da coronária esquerda em 50%).
A economia do POC-CAD e como o teste interage com a via de atendimento representam características cruciais para determinar se o teste é realmente adequado para uso clínico. Para o diagnóstico de DAC, o teste mais utilizado é o MPI, muitas vezes conhecido como teste de estresse nuclear ou SPECT. A partir de 2019, o MPI foi usado em aproximadamente 85% das avaliações para CAD15. Estima-se que 7-8 milhões de estudos SPECT-MPI sejam realizados nos EUA anualmente16. Em aproximadamente 5% dos casos de pacientes, a ATC é usada para diagnosticar DAC. A TA foi reconhecida como tendo desempenho diagnóstico superior na exclusão de DAC significativa. Duas outras modalidades de imagem, PET e ressonância magnética cardíaca, compõem a maior parte das avaliações restantes. Para todos esses testes, é necessária uma câmera de imagem e uma equipe qualificada para executar e interpretar o teste. Essas câmeras são equipamentos caros de capital. Consequentemente, esses testes são frequentemente limitados em disponibilidade para ambientes urbanos de saúde, onde há volume suficiente para justificar tanto a despesa inicial quanto os custos operacionais.
Em 2021, o American College of Cardiology (ACC) publicou suas diretrizes para pacientes sem DAC conhecida ou testes anteriores e com risco intermediário de DAC 2,17, onde tanto o MPI quanto o CCTA foram reconhecidos como opções diagnósticas de primeira linha. Em contraste com o CCTA e o MPI, o POC-CAD pode ser usado em qualquer ambiente de ponto de atendimento, como consultório médico, hospital de acesso crítico, centro de atendimento tribal e centros de atendimento terciário, em vez de ser restrito, como o CCTA e o MPI, apenas aos centros com equipamentos de imagem caros e às equipes necessárias para operá-los.
Normalmente, os pacientes com suspeita de DAC após um teste de primeira linha serão encaminhados para ACI; conforme descrito, este é considerado o diagnóstico padrão-ouro para DAC. A ACI é um procedimento invasivo realizado em ambiente hospitalar ambulatorial por especialistas em cardiologia invasiva.
Um estudo recente sobre a taxa de comparecimento a consultas radiológicas em um grande centro acadêmico terciário mostrou que 24% das consultas agendadas não foram atendidas pelo paciente por cancelamento ou não comparecimento18. As modalidades radiológicas estudadas incluíram diagnósticos de DAC. O número relatado nesse estudo se alinha com uma discussão com o diretor financeiro de um sistema de saúde, que assume uma taxa de não comparecimento de 20%. Além disso, em várias discussões com médicos rurais, onde pode ser necessário um tempo de viagem significativo para chegar ao teste, até 50% dos pacientes podem não marcar uma consulta e comparecer à consulta. No modelo a seguir, conservadoramente para o mercado rural, isso é assumido em 30% (ou seja, 70% comparecem à consulta).
Há um impacto direto no rendimento diagnóstico dos testes a jusante, onde um número significativo de pacientes não prossegue para o teste recomendado. Supondo que a taxa seja consistente entre indivíduos com e sem doença arterial coronariana significativa, a sensibilidade de detectar a condição em toda a população referida seria de 70% da sensibilidade esperada. No caso do SPECT, que tem uma sensibilidade relatada para detectar DAC funcionalmente significativa de 73%, a sensibilidade efetiva é de apenas 53% (= 0,7 x 73%)12, ou seja, quase metade dos pacientes da população referida com DAC funcionalmente significativa seria perdida. Esses pacientes perdidos não custam zero ao sistema de saúde. Os pacientes positivos com DAC funcionalmente significativa provavelmente serão atendidos mais tarde e incorrerão em custos adicionais significativos devido à progressão de sua doença. Por exemplo, se o paciente se apresentar posteriormente ao pronto-socorro, o custo médio da visita para um paciente com sinais de síndrome coronariana aguda foi calculado em US$ 30.00019.
Além disso, mesmo para aqueles pacientes sem DAC significativa, se eles não seguirem o encaminhamento de seu médico para exames de imagem, é menos provável que retornem a esse médico e, portanto, há oportunidades limitadas de determinar o que mais pode estar causando seus sintomas. Isso também pode ser caro tanto para o paciente, em termos de progressão da condição subjacente, quanto para o sistema de saúde. Por exemplo, um atraso no diagnóstico de insuficiência cardíaca demonstrou adicionar um incremento de US$ 8.000 por ano ao custo do tratamento desse paciente20.
O modelo econômico de custo apresentado aqui visa capturar esses impactos, comparando o cenário em que o POC-CAD é usado como teste de linha de frente para CAD significativo com um cenário em que o SPECT é usado. Como o POC-CAD é um teste de exclusão, espera-se um número maior de resultados falsos positivos do que para o SPECT. Não é razoável esperar que todos os positivos do teste prossigam para o ICA. Em muitos casos, seria ideal empregar um segundo teste. Ao analisar os desempenhos de entrada e exclusão de vários testes não invasivos para DAC funcionalmente significativa, Knuuti et al. recomendam seguir a ATC com um teste funcional, como o SPECT12. No entanto, isso novamente corre o risco de não identificar uma proporção relativamente grande de pacientes positivos. Um teste funcional melhor seria o PET cardíaco, que tem sensibilidade de 89% e especificidade de 85%12. A PET cardíaca está sendo cada vez mais utilizada nos EUA, atualmente é a mais frequentemente prescrita por cardiologistas e já é mais utilizada do que a ATC15,21. Neste modelo, os positivos do PET são então assumidos para prosseguir para o ICA. Como a sensibilidade do PET é semelhante à sensibilidade do POC-CAD, todos os positivos na população de PET de entrada são considerados corretamente classificados como positivos pelo PET. No modelo em que o SPECT é usado como teste de linha de frente, presume-se que os positivos prossigam para o ICA. Assumindo uma prevalência de entrada de 12%, isso resulta em um rendimento positivo na ICA de 41%, próximo ao observado no estudo PROMISE10.
A Figura 3 mostra o modelo e os resultados usando uma população hipotética de 200 pacientes com sintomas de doença cardiovascular. Presume-se que cada um dos SPECT, PET e POC-CAD seja reembolsado na mesma taxa: US$ 2.500 por teste. Presume-se que a ICA seja reembolsada em $ 3,000. O custo de qualquer tratamento durante a ACI, ou posteriormente, não está incluído no modelo, pois está além da via diagnóstica que o modelo representa. Os custos de pacientes negativos perdidos e positivos perdidos são mais difíceis de estimar. Dado que esses pacientes são definidos como não tendo seguido a orientação de seu médico para prosseguir com um exame de imagem, presume-se que sua próxima interação com o sistema de saúde seja apresentar-se em um pronto-socorro com sintomas de doença cardiovascular. Em um estudo de apresentações em pronto-socorro com esses sintomas, Pope et al. determinaram que 17% preenchiam os critérios para isquemia cardíaca aguda, 6% tinham angina estável, 21% tinham problemas cardíacos não isquêmicos e 56% tinham problemas não cardíacos22. Os custos para apresentação inicial no pronto-socorro foram calculados por O'Sullivan et al. em US$ 34.200 para isquemia miocárdica não fatal e US$ 17.300 para angina sem revascularização coronariana23. Usar apenas os custos na apresentação inicial é uma abordagem conservadora, pois os custos da fase aguda (3 anos) incorridos para o evento são substancialmente mais altos, em US$ 73.300 e US$ 36.000, respectivamente. O custo de uma visita ao pronto-socorro para 53% das visitas por dor no peito, mas sem nenhum problema cardíaco resultante identificado, foi estimado em US$ 2.988 usando informações relatadas pela United Healthcare24. Finalmente, para os 21% com um problema cardíaco não isquêmico, o custo foi estimado em US $ 2.988, mais um custo incremental causado pelo atraso no tratamento da condição cardíaca. Como dito acima, para um paciente com insuficiência cardíaca, o custo anual incremental do diagnóstico tardio foi calculado em US$ 8.00020. Portanto, o custo para os 21% foi assumido em $ 10,988, assumindo que a maioria desses pacientes terá insuficiência cardíaca ou hipertensão pulmonar e um custo de tratamento atrasado semelhante para ambos. Mais uma vez, usar apenas um ano de custo incremental é uma abordagem conservadora, pois isso se aplicaria, de fato, a cada ano subsequente. No geral, a média ponderada desses custos, conforme usada no modelo, é de US$ 10.833.
O modelo econômico de custo demonstra uma economia média potencial de US$ 1.172 por paciente para o sistema de saúde devido, em resumo, ao custo do tratamento tardio, resultando na progressão da doença que requer cuidados mais avançados. Além disso, a adoção dessa via aumentaria o rendimento na ICA para 62%, em comparação com os 41% atualmente observados e modelados na via SPECT.
Se extrapolado para a população rural de 2,25 milhões de pacientes que apresentam sintomas de doença cardiovascular por ano nos EUA, a economia potencial total da implementação do POC-CAD como um teste de linha de frente para DAC significativa seria de aproximadamente US$ 2,64 bilhões. Conforme discutido acima, um grande componente dessas economias é derivado de não perder pacientes com DAC funcionalmente significativa devido a uma maior sensibilidade e maior rendimento diagnóstico do que o SPECT. Além disso, o maior rendimento que poderia ser alcançado na ICA é um benefício crucial, pois mais ICAs seriam realizados na via POC-CAD>PET do que na via SPECT. Um maior rendimento na ACI seria benéfico para os pacientes, que muitas vezes estão frustrados com os resultados negativos da ACI25, o cardiologista intervencionista e o sistema de saúde.
Uma possível objeção a esse modelo é que todos devem ser encaminhados diretamente para o PET, em vez de usar o teste POC-CAD primeiro. Essa abordagem, especialmente quando se considera a população rural, pode estar repleta do mesmo problema que é observado atualmente em todos os exames de imagem - o da perda de seguimento. Se as mesmas suposições para o modelo fossem mantidas, o rendimento efetivo do PET teria uma sensibilidade de apenas 62% (= 0,7 x 89%), ainda faltando muitos dos pacientes verdadeiramente positivos nessa população. Por outro lado, observa-se que ter um teste positivo de POC-CAD pode encorajar os pacientes a acompanhar seu encaminhamento para testes diagnósticos subsequentes (como ICA) e, portanto, não se espera que isso seja um problema na via POC-CAD>PET. Pode-se também argumentar que o SPECT é a via predominante e, portanto, é mais provável que seja o teste usado na prática após o POC-CAD. Nesse caso, a economia da via POC-CAD>SPECT resultante seria ligeiramente maior do que as mostradas acima, mas o rendimento efetivo na ICA seria ligeiramente menor (58%), pois haveria três pacientes positivos perdidos (falsos negativos) adicionais de duzentos no fluxo.
Em conclusão, o POC-CAD fornece uma adição promissora à via diagnóstica. A principal vantagem desse teste é que ele pode ser usado no local de atendimento, sem o uso de radiação, estresse ou contraste, e ainda fornece resultados comparáveis aos da CCTA para descartar CADfuncionalmente significativo 26. Além disso, os resultados estão disponíveis na mesma visita, permitindo que o médico discuta as próximas etapas do atendimento com o paciente sem agendar outra visita. Como o teste pode ser administrado no local de atendimento e os resultados estão rapidamente disponíveis, o POC-CAD aborda o problema significativo de perda de acompanhamento observado, especialmente nas áreas rurais, representando aproximadamente um quarto da população dos EUA. Dado o perfil robusto de exclusão do teste, com resultado negativo, o médico pode explorar rapidamente outras explicações para os sintomas do paciente. Quando os custos do atraso resultante no diagnóstico do paciente são modelados, o uso do POC-CAD como um teste de primeira linha proporcionaria vantagens significativas para pacientes, médicos e pagador. Além disso, as modalidades de imagem existentes não veriam um aumento ou diminuição significativa no volume, o que é uma preocupação para muitos centros de imagem. A economia de custos é obtida por meio de diagnóstico e tratamento mais oportunos da condição do paciente.
Divulgações
T.B., N.N., F.F., H.G., C.B., S.R. e I.S. são funcionários da Analytics for Life.
As metodologias relacionadas à interpretação do escore CorVista CAD representam suposições atuais com base em um subconjunto da população validada e requerem validação adicional. Consulte as instruções de uso do produto.
Agradecimentos
Os autores gostariam de agradecer a Cody Wackerman e Hugh Dubberly, do Dubberly Design Office (San Francisco), por sua ajuda na visualização dos caminhos mostrados na Figura 3.
Materiais
| Name | Company | Catalog Number | Comments |
| CorVista CAD | CorVista | n/a | System comprising signal acquisition, cloud processing, and delivery of a report containing the CAD Score via a web portal |
| Electrodes | Various (see comments) | Diagnostic quality or high performance electrodes are recommended. For example: Conmed ClearTrace 1700-007 Skintact FS-TB1 Vermed A10005 |
Referências
- . The top 10 causes of death [Internet]. 2020 [cited 2024 Jun 27] Available from: https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death (2020)
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79 (2), e21-e129 (2022).
- Burton, T., et al. Development of a non-invasive machine-learned point-of-care rule-out test for coronary artery disease. Diagnostics. 14 (7), 719 (2024).
- Stuckey, T. D., et al. Clinical validation of a machine-learned, point-of-care system to IDENTIFY functionally significant coronary artery disease. Diagnostics. 14 (10), 987 (2024).
- Frank, E. An accurate, clinically practical system for spatial vectorcardiography. Circulation. 13 (5), 737-749 (1956).
- Park, J., Seok, H. S., Kim, S. S., Shin, H. Photoplethysmogram analysis and applications: An integrative review. Front Physiol. 12, 808451 (2022).
- Montalescot, G., et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 34 (38), 2949-3003 (2013).
- Baratloo, A., Hosseini, M., Negida, A., El Ashal, G. Part 1: Simple definition and calculation of accuracy, sensitivity and specificity. Emergency. 3 (2), 48-49 (2015).
- Ranganathan, P., Aggarwal, R. Understanding the properties of diagnostic tests-Part 2: Likelihood ratios. Perspect Clin Res. 9 (2), 99-102 (2018).
- Douglas, P. S., et al. Outcomes of anatomical versus functional testing for coronary artery disease. New Eng J Med. 372 (14), 1291-1300 (2015).
- Safari, S., Baratloo, A., Elfil, M., Negida, A. Evidence based emergency medicine; part 4: Pre-test and post-test probabilities and Fagan's nomogram. Emergency. 4 (1), 48 (2016).
- Knuuti, J., et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: a meta-analysis focused on post-test disease probability. Eur Heart J. 39 (35), 3322-3330 (2018).
- Diamond, G. A., Forrester, J. S. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. New Eng J Med. 300 (24), 1350-1358 (1979).
- Morise, A. P. Comparison of the Diamond-Forrester method and a new score to estimate the pre-test probability of coronary disease before exercise testing. Am Heart J. 138 (4), 740-745 (1999).
- Pelletier-Galarneau, M., Vandenbroucke, E., Lu, M., Li, O. Characteristics and key differences between patient populations receiving imaging modalities for coronary artery disease diagnosis in the US. BMC Cardiovasc Disord. 23 (1), 251 (2023).
- Li, J., et al. Factors that impact a patient's experience when undergoing single-photon emission computed tomography myocardial perfusion imaging (SPECT-MPI) in the US: A survey of patients, imaging center staff, and physicians. J Nuclear Cardiol. 28 (4), 1507-1518 (2021).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79, e21-e129 (2022).
- Aijaz, A., et al. Sociodemographic factors associated with outpatient radiology no-shows versus cancellations. Acad Radiol. S1076 - 6332 (24), 00228-00229 (2024).
- Cowper, P. A., et al. Acute and 1-year hospitalization costs for acute myocardial infarction treated with percutaneous coronary intervention: Results From the TRANSLATE-ACS registry. J Am Heart Assoc. 16 (8), 8 (2019).
- Thomas, A., et al. Forgone medical care associated with increased health care costs among the U.S. heart failure population. JACC Heart Fail. 9 (10), 710-719 (2021).
- Reeves, R. A., Halpern, E. J., Rao, V. M. Cardiac imaging trends from 2010 to 2019 in the Medicare population. Radiol Cardiothorac Imaging. 3 (5), (2021).
- Pope, J. H., et al. Missed diagnoses of acute cardiac ischemia in the Emergency Department. New Eng J Med. 342 (16), 1163-1170 (2000).
- OʼSullivan, A. K., et al. Cost estimation of cardiovascular disease events in the US. Pharmacoeconomics. 29 (8), 693-704 (2011).
- Emergency visit cost with and without insurance in 2024. Mira Available from: https://www.talktomira.com/post/how-much-does-an-er-visit-cost (2024)
- Patel, M. R. Low diagnostic yield of elective coronary angiography. New Eng J Med. 362 (10), 886-895 (2010).
- Browning, S. . CorVista System 510(k) Summary (K232686). , (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados