Method Article
Acquisition de signaux, interprétation du score et économie d’un test non invasif au point de service pour la maladie coronarienne
Dans cet article
Résumé
La méthodologie d’acquisition du signal physiologique pour un test de maladie coronarienne (CAD) est présentée. Une méthode est proposée pour interpréter le score CAD concernant la positivité et la négativité des tests, y compris les granularités de chacun. Les aspects économiques du test sont discutés dans le contexte de la norme de pratique actuelle.
Résumé
Un test non invasif au point de service pour la maladie coronarienne (CAD) (POC-CAD) a déjà été développé et validé. Le test nécessite l’acquisition simultanée de signaux de gradient de tension orthogonal (OVG) et de photopléthysmogrammes, qui constituent la méthodologie principale décrite dans cet article. L’acquisition de l’OVG, un signal biopotentiel, nécessite la mise en place d’électrodes sur la peau préparée du thorax du patient (disposées de manière similaire à la configuration de la sonde Frank, composée de six électrodes bipolaires et d’une électrode de référence) et d’un capteur hémodynamique sur le doigt (selon une modalité de transmission standard). Le signal est téléchargé sur un système basé sur le cloud, où les caractéristiques techniques sont extraites du signal et fournies à un algorithme d’apprentissage automatique pour produire le score CAO. Le médecin doit ensuite interpréter la valeur du score CAD dans le contexte de la probabilité de CAD de son patient avant le test, ce qui entraîne une probabilité de CAD après le test. Cette interprétation peut être effectuée au niveau de la positivité et de la négativité du test ou à un niveau de granularité plus fin ; Des méthodologies pour chacun d’eux sont proposées ici sur la base des rapports de vraisemblance. À l’aide de la probabilité post-test, le médecin doit déterminer la prochaine étape appropriée dans le traitement de son patient ; Plusieurs scénarios sont utilisés pour illustrer ce processus. L’adoption des tests n’est réalisable que si elle est économiquement viable ; Une discussion sur l’intégration du test dans le flux de diagnostic CAD et les économies de coûts qui en résultent pour le système de santé est fournie. Le modèle économique démontre que des économies pour le système de santé peuvent être réalisées en prévenant les traitements retardés, qui, s’ils ne sont pas traités, entraînent une progression de la maladie nécessitant des soins plus avancés (et plus coûteux).
Introduction
La cardiopathie ischémique (cardiopathie ischémique) est actuellement la principale cause de décès dans le monde1. La coronaropathie est le précurseur anatomique de la cardiopathie ischémique, caractérisée par la présence de lésions importantes au sein des artères coronaires. La signification peut être définie anatomiquement par une occlusion d’au moins 70 % ou 50 % dans l’artère principale gauche2. La signification peut également être définie en fonction de l’impact fonctionnel de la lésion en mesurant son effet sur le flux sanguin. Plus précisément, la réserve de débit fractionnaire (FFR) et la réserve de débit instantanée (iFR) évaluent le changement de débit causé par la lésion, et les lésions sont définies comme significatives à FFR < 0,80 ou iFR < 0,892. L’angiographie coronarienne invasive (ICA) par cathétérisme cardiaque gauche (LHC) est l’étalon-or pour confirmer la présence d’une coronaropathie significative. Une coronaropathie importante justifie une revascularisation par la mise en place d’un stent ou d’un pontage aorto-coronarien, ce qui atténue l’ischémie myocardique et les symptômes angineux correspondants et stabilise la plaque (dans le cas de la pose d’un stent).
Les tests non invasifs actuels de la coronaropathie nécessitent souvent une exposition aux rayonnements, du stress et une injection de produit de contraste (avec impacts rénaux)1. Les tests diagnostiques les plus couramment utilisés sont l’imagerie de perfusion myocardique (MPI), également connue sous le nom de tomographie par émission de photons uniques (SPECT), et l’angiographie coronarienne par tomodensitométrie (ACTC). La TEMP implique l’injection d’un radio-isotope pour suivre la perfusion pendant le repos et le stress (exercice ou médicament). L’ACTC image les artères coronaires à l’aide de plusieurs rayons X. La tomographie par émission de positons (TEP) et l’imagerie par résonance magnétique cardiaque (CMR) sont également parfois utilisées pour les tests de CAO1. Toutes ces modalités nécessitent des investissements importants en équipement, du personnel formé pour effectuer les tests et, dans certains cas, la disponibilité d’isotopes médicaux. En raison de ces exigences, ces modalités ne sont souvent pas largement disponibles, en particulier en milieu rural, ce qui entraîne des retards dans les soins aux patients et augmente les risques associés.
Par conséquent, l’objectif était de concevoir un test non invasif sur le lieu d’intervention pour la CAD (POC-CAD) : le système CorVista3. Ce système est un test approuvé par la FDA pour la DAO fonctionnellement significative, avec des performances comparables à celles de CCTA4. Le test peut être utilisé sans stress du patient et sans qu’il soit nécessaire d’investir dans de l’équipement ou du personnel spécialisé. Il est parfaitement adapté à une utilisation dans des environnements ruraux et à ressources limitées où l’accès aux technologies d’imagerie actuelles n’est souvent pas disponible.
Le développement3 et la validation4 de POC-CAD ont été publiés précédemment. En bref, le POC-CAD commence par l’acquisition simultanée de signaux de gradient de tension orthogonal et de photopléthysmogramme à l’aide du dispositif de capture, comme décrit à l’étape 1 du protocole. Le gradient de tension orthogonal est un signal biopotentiel acquis à l’aide d’un placement de sonde similaire à la configuration de sondede Frank 5, comprenant six électrodes bipolaires et une électrode de référence fixée au torse. Le photopléthysmogramme est obtenu en utilisant la modalité de transmission standard, où la lumière rouge et infrarouge est transmise du bout du doigt et frappe un capteur6. Une fois le signal acquis, il est automatiquement téléchargé dans le système basé sur le cloud, où les caractéristiques techniques sont extraites du signal et fournies à un algorithme d’apprentissage automatique pour produire le score CAO, qui est présenté dans le portail Web. Dans les étapes 2 et 3 du protocole, la méthodologie d’interprétation du score CAD renvoyé par le test est décrite. Plus précisément, des données publiées ou d’autres sources pertinentes pour le médecin peuvent être utilisées pour estimer la probabilité de coronaropathie avant que le patient ne passe le test. Les rapports de vraisemblance peuvent être calculés à partir des performances du test et utilisés pour mettre à jour la probabilité de CAD du pré-test au post-test, en utilisant soit le résultat du test binaire (étape 2), soit des valeurs plus granulaires du score CAD (étape 3). Enfin, la modélisation de l’économie du POC-CAD par rapport à la norme de soins actuelle est discutée.
Protocole
L’étude a été approuvée par le Conseil d’examen institutionnel de l’Ouest et menée conformément à la Déclaration d’Helsinki. Un consentement éclairé écrit a été obtenu de tous les sujets pour la participation. En bref, pour être inclus, les sujets doivent être âgés d’au moins 18 ans et présenter des symptômes cardiovasculaires, mais sans maladie coronarienne connue, et être devant subir une ICA ou une ACTC. Les critères d’exclusion comprenaient des antécédents documentés d’infarctus du myocarde, de pontage aortocoronarien et de remplacement des valves cardiaques, entre autres. Les critères complets d’inclusion et d’exclusion de l’étude se trouvent sur clinicaltrials.gov, sous le numéro d’essai clinique national (NCT) NCT03864081. L’équipement et les logiciels utilisés sont répertoriés dans la table des matériaux.
1. Acquisition du signal
- Préparez la peau en rasant les poils du site de l’électrode. Assurez-vous qu’il n’y a pas de résidu restant sur la peau en nettoyant à l’eau et au savon et en utilisant une gaze propre et sèche ou une lingette non alcoolisée si nécessaire.
- Connectez les fils aux électrodes et placez-les conformément au tableau 1.
REMARQUE : La qualité de l’électrode peut affecter la qualité du signal ; Il est recommandé d’utiliser des électrodes de qualité diagnostique ou performantes. - Placez le capteur hémodynamique (photopléthysmogramme, PPG) sur le doigt du sujet, en vous assurant que le doigt est aussi loin que possible dans le capteur, avec le câble du capteur positionné le long du haut de la main.
- Utilisez l’index à moins qu’une blessure ou une autre raison cliniquement pertinente ne l’interdise. Conseillez au patient de ne pas déplacer le capteur une fois qu’il est placé.
- Positionnez le patient à plat sur le dos dans une position de repos confortable. Assurez-vous que le câble du capteur PPG et les câbles d’électrode ne se chevauchent pas.
- Utilisez un rembourrage (par exemple, une couverture ou une serviette roulée, avec un oreiller) si nécessaire pour empêcher le patient d’exercer une pression directe sur l’électrode bleue sur le dos.
- Pour limiter le bruit du signal et maximiser la qualité du signal, dans la mesure du possible, éteignez tous les appareils électroniques (moniteurs, téléviseurs, téléphones cellulaires, etc.) ou retirez-les de la pièce. Éteignez l’éclairage de la pièce.
- Entrez les informations du patient et confirmez l’exactitude : prénom du patient, nom de famille du patient, sexe à la naissance, taille en pouces, poids en livres, date de naissance et numéro de dossier médical (tous obligatoires, peuvent être saisis dans n’importe quel ordre).
- Assurez-vous que le patient est à l’aise et rappelez-lui d’être immobile et silencieux (p. ex., ne pas parler pendant l’acquisition).
- Placez l’appareil sur une surface plane et confirmez son emplacement dans l’application. Appuyez sur Start pour commencer l’acquisition du signal.
- Surveillez l’appareil pour détecter les messages d’erreur et, s’ils apparaissent, suivez les instructions à l’écran pour les résoudre.
- Une fois l’acquisition du signal terminée, qui nécessite 3 min et 35 s, l’appareil transmet automatiquement les données au cloud pour l’évaluation de la qualité du signal. Gardez le patient attaché à l’appareil jusqu’à ce que la confirmation de la qualité du signal de passage soit reçue.
- Détachez les électrodes du patient et retirez le capteur PPG.
- Accédez au portail pour consulter les résultats des tests (ils seront disponibles environ 10 minutes après le téléchargement du signal sur le cloud).
Tableau 1 : Placement des fils. Description des emplacements anatomiques auxquels chacune des sept électrodes doit être placée. Veuillez cliquer ici pour télécharger ce tableau.
2. Interprétation des résultats du test donné test-positif vs . test négatif
- Déterminer la probabilité de maladie du patient avant le test (p. ex., à l’aide des lignes directrices de la Société européenne de cardiologie (ESC)7).
- Déterminez si le test du patient est positif ou négatif en comparant le score CAD à 0 : s’il est supérieur ou égal à zéro, le résultat du patient est positif, ou s’il est inférieur à zéro, le résultat est négatif.
- Lisez la valeur du score CAD dans le rapport et comparez-la aux distributions des patients négatifs et positifs dans la cohorte de validation indiquée au bas du rapport.
- Calculez la sensibilité et la spécificité8, puis les rapports de vraisemblance (LR) à l’aide de l’équation 1 et de l’équation 29.
REMARQUE : Un exemple concret est présenté, étant donné que la sensibilité du test est de 88 % (calculée à l’aide de sujets positifs de l’ICA, qui est le seul groupe de sujets atteints de la maladie) et que la spécificité est de 51 % (calculée à l’aide de sujets négatifs de l’ACTC à un poids de 94 % et de sujets négatifs de l’ICA à un poids de 6 %, pour représenter la population globale à l’aide de l’étude PROMISE10).
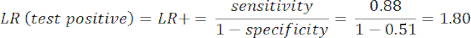 (EQN 1)
(EQN 1)
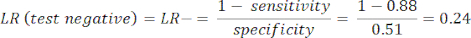 (QRT 2)
(QRT 2) - Calculez la probabilité post-test du patient à partir des équations suivantes 3-511, où LR+ est utilisé dans le cas d’un test positif et LR- est utilisé dans le cas d’un test négatif :
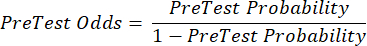 (EQN 3)
(EQN 3)
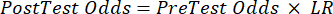 (EQN 4)
(EQN 4)
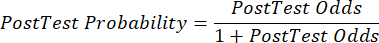 (EQN 5)
(EQN 5) - Compte tenu de la probabilité actualisée de coronaropathie, compte tenu des résultats de l’examen, déterminer la prochaine étape appropriée des soins au patient (p. ex., à l’aide des recommandations de la ligne directrice7 de l’ESC présentées dans le tableau 2).
Tableau 2 : Lignes directrices ESC par probabilité de DAO. Pour quatre niveaux de probabilité de coronaropathie, les directives de la Société européenne de cardiologie prévoient l’interprétation appropriée de cette probabilité, y compris le prochain test (si nécessaire). Veuillez cliquer ici pour télécharger ce tableau.
3. Interprétation des résultats des tests donnés avec une granularité plus fine
- Augmentez la granularité des résultats positifs et négatifs en tenant compte des plages du score CAD observées dans la population utilisée pour valider le test, en particulier la division en tertiles (nombre égal de sujets dans trois bacs) dans les plages de tests positifs et négatifs, comme le montre le tableau 3.
REMARQUE : Pour simplifier les calculs, la contribution de 6 % des sujets négatifs du cathétérisme est exclue de cette analyse, dont l’inclusion ne changera pas les résultats de manière significative. - Dans chaque tertile de la plage des tests négatifs, calculez le nombre de vrais négatifs (TN), qui sont des sujets qui n’ont vraiment pas la maladie, et le nombre de faux négatifs (FN), des sujets qui ont vraiment la maladie.
- Appliquez les équations suivantes 6-8et 11 pour déterminer le LR- de chaque tertile négatif (LR+ des tertiles négatifs non pertinents).
REMARQUE : Les équations supposent que le profil de performance du tertile représente la plage complète des tests négatifs pour calculer les statistiques de performance (ce qui nécessite le facteur de correction de trois, correspondant au nombre de teriles, pour atteindre la fréquence de négativité du test d’origine par rapport à la positivité du test).
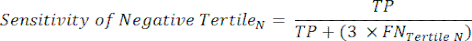 (EQN 6)
(EQN 6)
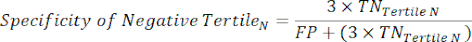 (EQN 7)
(EQN 7)
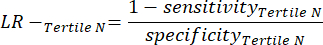 (EQN 8)
(EQN 8)
- Appliquez les équations suivantes 6-8et 11 pour déterminer le LR- de chaque tertile négatif (LR+ des tertiles négatifs non pertinents).
- Dans chaque tertile de la plage des tests positifs, calculez le nombre de vrais positifs (TP), qui sont des sujets qui ont vraiment la maladie, et le nombre de faux positifs (FP), des sujets qui n’ont vraiment pas la maladie.
- Appliquez les équations 9 à 11 pour déterminer le LR+ de chaque tertile testé positif (LR- à partir des tertiles positifs non pertinents)11.
REMARQUE : Les équations supposent que le profil de performance du tertile représente la plage complète des tests positifs aux fins du calcul des statistiques de performance (nécessitant le facteur de correction de trois, correspondant au nombre de tertiles, pour atteindre la fréquence de positivité du test d’origine par rapport à la négativité du test).
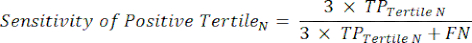 (QRN 9)
(QRN 9)
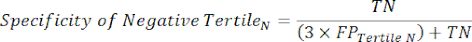 (EQN 10)
(EQN 10)
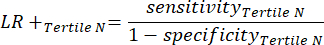 (EQN 11)
(EQN 11)
- Appliquez les équations 9 à 11 pour déterminer le LR+ de chaque tertile testé positif (LR- à partir des tertiles positifs non pertinents)11.
- Déterminez dans quel tertile se situe le score CAD du patient et, compte tenu des LR du tableau 3, calculez la probabilité post-test compte tenu de la procédure décrite à l’étape 2.
REMARQUE : Comme on peut s’y attendre, les valeurs LR- diminuent avec un plus grand nombre de scores CAD négatifs, et les valeurs LR+ augmentent avec des scores CAD plus positifs, ce qui signifie qu’un score CAD plus négatif réduit plus efficacement la probabilité de pré-test, et qu’un score CAD plus positif augmente plus efficacement la probabilité de pré-test. - Au lieu d’effectuer les calculs énumérés aux étapes 2.4 à 3.4, utilisez le tableau 4 pour traduire la probabilité pré-test en probabilité post-test à l’aide du score CAD7 du patient.
Tableau 3 : Rapports de vraisemblance. Pour trois plages de scores dans les tests positifs et négatifs, les rapports de vraisemblance positifs et négatifs correspondants, respectivement. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Cartographie des probabilités entre le pré-test et le post-test. Pour 10 niveaux de probabilité pré-test, la probabilité post-test correspondante donnée un score CAD dans chacun des trois tertiles négatifs et chacun des tertiles positifs. La coloration verte correspond à <15 % de probabilité de maladie (la directive de l’ESC stipule que la coronaropathie peut être exclue) ; la coloration jaune correspond à une probabilité de maladie de 15 à 65 % (les directives de l’ESC indiquent que les tests non invasifs basés sur l’imagerie sont préférables) ; l’orange correspond à une probabilité de maladie de 66 % à 85 % (les directives de l’ESC stipulent que des tests non invasifs basés sur l’imagerie doivent être effectués) ; le rouge correspond à une probabilité de maladie de >85 % (la directive de l’ESC stipule que la coronaropathie peut être exclue). Voir le tableau 2 pour de plus amples renseignements sur les lignes directrices. Notez qu’un score CAD de 0 est considéré comme positif. Veuillez cliquer ici pour télécharger ce tableau.
Résultats
Un exemple de signal peut être vu dans la figure 1, et un rapport dans la figure 2, comme le montrerait un médecin utilisant le test. Vous trouverez ci-dessous plusieurs cas de patients pour démontrer l’application de la méthodologie dans l’interprétation de la signification du score CAD.
Cas 1
Un homme de 67 ans s’est plaint de symptômes de douleurs thoraciques au repos, de douleurs irradiantes au bras, de diaphorèse et de nausées. D’après les directives de l’ESC7, son âge, son sexe et ses symptômes sont compatibles avec une probabilité initiale de maladie de 84 %. Les lignes directrices de l’ESC suggèrent qu’un tel patient a besoin de tests non invasifs pour poser un diagnostic de coronaropathie afin de justifier l’orientation vers un cathétérisme cardiaque et toute intervention nécessaire (tableau 2). Un POC-CAD a été réalisé et a donné un score CAD de 0,32, ce qui est un résultat positif au test et se situe dans le tertile le plus élevé des scores CAD positifs, avec un LR+ de 2,888 (tableau 3). Par conséquent, la probabilité post-test du patient est de 94 % et, selon les directives de l’ESC (tableau 2), on peut supposer sans risque que le patient souffre d’une coronaropathie, et qu’un cathétérisme cardiaque invasif est un plan d’action approprié.
Cas 2
Une femme de 39 ans présente une douleur thoracique au repos, irradiant à la fois vers le côté gauche et le côté droit. D’après les lignes directrices de l’ESC7, son âge, son sexe et ses symptômes sont compatibles avec une probabilité initiale de maladie de 28 %, et les lignes directrices suggèrent qu’un test non invasif serait la prochaine étape préférable pour mieux comprendre la probabilité de coronaropathie. Cependant, les lignes directrices indiquent également que chez les jeunes patients (comme cette femme de 39 ans), le médecin doit être conscient de l’exposition aux rayonnements, qui est nécessaire pour administrer un test tel que la SPECT, nécessitant une injection de radio-isotope. Une autre option pour un tel test est le CCTA, mais cela nécessite de nombreuses radiographies. Par conséquent, POC-CAD est un choix logique, car il ne nécessite pas de rayonnement. Le test a été effectué, avec une valeur de -0,12, dans les limites du premier tertile de la plage négative, avec un LR- de 0,129 (tableau 3). La probabilité post-test résultante est de 4 %, ce qui tombe au niveau où la CAD peut être exclue en toute sécurité selon les directives de l’ESC, sans qu’aucun test supplémentaire ne soit requis pour la CAO.
Cas 3
Une femme de 74 ans présente des douleurs thoraciques non angineuses et une dyspnée. D’après les lignes directrices de l’ESC7, son âge, son sexe et ses symptômes sont compatibles avec une probabilité initiale de maladie de 24 %, et les lignes directrices suggèrent qu’un test non invasif serait la prochaine étape préférable pour mieux comprendre la probabilité de coronaropathie. La patiente hésite à se déplacer de la clinique rurale où elle est traitée au grand centre urbain où toutes les modalités de test (TEP, SPECT, CCTA, CMR) sont disponibles, alors le médecin propose POC-CAD. Le score CAD est de 0,07, se situant dans le premier tertile de la plage positive avec un LR+ de 1,446, ce qui donne une probabilité post-test de 33 %. Sur la base du résultat positif et de l’augmentation de la probabilité de maladie, le patient accepte de se rendre en ville pour une TEP. La TEP était également indicative de la maladie, avec un LR+ de 6,0412, et augmente les 33 % à 75 % après la TEP.
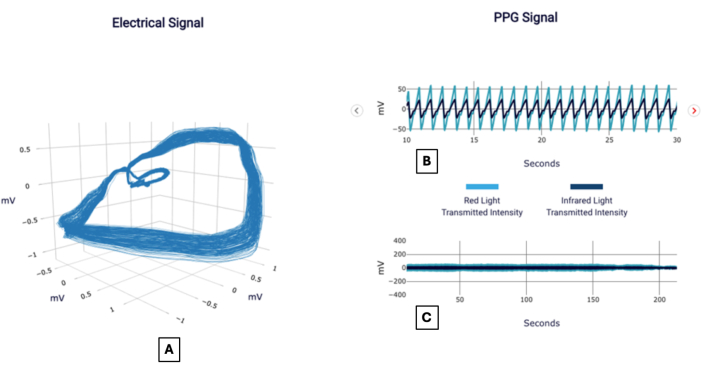
Figure 1 : Exemples de signaux. Exemple de rapport POC-CAD montrant des visualisations du gradient de tension orthogonal, également appelé signal électrique (A), et du signal du photopléthysmogramme focalisé sur un intervalle de 20 s (B) et une durée complète (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
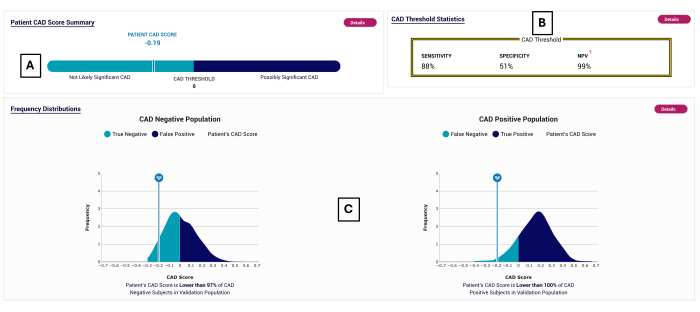
Figure 2 : Exemple de rapport CAO. Exemple de rapport POC-CAD, montrant un score CAD de -0,19 (A), qui se situe dans la plage des tests négatifs (<0). Les performances de l’essai sont indiquées en (B). La répartition des scores CAD est affichée pour les sujets sur lesquels POC-CAD a été validé en (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
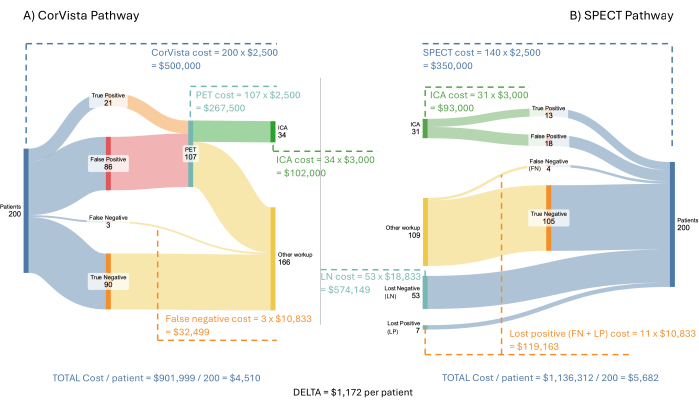
Figure 3 : Flux du modèle économique en termes de coûts. Une population entrante hypothétique de 200 patients est traitée par la voie POC-CAD>TEP (A) et la voie SPECT (B). Les coûts pour le système de santé sont indiqués pour chaque branche de chaque parcours, ainsi que l’économie moyenne par patient lorsque le parcours POC-CAD>PET est mis en œuvre. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’objectif principal de cette section est l’économie du test ; cependant, il est utile de discuter d’abord les aspects de l’évaluation de la probabilité pré-test pour la CAO. Comme décrit dans les étapes 2 et 3 du protocole, l’estimation de la probabilité de CAD avant le test est une étape critique dans la contextualisation du score CAD et la détermination de la probabilité après test de la DAO. Nous avons utilisé les lignes directrices de l’ESC 2013, qui basent la probabilité de coronaropathie sur trois caractéristiques : le sexe, l’âge et les symptômes (au sein des groupes d’angine de poitrine typique, de douleur atypique et de douleur non angineuse)7. Cependant, il est important de noter que le médecin peut appliquer son jugement clinique dans le choix de toute méthode quantitative ou qualitative. De plus, il existe d’autres méthodes quantitatives publiées pour une telle estimation, notamment Diamond-Forrester13, qui nécessite les mêmes caractéristiques d’entrée que l’ESC 2013. Des variations plus complètes ont également été publiées, telles que l’extension de14 Diamond-Forrester avec le statut œstrogénique pour les femmes (pour compenser la variation de l’âge à la ménopause, ainsi que toute hystérectomie), ainsi que le diabète, l’hypertension, l’hyperlipidémie, le tabagisme, les antécédents familiaux de maladie coronarienne et l’obésité. Cependant, sachez que certaines méthodologies peuvent définir la CAD à 50 % de rétrécissement luminal, alors que 70 % représente les directives ACC actuelles (à l’exception de l’artère principale gauche à 50 %).
L’économie du POC-CAD et la façon dont le test interagit avec le parcours de soins représentent des caractéristiques cruciales pour déterminer si le test est vraiment adapté à un usage clinique. Pour le diagnostic de la coronaropathie, le test le plus souvent utilisé est le MPI, souvent connu sous le nom de test d’effort nucléaire ou SPECT. En 2019, l’IPM a été utilisé dans environ 85 % des évaluations pour15 CAD. On estime que 7 à 8 millions d’études SPECT-MPI sont réalisées chaque année aux États-Unis16. Dans environ 5 % des cas de patients, l’ACTC est utilisé pour diagnostiquer la coronaropathie. Deux autres modalités d’imagerie, la TEP et l’IRM cardiaque, constituent la majeure partie des évaluations restantes. Pour tous ces tests, une caméra d’imagerie et une équipe qualifiée sont nécessaires pour exécuter et interpréter le test. Ces appareils photo sont des biens d’équipement coûteux. Par conséquent, la disponibilité de ces tests est souvent limitée dans les établissements de santé urbains, où le volume est suffisant pour justifier à la fois les dépenses initiales et les coûts d’exploitation.
En 2021, l’American College of Cardiology (ACC) a publié ses lignes directrices pour les patients sans coronaropathie connue ou sans tests antérieurs et présentant un risque intermédiaire de 2,17coronaropathiques, où l’IPM et l’ACCT ont été reconnus comme des options de diagnostic de première ligne. Contrairement à l’ACTC et à l’IPM, le POC-CAD peut être utilisé dans n’importe quel point de service, comme le cabinet d’un médecin, un hôpital d’accès critique, un centre de soins tribaux et des centres de soins tertiaires, plutôt que d’être limité, comme le sont l’ACTC et l’IPM, aux seuls centres disposant d’un équipement d’imagerie coûteux et aux équipes nécessaires pour les faire fonctionner.
En règle générale, les patients soupçonnés de coronaropathie à la suite d’un test de première ligne sont orientés vers l’ICA ; Comme décrit, il s’agit d’un diagnostic de référence pour la coronaropathie. L’ICA est une procédure invasive entreprise dans un hôpital externe par des spécialistes en cardiologie invasive.
Une étude récente sur le taux de présence aux rendez-vous pour des examens radiologiques dans un grand centre universitaire tertiaire a montré que 24 % des rendez-vous prévus n’étaient pas pris par le patient en raison d’une annulation ou d’une non-présentation18. Les modalités radiologiques étudiées comprenaient un diagnostic CAO. Le chiffre rapporté dans cette étude correspond à une discussion avec le responsable financier d’un système de santé, qui suppose un taux de non-présentation de 20 %. De plus, lors de multiples discussions avec des médecins ruraux, où il peut être nécessaire de faire beaucoup de temps pour se rendre au test, jusqu’à 50 % des patients pourraient ne pas prendre de rendez-vous et ne pas s’y rendre. Dans le modèle suivant, on suppose que ce chiffre est de 30 % (c.-à-d. que 70 % se présentent au rendez-vous).
Il y a un impact direct sur le rendement diagnostique des tests en aval lorsqu’un nombre important de patients ne passent pas au test recommandé. En supposant que le taux est cohérent chez les individus avec et sans maladie coronarienne significative, la sensibilité de détection de la maladie dans la population référée serait de 70 % de la sensibilité attendue. Dans le cas de la TEMP, dont la sensibilité signalée pour la détection d’une coronaropathie fonctionnellement significative est de 73 %, la sensibilité effective n’est que de 53 % (= 0,7 x 73 %)12, c’est-à-dire que près de la moitié des patients de la population référée présentant une coronaropathie fonctionnellement significative ne seraient pas détectés. Ces patients manqués ne coûtent rien au système de santé. Les patients positifs atteints d’une coronaropathie fonctionnellement significative seront probablement vus plus tard et encourront des coûts supplémentaires importants en raison de la progression de leur maladie. Par exemple, si le patient se présente par la suite à l’urgence, le coût moyen de la visite pour un patient présentant des signes de syndrome coronarien aigu a été calculé à 30 000 $19.
De plus, même pour les patients sans coronaropathie significative, s’ils ne suivent pas la recommandation de leur médecin pour l’imagerie, ils sont moins susceptibles de retourner chez ce médecin, et par conséquent, il y a peu de possibilités de déterminer ce qui pourrait être à l’origine de leurs symptômes. Cela peut également être coûteux pour le patient, en termes de progression de la maladie sous-jacente, et pour le système de santé. Par exemple, il a été démontré qu’un diagnostic tardif de l’insuffisance cardiaque ajoute 8 000 $ par année au coût du traitement de ce patient20.
Le modèle économique des coûts présenté ici vise à saisir ces impacts, en comparant le scénario où la POC-CAD est utilisée comme test de première ligne pour une DAO significative à un scénario dans lequel la SPECT est utilisée. Comme le POC-CAD est un test d’exclusion, un plus grand nombre de résultats faussement positifs est attendu que pour la TEMP. Il n’est pas raisonnable de s’attendre à ce que tous les résultats positifs du test soient transmis à l’ICA. Dans de nombreux cas, l’idéal serait d’utiliser un deuxième test. Lors de l’analyse des performances de contrôle d’entrée et de sortie de divers tests non invasifs pour la coronaropathie fonctionnellement significative, Knuuti et coll. recommandent de faire suivre l’ATCC d’un test fonctionnel, tel que SPECT12. Cependant, cela risque à nouveau de ne pas identifier une proportion relativement importante de patients positifs. Un meilleur test fonctionnel serait la TEP cardiaque, qui a une sensibilité de 89 % et une spécificité de 85 %12. La TEP cardiaque est de plus en plus utilisée aux États-Unis, est actuellement le plus souvent prescrite par les cardiologues et est déjà utilisée plus souvent que l’ACTC15,21. Dans ce modèle, les résultats positifs de la TEP sont ensuite supposés passer à l’ICA. Comme la sensibilité de la TEP est similaire à celle de la POC-CAD, tous les résultats positifs dans la population de TEP entrante sont supposés être correctement classés comme positifs par la TEP. Dans le modèle dans lequel la TEMP est utilisée comme test de première ligne, on suppose que les résultats positifs passent à l’ICA. En supposant une prévalence entrante de 12 %, cela se traduit par un rendement positif à l’ICA de 41 %, ce qui est proche de celui observé dans l’étude PROMISE10.
La figure 3 illustre le modèle et les résultats à l’aide d’une population entrante hypothétique de 200 patients présentant des symptômes de maladie cardiovasculaire. La TEMP, la TEP et le POC-CAD sont censés être remboursés au même taux : 2 500 $ par test. ICA est présumé être remboursé à 3 000 $. Le coût de tout traitement pendant l’ICA, ou par la suite, n’est pas inclus dans le modèle, car il dépasse le parcours diagnostique que le modèle représente. Les coûts des patients perdus négatifs et positifs perdus sont plus difficiles à estimer. Étant donné que ces patients sont définis comme n’ayant pas suivi les directives de leur médecin de procéder à un test d’imagerie, on suppose que leur prochaine interaction avec le système de santé est de se présenter à un service d’urgence avec des symptômes de maladie cardiovasculaire. Dans une étude sur les présentations aux urgences avec de tels symptômes, Pope et al. ont déterminé que 17 % répondaient aux critères de l’ischémie cardiaque aiguë, 6 % avaient une angine de poitrine stable, 21 % avaient des problèmes cardiaques non ischémiques et 56 % avaient des problèmes non cardiaques22. O’Sullivan et coll. ont calculé que les coûts de la présentation initiale à l’urgence s’élevaient à 34 200 $ pour l’ischémie myocardique non mortelle et à 17 300 $ pour l’angine de poitrine sans revascularisationcoronarien23. L’utilisation exclusive des coûts lors de la présentation initiale est une approche prudente, car les coûts de la phase aiguë (3 ans) engagés pour l’événement sont considérablement plus élevés, soit 73 300 $ et 36 000 $, respectivement. Le coût d’une visite aux urgences pour 53 % des visites pour des douleurs thoraciques, mais sans problème cardiaque identifié, a été estimé à 2 988 $ sur la base des informations rapportées par United Healthcare24. Enfin, pour les 21 % de personnes atteintes d’un problème cardiaque non ischémique, le coût a été estimé à 2 988 $, plus un coût supplémentaire causé par le retard dans le traitement de l’affection cardiaque. Comme nous l’avons mentionné ci-dessus, pour un patient atteint d’insuffisance cardiaque, le coût annuel supplémentaire d’un diagnostic retardé a été calculé à 8 000 $20. Par conséquent, on a supposé que le coût pour les 21 % était de 10 988 $, en supposant que la majorité de ces patients souffriront d’insuffisance cardiaque ou d’hypertension pulmonaire et d’un coût de traitement retardé similaire pour les deux. Encore une fois, l’utilisation d’une seule année de coûts différentiels est une approche prudente, car cela s’appliquerait en fait à chaque année subséquente. Dans l’ensemble, la moyenne pondérée de ces coûts, telle qu’elle est utilisée dans le modèle, est de 10 833 $.
Le modèle économique des coûts démontre une économie moyenne potentielle de 1 172 $ par patient pour le système de soins de santé en raison, en résumé, du coût du traitement retardé entraînant une progression de la maladie nécessitant des soins plus avancés. De plus, l’adoption de cette voie augmenterait le rendement à l’ICA à 62 %, contre 41 % actuellement observés et modélisés dans la voie SPECT.
Si l’on extrapolait à la population rurale entrante de 2,25 millions de patients présentant chaque année des symptômes de maladies cardiovasculaires aux États-Unis, les économies potentielles totales de la mise en œuvre du POC-CAD comme test de première ligne pour une coronaropathie significative seraient d’environ 2,64 milliards de dollars. Comme nous l’avons vu ci-dessus, une grande partie de ces économies provient du fait de ne pas manquer de patients atteints d’une coronaropathie fonctionnellement significative en raison d’une sensibilité plus élevée et d’un rendement diagnostique plus élevé que la TEMP. De plus, le rendement plus élevé qui pourrait être obtenu à l’ICA est un avantage crucial, car davantage d’ICA seraient réalisées dans le cadre du parcours POC-CAD>PET que dans le cadre du parcours SPECT. Un rendement plus élevé à l’ICA serait bénéfique pour les patients, qui sont souvent frustrés par des résultats négatifs à l’ICA25, le cardiologue interventionnel et le système de santé.
Une objection possible à ce modèle est que tout le monde devrait être orienté directement vers le PET plutôt que d’utiliser d’abord le test POC-CAD. Cette approche, surtout si l’on considère la population rurale, pourrait se heurter au même problème que celui que l’on observe actuellement avec tous les tests d’imagerie, à savoir la perte de suivi. Si les mêmes hypothèses étaient maintenues pour le modèle, le rendement effectif de la TEP aurait une sensibilité de seulement 62 % (= 0,7 x 89 %), manquant ainsi de nombreux patients véritablement positifs dans cette population. À l’inverse, on observe que le fait d’avoir un test positif au POC-CAD peut encourager les patients à faire un suivi avec leur référence pour des tests diagnostiques ultérieurs (tels que l’ICA), et par conséquent, cela ne devrait pas être un problème dans le parcours POC-CAD>TEP. On pourrait également faire valoir que la SPECT est la voie prédominante et, par conséquent, qu’elle est la plus susceptible d’être le test utilisé dans la pratique après le POC-CAD. Dans ce cas, les économies réalisées grâce à la voie POC-CAD>SPECT résultante seraient légèrement supérieures à celles indiquées ci-dessus, mais le rendement effectif à l’ICA serait légèrement inférieur (58 %) car il y aurait trois patients positifs manqués supplémentaires (faux négatifs) sur deux cents dans le flux.
En conclusion, le POC-CAD constitue un ajout prometteur au parcours de diagnostic. Le principal avantage de ce test est qu’il peut être utilisé au point de service, sans utiliser de rayonnement, de stress ou de contraste, tout en produisant des résultats comparables à ceux de l’ACTC pour exclure une valeur fonctionnellement significative deCAD 26. De plus, les résultats sont disponibles au cours de la même visite, ce qui permet au médecin de discuter des prochaines étapes des soins avec le patient sans planifier une autre visite. Étant donné que le test peut être administré au point de service et que les résultats sont rapidement disponibles, POC-CAD s’attaque au problème important de perte de suivi observé, en particulier dans les zones rurales, qui représentent environ un quart de la population américaine. Étant donné le profil d’exclusion robuste du test, avec un résultat négatif, le médecin peut rapidement explorer d’autres explications des symptômes du patient. Lorsque l’on modélise les coûts du retard dans le diagnostic du patient qui en résulte, l’utilisation de la POC-CAD comme test de première ligne procurerait des avantages importants aux patients, aux médecins et au payeur. De plus, les modalités d’imagerie existantes ne connaîtraient ni augmentation ni diminution significative du volume, ce qui est une préoccupation pour de nombreux centres d’imagerie. Les économies sont réalisées grâce à un diagnostic et à un traitement plus rapides de l’état du patient.
Déclarations de divulgation
T.B., N.N., F.F., H.G., C.B., S.R. et I.S. sont des employés d’Analytics for Life.
Les méthodologies relatives à l’interprétation du score CAD de CorVista représentent des hypothèses actuelles basées sur un sous-ensemble de la population validée et nécessitent une validation supplémentaire. Veuillez vous référer au mode d’emploi du produit.
Remerciements
Les auteurs tiennent à remercier Cody Wackerman et Hugh Dubberly du Dubberly Design Office (San Francisco) pour leur aide dans la visualisation des trajectoires illustrées à la figure 3.
matériels
| Name | Company | Catalog Number | Comments |
| CorVista CAD | CorVista | n/a | System comprising signal acquisition, cloud processing, and delivery of a report containing the CAD Score via a web portal |
| Electrodes | Various (see comments) | Diagnostic quality or high performance electrodes are recommended. For example: Conmed ClearTrace 1700-007 Skintact FS-TB1 Vermed A10005 |
Références
- World Health Organization. The top 10 causes of death [Internet]. 2020 [cited 2024 Jun 27]. , Available from: https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death (2020).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79 (2), e21-e129 (2022).
- Burton, T., et al. Development of a non-invasive machine-learned point-of-care rule-out test for coronary artery disease. Diagnostics. 14 (7), 719(2024).
- Stuckey, T. D., et al. Clinical validation of a machine-learned, point-of-care system to IDENTIFY functionally significant coronary artery disease. Diagnostics. 14 (10), 987(2024).
- Frank, E. An accurate, clinically practical system for spatial vectorcardiography. Circulation. 13 (5), 737-749 (1956).
- Park, J., Seok, H. S., Kim, S. S., Shin, H. Photoplethysmogram analysis and applications: An integrative review. Front Physiol. 12, 808451(2022).
- Montalescot, G., et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 34 (38), 2949-3003 (2013).
- Baratloo, A., Hosseini, M., Negida, A., El Ashal, G. Part 1: Simple definition and calculation of accuracy, sensitivity and specificity. Emergency. 3 (2), 48-49 (2015).
- Ranganathan, P., Aggarwal, R. Understanding the properties of diagnostic tests-Part 2: Likelihood ratios. Perspect Clin Res. 9 (2), 99-102 (2018).
- Douglas, P. S., et al. Outcomes of anatomical versus functional testing for coronary artery disease. New Eng J Med. 372 (14), 1291-1300 (2015).
- Safari, S., Baratloo, A., Elfil, M., Negida, A. Evidence based emergency medicine; part 4: Pre-test and post-test probabilities and Fagan's nomogram. Emergency. 4 (1), 48(2016).
- Knuuti, J., et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: a meta-analysis focused on post-test disease probability. Eur Heart J. 39 (35), 3322-3330 (2018).
- Diamond, G. A., Forrester, J. S. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. New Eng J Med. 300 (24), 1350-1358 (1979).
- Morise, A. P. Comparison of the Diamond-Forrester method and a new score to estimate the pre-test probability of coronary disease before exercise testing. Am Heart J. 138 (4), 740-745 (1999).
- Pelletier-Galarneau, M., Vandenbroucke, E., Lu, M., Li, O. Characteristics and key differences between patient populations receiving imaging modalities for coronary artery disease diagnosis in the US. BMC Cardiovasc Disord. 23 (1), 251(2023).
- Li, J., et al. Factors that impact a patient's experience when undergoing single-photon emission computed tomography myocardial perfusion imaging (SPECT-MPI) in the US: A survey of patients, imaging center staff, and physicians. J Nuclear Cardiol. 28 (4), 1507-1518 (2021).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79, e21-e129 (2022).
- Aijaz, A., et al. Sociodemographic factors associated with outpatient radiology no-shows versus cancellations. Acad Radiol. S1076 - 6332 (24), 00228-00229 (2024).
- Cowper, P. A., et al. Acute and 1-year hospitalization costs for acute myocardial infarction treated with percutaneous coronary intervention: Results From the TRANSLATE-ACS registry. J Am Heart Assoc. 16 (8), 8(2019).
- Thomas, A., et al. Forgone medical care associated with increased health care costs among the U.S. heart failure population. JACC Heart Fail. 9 (10), 710-719 (2021).
- Reeves, R. A., Halpern, E. J., Rao, V. M. Cardiac imaging trends from 2010 to 2019 in the Medicare population. Radiol Cardiothorac Imaging. 3 (5), (2021).
- Pope, J. H., et al. Missed diagnoses of acute cardiac ischemia in the Emergency Department. New Eng J Med. 342 (16), 1163-1170 (2000).
- OʼSullivan, A. K., et al. Cost estimation of cardiovascular disease events in the US. Pharmacoeconomics. 29 (8), 693-704 (2011).
- Corso, A. Emergency visit cost with and without insurance in 2024. Mira. , https://www.talktomira.com/post/how-much-does-an-er-visit-cost (2024).
- Patel, M. R. Low diagnostic yield of elective coronary angiography. New Eng J Med. 362 (10), 886-895 (2010).
- Browning, S. CorVista System 510(k) Summary (K232686). , U.S. Food and Drug Administration. Retrieved from https://www.accessdata.fda.gov/cdrh_docs/pdf23/K232686.pdf (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon