Method Article
Получение сигнала, интерпретация баллов и экономика неинвазивного теста на ишемическую болезнь сердца в месте оказания медицинской помощи
В этой статье
Резюме
Представлена методика получения физиологического сигнала для проведения теста на ишемическую болезнь сердца (ИБС). Предложен метод интерпретации оценки САПР в отношении положительности и негативности теста, включая гранулярность каждого из них. Экономические аспекты теста обсуждаются в контексте современных стандартов оказания медицинской помощи.
Аннотация
Ранее был разработан и валидирован неинвазивный тест на ишемическую болезнь сердца (ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА) (POC-CAD) в месте оказания медицинской помощи. Испытание требует одновременного получения сигналов ортогонального градиента напряжения (OVG) и фотоплетизмограммы, что является основной методологией, описанной в данной статье. Получение OVG, биопотенциального сигнала, требует размещения электродов на подготовленной коже грудной клетки пациента (расположенной аналогично конфигурации отведения Франка, состоящей из шести биполярных электродов и электрода сравнения) и гемодинамического датчика на пальце (с использованием стандартного метода передачи). Сигнал загружается в облачную систему, где из сигнала извлекаются инженерные функции и передаются алгоритму машинного обучения для получения оценки CAD. Затем врач должен интерпретировать значение оценки ИБС в контексте вероятности ИБС у пациента до теста, что приводит к вероятности ИБС после теста. Эта интерпретация может быть выполнена на уровне положительности теста и негатива теста или на более тонком уровне детализации; Здесь предлагаются методологии для каждого из них на основе отношений правдоподобия. Используя вероятность после теста, врач должен определить соответствующий следующий шаг в лечении своего пациента; Для иллюстрации этого процесса используется несколько сценариев. Тестовое внедрение возможно только в том случае, если это экономически целесообразно; Обсуждается интеграция теста в диагностический поток САПР и результирующая экономия средств для системы здравоохранения. Экономическая модель демонстрирует, что экономия средств для системы здравоохранения может быть достигнута за счет предотвращения несвоевременного лечения, которое, если его не решить, приводит к прогрессированию заболевания, требующему более современной (и дорогостоящей) помощи.
Введение
Ишемическая болезнь сердца (ИБС) в настоящее время является основной причиной смерти во всем мире1. Ишемическая болезнь сердца (ИБС) является анатомическим предшественником ИБС, характеризующейся наличием значительных поражений в коронарных артериях. Значимость может быть определена анатомически по окклюзии не менее 70% или 50% в левой главной артерии2. Значимость также может быть определена на основе функционального воздействия поражения путем измерения его влияния на кровоток. В частности, дробный резерв потока (ФРК) и мгновенный резерв потока (iFR) оценивают изменение потока, вызванное поражением, а поражения определяются как значимые при ФРП < 0,80 или iFR < 0,892. Золотым стандартом для подтверждения наличия значительной ИБС является инвазивная коронарография (ВСА) методом катетеризации левых отделов сердца (БАК). Значительная ИБС требует реваскуляризации путем установки стента или аортокоронарного шунтирования, что облегчает ишемию миокарда и соответствующие ангинальные симптомы и стабилизирует бляшку (в случае стентирования).
Современные неинвазивные исследования на ИБС часто требуют облучения, стресса и введения контрастного вещества (с почечными воздействиями)1. Наиболее часто используемыми диагностическими тестами являются перфузионная визуализация миокарда (MPI), также известная как однофотонная эмиссионная компьютерная томография (ОФЭКТ), и коронарная компьютерная томографическая ангиография (CCTA). ОФЭКТ включает в себя инъекцию радиоизотопа для отслеживания перфузии во время отдыха и стресса (физических упражнений или фармацевтических препаратов). КТА визуализирует коронарные артерии с помощью множественных рентгеновских лучей. Позитронно-эмиссионная томография (ПЭТ) и магнитно-резонансная томография сердца (КМР) также иногда используются для тестирования ИБС1. Все эти методы требуют значительных капиталовложений в оборудование, обученный персонал для проведения испытаний, а в некоторых случаях и доступность медицинских изотопов. Из-за этих требований эти методы часто не широко доступны, особенно в сельской местности, что приводит к задержкам в оказании медицинской помощи пациентам и повышает связанные с этим риски.
Поэтому цель состояла в том, чтобы разработать неинвазивный тест для САПР (POC-CAD): систему CorVista3. Эта система является одобренным FDA тестом на функционально значимую CAD, с производительностью, сопоставимой с CCTA4. Тест можно использовать без стресса пациента и без необходимости капитальных вложений в оборудование или специализированный персонал. Он идеально подходит для использования в сельской местности и в условиях ограниченных ресурсов, где доступ к современным технологиям визуализации часто недоступен.
Разработка3 и валидация4 POC-CAD были опубликованы ранее. Вкратце, POC-CAD начинается с одновременного сбора ортогонального градиента напряжения и сигналов фотоплетизмограммы с помощью устройства захвата, как описано в шаге протокола 1. Ортогональный градиент напряжения представляет собой биопотенциальный сигнал, полученный с использованием размещения отведения, аналогичногоконфигурации 5 отведения Франка, состоящей из шести биполярных электродов и электрода сравнения, прикрепленного к туловищу. Фотоплетизмограмма получается с использованием стандартного метода пропускания, при котором красный и инфракрасный свет пропускается через кончик пальца и попадает на датчик6. После того, как сигнал получен, он автоматически загружается в облачную систему, где из сигнала извлекаются инженерные функции и передаются алгоритму машинного обучения для получения оценки CAD, которая представлена на веб-портале. На этапах протокола 2 и 3 описана методология интерпретации оценки CAD, полученной в результате теста. В частности, либо опубликованные данные, либо другие источники, имеющие отношение к врачу, могут быть использованы для оценки вероятности ИБС до того, как пациент пройдет тест. Отношения правдоподобия могут быть рассчитаны на основе результатов теста и использованы для обновления вероятности САПР от предварительного к посттестовому периоду, используя либо двоичный результат теста (шаг 2), либо более детальные значения оценки САПР (шаг 3). Наконец, обсуждается моделирование экономики POC-CAD в сравнении с текущим стандартом медицинской помощи.
протокол
Исследование было одобрено Западным институциональным наблюдательным советом и проведено в соответствии с Хельсинкской декларацией. От всех субъектов было получено письменное информированное согласие на участие. Вкратце, чтобы быть включенными, субъекты должны быть не моложе 18 лет с сердечно-сосудистыми симптомами, но без известных заболеваний коронарных артерий и должны быть назначены для прохождения ICA или CCTA. Критерии исключения включали, среди прочего, ранее задокументированный инфаркт миокарда, предшествующее аортокоронарное шунтирование и предыдущую замену сердечного клапана. Полные критерии включения и исключения исследований можно найти на clinicaltrials.gov в Национальном клиническом исследовании (NCT) No NCT03864081. Используемое оборудование и программное обеспечение перечислены в Таблице материалов.
1. Регистрация сигналов
- Подготовьте кожу, сбрив все волосы с места электрода. Убедитесь, что на коже не осталось остатков, промыв водой с мылом и при необходимости используя чистую и сухую марлю или безалкогольную салфетку.
- Подсоедините провода к электродам и расположите их в соответствии с таблицей 1.
ПРИМЕЧАНИЕ: Качество электродов может повлиять на качество сигнала; Рекомендуется использовать качественные диагностические или высокопроизводительные электроды. - Поместите гемодинамический датчик (фотоплетизмограмма, ФПГ) на палец пациента так, чтобы палец находился как можно дальше в датчике, а кабель датчика располагался вдоль верхней части руки.
- Используйте указательный палец, если рана или другая клинически значимая причина не препятствуют его использованию. Посоветуйте пациенту не перемещать датчик после его установки.
- Положите пациента на спину в удобное положение покоя. Убедитесь, что кабель датчика PPG и кабели электродов не перекрываются.
- При необходимости используйте амортизацию (например, свернутое одеяло или полотенце вместе с подушкой), чтобы предотвратить прямое давление пациента на синий электрод на спине.
- Чтобы ограничить шум сигнала и максимально повысить качество сигнала, по возможности выключите все электронные устройства (мониторы, телевизоры, сотовые телефоны и т. д.) или уберите их из комнаты. Выключите освещение в комнате.
- Введите информацию о пациенте и подтвердите правильность: имя пациента, фамилию пациента, пол при рождении, рост в дюймах, вес в фунтах, дату рождения и номер медицинской карты (все обязательно, может быть введен в любом порядке).
- Убедитесь, что пациент чувствует себя комфортно, и напомните ему о необходимости быть неподвижным и тихим (например, не разговаривать во время осмотра).
- Поместите устройство на ровную поверхность и подтвердите размещение в приложении. Нажмите кнопку «Старт», чтобы начать сбор сигнала.
- Следите за сообщениями об ошибках на устройстве и если они появляются, следуйте инструкциям на экране, чтобы устранить их.
- После завершения сбора сигнала, занимающего 3 минуты и 35 секунд, устройство автоматически передаст данные в облако для оценки качества сигнала. Держите пациента привязанным к устройству до тех пор, пока не будет получено подтверждение качества проходящего сигнала.
- Отсоедините электроды от пациента и снимите датчик PPG.
- Зайдите на портал для просмотра результатов тестирования (будет доступно примерно через 10 минут после загрузки сигнала в облако).
Таблица 1: Размещение лидов. Описание анатомических мест, в которых должен быть размещен каждый из семи электродов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
2. Интерпретация результатов теста с положительным результатом теста в сравнении с . тест отрицательный
- Определите вероятность заболевания у пациента до проведения теста (например, используя рекомендации Европейского общества кардиологов (ESC)7).
- Определите, является ли тест пациента положительным или отрицательным, сравнив показатель CAD с 0: если больше или равно нулю, то результат пациента положительный, а если меньше нуля, то результат отрицательный.
- Прочтите значение CAD Score из отчета и сравните его с распределениями отрицательных и положительных пациентов в валидационной когорте, показанной в нижней части отчета.
- Рассчитайте чувствительность и специфичность8, затем отношения правдоподобия (LR) с помощью уравнения 1 и уравнения 29.
ПРИМЕЧАНИЕ: Показан рабочий пример, учитывая, что чувствительность теста составляет 88% (рассчитано с использованием субъектов с положительным результатом теста на ICA, который является единственной группой пациентов с заболеванием) и специфичность составляет 51% (рассчитано с использованием субъектов с отрицательным результатом теста CCTA с весом 94% и пациентов с отрицательным результатом теста ICA с весом 6%, чтобы представить общую популяцию в исследовании PROMISE10).
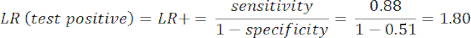 (Уравнение 1)
(Уравнение 1)
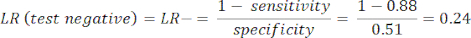 (уравнение 2)
(уравнение 2) - Рассчитайте посттестовую вероятность пациента по следующим уравнениям 3-511, где LR+ используется в случае положительного теста и LR- в случае отрицательного теста:
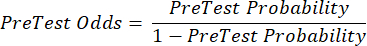 (уравнение 3)
(уравнение 3)
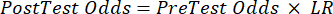 (Уравнение 4)
(Уравнение 4)
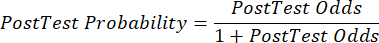 (уравнение 5)
(уравнение 5) - С учетом обновленной вероятности ИБС, учитывая результаты теста, определите соответствующий следующий шаг в уходе за пациентом (например,используя рекомендации 7-го руководства ESC, приведенные в таблице 2).
Таблица 2: Рекомендации ESC по вероятности CAD. Для четырех уровней вероятности ИБС рекомендации Европейского общества кардиологов предназначены для правильной интерпретации этой вероятности, включая следующий тест (при необходимости). Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
3. Интерпретация результатов испытаний с более высокой степенью детализации
- Увеличьте детализацию положительных и отрицательных результатов теста, рассмотрев диапазоны оценки ИБС, наблюдаемые в популяции, используемой для валидации теста, в частности, разделив на тертили (равное количество испытуемых в трех ячейках) в диапазонах положительных и отрицательных тестов, как показано в таблице 3.
ПРИМЕЧАНИЕ: Для упрощения расчетов из этого анализа исключается 6% вклад пациентов с отрицательным результатом катетеризации, включение которого существенно не изменит результаты. - В пределах каждого тертиля в диапазоне тестов и отрицательных результатов подсчитайте количество истинно отрицательных результатов (TN), то есть субъектов, у которых на самом деле нет заболевания, и количество ложноотрицательных результатов (FN), то есть субъектов, у которых действительно есть заболевание.
- Примените следующие уравнения 6-811 для определения LR- каждого тертиля с отрицательным результатом теста (LR+ от отрицательного тертиля не имеет значения).
ПРИМЕЧАНИЕ: Уравнения предполагают, что профиль производительности тертиля представляет собой полный диапазон отрицательных тестов для расчета статистики производительности (что требует поправочного коэффициента трех, соответствующего количеству тертилей, для достижения исходной частоты отрицательных тестов по отношению к положительности теста).
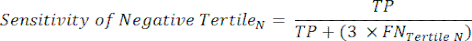 (Уравнение 6)
(Уравнение 6)
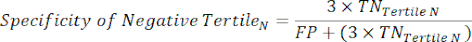 (Уравнение 7)
(Уравнение 7)
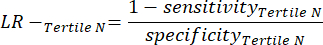 (уравнение 8)
(уравнение 8)
- Примените следующие уравнения 6-811 для определения LR- каждого тертиля с отрицательным результатом теста (LR+ от отрицательного тертиля не имеет значения).
- В пределах каждого тертиля в диапазоне положительных результатов теста подсчитайте количество истинно положительных результатов (TP), которые являются субъектами, у которых действительно есть заболевание, и количество ложноположительных результатов (FP), субъектов, у которых действительно нет заболевания.
- Примените уравнения 9-11 для определения LR+ каждого тертиля с положительным результатом теста (LR- от положительных тертилей не имеет значения)11.
ПРИМЕЧАНИЕ: Уравнения предполагают, что профиль производительности тертиля представляет собой полный диапазон положительных результатов теста для целей расчета статистики эффективности (что требует поправочного коэффициента трех, соответствующего количеству тертилей, для достижения исходной частоты положительных результатов теста по отношению к отрицательности теста).
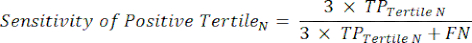 (Уравнение 9)
(Уравнение 9)
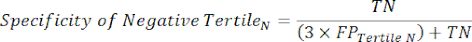 (уравнение 10)
(уравнение 10)
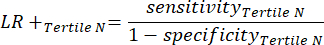 (Уравнение 11)
(Уравнение 11)
- Примените уравнения 9-11 для определения LR+ каждого тертиля с положительным результатом теста (LR- от положительных тертилей не имеет значения)11.
- Определите, в каком тертиле находится показатель ИБС пациента, и с учетом LR в таблице 3 рассчитайте вероятность после теста с учетом процедуры, показанной на шаге 2.
ПРИМЕЧАНИЕ: Как и следовало ожидать, значения LR- уменьшаются при более негативных оценках САПР, а значения LR+ увеличиваются при более положительных оценках САПР, что означает, что более отрицательная оценка САПР более эффективно снижает вероятность до теста, а более положительная оценка САПР более эффективно увеличивает вероятность до теста. - В качестве альтернативы выполнению расчетов, перечисленных в шагах 2.4-3.4, используйте таблицу 4 для перевода вероятности до теста в вероятность после теста с использованием балла ИБС пациента7.
Таблица 3: Отношения правдоподобия. Для трех диапазонов баллов в пределах тест-положительного и отрицательного теста соответствующие положительные и отрицательные отношения правдоподобия соответственно. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Сопоставление вероятностей до и после теста. Для 10 уровней вероятности до теста соответствующая вероятность после теста с учетом оценки CAD в каждом из трех отрицательных тертилей и в каждом из положительных тертилей. Зеленая окраска соответствует <15% вероятности заболевания (в рекомендациях ESC указано, что ИБС можно исключить); желтый цвет соответствует 15%-65% вероятности заболевания (в рекомендациях ESC указано, что предпочтительно неинвазивное тестирование на основе визуализации); оранжевый соответствует вероятности заболевания в 66%-85% (в рекомендациях ESC указано, что следует проводить неинвазивное тестирование на основе визуализации); красный цвет соответствует >85% вероятности заболевания (в рекомендациях ESC указано, что можно исключить ИБС). Дополнительную информацию о рекомендациях см. в таблице 2 . Обратите внимание, что оценка CAD 0 считается положительным результатом теста. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Результаты
Пример сигнала можно увидеть на рисунке 1, а отчет — на рисунке 2, как это может выглядеть для врача, использующего тест. Ниже приведены несколько примеров из практики, демонстрирующих применение методологии для интерпретации значимости оценки ИБС.
Кейс 1
67-летний мужчина обратился с жалобами на симптомы боли в груди в покое, с иррадиирующей болью в руке, а также потоотделением и тошнотой. Основываясь на рекомендациях ESC7, его возраст, пол и симптомы соответствуют первоначальной вероятности заболевания в 84%. Рекомендации ESC предполагают, что такому пациенту требуется неинвазивное тестирование для постановки диагноза ИБС, чтобы оправдать направление на катетеризацию сердца и любое необходимое вмешательство (Таблица 2). Был проведен тест POC-CAD, который показал оценку CAD 0,32, что является положительным результатом теста и находится в самой высокой трети положительных баллов CAD с LR+ 2,888 (Таблица 3). Таким образом, вероятность появления пациента после теста составляет 94%, и в соответствии с рекомендациями ESC (Таблица 2) можно с уверенностью предположить, что у пациента ИБС, и инвазивная катетеризация сердца является подходящим курсом действий.
Кейс 2
39-летняя женщина жалуется на боль в груди в состоянии покоя, отдающую как в левую, так и в правую сторону. Основываясь на рекомендациях ESC7, ее возраст, пол и симптомы согласуются с начальной вероятностью заболевания в 28%, и рекомендации предполагают, что неинвазивный тест будет предпочтительным следующим шагом для лучшего понимания вероятности ИБС. Тем не менее, в рекомендациях также указано, что у молодых пациентов (таких как эта 39-летняя женщина) врач должен осознавать радиационное облучение, которое необходимо для проведения такого теста, как ОФЭКТ, требующего введения радиоизотопа. Другим вариантом такого теста является CCTA, но для этого требуется много рентгеновских лучей. Поэтому POC-CAD является логичным выбором, так как он не требует излучения. Тест был проведен, вернув значение -0,12, в пределах первой трети отрицательного диапазона, с LR- 0,129 (табл. 3). Результирующая вероятность после тестирования составляет 4%, что падает до уровня, при котором САПР может быть безопасно исключена в соответствии с рекомендациями ESC, без необходимости дальнейшего тестирования САПР.
Кейс 3
74-летняя женщина обратилась с жалобами на неангинозную боль в груди и одышку. Основываясь на рекомендациях ESC7, ее возраст, пол и симптомы согласуются с начальной вероятностью заболевания в 24%, и рекомендации предполагают, что неинвазивный тест будет предпочтительным следующим шагом для лучшего понимания вероятности ИБС. Пациентка не решается поехать из сельской клиники, где она лечится, в крупный городской центр, где доступны все методы тестирования (ПЭТ, ОФЭКТ, КСТ, CMR), поэтому врач предлагает POC-CAD. Оценка CAD составляет 0,07, попадая в первую треть положительного диапазона с LR+ 1,446, в результате чего вероятность после теста составляет 33%. На основании положительного результата и повышения вероятности заболевания пациент соглашается на поездку в город для проведения ПЭТ-сканирования. ПЭТ также указывала на заболевание с LR+ 6,0412 и увеличивает от 33% до 75% после ПЭТ.
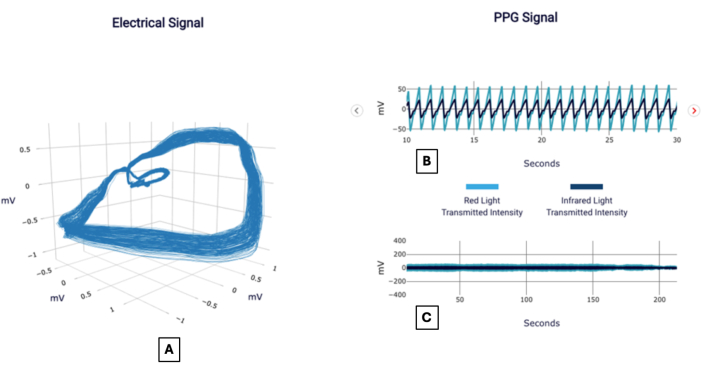
Рисунок 1: Примеры сигналов. Пример отчета POC-CAD, показывающий визуализацию ортогонального градиента напряжения, также называемого электрическим сигналом (A), и сигнала фотоплетизмограммы, сфокусированного на интервале 20 с (B) и полной продолжительности (C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
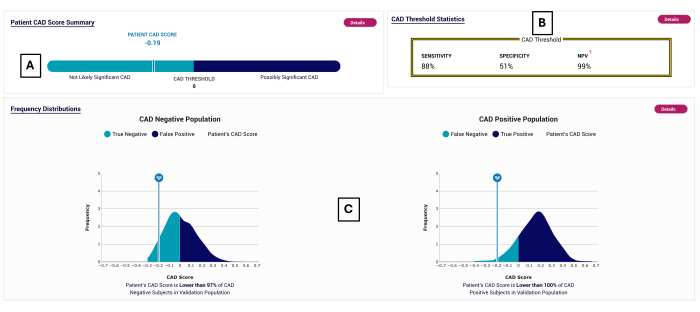
Рисунок 2: Пример отчета CAD. Пример отчета POC-CAD, показывающий оценку CAD -0,19 (A), которая попадает в диапазон отрицательных тестов (<0). Результаты испытаний показаны на рисунке (B). Распределение баллов CAD отображается для предметов, по которым POC-CAD был валидирован в (C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
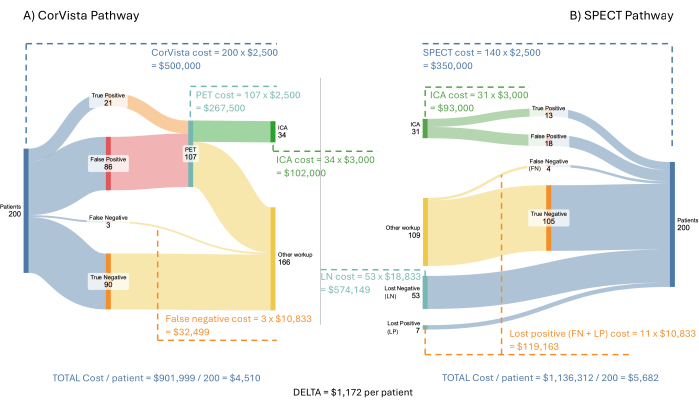
Рисунок 3: Поток экономической модели затрат. Гипотетическая поступающая популяция из 200 пациентов прогоняется по пути POC-CAD>PET (A) и пути SPECT (B). Затраты системы здравоохранения показаны для каждой ветви каждого пути, а также средняя экономия на одного пациента при внедрении пути POC-CAD>PET. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Основное внимание в этом разделе уделяется экономике теста; тем не менее, полезно сначала обсудить аспекты оценки предтестовой вероятности для САПР. Как описано на этапах 2 и 3 протокола, оценка вероятности ИПР до теста является критическим шагом в контексте оценки САПР и определении вероятности ИПР после теста. Мы использовали рекомендации ESC 2013, которые основывают вероятность ИБС на трех характеристиках: поле, возрасте и симптомах (в группах типичной стенокардии, атипичной и неангинальной боли)7. Тем не менее, важно отметить, что врач может применять свое клиническое суждение при выборе любого количественного или качественного метода. Кроме того, существуют другие опубликованные количественные методы для такой оценки, в том числе Diamond-Forrester13, который требует тех же входных характеристик, что и ESC 2013. Также были опубликованы более полные вариации, такие какрасширение 14 Diamond-Forrester со статусом эстрогена для женщин (для компенсации возрастных колебаний в менопаузе, а также любой гистерэктомии), а также диабета, гипертонии, гиперлипидемии, курения, семейного анамнеза ишемической болезни сердца и ожирения. Тем не менее, имейте в виду, что некоторые методологии могут определять ИБС при 50% сужении просвета, в то время как 70% представляет собой текущие рекомендации ACC (за исключением левой главной артерии при 50%).
Экономические характеристики POC-CAD и то, как тест взаимодействует с системой оказания медицинской помощи, являются решающими характеристиками для определения того, действительно ли тест подходит для клинического использования. Для диагностики ИБС наиболее часто используемым тестом является MPI, часто известный как ядерный стресс-тест или ОФЭКТ. По состоянию на 2019 год MPI использовался примерно в 85% оценок для CAD15. По оценкам, ежегодно в США проводится 7-8 миллионов исследований ОФЭКТ-МПИ16. Примерно в 5% случаев пациентов для диагностики ИБС используется CCTA. Было признано, что CCTA обладает превосходной диагностической эффективностью в исключении значительной ИБС. Два других метода визуализации, ПЭТ и МРТ сердца, составляют основную часть остальных обследований. Для проведения всех этих тестов требуется фотоаппарат и квалифицированная команда специалистов для проведения и интерпретации теста. Такие камеры являются дорогостоящим капитальным оборудованием. Следовательно, эти тесты часто ограничены в доступности для городских медицинских учреждений, где имеется достаточный объем, чтобы оправдать как первоначальные затраты, так и эксплуатационные расходы.
В 2021 году Американский колледж кардиологии (ACC) опубликовал свои рекомендации для пациентов без известных ИБС или ранее проведенных тестов и с промежуточным рискомИБС 2,17, где как MPI, так и CCTA были признаны передовыми диагностическими вариантами. В отличие от CCTA и MPI, POC-CAD может использоваться в любых местах оказания медицинской помощи, таких как кабинет врача, больница критического доступа, центр ухода за племенами и центры третичной медицинской помощи, а не ограничиваться, как CCTA и MPI, только теми центрами, которые оснащены дорогостоящим оборудованием для визуализации и бригадами, необходимыми для его работы.
Как правило, пациенты с подозрением на ИБС после теста первой линии направляются на ВСА; Как уже описано, это считается золотым стандартом диагностики ИБС. ICA – это инвазивная процедура, проводимая в амбулаторных условиях специалистами в области инвазивной кардиологии.
Недавнее исследование уровня посещаемости радиологических исследований в крупном высшем академическом центре показало, что 24% запланированных приемов не были посещены пациентом из-за отмены или неявки18. Изучаемые радиологические методы включали диагностику ИБС. Цифра, приведенная в этом исследовании, согласуется с обсуждением с финансовым директором системы здравоохранения, который предполагает, что процент неявки составляет 20%. Кроме того, в ходе многочисленных бесед с сельскими врачами, где для прохождения теста может потребоваться значительное время в пути, до 50% пациентов могут не успеть и записаться на прием, и прийти на него. В следующей модели, консервативно для сельского рынка, предполагается, что этот показатель составляет 30% (т.е. 70% приходят на прием).
Существует прямое влияние на диагностическую эффективность последующих тестов, когда значительное число пациентов не приступает к рекомендованному тесту. Предполагая, что этот показатель постоянен у лиц со значительным ишемическим заболеванием сердца и без него, чувствительность выявления состояния в указанной популяции составит 70% от ожидаемой чувствительности. В случае ОФЭКТ, у которой заявленная чувствительность для выявления функционально значимой ИБС составляет 73%, эффективная чувствительность составляет всего 53% (= 0,7 x 73%)12, т.е. почти половина пациентов из направленной популяции с функционально значимой ИБС будет пропущена. Эти пропущенные пациенты не обходятся системе здравоохранения в ноль. Положительные пациенты с функционально значимой ИБС, скорее всего, будут наблюдаться позже и понесут значительные дополнительные расходы из-за прогрессирования их заболевания. Например, если пациент впоследствии обращается в отделение неотложной помощи, средняя стоимость визита для пациента с признаками острого коронарного синдрома рассчитана в размере $30 00019.
Кроме того, даже у пациентов без значительной ИБС, если они не следуют направлению своего врача на визуализацию, они с меньшей вероятностью вернутся к этому врачу, и, таким образом, существует ограниченная возможность определить, что еще может вызывать их симптомы. Это также может дорого обойтись как пациенту с точки зрения прогрессирования основного заболевания, так и системе здравоохранения. Например, было показано, что задержка в диагностике сердечной недостаточности увеличивает стоимостьлечения этого пациента на 8000 долларов в год.
Представленная здесь экономическая модель затрат направлена на учет этих последствий, сравнивая сценарий, в котором POC-CAD используется в качестве основного теста для значительного CAD, со сценарием, в котором используется ОФЭКТ. Поскольку POC-CAD является тестом на исключение, ожидается большее количество ложноположительных результатов, чем для ОФЭКТ. Неразумно ожидать, что все положительные результаты теста попадут в ICA. Во многих случаях было бы идеально использовать второй тест. При анализе эффективности включения и исключения различных неинвазивных тестов на функционально значимую ИБС, Knuuti et al. рекомендуют использовать CCTA с функциональным тестом, таким как ОФЭКТ12. Однако это опять же сопряжено с риском того, что не будет выявлено относительно большая доля положительных пациентов. Лучшим функциональным тестом была бы сердечная ПЭТ, которая имеет чувствительность 89% и специфичность 85%12. Сердечная ПЭТ все чаще используется в США, в настоящее время чаще всего назначается кардиологами, и уже используется чаще, чем CCTA 15,21. В этой модели предполагается, что положительные результаты от ПЭТ затем поступают в ICA. Поскольку чувствительность ПЭТ аналогична чувствительности POC-CAD, предполагается, что все положительные результаты в поступающей популяции ПЭТ правильно классифицируются как положительные. В модели, в которой ОФЭКТ используется в качестве теста первой линии, предполагается, что положительные результаты передаются в ICA. Предполагая, что входящая распространенность составляет 12%, это приводит к положительному выходу по ICA в 41%, что близко к тому, что наблюдалось в исследовании PROMISE10.
На рисунке 3 показана модель и результаты с использованием гипотетической популяции из 200 пациентов с симптомами сердечно-сосудистых заболеваний. Предполагается, что каждый из ОФЭКТ, ПЭТ и POC-CAD возмещается по одинаковой ставке: 2 500 долларов США за тест. Предполагается, что МКА получит возмещение в размере 3 000 долл. Стоимость любого лечения во время ИЦА или впоследствии не включена в модель, поскольку это выходит за рамки диагностического пути, который представляет модель. Затраты на потерянных отрицательных и потерянных положительных пациентов оценить сложнее. Учитывая, что эти пациенты определяются как не последовавшие указаниям своего врача и не прошедшие визуализирующее исследование, предполагается, что их следующее взаимодействие с системой здравоохранения будет заключаться в обращении в отделение неотложной помощи с симптомами сердечно-сосудистых заболеваний. В исследовании обращений в отделение неотложной помощи с такими симптомами Pope et al. определили, что 17% соответствовали критериям острой ишемии сердца, 6% имели стабильную стенокардию, 21% имели неишемические проблемы с сердцем и 56% имели некардиальныепроблемы. Расходы на первичное обращение в отделение неотложной помощи были рассчитаны O'Sullivan et al. в размере 34 200 долларов США для несмертельной ишемии миокарда и 17 300 долларов США для стенокардии безкоронарной реваскуляризации. Использование только затрат на первоначальную презентацию является консервативным подходом, поскольку затраты на острую фазу (3 года), понесенные в связи с мероприятием, значительно выше и составляют 73 300 и 36 000 долларов США соответственно. Стоимость посещения отделения неотложной помощи в 53% случаев по поводу боли в груди, но без выявления сердечной проблемы, была оценена в 2988 долларов США на основе информации, предоставленной United Healthcare24. Наконец, для 21% пациентов с неишемической сердечной проблемой стоимость была оценена в 2988 долларов США, плюс дополнительные расходы, вызванные задержкой в лечении сердечного заболевания. Как указывалось выше, для пациента с сердечной недостаточностью дополнительные ежегодные затраты на отсроченную диагностику были рассчитаны в размере 8000 долларовСША. Таким образом, стоимость для 21% была принята в размере 10 988 долларов США, предполагая, что у большинства этих пациентов будет либо сердечная недостаточность, либо легочная гипертензия и аналогичная стоимость отсроченного лечения для обоих. Опять же, использование только одного года дополнительных затрат является консервативным подходом, поскольку это, по сути, будет применяться к каждому последующему году. В целом, средневзвешенное значение этих затрат, используемое в модели, составляет 10 833 доллара США.
Экономическая модель затрат демонстрирует потенциальную среднюю экономию в размере 1172 долларов США на одного пациента для системы здравоохранения, в целом, за счет затрат на более позднее лечение, приводящее к прогрессированию заболевания, требующего более продвинутого ухода. Кроме того, принятие этого пути увеличит выход на ICA до 62% по сравнению с 41%, наблюдаемыми и моделируемыми в настоящее время в пути ОФЭКТ.
Если экстраполировать на прибывающее сельское население, составляющее 2,25 миллиона пациентов в год с симптомами сердечно-сосудистых заболеваний в США, общая потенциальная экономия от внедрения POC-CAD в качестве передового теста для значительного ИБС составит примерно 2,64 миллиарда долларов. Как обсуждалось выше, большая часть этой экономии связана с тем, что пациенты с функционально значимой ИБС не пропускаются из-за более высокой чувствительности и более высокой диагностической эффективности по сравнению с ОФЭКТ. Кроме того, более высокая производительность, которая может быть достигнута на ICA, является решающим преимуществом, поскольку по пути POC-CAD>PET будет выполняться больше ICA, чем по пути SPECT. Более высокая доходность в ICA была бы полезна для пациентов, которые в настоящее время часто разочарованы отрицательными результатами ICA25, интервенционного кардиолога и системы здравоохранения.
Одно из возможных возражений против этой модели заключается в том, что каждый должен быть направлен непосредственно на ПЭТ, а не использовать сначала тест POC-CAD. Такой подход, особенно когда речь идет о сельском населении, может быть сопряжен с той же проблемой, которая в настоящее время наблюдается при проведении всех визуализирующих тестов – потерей возможности для последующего наблюдения. Если бы те же предположения для модели были сохранены, эффективный выход ПЭТ имел бы чувствительность всего 62% (= 0,7 x 89%), тем самым упуская из виду многих действительно положительных пациентов в этой популяции. И наоборот, замечено, что наличие положительного результата теста POC-CAD может побудить пациентов к последующему направлению на последующие диагностические тесты (такие как ICA), и, следовательно, не ожидается, что это будет проблемой в пути POC-CAD>PET. Можно также утверждать, что ОФЭКТ является преобладающим путем и, следовательно, скорее всего, будет использоваться на практике после POC-CAD. В этом случае экономия от полученного пути POC-CAD>ОФЭКТ будет немного выше, чем показано выше, но эффективный выход при ICA будет немного ниже (58%), так как в потоке будет еще три пропущенных положительных пациента (ложноотрицательных результата) из двухсот.
В заключение следует отметить, что POC-CAD является многообещающим дополнением к диагностическому пути. Основное преимущество этого теста заключается в том, что его можно использовать в месте оказания медицинской помощи, без использования излучения, стресса или контраста, и при этом он дает результаты, сопоставимые с результатами CCTA, для исключения функционально значимого CAD26. Кроме того, результаты доступны в рамках одного визита, что позволяет врачу обсудить с пациентом следующие шаги в лечении, не планируя еще один визит. Поскольку тест может быть проведен в месте оказания медицинской помощи, а результаты быстро доступны, POC-CAD решает значительную проблему потери для последующего наблюдения, особенно в сельских районах, где проживает примерно четверть населения США. Учитывая надежный профиль исключения теста с отрицательным результатом, врач может быстро изучить другие объяснения симптомов пациента. Когда смоделированы затраты на результирующую задержку в диагностике пациента, использование POC-CAD в качестве теста первой линии обеспечит значительные преимущества для пациентов, врачей и плательщика. Кроме того, существующие методы визуализации не увидят ни значительного увеличения, ни уменьшения объема, что является проблемой для многих центров визуализации. Экономия средств достигается за счет более своевременной диагностики и лечения состояния пациента.
Раскрытие информации
T.B., N.N., F.F., H.G., C.B., S.R. и I.S. являются сотрудниками Analytics for Life.
Методологии, касающиеся интерпретации оценки CorVista CAD, представляют собой текущие предположения, основанные на подмножестве проверенной совокупности, и требуют дальнейшей проверки. Пожалуйста, обратитесь к инструкции по применению продукта.
Благодарности
Авторы хотели бы поблагодарить Коди Вакермана и Хью Дабберли из Dubberly Design Office (Сан-Франциско) за их помощь в визуализации путей, показанных на рисунке 3.
Материалы
| Name | Company | Catalog Number | Comments |
| CorVista CAD | CorVista | n/a | System comprising signal acquisition, cloud processing, and delivery of a report containing the CAD Score via a web portal |
| Electrodes | Various (see comments) | Diagnostic quality or high performance electrodes are recommended. For example: Conmed ClearTrace 1700-007 Skintact FS-TB1 Vermed A10005 |
Ссылки
- World Health Organization. The top 10 causes of death [Internet]. 2020 [cited 2024 Jun 27]. , Available from: https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death (2020).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79 (2), e21-e129 (2022).
- Burton, T., et al. Development of a non-invasive machine-learned point-of-care rule-out test for coronary artery disease. Diagnostics. 14 (7), 719(2024).
- Stuckey, T. D., et al. Clinical validation of a machine-learned, point-of-care system to IDENTIFY functionally significant coronary artery disease. Diagnostics. 14 (10), 987(2024).
- Frank, E. An accurate, clinically practical system for spatial vectorcardiography. Circulation. 13 (5), 737-749 (1956).
- Park, J., Seok, H. S., Kim, S. S., Shin, H. Photoplethysmogram analysis and applications: An integrative review. Front Physiol. 12, 808451(2022).
- Montalescot, G., et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 34 (38), 2949-3003 (2013).
- Baratloo, A., Hosseini, M., Negida, A., El Ashal, G. Part 1: Simple definition and calculation of accuracy, sensitivity and specificity. Emergency. 3 (2), 48-49 (2015).
- Ranganathan, P., Aggarwal, R. Understanding the properties of diagnostic tests-Part 2: Likelihood ratios. Perspect Clin Res. 9 (2), 99-102 (2018).
- Douglas, P. S., et al. Outcomes of anatomical versus functional testing for coronary artery disease. New Eng J Med. 372 (14), 1291-1300 (2015).
- Safari, S., Baratloo, A., Elfil, M., Negida, A. Evidence based emergency medicine; part 4: Pre-test and post-test probabilities and Fagan's nomogram. Emergency. 4 (1), 48(2016).
- Knuuti, J., et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: a meta-analysis focused on post-test disease probability. Eur Heart J. 39 (35), 3322-3330 (2018).
- Diamond, G. A., Forrester, J. S. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. New Eng J Med. 300 (24), 1350-1358 (1979).
- Morise, A. P. Comparison of the Diamond-Forrester method and a new score to estimate the pre-test probability of coronary disease before exercise testing. Am Heart J. 138 (4), 740-745 (1999).
- Pelletier-Galarneau, M., Vandenbroucke, E., Lu, M., Li, O. Characteristics and key differences between patient populations receiving imaging modalities for coronary artery disease diagnosis in the US. BMC Cardiovasc Disord. 23 (1), 251(2023).
- Li, J., et al. Factors that impact a patient's experience when undergoing single-photon emission computed tomography myocardial perfusion imaging (SPECT-MPI) in the US: A survey of patients, imaging center staff, and physicians. J Nuclear Cardiol. 28 (4), 1507-1518 (2021).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79, e21-e129 (2022).
- Aijaz, A., et al. Sociodemographic factors associated with outpatient radiology no-shows versus cancellations. Acad Radiol. S1076 - 6332 (24), 00228-00229 (2024).
- Cowper, P. A., et al. Acute and 1-year hospitalization costs for acute myocardial infarction treated with percutaneous coronary intervention: Results From the TRANSLATE-ACS registry. J Am Heart Assoc. 16 (8), 8(2019).
- Thomas, A., et al. Forgone medical care associated with increased health care costs among the U.S. heart failure population. JACC Heart Fail. 9 (10), 710-719 (2021).
- Reeves, R. A., Halpern, E. J., Rao, V. M. Cardiac imaging trends from 2010 to 2019 in the Medicare population. Radiol Cardiothorac Imaging. 3 (5), (2021).
- Pope, J. H., et al. Missed diagnoses of acute cardiac ischemia in the Emergency Department. New Eng J Med. 342 (16), 1163-1170 (2000).
- OʼSullivan, A. K., et al. Cost estimation of cardiovascular disease events in the US. Pharmacoeconomics. 29 (8), 693-704 (2011).
- Corso, A. Emergency visit cost with and without insurance in 2024. Mira. , https://www.talktomira.com/post/how-much-does-an-er-visit-cost (2024).
- Patel, M. R. Low diagnostic yield of elective coronary angiography. New Eng J Med. 362 (10), 886-895 (2010).
- Browning, S. CorVista System 510(k) Summary (K232686). , U.S. Food and Drug Administration. Retrieved from https://www.accessdata.fda.gov/cdrh_docs/pdf23/K232686.pdf (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены