Method Article
Flujo de trabajo de biofabricación escalable para producir y aislar bioterapéuticos contra el cáncer basados en vesículas extracelulares derivados de células asesinas naturales
* Estos autores han contribuido por igual
En este artículo
Resumen
Las vesículas extracelulares derivadas de células asesinas naturales (NK-EV) tienen un potencial prometedor como bioterapéuticos contra el cáncer. Este estudio basado en la metodología presenta un flujo de trabajo de biofabricación escalable de circuito cerrado diseñado para producir y aislar continuamente grandes cantidades de NK-EV de alta pureza. Las pruebas de control durante el proceso se realizan en todo el flujo de trabajo de biofabricación, lo que garantiza que los vehículos eléctricos cumplan con los estándares de calidad para la liberación del producto.
Resumen
Las vesículas extracelulares derivadas de células asesinas naturales (NK-EV) se están investigando como bioterapéuticos contra el cáncer. Poseen propiedades únicas como nanovesículas citotóxicas dirigidas a las células cancerosas y como comunicadores inmunomoduladores. Un flujo de trabajo de biofabricación escalable permite la producción de grandes cantidades de NK-EV de alta pureza para satisfacer las demandas preclínicas y clínicas. El flujo de trabajo emplea un biorreactor de fibra hueca de circuito cerrado, lo que permite la producción continua de NK-EV de la línea celular NK92-MI en condiciones sin suero, sin xeno, sin alimentadores y sin antibióticos de acuerdo con los estándares de Buenas Prácticas de Fabricación. Este estudio basado en protocolos describe el flujo de trabajo de biofabricación para aislar NK-EV mediante cromatografía de exclusión por tamaño, ultrafiltración y esterilización basada en filtros. La caracterización esencial del producto NK-EV se realiza mediante un análisis de seguimiento de nanopartículas, y su funcionalidad se evalúa mediante un ensayo de potencia validado basado en la viabilidad celular contra células cancerosas. Este proceso de biofabricación escalable tiene un potencial significativo para avanzar en la traslación clínica de los bioterapéuticos contra el cáncer basados en NK-EV al adherirse a las mejores prácticas y garantizar la reproducibilidad.
Introducción
Enel siglo XXI se han logrado avances notables en la batalla contra el cáncer. Esto se debe principalmente al aumento de los inmunoterapéuticos contra el cáncer, una clase de fármacos que aprovechan el sistema inmunitario para combatir el cáncer. Las vesículas extracelulares derivadas de células asesinas naturales (NK-EV) representan contendientes prometedores en el ámbito en expansión de la inmunoterapia. Integradoras de la inmunidad innata y adaptativa, las células NK desempeñan un papel crucial en la defensa del cuerpo contra las células infectadas por virus, estresadas y malignas. Emplean un arsenal completo de maquinaria anticancerígena para eliminar las células anormales a través de medios citotóxicos 1,2,3. Entre estos mecanismos se encuentra la producción y secreción de EVs, estructuras bicapa a nanoescala que contienen diversas biomoléculas, como proteínas, ARNs y ADNs, cruciales para facilitar la comunicación intercelular 4,5,6. Los NK-EV emergen como prometedores terapéuticos libres de células debido a sus propiedades portadoras únicas. Estos incluyen su pequeño tamaño, que permite la esterilización basada en filtros, alta biocompatibilidad, acumulación preferencial dentro de los tumores, amplio espectro de entrega de carga, capacidad para superar barreras biológicas como la barrera hematoencefálica y un perfil de toxicidad mínimo. Por varias razones, los NK-EV obvian la necesidad de linfodepleción del paciente a través de quimioterapia antes de su administración: 1) convencionalmente, la linfodepleción se emplea para crear un entorno más hospitalario para la terapia basada en células, lo que permite que las células infundidas proliferen y ejerzan sus efectos terapéuticos; 2) a diferencia de las células, las VE carecen de la capacidad de replicación y son sustancialmente más pequeñas en escala; 3) Las VE operan a través de distintos mecanismos y exhiben una inmunogenicidad disminuida en comparación con las células 5,6,7. Además, los NK-EV mostraron consistentemente eficacia in vitro contra varios modelos de cáncer y también han mostrado efectos inmunomoduladores sobre las células inmunitarias que fomentan respuestas anticancerígenas 8,9. Los resultados in vivo corroboran estos hallazgos, mostrando una regresión del cáncer después del tratamiento con NK-EV y toxicidades insignificantes 10,11,12. Por lo tanto, las terapias basadas en NK-EV son muy prometedoras para abordar los desafíos del tratamiento de tumores sólidos fríos e inmunológicamente inertes 13,14,15,16,17.
Nuestro reciente estudio aborda un importante cuello de botella para la traslación clínica de los NK-EV a través de la biofabricación7. El artículo presenta una prueba de concepto para un flujo de trabajo de biofabricación rentable y escalable de NK-EV meticulosamente diseñado para garantizar las pruebas de control de calidad durante el proceso. Este enfoque produjo continuamente grandes cantidades de bioterapéuticos contra el cáncer basados en NK-EV de alta pureza, con una caracterización exhaustiva del producto realizada de acuerdo con las directrices MISEV201818. La escalabilidad del flujo de trabajo de biofabricación se puede lograr aumentando el tamaño del cartucho o teniendo varios biorreactores funcionando en paralelo. Del mismo modo, la escalabilidad del flujo de trabajo de aislamiento de EV se puede lograr fácilmente utilizando técnicas como la cromatografía líquida rápida de proteínas (FPLC), la cromatografía de exclusión por tamaño (SEC), la ultrafiltración (UF) y la esterilización basada en filtros. El sistema de biorreactor de fibra hueca (HFB) de circuito cerrado cultivó la línea celular NK autosuficiente de IL-2 (células NK92-MI) sin necesidad de suplementación con suero, un sistema de alimentación y antibióticos. Esto se logró utilizando un medio químicamente definido y libre de xeno disponible en el mercado (una versión GMP está ahora disponible comercialmente). Como resultado, se produjeron con éxito grandes cantidades de células NK (10a 9 células viables) y NK-EV (10a 12 EV) en un plazo de 5 a 7 días utilizando un solo cartucho de biorreactor de tamaño mediano, con ambos productos ampliamente caracterizados. A lo largo del proceso de biofabricación, la salud de las células se monitorizó diariamente utilizando métricas cuantificables como los niveles de pH, glucosa y lactato, junto con indicadores visuales como el color del medio y cualquier signo de contaminación, que son predictores esenciales de la calidad de las células y los VE. La evaluación postcosecha de la viabilidad y funcionalidad de las células NK generadas en el sistema HFB, en particular la citotoxicidad, reveló una mejora significativa en comparación con los cultivos basados en matraces7. Del mismo modo, los NK-EV purificados exhibieron un perfil de alta pureza, desprovistos de bacterias, micoplasma, entidades virales comunes y componentes celulares, y con niveles insignificantes de endotoxinas. Es importante destacar que los NK-EV purificados constituyeron más del 99,9% de todas las nanopartículas encontradas en el producto final7. Por último, estos NK-EV purificados conservaron las características clave de NK, incluidos los marcadores de superficie (CD2, CD45, CD56), la carga útil de citocinas (GzmB, PFN, IFN-g) y demostraron una potente citotoxicidad contra las células leucémicas K562, la línea de referencia para evaluar la citotoxicidad de las células NK7.
El presente protocolo detalla el flujo de trabajo de biofabricación escalable discutido anteriormente. Aclara la metodología para aislar los NK-EV producidos mediante FPLC-SEC junto con UF y esterilización basada en filtros. Además, el protocolo describe los pasos fundamentales, incluida la caracterización del producto mediante el análisis de seguimiento de nanopartículas (NTA), la evaluación de la calidad mediante diversas herramientas (cuantificación de proteínas/dsDNA y pruebas microbianas) y la validación funcional del producto NK-EV purificado contra células cancerosas mediante un ensayo de viabilidad celular. Por lo general, este flujo de trabajo produce de 1,0 a 1,5 mL de producto NK-EV con una concentración promedio de 1,18 x10 12 EV/mL7, con un total mínimo de 1 x 1012 EV basado en aproximadamente 40 mL de CM rico en EV. Este proceso permite la liberación de productos para diversas aplicaciones posteriores, como estudios de investigación, preclínicos y multiómicos (proteómica, transcriptómica, genómica, metabolómica, lipidómica y epigenómica) que exigen grandes cantidades de EV de alta calidad al tiempo que tienen potencial para la traducción clínica, con reproducibilidad demostrada.
Protocolo
1. Biofabricación de NK-EV a partir de células NK92-MI utilizando un biorreactor de circuito cerrado
NOTA: Los NK-EV se fabrican utilizando un flujo de trabajo de biofabricación escalable que se adhiere a las Buenas Prácticas de Fabricación (GMP) y utiliza las celdas NK92-MI (consulte la Figura 1). Nuestra reciente publicación contiene información detallada sobre el procedimiento de biofabricación y los perfiles de identidad y seguridad de los productos NK-EV7.
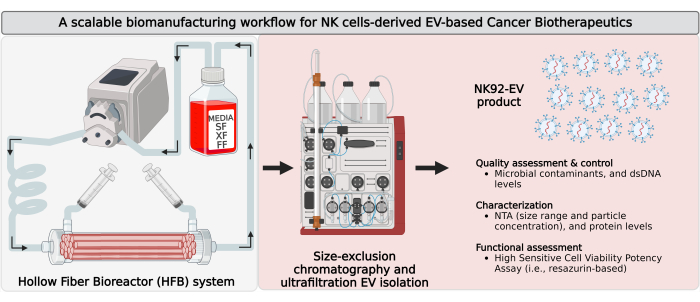
Figura 1: Biofabricación de vesículas extracelulares derivadas de células asesinas naturales (NK-EVs) en un biorreactor de fibra hueca (HFB) de circuito cerrado con flujo de trabajo de aislamiento escalable. Representación esquemática del flujo de trabajo de biofabricación para generar grandes cantidades de productos NK-EV de alta pureza. Las células NK92-MI autosuficientes de IL-2 se siembran en un cartucho HFB de circuito cerrado y se cultivan en condiciones sin suero (SF), sin xeno (XF), sin alimentadores y sin antibióticos, donde se cultivan para la recolección continua de medios acondicionados ricos en EV. El aislamiento de NK-EV a partir de CM rico en EV se realiza mediante cromatografía de exclusión por tamaño basada en cromatografía líquida rápida de proteínas (FPLC-SEC) junto con ultrafiltración (UF). Las NK-EV se caracterizan y evalúan mediante múltiples ensayos, y su funcionalidad frente a las células leucémicas K562 se evalúa mediante un ensayo de potencia de viabilidad. Esta cifra ha sido modificada de7(creado con Biorender.com). Haga clic aquí para ver una versión más grande de esta figura.
- A partir de 1 - 5 x 106 células NK92-MI y manteniendo una densidad celular entre 3 - 8 x 105 células/mL, cultive las células en matraces T25 - T175 utilizando un medio de cultivo precalentado. Incubar a 37 °C con 5% de CO2 (ver Tabla de Materiales). Reemplace el medio cada 2 a 3 días hasta que se produzcan 1 x 108 celdas NK92-MI de al menos el 70% de viabilidad.
NOTA: Mantenga 1/5 th-1/3rddel medio acondicionado (CM) al resembrar las células, ya que contiene factores de crecimiento favorables. - Realice la preparación del cartucho de HFB medio y la inoculación de células NK como se describe a continuación.
NOTA: Todas las manipulaciones deben realizarse dentro de una cabina de bioseguridad de clase II para garantizar y mantener la esterilidad. Antes de trasladar el sistema de cartucho a la cabina de bioseguridad, rocíe generosamente con etanol al 70%, prestando especial atención al cuello de botella del depósito y a las conexiones de la jeringa.- Prepare el cartucho HFB de acuerdo con las instrucciones del fabricante19 (consulte la Tabla de materiales; consulte la Figura 2) como se describe a continuación.
- Envuelva las conexiones Luer Lock con una película de cera y ajuste el caudal de la bomba de acuerdo con las instrucciones del fabricante19. Acondicione el cartucho de HFB permitiendo que 150 mL de solución salina estéril tamponada con fosfato (PBS; ver Tabla de Materiales) circule durante al menos cinco días.
- Para extraer el aire del espacio capilar extracelular (SEC; el volumen es de aproximadamente 29 ml), inyecte aproximadamente 40 ml de PBS a través del puerto ECS izquierdo y permita que el aire escape a través del puerto ECS derecho. Mientras lo hace, cierre las abrazaderas de los puertos de los extremos izquierdo y derecho. Asegúrese de que la jeringa esté siempre conectada a los puertos ECS izquierdo y derecho.
- Una vez completado, coloque el cartucho en la bomba de flujo (consulte la tabla de materiales) dentro de la incubadora configurada a 37 °C y 5% de CO2. Asegúrese de que no haya fugas después de unos días de circulación.
- Reemplace el PBS con 150 mL de medio de cultivo en el frasco del depósito y el ECS 2 días antes de sembrar las células en el cartucho. Repetir los pasos de acondicionamiento anteriores (paso 1.2.1.) utilizando el medio de cultivo pero durante 2 días de circulación.
- Antes de sembrar las células, reemplace el contenido en el frasco del depósito y el ECS con 250 mL de medio de cultivo fresco.
- Adquiera el matraz de cultivo de la incubadora y transfiera las células a un tubo de 50 ml. Girar a 300 x g durante 5 min. Vuelva a suspender el pellet celular utilizando 21 mL de medio de cultivo.
- Prepare dos alícuotas de 20,5 μL cada una a partir de la suspensión celular para el recuento de células en un contador de células automatizado (consulte la tabla de materiales). A cada alícuota de suspensión celular de 20,5 μL, agregue una cantidad igual de colorante AO/PI (consulte la Tabla de materiales) y mezcle hacia arriba y hacia abajo al menos 10 veces.
NOTA: No recomendamos el azul de tripano para un recuento preciso de células NK. Alternativamente, use un hemocitómetro para el conteo manual. - Cargue 20 μL en cada cámara de recuento de la corredera de recuento y realice el recuento automatizado de células utilizando el programa adecuado. Calcule la concentración media de células vivas y observe la viabilidad.
- Mezcle la solución de células NK varias veces antes de aspirarla con una jeringa de 20 ml y una aguja de 18 g para mantener la esterilidad. Esta solución debe contener aproximadamente 1 x 108 células NK vivas en aproximadamente 20 mL o aproximadamente 5 x 106 células/mL.
- Después de retirar la aguja de la jeringa, inyecte suavemente las células NK en el cartucho a través del puerto ECS izquierdo. Para garantizar una dispersión celular uniforme en todo el cartucho, recíproca suavemente la solución celular al menos 10 veces usando las jeringas conectadas a los puertos ECS izquierdo y derecho.
NOTA: la solución debe tener la misma turbidez en ambas jeringas, con los puertos de los extremos izquierdo y derecho cerrados. - Abra el puerto de los extremos izquierdo y derecho e inyecte lo que quede dentro de las jeringas. Cierre los puertos ECS izquierdo y derecho con las pinzas.
- Transfiera el cartucho a la incubadora y déjelo reposar durante 30 minutos antes de instalarlo correctamente en la bomba de flujo. Deje el cartucho para la biofabricación. Ajuste el caudal según el fabricante.
- Para controlar las métricas de salud celular, adquiera una alícuota de 0,5 mL de medio al día del medio completamente mezclado en la botella del depósito y guárdela a -20 °C después de verificar los niveles de glucosa y pH. Los niveles de L-lactato se pueden verificar más adelante (ver Tabla de Materiales).
- Reemplace el medio en el depósito (250 a 500 mL) cada 1 a 2 días para mantener el contenido de glucosa por encima del 50% de los niveles iniciales encontrados en el medio y el pH por encima de 7.0 (rango de 7.0 a 8.0).
- Prepare el cartucho HFB de acuerdo con las instrucciones del fabricante19 (consulte la Tabla de materiales; consulte la Figura 2) como se describe a continuación.
- Realice la recolección diaria de CM rico en NK-EV después de 1 día de descanso al sembrar el cartucho por primera vez, como se describe a continuación.
- Mueva el sistema de cartuchos al gabinete de bioseguridad. Inyecte suavemente aproximadamente 21 mL de medio de cultivo a través del puerto ECS izquierdo para empujar un volumen equivalente de CM rico en EV a través del ECS derecho, no mezcle (ver Figura 3).
NOTA: Utilice siempre material de plástico nuevo para evitar la contaminación. - Transfiera la solución de CM rica en EV a un tubo de 50 ml y centrifuga a 300 x g durante 5 min. Mientras tanto, vuelva a colocar el sistema de cartucho en la incubadora de la bomba de flujo.
- Transfiera el sobrenadante a un nuevo tubo y centrifugue a 2000 x g durante 10 min. Nuevamente, transfiera el sobrenadante a un nuevo tubo. A continuación, alícuota el CM rico en EV por igual en 3 tubos de 50 mL (~7 mL/tubo) y guárdelo a -80 °C hasta su posterior procesamiento.
NOTA: El CM rico en EV cosechado secuencialmente se agrupa a través de estos tres tubos, generando tres tubos de muestra técnicos replicados.
- Mueva el sistema de cartuchos al gabinete de bioseguridad. Inyecte suavemente aproximadamente 21 mL de medio de cultivo a través del puerto ECS izquierdo para empujar un volumen equivalente de CM rico en EV a través del ECS derecho, no mezcle (ver Figura 3).
- Realice la recolección de células HFB-NK para continuar produciendo CM rico en EV utilizando el mismo cartucho HFB que se describe a continuación.
NOTA: Las células NK se pueden recolectar del ECS del HFB realizando el protocolo de recolección de células HFB-NK una vez que el cartucho alcanza la confluencia (máximo de 1 x 109 celdas). Esto sucede después de 5 a 7 días para cada lote o cuando se encuentra que el contenido de glucosa está por debajo del límite de detección del medidor de glucosa (por ejemplo, sin lectura o lecturas de ~ 0) durante 2 días consecutivos. Si esta es la recolección final de células, el medio puede ser sustituido por PBS para lavar el cartucho y recuperar las células.- Coseche CM rico en EV exactamente como se detalla anteriormente en el paso 1.3.
- Inyecte aproximadamente 50 ml del medio a través del puerto ECS izquierdo. Para garantizar una dispersión celular homogénea en todo el cartucho, empuje suavemente hacia adelante y hacia atrás la solución celular con las jeringas conectadas a los puertos ECS izquierdo y derecho al menos 10 veces para aflojar las células antes de empujarlas y recogerlas con una jeringa a través del puerto ECS derecho. Transfiera el CM rico en EV cosechado a un tubo de 50 mL. Dejar a 37 °C (baño de agua o incubadora) por ahora.
NOTA: La acción de retroceso ayuda a desalojar las células antes de que sean completamente expulsadas y recogidas por una jeringa a través del puerto ECS derecho. La solución debe tener la misma turbidez en ambas jeringas, con los puertos de los extremos izquierdo y derecho cerrados. Golpear el cartucho del biorreactor (perturbación física) puede ayudar a desalojar de forma preventiva el grupo de células en la parte inferior del cartucho. La mezcla agresiva de ida y vuelta de la suspensión celular puede afectar negativamente la viabilidad de las células recuperadas. Se debe aplicar cuidado y paciencia para maximizar la viabilidad. - Repita el último paso 2 veces. En total, se deben recuperar 150 mL de suspensión celular. Centrifugar a 300 x g durante 5 min. Deseche el sobrenadante.
- Vuelva a suspender ambos gránulos celulares en 20 ml de medio fresco cada uno y combínelos. Recoja dos alícuotas de 20,5 μL cada una de la suspensión celular para el recuento de células en un contador de células automatizado (consulte la tabla de materiales).
NOTA: Por lo general, se requieren numerosas diluciones celulares que utilizan PBS como diluyente para que caigan dentro del rango dinámico del contador de celdas. - A la alícuota de suspensión celular de 20,5 μL, agregue una cantidad igual de colorante AO/PI (consulte la Tabla de materiales) y mezcle hacia arriba y hacia abajo al menos 10 veces. Cargue 20 μL en cada cámara de recuento de la corredera de recuento y realice el recuento automatizado de células utilizando el programa adecuado.
- Promedie la concentración de células vivas de todos los recuentos corregidos por dilución, determine la cantidad total de células vivas y registre la viabilidad. Como se detalló anteriormente, para producir continuamente CM rico en EV utilizando el mismo cartucho de biorreactor, vuelva a sembrar 1 x 108 celdas NK producidas por HFB.
NOTA: Si se desea, las células NK producidas por HFB se pueden almacenar utilizando un medio de congelación por criopreservación y un contenedor de congelación para controlar la tasa de congelación (consulte la Tabla de materiales).

Figura 2: Componente y configuración del sistema de biorreactor de fibra hueca (HFB). La botella del depósito (1) contiene el medio completo que circula a través del cartucho del biorreactor (2) por la acción de una bomba peristáltica (no mostrada) que actúa sobre la tubería de la bomba (3). Las células se introducen en el espacio capilar extracelular (SEC) a través de los puertos laterales izquierdo (4) y derecho (5) del SEC. Una vez que se cierran las abrazaderas deslizantes ECS, los puertos laterales izquierdo (6) y derecho (7) se abren para permitir que el medio circule por todo el sistema. Observe la adición de una película de cera en la conexión Luer Lock cerca de la tapa del depósito de la botella mediana para evitar una posible contaminación. Haga clic aquí para ver una versión más grande de esta figura.
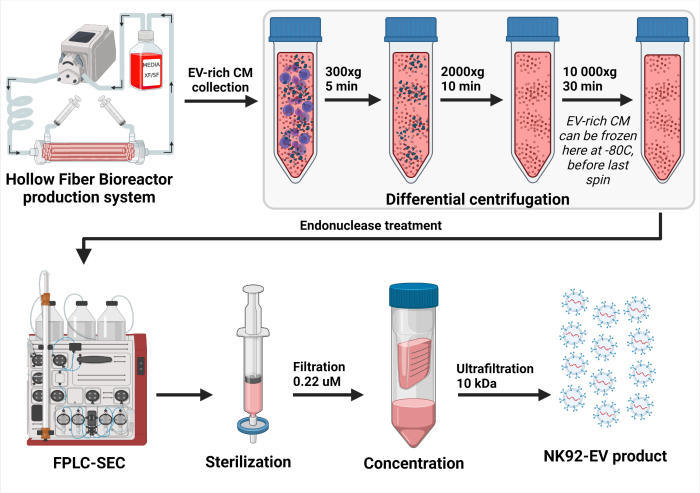
Figura 3: Representación esquemática del proceso de aislamiento de NK-EV. Después de la recolección diaria de medio acondicionado (CM) rico en EV, la solución se centrifuga diferencialmente para eliminar las células (primer centrifugado a 300 x g durante 5 min) y los restos celulares (segundo centrifugado a 2000 x g durante 10 min). El CM rico en EV aclarado se almacenó a -80 °C hasta su posterior procesamiento. Una vez listo para el aislamiento de NK-EV, el CM congelado rico en EV se descongela y se centrifuga una vez más para garantizar la eliminación de los residuos celulares (tercer centrifugado a 10.000 x g durante 30 min). A continuación, el CM rico en EV se trata durante 2 a 4 h a 37 °C con endonucleasa para digerir los ácidos nucleicos considerados contaminantes de la célula huésped. A continuación, el CM rico en EV se procesa mediante cromatografía de exclusión por tamaño basada en cromatografía líquida rápida de proteínas (FPLC-SEC) para la purificación de EV utilizando una resina bimodal. Las fracciones eluidas de aproximadamente 10 a 15 mL se combinan y filtran con filtros de 0,22 μM para garantizar la esterilidad del producto final NK-EV. La ultrafiltración permite concentrar el producto en un factor de aproximadamente 35 a 50 veces, lo que produce una concentración garantizada de más de 1 x 1012 EV / mL, con un total de 1,0 a 1,5 mL. Esta cifra ha sido modificada de7(creada con Biorender.com). Haga clic aquí para ver una versión más grande de esta figura.
2. Purificación de NK-EV por FPLC-SEC junto con UF y esterilización basada en filtros
- Prepare las siguientes soluciones y fíltrelas dos veces con un filtro de 0,1 μm (ver Tabla de Materiales): agua (conductividad de 0 mS/cm), PBS: 50 mL de 10x PBS + 450 mL de agua (conductividad alrededor de 14,7 mS/cm), 20% de etanol, solución de limpieza (0,5 M de NaOH y 30% de alcohol isopropílico en agua).
- Realice el inicio del sistema FPLC de acuerdo con las instrucciones del fabricante (consulte la Tabla de materiales). Realice los pasos de limpieza in situ (CIP) previos y posteriores a la ejecución de acuerdo con las instrucciones del fabricante. Lave todas las líneas y la resina de la columna y enjuague con agua de doble filtro (DF), solución de limpieza, agua DF y DF-PBS.
NOTA: Vale la pena señalar que el CIP se puede realizar otro día si es necesario. - Utilice una columna de cromatografía empaquetada con una resina bimodal (ver Tabla de Materiales) con una altura de lecho de 20 cm. Realice las conexiones utilizando el método de goteo a goteo para asegurarse de que no se introduzca aire dentro de la columna.
- Configure el colector de fracciones con los tubos de recolección apropiados y cambie la configuración de fraccionamiento al volumen de recolección deseado (por ejemplo, 15 mL). Coloque suficientes tubos y dos tubos adicionales para recoger todo el volumen de la muestra.
- Lleve a cabo la preparación de la muestra como se describe a continuación.
- Tome de 40 a 80 ml de CM rico en EV del congelador a -80 °C y descongele rápidamente a 37 °C. Cargue la muestra en la ultracentrífuga y centrifuga a 10.000 x g durante 30 minutos a 4 °C.
NOTA: Los tubos deben equilibrarse con precisión por peso, no por volumen. - Después de girar, recoja el sobrenadante y transfiéralo a un nuevo tubo. Para reducir los niveles de dsDNA, trate el CM rico en EV con 50 U/mL de endonucleasa y 1,5 mM de MgCl2 (ver Tabla de Materiales). Incubar durante 2 - 4 h en una incubadora (37 °C), permitiendo una mezcla moderada.
- Tome de 40 a 80 ml de CM rico en EV del congelador a -80 °C y descongele rápidamente a 37 °C. Cargue la muestra en la ultracentrífuga y centrifuga a 10.000 x g durante 30 minutos a 4 °C.
- Una vez que el sistema (líneas y columna) esté listo para el aislamiento de EV, cargue el CM rico en EV en una jeringa de 60 mL y conéctelo a la línea de muestreo. Inicie el sistema haciendo clic en Ejecución manual y establezca el caudal en 0. Siga las instrucciones del software para guardar la ejecución de forma preventiva y, a continuación, haga clic en Iniciar.
- Seleccione la línea B (DF-PBS) y funcione a una velocidad de flujo de 150 cm/h (caudal de 2,0 mL/min). Asegúrese de que la solución se ejecuta a través de la columna.
- Una vez que la conductividad se estabilice, presione Auto Zero UV. Cambie la ruta de flujo para dirigir la muestra a la botella de residuos antes de la columna. Asegúrese de que no se introduzcan burbujas en el sistema.
- Después de un máximo de 5 a 20 s, dirija la muestra a la columna. Haga clic en Fraccionamiento una vez que las lecturas UV alcancen aproximadamente 230 mAU.
- Una vez que la muestra se haya inyectado completamente a través del sistema, cambie el sistema tampón a DF-PBS (en la válvula de muestra) para continuar con la purificación. Vuelva a hacer clic en Fraccionamiento cuando el valor UV alcance aproximadamente 1600 mAU.
NOTA: Esto corresponde a la intersección entre las lecturas UV y las lecturas de conductividad. Un fraccionamiento más prolongado solo diluye el retenido sin aumentar el rendimiento del EV. - Combine todas las fracciones (NK-EV diluidas) y guárdelas a 4 °C hasta que estén listas para la esterilización basada en filtros y la ultrafiltración (UF).
- Continúe ejecutando DF-PBS hasta que el valor UV alcance aproximadamente 1000 mAU. Después de esto, deje de ejecutar y guarde el cromatograma como un documento PDF.
3. Esterilización y concentración basadas en filtros de productos NK-EV por UF
- Enfríe la centrífuga a 10 °C. Desinfecte todos los componentes del aparato de UF (consulte la Tabla de materiales) enjuagando con 20 a 30 mL de etanol al 90%. Girar a 4000 x g durante 5 - 10 min.
NOTA: El filtro está hecho de celulosa regenerada MWCO de 10 kDa. - Deseche el flujo y luego repita el enjuague con PBS estéril para equilibrar el dispositivo. Repita 2 veces en total.
- Para maximizar la esterilidad, filtre la solución diluida de NK-EV utilizando un filtro de jeringa de 0,22 μm prehumedecido con DF-PBS (consulte la tabla de materiales). Recoja el filtrado directamente en el aparato de concentración esterilizado.
- Centrifugar a 4000 x g durante 15 - 40 min (el tiempo de centrifugado depende de la muestra). Mezcle la solución dentro del compartimento del filtro superior con una pipeta serológica después de centrifugar. Girar a 4000 x g durante 10 minutos más.
NOTA: El paso de mezcla es opcional, ya que simplemente facilita el paso de concentración al evitar que la membrana se obstruya por los EV. - Deje a un lado temporalmente el flujo y recoja la muestra NK-EV invirtiendo el dispositivo de filtración y conectándolo al dispositivo de recolección.
- Girar a 2000 x g durante 2 min. Transfiera el producto NK-EV purificado a un tubo de 2 mL. Almacene el producto NK-EV purificado a 4 °C para uso a corto plazo (≤ 7 días) o congelado a -20 °C para uso a largo plazo.
4. Caracterización de NK-EV mediante análisis de seguimiento de nanopartículas (NTA)
- Preparar la solución y filtrarla dos veces a 0,1 μm (ver Tabla de Materiales): agua, PBS, solución de limpieza (lejía al 10% (PRECAUCIÓN) en agua).
- Inicie el sistema NTA de acuerdo con las instrucciones del fabricante. Del mismo modo, realice los pasos de limpieza in situ (CIP) previos y posteriores a la ejecución. Lave todas las líneas y enjuague con agua de doble filtro (DF), solución de limpieza y agua de DF. Equilibre las líneas usando DF-PBS.
- Verifique la celda de flujo y verifique si hay burbujas de aire. Retire las burbujas si las hay. Una vez limpio, vuelva a insertar con cuidado la celda de flujo en el instrumento NTA.
NOTA: Aunque no está recomendado por el fabricante, las burbujas de aire muy difíciles de eliminar se pueden eliminar fácilmente enjuagando con etanol al 20% y luego con agua DF. - Una vez que la celda de flujo esté en su lugar y la puerta esté cerrada, haga clic en Iniciar cámara. Con las líneas rellenas de DF-PBS, la pantalla debe mostrar un número mínimo absoluto de partículas.
- Cambie la configuración de captura a una ganancia de pantalla de 2 y un nivel de cámara de 14. Además, encienda el calentador para estabilizar la temperatura de la celda de flujo.
- Haga clic en Medición estándar para crear un script en la pestaña SOP para recopilar una captura durante 1 minuto con un caudal de 30 partículas/fotograma y 23 °C.
- Justo debajo, agregue la carpeta y el nombre del archivo al nombre de la ruta para guardar los datos.
- Prepare diluciones del producto NK-EV purificado usando DF-PBS con anticipación. Cuando se ejecuta NTA, la cuantificación precisa requiere de 30 a 80 partículas/fotograma.
- Agite la muestra antes de cargarla en la jeringa (consulte la tabla de materiales).
- Conecte con cuidado la jeringa de adquisición de 1 mL a la línea de carga del instrumento. No debe haber aire, ya que afectará negativamente a la adquisición y al análisis. Empuje lentamente la mitad de la muestra, dejando alrededor de 0,5 ml en la jeringa.
- Una vez que las partículas sean visibles en la pantalla, enfoca la cámara para tener un máximo de un halo alrededor de cada partícula. Haga clic en Infundir en la pestaña Hardware a una velocidad de 1000 durante 5 s. Luego, bájalo a una tasa de 30.
- Presione Ejecutar script y siga las indicaciones. El software se asegurará de que la temperatura esté configurada y preguntará si los ajustes son correctos. Haga clic en Sí y siga las instrucciones del software.
- Después de completar la captura, haga clic en Cancelar cuando el software le pida procesar o exportar archivos. Haga clic en Infundir en la pestaña Hardware a una velocidad de 1000 durante 10 a 15 s. Mientras tanto, vuelva a encender el calentador y la cámara. Luego, baje la velocidad a 30 hasta que las partículas se muevan.
- Reúna cuatro capturas más repitiendo los pasos anteriores. Una vez que se haya registrado un total de cinco capturas por dilución, realice el análisis después de importar las cinco capturas.
- Seleccione los archivos que se van a procesar resaltándolos. Haga clic en Procesar archivos seleccionados. En la pestaña Proceso, ajuste la configuración del análisis a una ganancia de pantalla de 2 y un umbral de detección de 15.
La configuración depende de la muestra; Asegúrese de que se vean de 30 a 80 partículas por fotograma. - Marque y haga clic en Aceptar para el análisis.
- Una vez procesados los archivos, el software te pedirá que los exportes. Haga clic en Sí sin hacer clic en casillas adicionales o haga clic en Exportar.
- Repita el procedimiento para todas las diluciones o muestras de EV. Apague el instrumento NTA después de que se hayan completado todas las muestras y se haya realizado la CIP.
5. Pruebas de aseguramiento de la calidad
- Realice pruebas microbianas utilizando dos pruebas: 1) una pequeña alícuota de NK-EV purificados se introduce en un medio de caldo LB esterilizado en autoclave, y 2) una pequeña alícuota de NK-EV purificados se utiliza para la detección de PCR de micoplasma (consulte la Tabla de materiales).
- Prueba 1: medio de cultivo LB a 37 °C durante un máximo de 5 días con controles positivos y negativos incluidos. Registre el OD600, si es necesario.
- Prueba 2: realizar la detección de micoplasma por PCR según el protocolo del fabricante.
- Cuantifique proteínas y dsDNA en diluciones purificadas de NK-EV utilizando ensayos basados en fluorímetros según las instrucciones del fabricante (consulte la tabla de materiales).
6. Evaluación de la potencia de las células cancerosas tratadas con NK-EV mediante un ensayo de viabilidad celular validado y altamente sensible basado en resazurina 20
- Cultivo de células leucémicas humanas K562 utilizando RPMI-1640 con FBS inactivado por calor al 10% durante unos días antes de realizar el ensayo de potencia (ver Tabla de Materiales). Mantenga la densidad entre 2 - 8 x 105 células/mL y reemplace el medio cada 2 - 3 días.
- Adquiera una placa de fondo plano de 96 pocillos (consulte la Tabla de materiales) y agregue de manera preventiva el volumen de medio de ensayo (complementado con un 5% de FBS agotado en EV) requerido para fines de normalización (consulte la Tabla de materiales). El volumen final es de 150 μL/pocillo.
NOTA: Utilice una pipeta repetidora para reducir la variación de pocillo a pocillo. - Adquiera el cultivo celular y transfiera las células a un tubo. Girar a 300 x g durante 5 min. Vuelva a suspender el gránulo de celda en una solución de una sola celda utilizando 2 a 5 ml de medio de ensayo.
- Recoja una alícuota de 20,5 μL de la suspensión celular para el recuento de células en un contador de células automatizado (consulte la tabla de materiales).
- A la alícuota de suspensión celular de 20,5 μL, agregue una cantidad igual de colorante AO/PI (consulte la Tabla de materiales) y mezcle hacia arriba y hacia abajo al menos 10 veces.
NOTA: Recomendamos AO/PI para un recuento preciso de células. Alternativamente, use un hemocitómetro para el conteo manual. - Cargue 20 μL en cada cámara de recuento de la corredera de recuento y realice el recuento automatizado de células utilizando el programa adecuado. Promedie la concentración de células vivas y registre la viabilidad.
- Transfiera aproximadamente 1 x 106 células a un tubo secundario. Diluya las células hasta obtener una precisión de 7 ml de medio de ensayo y repita el recuento de células. La concentración debe ser de aproximadamente 1,2 - 1,5 x 105células vivas/mL.
- Como se detalló anteriormente, ajuste la concentración de suspensión de una sola célula a 1 x 105 células vivas/ml y repita el recuento de células si es necesario.
NOTA: El coeficiente de variación entre los recuentos técnicos de duplicados debe ser inferior al 25%; por lo general, es menos del 5% con el recuento de AO/PI. - Una vez que se alcanza la concentración deseada, transfiera 50 μL (± 1 μL) de esta solución a cada pocillo para acercarse lo más posible a 5000 células/pocillo (4900 - 5100 células/pocillo). Prepare triplicados técnicos para cada condición de ensayo y utilice una pipeta repetidora para reducir la variación de pocillo a pocillo.
- Transfiera la placa a un agitador orbital (350 - 500 RPM) durante 2 min. Transfiera las células de vuelta a la incubadora hasta que estén listas para continuar con el tratamiento con NK-EV.
- Prepare las diluciones de NK-EV requeridas (1:5, 1:10 y 1:100) utilizando un medio de ensayo.
- A partir de estas diluciones, pruebe las siguientes concentraciones de EV: 1 x 108, 5 x 108, 1 x 109, 5 x 109, 1 x 1010, 5 x 1010 y 1 x 1011 partículas/mL. El volumen de dosificación está limitado al 20% del volumen total del ensayo.
- Una vez listo, transfiera el volumen requerido de una dilución dada a los pozos que requieren una concentración de EV deseada para el tratamiento. Agregue 15 μL de Triton-X 10x al pocillo de control positivo (consulte la tabla de materiales). El volumen final del pocillo debe normalizarse a 150 μL.
- Agregue la placa a un agitador orbital (350 - 500 RPM) durante 2 min. Incubar las células a 37 °C en la incubadora de CO2 al 5% durante 3 h.
- Precaliente el lector de placas (consulte la tabla de materiales) a 37 °C y cargue el siguiente script: 37 °C (reduce la variación relacionada con la temperatura), 450 RPM de mezcla durante 1 minuto (garantiza la homogeneidad de la muestra) y lea.
- Añada 15 μL del reactivo a base de resazurina a cada pocillo (ver Tabla de Materiales). Proteja el reactivo de la luz y utilice una pipeta repetidora para reducir la variación de un pocillo a otro.
- Agregue la placa a un agitador orbital (350 - 500 RPM) durante 2 min. Transfiera la placa a la incubadora e incube durante 60 min. Elimine las burbujas de aire con una punta de pipeta sumergida en etanol. Placa de lectura con una excitación de 560 nm y una emisión de 590 nm.
- Análisis de datos: Se promediaron las réplicas técnicas promedio y se corrigieron los antecedentes antes de realizar un análisis de dosis-respuesta utilizando una regresión no lineal para el efecto de inhibición que mostró la pendiente de la variable de respuesta logarítmica (inhibidora) frente a la normalizada sin restricción. Registre los valores de Hillslope y EC50 .
Resultados
Los NK-EV poseen funciones citotóxicas inherentes y han demostrado una alta eficacia contra varios modelos de cáncer. Sin embargo, es necesario que haya una mayor estandarización entre los estudios actuales con respecto a un flujo de trabajo de biofabricación adecuado para la producción a gran escala de NK-EV 6,21. Nuestro estudio previo describió la factibilidad de un sistema de biorreactor de fibra hueca (HFB) de circuito cerrado para producir grandes cantidades de productos NK-EV de alta pureza7. Como seguimiento, este estudio basado en protocolos detalla el flujo de trabajo de biofabricación y demuestra su reproducibilidad mediante la producción y el aislamiento del producto NK-EV (Figura 1). Además, se requiere una caracterización y validación esenciales del producto antes de que se realice el lanzamiento del producto, por lo que en este estudio se presentan datos nuevos y originales.
El sistema HFB fue seleccionado para la producción de NK-EV debido a su facilidad de uso, confiabilidad, escalabilidad y cumplimiento de GMP7. En referencia a la configuración del sistema HFB, las células NK se inyectan a través del puerto ECS izquierdo y se siembran en el cartucho del biorreactor (Figura 2). Al mismo tiempo, la botella de medios se conecta al HFB a través de los puertos laterales y se permite que los medios fluyan por todo el sistema. Las células NK se cultivan en un medio sin suero, sin xeno, sin alimentadores y sin antibióticos, donde el medio se reemplaza cuando el contenido de glucosa cae por debajo del 50% para mantener y maximizar la salud celular a lo largo del tiempo. El CM se recolecta diariamente, se procesa a través de centrifugaciones diferenciales y se mantiene congelado (-80 °C) hasta que está listo para su posterior procesamiento. Posteriormente, el aislamiento de EV se lleva a cabo a través de una combinación de centrifugaciones diferenciales y FPLC-SEC junto con UF y filtración (Figura 3). Esto da como resultado un producto NK-EV concentrado y estéril con un volumen final de aproximadamente 1,0 - 1,5 mL. Se proporciona un cromatograma representativo del aislamiento FPLC-SEC de NK-EV (Figura 4). Antes del procesamiento de FPLC-SEC, el CM rico en NK-EV se trata con endonucleasa, lo que reduce significativamente los niveles de dsDNA, un contaminante potencial de la célula huésped (NK)7. Por lo tanto, el flujo de trabajo de aislamiento de EV descrito elimina los desechos celulares y los contaminantes de ARN/ADN del producto NK-EV, lo cual es esencial para garantizar un potencial inmunogénico bajo y no deseado y que el producto final sea adecuado para estudios posteriores.
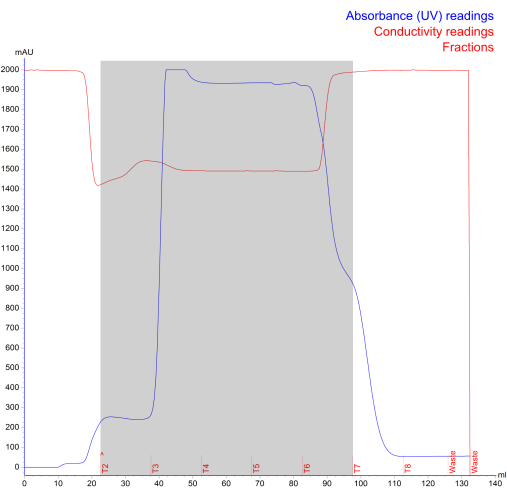
Figura 4: Cromatograma de aislamiento NK-EV generado durante la exclusión de tamaño de la cromatografía líquida rápida de proteínas. La línea azul representa la absorbancia (mAU; lectura máxima de 2000 mAU), la línea roja representa la conductividad, el texto rojo representa el registro de ejecución y el área sombreada en gris representa los NK-EV fraccionados (denotados por las fracciones T2 - T7). Haga clic aquí para ver una versión más grande de esta figura.
Después del aislamiento, la caracterización básica de NK-EV y las pruebas de aseguramiento de la calidad se utilizan para evaluar si el producto NK-EV puede liberarse para una experimentación posterior. El rango de tamaño de partícula y la concentración del producto NK-EV se miden mediante análisis de seguimiento de nanopartículas (NTA), con tamaños que oscilan entre 76,30 y 174,30 nm de diámetro (D10 de 78,38 ± 2,07 nm, D50 de 106,72 ± 2,43 nm y D90 de 169,80 ± 4,17 nm) y una concentración media de 1,39 x10 12 EV/mL (Figura 5A-B). Además, la cuantificación con fluorímetro mostró una concentración de proteína y dsDNA de 298,90 ± 66,62 mg/mL y de 225,60 ± 37,7 ng/mL para el producto final, respectivamente (Figura 5C-D). Esto corresponde a una proporción media de 5,06 x 106 EV/μg de proteína y 6,16 x10 12 EV/μg de ADN. Las pruebas microbianas y de micoplasma arrojaron resultados negativos (datos no mostrados). Estos resultados son consistentes con la caracterización de los NK-EVs de trabajos previos7. La publicación anterior7 también proporciona una caracterización más profunda de los productos NK-EV siguiendo las pautas de MISEV (es decir, TEM, Western blot, nivel de endotoxinas, entidades virales y citometría de flujo para antígenos de superficie y citocinas).
Por último, se evaluó la funcionalidad del producto NK-EV (es decir, la citotoxicidad frente a las células cancerosas) mediante un ensayo de viabilidad celular validado y altamente sensible basado en resazurina tras el tratamiento con NK-EV frente a la línea celular leucémica K562 7,20. El tratamiento celular con NK-EVs durante 3 h produjo un efecto dosis-dependiente sobre la viabilidad celular, correspondiente a una EC50 de 9,33 x 109 EVs/mL (es decir, la dosis que corresponde a la muerte del 50% de la población celular; Figura 6A-B). Por lo tanto, siguiendo los criterios de lanzamiento del producto descritos, el producto NK-EV se considera adecuado para una mayor experimentación.
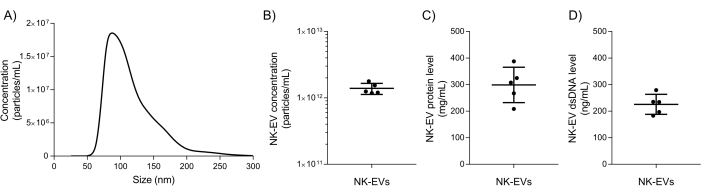
Figura 5: Caracterización del producto NK-EV purificado. (A) Distribución del tamaño del producto NK-EV medida por NTA, mostrada como media de 5 experimentos independientes, cada uno con 10 réplicas técnicas (5 capturas de video x 2 diluciones). (B) Concentración de producto de partículas NK-EV (partículas/mL) medida por NTA, presentada como media ± SD de 5 experimentos independientes, cada uno con duplicados técnicos. (C) La concentración de proteínas del producto NK-EV (mg/mL) se midió mediante el uso de un fluorómetro, presentado como media ± SD de 5 experimentos independientes, cada uno con triplicados técnicos. (D) Concentración de dsDNA del producto NK-EV (ng/mL) medida mediante el uso de un fluorómetro, presentada como media ± SD de 5 experimentos independientes, cada uno con triplicados técnicos. Haga clic aquí para ver una versión más grande de esta figura.
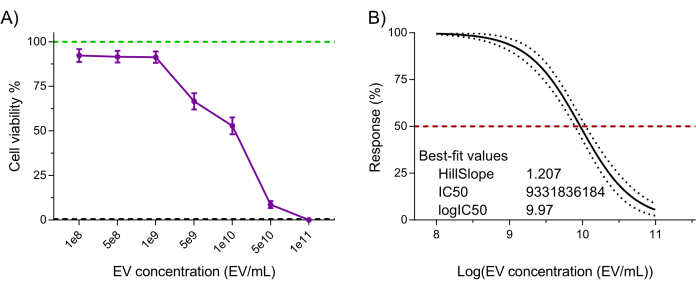
Figura 6: Validación funcional del producto NK-EV purificado. Los NK-EV demuestran una citotoxicidad dependiente de la dosis contra las células de leucemia K562 humanas tratadas a varias concentraciones de NK-EV durante 3 horas utilizando un ensayo de viabilidad celular basado en resazurina de alta sensibilidad. (A) Lecturas de ensayos normalizadas (la línea verde representa el control de células leucémicas K562 no tratadas, y la línea discontinua negra representa el control de células muertas de leucemia K562 lisadas; tratado con detergente). Los datos se muestran como media ± SEM de 11 experimentos independientes con triplicados técnicos. (B) Análisis de la curva EC50 con una pendiente variable para el tratamiento de NK-EV con intervalo de confianza/bandas de predicción del 95% (la línea discontinua roja representa el 50% de la respuesta). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Varios estudios sugieren que los NK-EV poseen un gran potencial como terapéutico anticancerígeno 4,5,7,9,16,22,23,24,25,26,27,28,29,30 . Sin embargo, se requiere un sistema de biofabricación escalable que cumpla con las GMP y sea capaz de producir grandes cantidades de NK-EV de alta pureza para realizar más pruebas preclínicas y futuras aplicaciones clínicas. Para abordar este problema, un estudio anterior utilizó un sistema HFB de circuito cerrado para producir continuamente células NK y CM ricas en NK-EV adecuadas para la experimentación posterior. Debido a su diseño 3D, los sistemas HFB reflejan fielmente las condiciones del sistema vascular y poseen una relación superficie-volumen increíblemente alta, lo que permite que más de mil millones de células permanezcan en cultivo, lo que en última instancia conduce a una mejor producción de EV 7,31,32. Es importante destacar que este trabajo fue el primero en informar sobre el uso de un sistema HFB para el cultivo de células NK, probablemente debido a la autosuficiencia de la línea celular IL-27.
Se deben tomar medidas adicionales para garantizar la esterilidad del sistema HFB y la producción de NK-EV de alta pureza. Estas precauciones son especialmente cruciales en ausencia de una sala estéril y limpia, que puede ser el caso de varios centros de investigación. Antes de entrar en la cabina de bioseguridad, el sistema HFB se rocía meticulosamente con etanol al 70% para desinfectar todas las superficies externas. Además, la película de cera se envuelve alrededor de todas las conexiones Luer Lock para minimizar el riesgo de contaminación. Esto es particularmente importante ya que este flujo de trabajo de biofabricación no utiliza antibióticos, que se sabe que afectan el perfil bioquímico de las células y los productos derivados de células33. Se utilizaron varias métricas para evaluar la salud celular durante la biofabricación de productos celulares. Por ejemplo, se llevaron a cabo evaluaciones diarias de los niveles de pH, glucosa y lactato del medio reservorio, ya que estos son sustitutos vitales de la salud celular para el monitoreo. Además de las evaluaciones cuantitativas, las observaciones cualitativas del sistema HFB (por ejemplo, el color del medio y los signos visuales de contaminación, como la turbidez) también son útiles para monitorear la salud celular. No se ha encontrado que los recuentos de células en la MC recuperada diariamente sean una métrica representativa de la viabilidad para la salud del cultivo (datos no mostrados). Es probable que esto se deba a las células muertas recuperadas durante el muestreo de MC que se encontraron dentro del tubo donde no se permitió que circularan los medios (la pequeña sección entre el ECS y el puerto de la jeringa ECS), lo que subestima la viabilidad del cultivo celular en general. Solo las células NK cosechadas y producidas por el HFB al final de un lote de producción pueden proporcionar una métrica fiable de la salud del cultivo. Estas celdas mostraron consistentemente valores de viabilidad superiores al 70% en todos los lotes de producción7. Juntos, estos métodos de evaluación de la calidad garantizan la producción continua de NK-EV de alta pureza.
Se han desarrollado varias técnicas de aislamiento para purificar y aislar los EV34. Un método, SEC, utiliza una columna empaquetada con un material poroso, resina, que permite la separación de moléculas basada en la discriminación de tamaño. Aquí, los vehículos eléctricos más grandes se eluyen a través de la columna más rápido; Este método se conoce como purificación de flujo continuo basada en la exclusión de tamaño. Al mismo tiempo, los contaminantes más pequeños (dsDNA, proteínas que flotan libremente como la endonucleasa, las sales, el rojo de fenol, etc.) se dejan atrás y se retienen aún más dentro de la resina por fuerzas electrostáticas (es decir, se utilizó una resina bimodal). El procesamiento basado en SEC elimina las proteínas no unidas a EV mientras mantiene la estructura y funcionalidad originales de EV35,36. Además, la purificación basada en SEC es fácilmente escalable sin comprometer el alto rendimiento y la pureza, lo que la convierte en una opción adecuada para aislar NK-EV para usos bioterapéuticos. A pesar de estas ventajas, la SEC tiene algunos inconvenientes, como el flujo relativamente diluido (eluyente); por lo tanto, UF es necesario para la concentración del producto, pero también permite el intercambio de tampones. El aparato de UF no estéril se enjuaga con etanol al 70% y PBS y se mantiene en el gabinete de bioseguridad antes de su uso para garantizar la esterilidad. Por lo general, el flujo a través se puede concentrar a 35x-50x del volumen inicial mientras se eliminan las moléculas pequeñas que podrían haber llegado al eluyente. La centrifugación diferencial y el tratamiento con endonucleasas se realizan antes de FPLC-SEC junto con UF para eliminar las células residuales, los desechos celulares y las hebras largas de dsDNAantigénico 7.
Después del aislamiento, la caracterización y la validación funcional del producto NK-EV se realizan según las pautas de MISEV2018 y MISEV2023 para determinar la idoneidad del producto para su uso posterior 6,18. Cada aislamiento produce de 1,0 a 1,5 mL de producto NK-EV de alta pureza a una concentración mínima de 1 x 1012 EVs/mL, con una concentración media de 1,39 x10 12 partículas/mL. Anteriormente, Gupta et al. determinaron que la dosis media de EV in vivo es de 3,37 x 108 EVs/kg de peso corporal de ratones37. El tratamiento con la dosis mediana requeriría 8,43 x 106 EVs/ratón con un peso corporal de 25 g, un valor muy por debajo del mínimo garantizado (1 x 1012 partículas/mL) obtenido a través de este flujo de trabajo. Por lo tanto, el flujo de trabajo de biofabricación descrito puede producir NK-EV más que suficientes para la experimentación preclínica o para cumplir con los objetivos de dosificación. Cada aislamiento se somete a pruebas para determinar la presencia de micoplasma y microbios como parte de la evaluación de control de calidad del producto. Además, un estudio previo demostró la ausencia de entidades virales comunes y endotoxinas en el producto final y la ausencia de componentes celulares considerados contaminantes de la célula huésped (por análisis de western blot)7,34. Por último, la evaluación funcional se realizó utilizando un ensayo de viabilidad celular validado y altamente sensible basado en resazurina para evaluar la funcionalidad de los NK-EV20. El ensayo de viabilidad descrito funciona reduciendo la resazurina (débilmente fluorescente) a resorufina (altamente fluorescente) por células metabólicamente activas, lo que permite evaluar la viabilidad celular después del tratamiento con NK-EV. En comparación con otros ensayos alternativos de viabilidad celular, el ensayo basado en resazurina utilizado en el estudio es altamente sensible a los cambios en la viabilidad celular (ruido de fondo muy bajo) y permite acortar el tiempo de incubación para observar los resultados (menos de 30 min para obtener resultados estadísticamente significativos)20. Generalmente, los NK-EV exhiben un efecto dependiente de la dosis sobre la viabilidad de K562. En conjunto, los resultados presentados representan un producto NK-EV que ha cumplido con los criterios de liberación del producto para la evaluación preclínica y es adecuado para aplicaciones posteriores.
En conclusión, este estudio basado en protocolos describe la biofabricación de NK-EVs con potencial de grado clínico. Como se ha comentado, los NK-EV se producen utilizando un sistema HFB de circuito cerrado en condiciones sin suero, sin xeno, sin alimentadores y sin antibióticos7. Una combinación de FPLC-SEC/UF aísla y purifica el producto NK-EV. Antes de lanzar los productos para su aplicación posterior, los NK-EV deben caracterizarse y validarse funcionalmente para garantizar que son adecuados para su uso. Como se ha demostrado, el seguimiento de este protocolo de biofabricación puede generar con éxito una gran cantidad de NK-EV de alta pureza que exhiben citotoxicidad en el objetivo contra las células cancerosas. Por lo tanto, el protocolo de biofabricación descrito puede ser un activo para futuros estudios que requieran la producción de NK-EV de grado clínico.
Divulgaciones
Todos los autores declaran no tener ningún conflicto de intereses o divulgación.
Agradecimientos
Los autores desean agradecer a los Dres. Simon Sauvé, Roger Tam y Xu Zhang por su revisión crítica de manuscritos. Este trabajo fue respaldado por subvenciones operativas de la Iniciativa de Investigación y Desarrollo Genómico (GRDI) Fase VII (2019-2025) del Gobierno de Canadá obtenidas por JRL, LW, así como subvenciones operativas del Consejo de Investigación de Ciencias Naturales e Ingeniería RGPIN-2019-05220, Sociedad de Investigación del Cáncer / Universidad de Ottawa 24064, la Subvención Operativa de Investigación de los Institutos Canadienses de Salud (CIHR) 175177 obtenida por LW, la Beca de Maestría CIHR obtenida por MK, y las Becas Reina Isabel II en Ciencia y Tecnología (QEII-GSST) obtenidas por FSDB.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.1 µm vacuum filtration unit Filtropur V50 | Sarstedt | 83,3941,002 | |
| 0.22 µm Acrodisc Syringe Filter | Pall Corporation | PN4612 | |
| 1 mL syringe | Thermo Fisher Scientific | MB9204560TF-LAB | |
| 10 kDa Centricon Plus-70 Centrifugal Filter | Sigma | UFC701008 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| 96-well Flat Clear Bottom Black Polystyrene TC-treated Microplates | Costar | 3603 | |
| Agarose | Thermo Fisher Scientific | R0491 | |
| AKTA Fast Protein Liquid Chromatograph | GE Lifesciences | 29022094 | |
| BD PrecisionGlide Needle - 18G | BD Biosciences | 305196 | |
| Benzonase Nuclease | Sigma | E1014-25KU | |
| BioTek Synergy H1 Multimode Reader | BioTek | SH1M2G-SN | |
| Blue Juice Gel Loading Buffer | Invitrogen | 10816015 | |
| CaptoCore 700 resin | Cytiva | 17548102 | |
| Cellometer Auto 2000 Viability Counter | Nexcelom BioScience LLC | ||
| CryoStor CS10 freezing medium | Sigma | C2874 | |
| DPBS−/− | Fisher | BP399-1 | |
| Dual LED Blue/White Light Transilluminator | Invitrogen | LB0100 | |
| Duet P3202 Flow Control Pump | FiberCell Systems | ||
| Dulbecco's phosphate-buffered saline | Gibco | 14190250 | |
| Ethanol | Commercial Alcohols | P006EAAN | |
| Exosome-Depleted FBS | Gibco | A2720803 | |
| Fluorobrite DMEM | Gibco | A18967-01 | |
| Glucose meter | AccuCheck | Model 930 | |
| HiScale chromatography column 10/40 | Cytiva | 29360550 | |
| ImmunoCult-XF (GMP medium alternative) | StemCell Technologies | 100-0956 | |
| ImmunoCult-XF T Cell Expansion Medium | StemCell Technologies | 10981 | |
| Isopropyl Alcohol | EMD | PX1834-1 | |
| K562 cells | ATCC | CCL-243 | |
| LB media | BioBasic | SD7002 | |
| L-Lactate Assay Kit | Abcam | ab65331 | |
| Medium hollow-fibre cartridge | FiberCell Systems | C2011 | |
| MgCl2 | Sigma | M1028 | |
| Mycoplasma PCR detection kit | Abcam | ab289834 | |
| NanoSight NS300 | Malvern | ||
| NaOH | Supelco | SX0607N-6 | |
| NK92-MI cells | ATCC | CRL-2408 | |
| pH Strips-Mquant | Sigma | 1,09533 | |
| PrestoBlue HS Cell Viability Reagent Assay | Invitrogen | P50200 | |
| Qubit 4 Fluorometer | Invitrogen | ||
| Qubit dsDNA BR Assay Kit | Invitrogen | Q33262 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q33231 | |
| Qubit Flex Assay Tube Strips | Invitrogen | Q33252 | |
| Qubit Flex Fluorometer | Invitrogen | Q33327 | |
| Qubit Protein BR Assay Kit | Invitrogen | A50669 | |
| Quick Load 1Kb Plus DNA ladder | NEB | N0469S | |
| SYBRSafe DNA Gel Stain Invitrogen | Invitrogen | S33102 | |
| Syringe pump | Harvard Apparatus | 984730 | |
| Triton-X 100 | Sigma | T-9284 | |
| UltraPure TAE Buffer | Invitrogen | 15558042 | |
| ViaStain Acridine Orange and Propidium Iodide (AO/PI) Staining Solution | ESBE Scientific | CS2-0106 |
Referencias
- Cheng, M., Chen, Y., Xiao, W., Sun, R., Tian, Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 10 (3), 230-252 (2013).
- Sheridan, C. Industry appetite for natural killer cells intensifies. Nat Biotechnol. 41 (2), 159-161 (2023).
- Shimasaki, N., Coustan-Smith, E., Kamiya, T., Campana, D. Expanded and armed natural killer cells for cancer treatment. Cytotherapy. 18 (11), 1422-1434 (2016).
- Elsharkasy, O. M., et al. Extracellular vesicles as drug delivery systems: Why and how. Adv Drug Deliv Rev. 159, 332-343 (2020).
- St-Denis-Bissonnette, F., et al. Applications of extracellular vesicles in triple-negative breast cancer. Cancers. 14 (2), 451 (2022).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- St-Denis-Bissonnette, F., et al. A clinically relevant large-scale biomanufacturing workflow to produce natural killer cells and natural killer cell-derived extracellular vesicles for cancer immunotherapy. J Extracell Vesicles. 12 (12), e12387 (2023).
- Federici, C., et al. Natural-killer-derived extracellular vesicles: Immune sensors and interactors. Front Immunol. 11, 262 (2020).
- Lugini, L., et al. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 189 (6), 2833-2842 (2012).
- Zhu, L., et al. Novel alternatives to extracellular vesicle-based immunotherapy - exosome mimetics derived from natural killer cells. Artif Cells Nanomed Biotechnol. 46 (sup3), S166-S179 (2018).
- Cochran, A. M., Kornbluth, J. Extracellular vesicles from the human natural killer cell line NK3.3 have broad and potent anti-tumor activity. Front Cell Dev Biol. 9, 698639 (2021).
- Kim, H. Y., et al. Delivery of human natural killer cell-derived exosomes for liver cancer therapy: an in vivo study in subcutaneous and orthotopic animal models. Drug Deliv. 29 (1), 2897-2911 (2022).
- Alvarez-Erviti, L., et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 29 (4), 341-345 (2011).
- El-Sahli, S., et al. A triple-drug nanotherapy to target breast cancer cells, cancer stem cells, and tumor vasculature. Cell Death Dis. 12 (1), 8 (2021).
- Sulaiman, A., et al. Co-targeting bulk tumor and CSCs in clinically translatable TNBC patient-derived xenografts via combination nanotherapy. Mol Cancer Ther. 18 (10), 1755-1764 (2019).
- Farcas, M., Inngjerdingen, M. Natural killer cell-derived extracellular vesicles in cancer therapy. Scand J Immunol. 92 (4), e12938 (2020).
- Murphy, D. E., et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking. Exp Mol Med. 51, 1-12 (2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- FiberCell-Systems. . FiberCell systems user manual & quick start guide. , (2024).
- St-Denis-Bissonnette, F., et al. Evaluation of resazurin phenoxazine dye as a highly sensitive cell viability potency assay for natural killer cell-derived extracellular vesicle-based cancer biotherapeutics. J Extracell Biology. 3 (7), e166 (2024).
- Herrmann, I. K., Wood, M. J. A., Fuhrmann, G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol. 16 (7), 748-759 (2021).
- Andaloussi, E. L. A., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Federici, C., et al. Exosome release and low pH belong to a framework of resistance of human melanoma cells to cisplatin. PLoS One. 9 (2), e88193 (2014).
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4, 27066 (2015).
- Neviani, P., et al. Natural killer-derived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 79 (6), 1151-1164 (2019).
- Sun, H., et al. Natural killer cell-derived exosomal miR-3607-3p inhibits pancreatic cancer progression by targeting IL-26. Front Immunol. 10, 2819 (2019).
- Jiang, Y., et al. Engineered exosomes: a promising drug delivery strategy for brain disease. Curr Med Chem. 29 (17), 3111-3124 (2022).
- Dosil, S. G., et al. Natural killer (NK) cell-derived extracellular-vesicle shuttled microRNAs control T cell responses. Elife. 11, e76319 (2022).
- Geeurickx, E., et al. The generation and use of recombinant extracellular vesicles as biological reference material. Nat Commun. 10 (1), 3288 (2019).
- Nathani, A., et al. Combined role of interleukin-15 stimulated natural killer cell-derived extracellular vesicles and carboplatin in osimertinib-resistant H1975 lung cancer cells with EGFR mutations. Pharmaceutics. 16 (1), 83 (2024).
- Gobin, J., et al. Hollow-fiber bioreactor production of extracellular vesicles from human bone marrow mesenchymal stromal cells yields nanovesicles that mirrors the immuno-modulatory antigenic signature of the producer cell. Stem Cell Res Ther. 12 (1), 127 (2021).
- Sun, L., et al. A 3D culture system improves the yield of MSCs-derived extracellular vesicles and enhances their therapeutic efficacy for heart repair. Biomed Pharmacother. 161, 114557 (2023).
- Ryu, A. H., Eckalbar, W. L., Kreimer, A., Yosef, N., Ahituv, N. Use antibiotics in cell culture with caution: genome-wide identification of antibiotic-induced changes in gene expression and regulation. Sci Rep. 7 (1), 7533 (2017).
- Meng, W., et al. Prospects and challenges of extracellular vesicle-based drug delivery system: considering cell source. Drug Deliv. 27 (1), 585-598 (2020).
- Yang, Y., et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. J Transl Med. 19 (1), 104 (2021).
- Gamez-Valero, A., et al. Size-exclusion chromatography-based isolation minimally alters extracellular vesicles' characteristics compared to precipitating agents. Sci Rep. 6, 33641 (2016).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 178 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados