Method Article
Flux de travail de biofabrication évolutif pour produire et isoler des produits biothérapeutiques anticancéreux extracellulaires dérivés de cellules tueuses naturelles
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les vésicules extracellulaires dérivées de cellules tueuses naturelles (NK-EV) ont un potentiel prometteur en tant que biothérapies anticancéreuses. Cette étude méthodologique présente un flux de travail de biofabrication en boucle fermée évolutif conçu pour produire et isoler en continu de grandes quantités de NK-EV de haute pureté. Des tests de contrôle en cours de fabrication sont effectués tout au long du flux de travail de biofabrication, ce qui permet de s’assurer que les VE répondent aux normes de qualité pour la libération du produit.
Résumé
Les vésicules extracellulaires dérivées de cellules tueuses naturelles (NK-EV) sont étudiées comme biothérapies anticancéreuses. Ils possèdent des propriétés uniques en tant que nanovésicules cytotoxiques ciblant les cellules cancéreuses et en tant que communicateurs immunomodulateurs. Un flux de travail de biofabrication évolutif permet de produire de grandes quantités de NK-EV de haute pureté pour répondre aux exigences précliniques et cliniques. Le flux de travail utilise un bioréacteur à fibres creuses en boucle fermée, permettant une production continue de NK-EV à partir de la lignée cellulaire NK92-MI dans des conditions sans sérum, sans xéno, sans mangeur et sans antibiotiques, conformément aux normes des bonnes pratiques de fabrication. Cette étude basée sur un protocole décrit le flux de travail de biofabrication pour isoler les NK-EV à l’aide de la chromatographie d’exclusion stérique, de l’ultrafiltration et de la stérilisation par filtre. La caractérisation essentielle des produits NK-EV est effectuée par le biais d’une analyse de suivi des nanoparticules, et leur fonctionnalité est évaluée par un test d’activité validé basé sur la viabilité cellulaire contre les cellules cancéreuses. Ce processus de biofabrication évolutif présente un potentiel important pour faire progresser l’application clinique des produits biothérapeutiques anticancéreux à base de NK-EV en adhérant aux meilleures pratiques et en assurant la reproductibilité.
Introduction
Au 21esiècle, des progrès remarquables ont été réalisés dans la lutte contre le cancer. Cela est principalement dû à l’essor des immunothérapies anticancéreuses, une classe de médicaments qui exploitent le système immunitaire pour lutter contre le cancer. Les vésicules extracellulaires dérivées de cellules tueuses naturelles (NK-EV) représentent des candidats prometteurs dans le domaine en expansion de l’immunothérapie. Intégratives à l’immunité innée et adaptative, les cellules NK jouent un rôle crucial dans la défense de l’organisme contre les cellules infectées par le virus, stressées et malignes. Ils utilisent un arsenal complet de machines anticancéreuses pour éliminer les cellules anormales par des moyens cytotoxiques 1,2,3. Parmi ces mécanismes figure la production et la sécrétion de VE, des structures bicouches à l’échelle nanométrique contenant diverses biomolécules, telles que des protéines, des ARN et des ADN, cruciales pour faciliter la communication intercellulaire 4,5,6. Les NK-EV apparaissent comme des thérapies acellulaires prometteuses en raison de leurs propriétés de support uniques. Il s’agit notamment de leur petite taille, permettant une stérilisation par filtre, d’une biocompatibilité élevée, d’une accumulation préférentielle dans les tumeurs, d’un large spectre de livraison de marchandises, de la capacité à surmonter les barrières biologiques telles que la barrière hémato-encéphalique et d’un profil de toxicité minimal. Pour plusieurs raisons, les NK-EV évitent la nécessité d’une lymphodéplétion du patient par chimiothérapie avant l’administration : 1) conventionnellement, la lymphodéplétion est utilisée pour créer un environnement plus hospitalier pour la thérapie cellulaire, permettant aux cellules perfusées de proliférer et d’exercer leurs effets thérapeutiques ; 2) contrairement aux cellules, les VE n’ont pas la capacité de réplication et sont considérablement plus petites en échelle ; 3) Les VE fonctionnent par des mécanismes distincts et présentent une immunogénicité diminuée par rapport aux cellules 5,6,7. De plus, les NK-EV ont constamment montré une efficacité in vitro contre divers modèles de cancer et ont également montré des effets immunomodulateurs sur les cellules immunitaires qui favorisent les réponses anticancéreuses 8,9. Les résultats in vivo corroborent ces résultats, mettant en évidence une régression du cancer après un traitement par NK-EV et des toxicités négligeables 10,11,12. Par conséquent, les thérapies à base de NK-EV sont très prometteuses pour relever les défis du traitement des tumeurs solides froides et immunologiquement inertes 13,14,15,16,17.
Notre récente étude s’attaque à un goulot d’étranglement important dans la traduction clinique des NK-EV par le biais de la biofabrication7. L’article présente une preuve de concept pour un flux de travail de biofabrication rentable et évolutif de NK-EV, méticuleusement conçu pour garantir des tests de contrôle de la qualité en cours de processus. Cette approche a permis de produire en permanence de grandes quantités de produits biothérapeutiques anticancéreux à base de NK-EV de haute pureté, avec une caractérisation approfondie du produit menée conformément aux directives MISEV201818. L’évolutivité du flux de travail de biofabrication peut être obtenue en augmentant la taille de la cartouche ou en faisant fonctionner plusieurs bioréacteurs en parallèle. De même, l’évolutivité du flux de travail d’isolation des VE peut être facilement obtenue à l’aide de techniques telles que la chromatographie liquide à protéines rapides (FPLC), la chromatographie d’exclusion stérique (SEC), l’ultrafiltration (UF) et la stérilisation par filtre. Le système de bioréacteur à fibres creuses (HFB) en boucle fermée a développé la lignée de cellules NK autosuffisantes IL-2 (cellules NK92-MI) sans nécessiter de supplémentation en sérum, un système d’alimentation et des antibiotiques. Cela a été accompli à l’aide d’un milieu chimiquement défini et sans xénogramme disponible dans le commerce (une version GMP est maintenant disponible dans le commerce). En conséquence, de grandes quantités de cellules NK (10 à9 cellules viables) et de NK-EV (10 à12 VE) ont été produites avec succès en 5 à 7 jours à l’aide d’une seule cartouche de bioréacteur de taille moyenne, les deux produits ayant été largement caractérisés. Tout au long du processus de biofabrication, la santé cellulaire a été surveillée quotidiennement à l’aide de paramètres quantifiables tels que le pH, le glucose et les niveaux de lactate, ainsi que d’indicateurs visuels tels que la couleur du milieu et tout signe de contamination, qui sont des prédicteurs essentiels de la qualité des cellules et des VE. L’évaluation post-récolte de la viabilité et de la fonctionnalité des cellules NK générées dans le système HFB, en particulier la cytotoxicité, a révélé une amélioration significative par rapport aux cultures en flacon7. De même, les NK-EV purifiés présentaient un profil de pureté élevé, dépourvus de bactéries, de mycoplasmes, d’entités virales communes et de composants cellulaires, et avec des niveaux d’endotoxines négligeables. Il est important de noter que les NK-EV purifiés représentaient plus de 99,9 % de toutes les nanoparticules trouvées dans le produit final7. Enfin, ces NK-EV purifiés ont conservé les caractéristiques clés des NK, y compris les marqueurs de surface (CD2, CD45, CD56), la charge utile de cytokines (GzmB, PFN, IFN-g), et ont démontré une cytotoxicité puissante contre les cellules leucémiques K562, la ligne de référence pour évaluer la cytotoxicité des cellules NK7.
Le présent protocole détaille le flux de travail de biofabrication évolutif discuté ci-dessus. Il explique la méthodologie d’isolement des NK-EV produits à l’aide de la FPLC-SEC couplée à l’UF et à la stérilisation par filtre. De plus, le protocole décrit des étapes cruciales, notamment la caractérisation du produit à l’aide de l’analyse de suivi des nanoparticules (NTA), l’évaluation de la qualité à l’aide de divers outils (quantification des protéines/ADNdb et tests microbiens) et la validation fonctionnelle du produit NK-EV purifié contre les cellules cancéreuses par test de viabilité cellulaire. En règle générale, ce flux de travail produit 1,0 à 1,5 mL de produit NK-EV avec une concentration moyenne de 1,18 x10 12 VE/mL7, soit un total d’au moins 1 x 1012 IL sur la base d’environ 40 mL de CM riche en VE. Ce processus permet la libération du produit pour diverses applications en aval, telles que les études expérimentales, précliniques et multi-omiques (protéomique, transcriptomique, génomique, métabolomique, lipidomique et épigénomique) exigeant de grandes quantités de VE de haute qualité tout en présentant un potentiel d’application clinique, avec une reproductibilité démontrée.
Protocole
1. Biofabrication de NK-EV à partir de cellules NK92-MI à l’aide d’un bioréacteur en boucle fermée
REMARQUE : Les NK-EV sont fabriqués à l’aide d’un flux de travail de biofabrication évolutif qui respecte les bonnes pratiques de fabrication (BPF) et utilise les cellules NK92-MI (voir Figure 1). Notre récente publication a donné un aperçu détaillé du processus de biofabrication et des profils d’identité et de sécurité des produits NK-EV7.
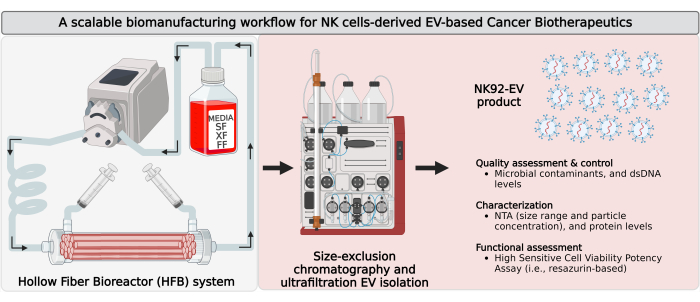
Figure 1 : Biofabrication de vésicules extracellulaires dérivées de cellules tueuses naturelles (NK-EV) dans un bioréacteur à fibres creuses (HFB) en boucle fermée avec un flux d’isolement évolutif. Représentation schématique du flux de travail de biofabrication pour générer de grandes quantités de produits NK-EV de haute pureté. Les cellules NK92-MI autonomes IL-2 sont ensemencées dans une cartouche HFB en boucle fermée et cultivées dans des conditions sans sérum (SF), sans xéno (XF), sans nourrisseur et sans antibiotiques, où elles sont cultivées pour une collecte continue de milieux conditionnés riches en VE. L’isolement du NK-EV à partir de CM riches en EV est réalisé par chromatographie d’exclusion stérique basée sur la chromatographie liquide à protéines rapides (FPLC-SEC) couplée à l’ultrafiltration (UF). Les NK-EV sont caractérisés et évalués à l’aide de plusieurs essais, et leur fonctionnalité contre les cellules leucémiques K562 est évaluée à l’aide d’un test de viabilité et de puissance. Cette figure a été modifiée de7 (créé avec Biorender.com). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- À partir de 1 à 5 x 10cellules 6 NK92-MI et en maintenant une densité cellulaire comprise entre 3 et 8 x 105 cellules/mL, cultivez les cellules dans des fioles T25 - T175 à l’aide d’un milieu de culture préchauffé. Incuber à 37 °C avec 5 % de CO2 (voir tableau des matériaux). Remplacer le milieu tous les 2 à 3 jours jusqu’à ce que 1 x 108 cellules NK92-MI soient produites avec une viabilité d’au moins 70 %.
REMARQUE : Conservez 1/5th-1/3rd du milieu conditionné (CM) lors du réensemencement des cellules, car il contient des facteurs de croissance favorables. - Effectuer la préparation de la cartouche HFB moyenne et l’inoculation des cellules NK comme décrit ci-dessous.
REMARQUE : Toutes les manipulations doivent être effectuées à l’intérieur d’une enceinte de biosécurité de classe II pour assurer et maintenir la stérilité. Avant de déplacer le système de cartouche dans l’enceinte de biosécurité, vaporisez généreusement de l’éthanol à 70 %, en accordant une attention particulière au goulot d’étranglement du réservoir et aux raccords de la seringue.- Préparez la cartouche HFB conformément aux instructions du fabricant19 (voir la table des matériaux ; voir Figure 2) comme décrit ci-dessous.
- Enroulez les raccords Luer Lock avec un film de cire et ajustez le débit de la pompe selon les instructions du fabricant19. Conditionnez la cartouche HFB en laissant circuler 150 mL de solution saline stérile tamponnée au phosphate (PBS ; voir le tableau des matières) pendant au moins cinq jours.
- Pour évacuer l’air de l’espace capillaire extracellulaire (ECS ; le volume est d’environ 29 ml), injectez environ 40 ml de PBS par le port ECS gauche et laissez l’air s’échapper par le port ECS droit. Ce faisant, fermez les pinces des ports d’extrémité gauche et droite. Assurez-vous que la seringue est toujours connectée aux ports ECS gauche et droit.
- Une fois terminé, placez la cartouche sur la pompe à débit (voir tableau des matériaux) à l’intérieur de l’incubateur réglé à 37 °C et 5 % de CO2. Assurez-vous qu’il n’y a pas de fuites après quelques jours de circulation.
- Remplacer le PBS par 150 mL de milieu de culture dans le flacon réservoir et le ECS 2 jours avant d’ensemencer les cellules dans la cartouche. Répéter les étapes de conditionnement précédentes (étape 1.2.1.) en utilisant le milieu de culture mais pendant 2 jours de circulation.
- Avant d’ensemencer les cellules, remplacer le contenu de la bouteille réservoir et de l’ECS par 250 mL de milieu de culture frais.
- Sortez le ballon de culture de l’incubateur et transférez les cellules dans un tube de 50 ml. Faites tourner à 300 x g pendant 5 min. Remettre la pastille en suspension à l’aide de 21 mL de milieu de culture.
- Préparez deux aliquotes de 20,5 μL chacune à partir de la suspension cellulaire pour le comptage des cellules sur un compteur de cellules automatisé (voir le Tableau des matériaux). Pour chaque aliquote de suspension cellulaire de 20,5 μL, ajoutez une quantité égale de colorant AO/PI (voir le tableau des matériaux) et mélangez de haut en bas au moins 10 fois.
REMARQUE : Nous ne recommandons pas le bleu trypan pour un comptage précis des cellules NK. Vous pouvez également utiliser un hémocytomètre pour le comptage manuel. - Chargez 20 μL dans chaque chambre de comptage de la lame de comptage et effectuez le comptage automatisé des cellules à l’aide du programme approprié. Calculez la concentration moyenne de cellules vivantes et notez la viabilité.
- Mélangez la solution de cellules NK plusieurs fois avant de l’aspirer à l’aide d’une seringue de 20 ml et d’une aiguille de 18 g pour maintenir la stérilité. Cette solution doit contenir environ 1 x 108 cellules NK vivantes dans environ 20 mL ou environ 5 x 106 cellules/mL.
- Après avoir retiré l’aiguille de la seringue, injectez doucement les cellules NK dans la cartouche par le port ECS gauche. Pour assurer une dispersion uniforme des cellules dans toute la cartouche, agissez doucement la solution cellulaire au moins 10 fois à l’aide des seringues connectées aux ports ECS gauche et droit.
REMARQUE : la solution doit avoir la même turbidité sur les deux seringues, avec les orifices d’extrémité gauche et droite fermés. - Ouvrez les ports d’extrémité gauche et droit et injectez ce qui reste dans les seringues. Fermez les ports ECS gauche et droit à l’aide des pinces.
- Transférez la cartouche dans l’incubateur et laissez-la reposer pendant 30 min avant de l’installer correctement sur la pompe d’écoulement. Laissez la cartouche pour la biofabrication. Ajustez le débit en fonction du fabricant.
- Pour surveiller les paramètres de santé cellulaire, prélevez une aliquote de 0,5 mL de milieu par jour à partir du milieu soigneusement mélangé dans le flacon réservoir et conservez-la à -20 °C après avoir vérifié les niveaux de glucose et de pH. Les taux de L-lactate peuvent être vérifiés ultérieurement (voir le tableau des matériaux).
- Remplacez le milieu dans le réservoir (250 à 500 ml) tous les 1 à 2 jours pour maintenir la teneur en glucose au-dessus de 50 % des niveaux initiaux trouvés dans le milieu et le pH au-dessus de 7,0 (plage de 7,0 à 8,0).
- Préparez la cartouche HFB conformément aux instructions du fabricant19 (voir la table des matériaux ; voir Figure 2) comme décrit ci-dessous.
- Effectuez le prélèvement de CM riche en NK-EV tous les jours après 1 jour de repos lors du premier ensemencement de la cartouche, comme décrit ci-dessous.
- Déplacez le système de cartouche dans l’enceinte de biosécurité. Injectez doucement environ 21 ml de milieu de culture par l’orifice ECS gauche pour pousser un volume équivalent de CM riche en EV à travers l’ECS droit - ne mélangez pas (voir la figure 3).
REMARQUE : Utilisez toujours des articles en plastique neufs pour éviter toute contamination. - Transférer la solution de CM riche en VE dans un tube de 50 mL et centrifuger à 300 x g pendant 5 min. Pendant ce temps, remettez le système de cartouche dans l’incubateur de la pompe à débit.
- Transvasez le surnageant dans un tube neuf et centrifugez à 2000 x g pendant 10 min. Encore une fois, transférez le surnageant dans un nouveau tube. Ensuite, aliquote uniformément le CM riche en VE sur 3 tubes de 50 mL (~7 mL/tube) et stockez-le à −80 °C jusqu’à ce qu’il soit traité ultérieurement.
REMARQUE : Des CM riches en EV récoltés séquentiellement sont regroupés dans ces trois tubes, générant ainsi trois tubes d’échantillons techniques répliqués.
- Déplacez le système de cartouche dans l’enceinte de biosécurité. Injectez doucement environ 21 ml de milieu de culture par l’orifice ECS gauche pour pousser un volume équivalent de CM riche en EV à travers l’ECS droit - ne mélangez pas (voir la figure 3).
- Effectuez la récolte de cellules HFB-NK pour continuer à produire des CM riches en VE en utilisant la même cartouche HFB que celle décrite ci-dessous.
REMARQUE : Les cellules NK peuvent être prélevées à partir de l’ECS du HFB en exécutant le protocole de récolte de cellules HFB-NK une fois que la cartouche atteint la confluence (maximum de 1 x 109 cellules). Cela se produit après 5 à 7 jours pour chaque lot ou lorsque la teneur en glucose est inférieure à la limite de détection du glucomètre (par exemple, aucune lecture ou lectures de ~ 0) pendant 2 jours consécutifs. S’il s’agit de la récolte finale de cellules, le milieu peut être substitué au PBS pour rincer la cartouche et récupérer les cellules.- Récoltez les CM riches en VE exactement comme indiqué ci-dessus à l’étape 1.3.
- Injectez environ 50 ml du fluide par le port ECS gauche. Pour assurer une dispersion cellulaire homogène dans toute la cartouche, poussez doucement la solution cellulaire d’avant en arrière à l’aide des seringues connectées aux ports ECS gauche et droit au moins 10 fois pour desserrer les cellules avant de les pousser et de les collecter avec une seringue à travers le port ECS droit. Transférez le CM riche en VE récolté dans un tube de 50 ml. Réserver à 37 °C (bain-marie ou incubateur) pour l’instant.
REMARQUE : L’action de refoulement aide à déloger les cellules avant qu’elles ne soient complètement expulsées et collectées par une seringue par le port ECS droit. La solution doit avoir la même turbidité sur les deux seringues, les orifices gauche et droit étant fermés. Tapoter sur la cartouche du bioréacteur (perturbation physique) peut aider à déloger de manière préventive l’amas de cellules au bas de la cartouche. Un mélange agressif de la suspension cellulaire peut affecter négativement la viabilité des cellules récupérées. Il faut faire preuve de prudence et de patience pour maximiser la viabilité. - Répétez la dernière étape 2 fois. Au total, 150 mL de suspension cellulaire doivent être récupérés. Centrifuger à 300 x g pendant 5 min. Jeter le surnageant.
- Remettre en suspension les deux pastilles de cellules dans 20 mL de milieu frais chacune et les combiner. Prélever deux aliquotes de 20,5 μL chacune de la suspension cellulaire pour le comptage des cellules sur un compteur de cellules automatisé (voir le tableau des matériaux).
REMARQUE : En règle générale, de nombreuses dilutions de cellules utilisant du PBS comme diluant sont nécessaires pour se situer dans la plage dynamique du compteur de cellules. - À l’aliquote en suspension cellulaire de 20,5 μL, ajoutez une quantité égale de colorant AO/PI (voir le tableau des matériaux) et mélangez de haut en bas au moins 10 fois. Chargez 20 μL dans chaque chambre de comptage de la lame de comptage et effectuez le comptage automatisé des cellules à l’aide du programme approprié.
- Faites la moyenne de la concentration de cellules vivantes de tous les comptages corrigés de la dilution, déterminez la quantité totale de cellules vivantes et enregistrez la viabilité. Comme détaillé ci-dessus, pour produire en continu des CM riches en VE en utilisant la même cartouche de bioréacteur, réensemencez 1 x 10cellules NK produites par 8 HFB.
REMARQUE : Si vous le souhaitez, les cellules NK produites par HFB peuvent être stockées à l’aide d’un milieu de congélation de cryoconservation et d’un récipient de congélation pour contrôler la vitesse de congélation (voir le tableau des matériaux).

Figure 2 : Composant et configuration du système de bioréacteur à fibres creuses (HFB). La bouteille réservoir (1) contient le fluide complet qui circule à travers la cartouche du bioréacteur (2) par l’action d’une pompe péristaltique (non illustrée) agissant sur le tube de la pompe (3). Les cellules sont introduites dans l’espace capillaire extracellulaire (ECS) par les ports latéraux ECS gauche (4) et droit (5). Une fois les pinces coulissantes ECS fermées, les orifices latéraux gauche (6) et droit (7) sont ouverts pour permettre au fluide de circuler dans tout le système. Notez l’ajout d’un film de cire sur le raccord Luer Lock près du bouchon du réservoir de la bouteille moyenne pour éviter une contamination potentielle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
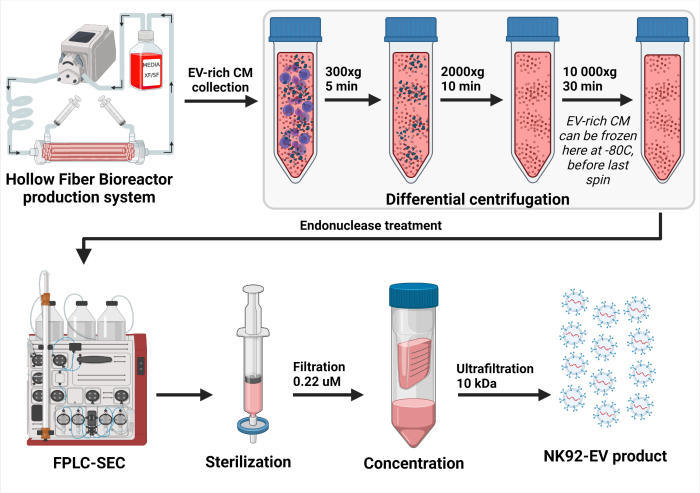
Figure 3 : Représentation schématique du processus d’isolement NK-EV. Après la collecte quotidienne d’un milieu conditionné riche en EV (CM), la solution a été centrifugée différentiellement pour éliminer les cellules (premier spin à 300 x g pendant 5 min) et les débris cellulaires (deuxième spin à 2000 x g pendant 10 min). Le CM riche en EV éliminé a été stocké à -80 °C jusqu’à la suite du traitement. Une fois prêt pour l’isolement du NK-EV, le CM congelé riche en EV est décongelé et centrifugé une fois de plus pour assurer l’élimination des débris cellulaires (troisième spin à 10 000 x g pendant 30 min). Ensuite, le CM riche en VE est traité pendant 2 à 4 h à 37 °C avec de l’endonucléase pour digérer les acides nucléiques considérés comme des contaminants de la cellule hôte. Ensuite, le CM riche en VE est traité par chromatographie stérique basée sur la chromatographie liquide à protéines rapides (FPLC-SEC) pour la purification des VE à l’aide d’une résine bimodale. Des fractions éluées d’environ 10 à 15 mL sont combinées et filtrées avec des filtres de 0,22 μM pour garantir la stérilité du produit NK-EV final. L’ultrafiltration permet de concentrer le produit par un facteur d’environ 35 à 50X, ce qui donne une concentration garantie de plus de 1 x 1012 EV/mL, soit un total de 1,0 à 1,5 mL. Cette figure a été modifiée par rapport à7 (créé avec Biorender.com). Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Purification NK-EV par FPLC-SEC couplée à une stérilisation UF et par filtre
- Préparez les solutions suivantes et filtrez-les deux fois à l’aide d’un filtre de 0,1 μm (voir tableau des matériaux) : eau (conductivité de 0 mS/cm), PBS : 50 mL de 10x PBS + 450 mL d’eau (conductivité autour de 14,7 mS/cm), éthanol à 20 %, solution de nettoyage (NaOH 0,5 M et alcool isopropylique à 30 % dans l’eau).
- Effectuer l’amorçage du système FPLC conformément aux instructions du fabricant (voir le tableau des matériaux). Effectuez les étapes de nettoyage en place (NEP) avant et après le fonctionnement conformément aux instructions du fabricant. Lavez toutes les conduites et la résine de la colonne et rincez-les à l’aide d’eau doublement filtrée (DF), d’une solution de nettoyage, d’eau DF et d’un DF-PBS.
REMARQUE : Il convient de noter que le CIP peut être effectué un autre jour si nécessaire. - Utiliser une colonne de chromatographie garnie d’une résine bimodale (voir tableau des matériaux) d’une hauteur de lit de 20 cm. Effectuez les connexions à l’aide de la méthode goutte à goutte pour vous assurer qu’aucun air n’est introduit à l’intérieur de la colonne.
- Installez le collecteur de fractions avec les tubes de collecte appropriés et modifiez les paramètres de fractionnement pour le volume de collecte souhaité (par exemple, 15 ml). Placez suffisamment de tubes et deux tubes supplémentaires pour recueillir tout le volume d’échantillon.
- Effectuez la préparation des échantillons comme décrit ci-dessous.
- Sortez 40 à 80 ml de CM riche en VE du congélateur à -80 °C et décongelez-le rapidement à 37 °C. Chargez l’échantillon dans l’ultracentrifugeuse et faites-le tourner à 10 000 x g pendant 30 min à 4 °C.
REMARQUE : Les tubes doivent être équilibrés avec précision en poids, et non en volume. - Après l’essorage, récupérez le surnageant et transférez-le dans un nouveau tube. Pour réduire les niveaux d’ADNdb, traitez le CM riche en EV avec 50 U/mL d’endonucléase et 1,5 mM de MgCl2 (voir le tableau des matériaux). Incuber pendant 2 à 4 h dans un incubateur (37 °C), en permettant un mélange modéré.
- Sortez 40 à 80 ml de CM riche en VE du congélateur à -80 °C et décongelez-le rapidement à 37 °C. Chargez l’échantillon dans l’ultracentrifugeuse et faites-le tourner à 10 000 x g pendant 30 min à 4 °C.
- Une fois que le système (lignes et colonne) est prêt pour l’isolation EV, chargez le CM riche en EV dans une seringue de 60 ml et connectez-le à la ligne d’échantillonnage. Démarrez le système en cliquant sur Exécuter manuellement et réglez le débit sur 0. Suivez les instructions du logiciel pour enregistrer l’exécution de manière préventive, puis cliquez sur Démarrer.
- Sélectionnez la ligne B (DF-PBS) et exécutez à une vitesse d’écoulement de 150 cm/h (débit de 2,0 mL/min). Assurez-vous que la solution traverse la colonne.
- Une fois la conductivité stabilisée, appuyez sur Auto Zero UV. Modifiez la trajectoire d’écoulement pour diriger l’échantillon vers la bouteille de déchets avant la colonne. Assurez-vous qu’aucune bulle n’est introduite dans le système.
- Après un maximum de 5 à 20 s, dirigez l’échantillon vers la colonne. Cliquez sur Fractionnement lorsque les lectures UV atteignent environ 230 mAU.
- Une fois que l’échantillon est complètement injecté dans le système, basculez le système tampon sur DF-PBS (au niveau de la vanne d’échantillonnage) pour poursuivre la purification. Cliquez à nouveau sur Fractionnement lorsque la valeur UV atteint environ 1600 mAU.
REMARQUE : Cela correspond à l’intersection entre les lectures UV et les lectures de conductivité. Un fractionnement plus long ne fait que diluer le rétentat sans augmenter le rendement EV. - Combinez toutes les fractions (NK-EV diluées) et stockez-les à 4 °C jusqu’à ce qu’elles soient prêtes pour la stérilisation par filtre et l’ultrafiltration (UF).
- Continuez à exécuter DF-PBS jusqu’à ce que la valeur UV atteigne environ 1000 mAU. Après cela, arrêtez de fonctionner et enregistrez le chromatogramme en tant que document PDF.
3. Stérilisation et concentration par filtre du produit NK-EV par UF
- Refroidissez la centrifugeuse à 10 °C. Désinfectez chaque composant de l’appareil UF (voir le tableau des matériaux) en rinçant avec 20 à 30 ml d’éthanol à 90 %. Essorer à 4000 x g pendant 5 à 10 min.
REMARQUE : Le filtre est fabriqué en cellulose régénérée MWCO de 10 kDa. - Jetez le flux, puis répétez le rinçage à l’aide de PBS stérile pour équilibrer l’appareil. Répétez l’opération 2 fois au total.
- Pour maximiser la stérilité, filtrez la solution diluée de NK-EV à l’aide d’un filtre à seringue de 0,22 μm pré-humidifié avec du DF-PBS (voir le tableau des matériaux). Recueillir le filtrat directement dans l’appareil de concentration stérilisé.
- Essorage à 4000 x g pendant 15 à 40 minutes (le temps d’essorage dépend de l’échantillon). Mélangez la solution dans le compartiment supérieur du filtre à l’aide d’une pipette sérologique après l’essorage. Essorage à 4000 x g pendant 10 min supplémentaires.
REMARQUE : L’étape de mélange est facultative car elle facilite simplement l’étape de concentration en empêchant la membrane d’être obstruée par les VE. - Mettez temporairement de côté le flux continu et prélevez l’échantillon NK-EV en inversant le dispositif de filtration et en le fixant au dispositif de collecte.
- Essorage à 2000 x g pendant 2 min. Transférez le produit NK-EV purifié dans un tube de 2 ml. Conservez le produit NK-EV purifié à 4 °C pour une utilisation à court terme (≤ 7 jours) ou congelé à -20 °C pour une utilisation à long terme.
4. Caractérisation NK-EV par analyse de suivi des nanoparticules (NTA)
- Préparez la solution et filtrez-la deux fois à 0,1 μm (voir tableau des matériaux) : eau, PBS, solution de nettoyage (10 % d’eau de Javel (ATTENTION) dans l’eau).
- Lancez le système NTA conformément aux instructions du fabricant. De même, effectuez les étapes de nettoyage en place (NEP) avant et après l’exécution. Lavez toutes les conduites et rincez-les à l’aide d’eau doublement filtrée (DF), d’une solution de nettoyage et d’eau DF. Équilibrez les lignes à l’aide de DF-PBS.
- Vérifiez la cellule d’écoulement et vérifiez s’il y a des bulles d’air. Retirez les bulles si présentes. Une fois dégagé, réinsérez soigneusement la cellule d’écoulement dans l’instrument NTA.
REMARQUE : Bien que non recommandé par le fabricant, les bulles d’air très difficiles à éliminer peuvent facilement être éliminées en rinçant avec de l’éthanol à 20 %, puis de l’eau DF. - Une fois la cellule d’écoulement en place et la porte fermée, cliquez sur Démarrer la caméra. Avec les lignes remplies de DF-PBS, l’écran doit afficher un nombre minimum absolu de particules.
- Modifiez les paramètres de capture pour un gain d’écran de 2 et un niveau de caméra de 14. Allumez également le chauffage pour stabiliser la température de la cellule d’écoulement.
- Cliquez sur Mesure standard pour créer un script sous l’onglet SOP afin de collecter une capture sur 1 min à un débit de 30 particules/image et 23 °C.
- Juste en dessous, ajoutez le nom du dossier et du fichier au nom du chemin d’accès pour enregistrer les données.
- Préparez à l’avance les dilutions du produit NK-EV purifié à l’aide de DF-PBS. Lors de l’exécution de NTA, une quantification précise nécessite 30 à 80 particules/image.
- Vortex l’échantillon avant de le charger dans la seringue (voir le tableau des matériaux).
- Connectez soigneusement la seringue d’acquisition de 1 ml à la ligne de chargement de l’instrument. Il ne doit pas y avoir d’air car cela affecterait négativement l’acquisition et l’analyse. Poussez lentement la moitié de l’échantillon, en laissant environ 0,5 ml dans la seringue.
- Une fois que les particules sont visibles à l’écran, faites la mise au point de l’appareil photo pour avoir un maximum d’un halo autour de chaque particule. Cliquez sur Infuse sous l’onglet Matériel à une vitesse de 1000 pendant 5 s. Ensuite, ramènez-le à un taux de 30.
- Appuyez sur Exécuter le script et suivez les instructions. Le logiciel s’assurera que la température est réglée et vous demandera si les paramètres sont corrects. Cliquez sur Oui et suivez les instructions du logiciel.
- Une fois la capture terminée, cliquez sur Annuler lorsque le logiciel vous demande de traiter ou d’exporter des fichiers. Cliquez sur Infuse sous l’onglet Matériel à une vitesse de 1000 pendant 10 à 15 s. Pendant ce temps, rallumez le chauffage et l’appareil photo. Ensuite, réduisez le taux à 30 jusqu’à ce que les particules se déplacent.
- Rassemblez quatre captures supplémentaires en répétant les étapes précédentes. Une fois qu’un total de cinq captures par dilution a été enregistré, effectuer l’analyse après avoir importé les cinq captures.
- Sélectionnez les fichiers à traiter en les mettant en surbrillance. Cliquez sur Traiter les fichiers sélectionnés. Sous l’onglet Processus, ajustez les paramètres d’analyse sur un gain d’écran de 2 et un seuil de détection de 15.
Les paramètres dépendent de l’échantillon ; Assurez-vous que 30 à 80 particules par image sont visibles. - Cochez et cliquez sur OK pour l’analyse.
- Une fois les fichiers traités, le logiciel demandera à les exporter. Cliquez sur Oui sans cliquer sur des cases supplémentaires ou sur Exporter.
- Répétez l’opération pour toutes les dilutions ou tous les échantillons de VE. Arrêtez l’instrument NTA une fois que tous les échantillons sont terminés et que le NEP est terminé.
5. Tests d’assurance qualité
- Effectuez des tests microbiens à l’aide de deux tests : 1) une petite aliquote de NK-EV purifiés est enrichie dans un milieu de bouillon LB autoclave, et 2) une petite aliquote de NK-EV purifiés est utilisée pour la détection PCR des mycoplasmes (voir le tableau des matériaux).
- Test 1 : milieu de culture LB à 37 °C jusqu’à 5 jours avec contrôles positifs et négatifs inclus. Enregistrez l’OD600, si nécessaire.
- Test 2 : effectuer la détection PCR des mycoplasmes selon le protocole du fabricant.
- Quantifier les protéines et l’ADNdb sur des dilutions NK-EV purifiées à l’aide d’essais basés sur un fluorimètre, conformément aux instructions du fabricant (voir le tableau des matériaux).
6. Évaluation de l’activité de cellules cancéreuses traitées par NK-EV à l’aide d’un test de viabilité cellulaire validé à base de résazurine hautement sensible 20
- Cultivez des cellules de leucémie humaine K562 à l’aide du RPMI-1640 avec 10 % de FBS inactivé par la chaleur pendant quelques jours avant d’effectuer le test d’activité (voir le tableau des matériaux). Maintenir la densité entre 2 et 8 x 105 cellules/mL et remplacer le milieu tous les 2 à 3 jours.
- Acquérir une plaque à fond plat de 96 puits (voir le tableau des matériaux) et ajouter de manière préventive le volume de milieu de dosage (complété par 5 % de FBS appauvri en EV) requis à des fins de normalisation (voir le tableau des matériaux). Le volume final est de 150 μL/puits.
REMARQUE : Utilisez une pipette à répéteur pour réduire les variations d’un puits à l’autre. - Acquérez la culture cellulaire et transférez-la dans un tube. Faites tourner à 300 x g pendant 5 min. Remettre en suspension la pastille cellulaire dans une solution unicellulaire à l’aide de 2 à 5 mL de milieu de dosage.
- Prélever une aliquote de 20,5 μL de la suspension cellulaire pour le comptage des cellules sur un compteur de cellules automatisé (voir le tableau des matériaux).
- À l’aliquote en suspension cellulaire de 20,5 μL, ajoutez une quantité égale de colorant AO/PI (voir le tableau des matériaux) et mélangez de haut en bas au moins 10 fois.
REMARQUE : Nous recommandons AO / PI pour un comptage précis des cellules. Vous pouvez également utiliser un hémocytomètre pour le comptage manuel. - Chargez 20 μL dans chaque chambre de comptage de la lame de comptage et effectuez le comptage automatisé des cellules à l’aide du programme approprié. Faites la moyenne de la concentration de cellules vivantes et enregistrez la viabilité.
- Transférez environ 1 x 106 cellules dans un tube secondaire. Diluez les cellules à 7 mL de milieu de dosage et répétez le comptage des cellules. La concentration doit être d’environ 1,2 à 1,5 x 105cellules vivantes/mL.
- Comme indiqué ci-dessus, ajustez la concentration de suspension sur cellule unique à 1 x 105 cellules vivantes/ml et répétez le comptage des cellules si nécessaire.
REMARQUE : Le coefficient de variation entre les dénombrements techniques en double doit être inférieur à 25 %; généralement, il est inférieur à 5 % avec le comptage AO/PI. - Une fois la concentration souhaitée atteinte, transférez 50 μL (± 1 μL) de cette solution dans chaque puits pour vous rapprocher le plus possible de 5000 cellules/puits (4900 - 5100 cellules/puits). Préparez des triplets techniques pour chaque condition de test et utilisez une pipette à répéteur pour réduire les variations d’un puits à l’autre.
- Transférez la plaque dans un agitateur orbital (350 - 500 tr/min) pendant 2 min. Transférez les cellules dans l’incubateur jusqu’à ce qu’elles soient prêtes à procéder au traitement NK-EV.
- Préparez les dilutions NK-EV requises (1:5, 1:10 et 1:100) à l’aide d’un milieu de dosage.
- À partir de ces dilutions, tester les concentrations suivantes de VE : 1 x 108, 5 x 108, 1 x 109, 5 x 109, 1 x 1010, 5 x 1010 et 1 x 1011 particules/mL. Le volume de dosage est limité à 20 % du volume total du dosage.
- Une fois prêt, transférez le volume requis d’une dilution donnée dans les puits nécessitant une concentration souhaitée de VE pour le traitement. Ajouter 15 μL de 10x Triton-X dans le puits de contrôle positif (voir le tableau des matériaux). Le volume final du puits doit être normalisé à 150 μL.
- Ajouter la plaque dans un agitateur orbital (350 - 500 tr/min) pendant 2 min. Incuber les cellules à 37 °C dans l’incubateur à 5 % de CO2 pendant 3 h.
- Préchauffez le lecteur de plaques (voir la table des matériaux) à 37 °C et chargez le script suivant : 37 °C (réduit les variations liées à la température), mélange à 450 tr/min pendant 1 min (assure l’homogénéité de l’échantillon) et lisez.
- Ajouter 15 μL du réactif à base de résazurine dans chaque puits (voir le tableau des matériaux). Protégez le réactif de la lumière et utilisez une pipette à répéteur pour réduire les variations d’un puits à l’autre.
- Ajouter la plaque dans un agitateur orbital (350 - 500 tr/min) pendant 2 min. Transférez la plaque dans l’incubateur et incubez pendant 60 min. Éliminez les bulles d’air à l’aide d’une pointe de pipette imbibée d’éthanol. Lire la plaque en utilisant une excitation de 560 nm et une émission de 590 nm.
- Analyse des données : La moyenne des répétitions techniques moyennes a été calculée et corrigée pour le bruit de fond avant d’effectuer une analyse dose-réponse à l’aide d’une régression non linéaire pour l’effet d’inhibition montrant la pente log(inhibiteur) par rapport à la réponse normalisée sans contrainte. Notez les valeurs de pente et de EC50 .
Résultats
Les NK-EV possèdent des fonctions cytotoxiques inhérentes et ont démontré une grande efficacité contre divers modèles de cancer. Cependant, il faut davantage de normalisation parmi les études actuelles concernant un flux de travail de biofabrication adapté à la production à grande échelle de NK-EVs 6,21. Notre étude précédente a décrit la faisabilité d’un système de bioréacteur à fibres creuses (HFB) en boucle fermée pour produire de grandes quantités de produits NK-EV de haute pureté7. Dans le cadre d’un suivi, cette étude basée sur un protocole détaille le flux de travail de biofabrication et démontre sa reproductibilité en produisant et en isolant le produit NK-EV (Figure 1). De plus, la caractérisation et la validation essentielles du produit sont nécessaires avant la mise sur le marché du produit, et des données nouvelles et originales sont présentées dans cette étude.
Le système HFB a été sélectionné pour la production de NK-EV en raison de sa facilité d’utilisation, de sa fiabilité, de son évolutivité et de sa conformité aux BPF7. En ce qui concerne la configuration du système HFB, les cellules NK sont injectées par le port ECS gauche et ensemencent dans la cartouche du bioréacteur (Figure 2). Dans le même temps, la bouteille de média est connectée au HFB par les ports latéraux, et le média est autorisé à circuler dans tout le système. Les cellules NK sont cultivées dans un milieu sans sérum, sans xéno, sans mangeoire et sans antibiotique, où le milieu est remplacé lorsque la teneur en glucose tombe en dessous de 50 % pour maintenir et maximiser la santé cellulaire au fil du temps. Le CM est collecté quotidiennement, traité par centrifugation différentielle et conservé congelé (-80 °C) jusqu’à ce qu’il soit prêt pour un traitement ultérieur. Ensuite, l’isolation des VE est réalisée par une combinaison de centrifugations différentielles et de FPLC-SEC couplée à l’UF et à la filtration (Figure 3). Il en résulte un produit NK-EV concentré et stérile d’un volume final d’environ 1,0 à 1,5 ml. Un chromatogramme représentatif de l’isolement FPLC-SEC des NK-EV est fourni (Figure 4). Avant le traitement FPLC-SEC, le CM riche en NK-EV est traité avec une endonucléase, ce qui réduit considérablement les niveaux d’ADNdb, un contaminant potentiel de la cellule hôte (NK)7. Ainsi, le flux de travail d’isolement des VE décrit élimine les débris cellulaires et les contaminants ARN/ADN du produit NK-EV, ce qui est essentiel pour garantir un potentiel immunogène faible et indésirable et pour que le produit final soit adapté aux études en aval.
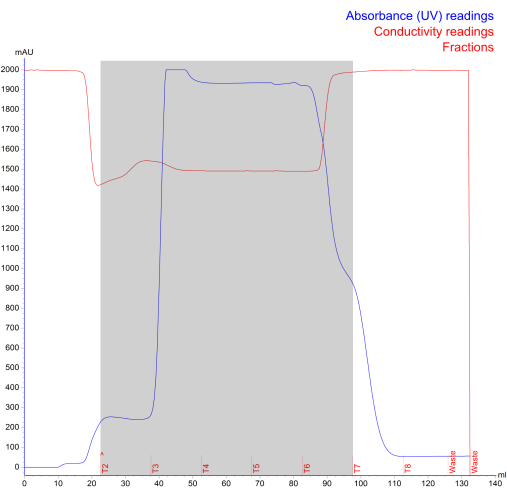
Figure 4 : Chromatogramme d’isolement NK-EV généré lors de l’exclusion stérique par chromatographie liquide à protéines rapides. La ligne bleue représente l’absorbance (mUA ; lecture maximale de 2000 mAU), la ligne rouge représente la conductivité, le texte rouge représente le log de fonctionnement et la zone grise représente les NK-EV fractionnés (désignés par les fractions T2 - T7). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Après l’isolement, des tests de caractérisation et d’assurance qualité de base du NK-EV sont utilisés pour évaluer si le produit NK-EV peut être libéré pour une expérimentation ultérieure en aval. La gamme granulométrique et la concentration des particules du produit NK-EV sont mesurées à l’aide d’une analyse de suivi des nanoparticules (NTA), avec des tailles allant de 76,30 à 174,30 nm de diamètre (D10 de 78,38 ± 2,07 nm, D50 de 106,72 ± 2,43 nm et D90 de 169,80 ± 4,17 nm) et une concentration moyenne de 1,39 x 1012 EV/mL (figures 5A-B). De plus, la quantification par fluorimètre a montré une concentration de protéines et d’ADNdb de 298,90 ± 66,62 mg/mL et de 225,60 ± 37,7 ng/mL pour le produit final, respectivement (figure 5C-D). Cela correspond à un rapport moyen de 5,06 x 106 EV/μg de protéines et de 6,16 x 1012 EV/μg d’ADN. Les tests microbiens et les tests de mycoplasmes ont tous deux donné des résultats négatifs (données non présentées). Ces résultats sont cohérents avec la caractérisation des NK-EV issue de travaux antérieurs7. La publication antérieure7 fournit également une caractérisation plus approfondie des produits NK-EV conformément aux lignes directrices MISEV (c.-à-d. TEM, transfert Western, niveau d’endotoxines, entités virales et cytométrie en flux pour les antigènes de surface et les cytokines).
Enfin, la fonctionnalité du produit NK-EV (c’est-à-dire la cytotoxicité contre les cellules cancéreuses) a été évaluée à l’aide d’un test de viabilité cellulaire validé à base de résazurine très sensible après un traitement par NK-EV contre la lignée cellulaire leucémique K562 7,20. Le traitement cellulaire K562 avec des NK-EV pendant 3 h a produit un effet dose-dépendant sur la viabilité cellulaire, correspondant à une EC50 de 9,33 x 109 EV/mL (c’est-à-dire la dose qui correspond à l’élimination de 50 % de la population cellulaire ; Figures 6A-B). Ainsi, conformément aux critères de lancement du produit décrits, le produit NK-EV est jugé apte à une expérimentation ultérieure.
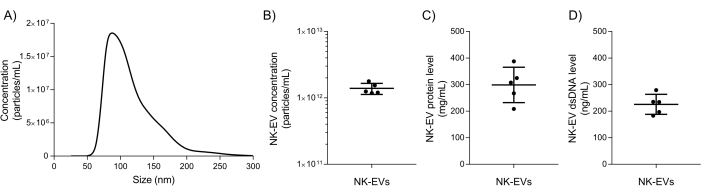
Figure 5 : Caractérisation du produit NK-EV purifié. (A) Distribution de la taille du produit NK-EV mesurée par NTA, représentée par la moyenne de 5 expériences indépendantes, chacune avec 10 répétitions techniques (5 captures vidéo x 2 dilutions). (B) Concentration de produits particulaires NK-EV (particules/mL) mesurée par NTA, présentée en moyenne ± ET à partir de 5 expériences indépendantes, chacune avec des doublons techniques. (C) La concentration en protéines du produit NK-EV (mg/mL) a été mesurée à l’aide d’un fluorimètre, présentée en moyenne ± ET à partir de 5 expériences indépendantes, chacune avec des triplets techniques. (D) Concentration d’ADNdb du produit NK-EV (ng/mL) mesurée à l’aide d’un fluorimètre, présentée en moyenne ± ET à partir de 5 expériences indépendantes, chacune avec des triplets techniques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
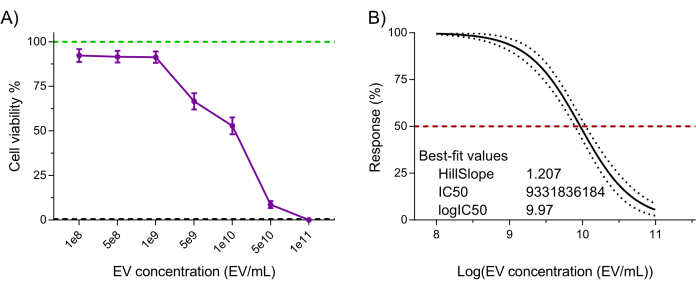
Figure 6 : Validation fonctionnelle du produit NK-EV purifié. Les NK-EV présentent une cytotoxicité dose-dépendante contre les cellules leucémiques humaines K562 traitées à diverses concentrations de NK-EV pendant 3 heures à l’aide d’un test de viabilité cellulaire à base de résazurine à haute sensibilité. (A) Lectures normalisées du test (la ligne verte représente le contrôle des cellules leucémiques K562 non traitées, et la ligne pointillée noire représente le contrôle des cellules mortes de la leucémie K562 lysée ; traité au détergent). Les données sont présentées sous forme de MEB ± moyenne à partir de 11 expériences indépendantes avec des triplicats techniques. (B) Analyse de la courbe EC50 avec une pente variable pour le traitement NK-EV avec intervalle de confiance/bandes de prédiction à 95 % (la ligne pointillée rouge représente une réponse de 50 %). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Plusieurs études suggèrent que les NK-EVs possèdent un vaste potentiel en tant que thérapeutique anticancéreux 4,5,7,9,16,22,23,24,25,26,27,28,29,30 . Cependant, un système de biofabrication évolutif conforme aux BPF, capable de produire de grandes quantités de NK-EV de haute pureté, est nécessaire pour d’autres essais précliniques et de futures applications cliniques. Pour résoudre ce problème, une étude précédente a utilisé un système HFB en boucle fermée pour produire en continu des cellules NK et des CM riches en NK-EV adaptés à l’expérimentation en aval. Grâce à leur conception 3D, les systèmes HFB reflètent étroitement les conditions du système vasculaire et possèdent un rapport surface/volume incroyablement élevé, permettant à plus d’un milliard de cellules de rester en culture, ce qui permet d’améliorer la production de VE 7,31,32. Il est important de noter que ce travail a été le premier à faire état de l’utilisation d’un système HFB pour la culture de cellules NK, probablement en raison de l’autosuffisance de la lignée cellulaire IL-27.
Des mesures supplémentaires doivent être prises pour garantir la stérilité du système HFB et la production de NK-EV de haute pureté. Ces précautions sont particulièrement cruciales en l’absence d’une salle stérile et blanche, ce qui peut être le cas pour plusieurs installations de recherche. Avant d’entrer dans l’enceinte de biosécurité, le système HFB est méticuleusement pulvérisé avec de l’éthanol à 70 % pour désinfecter toutes les surfaces externes. De plus, un film de cire est enroulé autour de tous les raccords Luer Lock pour minimiser le risque de contamination. Ceci est particulièrement important car ce flux de travail de biofabrication n’utilise pas d’antibiotiques, qui sont connus pour affecter le profil biochimique des cellules et des produits dérivés de cellules33. Divers paramètres ont été utilisés pour évaluer la santé cellulaire pendant la biofabrication de produits cellulaires. Par exemple, des évaluations quotidiennes du pH, du glucose et des niveaux de lactate du milieu réservoir ont été effectuées, car il s’agit de substituts essentiels de la santé cellulaire pour la surveillance. En plus des évaluations quantitatives, les observations qualitatives du système HFB (p. ex., couleur des milieux et signes visuels de contamination tels que la turbidité) sont également utiles pour surveiller la santé cellulaire. Il n’a pas été constaté que le nombre de cellules sur les MC récupérés quotidiennement était une mesure représentative de la viabilité de la culture (données non présentées). Cela est probablement dû au fait que des cellules mortes prélevées lors de l’échantillonnage de la MC ont été trouvées dans la tubulure où le milieu n’a pas été autorisé à circuler (la petite section entre l’ECS et l’orifice de seringue ECS), sous-estimant ainsi la viabilité de la culture cellulaire globale. Seules les cellules NK récoltées et produites par le HFB à la fin d’un lot de production peuvent fournir une mesure fiable de la santé de la culture. Ces cellules ont systématiquement montré des valeurs de viabilité supérieures à 70 % sur l’ensemble des lots de production7. Ensemble, ces méthodes d’évaluation de la qualité garantissent la production continue de NK-EV de haute pureté.
Plusieurs techniques d’isolement ont été développées pour purifier et isoler les VEs34. L’une d’entre elles, SEC, utilise une colonne remplie d’un matériau poreux - la résine - permettant la séparation des molécules en fonction de la discrimination de taille. Ici, les plus gros véhicules électriques sont élutés plus rapidement à travers la colonne ; Cette méthode est connue sous le nom de purification par flux continu basée sur l’exclusion de taille. Dans le même temps, des contaminants plus petits (ADNdb, protéines flottantes comme l’endonucléase, les sels, le rouge de phénol, etc.) sont laissés derrière et retenus dans la résine par des forces électrostatiques (c’est-à-dire qu’une résine bimodale a été utilisée). Le traitement basé sur la SEC élimine les protéines non liées à l’EV tout en conservant la structure et la fonctionnalité d’origine de l’EV35,36. De plus, la purification basée sur SEC est facilement évolutive sans compromettre le rendement élevé et la pureté, ce qui en fait un choix approprié pour isoler les NK-EV à des fins biothérapeutiques. Malgré ces avantages, le SEC présente certains inconvénients, tels que le flux relativement dilué (éluant) ; par conséquent, l’UF est nécessaire pour la concentration du produit, mais il permet également l’échange de tampon. L’appareil UF non stérile est rincé avec de l’éthanol à 70 % et du PBS et conservé dans l’enceinte de biosécurité avant utilisation pour garantir la stérilité. En règle générale, le flux peut être concentré à 35 à 50 fois le volume initial tout en éliminant les petites molécules qui auraient pu se frayer un chemin dans l’éluant. La centrifugation différentielle et le traitement par endonucléase sont effectués avant la FPLC-SEC couplée à l’UF pour éliminer les cellules résiduelles, les débris cellulaires et les longs brins d’ADNdbantigéniques 7.
Après l’isolement du produit NK-EV, la caractérisation et la validation fonctionnelle sont effectuées conformément aux lignes directrices de la MISEV2018 et MISEV2023 afin de déterminer l’aptitude du produit à une utilisation ultérieure 6,18. Chaque isolement produit 1,0 à 1,5 mL de produit NK-EV de haute pureté à une concentration minimale de 1 x 1012 VE/mL, avec une concentration moyenne de 1,39 x 1012 particules/mL. Auparavant, Gupta et al. ont déterminé que la dose médiane de VE in vivo est de 3,37 x 108 VE/kg de poids corporel de souris37. Le traitement avec la dose médiane nécessiterait 8,43 x 106 EV/souris avec un poids corporel de 25 g, une valeur bien inférieure au minimum garanti (1 x 1012 particules/mL) obtenu par ce flux de travail. Ainsi, le flux de travail de biofabrication décrit peut produire plus qu’assez de NK-EV pour l’expérimentation préclinique ou pour atteindre les objectifs de dosage. Chaque isolement est testé pour détecter la présence de mycoplasmes et de microbes dans le cadre de l’évaluation du contrôle de la qualité du produit. De plus, une étude antérieure a démontré l’absence d’entités virales communes et d’endotoxines dans le produit final et l’absence de composants cellulaires considérés comme des contaminants de la cellule hôte (par analyse par transfert Western)7,34. Enfin, l’évaluation fonctionnelle a été réalisée à l’aide d’un test de viabilité cellulaire validé à base de résazurine très sensible pour évaluer la fonctionnalité des NK-EVs20. Le test de viabilité décrit fonctionne en réduisant la résazurine (faiblement fluorescente) en résorupine (hautement fluorescente) par des cellules métaboliquement actives, ce qui permet d’évaluer la viabilité cellulaire après un traitement NK-EV. Comparé à d’autres tests de viabilité cellulaire, le test à base de résazurine utilisé dans l’étude est très sensible aux changements de viabilité cellulaire (très faible bruit de fond) et permet de raccourcir le temps d’incubation pour observer les résultats (moins de 30 minutes pour obtenir des résultats statistiquement significatifs)20. En général, les NK-EV présentent un effet dose-dépendant sur la viabilité du K562. Ensemble, les résultats présentés représentent un produit NK-EV qui a satisfait aux critères de libération du produit pour l’évaluation préclinique et qui convient aux applications en aval.
En conclusion, cette étude basée sur un protocole décrit la biofabrication de NK-EV avec un potentiel de qualité clinique. Comme nous l’avons vu, les NK-EV sont produits à l’aide d’un système HFB en boucle fermée dans des conditions sans sérum, sans xéno, sans mangeoire et sans antibiotiques7. Une combinaison de FPLC-SEC/UF isole et purifie le produit NK-EV. Avant de commercialiser les produits pour une application en aval, les NK-EV doivent être caractérisés et validés fonctionnellement pour s’assurer qu’ils sont adaptés à l’utilisation. Comme démontré, le respect de ce protocole de biofabrication permet de générer avec succès une grande quantité de NK-EV de haute pureté qui présentent une cytotoxicité ciblée contre les cellules cancéreuses. Par conséquent, le protocole de biofabrication décrit pourrait être un atout pour de futures études nécessitant la production de NK-EV de qualité clinique.
Déclarations de divulgation
Tous les auteurs ne déclarent aucun conflit d’intérêts ou divulgation.
Remerciements
Les auteurs tiennent à remercier les Drs Simon Sauvé, Roger Tam et Xu Zhang pour leur examen critique des manuscrits. Ces travaux ont été soutenus par des subventions de fonctionnement de la phase VII (2019-2025) de l’Initiative de recherche et développement en génomique (IRDG) du gouvernement du Canada obtenues par JRL et LW, ainsi que par des subventions de fonctionnement du Conseil de recherches en sciences naturelles et en génie du Canada RGPIN-2019-05220, de la Société de recherche sur le cancer de l’Université d’Ottawa 24064, des subventions de fonctionnement de recherche des Instituts de santé du Canada (IRSC) 175177 obtenues par LW, la bourse de maîtrise des IRSC obtenue par MK et la bourse d’études Queen Elizabeth II en sciences et technologie (QEII-GSST) obtenue par la FSDB.
matériels
| Name | Company | Catalog Number | Comments |
| 0.1 µm vacuum filtration unit Filtropur V50 | Sarstedt | 83,3941,002 | |
| 0.22 µm Acrodisc Syringe Filter | Pall Corporation | PN4612 | |
| 1 mL syringe | Thermo Fisher Scientific | MB9204560TF-LAB | |
| 10 kDa Centricon Plus-70 Centrifugal Filter | Sigma | UFC701008 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| 96-well Flat Clear Bottom Black Polystyrene TC-treated Microplates | Costar | 3603 | |
| Agarose | Thermo Fisher Scientific | R0491 | |
| AKTA Fast Protein Liquid Chromatograph | GE Lifesciences | 29022094 | |
| BD PrecisionGlide Needle - 18G | BD Biosciences | 305196 | |
| Benzonase Nuclease | Sigma | E1014-25KU | |
| BioTek Synergy H1 Multimode Reader | BioTek | SH1M2G-SN | |
| Blue Juice Gel Loading Buffer | Invitrogen | 10816015 | |
| CaptoCore 700 resin | Cytiva | 17548102 | |
| Cellometer Auto 2000 Viability Counter | Nexcelom BioScience LLC | ||
| CryoStor CS10 freezing medium | Sigma | C2874 | |
| DPBS−/− | Fisher | BP399-1 | |
| Dual LED Blue/White Light Transilluminator | Invitrogen | LB0100 | |
| Duet P3202 Flow Control Pump | FiberCell Systems | ||
| Dulbecco's phosphate-buffered saline | Gibco | 14190250 | |
| Ethanol | Commercial Alcohols | P006EAAN | |
| Exosome-Depleted FBS | Gibco | A2720803 | |
| Fluorobrite DMEM | Gibco | A18967-01 | |
| Glucose meter | AccuCheck | Model 930 | |
| HiScale chromatography column 10/40 | Cytiva | 29360550 | |
| ImmunoCult-XF (GMP medium alternative) | StemCell Technologies | 100-0956 | |
| ImmunoCult-XF T Cell Expansion Medium | StemCell Technologies | 10981 | |
| Isopropyl Alcohol | EMD | PX1834-1 | |
| K562 cells | ATCC | CCL-243 | |
| LB media | BioBasic | SD7002 | |
| L-Lactate Assay Kit | Abcam | ab65331 | |
| Medium hollow-fibre cartridge | FiberCell Systems | C2011 | |
| MgCl2 | Sigma | M1028 | |
| Mycoplasma PCR detection kit | Abcam | ab289834 | |
| NanoSight NS300 | Malvern | ||
| NaOH | Supelco | SX0607N-6 | |
| NK92-MI cells | ATCC | CRL-2408 | |
| pH Strips-Mquant | Sigma | 1,09533 | |
| PrestoBlue HS Cell Viability Reagent Assay | Invitrogen | P50200 | |
| Qubit 4 Fluorometer | Invitrogen | ||
| Qubit dsDNA BR Assay Kit | Invitrogen | Q33262 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q33231 | |
| Qubit Flex Assay Tube Strips | Invitrogen | Q33252 | |
| Qubit Flex Fluorometer | Invitrogen | Q33327 | |
| Qubit Protein BR Assay Kit | Invitrogen | A50669 | |
| Quick Load 1Kb Plus DNA ladder | NEB | N0469S | |
| SYBRSafe DNA Gel Stain Invitrogen | Invitrogen | S33102 | |
| Syringe pump | Harvard Apparatus | 984730 | |
| Triton-X 100 | Sigma | T-9284 | |
| UltraPure TAE Buffer | Invitrogen | 15558042 | |
| ViaStain Acridine Orange and Propidium Iodide (AO/PI) Staining Solution | ESBE Scientific | CS2-0106 |
Références
- Cheng, M., Chen, Y., Xiao, W., Sun, R., Tian, Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 10 (3), 230-252 (2013).
- Sheridan, C. Industry appetite for natural killer cells intensifies. Nat Biotechnol. 41 (2), 159-161 (2023).
- Shimasaki, N., Coustan-Smith, E., Kamiya, T., Campana, D. Expanded and armed natural killer cells for cancer treatment. Cytotherapy. 18 (11), 1422-1434 (2016).
- Elsharkasy, O. M., et al. Extracellular vesicles as drug delivery systems: Why and how. Adv Drug Deliv Rev. 159, 332-343 (2020).
- St-Denis-Bissonnette, F., et al. Applications of extracellular vesicles in triple-negative breast cancer. Cancers. 14 (2), 451 (2022).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- St-Denis-Bissonnette, F., et al. A clinically relevant large-scale biomanufacturing workflow to produce natural killer cells and natural killer cell-derived extracellular vesicles for cancer immunotherapy. J Extracell Vesicles. 12 (12), e12387 (2023).
- Federici, C., et al. Natural-killer-derived extracellular vesicles: Immune sensors and interactors. Front Immunol. 11, 262 (2020).
- Lugini, L., et al. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 189 (6), 2833-2842 (2012).
- Zhu, L., et al. Novel alternatives to extracellular vesicle-based immunotherapy - exosome mimetics derived from natural killer cells. Artif Cells Nanomed Biotechnol. 46 (sup3), S166-S179 (2018).
- Cochran, A. M., Kornbluth, J. Extracellular vesicles from the human natural killer cell line NK3.3 have broad and potent anti-tumor activity. Front Cell Dev Biol. 9, 698639 (2021).
- Kim, H. Y., et al. Delivery of human natural killer cell-derived exosomes for liver cancer therapy: an in vivo study in subcutaneous and orthotopic animal models. Drug Deliv. 29 (1), 2897-2911 (2022).
- Alvarez-Erviti, L., et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 29 (4), 341-345 (2011).
- El-Sahli, S., et al. A triple-drug nanotherapy to target breast cancer cells, cancer stem cells, and tumor vasculature. Cell Death Dis. 12 (1), 8 (2021).
- Sulaiman, A., et al. Co-targeting bulk tumor and CSCs in clinically translatable TNBC patient-derived xenografts via combination nanotherapy. Mol Cancer Ther. 18 (10), 1755-1764 (2019).
- Farcas, M., Inngjerdingen, M. Natural killer cell-derived extracellular vesicles in cancer therapy. Scand J Immunol. 92 (4), e12938 (2020).
- Murphy, D. E., et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking. Exp Mol Med. 51, 1-12 (2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- FiberCell-Systems. . FiberCell systems user manual & quick start guide. , (2024).
- St-Denis-Bissonnette, F., et al. Evaluation of resazurin phenoxazine dye as a highly sensitive cell viability potency assay for natural killer cell-derived extracellular vesicle-based cancer biotherapeutics. J Extracell Biology. 3 (7), e166 (2024).
- Herrmann, I. K., Wood, M. J. A., Fuhrmann, G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol. 16 (7), 748-759 (2021).
- Andaloussi, E. L. A., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Federici, C., et al. Exosome release and low pH belong to a framework of resistance of human melanoma cells to cisplatin. PLoS One. 9 (2), e88193 (2014).
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4, 27066 (2015).
- Neviani, P., et al. Natural killer-derived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 79 (6), 1151-1164 (2019).
- Sun, H., et al. Natural killer cell-derived exosomal miR-3607-3p inhibits pancreatic cancer progression by targeting IL-26. Front Immunol. 10, 2819 (2019).
- Jiang, Y., et al. Engineered exosomes: a promising drug delivery strategy for brain disease. Curr Med Chem. 29 (17), 3111-3124 (2022).
- Dosil, S. G., et al. Natural killer (NK) cell-derived extracellular-vesicle shuttled microRNAs control T cell responses. Elife. 11, e76319 (2022).
- Geeurickx, E., et al. The generation and use of recombinant extracellular vesicles as biological reference material. Nat Commun. 10 (1), 3288 (2019).
- Nathani, A., et al. Combined role of interleukin-15 stimulated natural killer cell-derived extracellular vesicles and carboplatin in osimertinib-resistant H1975 lung cancer cells with EGFR mutations. Pharmaceutics. 16 (1), 83 (2024).
- Gobin, J., et al. Hollow-fiber bioreactor production of extracellular vesicles from human bone marrow mesenchymal stromal cells yields nanovesicles that mirrors the immuno-modulatory antigenic signature of the producer cell. Stem Cell Res Ther. 12 (1), 127 (2021).
- Sun, L., et al. A 3D culture system improves the yield of MSCs-derived extracellular vesicles and enhances their therapeutic efficacy for heart repair. Biomed Pharmacother. 161, 114557 (2023).
- Ryu, A. H., Eckalbar, W. L., Kreimer, A., Yosef, N., Ahituv, N. Use antibiotics in cell culture with caution: genome-wide identification of antibiotic-induced changes in gene expression and regulation. Sci Rep. 7 (1), 7533 (2017).
- Meng, W., et al. Prospects and challenges of extracellular vesicle-based drug delivery system: considering cell source. Drug Deliv. 27 (1), 585-598 (2020).
- Yang, Y., et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. J Transl Med. 19 (1), 104 (2021).
- Gamez-Valero, A., et al. Size-exclusion chromatography-based isolation minimally alters extracellular vesicles' characteristics compared to precipitating agents. Sci Rep. 6, 33641 (2016).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 178 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon