Method Article
자연 살해 세포 유래 세포외 소포체 기반 암 바이오치료제를 생산 및 분리하기 위한 확장 가능한 바이오제조 워크플로우
* 이 저자들은 동등하게 기여했습니다
요약
자연살해세포유래 세포외 소포체(NK-EV)는 암 바이오치료제로서 유망한 잠재력을 가지고 있습니다. 이 방법론 기반 연구는 대량의 고순도 NK-EV를 지속적으로 생산하고 분리하도록 설계된 확장 가능한 폐쇄 루프 바이오제조 워크플로를 제시합니다. 공정 중 제어 테스트는 바이오 제조 워크플로 전반에 걸쳐 수행되어 EV가 제품 출시를 위한 품질 표준을 충족하는지 확인합니다.
초록
자연살해세포유래 세포외소포체(NK-EV)는 암 생물치료제로 연구되고 있습니다. 이들은 암세포를 표적으로 하는 세포독성 나노소포체(cytotoxic nanovesicle)와 면역조절 전달체(immunomodulatory communicator)로서 독특한 특성을 가지고 있습니다. 확장 가능한 바이오제조 워크플로우를 통해 전임상 및 임상 요구 사항을 충족하기 위해 대량의 고순도 NK-EV를 생산할 수 있습니다. 이 워크플로우는 폐쇄 루프 중공사 바이오리액터를 사용하여 우수제조관리기준(Good Manufacturing Practices) 표준에 따라 무혈청, 무이종, 공급기 및 항생제가 없는 조건에서 NK92-MI 세포주에서 NK-EV를 지속적으로 생산할 수 있습니다. 이 프로토콜 기반 연구는 크기 배제 크로마토그래피, 한외여과 및 필터 기반 멸균을 사용하여 NK-EV를 분리하기 위한 바이오제조 워크플로우를 간략하게 설명합니다. 필수 NK-EV 제품 특성화는 나노 입자 추적 분석을 통해 수행되며, 암세포에 대한 검증된 세포 생존율 기반 효능 분석을 통해 그 기능을 평가합니다. 이 확장 가능한 바이오 제조 공정은 모범 사례를 준수하고 재현성을 보장함으로써 NK-EV 기반 암 바이오 치료제의 임상 번역을 발전시킬 수 있는 상당한 잠재력을 가지고 있습니다.
서문
21세기에는 암과의 전쟁에서 놀라운 발전이 이루어졌습니다. 이는 주로 면역 체계를 활용하여 암과 싸우는 약물 종류인 암 면역 요법의 부상에 기인합니다. 자연살해세포 유래 세포외 소포체(NK-EV)는 면역 요법의 확장 영역에서 유망한 경쟁자입니다. 선천성 면역 및 적응 면역에 통합된 NK 세포는 바이러스에 감염된 세포, 스트레스를 받은 세포, 악성 세포에 대한 신체의 방어에 중요한 역할을 합니다. 그들은 세포 독성 수단을 통해 비정상적인 세포를 제거하기 위해 포괄적 인 항암 기계를 사용합니다 1,2,3. 이러한 메커니즘 중에는 단백질, RNA 및 DNA와 같은 다양한 생체 분자를 포함하는 나노 스케일 이중층 구조인 EV의 생산 및 분비가 있으며, 이는 세포 간 통신을 촉진하는 데 중요합니다 4,5,6. NK-EV는 고유한 운반체 특성으로 인해 유망한 무세포 치료제로 부상하고 있습니다. 여기에는 작은 크기, 필터 기반 멸균 가능, 높은 생체 적합성, 종양 내 우선적 축적, 광범위한 화물 전달 스펙트럼, 혈액-뇌 장벽과 같은 생물학적 장벽을 극복할 수 있는 능력 및 최소 독성 프로필이 포함됩니다. 몇 가지 이유로, NK-EV는 투여 전에 화학요법을 통해 환자의 림프구 고갈의 필요성을 없애줍니다: 1) 전통적으로, 림프구 고갈은 세포 기반 치료를 위한 보다 호의적인 환경을 조성하기 위해 사용되며, 주입된 세포가 증식하고 치료 효과를 발휘할 수 있도록 합니다. 2) 세포와 달리 EV는 복제 능력이 부족하고 규모가 상당히 작습니다. 3) EV는 뚜렷한 메커니즘을 통해 작동하며 세포에 비해 면역원성이 감소합니다 5,6,7. 또한, NK-EV는 다양한 암 모델에 대해 지속적으로 체외 효능을 보였으며, 항암 반응을 촉진하는 면역 세포에 대한 면역 조절 효과도 보여주었습니다 8,9. 생체 내 결과는 이러한 결과를 뒷받침하며, NK-EV 치료 후 암 퇴행과 무시할 수 있는 독성을 보여줍니다 10,11,12. 따라서 NK-EV 기반 치료제는 면역학적으로 불활성인 차가운 고형 종양을 치료하는 데 있어 어려움을 해결할 수 있는 큰 가능성을 가지고 있습니다 13,14,15,16,17.
우리의 최근 연구는 바이오 제조를 통한 NK-EV의 임상 번역에 대한 심각한 병목 현상을 해결합니다7. 이 기사는 공정 중 품질 관리 테스트를 보장하기 위해 세심하게 설계된 NK-EV의 비용 효율적이고 확장 가능한 바이오제조 워크플로에 대한 개념 증명을 제시합니다. 이 접근법은 MISEV2018 가이드라인18에 따라 철저한 제품 특성화를 통해 대량의 고순도 NK-EV 기반 암 바이오치료제를 지속적으로 생산했다. 바이오제조 워크플로우의 확장성은 카트리지 크기를 늘리거나 여러 바이오리액터를 병렬로 실행함으로써 달성할 수 있습니다. 마찬가지로, EV 분리 워크플로우의 확장성은 FPLC(Fast Protein Liquid Chromatography) 기반 크기 배제 크로마토그래피(SEC), 한외여과(UF) 및 필터 기반 멸균과 같은 기술을 사용하여 쉽게 달성할 수 있습니다. 폐쇄 루프 중공사 생물반응기(HFB) 시스템은 혈청 보충, 공급기 시스템 및 항생제 없이 IL-2 자급자족 NK 세포주(NK92-MI 세포)를 성장시켰습니다. 이는 상업적으로 이용 가능한 화학적으로 정의되고 이종이 없는 배지(GMP 버전은 현재 상업적으로 이용 가능함)를 사용하여 수행되었습니다. 그 결과, 단일 중형 바이오리액터 카트리지를 사용하여 대량의 NK 세포(109 생존 세포)와 NK-EV(1012 EV)를 5-7일 이내에 성공적으로 생산할 수 있었으며, 두 제품 모두 광범위하게 특성화되었습니다. 바이오제조 공정 전반에 걸쳐 pH, 포도당 및 젖산 수치와 같은 정량화 가능한 지표와 함께 세포 및 EV 품질의 필수 예측 변수인 매체 색상 및 오염 징후와 같은 시각적 지표를 사용하여 세포 건강을 매일 모니터링했습니다. HFB 시스템에서 생성된 NK 세포 생존력 및 기능, 특히 세포 독성에 대한 수확 후 평가는 플라스크 기반 배양에 비해 상당한 개선을 보여주었습니다7. 마찬가지로, 정제된 NK-EV는 박테리아, 마이코플라스마, 일반적인 바이러스 실체 및 세포 성분이 없고 내독소 수치가 무시할 수 있는 높은 순도 프로파일을 나타냈습니다. 중요한 것은 정제된 NK-EV가 최종 제품에서 발견되는 모든 나노 입자의 99.9% 이상을 차지한다는 것입니다7. 마지막으로, 이러한 정제된 NK-EV는 표면 마커(CD2, CD45, CD56), 사이토카인 페이로드(GzmB, PFN, IFN-g)를 포함한 주요 NK 특성을 유지했으며, NK 세포 독성 7을 평가하기 위한 황금 표준 라인인 백혈병 K562 세포에 대해 강력한 세포 독성을 입증했습니다.
본 프로토콜은 위에서 논의한 확장 가능한 바이오제조 워크플로우를 자세히 설명합니다. FPLC-SEC와 UF 및 필터 기반 멸균을 결합하여 생산된 NK-EV를 분리하는 방법론을 설명합니다. 또한 이 프로토콜은 나노입자 추적 분석(NTA)을 사용한 제품 특성화, 다양한 도구(단백질/dsDNA 정량 분석 및 미생물 검사)를 사용한 품질 평가, 세포 생존율 분석을 통한 암세포에 대한 정제된 NK-EV 제품의 기능 검증을 포함한 중추적인 단계를 설명합니다. 일반적으로 이 워크플로우는 평균 농도가 1.18 x 1012 EVs/mL7인 1.0 - 1.5mL의 NK-EV 제품을 생성하며, 약 40mL의 EV-rich CM을 기준으로 최소 1 x 1012 EV를 산출합니다. 이 프로세스를 통해 대량의 고품질 EV를 요구하는 연구, 전임상 및 다중 오믹스(단백질체학, 전사체학, 유전체학, 대사체학, 지질체학 및 후성유전체학) 연구와 같은 다양한 다운스트림 응용 분야에서 제품을 출시할 수 있으며 입증된 재현성을 갖춘 임상 번역 잠재력을 보유하고 있습니다.
프로토콜
1. 폐쇄 루프 생물 반응기를 사용한 NK92-MI 세포에서 NK-EV 바이오 제조
참고: NK-EV는 GMP(Good Manufacturing Practices)를 준수하고 NK92-MI 셀을 활용하는 확장 가능한 바이오제조 워크플로를 사용하여 제조됩니다( 그림 1 참조). 최근 발간된 간행물에는 바이오제조 절차와 NK-EV 제품의 정체성 및 안전성 프로파일에 대한 자세한 통찰력이 담겨 있습니다7.
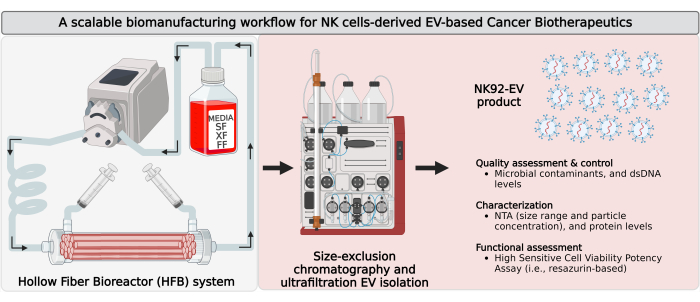
그림 1: 확장 가능한 분리 워크플로우를 갖춘 폐쇄 루프 중공사 생물반응기(HFB)에서 자연살해세포 유래 세포외 소포체(NK-EV)의 바이오제조. 대량의 고순도 NK-EV 제품을 생산하기 위한 바이오제조 워크플로우의 개략도. IL-2 자급자족 NK92-MI 세포는 폐쇄 루프 HFB 카트리지에 파종되고 무혈청(SF), 무균(XF), 무공급(feeder-free) 및 무항생제 조건에서 배양된 후 지속적인 EV가 풍부한 컨디셔닝 배지 수집을 위해 성장합니다. EV가 풍부한 CM에서 NK-EV 분리는 한외여과(UF)와 결합된 Fast Protein Liquid Chromatography 기반 크기 배제 크로마토그래피(FPLC-SEC)에 의해 수행됩니다. NK-EV는 여러 분석을 통해 특성화 및 평가되며, K562 백혈병 세포에 대한 기능은 생존력 효능 분석을 사용하여 평가됩니다. 이 그림은7(Biorender.com 로 생성됨)에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 1 - 5 x 106 NK92-MI 세포에서 시작하여 3 - 8 x 105 cells/mL 사이의 세포 밀도를 유지하고 예열된 배양 배지를 사용하여 T25 - T175 플라스크에서 세포를 배양합니다. 37 ° C에서 5 % CO2 로 배양하십시오 ( 재료 표 참조). 1 x 108 NK92-MI 세포가 최소 70%의 생존율을 가질 때까지 2 - 3일마다 배지를 교체합니다.
참고: 세포를 다시 파종할 때 유리한 성장 인자를 포함하고 있으므로 조절된 배지(CM)의 1/5th-1/3rd 를 유지하십시오. - 아래와 같이 중간 HFB 카트리지 준비 및 NK 세포 접종을 수행합니다.
참고: 모든 조작은 멸균을 보장하고 유지하기 위해 클래스 II 생물 안전 캐비닛 내에서 수행해야 합니다. 카트리지 시스템을 생물 안전 캐비닛으로 옮기기 전에 70% 에탄올을 넉넉하게 분사하고 저장소 병목 현상과 주사기 연결부에 특히 주의하십시오.- 아래 설명된 대로 제조업체의 지침19 ( 재료 표 참조, 그림 2 참조)에 따라 HFB 카트리지를 준비합니다.
- Luer Lock 연결부를 왁스 필름으로 감싸고 제조업체의 지침에 따라 펌프 유량을 조정하십시오19. 150mL의 멸균 인산염 완충 식염수(PBS, 재료 표 참조)가 최소 5일 동안 순환하도록 하여 HFB 카트리지를 컨디셔닝합니다.
- 세포 외 모세관 공간(ECS, 부피는 약 29mL)에서 공기를 제거하려면 왼쪽 ECS 포트를 통해 약 40mL의 PBS를 주입하고 공기가 오른쪽 ECS 포트를 통해 빠져나가도록 합니다. 그렇게 하는 동안 왼쪽 및 오른쪽 끝 포트 cl을 닫습니다.amps. 주사기가 항상 왼쪽 및 오른쪽 ECS 포트에 연결되어 있는지 확인합니다.
- 완료되면 37 °C 및 5% CO2로 설정된 인큐베이터 내부의 흐름 펌프(재료 표 참조)에 카트리지를 놓습니다. 순환 후 며칠 후에 누출이 없는지 확인하십시오.
- PBS를 저장소 병에 150mL의 배양 배지로 교체하고 세포를 카트리지에 파종하기 2일 전에 ECS를 교체합니다. 배양 배지를 사용하여 이전 컨디셔닝 단계(단계 1.2.1)를 반복하되 순환 2일 동안 반복합니다.
- 세포를 파종하기 전에 저장 용기와 ECS의 내용물을 250mL의 신선한 배양 배지로 교체합니다.
- 인큐베이터에서 배양 플라스크를 가져와 세포를 50mL 튜브로 옮깁니다. 300 x g 에서 5분 동안 회전합니다. 21mL의 배양 배지를 사용하여 세포 펠렛을 재현탁합니다.
- 자동 세포 계수기에서 세포 계수를 위해 세포 현탁액에서 각각 20.5μL의 부분 표본 2개를 준비합니다( 재료 표 참조). 각 20.5μL 세포 현탁액 분취액에 동일한 양의 AO/PI 염료( 재료 표 참조)를 추가하고 최소 10회 위아래로 혼합합니다.
참고: 정확한 NK 세포 계수를 위해 Trypan Blue를 권장하지 않습니다. 또는 수동 계수를 위해 혈구계를 사용하십시오. - 계수 슬라이드의 각 계수 챔버에 20 μL를 로드하고 적절한 프로그램을 사용하여 자동 세포 계수를 수행합니다. 평균 살아있는 세포 농도를 계산하고 생존력을 기록합니다.
- NK 세포 용액을 몇 번 혼합한 후 20mL 주사기와 18G 바늘을 사용하여 흡입하여 무균 상태를 유지합니다. 이 용액은 약 20mL 또는 약 5 x 106 cells/mL에 약 1 x 108 살아있는 NK 세포를 포함해야 합니다.
- 주사기에서 바늘을 제거한 후 왼쪽 ECS 포트를 통해 NK 세포를 카트리지에 부드럽게 주입합니다. 카트리지 전체에 걸쳐 세포가 균일하게 분산되도록 하려면 왼쪽 및 오른쪽 ECS 포트에 연결된 주사기를 사용하여 세포 용액을 최소 10회 부드럽게 왕복 운동합니다.
참고: 용액은 두 주사기에서 동일한 탁도를 가져야 하며 왼쪽 및 오른쪽 끝 포트가 닫혀 있어야 합니다. - 왼쪽 및 오른쪽 끝 포트를 열고 주사기 내에 남아 있는 것을 주입합니다. 클램프를 사용하여 왼쪽 및 오른쪽 ECS 포트를 닫습니다.
- 카트리지를 인큐베이터로 옮기고 유량 펌프에 제대로 설치하기 전에 30분 동안 그대로 두십시오. 바이오 제조를 위해 카트리지를 그대로 두십시오. 제조업체에 따라 유량을 조정하십시오.
- 세포 건강 지표를 모니터링하려면 저장소 병에서 완전히 혼합된 배지에서 매일 0.5mL의 배지 부분 표본을 획득하고 포도당 및 pH 수준을 확인한 후 -20°C에서 보관합니다. L-젖산 수치는 나중에 확인할 수 있습니다( 재료 표 참조).
- 1 - 2일마다 저장소(250 - 500 mL)의 배지를 교체하여 포도당 함량을 배지에서 발견되는 초기 수준의 50% 이상으로 유지하고 pH를 7.0 이상(7.0 - 8.0 범위)으로 유지합니다.
- 아래 설명된 대로 제조업체의 지침19 ( 재료 표 참조, 그림 2 참조)에 따라 HFB 카트리지를 준비합니다.
- 아래 설명된 대로 카트리지를 처음 파종할 때 1일 휴식 후 매일 NK-EV가 풍부한 CM 수집을 수행합니다.
- 카트리지 시스템을 생물 안전 캐비닛으로 이동합니다. 왼쪽 ECS 포트를 통해 약 21mL의 배양 배지를 부드럽게 주입하여 오른쪽 ECS를 통해 동일한 부피의 EV가 풍부한 CM을 밀어 넣습니다(혼합하지 마십시오)( 그림 3 참조).
알림: 오염을 방지하기 위해 항상 새 플라스틱 용기를 사용하십시오. - EV가 풍부한 CM 용액을 50mL 튜브에 넣고 300 x g 에서 5분 동안 원심분리합니다. 한편, 카트리지 시스템을 유량 펌프의 인큐베이터로 다시 이동합니다.
- 상층액을 새 튜브로 옮기고 2000 x g 에서 10분 동안 원심분리합니다. 다시 상층액을 새 튜브로 옮깁니다. 그런 다음 EV가 풍부한 CM을 3, 50 mL 튜브(~7 mL/튜브)에 균등하게 분취하고 추가 처리까지 -80 °C에서 보관합니다.
참고: 순차적으로 수확된 EV가 풍부한 CM은 이 3개의 튜브에 걸쳐 풀링되어 3개의 기술 복제 샘플 튜브를 생성합니다.
- 카트리지 시스템을 생물 안전 캐비닛으로 이동합니다. 왼쪽 ECS 포트를 통해 약 21mL의 배양 배지를 부드럽게 주입하여 오른쪽 ECS를 통해 동일한 부피의 EV가 풍부한 CM을 밀어 넣습니다(혼합하지 마십시오)( 그림 3 참조).
- HFB-NK 세포 수확을 수행하여 아래 설명된 것과 동일한 HFB 카트리지를 사용하여 EV가 풍부한 CM을 계속 생산합니다.
참고: 카트리지가 합류점(최대 1 x 109 셀)에 도달하면 HFB-NK 세포 수확 프로토콜"을 수행하여 HFB의 ECS에서 NK 세포를 수확할 수 있습니다. 이는 각 로트에 대해 5-7일 후 또는 포도당 함량이 연속 2일 동안 혈당 측정기의 검출 한계 미만인 경우(예: 판독값 없음 또는 ~ 0의 판독값) 발생합니다. 이것이 최종 세포 수확인 경우, PBS를 배지로 대체하여 카트리지를 플러시하고 세포를 회수할 수 있습니다.- 위의 1.3단계에서 자세히 설명한 대로 EV가 풍부한 CM을 정확히 수확합니다.
- 왼쪽 ECS 포트를 통해 약 50mL의 배지를 주입합니다. 카트리지 전체에서 균일한 세포 분산을 보장하려면 왼쪽 및 오른쪽 ECS 포트에 연결된 주사기를 사용하여 세포 용액을 앞뒤로 10회 이상 부드럽게 밀어 세포를 느슨하게 한 후 궁극적으로 오른쪽 ECS 포트를 통해 주사기로 세포를 밀어 넣습니다. 수확된 EV가 풍부한 CM을 50mL 튜브로 옮깁니다. 지금은 37°C(수조 또는 인큐베이터)로 두십시오.
참고: 푸시백 작용은 세포가 완전히 배출되어 오른쪽 ECS 포트를 통해 주사기에 의해 수집되기 전에 세포를 제거하는 데 도움이 됩니다. 용액은 두 주사기에서 동일한 탁도를 가져야 하며 왼쪽 및 오른쪽 끝 포트가 닫혀 있어야 합니다. 바이오리액터 카트리지를 두드리면(물리적 교란) 카트리지 하단의 세포 클러스터를 선제적으로 제거하는 데 도움이 될 수 있습니다. 세포 현탁액의 공격적인 역-전 혼합은 회수된 세포의 생존력에 부정적인 영향을 미칠 수 있습니다. 생존 능력을 극대화하기 위해 주의와 인내심을 발휘해야 합니다. - 마지막 단계를 2회 반복합니다. 총 150mL의 세포 현탁액을 회수해야 합니다. 300 x g 에서 5분 동안 원심분리기 상층액을 버립니다.
- 두 세포 펠릿을 각각 20mL의 신선한 배지에 재현탁시키고 결합합니다. 자동 세포 계수기에서 세포 계수를 위해 각각 20.5μL의 세포 현탁액으로 구성된 두 개의 부분 표본을 수집합니다( 재료 표 참조).
참고: 일반적으로 PBS를 희석제로 사용하는 수많은 세포 희석이 세포 계수기의 동적 범위 내에 있어야 합니다. - 20.5μL 세포 현탁액 분취액에 동일한 양의 AO/PI 염료( 재료 표 참조)를 추가하고 10회 이상 위아래로 혼합합니다. 계수 슬라이드의 각 계수 챔버에 20 μL를 로드하고 적절한 프로그램을 사용하여 자동 세포 계수를 수행합니다.
- 모든 희석 보정된 계수의 살아있는 세포 농도를 평균화하고, 살아있는 세포의 총량을 결정하고, 생존율을 기록합니다. 위에서 자세히 설명한 바와 같이 동일한 바이오리액터 카트리지를 사용하여 EV가 풍부한 CM을 지속적으로 생산하려면 1 x 108 HFB로 생산된 NK 셀을 다시 시드합니다.
참고: 원하는 경우 HFB에서 생산된 NK 세포는 동결 속도를 제어하기 위해 동결 보존 동결 매체와 동결 용기를 사용하여 저장할 수 있습니다( 재료 표 참조).

그림 2: HFB(Hollow-Fiber Bioreactor) 시스템 구성 요소 및 설정. 저장 용기(1)에는 펌프 튜브(3)에 작용하는 연동 펌프(표시되지 않음)의 작용에 의해 생물 반응기 카트리지(2)를 통해 순환하는 완전한 매체가 포함되어 있습니다. 세포는 왼쪽(4) 및 오른쪽(5) ECS 측면 포트를 통해 세포외 모세혈관 공간(ECS)으로 유입됩니다. ECS 슬라이드 클램프가 닫히면 왼쪽(6) 및 오른쪽(7) 끝 쪽 포트가 열려 매체가 시스템 전체를 순환할 수 있습니다. 잠재적인 오염을 방지하기 위해 중간 병의 저장 탱크 캡 근처에 있는 Luer Lock 연결부에 왁스 필름이 추가된 것을 확인하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
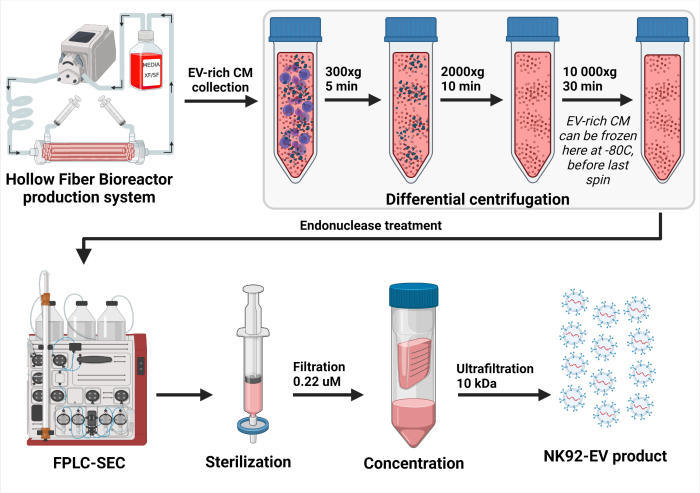
그림 3: NK-EV 절연 프로세스의 개략도. EV가 풍부한 컨디셔닝 배지(CM)를 매일 채취한 후, 세포(300 x g 에서 5분 동안 첫 번째 스핀)와 세포 파편(10분 동안 2000 x g 에서 두 번째 스핀)을 제거하기 위해 용액을 차등 원심분리했습니다. 투명화된 EV-rich CM은 추가 처리까지 -80°C에서 보관되었습니다. NK-EV 분리 준비가 되면 세포 파편을 제거하기 위해 동결된 EV가 풍부한 CM을 한 번 더 해동 및 원심분리합니다(10,000 x g 에서 30분 동안 3차 탈수). 그런 다음, EV가 풍부한 CM을 37°C에서 2 - 4시간 동안 엔도뉴클레아제로 처리하여 숙주 세포 오염 물질로 간주되는 핵산을 분해합니다. 다음으로, EV가 풍부한 CM은 바이모달 수지를 사용한 EV 정제를 위해 FPLC-SEC(Fast Protein Liquid Chromatography-based size-exclusion chromatography)로 처리됩니다. 약 10 - 15 mL의 용리 분획을 0.22 μM 필터와 결합 및 여과하여 최종 NK-EV 제품의 멸균성을 보장합니다. 한외여과를 통해 제품을 약 35 - 50배 농도로 농축할 수 있으며, 1 x 1012 EVs/mL 이상, 총 1.0 - 1.5mL의 농도를 보장합니다. 이 그림은7(Biorender.com 로 생성됨)에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. UF 및 필터 기반 살균과 결합된 FPLC-SEC에 의한 NK-EV 정제
- 다음 용액을 준비하고 0.1μm 필터( 재료 표 참조)를 사용하여 두 번 여과합니다: 물(전도도 0mS/cm), PBS: 10x PBS 50mL + 물 450mL(전도도 약 14.7mS/cm), 20% 에탄올, 세척액(물 중 0.5M NaOH 및 30% 이소프로필 알코올).
- 제조업체의 지침에 따라 FPLC 시스템 초기화를 수행합니다( 재료 표 참조). 제조업체의 지침에 따라 실행 전 및 사후 CIP(Clean-in-Place) 단계를 수행합니다. 모든 라인과 컬럼 수지를 세척하고 이중 여과수(DF), 세척액, DF-물 및 DF-PBS를 사용하여 헹굽니다.
참고: 필요한 경우 CIP를 다른 날에 수행할 수 있다는 점은 주목할 가치가 있습니다. - 베드 높이가 20cm인 바이모드 레진( 재료 표 참조)으로 패킹된 크로마토그래피 컬럼을 사용합니다. 드립-투-드립 방법을 사용하여 컬럼 내부에 공기가 유입되지 않도록 연결합니다.
- 적절한 분획 분취기(fraction collector)를 적절한 분취 튜브로 설정하고 분획 설정을 원하는 분취 부피(예: 15mL)로 변경합니다. 전체 샘플 부피를 수집하기 위해 충분한 튜브와 두 개의 추가 튜브를 배치합니다.
- 아래 설명된 대로 샘플 준비를 수행합니다.
- -80 °C 냉동고에서 EV가 풍부한 CM 40 - 80 mL를 취하고 37 °C에서 빠르게 해동합니다. 샘플을 초원심분리기에 넣고 10,000 x g 에서 4°C에서 30분 동안 회전합니다.
알림: 튜브는 부피가 아닌 무게에 의해 정확하게 균형을 이루어야 합니다. - 회전 후 상등액을 모아 새 튜브로 옮깁니다. dsDNA 수치를 낮추기 위해 EV가 풍부한 CM을 50 U/mL의 엔도뉴클레아제와 1.5 mM의 MgCl2 로 처리하십시오( 재료 표 참조). 인큐베이터(37 °C)에서 2 - 4시간 동안 배양하여 적당히 혼합할 수 있습니다.
- -80 °C 냉동고에서 EV가 풍부한 CM 40 - 80 mL를 취하고 37 °C에서 빠르게 해동합니다. 샘플을 초원심분리기에 넣고 10,000 x g 에서 4°C에서 30분 동안 회전합니다.
- 시스템(라인 및 컬럼)이 EV 분리를 위한 준비가 되면 EV가 풍부한 CM을 60mL 주사기에 로드하고 샘플 라인에 연결합니다. Manual Run(수동 실행 )을 클릭하여 시스템을 시작하고 유량을 0으로 설정합니다. 소프트웨어 지시에 따라 실행을 미리 저장한 다음 Start(시작)를 클릭합니다.
- 라인 B(DF-PBS)를 선택하고 150cm/h의 유속(2.0mL/분의 유속)으로 실행합니다. 솔루션이 열을 통과하는지 확인합니다.
- 전도도가 안정화되면 Auto Zero UV를 누릅니다. 유동 경로를 변경하여 샘플이 컬럼 앞의 폐기물 병으로 향하도록 합니다. 시스템에 기포가 유입되지 않았는지 확인하십시오.
- 최대 5 - 20초 후에 샘플을 컬럼으로 보냅니다. UV 판독값이 약 230mAU에 도달하면 분별을 클릭합니다.
- 시료가 시스템을 통해 완전히 주입되면 버퍼 시스템을 DF-PBS(시료 밸브에서)로 전환하여 정제를 계속합니다. UV 값이 약 1600mAU에 도달하면 Fractionation(분별) 을 다시 클릭합니다.
알림: 이것은 UV 판독값과 전도도 판독값 사이의 교차점에 해당합니다. 더 긴 분별은 EV 수율을 증가시키지 않고 잔류물만 희석시킵니다. - 모든 분획물(희석된 NK-EV)을 결합하고 필터 기반 멸균 및 한외여과(UF)가 준비될 때까지 4°C에서 보관합니다.
- UV 값이 약 1000mAU에 도달할 때까지 DF-PBS를 계속 실행합니다. 그런 다음 실행을 중지하고 크로마토그램을 PDF 문서로 저장합니다.
3. NK-EV 제품 UF에 의한 필터 기반 살균 및 농축
- 원심분리기를 10°C로 식힙니다. UF 장치의 모든 구성 요소( 재료 표 참조)를 20 - 30mL의 90% 에탄올로 헹궈 소독합니다. 4000 x g 에서 5 - 10분 동안 회전합니다.
참고: 필터는 10kDa MWCO 재생 셀룰로오스로 만들어졌습니다. - 흐름을 버리고 멸균 PBS를 사용하여 헹굼을 반복하여 장치를 평형화합니다. 총 2번 반복합니다.
- 멸균성을 최대화하려면 DF-PBS가 미리 적신 0.22μm 주사기 필터를 사용하여 희석된 NK-EV 용액을 여과합니다( 재료 표 참조). 여과액을 멸균된 농축 장치에 직접 수집합니다.
- 4000 x g 에서 15 - 40분 동안 회전합니다(회전 시간은 샘플에 따라 다름). 회전 후 혈청학적 피펫을 사용하여 상단 필터 구획 내에서 용액을 혼합합니다. 4000 x g 에서 추가로 10분 동안 회전합니다.
참고: 혼합 단계는 EV에 의해 멤브레인이 막히는 것을 방지하여 농축 단계를 완화하기 때문에 선택 사항입니다. - 플로우 스루를 임시로 보관하고 여과 장치를 뒤집어 수집 장치에 부착하여 NK-EV 샘플을 수집합니다.
- 2000 x g 에서 2분 동안 회전합니다. 정제된 NK-EV 제품을 2mL 튜브에 넣습니다. 정제된 NK-EV 제품은 단기(≤ 7일) 4°C에서 보관하거나 -20°C에서 냉동 보관하여 장기간 사용하십시오.
4. 나노입자 추적 분석(NTA)에 의한 NK-EV 특성화
- 용액을 준비하고 0.1μm에서 두 번 여과합니다( 재료 표 참조): 물, PBS, 세척액(물 중 10% 표백제(주의)).
- 제조업체의 지침에 따라 NTA 시스템을 시작하십시오. 마찬가지로, 실행 전 및 사후 CIP(Clean-in-Place) 단계를 수행합니다. 모든 라인을 세척하고 이중 여과수(DF), 세척액 및 DF 물을 사용하여 헹굽니다. DF-PBS를 사용하여 선을 평형화합니다.
- 플로우 셀을 확인하고 기포를 확인합니다. 거품이 있는 경우 제거합니다. 깨끗해지면 플로우 셀(flow cell)을 NTA 기기에 조심스럽게 다시 삽입합니다.
알림: 제조업체에서 권장하지는 않지만 제거하기 매우 어려운 기포는 20% 에탄올로 헹군 다음 DF-물로 쉽게 제거할 수 있습니다. - 플로우 셀이 설치되고 도어가 닫히면 카메라 시작을 클릭합니다. 선이 DF-PBS로 채워지면 화면에 절대 최소 입자 수가 표시되어야 합니다.
- 캡처 설정을 화면 게인 2와 카메라 수준 14로 변경합니다. 또한 히터를 켜서 플로우 셀의 온도를 안정화합니다.
- 표준 측정을 클릭하여 SOP 탭 아래에 30입자/프레임 및 23°C의 유속으로 1분 동안 하나의 캡처를 수집하기 위한 스크립트를 만듭니다.
- 바로 아래에서 폴더 및 파일 이름을 경로 이름에 추가하여 데이터를 저장합니다.
- DF-PBS를 이용하여 정제된 NK-EV 제품의 희석액을 미리 준비한다. NTA를 실행할 때 정확한 정량화에는 30 - 80 입자/프레임이 필요합니다.
- 주사기에 넣기 전에 샘플을 볼텍스합니다( 재료 표 참조).
- 1mL 수집 주사기를 기기 로딩 라인에 조심스럽게 연결합니다. 공기는 수집 및 분석에 부정적인 영향을 미치므로 존재해서는 안 됩니다. 주사기에 약 0.5mL를 남겨두고 샘플의 절반을 천천히 밀어 넣습니다.
- 입자가 화면에 보이면 각 입자 주위에 최대 하나의 후광이 있도록 카메라의 초점을 맞춥니다. 하드웨어 탭에서 5초 동안 1000의 속도로 주입 을 클릭합니다. 그런 다음 30의 비율로 낮추십시오.
- Run Script를 누르고 프롬프트를 따릅니다. 소프트웨어는 온도가 설정되었는지 확인하고 설정이 올바른지 묻습니다. 예를 클릭하고 화면의 지시를 따릅니다.
- 캡처를 완료한 후 소프트웨어가 파일을 처리하거나 내보내도록 요청하면 취소 를 클릭합니다. 하드웨어 탭에서 Infuse 를 10 - 15초 동안 1000의 속도로 클릭합니다. 그 동안 히터와 카메라를 다시 켜십시오. 그런 다음 입자가 움직일 때까지 속도를 30으로 낮춥니다.
- 이전 단계를 반복하여 캡처를 4개 더 수집합니다. 희석액당 총 5개의 캡처가 기록되면 5개의 캡처를 모두 가져온 후 분석을 수행합니다.
- 강조 표시하여 처리할 파일을 선택합니다. 선택한 파일 처리를 클릭합니다. Process 탭에서 분석 설정을 화면 게인 2와 감지 임계값 15로 조정합니다.
설정은 샘플에 따라 다릅니다. 프레임당 30 - 80개의 파티클이 보이는지 확인합니다. - 분석을 위해 확인을 선택하고 클릭합니다.
- 파일이 처리되면 소프트웨어에서 파일을 내보내도록 요청합니다. 추가 상자를 클릭하지 않고 예를 클릭하거나 내보내기를 클릭합니다.
- 모든 EV 희석 또는 샘플에 대해 반복합니다. 모든 샘플이 완료되고 CIP가 완료된 후 NTA 기기를 종료합니다.
5. 품질 보증 테스트
- 1) 소량의 정제된 NK-EV를 고압 증기멸균 LB 배지에 스파이크하고, 2) 소량의 정제된 NK-EV를 마이코플라스마 PCR 검출에 사용합니다( 표 참조).
- 테스트 1: 양성 및 음성 대조군이 포함된 최대 5일 동안 37°C에서 LB 배지를 배양합니다. 필요한 경우 OD600을 기록합니다.
- 테스트 2: 제조업체의 프로토콜에 따라 마이코플라스마 PCR 검출을 수행합니다.
- 제조업체의 지침에 따라 형광측정기 기반 분석을 사용하여 정제된 NK-EV 희석액에서 단백질 및 dsDNA를 정량화합니다( 재료 표 참조).
6. 검증된 고감도 레사주린 기반 세포 생존율 분석을 이용한 NK-EV 처리암세포의 효능 평가 20
- 효능 분석을 수행하기 전에 며칠 동안 10% 열 비활성화 FBS가 포함된 RPMI-1640을 사용하여 인간 K562 백혈병 세포를 배양합니다( 재료 표 참조). 2 - 8 x 105 cells/mL 사이의 밀도를 유지하고 2 - 3일마다 배지를 교체합니다.
- 96웰 평평한 바닥 플레이트( 재료 표 참조)를 확보하고 정규화 목적에 필요한 분석 매체(5% EV 공핍 FBS로 보충됨)의 부피를 선제적으로 추가합니다( 재료 표 참조). 최종 부피는 150μL/well입니다.
알림: 리피터 피펫터를 사용하여 well-to-well 변동을 줄이십시오. - 세포 배양을 획득하고 세포를 튜브로 옮깁니다. 300 x g 에서 5분 동안 회전합니다. 2 - 5 mL의 분석 배지를 사용하여 세포 펠릿을 단일 세포 용액으로 재현탁합니다.
- 자동화된 세포 계수기에서 세포 계수를 위해 세포 현탁액 20.5μL의 부분 표본을 수집합니다( 재료 표 참조).
- 20.5μL 세포 현탁액 분취액에 동일한 양의 AO/PI 염료( 재료 표 참조)를 추가하고 10회 이상 위아래로 혼합합니다.
참고: 정확한 세포 계수를 위해 AO/PI를 권장합니다. 또는 수동 계수를 위해 혈구계를 사용하십시오. - 계수 슬라이드의 각 계수 챔버에 20 μL를 로드하고 적절한 프로그램을 사용하여 자동 세포 계수를 수행합니다. 살아있는 세포 농도를 평균하고 생존율을 기록합니다.
- 약 1 x 106 세포를 2차 튜브로 전달합니다. 세포를 정확히 7mL의 분석 배지로 희석하고 세포 계수를 반복합니다. 농도는 약 1.2 - 1.5 x 105live cells/mL여야 합니다.
- 위에서 자세히 설명한 대로 단일 세포 현탁액 농도를 1 x 105 live cells/mL로 조정하고 필요한 경우 세포 계수를 반복합니다.
참고: 기술적 중복 횟수 간의 변동 계수는 25% 미만이어야 합니다. 일반적으로 AO/PI 계수에서는 5% 미만입니다. - 원하는 농도에 도달하면 이 용액 50 μL(± 1 μL)를 각 웰로 전달하여 5000 cells/well(4900 - 5100 cells/well)에 최대한 가깝게 만듭니다. 각 분석 조건에 대한 기술적 삼중주를 준비하고 리피터 피펫터를 사용하여 well-to-well 변동을 줄입니다.
- 플레이트를 오비탈 셰이커(350 - 500 RPM)로 2분 동안 옮깁니다. NK-EV 치료를 진행할 준비가 될 때까지 세포를 인큐베이터로 다시 옮깁니다.
- 분석 매체를 사용하여 필요한 NK-EV 희석액(1:5, 1:10 및 1:100)을 준비합니다.
- 이러한 희석액에서 1 x 108, 5 x 108, 1 x 109, 5 x 109, 1 x 1010, 5 x 1010 및 1 x 1011 particles/mL의 EV 농도를 테스트합니다. 투여량은 전체 분석 부피의 20%로 제한됩니다.
- 준비가 되면 주어진 희석액의 필요한 부피를 처리를 위해 원하는 EV 농도가 필요한 웰로 옮깁니다. 15μL의 10x Triton-X를 positive control well에 추가합니다( Table of Materials(재료표) 참조). 최종 웰 부피는 150μL로 정규화되어야 합니다.
- 플레이트를 오비탈 셰이커(350 - 500 RPM)에 2분 동안 추가합니다. 37 ° C의 5 % CO2 인큐베이터에서 3 시간 동안 세포를 배양합니다.
- 플레이트 리더( 재료 표 참조)를 37°C에서 예열하고 37°C(온도 관련 변동 감소), 450분 동안 혼합(샘플 균질성 보장) 스크립트를 로드하고 판독합니다.
- 각 웰에 15μL의 레사주린 기반 시약을 추가합니다( 재료 표 참조). 시약을 빛으로부터 보호하고 리피터 피펫터를 사용하여 well-to-well 변동을 줄입니다.
- 플레이트를 오비탈 셰이커(350 - 500 RPM)에 2분 동안 추가합니다. 플레이트를 인큐베이터로 옮기고 60분 동안 배양합니다. 에탄올에 담근 피펫 팁을 사용하여 기포를 제거합니다. 560nm의 여기와 590nm의 방출을 사용하여 플레이트를 읽습니다.
- 데이터 분석: 제약 조건이 없는 로그(억제제) 대 정규화된 반응-변수 기울기를 보여주는 억제 효과에 대한 비선형 회귀를 사용하여 용량-반응 분석을 수행하기 전에 평균 기술 반복 실험을 평균화하고 배경에 대해 수정했습니다. 언덕 경사면 및 EC50 값을 기록합니다.
결과
NK-EV는 고유한 세포독성 기능을 가지고 있으며 다양한 암 모델에 대해 높은 효능을 입증되었습니다. 그러나 NK-EV의 대규모 생산에 적합한 바이오제조 워크플로우에 관한 현재 연구 중 더 많은 표준화가 필요합니다 6,21. 이전 연구에서는 고순도 NK-EV 제품을 대량으로 생산할 수 있는 폐쇄 루프 중공사 생물반응기(HFB) 시스템의 타당성을 설명했습니다7. 후속 조치로, 이 프로토콜 기반 연구는 바이오제조 워크플로우를 자세히 설명하고 NK-EV 제품을 생산 및 분리하여 재현성을 입증합니다(그림 1). 또한 제품 출시를 수행하기 전에 필수적인 제품 특성화 및 검증이 필요하며, 이를 통해 이 연구에서 새롭고 독창적인 데이터를 제시합니다.
HFB 시스템은 사용 편의성, 신뢰성, 확장성 및GMP 준수 7로 인해 NK-EV 생산을 위해 선택되었습니다. HFB 시스템 설정과 관련하여, NK 세포는 왼쪽 ECS 포트를 통해 주입되어 생물반응기 카트리지에 파종됩니다(그림 2). 동시에 미디어 병은 측면 포트를 통해 HFB에 연결되고 미디어는 시스템 전체로 흐를 수 있습니다. NK 세포는 무혈청, 무이종, 무공급, 무항생제 배지에서 배양되며, 포도당 함량이 50% 미만으로 떨어지면 배지를 교체하여 시간이 지남에 따라 세포 건강을 유지하고 극대화합니다. CM은 매일 수집되어 차동 원심 분리를 통해 처리되고 추가 처리가 준비될 때까지 동결(-80 °C)된 상태로 유지됩니다. 그 후, EV 분리는 UF 및 여과와 결합된 차동 원심분리 및 FPLC-SEC의 조합을 통해 수행됩니다(그림 3). 그 결과 최종 부피가 약 1.0 - 1.5 mL인 농축 멸균 NK-EV 제품이 생성됩니다. NK-EV의 FPLC-SEC 분리에 대한 대표적인 크로마토그램이 제공됩니다(그림 4). FPLC-SEC 처리 전에 NK-EV가 풍부한 CM을 엔도뉴클레아제로 처리하여 잠재적 숙주(NK) 세포 오염 물질인 dsDNA 수치를 크게 줄입니다7. 따라서 설명된 EV 분리 워크플로우는 NK-EV 제품에서 세포 파편과 RNA/DNA 오염 물질을 제거하며, 이는 낮고 원치 않는 면역원성 가능성을 보장하고 최종 제품이 다운스트림 연구에 적합한지 확인하는 데 필수적입니다.
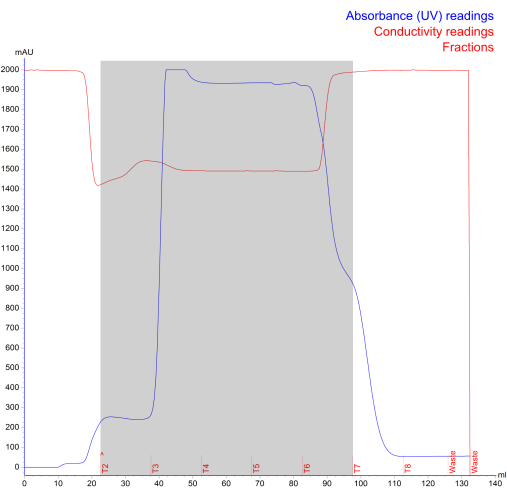
그림 4: Fast Protein Liquid Chromatography 크기 배제 중에 생성된 NK-EV 분리 크로마토그램. 파란색 선은 흡광도(mAU, 최대 판독값 2000mAU)를 나타내고, 빨간색 선은 전도도를, 빨간색 텍스트는 실행 로그를 나타내고, 회색 음영 영역은 분수 T2 - T7로 표시)을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
분리 후 기본 NK-EV 특성화 및 품질 보증 테스트를 사용하여 추가 다운스트림 실험을 위해 NK-EV 제품을 출시할 수 있는지 평가합니다. NK-EV 제품의 입자 크기 범위 및 농도는 직경 76.30 - 174.30nm(D10 ± 78.38 ± 2.07nm, D50 106.72 2.43nm), D90 169.80 ± 4.17nm)의 크기와 평균 농도 1.39 x 1012 EVs/mL의 나노입자 추적 분석(NTA)을 사용하여 측정됩니다(그림 5A-B). 또한 형광측정기 정량화는 최종 제품에 대해 각각 298.90 ± 66.62 mg/mL 및 225.60 ± 37.7 ng/mL의 단백질 및 dsDNA 농도를 보여주었습니다(그림 5C-D). 이는 단백질 5.06 x 106 EV/μg과 DNA 6.16 x 1012 EV/μg의 평균 비율에 해당합니다. 미생물 및 마이코플라스마 검사는 모두 음성 결과를 나왔습니다(데이터는 표시되지 않음). 이러한 결과는 이전 연구7에서 NK-EV의 특성화와 일치한다. 또한 이전 간행물7에서는 MISEV 가이드라인에 따른 NK-EV 제품(즉, TEM, 웨스턴 블롯, 내독소 수준, 바이러스 개체, 표면 항원 및 사이토카인에 대한 유세포 분석)에 대한 보다 심층적인 특성 분석을 제공합니다.
마지막으로, 백혈병 세포주 K562에 대한 NK-EV 치료 후 검증된 고감도 레사주린 기반 세포 생존율 분석을 사용하여 NK-EV 제품의 기능(즉, 암세포에 대한 세포 독성)을 평가했습니다 7,20. 3시간 동안 NK-EV를 사용한 K562 세포 처리는 9.33 x 109 EVs/mL의 EC50에 해당하는 세포 생존율에 대한 용량 의존적 효과를 생성했습니다(즉, 세포 집단의 50%를 사멸시키는 데 해당하는 용량; 그림 6A-B). 따라서 요약된 제품 출시 기준에 따라 NK-EV 제품은 추가 실험에 적합한 것으로 간주됩니다.
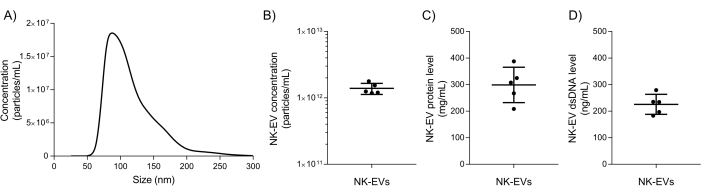
그림 5: 정제된 NK-EV 제품 특성화. (A) NTA로 측정한 NK-EV 제품 크기 분포는 각각 10회의 기술적 반복실험(5개의 비디오 캡처 x 2개의 희석)이 있는 5개의 독립적인 실험에서 얻은 평균으로 표시되었습니다. (B) NTA로 측정한 NK-EV 입자 생성물 농도(입자수/mL)는 5개의 독립적인 실험에서 얻은 평균 ± SD로 제시되었으며, 각각 기술적 중복이 있습니다. (C) NK-EV 생성물 단백질 농도(mg/mL)는 5개의 독립적인 실험에서 평균 ± SD로 제시된 형광측정기를 사용하여 측정했으며, 각각 기술적 삼중수를 가졌습니다. (D) 형광측정기를 사용하여 측정한 NK-EV 제품 dsDNA 농도(ng/mL)는 5개의 독립적인 실험에서 평균 ± SD로 제시되었으며 각각 기술적 삼중수를 가졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
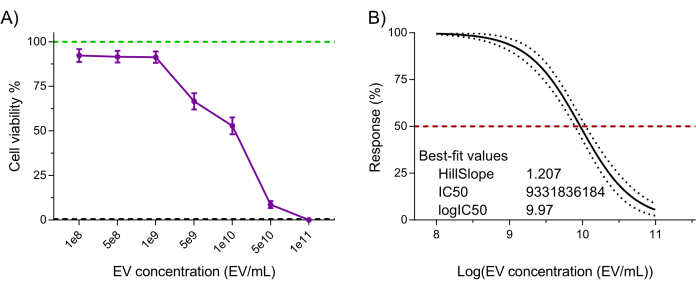
그림 6: 정제된 NK-EV 제품 기능 검증. NK-EV는 고감도 레사주린 기반 세포 생존율 분석을 사용하여 다양한 NK-EV 농도에서 3시간 동안 처리된 인간 K562 백혈병 세포에 대해 용량 의존적 세포 독성을 입증합니다. (A) 정규화된 분석 판독값(녹색 선은 처리되지 않은 K562 백혈병 세포 제어를 나타내고 검은색 점선은 용해된 K562 백혈병 사세포 제어를 나타냅니다. 세제 처리). 데이터는 기술적 삼중± 대한 11개의 독립적인 실험에서 얻은 평균 SEM으로 표시됩니다. (B) 95% 신뢰 구간/예측 대역으로 NK-EV 처리를 위한 가변 기울기를 사용한 EC50 곡선 분석(빨간색 점선은 50% 응답을 나타냄). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여러 연구에 따르면 NK-EV는 항암 치료제로서 엄청난 잠재력을 가지고 있습니다 4,5,7,9,16,22,23,24,25,26,27,28,29,30 . 그러나 추가 전임상 테스트 및 향후 임상 응용 분야를 위해서는 대량의 고순도 NK-EV를 생산할 수 있는 확장 가능한 GMP 준수 바이오 제조 시스템이 필요합니다. 이 문제를 해결하기 위해 이전 연구에서는 폐쇄 루프 HFB 시스템을 사용하여 다운스트림 실험에 적합한 NK 세포와 NK-EV가 풍부한 CM을 지속적으로 생산했습니다. 3D 설계로 인해 HFB 시스템은 혈관 시스템의 상태를 밀접하게 반영하고 믿을 수 없을 정도로 높은 표면적 대 부피 비율을 가지고 있어 10억 개 이상의 세포가 배양에 남아 궁극적으로 EV 생산을 개선할 수 있습니다 7,31,32. 중요한 것은 이 연구가 NK 세포 배양을 위해 HFB 시스템을 사용한 것으로 보고된 최초의 연구라는 것인데, 이는 세포주 IL-2 자급자족7 때문일 수 있습니다.
HFB 시스템의 무균 상태와 고순도 NK-EV의 생산을 보장하기 위해 추가 조치를 취해야 합니다. 이러한 예방 조치는 멸균된 클린룸이 없는 경우 특히 중요하며, 이는 여러 연구 시설의 경우일 수 있습니다. 생물 안전 캐비닛에 들어가기 전에 HFB 시스템에는 70% 에탄올이 꼼꼼하게 분사되어 모든 외부 표면을 소독합니다. 또한 왁스 필름은 오염 위험을 최소화하기 위해 모든 Luer Lock 연결부를 감쌉니다. 이는 이 바이오제조 워크플로우가 세포 및 세포 유래 산물의 생화학적 프로파일에 영향을 미치는 것으로 알려진 항생제를 사용하지 않기 때문에 특히 중요합니다33. 세포 제품 바이오 제조 중 세포 건강을 평가하기 위해 다양한 지표가 사용되었습니다. 예를 들어, 저장소 매체의 pH, 포도당 및 젖산 수치에 대한 일일 평가는 모니터링을 위한 중요한 세포 건강 대용품이기 때문에 수행되었습니다. 정량적 평가 외에도 HFB 시스템의 정성적 관찰(예: 매체 색상 및 탁도와 같은 시각적 오염 징후)도 세포 건강을 모니터링하는 데 도움이 됩니다. 매일 검색된 CM의 세포 수는 배양 건전성에 대한 생존 가능성의 대표 지표로 발견되지 않았습니다(데이터는 표시되지 않음). 이는 CM 샘플링 중에 회수된 죽은 세포가 배지가 순환되지 않는 튜브(ECS와 ECS 주사기 포트 사이의 작은 부분) 내에서 발견되어 전체 세포 배양의 생존력을 과소평가한 결과일 수 있습니다. 생산 로트가 끝날 때 HFB에 의해 생산된 채취된 NK 세포만이 배양물의 건강에 대한 신뢰할 수 있는 지표를 제공할 수 있습니다. 이 세포는 생산 로트7에서 70% 이상의 생존율 값을 일관되게 보여주었습니다. 이러한 품질 평가 방법은 함께 고순도 NK-EV의 지속적인 생산을 보장합니다.
EV를 정제하고 분리하기 위해 여러 가지 분리 기술이 개발되었습니다34. 한 가지 방법인 SEC는 다공성 물질(수지)로 충전된 컬럼을 사용하여 크기 구별에 따라 분자를 분리할 수 있습니다. 여기서 더 큰 EV는 컬럼을 통해 더 빨리 용리됩니다. 이 방법은 크기 배제를 기반으로 하는 플로우 스루 정제(flow-through purification based on size exclusion)로 알려져 있습니다. 동시에 더 작은 오염 물질(dsDNA, 엔도뉴클레아제, 염, 페놀 레드 등과 같은 자유 부유 단백질)은 정전기력에 의해 수지 내에 남아 더 많이 유지됩니다(즉, 이중 모드 수지가 사용됨). SEC 기반 처리는 원래의 EV 구조와 기능을 유지하면서 EV에 결합하지 않은 단백질을 제거합니다35,36. 또한 SEC 기반 정제는 높은 수율과 순도를 손상시키지 않으면서 쉽게 확장할 수 있어 바이오 치료용 NK-EV를 분리하는 데 적합합니다. 이러한 장점에도 불구하고 SEC에는 상대적으로 희석된 관류(용리액)와 같은 몇 가지 단점이 있습니다. 따라서 UF는 제품 농도에 필요하지만 완충액 교환도 허용합니다. 비멸균 UF 장치는 70% 에탄올과 PBS로 헹구고 멸균을 보장하기 위해 사용하기 전에 생물 안전 캐비닛에 보관합니다. 일반적으로 플로우 스루는 초기 부피의 35배-50배까지 농축될 수 있으며 용리액으로 유입될 수 있는 작은 분자를 제거할 수 있습니다. FPLC-SEC와 UF를 결합하기 전에 차등 원심분리 및 엔도뉴클레아제 처리를 수행하여 잔류 세포, 세포 파편 및 긴 가닥의 항원 dsDNA7을 제거합니다.
NK-EV 제품 격리 후 MISEV2018 및 MISEV2023의 지침에 따라 특성화 및 기능 검증을 수행하여 제품의 추가 사용에 대한 적합성을 결정합니다 6,18. 각 분리는 1 x 1012 EVs/mL의 최소 농도에서 1.0 - 1.5mL의 고순도 NK-EV 생성물을 생성하며, 평균 농도는 1.39 x 1012 particles/mL입니다. 이전에 Gupta 등은 생체 내 EV 투여량 중앙값이 마우스 37 체중의 3.37 x 108 EVs/kg이라고 결정했습니다37. 중간 용량으로 치료하려면 체중이 25g이고 마우스당 8.43 x 106 EVs가 필요하며, 이는 이 워크플로우를 통해 얻은 보장된 최소값(1 x 1012 입자/mL)보다 훨씬 낮은 값입니다. 따라서 설명된 바이오제조 워크플로우는 전임상 실험 또는 투여 목표를 달성하기에 충분한 NK-EV를 생산할 수 있습니다. 각 분리는 제품의 품질 관리 평가의 일환으로 마이코플라스마 및 미생물 존재에 대해 테스트됩니다. 또한, 이전 연구에서는 최종 제품에 일반적인 바이러스 실체와 내독소가 없고 숙주 세포 오염 물질로 간주되는 세포 성분이 없음을 보여주었습니다(웨스턴 블롯 분석에 의해)7,34. 마지막으로, NK-EV의 기능을 평가하기 위해 검증된 고감도 레사주린 기반 세포 생존율 분석을 사용하여 기능 평가를 수행했습니다20. 설명된 생존율 분석은 대사 활성 세포에 의해 resazurin(약한 형광성)을 resorufin(고형광성)으로 환원시켜 NK-EV 처리 후 세포 생존율을 평가할 수 있도록 하는 기능을 합니다. 다른 대체 세포 생존율 분석법과 비교했을 때, 연구에 사용된 레사주린 기반 분석법은 세포 생존율의 변화에 매우 민감하며(매우 낮은 배경 잡음) 결과를 관찰하기 위한 배양 시간을 단축할 수 있습니다(통계적으로 유의미한 결과를 얻는 데 30분 미만)20. 일반적으로 NK-EV는 K562 생존력에 용량 의존적 효과를 나타냅니다. 또한, 제시된 결과는 전임상 평가의 제품 출시 기준을 충족하고 다운스트림 애플리케이션에 적합한 NK-EV 제품을 나타냅니다.
결론적으로, 이 프로토콜 기반 연구는 임상 등급의 잠재력을 가진 NK-EV의 바이오 제조에 대해 설명합니다. 앞서 논의한 바와 같이, NK-EV는 무혈청, 무이종, 피더 및 항생제가 없는 조건에서 폐쇄 루프 HFB 시스템을 사용하여 생산됩니다7. FPLC-SEC/UF의 조합은 NK-EV 제품을 분리 및 정제합니다. 다운스트림 애플리케이션을 위해 제품을 출시하기 전에 NK-EV가 사용하기에 적합한지 확인하기 위해 특성을 분석하고 기능적으로 검증해야 합니다. 입증된 바와 같이, 이 바이오제조 프로토콜을 따르면 암세포에 대해 표적 세포 독성을 나타내는 고순도 NK-EV를 대량으로 성공적으로 생성할 수 있습니다. 따라서 설명된 바이오제조 프로토콜은 임상 등급의 NK-EV 생산이 필요한 향후 연구를 위한 자산이 될 수 있습니다.
공개
모든 저자는 이해 상충 또는 공개가 없음을 선언합니다.
감사의 말
저자들은 비평적 원고 검토를 해준 Simon Sauvé 박사, Roger Tam 박사, Xu Zhang 박사에게 감사의 뜻을 전한다. 이 작업은 JRL, LW가 입수한 캐나다 정부의 GRDI(Genomics Research and Development Initiative) Phase VII(2019-2025)의 운영 보조금과 자연 과학 및 공학 연구 위원회 RGPIN-2019-05220, Cancer Research Society/University of Ottawa 24064, LW가 획득한 CIHR(Canadian Institutes of Health) 연구 운영 보조금 175177의 운영 보조금으로 지원되었습니다. MK가 획득한 CIHR 석사 장학금과 FSDB가 획득한 Queen Elizabeth II Scholarships in Science and Technology(QEII-GSST).
자료
| Name | Company | Catalog Number | Comments |
| 0.1 µm vacuum filtration unit Filtropur V50 | Sarstedt | 83,3941,002 | |
| 0.22 µm Acrodisc Syringe Filter | Pall Corporation | PN4612 | |
| 1 mL syringe | Thermo Fisher Scientific | MB9204560TF-LAB | |
| 10 kDa Centricon Plus-70 Centrifugal Filter | Sigma | UFC701008 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| 96-well Flat Clear Bottom Black Polystyrene TC-treated Microplates | Costar | 3603 | |
| Agarose | Thermo Fisher Scientific | R0491 | |
| AKTA Fast Protein Liquid Chromatograph | GE Lifesciences | 29022094 | |
| BD PrecisionGlide Needle - 18G | BD Biosciences | 305196 | |
| Benzonase Nuclease | Sigma | E1014-25KU | |
| BioTek Synergy H1 Multimode Reader | BioTek | SH1M2G-SN | |
| Blue Juice Gel Loading Buffer | Invitrogen | 10816015 | |
| CaptoCore 700 resin | Cytiva | 17548102 | |
| Cellometer Auto 2000 Viability Counter | Nexcelom BioScience LLC | ||
| CryoStor CS10 freezing medium | Sigma | C2874 | |
| DPBS−/− | Fisher | BP399-1 | |
| Dual LED Blue/White Light Transilluminator | Invitrogen | LB0100 | |
| Duet P3202 Flow Control Pump | FiberCell Systems | ||
| Dulbecco's phosphate-buffered saline | Gibco | 14190250 | |
| Ethanol | Commercial Alcohols | P006EAAN | |
| Exosome-Depleted FBS | Gibco | A2720803 | |
| Fluorobrite DMEM | Gibco | A18967-01 | |
| Glucose meter | AccuCheck | Model 930 | |
| HiScale chromatography column 10/40 | Cytiva | 29360550 | |
| ImmunoCult-XF (GMP medium alternative) | StemCell Technologies | 100-0956 | |
| ImmunoCult-XF T Cell Expansion Medium | StemCell Technologies | 10981 | |
| Isopropyl Alcohol | EMD | PX1834-1 | |
| K562 cells | ATCC | CCL-243 | |
| LB media | BioBasic | SD7002 | |
| L-Lactate Assay Kit | Abcam | ab65331 | |
| Medium hollow-fibre cartridge | FiberCell Systems | C2011 | |
| MgCl2 | Sigma | M1028 | |
| Mycoplasma PCR detection kit | Abcam | ab289834 | |
| NanoSight NS300 | Malvern | ||
| NaOH | Supelco | SX0607N-6 | |
| NK92-MI cells | ATCC | CRL-2408 | |
| pH Strips-Mquant | Sigma | 1,09533 | |
| PrestoBlue HS Cell Viability Reagent Assay | Invitrogen | P50200 | |
| Qubit 4 Fluorometer | Invitrogen | ||
| Qubit dsDNA BR Assay Kit | Invitrogen | Q33262 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q33231 | |
| Qubit Flex Assay Tube Strips | Invitrogen | Q33252 | |
| Qubit Flex Fluorometer | Invitrogen | Q33327 | |
| Qubit Protein BR Assay Kit | Invitrogen | A50669 | |
| Quick Load 1Kb Plus DNA ladder | NEB | N0469S | |
| SYBRSafe DNA Gel Stain Invitrogen | Invitrogen | S33102 | |
| Syringe pump | Harvard Apparatus | 984730 | |
| Triton-X 100 | Sigma | T-9284 | |
| UltraPure TAE Buffer | Invitrogen | 15558042 | |
| ViaStain Acridine Orange and Propidium Iodide (AO/PI) Staining Solution | ESBE Scientific | CS2-0106 |
참고문헌
- Cheng, M., Chen, Y., Xiao, W., Sun, R., Tian, Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 10 (3), 230-252 (2013).
- Sheridan, C. Industry appetite for natural killer cells intensifies. Nat Biotechnol. 41 (2), 159-161 (2023).
- Shimasaki, N., Coustan-Smith, E., Kamiya, T., Campana, D. Expanded and armed natural killer cells for cancer treatment. Cytotherapy. 18 (11), 1422-1434 (2016).
- Elsharkasy, O. M., et al. Extracellular vesicles as drug delivery systems: Why and how. Adv Drug Deliv Rev. 159, 332-343 (2020).
- St-Denis-Bissonnette, F., et al. Applications of extracellular vesicles in triple-negative breast cancer. Cancers. 14 (2), 451 (2022).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- St-Denis-Bissonnette, F., et al. A clinically relevant large-scale biomanufacturing workflow to produce natural killer cells and natural killer cell-derived extracellular vesicles for cancer immunotherapy. J Extracell Vesicles. 12 (12), e12387 (2023).
- Federici, C., et al. Natural-killer-derived extracellular vesicles: Immune sensors and interactors. Front Immunol. 11, 262 (2020).
- Lugini, L., et al. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 189 (6), 2833-2842 (2012).
- Zhu, L., et al. Novel alternatives to extracellular vesicle-based immunotherapy - exosome mimetics derived from natural killer cells. Artif Cells Nanomed Biotechnol. 46 (sup3), S166-S179 (2018).
- Cochran, A. M., Kornbluth, J. Extracellular vesicles from the human natural killer cell line NK3.3 have broad and potent anti-tumor activity. Front Cell Dev Biol. 9, 698639 (2021).
- Kim, H. Y., et al. Delivery of human natural killer cell-derived exosomes for liver cancer therapy: an in vivo study in subcutaneous and orthotopic animal models. Drug Deliv. 29 (1), 2897-2911 (2022).
- Alvarez-Erviti, L., et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 29 (4), 341-345 (2011).
- El-Sahli, S., et al. A triple-drug nanotherapy to target breast cancer cells, cancer stem cells, and tumor vasculature. Cell Death Dis. 12 (1), 8 (2021).
- Sulaiman, A., et al. Co-targeting bulk tumor and CSCs in clinically translatable TNBC patient-derived xenografts via combination nanotherapy. Mol Cancer Ther. 18 (10), 1755-1764 (2019).
- Farcas, M., Inngjerdingen, M. Natural killer cell-derived extracellular vesicles in cancer therapy. Scand J Immunol. 92 (4), e12938 (2020).
- Murphy, D. E., et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking. Exp Mol Med. 51, 1-12 (2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- FiberCell-Systems. . FiberCell systems user manual & quick start guide. , (2024).
- St-Denis-Bissonnette, F., et al. Evaluation of resazurin phenoxazine dye as a highly sensitive cell viability potency assay for natural killer cell-derived extracellular vesicle-based cancer biotherapeutics. J Extracell Biology. 3 (7), e166 (2024).
- Herrmann, I. K., Wood, M. J. A., Fuhrmann, G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol. 16 (7), 748-759 (2021).
- Andaloussi, E. L. A., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Federici, C., et al. Exosome release and low pH belong to a framework of resistance of human melanoma cells to cisplatin. PLoS One. 9 (2), e88193 (2014).
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4, 27066 (2015).
- Neviani, P., et al. Natural killer-derived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 79 (6), 1151-1164 (2019).
- Sun, H., et al. Natural killer cell-derived exosomal miR-3607-3p inhibits pancreatic cancer progression by targeting IL-26. Front Immunol. 10, 2819 (2019).
- Jiang, Y., et al. Engineered exosomes: a promising drug delivery strategy for brain disease. Curr Med Chem. 29 (17), 3111-3124 (2022).
- Dosil, S. G., et al. Natural killer (NK) cell-derived extracellular-vesicle shuttled microRNAs control T cell responses. Elife. 11, e76319 (2022).
- Geeurickx, E., et al. The generation and use of recombinant extracellular vesicles as biological reference material. Nat Commun. 10 (1), 3288 (2019).
- Nathani, A., et al. Combined role of interleukin-15 stimulated natural killer cell-derived extracellular vesicles and carboplatin in osimertinib-resistant H1975 lung cancer cells with EGFR mutations. Pharmaceutics. 16 (1), 83 (2024).
- Gobin, J., et al. Hollow-fiber bioreactor production of extracellular vesicles from human bone marrow mesenchymal stromal cells yields nanovesicles that mirrors the immuno-modulatory antigenic signature of the producer cell. Stem Cell Res Ther. 12 (1), 127 (2021).
- Sun, L., et al. A 3D culture system improves the yield of MSCs-derived extracellular vesicles and enhances their therapeutic efficacy for heart repair. Biomed Pharmacother. 161, 114557 (2023).
- Ryu, A. H., Eckalbar, W. L., Kreimer, A., Yosef, N., Ahituv, N. Use antibiotics in cell culture with caution: genome-wide identification of antibiotic-induced changes in gene expression and regulation. Sci Rep. 7 (1), 7533 (2017).
- Meng, W., et al. Prospects and challenges of extracellular vesicle-based drug delivery system: considering cell source. Drug Deliv. 27 (1), 585-598 (2020).
- Yang, Y., et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. J Transl Med. 19 (1), 104 (2021).
- Gamez-Valero, A., et al. Size-exclusion chromatography-based isolation minimally alters extracellular vesicles' characteristics compared to precipitating agents. Sci Rep. 6, 33641 (2016).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 178 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유