Method Article
זרימת עבודה של ייצור ביולוגי מדרגי לייצור ובידוד של טיפולים אתר-תאיים מבוססי סרטן חוץ-תאיים שמקורם בתאי הרג טבעיים
* These authors contributed equally
In This Article
Summary
שלפוחיות חוץ-תאיות טבעיות שמקורן בתאי הרג (NK-EVs) טומנות בחובן פוטנציאל מבטיח כתרופות ביותרפיות לסרטן. מחקר מבוסס מתודולוגיה זה מציג זרימת עבודה מדרגית של ייצור ביולוגי בלולאה סגורה שנועדה לייצר ולבודד ברציפות כמויות גדולות של כלי רכב חשמליים בעלי טוהר גבוה. בדיקות בקרה בתהליך מבוצעות לאורך כל תהליך הייצור הביולוגי, ומבטיחות שכלי הרכב החשמליים עומדים בתקני האיכות לשחרור המוצר.
Abstract
שלפוחיות חוץ-תאיות טבעיות שמקורן בתאי הרג (NK-EVs) נחקרות כביותרפיות לסרטן. יש להם תכונות ייחודיות כננו-שלפוחיות ציטוטוקסיות המכוונות לתאים סרטניים וכמתקשרים אימונומודולטוריים. תהליך עבודה מדרגי של ייצור ביולוגי מאפשר ייצור כמויות גדולות של כלי רכב חשמליים בעלי טוהר גבוה כדי לעמוד בדרישות הפרה-קליניות והקליניות. תהליך העבודה משתמש בביוריאקטור סיבים חלולים בלולאה סגורה, המאפשר ייצור רציף של NK-EV מקו התאים NK92-MI בתנאים ללא סרום, ללא קסנו, ללא מזין וללא אנטיביוטיקה בהתאם לתקני תנאי ייצור נאותים. מחקר מונחה פרוטוקולים זה מתאר את זרימת העבודה של ייצור ביולוגי לבידוד NK-EV באמצעות כרומטוגרפיה של אי הכללת גודל, אולטרה-סינון ועיקור מבוסס מסנן. אפיון מוצרים חיוניים של NK-EV מתבצע באמצעות ניתוח מעקב אחר ננו-חלקיקים, והפונקציונליות שלהם מוערכת באמצעות בדיקת עוצמה מאומתת המבוססת על כדאיות תאים כנגד תאים סרטניים. תהליך ייצור ביולוגי מדרגי זה טומן בחובו פוטנציאל משמעותי לקידום התרגום הקליני של תרופות ביותרפיות מבוססות סרטן מבוססות NK-EV על ידי הקפדה על שיטות עבודה מומלצות והבטחת יכולת שחזור.
Introduction
במאה ה-21 הושגו התקדמות יוצאת דופן במאבק בסרטן. זאת בעיקר בשל עליית האימונותרפיה לסרטן, סוג של תרופות הרותמות את מערכת החיסון להילחם בסרטן. שלפוחיות חוץ-תאיות טבעיות שמקורן בתאי הרג (NK-EVs) מייצגות מתחרים מבטיחים בתחום המתרחב של אימונותרפיה. אינטגרטיביים לחסינות מולדת ונרכשת, תאי NK ממלאים תפקיד מכריע בהגנה של הגוף מפני תאים נגועים בנגיף, סטרס וממאירים. הם משתמשים בארסנל מקיף של מכונות אנטי-סרטניות כדי לחסל תאים חריגים באמצעים ציטוטוקסיים 1,2,3. בין מנגנונים אלה ניתן למנות ייצור והפרשה של כלי רכב חשמליים, מבנים ננומטריים דו-שכבתיים המכילים ביומולקולות שונות, כגון חלבונים, רנ"א ודנ"א, החיוניים להקלת התקשורת הבין-תאית 4,5,6. NK-EV מתגלים כטיפולים מבטיחים ללא תאים בשל תכונות הנשא הייחודיות שלהם. אלה כוללים את גודלם הקטן, המאפשר עיקור מבוסס פילטר, תאימות ביולוגית גבוהה, הצטברות מועדפת בתוך גידולים, ספקטרום הובלת מטענים רחב, יכולת להתגבר על מחסומים ביולוגיים כגון מחסום דם-מוח, ופרופיל רעילות מינימלי. מכמה סיבות, NK-EVs מייתרים את הצורך בדלדול לימפו של המטופל באמצעות כימותרפיה לפני מתן התרופה: 1) באופן קונבנציונלי, משתמשים בלימפודלציה כדי ליצור סביבה מסבירת פנים יותר לטיפול מבוסס תאים, המאפשרת לתאים חדורים להתרבות ולהפעיל את ההשפעות הטיפוליות שלהם; 2) בניגוד לתאים, כלי רכב חשמליים חסרים את יכולת השכפול והם קטנים משמעותית בהיקפם; 3) כלי רכב חשמליים פועלים באמצעות מנגנונים נפרדים ומפגינים אימונוגניות מופחתת בהשוואה לתאים 5,6,7. יתר על כן, NK-EVs הציגו באופן עקבי יעילות במבחנה נגד מודלים שונים של סרטן וגם הראו השפעות אימונומודולטוריות על תאי מערכת החיסון המעודדות תגובות אנטי סרטניות 8,9. תוצאות In vivo מאששות ממצאים אלה, ומראות נסיגה בסרטן בעקבות טיפול ב- NK-EV ורעילות זניחה 10,11,12. לכן, טיפולים מבוססי NK-EV טומנים בחובם הבטחה גדולה להתמודד עם האתגרים של טיפול בגידולים מוצקים קרים ואינרטיים מבחינה חיסונית 13,14,15,16,17.
המחקר האחרון שלנו מטפל בצוואר בקבוק משמעותי לתרגום הקליני של NK-EV באמצעות ייצור ביולוגי7. המאמר מציג הוכחת היתכנות לזרימת עבודה חסכונית ומדרגית של ייצור ביולוגי של כלי רכב חשמליים מסוג NK-EV, שתוכננה בקפידה כדי להבטיח בדיקות בקרת איכות בתהליך. גישה זו ייצרה ברציפות כמויות גדולות של תרופות ביותרפיות מבוססות סרטן NK-EV ברמת טוהר גבוהה, עם אפיון מוצר יסודי שנערך על פי הנחיות MISEV201818. ניתן להשיג את המדרגיות של זרימת העבודה של הייצור הביולוגי על ידי הגדלת גודל המחסנית או הפעלה של מספר ביוריאקטורים במקביל. באופן דומה, ניתן להשיג בקלות את המדרגיות של זרימת העבודה של בידוד EV באמצעות טכניקות כמו כרומטוגרפיה נוזלית מבוססת חלבון מהיר (FPLC) מבוססת כרומטוגרפיה של אי הכללת גודל (SEC), אולטרה-סינון (UF) ועיקור מבוסס מסנן. מערכת הביוריאקטור מסיבים חלולים בלולאה סגורה (HFB) גידלה את קו תאי ה-NK העצמאיים IL-2 (תאי NK92-MI) ללא צורך בתוספי סרוב, מערכת הזנה ואנטיביוטיקה. זה הושג באמצעות מדיום מסחרי המוגדר כימית וללא קסנו (גרסת GMP זמינה כעת באופן מסחרי). כתוצאה מכך, כמויות גדולות של תאי NK (109 תאים ברי קיימא) ו- NK-EV (1012 EVs) יוצרו בהצלחה תוך 5 - 7 ימים באמצעות מחסנית ביוריאקטור אחת בגודל בינוני, כאשר שני המוצרים אופיינו באופן נרחב. לאורך כל תהליך הייצור הביולוגי, בריאות התאים נוטרה מדי יום באמצעות מדדים הניתנים לכימות כגון pH, גלוקוז ורמות לקטט, יחד עם אינדיקטורים חזותיים כגון צבע מדיה וכל סימן לזיהום, שהם מנבאים חיוניים לאיכות התאים והרכב החשמלי. הערכה לאחר הקציר של כדאיות תאי NK ופונקציונליות שנוצרו במערכת HFB, במיוחד ציטוטוקסיות, חשפה שיפור משמעותי בהשוואה לתרביות מבוססות צלוחיות7. כמו כן, NK-EV מטוהרים הציגו פרופיל טוהר גבוה, ללא חיידקים, מיקופלסמה, ישויות נגיפיות נפוצות ורכיבים תאיים, ועם רמות אנדוטוקסין זניחות. חשוב לציין כי רכבי NK-EV מטוהרים היוו מעל 99.9% מכלל הננו-חלקיקים שנמצאו במוצר הסופי7. לבסוף, רכבי NK-EV מטוהרים אלה שמרו על מאפייני NK מרכזיים, כולל סמני פני שטח (CD2, CD45, CD56), מטען ציטוקינים (GzmB, PFN, IFN-g), והראו ציטוטוקסיות חזקה נגד תאי K562 לוקמיים, קו תקן הזהב להערכת ציטוטוקסיות תאי NK7.
הפרוטוקול הנוכחי מפרט את זרימת העבודה המדרגית של ייצור ביולוגי שנידונה לעיל. הוא מבהיר את המתודולוגיה לבידוד NK-EV המיוצרים באמצעות FPLC-SEC בשילוב עם UF ועיקור מבוסס פילטר. בנוסף, הפרוטוקול מתאר שלבים מרכזיים, כולל אפיון המוצר באמצעות ניתוח מעקב אחר ננו-חלקיקים (NTA), הערכת איכות באמצעות כלים שונים (כימות חלבון/dsDNA ובדיקות מיקרוביאליות), ותיקוף פונקציונלי של מוצר NK-EV המטוהר כנגד תאים סרטניים על ידי בדיקת כדאיות התא. בדרך כלל, זרימת עבודה זו מניבה 1.0 - 1.5 מ"ל של מוצר NK-EV עם ריכוז ממוצע של 1.18 x 1012 EVs/mL7, בסך הכל מינימום של 1 x 1012 EV בהתבסס על כ- 40 מ"ל של CM עשיר ב- EV. תהליך זה מאפשר שחרור מוצרים עבור יישומים שונים במורד הזרם, כגון מחקרים חקירתיים, פרה-קליניים ורב-אומיים (פרוטאומיקה, תעתוק, גנומיקה, מטבולומיקה, ליפידומיה ואפיגנומיקה) הדורשים כמויות גבוהות של כלי רכב חשמליים באיכות גבוהה תוך פוטנציאל לתרגום קליני, עם יכולת שחזור מוכחת.
Protocol
1. ייצור ביולוגי של NK-EV מתאי NK92-MI באמצעות ביוריאקטור בלולאה סגורה
הערה: רכבי NK-EV מיוצרים באמצעות זרימת עבודה של ייצור ביולוגי מדרגי העומדת בתנאי ייצור נאותים (GMP) ומשתמשת בתאי NK92-MI (ראה איור 1). הפרסום האחרון שלנו כולל תובנות מפורטות לגבי הליך הייצור הביולוגי ופרופילי הזהות והבטיחות של מוצרי NK-EV7.
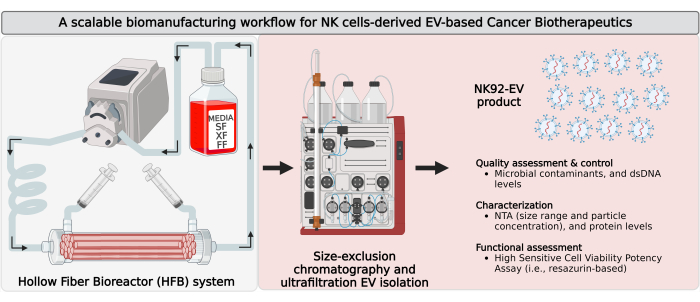
איור 1: ייצור ביולוגי של שלפוחיות חוץ-תאיות טבעיות שמקורן בתאי הרג (NK-EVs) בביוריאקטור סיבים חלולים בלולאה סגורה (HFB) עם זרימת עבודה של בידוד מדרגי. ייצוג סכמטי של זרימת העבודה של הייצור הביולוגי כדי ליצור כמויות גדולות של מוצרי NK-EV בעלי טוהר גבוה. תאי NK92-MI עצמאיים מדגם IL-2 נזרעים לתוך מחסנית HFB בלולאה סגורה ועוברים תרבית בתנאים נטולי סרום (SF), נטולי קסנו (XF), נטולי מזין ונטולי אנטיביוטיקה, שם הם גדלים לאיסוף בינוני מותנה עשיר ברכבים חשמליים. בידוד NK-EV מ-CM עשיר ב-EV מתבצע על ידי כרומטוגרפיית אי-הכללת גודל מבוססת Fast Protein Liquid Chromatography (FPLC-SEC) יחד עם אולטרה-סינון (UF). NK-EV מאופיינים ומוערכים באמצעות בדיקות מרובות, והפונקציונליות שלהם כנגד תאי לוקמיה K562 מוערכת באמצעות בדיקת עוצמת כדאיות. נתון זה שונה מ- 7 (נוצר עם Biorender.com). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- החל מ 1 - 5 x 106 תאי NK92-MI ושמירה על צפיפות תאים בין 3 - 8 x 105 תאים / מ"ל, תרבית את התאים בצלוחיות T25 - T175 באמצעות מדיום תרבית שחומם מראש. יש לדגור בטמפרטורה של 37°C עם 5%CO2 (ראו טבלת חומרים). החלף את המדיום כל 2 - 3 ימים עד 1 x 108 NK92-MI תאים מיוצרים של לפחות 70% כדאיות.
הערה: שמור 1/5th-1/3rd של התווך המותנה (CM) בעת זריעה מחדש של התאים, שכן הוא מכיל גורמי גדילה חיוביים. - בצע הכנת מחסנית HFB בינונית וחיסון תאי NK כמתואר להלן.
הערה: יש לבצע את כל המניפולציות בתוך ארון בטיחות ביולוגית Class II כדי להבטיח ולשמור על סטריליות. לפני העברת מערכת המחסנית לארון הבטיחות הביולוגית, רססו בנדיבות עם 70% אתנול, תוך מתן תשומת לב מיוחדת לצוואר הבקבוק של המאגר ולחיבורי המזרק.- הכן את מחסנית HFB בהתאם להוראות היצרן19 (ראה טבלת חומרים; ראה איור 2) כמתואר להלן.
- יש לעטוף חיבורי נעילת Luer באמצעות סרט שעווה ולהתאים את קצב זרימת המשאבה בהתאם להוראות היצרן19. מצב את מחסנית HFB בכך שתאפשר ל-150 מ"ל של מלח סטרילי חוצץ פוספט (PBS; ראה טבלת חומרים) להסתובב במשך חמישה ימים לפחות.
- כדי להסיר את האוויר מהחלל הנימי החוץ-תאי (ECS; הנפח הוא כ-29 מ"ל), הזריקו כ-40 מ"ל PBS דרך יציאת ה-ECS השמאלית ואפשרו לאוויר לברוח דרך יציאת ה-ECS הימנית. תוך כדי כך, סגור את מהדקי היציאה בקצה השמאלי והימני. ודא שהמזרק מחובר תמיד ליציאות ECS השמאלית והימנית.
- לאחר השלמתה, הניחו את המחסנית על משאבת הזרימה (ראו טבלת חומרים) בתוך האינקובטור שהוגדר לטמפרטורה של 37°C ו-5% CO2. ודא שאין דליפות לאחר מספר ימים של מחזור.
- החלף את PBS עם 150 מ"ל של מדיום תרבית בבקבוק המאגר ואת ECS יומיים לפני זריעת תאים לתוך המחסנית. חזור על שלבי ההתניה הקודמים (שלב 1.2.1.) באמצעות מדיום התרבית אך למשך יומיים של מחזור.
- לפני זריעת תאים, להחליף את התוכן בבקבוק המאגר ואת ECS עם 250 מ"ל של מדיום תרבית טרי.
- לרכוש את בקבוק התרבות מן האינקובטור ולהעביר את התאים צינור 50 מ"ל. סחרור ב 300 x גרם במשך 5 דקות. השהה מחדש את גלולת התא באמצעות 21 מ"ל של מדיום תרבית.
- הכינו שני aliquots של 20.5 μL כל אחד מתרחיף התא לספירת תאים על מונה תאים אוטומטי (ראה טבלת חומרים). לכל aliquot תרחיף תאים של 20.5 μL, הוסף כמות שווה של צבע AO/PI (ראה טבלת חומרים) וערבב למעלה ולמטה לפחות פי 10.
הערה: איננו ממליצים על Trypan Blue לספירת תאי NK מדויקת. לחלופין, השתמש בהמוציטומטר לספירה ידנית. - טען 20 μL לכל תא ספירה של שקופית הספירה ובצע ספירת תאים אוטומטית באמצעות התוכנית המתאימה. חשב את ריכוז התא החי הממוצע ושים לב לכדאיות.
- ערבב את תמיסת תאי ה- NK מספר פעמים לפני שאפו אותה באמצעות מזרק 20 מ"ל ומחט 18 גרם כדי לשמור על סטריליות. פתרון זה צריך להכיל בערך 1 x 108 תאי NK חיים בכ 20 מ"ל או בערך 5 x 106 תאים / מ"ל.
- לאחר הסרת המחט מהמזרק, הזריקו בעדינות את תאי ה- NK למחסנית דרך יציאת ECS השמאלית. כדי להבטיח פיזור תאים אחיד בכל המחסנית, החזר בעדינות את תמיסת התא לפחות פי 10 באמצעות המזרקים המחוברים ליציאות ECS השמאלית והימנית.
הערה: הפתרון צריך להיות עכירות שווה על פני שני מזרקים, עם יציאות קצה שמאל וימין סגור. - פתח את יציאת הקצה השמאלית והימנית והזריק את מה שנשאר בתוך המזרקים. סגור את יציאות ECS השמאלית והימנית באמצעות מלחציים.
- העבר את המחסנית לאינקובטור ותן לה לשבת במשך 30 דקות לפני התקנתה כראוי על משאבת הזרימה. השאר את המחסנית בייצור ביולוגי. התאימו את קצב הזרימה בהתאם ליצרן.
- כדי לפקח על מדדי בריאות התא, לרכוש aliquot 0.5 מ"ל של מדיום יומי מן המדיום מעורב היטב בבקבוק המאגר ולאחסן אותו ב -20 ° C לאחר אימות רמות גלוקוז ו- pH. ניתן לאמת את רמות L-לקטט מאוחר יותר (ראה טבלת חומרים).
- החלף את המדיום במאגר (250 - 500 מ"ל) כל 1 - 2 ימים כדי לשמור על תכולת הגלוקוז מעל 50% מהרמות הראשוניות שנמצאו בתווך ו- pH מעל 7.0 (טווח בין 7.0 - 8.0).
- הכן את מחסנית HFB בהתאם להוראות היצרן19 (ראה טבלת חומרים; ראה איור 2) כמתואר להלן.
- בצע איסוף CM עשיר ב- NK-EV מדי יום לאחר יום מנוחה אחד בעת הזריעה הראשונה של המחסנית כמתואר להלן.
- העבר את מערכת המחסניות לארון הבטיחות הביולוגית. הזריקו בעדינות כ-21 מ"ל של מדיום תרבית דרך יציאת ה-ECS השמאלית כדי לדחוף נפח שווה ערך של CM עשיר ברכב חשמלי דרך ה-ECS הימני - אין לערבב (ראו איור 3).
הערה: השתמש תמיד בכלי פלסטיק חדשים כדי למנוע זיהום. - העבר תמיסת CM עשירה ברכב חשמלי לצינור 50 מ"ל וצנטריפוגה במהירות של 300 x גרם למשך 5 דקות. בינתיים, העבר את מערכת המחסנית בחזרה לאינקובטור במשאבת הזרימה.
- מעבירים את הסופרנאטנט לצינור וצנטריפוגה חדשים במהירות של 2000 x גרם למשך 10 דקות. שוב, להעביר את supernatant לתוך צינור חדש. לאחר מכן, aliquot CM עשיר EV באופן שווה על פני 3, 50 מ"ל צינורות (~ 7 מ"ל / צינור) ולאחסן ב -80 ° C עד עיבוד נוסף.
הערה: CM עשיר ב-EV שנקצר ברצף מאוגד על פני שלושת הצינורות הללו, ומייצר שלוש שפופרות דגימה טכניות משוכפלות.
- העבר את מערכת המחסניות לארון הבטיחות הביולוגית. הזריקו בעדינות כ-21 מ"ל של מדיום תרבית דרך יציאת ה-ECS השמאלית כדי לדחוף נפח שווה ערך של CM עשיר ברכב חשמלי דרך ה-ECS הימני - אין לערבב (ראו איור 3).
- בצע קצירת תאי HFB-NK כדי להמשיך לייצר CM עשיר ברכב חשמלי באמצעות אותה מחסנית HFB כמתואר להלן.
הערה: ניתן לקצור תאי NK מה-ECS של HFB על ידי ביצוע פרוטוקול קצירת תאי HFB-NK" ברגע שהמחסנית מגיעה למפגש (מקסימום 1 x 109 תאים). זה קורה לאחר 5 - 7 ימים עבור כל מנה או כאשר תוכן הסוכר נמצא מתחת לגבול הזיהוי של מד הגלוקוז (למשל, ללא קריאה או קריאות של ~ 0) במשך יומיים רצופים. אם זהו קציר התאים הסופי, ניתן להחליף את המדיום ב- PBS כדי לשטוף את המחסנית ולאחזר את התאים.- קצרו CM עשיר ב-EV בדיוק כפי שפורט לעיל בשלב 1.3.
- להזריק כ 50 מ"ל של המדיום דרך יציאת ECS השמאלית. כדי להבטיח פיזור תאים הומוגני בכל המחסנית, דחפו בעדינות קדימה ואחורה את תמיסת התא באמצעות המזרקים המחוברים ליציאות ECS השמאלית והימנית לפחות פי 10 כדי לשחרר את התאים לפני שבסופו של דבר דחפו ואספו אותם עם מזרק דרך יציאת ECS הימנית. העבירו את ה-CM העשיר ברכב חשמלי שנקטף לתוך צינור של 50 מ"ל. הניחו בצד ב-37 מעלות צלזיוס (אמבט מים או אינקובטור) לעת עתה.
הערה: פעולת הדחיפה לאחור מסייעת לעקור את התאים לפני שהם מגורשים במלואם ונאספים על ידי מזרק דרך יציאת ECS הימנית. הפתרון צריך להיות עכירות שווה על פני שני מזרקים, עם יציאות קצה שמאל וימין סגור. הקשה על מחסנית הביוריאקטור (הפרעה פיזית) יכולה לעזור לעקור מראש את אשכול התאים בתחתית המחסנית. ערבוב אגרסיבי קדימה קדימה של תרחיף התא יכול להשפיע לרעה על הכדאיות של התאים שהתאוששו. יש להפעיל זהירות וסבלנות כדי למקסם את הכדאיות. - חזור על השלב האחרון 2x. בסך הכל, 150 מ"ל של השעיית תאים צריך להיות התאושש. צנטריפוגה ב 300 x גרם במשך 5 דקות.
- השהה מחדש את שתי כדוריות התא ב -20 מ"ל של מדיום טרי כל אחת ושלב אותן. אסוף שני aliquots של 20.5 μL כל אחד מתרחיף התא לספירת תאים על מונה תאים אוטומטי (ראה טבלת חומרים).
הערה: בדרך כלל, דילולי תאים רבים המשתמשים ב-PBS כמדללים נדרשים כדי להיכנס לטווח הדינמי של מונה התא. - לאליציטוט תרחיף התאים של 20.5 μL, הוסף כמות שווה של צבע AO/PI (ראה טבלת חומרים) וערבב למעלה ולמטה לפחות פי 10. טען 20 μL לכל תא ספירה של שקופית הספירה ובצע ספירת תאים אוטומטית באמצעות התוכנית המתאימה.
- ממוצע ריכוז התאים החיים של כל הספירות המתוקנות בדילול, קבע את הכמות הכוללת של תאים חיים ורשום את הכדאיות. כפי שפורט לעיל, כדי לייצר באופן רציף CM עשיר ברכב חשמלי באמצעות אותה מחסנית ביוריאקטור, זרעו מחדש 1 x 108 תאי NK המיוצרים על ידי HFB.
הערה: אם תרצה, ניתן לאחסן תאי NK המיוצרים ב- HFB באמצעות מדיום הקפאה בהקפאה ומיכל הקפאה כדי לשלוט בקצב ההקפאה (ראה טבלת חומרים).

איור 2: רכיב ומערך של מערכת ביוריאקטור סיבים חלולים (HFB). בקבוק המאגר (1) מכיל את התווך השלם שזורם דרך מחסנית הביוריאקטור (2) על ידי פעולה של משאבה פריסטלטית (לא מוצגת) הפועלת על צינור המשאבה (3). תאים מוכנסים לחלל הנימי החוץ תאי (ECS) דרך היציאות הצדדיות השמאליות (4) והימניות (5) ECS. לאחר סגירת מהדקי השקופיות של ECS, יציאות הצד השמאלי (6) והימני (7) פתוחות כדי לאפשר למדיום להסתובב ברחבי המערכת. שימו לב לתוספת של סרט שעווה על חיבור Luer Lock ליד מכסה המאגר של הבקבוק הבינוני כדי למנוע זיהום פוטנציאלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
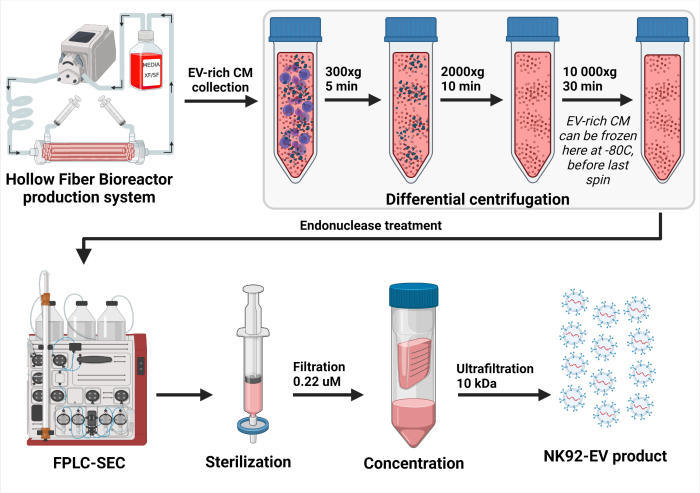
איור 3: ייצוג סכמטי של תהליך בידוד NK-EV. לאחר איסוף יומי של מדיום מותנה עשיר ברכב חשמלי (CM), התמיסה עברה צנטריפוגה דיפרנציאלית כדי להסיר תאים (ספין ראשון ב 300 x גרם במשך 5 דקות) ופסולת תאית (סיבוב שני ב 2000 x גרם במשך 10 דקות). CM עשיר EV מפונה אוחסן ב -80 ° C עד עיבוד נוסף. לאחר שהוא מוכן לבידוד NK-EV, CM קפוא עשיר ברכב חשמלי מופשר וצנטריפוגה פעם נוספת כדי להבטיח את פינוי הפסולת התאית (סיבוב שלישי ב-10,000 x גרם למשך 30 דקות). לאחר מכן, CM עשיר EV מטופל במשך 2 - 4 שעות ב 37 ° C עם אנדונוקלאז לעכל חומצות גרעין נחשב מזהמים התא המארח. לאחר מכן, CM עשיר EV מעובד על ידי כרומטוגרפיית גודל מבוססת כרומטוגרפיה נוזלית חלבון מהיר (FPLC-SEC) לטיהור EV באמצעות שרף בימודאלי. שברים של כ 10 - 15 מ"ל משולבים ומסוננים עם מסננים 0.22 מיקרומטר כדי להבטיח את הסטריליות של המוצר הסופי NK-EV. אולטרה-סינון מאפשר ריכוז של המוצר פי 35 - 50, ומניב ריכוז מובטח של מעל 1 x 1012 EVs/mL, בסך הכל 1.0 - 1.5 מ"ל. נתון זה שונה מ- 7 (נוצר עם Biorender.com). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. טיהור NK-EV על ידי FPLC-SEC בשילוב עם UF ועיקור מבוסס מסנן
- הכינו את התמיסות הבאות וסננו אותן פעמיים באמצעות מסנן 0.1 מיקרומטר (ראו טבלת חומרים): מים (מוליכות של 0 מילימטר לס"מ), PBS: 50 מ"ל של 10x PBS + 450 מ"ל מים (מוליכות סביב 14.7 מילימטר לס"מ), 20% אתנול, תמיסת ניקוי (0.5 מ' NaOH ו-30% איזופרופיל אלכוהול במים).
- בצע אתחול מערכת FPLC בהתאם להוראות היצרן (ראה טבלת חומרים). בצע שלבי ניקוי במקום (CIP) לפני ואחרי ההפעלה בהתאם להוראות היצרן. שטפו את כל הקווים ואת שרף העמוד ושטפו באמצעות מים מסוננים כפול (DF), תמיסת ניקוי, DF-water ו-DF-PBS.
הערה: ראוי לציין כי CIP ניתן לעשות ביום אחר במידת הצורך. - השתמשו בעמוד כרומטוגרפיה עמוס בשרף בימודאלי (ראו טבלת חומרים) בגובה מיטה של 20 ס"מ. בצע חיבורים בשיטת טפטוף לטפטוף כדי להבטיח שלא יוכנס אוויר לתוך העמודה.
- הגדר את אספן השברים עם צינורות איסוף מתאימים ושנה את הגדרות השבר לנפח האיסוף הרצוי (למשל, 15 מ"ל). הניחו מספיק צינורות ושתי שפופרות נוספות כדי לאסוף את כל נפח הדגימה.
- בצע הכנת מדגם כמתואר להלן.
- קח 40 - 80 מ"ל של CM עשיר EV מהמקפיא -80 ° C והפשיר במהירות ב 37 ° C. טען את הדגימה לתוך אולטרה-צנטריפוגה וסחרור ב 10,000 x גרם במשך 30 דקות ב 4 ° C.
הערה: יש לאזן את הצינורות במדויק לפי משקל, לא לפי נפח. - לאחר הסיבוב, לאסוף את supernatant ולהעביר אותו צינור חדש. כדי להפחית את רמות dsDNA, טפל CM עשיר EV עם 50 U/mL של אנדונוקלאז ו 1.5 mM של MgCl2 (ראה טבלה של חומרים). דגירה במשך 2 - 4 שעות באינקובטור (37 מעלות צלזיוס), המאפשר ערבוב מתון.
- קח 40 - 80 מ"ל של CM עשיר EV מהמקפיא -80 ° C והפשיר במהירות ב 37 ° C. טען את הדגימה לתוך אולטרה-צנטריפוגה וסחרור ב 10,000 x גרם במשך 30 דקות ב 4 ° C.
- ברגע שהמערכת (קווים ועמודות) מוכנה לבידוד EV, טען את CM עשיר EV לתוך מזרק 60 מ"ל וחבר אותו לקו הדגימה. הפעל את המערכת על ידי לחיצה על הפעלה ידנית והגדר את קצב הזרימה ל- 0. בצע את הנחיות התוכנה כדי לשמור את ההפעלה מראש ולאחר מכן לחץ על התחל.
- בחר קו B (DF-PBS) והפעל במהירות זרימה של 150 ס"מ/שעה (קצב זרימה של 2.0 מ"ל/דקה). ודא שהפתרון פועל דרך העמודה.
- לאחר שהמוליכות מתייצבת, לחץ על Auto Zero UV. שנה את נתיב הזרימה כדי להפנות את הדגימה לבקבוק הפסולת לפני העמודה. ודא שלא הוכנסו בועות למערכת.
- לאחר מקסימום של 5 - 20 שניות, כוון את הדגימה לעמודה. לחץ על שבר ברגע שקריאות UV מגיעות לכ- 230 mAU.
- לאחר הזרקת הדגימה במלואה דרך המערכת, העבר את מערכת החיץ ל- DF-PBS (בשסתום הדגימה) כדי להמשיך בטיהור. לחץ שוב על שבר כאשר ערך UV מגיע ל- 1600 mAU בקירוב.
הערה: זה מתאים להצטלבות בין קריאות UV וקריאות מוליכות. שבירה ארוכה יותר רק מדללת את ה-retentate מבלי להגדיל את תפוקת הרכב החשמלי. - ערבבו את כל השברים (NK-EV מדוללים) ואחסנו אותם בטמפרטורה של 4°C עד שהם מוכנים לעיקור ואולטרה-סינון מבוססי מסנן (UF).
- המשך להפעיל את DF-PBS עד שערך ה- UV יגיע לכ- 1000 mAU. לאחר מכן, הפסק לפעול ושמור את הכרומטוגרמה כמסמך PDF.
3. עיקור וריכוז מבוססי מסנן מוצר NK-EV על ידי UF
- מצננים את הצנטריפוגה ל-10°C. יש לחטא כל רכיב של מנגנון ה-UF (ראו טבלת חומרים) על ידי שטיפה ב-20-30 מ"ל של 90% אתנול. סחרור ב 4000 x גרם במשך 5 - 10 דקות.
הערה: המסנן עשוי מתאית מתחדשת MWCO 10 kDa . - יש להשליך את הזרימה ולאחר מכן לחזור על השטיפה באמצעות PBS סטרילי כדי לאזן את המכשיר. חזור על הפעולה פעמיים בסך הכל.
- כדי למקסם את הסטריליות, סנן את תמיסת NK-EV המדוללת באמצעות מסנן מזרקים בגודל 0.22 מיקרומטר שהורטב מראש עם DF-PBS (ראה טבלת חומרים). אספו את התסנין ישירות למנגנון הריכוז המעוקר.
- סחרור ב 4000 x גרם במשך 15 - 40 דקות (זמן הסחיטה תלוי בדגימה). ערבבו את התמיסה בתוך תא המסנן העליון באמצעות פיפטה סרולוגית לאחר הסיבוב. סובב ב 4000 x גרם במשך 10 דקות נוספות.
הערה: שלב הערבוב הוא אופציונלי מכיוון שהוא פשוט מקל על שלב הריכוז על ידי מניעת סתימת הממברנה על ידי כלי רכב חשמליים. - הניחו בצד באופן זמני את הזרימה ואספו את דגימת ה-NK-EV על ידי היפוך התקן הסינון והצמדתו למכשיר האיסוף.
- סחרור ב 2000 x גרם במשך 2 דקות. העבירו את מוצר ה-NK-EV המטוהר לצינור בנפח 2 מ"ל. אחסנו את מוצר ה-NK-EV המטוהר בטמפרטורה של 4°C לשימוש לטווח קצר (≤ 7 ימים) או קפואים בטמפרטורה של -20°C לשימוש לטווח ארוך.
4. אפיון NK-EV על ידי Nanoparticle Tracking Analysis (NTA)
- הכינו את התמיסה וסננו אותה פעמיים במינון של 0.1 מיקרומטר (ראו טבלת חומרים): מים, PBS, תמיסת ניקוי (10% אקונומיקה (זהירות) במים).
- הפעלת מערכת נת"ע בהתאם להוראות היצרן. באופן דומה, בצע את שלבי הניקוי במקום (CIP) לפני ואחרי ההפעלה. יש לשטוף את כל הקווים ולשטוף באמצעות מים עם סינון כפול (DF), תמיסת ניקוי ומי DF. אזן את הקווים באמצעות DF-PBS.
- בדוק את תא הזרימה ובדוק אם יש בועות אוויר. הסירו בועות אם הן קיימות. לאחר הפינוי יש להכניס בזהירות את תא הזרימה למכשיר של נת"ע.
הערה: למרות שלא מומלץ על ידי היצרן, ניתן להסיר בקלות בועות אוויר קשות מאוד להסרה על ידי שטיפה עם 20% אתנול ולאחר מכן DF-מים. - לאחר שתא הזרימה נמצא במקומו והדלת סגורה, לחץ על Start Camera (הפעל מצלמה). כאשר הקווים מלאים DF-PBS, המסך צריך להציג מספר מינימלי מוחלט של חלקיקים.
- שנה את הגדרות הצילום לרווח מסך של 2 ורמת מצלמה של 14. כמו כן, הפעל את תנור החימום כדי לייצב את תא הזרימה.
- לחץ על מדידה רגילה כדי ליצור סקריפט תחת הכרטיסייה SOP לאיסוף לכידה אחת במשך דקה אחת בקצב זרימה של 30 חלקיקים למסגרת ו- 23 ° C.
- ממש מתחת, הוסף את התיקיה ואת שם הקובץ לשם הנתיב כדי לשמור את הנתונים.
- הכינו מראש דילולים של מוצר NK-EV מטוהר באמצעות DF-PBS. כאשר מריצים נת"ע, כימות מדויק דורש 30-80 חלקיקים למסגרת.
- מערבלים את הדגימה לפני העמסתה למזרק (ראו טבלת חומרים).
- חבר בזהירות את מזרק הרכישה של 1 מ"ל לקו טעינת המכשיר. לא צריך להיות אוויר מכיוון שהוא ישפיע לרעה על הרכישה והניתוח. לדחוף לאט חצי הדגימה דרך, משאיר סביב 0.5 מ"ל מזרק.
- ברגע שהחלקיקים נראים על המסך, מקד את המצלמה כך שתהיה הילה אחת לכל היותר סביב כל חלקיק. לחץ על Infuse תחת הכרטיסיה חומרה בקצב של 1000 עבור 5 שניות. לאחר מכן, הורידו אותו לשיעור של 30.
- לחץ על הפעל קובץ Script ופעל בהתאם להנחיות. התוכנה תבטיח שהטמפרטורה מוגדרת ותשאל אם ההגדרות נכונות. לחץ על כן ופעל בהתאם להנחיות התוכנה.
- לאחר השלמת הלכידה, לחץ על ביטול כאשר התוכנה מבקשת לעבד או לייצא קבצים. לחץ על Infuse תחת הכרטיסיה חומרה בקצב של 1000 עבור 10 - 15 שניות. בינתיים, הפעילו שוב את תנור החימום ואת המצלמה. לאחר מכן, הורידו את הקצב ל-30 עד שהחלקיקים ינועו.
- אסוף ארבע לכידות נוספות על-ידי חזרה על השלבים הקודמים. לאחר שתועדו בסך הכל חמש לכידות לכל דילול, בצע ניתוח לאחר ייבוא כל חמש הלכידות .
- בחר את הקבצים לעיבוד על-ידי הדגשתם. לחץ על עבד קבצים נבחרים. תחת הכרטיסיה תהליך, התאם את הגדרות הניתוח לרווח מסך של 2 ולסף זיהוי של 15.
ההגדרות תלויות מדגם; ודא כי 30 - 80 חלקיקים לכל מסגרת גלויים. - סמן ולחץ על אישור לניתוח.
- לאחר עיבוד הקבצים, התוכנה תבקש לייצא אותם. לחץ על כן מבלי ללחוץ על תיבות נוספות או לחץ על יצא.
- יש לחזור על הפעולה עבור כל דילול או דגימות של כלי רכב חשמליים. יש לכבות את מכשיר נת"ע לאחר השלמת כל הדגימות והשלמת ה-CIP.
5. בדיקות אבטחת איכות
- בצע בדיקות מיקרוביאליות באמצעות שתי בדיקות: 1) aliquot קטן של NK-EV מטוהרים הוא spiked לתוך autoclaved LB מרק בינוני, 2) aliquot קטן של NK-EV מטוהר משמש לזיהוי PCR mycoplasma (ראה טבלה של חומרים).
- בדיקה 1: תרבית LB בינונית ב 37 ° C עד 5 ימים של עם בקרות חיוביות ושליליות כלולות. הקלט את OD600, במידת הצורך.
- בדיקה 2: בצע זיהוי מיקופלסמה PCR בהתאם לפרוטוקול היצרן.
- כימות חלבונים ו-dsDNA על דילולי NK-EV מטוהרים באמצעות בדיקות מבוססות פלואורומטר בהתאם להוראות היצרן (ראה טבלת חומרים).
6. הערכת עוצמה של תאים סרטניים שטופלו ב-NK-EV באמצעות בדיקת כדאיות תאים מאומתת בעלת רגישות גבוהה המבוססת על רזאזורין 20
- תרבית תאי לוקמיה K562 אנושיים באמצעות RPMI-1640 עם 10% FBS מומת בחום למשך מספר ימים לפני ביצוע בדיקת העוצמה (ראה טבלת חומרים). לשמור על צפיפות בין 2 - 8 x 105 תאים / מ"ל ולהחליף מדיה כל 2 - 3 ימים.
- רכוש צלחת שטוחה בעלת 96 בארות (ראה טבלת חומרים) והוסף מראש את נפח מדיום הבדיקה (בתוספת FBS מדולדל EV של 5%) הדרוש למטרות נורמליזציה (ראה טבלת חומרים). הנפח הסופי הוא 150 μL/well.
הערה: השתמש בפיפטור מהדר כדי להפחית את השונות בין באר. - לרכוש את תרבית התאים ולהעביר את התאים לצינור. סחרור ב 300 x גרם במשך 5 דקות. השהה מחדש את גלולת התא לתמיסה חד-תאית באמצעות 2 - 5 מ"ל של מדיום בדיקה.
- אסוף aliquot של 20.5 μL של תרחיף התא לספירת תאים על מונה תאים אוטומטי (ראה טבלת חומרים).
- לאליציטוט תרחיף התאים של 20.5 μL, הוסף כמות שווה של צבע AO/PI (ראה טבלת חומרים) וערבב למעלה ולמטה לפחות פי 10.
הערה: אנו ממליצים על AO/PI לספירת תאים מדויקת. לחלופין, השתמש בהמוציטומטר לספירה ידנית. - טען 20 μL לכל תא ספירה של שקופית הספירה ובצע ספירת תאים אוטומטית באמצעות התוכנית המתאימה. ממוצע ריכוז התא החי ורישום הכדאיות.
- מעבירים בערך 1 x 106 תאים לתוך צינור משני. לדלל את התאים בדיוק 7 מ"ל של מדיום הבדיקה ולחזור על ספירת תאים. הריכוז צריך להיות בערך 1.2 - 1.5 x 105תאים חיים / מ"ל.
- כמפורט לעיל, התאם את ריכוז התרחיף של תא בודד ל- 1 x 105 תאים חיים/מ"ל וחזור על ספירת התאים במידת הצורך.
הערה: מקדם השונות בין ספירות כפולות טכניות צריך להיות קטן מ- 25%; בדרך כלל, זה פחות מ 5% עם ספירת AO/PI. - לאחר השגת הריכוז הרצוי, העבר 50 μL (± 1 μL) של תמיסה זו לכל באר כדי להגיע קרוב ככל האפשר ל 5000 תאים / באר (4900 - 5100 תאים / באר). הכינו טריפליקטים טכניים עבור כל תנאי בדיקה והשתמשו בפיפטור מהדר כדי להפחית את השונות בין באר.
- מעבירים את הצלחת לשייקר מסלול (350 - 500 סל"ד) למשך 2 דקות. מעבירים תאים חזרה לאינקובטור עד שהם מוכנים להמשיך בטיפול ב-NK-EV.
- הכינו את דילולי NK-EV הנדרשים (1:5, 1:10 ו-1:100) באמצעות מדיום בדיקה.
- מתוך דילולים אלה, בדוק את ריכוזי הרכב החשמלי הבאים: 1 x 108, 5 x 108, 1 x 109, 5 x 109, 1 x 1010, 5 x 1010 ו- 1 x 1011 חלקיקים/מ"ל. נפח המינון מוגבל ל -20% מנפח הבדיקה הכולל.
- ברגע שאתה מוכן, העבר את הנפח הנדרש של דילול נתון לבארות הדורשות ריכוז EV רצוי לטיפול. הוסף 15 μL של 10x Triton-X לבאר הבקרה החיובית (ראה טבלת חומרים). נפח הבאר הסופי צריך להיות מנורמל ל 150 μL.
- מוסיפים את הצלחת לשייקר מסלול (350 - 500 סל"ד) למשך 2 דקות. לדגור על התאים ב 37 ° C ב 5% CO2 אינקובטור במשך 3 שעות.
- חממו מראש את קורא הלוחות (ראו טבלת חומרים) ב-37°C וטענו את הסקריפט הבא: 37°C (מפחית שינויים הקשורים לטמפרטורה), ערבוב של 450 סל"ד למשך דקה אחת (מבטיח הומוגניות דגימה) וקראו.
- הוסף 15 μL של מגיב מבוסס resazurin, לכל באר (ראה טבלה של חומרים). הגן על המגיב מפני אור והשתמש בפיפטור מהדר כדי להפחית את השונות מבאר.
- מוסיפים את הצלחת לשייקר מסלול (350 - 500 סל"ד) למשך 2 דקות. מעבירים את הצלחת לאינקובטור ודגרים במשך 60 דקות. הסירו את בועות האוויר בעזרת קצה פיפטה טבול באתנול. לוח קריאה באמצעות עירור של 560 ננומטר ופליטה של 590 ננומטר.
- ניתוח נתונים: שכפולים טכניים ממוצעים היו ממוצעים ונכונים לרקע לפני ביצוע ניתוח מנה-תגובה באמצעות רגרסיה לא ליניארית עבור אפקט העיכוב המציג את השיפוע log(inhibitor) לעומת משתנה תגובה מנורמל ללא אילוץ. רשום את הערכים Hillslope ו- EC50 .
תוצאות
לכלי רכב חשמליים יש פונקציות ציטוטוקסיות אינהרנטיות והם הוכיחו יעילות גבוהה נגד מודלים שונים של סרטן. עם זאת, נדרשת סטנדרטיזציה רבה יותר בין המחקרים הנוכחיים בנוגע לזרימת עבודה של ייצור ביולוגי המתאימה לייצור בקנה מידה גדול של NK-EVs 6,21. המחקר הקודם שלנו תיאר את ההיתכנות של מערכת ביוריאקטור סיבים חלולים בלולאה סגורה (HFB) לייצור כמויות גדולות של מוצרי NK-EV בעלי טוהר גבוה7. כהמשך, מחקר מבוסס פרוטוקולים זה מפרט את זרימת העבודה של הייצור הביולוגי ומדגים את יכולת השחזור שלו על-ידי ייצור ובידוד של מוצר NK-EV (איור 1). יתר על כן, נדרשים אפיון ותיקוף חיוניים של המוצר לפני ביצוע שחרור המוצר, כאשר במחקר זה מוצגים נתונים חדשים ומקוריים.
מערכת HFB נבחרה לייצור NK-EV בשל קלות השימוש, האמינות, המדרגיות ותאימות GMP7. בהתייחס למערך מערכת HFB, תאי ה-NK מוזרקים דרך יציאת ה-ECS השמאלית ונזרעים לתוך מחסנית הביו-ריאקטור (איור 2). במקביל, בקבוק המדיה מחובר ל- HFB דרך היציאות הצדדיות, והתקשורת מורשית לזרום ברחבי המערכת. תאי ה-NK מגודלים בתרבית במדיום ללא סרום, ללא קסנו, ללא מזין וללא אנטיביוטיקה, כאשר המדיה מוחלפת כאשר תכולת הגלוקוז יורדת מתחת ל-50% כדי לשמור ולמקסם את בריאות התאים לאורך זמן. CM נאסף מדי יום, מעובד באמצעות צנטריפוגות דיפרנציאליות, ונשמר קפוא (-80 ° C) עד מוכן לעיבוד נוסף. לאחר מכן, בידוד רכב חשמלי מתבצע באמצעות שילוב של צנטריפוגות דיפרנציאליות ו-FPLC-SEC בשילוב עם UF וסינון (איור 3). התוצאה היא מוצר NK-EV מרוכז וסטרילי בנפח סופי של כ-1.0-1.5 מ"ל. כרומטוגרמה מייצגת של בידוד FPLC-SEC של NK-EV מסופקת (איור 4). לפני עיבוד FPLC-SEC, CM עשיר NK-EV מטופל עם אנדונוקלאז, הפחתה משמעותית של רמות dsDNA, מזהם תא מארח פוטנציאלי (NK)7. לפיכך, זרימת העבודה המתוארת של בידוד EV מסירה פסולת תאית ומזהמי RNA/DNA ממוצר NK-EV, החיוני להבטחת פוטנציאל אימונוגני נמוך ולא רצוי וכי המוצר הסופי מתאים למחקרים במורד הזרם.
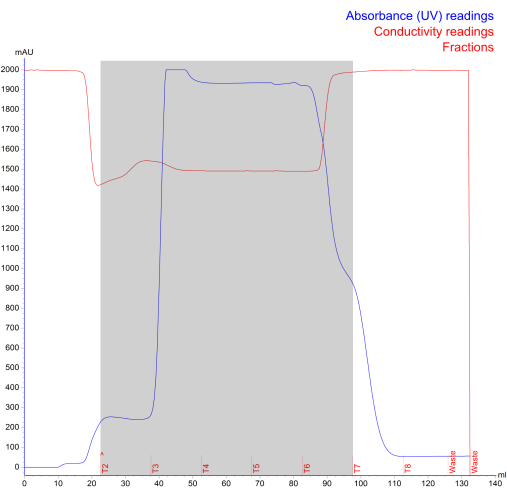
איור 4: כרומטוגרמה של בידוד NK-EV שנוצרה במהלך אי-הכללת גודל הכרומטוגרפיה הנוזלית של חלבון מהיר. הקו הכחול מייצג את הספיגה (mAU; קריאה מרבית של 2000 mAU), הקו האדום מייצג את המוליכות, הטקסט האדום מייצג את יומן הריצה, והאזור המוצלל האפור מייצג את ה- NK-EV המפוצלים (מסומנים בשברים T2 - T7). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
לאחר הבידוד, נעשה שימוש באפיון בסיסי של NK-EV ובבדיקות אבטחת איכות כדי להעריך אם ניתן לשחרר את המוצר NK-EV לניסויים נוספים במורד הזרם. טווח הגודל והריכוז של חלקיקי מוצר NK-EV נמדדים באמצעות ניתוח מעקב אחר ננו-חלקיקים (NTA), בגדלים הנעים בין 76.30 ל-174.30 ננומטר (D10 מתוך 78.38 ±-2.07 ננומטר, D50 מתוך 106.72 ±-2.43 ננומטר, ו-D90 של 169.80 ±-4.17 ננומטר) וריכוז ממוצע של 1.39 x 1012 EVs/mL (איור 5A-B). בנוסף, כימות פלואורומטר הראה ריכוז חלבון ו-dsDNA של 298.90 ± 66.62 מ"ג/מ"ל ו-225.60 ±-37.7 ננוגרם/מ"ל עבור המוצר הסופי, בהתאמה (איור 5C-D). זה מתאים ליחס ממוצע של 5.06 x 10,6 EV/μg של חלבון ו- 6.16 x 10,12 EV/μg של DNA. בדיקות מיקרוביאליות ומיקופלסמה החזירו שתיהן תוצאות שליליות (הנתונים לא מוצגים). תוצאות אלה תואמות את אפיון כלי הרכב החשמליים מעבודה קודמת7. הפרסום המוקדם יותר7 מספק גם אפיון מעמיק נוסף של מוצרי NK-EV בהתאם להנחיות MISEV (כלומר, TEM, כתם מערבי, רמת אנדוטוקסין, ישויות נגיפיות וציטומטריית זרימה עבור אנטיגנים וציטוקינים על פני השטח).
לבסוף, הפונקציונליות של מוצר NK-EV (כלומר, ציטוטוקסיות נגד תאים סרטניים) הוערכה באמצעות בדיקת כדאיות תאים מאומתת רגישה ביותר מבוססת רזאזורין לאחר טיפול NK-EV נגד קו תאים לוקמי K562 7,20. טיפול בתאי K562 עם NK-EV במשך 3 שעות יצר השפעה תלוית מינון על כדאיות התא, המקבילה ל- EC50 של 9.33 x 109 EVs/mL (כלומר, המינון המתאים להרג של 50% מאוכלוסיית התאים; איור 6A-B). לפיכך, בהתאם לקריטריונים המתוארים לשחרור המוצר, המוצר NK-EV נחשב מתאים לניסויים נוספים.
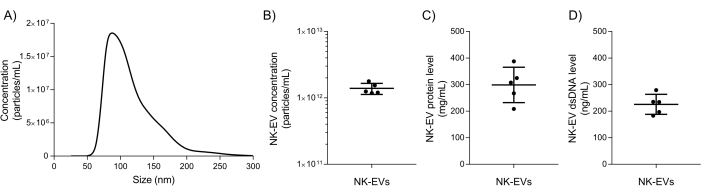
איור 5: אפיון מוצר NK-EV מטוהר. (A) התפלגות גודל המוצר של NK-EV שנמדדה על-ידי NTA, מוצגת כממוצע מ-5 ניסויים עצמאיים, כל אחד עם 10 עותקים טכניים משוכפלים (5 לכידת וידאו x 2 דילולים). (B) ריכוז תוצר חלקיקי NK-EV (חלקיקים/מ"ל) שנמדד על ידי נת"ע, מוצג כממוצע ± SD מ-5 ניסויים עצמאיים, כל אחד עם כפילויות טכניות. (C) ריכוז חלבון המוצר NK-EV (מ"ג/מ"ל) נמדד באמצעות פלואורומטר, שהוצג כממוצע ± SD מ-5 ניסויים עצמאיים, כל אחד עם טריפליקטים טכניים. (D) ריכוז dsDNA של מוצר NK-EV (ng/mL) נמדד באמצעות פלואורומטר, המוצג כממוצע ± SD מ-5 ניסויים עצמאיים, כל אחד עם טריפליקטים טכניים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
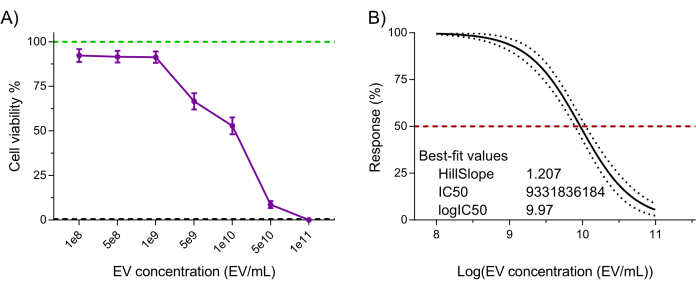
איור 6: אימות פונקציונלי של מוצר NK-EV מטוהר. NK-EVs מדגימים ציטוטוקסיות תלוית מינון כנגד תאי לוקמיה K562 אנושיים שטופלו בריכוזי NK-EV שונים במשך 3 שעות באמצעות בדיקת כדאיות תאים מבוססת רזאזורין בעלת רגישות גבוהה. (A) קריאות בדיקה מנורמלות (הקו הירוק מייצג את בקרת תאי הלוקמיה K562 שלא טופלו, והקו המקווקו השחור מייצג את בקרת התאים המתים בלוקמיה K562; מטופל בחומרי ניקוי). הנתונים מוצגים כממוצע ± SEM מ-11 ניסויים עצמאיים עם טריפליקטים טכניים. (B) ניתוח עקומת EC50 עם שיפוע משתנה לטיפול ב-NK-EV עם רווח בר-סמך/פסי חיזוי של 95% (קו מקווקו אדום מייצג תגובה של 50%). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מספר מחקרים מצביעים על כך שלרכבים חשמליים מסוג NK-EV יש פוטנציאל עצום כטיפול אנטי-סרטני 4,5,7,9,16,22,23,24,25,26,27,28,29,30 . עם זאת, נדרשת מערכת ייצור ביולוגי מדרגית תואמת GMP המסוגלת להניב כמויות גדולות של רכבי NK-EV בעלי טוהר גבוה לצורך בדיקות פרה-קליניות נוספות ויישומים קליניים עתידיים. כדי להתמודד עם בעיה זו, מחקר קודם השתמש במערכת HFB סגורה כדי לייצר ברציפות תאי NK ו- CM עשיר ב- NK-EV המתאים לניסויים במורד הזרם. הודות לתכנון התלת-ממדי שלהן, מערכות HFB משקפות מקרוב את התנאים של מערכת כלי הדם ובעלות יחס פנים-שטח לנפח, המאפשר ליותר ממיליארד תאים להישאר בתרבית, מה שמוביל בסופו של דבר לשיפור ייצור הרכב החשמלי 7,31,32. חשוב לציין, עבודה זו הייתה הראשונה אי פעם לדווח על שימוש במערכת HFB לגידול תאי NK, ככל הנראה בשל קו התא IL-2 עצמאות7.
יש לנקוט צעדים נוספים כדי להבטיח את סטריליות מערכת HFB ואת הייצור של NK-EV טוהר גבוה. אמצעי זהירות אלה חיוניים במיוחד בהיעדר חדר סטרילי ונקי, כפי שעשוי להיות המקרה עבור מספר מתקני מחקר. לפני הכניסה לארון הבטיחות הביולוגית, מערכת HFB מרוססת בקפידה באתנול 70% לחיטוי כל המשטחים החיצוניים. בנוסף, סרט שעווה כרוך סביב כל חיבורי Luer Lock כדי למזער את הסיכון לזיהום. זה חשוב במיוחד מכיוון שתהליך הייצור הביולוגי הזה אינו משתמש באנטיביוטיקה, הידועה כמשפיעה על הפרופיל הביוכימי של מוצרים שמקורם בתאים ובתאים33 . מדדים שונים שימשו להערכת בריאות התא במהלך ייצור ביולוגי של מוצרי תאים. לדוגמה, נערכו הערכות יומיות של רמות החומציות, הגלוקוז והלקטט של אמצעי המאגר, שכן מדובר בפונדקאיות חיוניות לבריאות התאים לצורך ניטור. בנוסף להערכות כמותיות, תצפיות איכותניות של מערכת HFB (למשל, צבע מדיה וסימנים חזותיים של זיהום כגון עכירות) מועילות גם לניטור בריאות התא. ספירת תאים ב-CM שנשלפה מדי יום לא נמצאה כמדד מייצג לכדאיות לבריאות התרבית (הנתונים לא מוצגים). זו ככל הנראה תוצאה של תאים מתים שנלקחו במהלך דגימת CM שנמצאו בתוך הצינורית שבה המדיה לא הורשתה להסתובב (החלק הקטן בין ECS ליציאת מזרק ECS), ובכך המעיטה בערך הכדאיות של תרבית התאים הכוללת. רק תאי NK שנקטפו המיוצרים על ידי HFB בסוף מגרש הייצור יכולים לספק מדד אמין לבריאות התרבית. תאים אלה הראו באופן עקבי ערכי כדאיות מעל 70% במגרשי ייצור7. יחד, שיטות הערכת איכות אלה מבטיחות ייצור מתמשך של NK-EV בעלי טוהר גבוה.
מספר טכניקות בידוד פותחו כדי לטהר ולבודד כלי רכב חשמליים34. שיטה אחת, SEC, משתמשת בעמוד עמוס בחומר נקבובי - שרף - המאפשר הפרדת מולקולות על בסיס הבחנה בגודל. כאן, כלי הרכב החשמליים הגדולים יותר מדוללים דרך הטור מהר יותר; שיטה זו ידועה בשם טיהור זרימה המבוסס על אי הכללת גודל. במקביל, מזהמים קטנים יותר (dsDNA, חלבונים צפים בחופשיות כמו אנדונוקלאז, מלחים, פנול אדום וכו ') נשארים מאחור ונשמרים עוד יותר בתוך השרף על ידי כוחות אלקטרוסטטיים (כלומר, נעשה שימוש בשרף בימודאלי). עיבוד מבוסס SEC מסיר חלבונים שאינם קשורים לרכב חשמלי תוך שמירה על המבנה והפונקציונליות המקוריים של EV35,36. יתר על כן, טיהור מבוסס SEC ניתן להרחבה בקלות מבלי להתפשר על התפוקה והטוהר הגבוהים, מה שהופך אותו לבחירה מתאימה לבידוד NK-EV לשימושים ביותרפיים. למרות יתרונות אלה, ל-SEC יש כמה חסרונות, כגון זרימה מדוללת יחסית (eluent); לפיכך, UF נדרש לריכוז המוצר, אך הוא מאפשר גם החלפת חיץ. מכשיר ה-UF הלא סטרילי נשטף ב-70% אתנול ו-PBS ונשמר בארון הבטיחות הביולוגית לפני השימוש כדי להבטיח סטריליות. בדרך כלל, ניתן לרכז את הזרימה עד פי 35x-50x מהנפח הראשוני תוך הסרת מולקולות קטנות שהיו יכולות לעשות את דרכן לתוך האלואנט. צנטריפוגה דיפרנציאלית וטיפול אנדונוקלאז מבוצעים לפני FPLC-SEC יחד עם UF כדי להסיר תאים שיורית, פסולת תאית וגדילים ארוכים של dsDNA אנטיגני7.
לאחר בידוד המוצר NK-EV, מבוצעים אפיון ותיקוף פונקציונלי בהתאם להנחיות MISEV2018 ו-MISEV2023 כדי לקבוע את התאמת המוצר לשימוש נוסף 6,18. כל בידוד מניב 1.0 - 1.5 מ"ל של מוצר NK-EV בעל טוהר גבוה בריכוז מינימלי של 1 x10 12 EVs/mL, עם ריכוז ממוצע של 1.39 x 1012 חלקיקים / מ"ל. בעבר, Gupta et al. קבעו כי המינון החציוני של EV in vivo הוא 3.37 x 108 EVs / kg של משקל הגוף של עכברים37. טיפול במינון החציוני ידרוש 8.43 x 106 EVs / עכבר עם משקל גוף של 25 גרם, ערך הרבה מתחת למינימום המובטח (1 x10 12 חלקיקים / מ"ל) המתקבל באמצעות זרימת עבודה זו. לפיכך, זרימת העבודה המתוארת של ייצור ביולוגי יכולה לייצר די והותר NK-EV לניסויים פרה-קליניים או לעמידה ביעדי המינון. כל בידוד נבדק לנוכחות מיקופלסמה וחיידקים כחלק מהערכת בקרת האיכות של המוצר. בנוסף, מחקר קודם הדגים היעדר ישויות ויראליות נפוצות ואנדוטוקסין במוצר הסופי והיעדר רכיבים תאיים הנחשבים למזהמים של תאים מארחים (על ידי ניתוח כתם מערבי)7,34. לבסוף, הערכה תפקודית בוצעה באמצעות בדיקת כדאיות תאים מבוססת רזאזורין רגישה ביותר כדי להעריך את הפונקציונליות של NK-EV20. בדיקת הכדאיות המתוארת פועלת על ידי הפחתת רזזורין (פלואורסצנטי חלש) לרסורופין (פלואורסצנטי מאוד) על ידי תאים פעילים מטבולית, מה שמאפשר להעריך את כדאיות התא לאחר טיפול ב- NK-EV. בהשוואה למבחני כדאיות תאים חלופיים אחרים, הבדיקה מבוססת הרזאזורינים ששימשה במחקר רגישה מאוד לשינויים בכדאיות התא (רעשי רקע נמוכים מאוד) ומאפשרת זמן דגירה מקוצר לצפייה בתוצאות (פחות מ-30 דקות לקבלת תוצאות מובהקות סטטיסטית)20. באופן כללי, לכלי הרכב החשמליים יש השפעה תלוית מינון על יכולת הקיום של K562. יחד, התוצאות המוצגות מייצגות מוצר NK-EV שעמד בקריטריוני שחרור המוצר להערכה פרה-קלינית ומתאים ליישומים במורד הזרם.
לסיכום, מחקר מבוסס פרוטוקול זה מתאר את הייצור הביולוגי של NK-EV עם פוטנציאל ברמה קלינית. כפי שנדון, ה- NK-EV מיוצרים באמצעות מערכת HFB בלולאה סגורה בתנאים ללא סרום, ללא קסנו, ללא מזין וללא אנטיביוטיקה7. שילוב של FPLC-SEC/UF מבודד ומטהר את מוצר NK-EV. לפני שחרור המוצרים ליישום במורד הזרם, יש לאפיין את כלי הרכב החשמליים ולאמת אותם מבחינה תפקודית כדי להבטיח שהם מתאימים לשימוש. כפי שהוכח, מעקב אחר פרוטוקול ייצור ביולוגי זה יכול לייצר בהצלחה כמות גדולה של NK-EV בעלי טוהר גבוה המפגינים ציטוטוקסיות ממוקדת מטרה נגד תאים סרטניים. לכן, פרוטוקול הייצור הביולוגי המתואר עשוי להיות נכס למחקרים עתידיים הדורשים ייצור של NK-EV ברמה קלינית.
Disclosures
כל המחברים מצהירים כי אין ניגוד עניינים או גילוי.
Acknowledgements
המחברים רוצים להודות לד"ר סיימון סובה, רוג'ר טאם וד"ר שו ז'אנג על סקירת כתבי היד הביקורתית שלהם. עבודה זו נתמכה על ידי מענקי תפעול מיוזמת המחקר והפיתוח הגנומיקה (GRDI) שלב VII (2019-2025) מממשלת קנדה שהתקבלו על ידי JRL, LW, כמו גם מענקי הפעלה ממועצת המחקר למדעי הטבע וההנדסה RGPIN-2019-05220, החברה לחקר הסרטן / אוניברסיטת אוטווה 24064, מענק תפעול המחקר של המכונים הקנדיים לבריאות (CIHR) 175177 שהתקבלו על ידי LW, מלגת CIHR MSc שהושגה על ידי MK, ומלגות המלכה אליזבת השנייה במדע וטכנולוגיה (QEII-GSST) שהושגו על ידי FSDB.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1 µm vacuum filtration unit Filtropur V50 | Sarstedt | 83,3941,002 | |
| 0.22 µm Acrodisc Syringe Filter | Pall Corporation | PN4612 | |
| 1 mL syringe | Thermo Fisher Scientific | MB9204560TF-LAB | |
| 10 kDa Centricon Plus-70 Centrifugal Filter | Sigma | UFC701008 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| 96-well Flat Clear Bottom Black Polystyrene TC-treated Microplates | Costar | 3603 | |
| Agarose | Thermo Fisher Scientific | R0491 | |
| AKTA Fast Protein Liquid Chromatograph | GE Lifesciences | 29022094 | |
| BD PrecisionGlide Needle - 18G | BD Biosciences | 305196 | |
| Benzonase Nuclease | Sigma | E1014-25KU | |
| BioTek Synergy H1 Multimode Reader | BioTek | SH1M2G-SN | |
| Blue Juice Gel Loading Buffer | Invitrogen | 10816015 | |
| CaptoCore 700 resin | Cytiva | 17548102 | |
| Cellometer Auto 2000 Viability Counter | Nexcelom BioScience LLC | ||
| CryoStor CS10 freezing medium | Sigma | C2874 | |
| DPBS−/− | Fisher | BP399-1 | |
| Dual LED Blue/White Light Transilluminator | Invitrogen | LB0100 | |
| Duet P3202 Flow Control Pump | FiberCell Systems | ||
| Dulbecco's phosphate-buffered saline | Gibco | 14190250 | |
| Ethanol | Commercial Alcohols | P006EAAN | |
| Exosome-Depleted FBS | Gibco | A2720803 | |
| Fluorobrite DMEM | Gibco | A18967-01 | |
| Glucose meter | AccuCheck | Model 930 | |
| HiScale chromatography column 10/40 | Cytiva | 29360550 | |
| ImmunoCult-XF (GMP medium alternative) | StemCell Technologies | 100-0956 | |
| ImmunoCult-XF T Cell Expansion Medium | StemCell Technologies | 10981 | |
| Isopropyl Alcohol | EMD | PX1834-1 | |
| K562 cells | ATCC | CCL-243 | |
| LB media | BioBasic | SD7002 | |
| L-Lactate Assay Kit | Abcam | ab65331 | |
| Medium hollow-fibre cartridge | FiberCell Systems | C2011 | |
| MgCl2 | Sigma | M1028 | |
| Mycoplasma PCR detection kit | Abcam | ab289834 | |
| NanoSight NS300 | Malvern | ||
| NaOH | Supelco | SX0607N-6 | |
| NK92-MI cells | ATCC | CRL-2408 | |
| pH Strips-Mquant | Sigma | 1,09533 | |
| PrestoBlue HS Cell Viability Reagent Assay | Invitrogen | P50200 | |
| Qubit 4 Fluorometer | Invitrogen | ||
| Qubit dsDNA BR Assay Kit | Invitrogen | Q33262 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q33231 | |
| Qubit Flex Assay Tube Strips | Invitrogen | Q33252 | |
| Qubit Flex Fluorometer | Invitrogen | Q33327 | |
| Qubit Protein BR Assay Kit | Invitrogen | A50669 | |
| Quick Load 1Kb Plus DNA ladder | NEB | N0469S | |
| SYBRSafe DNA Gel Stain Invitrogen | Invitrogen | S33102 | |
| Syringe pump | Harvard Apparatus | 984730 | |
| Triton-X 100 | Sigma | T-9284 | |
| UltraPure TAE Buffer | Invitrogen | 15558042 | |
| ViaStain Acridine Orange and Propidium Iodide (AO/PI) Staining Solution | ESBE Scientific | CS2-0106 |
References
- Cheng, M., Chen, Y., Xiao, W., Sun, R., Tian, Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 10 (3), 230-252 (2013).
- Sheridan, C. Industry appetite for natural killer cells intensifies. Nat Biotechnol. 41 (2), 159-161 (2023).
- Shimasaki, N., Coustan-Smith, E., Kamiya, T., Campana, D. Expanded and armed natural killer cells for cancer treatment. Cytotherapy. 18 (11), 1422-1434 (2016).
- Elsharkasy, O. M., et al. Extracellular vesicles as drug delivery systems: Why and how. Adv Drug Deliv Rev. 159, 332-343 (2020).
- St-Denis-Bissonnette, F., et al. Applications of extracellular vesicles in triple-negative breast cancer. Cancers. 14 (2), 451 (2022).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- St-Denis-Bissonnette, F., et al. A clinically relevant large-scale biomanufacturing workflow to produce natural killer cells and natural killer cell-derived extracellular vesicles for cancer immunotherapy. J Extracell Vesicles. 12 (12), e12387 (2023).
- Federici, C., et al. Natural-killer-derived extracellular vesicles: Immune sensors and interactors. Front Immunol. 11, 262 (2020).
- Lugini, L., et al. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 189 (6), 2833-2842 (2012).
- Zhu, L., et al. Novel alternatives to extracellular vesicle-based immunotherapy - exosome mimetics derived from natural killer cells. Artif Cells Nanomed Biotechnol. 46 (sup3), S166-S179 (2018).
- Cochran, A. M., Kornbluth, J. Extracellular vesicles from the human natural killer cell line NK3.3 have broad and potent anti-tumor activity. Front Cell Dev Biol. 9, 698639 (2021).
- Kim, H. Y., et al. Delivery of human natural killer cell-derived exosomes for liver cancer therapy: an in vivo study in subcutaneous and orthotopic animal models. Drug Deliv. 29 (1), 2897-2911 (2022).
- Alvarez-Erviti, L., et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 29 (4), 341-345 (2011).
- El-Sahli, S., et al. A triple-drug nanotherapy to target breast cancer cells, cancer stem cells, and tumor vasculature. Cell Death Dis. 12 (1), 8 (2021).
- Sulaiman, A., et al. Co-targeting bulk tumor and CSCs in clinically translatable TNBC patient-derived xenografts via combination nanotherapy. Mol Cancer Ther. 18 (10), 1755-1764 (2019).
- Farcas, M., Inngjerdingen, M. Natural killer cell-derived extracellular vesicles in cancer therapy. Scand J Immunol. 92 (4), e12938 (2020).
- Murphy, D. E., et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking. Exp Mol Med. 51, 1-12 (2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- FiberCell-Systems. . FiberCell systems user manual & quick start guide. , (2024).
- St-Denis-Bissonnette, F., et al. Evaluation of resazurin phenoxazine dye as a highly sensitive cell viability potency assay for natural killer cell-derived extracellular vesicle-based cancer biotherapeutics. J Extracell Biology. 3 (7), e166 (2024).
- Herrmann, I. K., Wood, M. J. A., Fuhrmann, G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol. 16 (7), 748-759 (2021).
- Andaloussi, E. L. A., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Federici, C., et al. Exosome release and low pH belong to a framework of resistance of human melanoma cells to cisplatin. PLoS One. 9 (2), e88193 (2014).
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4, 27066 (2015).
- Neviani, P., et al. Natural killer-derived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 79 (6), 1151-1164 (2019).
- Sun, H., et al. Natural killer cell-derived exosomal miR-3607-3p inhibits pancreatic cancer progression by targeting IL-26. Front Immunol. 10, 2819 (2019).
- Jiang, Y., et al. Engineered exosomes: a promising drug delivery strategy for brain disease. Curr Med Chem. 29 (17), 3111-3124 (2022).
- Dosil, S. G., et al. Natural killer (NK) cell-derived extracellular-vesicle shuttled microRNAs control T cell responses. Elife. 11, e76319 (2022).
- Geeurickx, E., et al. The generation and use of recombinant extracellular vesicles as biological reference material. Nat Commun. 10 (1), 3288 (2019).
- Nathani, A., et al. Combined role of interleukin-15 stimulated natural killer cell-derived extracellular vesicles and carboplatin in osimertinib-resistant H1975 lung cancer cells with EGFR mutations. Pharmaceutics. 16 (1), 83 (2024).
- Gobin, J., et al. Hollow-fiber bioreactor production of extracellular vesicles from human bone marrow mesenchymal stromal cells yields nanovesicles that mirrors the immuno-modulatory antigenic signature of the producer cell. Stem Cell Res Ther. 12 (1), 127 (2021).
- Sun, L., et al. A 3D culture system improves the yield of MSCs-derived extracellular vesicles and enhances their therapeutic efficacy for heart repair. Biomed Pharmacother. 161, 114557 (2023).
- Ryu, A. H., Eckalbar, W. L., Kreimer, A., Yosef, N., Ahituv, N. Use antibiotics in cell culture with caution: genome-wide identification of antibiotic-induced changes in gene expression and regulation. Sci Rep. 7 (1), 7533 (2017).
- Meng, W., et al. Prospects and challenges of extracellular vesicle-based drug delivery system: considering cell source. Drug Deliv. 27 (1), 585-598 (2020).
- Yang, Y., et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. J Transl Med. 19 (1), 104 (2021).
- Gamez-Valero, A., et al. Size-exclusion chromatography-based isolation minimally alters extracellular vesicles' characteristics compared to precipitating agents. Sci Rep. 6, 33641 (2016).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 178 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved