Method Article
Fluxo de trabalho de biofabricação escalável para produzir e isolar bioterapêuticos de câncer baseados em vesículas extracelulares derivadas de células assassinas naturais
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
As vesículas extracelulares derivadas de células assassinas naturais (NK-EVs) têm potencial promissor como bioterapêuticos do câncer. Este estudo baseado em metodologia apresenta um fluxo de trabalho de biofabricação escalável em circuito fechado projetado para produzir e isolar continuamente grandes quantidades de NK-EVs de alta pureza. Os testes de controle em processo são realizados em todo o fluxo de trabalho de biofabricação, garantindo que os EVs atendam aos padrões de qualidade para liberação do produto.
Resumo
As vesículas extracelulares derivadas de células assassinas naturais (NK-EVs) estão sendo investigadas como bioterapêuticas do câncer. Eles possuem propriedades únicas como nanovesículas citotóxicas direcionadas a células cancerígenas e como comunicadores imunomoduladores. Um fluxo de trabalho de biofabricação escalável permite a produção de grandes quantidades de NK-EVs de alta pureza para atender às demandas pré-clínicas e clínicas. O fluxo de trabalho emprega um biorreator de fibra oca de circuito fechado, permitindo a produção contínua de NK-EVs da linhagem celular NK92-MI sob condições sem soro, sem xeno, sem alimentador e sem antibióticos, em conformidade com os padrões de Boas Práticas de Fabricação. Este estudo orientado por protocolo descreve o fluxo de trabalho de biofabricação para isolar NK-EVs usando cromatografia de exclusão de tamanho, ultrafiltração e esterilização baseada em filtro. A caracterização essencial do produto NK-EV é realizada por meio de análise de rastreamento de nanopartículas e sua funcionalidade é avaliada por meio de um ensaio de potência baseado em viabilidade celular validado contra células cancerígenas. Este processo de biofabricação escalável tem um potencial significativo para avançar na tradução clínica de bioterapêuticos de câncer baseados em NK-EV, aderindo às melhores práticas e garantindo a reprodutibilidade.
Introdução
Noséculo 21, avanços notáveis foram alcançados na batalha contra o câncer. Isso se deve principalmente ao aumento dos imunoterápicos contra o câncer, uma classe de medicamentos que aproveita o sistema imunológico para combater o câncer. As vesículas extracelulares derivadas de células assassinas naturais (NK-EVs) representam concorrentes promissores no domínio em expansão da imunoterapia. Integrativas à imunidade inata e adaptativa, as células NK desempenham um papel crucial na defesa do corpo contra células infectadas por vírus, estressadas e malignas. Eles empregam um arsenal abrangente de maquinário anticâncer para eliminar células anormais por meios citotóxicos 1,2,3. Entre esses mecanismos está a produção e secreção de EVs, estruturas de bicamada em nanoescala contendo várias biomoléculas, como proteínas, RNAs e DNAs, cruciais para facilitar a comunicação intercelular 4,5,6. Os NK-EVs surgem como terapêuticas promissoras sem células devido às suas propriedades transportadoras únicas. Isso inclui seu pequeno tamanho, permitindo esterilização baseada em filtro, alta biocompatibilidade, acúmulo preferencial dentro de tumores, amplo espectro de entrega de carga, capacidade de superar barreiras biológicas, como a barreira hematoencefálica, e perfil mínimo de toxicidade. Por várias razões, os NK-EVs evitam a necessidade de linfodepleção do paciente por meio de quimioterapia antes da administração: 1) convencionalmente, a linfodepleção é empregada para criar um ambiente mais hospitaleiro para a terapia baseada em células, permitindo que as células infundidas proliferem e exerçam seus efeitos terapêuticos; 2) ao contrário das células, os EVs não têm capacidade de replicação e são substancialmente menores em escala; 3) As EVs operam por meio de mecanismos distintos e exibem imunogenicidade diminuída em comparação com as células 5,6,7. Além disso, os NK-EVs exibiram consistentemente eficácia in vitro contra vários modelos de câncer e também mostraram efeitos imunomoduladores nas células imunes que promovem respostas anticancerígenas 8,9. Os resultados in vivo corroboram esses achados, mostrando regressão do câncer após o tratamento com NK-EV e toxicidades insignificantes 10,11,12. Portanto, a terapêutica baseada em NK-EV é uma grande promessa para enfrentar os desafios do tratamento de tumores sólidos frios e imunologicamente inertes 13,14,15,16,17.
Nosso estudo recente aborda um gargalo significativo para a tradução clínica de NK-EVs por meio da biofabricação7. O artigo apresenta uma prova de conceito para um fluxo de trabalho de biofabricação econômico e escalável de NK-EVs meticulosamente projetado para garantir testes de controle de qualidade em processo. Essa abordagem produziu continuamente grandes quantidades de bioterapêuticos de câncer baseados em NK-EV de alta pureza, com caracterização completa do produto conduzida de acordo com as diretrizes MISEV201818. A escalabilidade do fluxo de trabalho de biofabricação pode ser alcançada aumentando o tamanho do cartucho ou tendo vários biorreatores funcionando em paralelo. Da mesma forma, a escalabilidade do fluxo de trabalho de isolamento EV pode ser facilmente alcançada usando técnicas como cromatografia líquida de proteína rápida (FPLC) baseada em cromatografia de exclusão de tamanho (SEC), ultrafiltração (UF) e esterilização baseada em filtro. O sistema de biorreator de fibra oca de circuito fechado (HFB) cultivou a linha celular NK autossuficiente em IL-2 (células NK92-MI) sem a necessidade de suplementação sérica, um sistema alimentador e antibióticos. Isso foi feito usando um meio quimicamente definido e livre de xeno disponível comercialmente (uma versão GMP está agora disponível comercialmente). Como resultado, grandes quantidades de células NK (109 células viáveis) e NK-EVs (1012 EVs) foram produzidas com sucesso em 5 a 7 dias usando um único cartucho de biorreator de tamanho médio, com ambos os produtos extensivamente caracterizados. Durante todo o processo de biofabricação, a saúde celular foi monitorada diariamente usando métricas quantificáveis, como pH, glicose e níveis de lactato, juntamente com indicadores visuais, como cor do meio e qualquer sinal de contaminação, que são preditores essenciais da qualidade celular e EV. A avaliação pós-colheita da viabilidade e funcionalidade das células NK geradas no sistema HFB, particularmente a citotoxicidade, revelou um aumento significativo em comparação com as culturas baseadas em frascos7. Da mesma forma, os NK-EVs purificados exibiram um perfil de alta pureza, desprovido de bactérias, micoplasma, entidades virais comuns e componentes celulares, e com níveis insignificantes de endotoxina. É importante ressaltar que os NK-EVs purificados constituíram mais de 99,9% de todas as nanopartículas encontradas no produto final7. Por fim, esses NK-EVs purificados mantiveram as principais características NK, incluindo marcadores de superfície (CD2, CD45, CD56), carga útil de citocinas (GzmB, PFN, IFN-g) e demonstraram citotoxicidade potente contra células leucêmicas K562, a linha padrão-ouro para avaliar a citotoxicidade de células NK7.
O presente protocolo detalha o fluxo de trabalho de biofabricação escalável discutido acima. Ele elucida a metodologia para isolar NK-EVs produzidos usando FPLC-SEC acoplado a UF e esterilização baseada em filtro. Além disso, o protocolo descreve etapas essenciais, incluindo a caracterização do produto usando análise de rastreamento de nanopartículas (NTA), avaliação de qualidade usando várias ferramentas (quantificação de proteína/dsDNA e teste microbiano) e validação funcional do produto NK-EV purificado contra células cancerígenas por ensaio de viabilidade celular. Normalmente, esse fluxo de trabalho produz 1,0 - 1,5 mL de produto NK-EV com uma concentração média de 1,18 x 1012 EVs/mL7, totalizando um mínimo de 1 x 1012 EVs com base em aproximadamente 40 mL de CM rico em EV. Esse processo permite a liberação do produto para várias aplicações downstream, como estudos investigativos, pré-clínicos e multiômicos (proteômica, transcriptômica, genômica, metabolômica, lipidômica e epigenômica) que exigem grandes quantidades de EVs de alta qualidade, mantendo potencial para tradução clínica, com reprodutibilidade demonstrada.
Protocolo
1. Biofabricação de NK-EV a partir de células NK92-MI usando um biorreator de circuito fechado
NOTA: Os NK-EVs são fabricados usando um fluxo de trabalho de biofabricação escalável que adere às Boas Práticas de Fabricação (GMP) e utiliza as células NK92-MI (consulte a Figura 1). Nossa publicação recente tem insights detalhados sobre o procedimento de biofabricação e os perfis de identidade e segurança dos produtos NK-EV7.
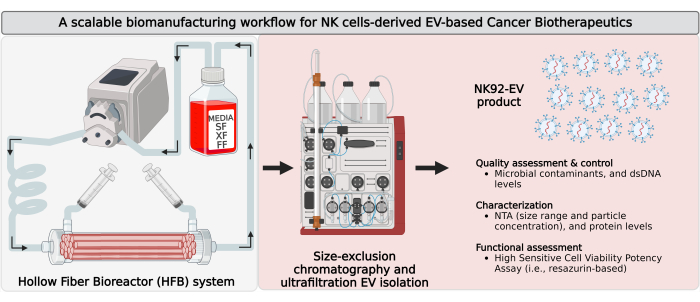
Figura 1: Biofabricação de vesículas extracelulares derivadas de células assassinas naturais (NK-EVs) em um biorreator de fibra oca de circuito fechado (HFB) com fluxo de trabalho de isolamento escalável. Representação esquemática do fluxo de trabalho de biofabricação para gerar grandes quantidades de produtos NK-EV de alta pureza. As células NK92-MI autossuficientes em IL-2 são semeadas em um cartucho HFB de circuito fechado e cultivadas em condições sem soro (SF), sem xeno (XF), sem alimentador e sem antibióticos, onde são cultivadas para coleta contínua de meio condicionado rico em EV. O isolamento de NK-EV de CM rico em EV é realizado por cromatografia de exclusão de tamanho baseada em cromatografia líquida de proteína rápida (FPLC-SEC) acoplada à ultrafiltração (UF). Os NK-EVs são caracterizados e avaliados por meio de vários ensaios, e sua funcionalidade contra células de leucemia K562 é avaliada usando um ensaio de potência de viabilidade. Esta figura foi modificada de7 (criada com Biorender.com). Clique aqui para ver uma versão maior desta figura.
- Partindo de 1 - 5 x 106 células NK92-MI e mantendo uma densidade celular entre 3 - 8 x 105 células / mL, cultive as células em frascos T25 - T175 usando um meio de cultura pré-aquecido. Incubar a 37 °C com 5% de CO2 (ver Tabela de Materiais). Substitua o meio a cada 2 - 3 dias até que 1 x 108 células NK92-MI sejam produzidas com pelo menos 70% de viabilidade.
NOTA: Mantenha 1/5th-1/3rd do meio condicionado (CM) ao semear novamente as células, pois contém fatores de crescimento favoráveis. - Execute a preparação do cartucho de HFB médio e a inoculação de células NK conforme descrito abaixo.
NOTA: Todas as manipulações devem ser realizadas dentro de um gabinete de biossegurança classe II para garantir e manter a esterilidade. Antes de mover o sistema de cartucho para o gabinete de biossegurança, pulverize generosamente com etanol 70%, prestando atenção especial ao gargalo do reservatório e às conexões da seringa.- Prepare o cartucho HFB de acordo com as instruções do fabricante19 (consulte a Tabela de Materiais; consulte a Figura 2) conforme descrito abaixo.
- Enrole as conexões Luer Lock com filme de cera e ajuste a vazão da bomba de acordo com as instruções do fabricante19. Condicione o cartucho de HFB permitindo que 150 mL de solução salina estéril tamponada com fosfato (PBS; consulte a Tabela de Materiais) circulem por pelo menos cinco dias.
- Para remover o ar do espaço capilar extracelular (ECS; o volume é de aproximadamente 29 mL), injete aproximadamente 40 mL de PBS pela porta ECS esquerda e permita que o ar escape pela porta ECS direita. Ao fazer isso, feche as braçadeiras da porta da extremidade esquerda e direita. Certifique-se de que a seringa esteja sempre conectada às portas ECS esquerda e direita.
- Depois de concluído, coloque o cartucho na bomba de fluxo (consulte a Tabela de Materiais) dentro da incubadora ajustada para 37 °C e 5% CO2. Certifique-se de que não haja vazamentos após alguns dias de circulação.
- Substitua o PBS por 150 mL de meio de cultura no frasco reservatório e o ECS 2 dias antes de semear as células no cartucho. Repetir os passos de condicionamento anteriores (passo 1.2.1) utilizando o meio de cultura, mas durante 2 dias de circulação.
- Antes de semear as células, substitua o conteúdo do frasco reservatório e do ECS por 250 mL de meio de cultura fresco.
- Adquirir o balão de cultura da incubadora e transferir as células para um tubo de 50 ml. Gire a 300 x g por 5 min. Ressuspenda o pellet celular usando 21 mL de meio de cultura.
- Preparar duas alíquotas de 20,5 μL cada da suspensão de células para contagem de células num contador de células automatizado (ver Tabela de Materiais). Para cada alíquota de suspensão celular de 20,5 μL, adicione uma quantidade igual de corante AO / PI (consulte a Tabela de Materiais) e misture para cima e para baixo pelo menos 10x.
NOTA: Não recomendamos o Trypan Blue para uma contagem precisa de células NK. Como alternativa, use um hemocitômetro para contagem manual. - Carregue 20 μL em cada câmara de contagem da lâmina de contagem e execute a contagem automatizada de células usando o programa apropriado. Calcule a concentração média de células vivas e observe a viabilidade.
- Misture a solução de células NK algumas vezes antes de aspirá-la usando uma seringa de 20 mL e uma agulha de 18 G para manter a esterilidade. Esta solução deve conter aproximadamente 1 x 108 células NK vivas em aproximadamente 20 mL ou cerca de 5 x 106 células / mL.
- Depois de remover a agulha da seringa, injete suavemente as células NK no cartucho através da porta ECS esquerda. Para garantir uma dispersão celular uniforme em todo o cartucho, alterne suavemente a solução celular pelo menos 10x usando as seringas conectadas às portas ECS esquerda e direita.
NOTA: a solução deve ter turbidez igual em ambas as seringas, com as portas das extremidades esquerda e direita fechadas. - Abra a porta final esquerda e direita e injete o que resta dentro das seringas. Feche as portas ECS esquerda e direita usando os grampos.
- Transfira o cartucho para a incubadora e deixe-o descansar por 30 minutos antes de instalá-lo corretamente na bomba de fluxo. Deixe o cartucho para biofabricação. Ajuste a vazão de acordo com o fabricante.
- Para monitorar as métricas de saúde celular, adquira uma alíquota de 0,5 mL de meio diariamente do meio bem misturado no frasco reservatório e armazene-o a -20 ° C após verificar os níveis de glicose e pH. Os níveis de L-lactato podem ser verificados posteriormente (ver Tabela de Materiais).
- Substitua o meio no reservatório (250 - 500 mL) a cada 1 - 2 dias para manter o teor de glicose acima de 50% dos níveis iniciais encontrados no meio e pH acima de 7,0 (faixa de 7,0 - 8,0).
- Prepare o cartucho HFB de acordo com as instruções do fabricante19 (consulte a Tabela de Materiais; consulte a Figura 2) conforme descrito abaixo.
- Realize a coleta de CM rico em NK-EV diariamente após 1 dia de descanso ao semear o cartucho pela primeira vez, conforme descrito abaixo.
- Mova o sistema de cartucho para o gabinete de biossegurança. Injete suavemente aproximadamente 21 mL de meio de cultura através da porta ECS esquerda para empurrar um volume equivalente de CM rico em EV através do ECS direito - não misture (veja a Figura 3).
NOTA: Sempre use plástico novo para evitar contaminação. - Transfira a solução de CM rica em EV para um tubo de 50 mL e centrifugue a 300 x g por 5 min. Enquanto isso, mova o sistema de cartucho de volta para a incubadora na bomba de fluxo.
- Transferir o sobrenadante para um novo tubo e centrifugar a 2000 x g durante 10 min. Novamente, transfira o sobrenadante para um novo tubo. Em seguida, alíquota do CM rico em EV igualmente em 3 tubos de 50 mL (~ 7 mL / tubo) e armazene a -80 ° C até processamento posterior.
NOTA: O CM rico em EV colhido sequencialmente é agrupado nesses três tubos, gerando três tubos de amostra replicados técnicos.
- Mova o sistema de cartucho para o gabinete de biossegurança. Injete suavemente aproximadamente 21 mL de meio de cultura através da porta ECS esquerda para empurrar um volume equivalente de CM rico em EV através do ECS direito - não misture (veja a Figura 3).
- Realize a colheita de células HFB-NK para continuar produzindo CM rico em EV usando o mesmo cartucho HFB descrito abaixo.
NOTA: As células NK podem ser colhidas do ECS do HFB executando o protocolo de colheita de células HFB-NK" assim que o cartucho atingir a confluência (máximo de 1 x 109 células). Isso acontece após 5 a 7 dias para cada lote ou quando o teor de glicose está abaixo do limite de detecção do medidor de glicose (por exemplo, sem leitura ou leituras de ~ 0) por 2 dias consecutivos. Se esta for a colheita final de células, o meio pode ser substituído por PBS para lavar o cartucho e recuperar as células.- Colha CM rico em EV exatamente conforme detalhado acima na etapa 1.3.
- Injete aproximadamente 50 mL do meio através da porta ECS esquerda. Para garantir a dispersão celular homogênea em todo o cartucho, empurre suavemente para frente e para trás a solução celular usando as seringas conectadas às portas ECS esquerda e direita pelo menos 10x para soltar as células antes de empurrá-las e coletá-las com uma seringa pela porta ECS direita. Transfira o CM rico em EV colhido para um tubo de 50 mL. Reserve a 37 °C (banho-maria ou incubadora) por enquanto.
NOTA: A ação de push-back ajuda a desalojar as células antes que sejam totalmente expelidas e coletadas por uma seringa através da porta ECS direita. A solução deve ter turbidez igual em ambas as seringas, com as portas das extremidades esquerda e direita fechadas. Tocar no cartucho do biorreator (perturbação física) pode ajudar a desalojar preventivamente o aglomerado de células na parte inferior do cartucho. A mistura agressiva da suspensão celular pode afetar negativamente a viabilidade das células recuperadas. Cuidado e paciência devem ser aplicados para maximizar a viabilidade. - Repita a última etapa 2x. No total, 150 mL de suspensão celular devem ser recuperados. Centrifugue a 300 x g por 5 min. Descarte o sobrenadante.
- Ressuspenda os dois grânulos celulares em 20 mL de meio fresco cada e combine-os. Colete duas alíquotas de 20,5 μL cada uma da suspensão de células para contagem de células em um contador de células automatizado (consulte a Tabela de Materiais).
NOTA: Normalmente, várias diluições de células usando PBS como diluente são necessárias para se enquadrar na faixa dinâmica do contador de células. - Para a alíquota de suspensão celular de 20,5 μL, adicione uma quantidade igual de corante AO/PI (consulte a Tabela de Materiais) e misture para cima e para baixo pelo menos 10x. Carregue 20 μL em cada câmara de contagem da lâmina de contagem e execute a contagem automatizada de células usando o programa apropriado.
- Calcule a média da concentração de células vivas de todas as contagens corrigidas por diluição, determine a quantidade total de células vivas e registre a viabilidade. Conforme detalhado acima, para produzir continuamente CM rico em EV usando o mesmo cartucho de biorreator, semeie novamente 1 x 108 células NK produzidas por HFB.
NOTA: Se desejado, as células NK produzidas por HFB podem ser armazenadas usando um meio de congelamento de criopreservação e um recipiente de congelamento para controlar a taxa de congelamento (consulte a Tabela de Materiais).

Figura 2: Componente e configuração do sistema de biorreator de fibra oca (HFB). O reservatório (1) contém o meio completo que circula pelo cartucho do biorreator (2) pela ação de uma bomba peristáltica (não mostrada) atuando na tubulação da bomba (3). As células são introduzidas no espaço capilar extracelular (ECS) através das portas laterais esquerda (4) e direita (5) do ECS. Uma vez que os grampos deslizantes ECS são fechados, as portas laterais esquerda (6) e direita (7) são abertas para permitir que o meio circule por todo o sistema. Observe a adição de filme de cera na conexão Luer Lock perto da tampa do reservatório do frasco médio para evitar contaminação potencial. Clique aqui para ver uma versão maior desta figura.
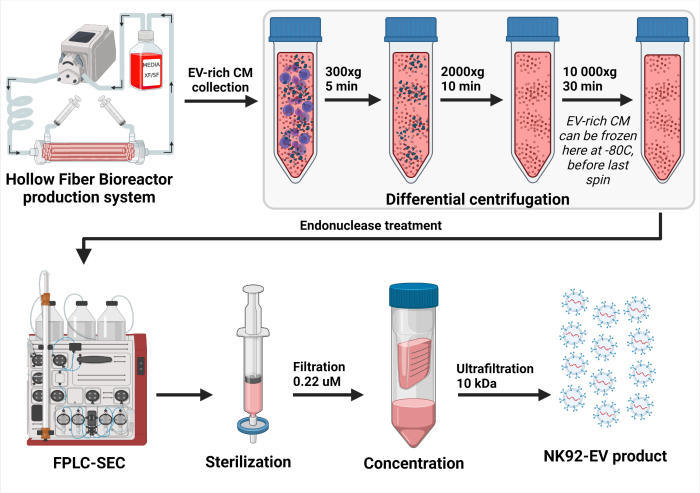
Figura 3: Representação esquemática do processo de isolamento NK-EV. Após a coleta diária do meio condicionado rico em EV (CM), a solução foi centrifugada diferencialmente para remover células (primeiro centrifugação a 300 x g por 5 min) e detritos celulares (segunda centrifugação a 2000 x g por 10 min). O CM rico em EV limpo foi armazenado a -80 °C até processamento posterior. Uma vez pronto para o isolamento NK-EV, o CM rico em EV congelado é descongelado e centrifugado mais uma vez para garantir a remoção de detritos celulares (terceira centrifugação a 10.000 x g por 30 min). Em seguida, o CM rico em EV é tratado por 2 a 4 h a 37 ° C com endonuclease para digerir ácidos nucléicos considerados contaminantes da célula hospedeira. Em seguida, o CM rico em EV é processado por cromatografia de exclusão de tamanho baseada em cromatografia líquida de proteína rápida (FPLC-SEC) para purificação de EV usando uma resina bimodal. Frações eluídas de aproximadamente 10 - 15 mL são combinadas e filtradas com filtros de 0,22 μM para garantir a esterilidade do produto NK-EV final. A ultrafiltração permite que o produto seja concentrado por um fator de cerca de 35 a 50X, produzindo uma concentração garantida de mais de 1 x 1012 EVs/mL, totalizando 1,0 a 1,5 mL. Esta figura foi modificada de7 (criado com Biorender.com). Clique aqui para ver uma versão maior desta figura.
2. Purificação de NK-EV por FPLC-SEC acoplada com UF e esterilização filtrante-baseada
- Preparar as seguintes soluções e filtrá-las duas vezes com um filtro de 0,1 μm (ver Tabela de Materiais): água (condutividade de 0 mS/cm), PBS: 50 mL de PBS 10x + 450 mL de água (condutividade em torno de 14,7 mS/cm), etanol a 20%, solução de limpeza (NaOH 0,5 M e álcool isopropílico a 30% em água).
- Execute a iniciação do sistema FPLC de acordo com as instruções do fabricante (consulte a Tabela de Materiais). Execute as etapas de limpeza no local (CIP) pré e pós-execução de acordo com as instruções do fabricante. Lave todas as linhas e a resina da coluna e enxágue com água com filtro duplo (DF), solução de limpeza, água DF e DF-PBS.
NOTA: Vale ressaltar que o CIP pode ser feito em outro dia, se necessário. - Utilizar uma coluna de cromatografia cheia de resina bimodal (ver Tabela de Materiais) com uma altura de leito de 20 cm. Faça as conexões usando o método gotejamento para gotejamento para garantir que nenhum ar seja introduzido dentro da coluna.
- Configure o coletor de frações com tubos de coleta apropriados e altere as configurações de fracionamento para o volume de coleta desejado (por exemplo, 15 mL). Coloque tubos suficientes e dois tubos adicionais para coletar todo o volume da amostra.
- Realize a preparação da amostra conforme descrito abaixo.
- Retire 40 - 80 mL de CM rico em EV do freezer a -80 °C e descongele rapidamente a 37 °C. Carregue a amostra na ultracentrífuga e gire a 10.000 x g por 30 min a 4 °C.
NOTA: Os tubos devem ser balanceados com precisão por peso, não por volume. - Depois de girar, colete o sobrenadante e transfira-o para um novo tubo. Para reduzir os níveis de dsDNA, trate o CM rico em EV com 50 U / mL de endonuclease e 1,5 mM de MgCl2 (ver Tabela de Materiais). Incubar durante 2 a 4 h numa incubadora (37 °C), permitindo uma mistura moderada.
- Retire 40 - 80 mL de CM rico em EV do freezer a -80 °C e descongele rapidamente a 37 °C. Carregue a amostra na ultracentrífuga e gire a 10.000 x g por 30 min a 4 °C.
- Quando o sistema (linhas e coluna) estiver pronto para o isolamento de EV, carregue o CM rico em EV em uma seringa de 60 mL e conecte-o à linha de amostra. Inicie o sistema clicando em Execução manual e defina a taxa de fluxo como 0. Siga as instruções do software para salvar a execução preventivamente e clique em Iniciar.
- Selecione a Linha B (DF-PBS) e opere a uma velocidade de fluxo de 150 cm/h (vazão de 2.0 mL/min). Certifique-se de que a solução seja executada na coluna.
- Assim que a condutividade se estabilizar, pressione Auto Zero UV. Altere o caminho do fluxo para direcionar a amostra para o frasco de resíduos antes da coluna. Certifique-se de que nenhuma bolha seja introduzida no sistema.
- Após um máximo de 5 a 20 s, direcione a amostra para a coluna. Clique em Fracionamento quando as leituras de UV atingirem aproximadamente 230 mAU.
- Uma vez que a amostra é completamente injetada através do sistema, mude o sistema tampão para DF-PBS (na válvula de amostra) para continuar a purificação. Clique em Fracionamento novamente quando o valor de UV atingir aproximadamente 1600 mAU.
NOTA: Isso corresponde à interseção entre as leituras de UV e as leituras de condutividade. O fracionamento mais longo apenas dilui o retentado sem aumentar o rendimento do EV. - Combinar todas as fracções (NK-EV diluídas) e conservá-las a 4 °C até estarem prontas para a esterilização e ultrafiltração (UF) por filtração.
- Continue executando o DF-PBS até que o valor de UV atinja aproximadamente 1000 mAU. Depois disso, pare de executar e salve o cromatograma como um documento PDF.
3. Esterilização e concentração à base de filtro do produto NK-EV por UF
- Arrefecer a centrífuga a 10 °C. Higienize todos os componentes do aparelho de UF (consulte a Tabela de Materiais) enxaguando com 20 a 30 mL de etanol a 90%. Gire a 4000 x g por 5 a 10 min.
NOTA: O filtro é feito de celulose regenerada MWCO de 10 kDa. - Descarte o fluxo e repita o enxágue usando PBS estéril para equilibrar o dispositivo. Repita 2x no total.
- Para maximizar a esterilidade, filtre a solução diluída de NK-EV usando um filtro de seringa de 0,22 μm pré-umedecido com DF-PBS (consulte a Tabela de Materiais). Recolher o filtrado directamente para o aparelho de concentração esterilizado.
- Gire a 4000 x g por 15 a 40 min (o tempo de centrifugação depende da amostra). Misturar a solução no compartimento superior do filtro com uma pipeta serológica após centrifugação. Gire a 4000 x g por mais 10 min.
NOTA: A etapa de mistura é opcional, pois simplesmente facilita a etapa de concentração, evitando que a membrana seja obstruída por EVs. - Separar temporariamente o fluxo e recolher a amostra NK-EV invertendo o dispositivo de filtração e fixando-o ao dispositivo de recolha.
- Gire a 2000 x g por 2 min. Transfira o produto purificado NK-EV para um tubo de 2 mL. Armazene o produto purificado NK-EV a 4 °C para uso de curto prazo (≤ 7 dias) ou congelado a -20 °C para uso de longo prazo.
4. Caracterização de NK-EV por Análise de Rastreamento de Nanopartículas (NTA)
- Prepare a solução e filtre-a duas vezes a 0,1 μm (ver Tabela de Materiais): água, PBS, solução de limpeza (alvejante a 10% (CUIDADO) em água).
- Inicie o sistema NTA de acordo com as instruções do fabricante. Da mesma forma, execute as etapas de limpeza no local (CIP) pré e pós-execução. Lave todas as linhas e enxágue com água com filtro duplo (DF), solução de limpeza e água DF. Equilibre as linhas usando DF-PBS.
- Verifique a célula de fluxo e verifique se há bolhas de ar. Remova as bolhas, se houver. Uma vez limpo, reinsira cuidadosamente a célula de fluxo no instrumento NTA.
NOTA: Embora não seja recomendado pelo fabricante, bolhas de ar muito difíceis de remover podem ser facilmente removidas enxaguando com etanol a 20% e depois com água DF. - Quando a célula de fluxo estiver no lugar e a porta estiver fechada, clique em Iniciar câmera. Com as linhas preenchidas com DF-PBS, a tela deve mostrar um número mínimo absoluto de partículas.
- Altere as configurações de captura para um ganho de tela de 2 e um nível de câmera de 14. Além disso, ligue o aquecedor para estabilizar a temperatura da célula de fluxo.
- Clique em Medição padrão para criar um script na guia SOP para coletar uma captura em 1 min a uma taxa de fluxo de 30 partículas/quadro e 23 °C.
- Logo abaixo, adicione a pasta e o nome do arquivo ao nome do caminho para salvar os dados.
- Preparar previamente as diluições do produto purificado NK-EV utilizando DF-PBS. Ao executar o NTA, a quantificação precisa requer 30 a 80 partículas/quadro.
- Vortex a amostra antes de colocá-la na seringa (consulte a Tabela de Materiais).
- Conecte cuidadosamente a seringa de aquisição de 1 mL à linha de carregamento do instrumento. Nenhum ar deve estar presente, pois afetará negativamente a aquisição e a análise. Empurre lentamente metade da amostra, deixando cerca de 0,5 mL na seringa.
- Quando as partículas estiverem visíveis na tela, foque a câmera para ter no máximo um halo ao redor de cada partícula. Clique em Infundir na guia Hardware a uma taxa de 1000 por 5 s. Em seguida, reduza para uma taxa de 30.
- Pressione Executar Script e siga as instruções. O software garantirá que a temperatura esteja definida e perguntará se as configurações estão corretas. Clique em Sim e siga as instruções do software.
- Depois de concluir a captura, clique em Cancelar quando o software solicitar o processamento ou exportação de arquivos. Clique em Infundir na guia Hardware a uma taxa de 1000 por 10 a 15 s. Enquanto isso, ligue novamente o aquecedor e a câmera. Em seguida, reduza a taxa para 30 até que as partículas se movam.
- Reúna mais quatro capturas repetindo as etapas anteriores. Depois que um total de cinco capturas tiver sido registrado por diluição, execute a análise após importar todas as cinco capturas.
- Selecione os arquivos a serem processados, destacando-os. Clique em Processar arquivos selecionados. Na guia Processo, ajuste as configurações de análise para um ganho de tela de 2 e um limite de detecção de 15.
As configurações dependem da amostra; Certifique-se de que 30 a 80 partículas por quadro estejam visíveis. - Marque e clique em OK para análise.
- Depois que os arquivos forem processados, o software solicitará a exportação. Clique em Sim sem clicar em caixas adicionais ou clique em Exportar.
- Repita para todas as diluições ou amostras EV. Desligue o instrumento NTA depois que todas as amostras forem concluídas e o CIP estiver concluído.
5. Teste de garantia de qualidade
- Realize testes microbianos usando dois testes: 1) uma pequena alíquota de NK-EVs purificados é enriquecida em meio de caldo LB autoclavado e 2) uma pequena alíquota de NK-EVs purificados é usada para detecção de PCR de micoplasma (ver Tabela de Materiais).
- Teste 1: cultura de meio LB a 37 °C por até 5 dias com controles positivos e negativos incluídos. Registre o OD600, se necessário.
- Teste 2: realizar a detecção de micoplasma PCR de acordo com o protocolo do fabricante.
- Quantifique proteínas e dsDNA em diluições purificadas de NK-EV usando ensaios baseados em fluorômetros de acordo com as instruções do fabricante (consulte a Tabela de Materiais).
6. Avaliação da potência de células cancerígenas tratadas com NK-EV usando um ensaio de viabilidade celular validado à base de resazurina altamente sensível 20
- Cultive células de leucemia K562 humanas usando RPMI-1640 com 10% de FBS inativado por calor por alguns dias antes de realizar o ensaio de potência (ver Tabela de Materiais). Mantenha a densidade entre 2 - 8 x 105 células/mL e substitua o meio a cada 2 - 3 dias.
- Adquira uma placa de fundo plano de 96 poços (consulte a Tabela de Materiais) e adicione preventivamente o volume de meio de ensaio (complementado com 5% de FBS empobrecido em EV) necessário para fins de normalização (consulte a Tabela de Materiais). O volume final é de 150 μL/poço.
NOTA: Use um pipetador repetidor para reduzir a variação de poço para poço. - Adquira a cultura de células e transfira as células para um tubo. Gire a 300 x g por 5 min. Ressuspenda o pellet celular em uma solução de célula única usando 2 a 5 mL de meio de ensaio.
- Colete uma alíquota de 20,5 μL da suspensão de células para contagem de células em um contador de células automatizado (consulte a Tabela de Materiais).
- Para a alíquota de suspensão celular de 20,5 μL, adicione uma quantidade igual de corante AO/PI (consulte a Tabela de Materiais) e misture para cima e para baixo pelo menos 10x.
NOTA: Recomendamos AO/PI para contagem precisa de células. Como alternativa, use um hemocitômetro para contagem manual. - Carregue 20 μL em cada câmara de contagem da lâmina de contagem e execute a contagem automatizada de células usando o programa apropriado. Calcule a média da concentração de células vivas e registre a viabilidade.
- Transfira aproximadamente 1 x 106 células para um tubo secundário. Dilua as células para precisamente 7 mL de meio de ensaio e repita a contagem de células. A concentração deve ser de aproximadamente 1,2 - 1,5 x 105células vivas / mL.
- Conforme detalhado acima, ajuste a concentração de suspensão de célula única para 1 x 105 células vivas / mL e repita a contagem de células, se necessário.
NOTA: O coeficiente de variação entre as contagens técnicas de duplicatas deve ser inferior a 25%; normalmente, é inferior a 5% com a contagem AO/PI. - Uma vez alcançada a concentração desejada, transfira 50 μL (± 1 μL) desta solução para cada poço para chegar o mais próximo possível de 5000 células/poço (4900 - 5100 células/poço). Prepare triplicados técnicos para cada condição de ensaio e use um pipetador repetidor para reduzir a variação de poço a poço.
- Transfira a placa para um agitador orbital (350 - 500 RPM) por 2 min. Transfira as células de volta para a incubadora até que estejam prontas para prosseguir com o tratamento com NK-EV.
- Prepare as diluições NK-EV necessárias (1:5, 1:10 e 1:100) usando um meio de ensaio.
- A partir dessas diluições, testar as seguintes concentrações de EV: 1 x 108, 5 x 108, 1 x 109, 5 x 109, 1 x 1010, 5 x 1010 e 1 x 1011 partículas/mL. O volume de dosagem é limitado a 20% do volume total do ensaio.
- Quando estiver pronto, transfira o volume necessário de uma determinada diluição para os poços que requerem uma concentração de EV desejada para tratamento. Adicione 15 μL de 10x Triton-X ao poço de controle positivo (consulte a Tabela de Materiais). O volume final do poço deve ser normalizado para 150 μL.
- Adicione a placa a um agitador orbital (350 - 500 RPM) por 2 min. Incubar as células a 37 °C na incubadora de CO2 a 5% durante 3 h.
- Pré-aqueça o leitor de placas (consulte a Tabela de Materiais) a 37 °C e carregue o seguinte script: 37 °C (reduz a variação relacionada à temperatura), mistura de 450 RPM por 1 min (garante a homogeneidade da amostra) e leia.
- Adicione 15 μL do reagente à base de resazurina a cada poço (consulte a Tabela de Materiais). Proteja o reagente da luz e use um pipetador repetidor para reduzir a variação de poço para poço.
- Adicione a placa a um agitador orbital (350 - 500 RPM) por 2 min. Transfira a placa para a incubadora e incube por 60 min. Remova as bolhas de ar usando uma ponta de pipeta embebida em etanol. Placa de leitura com uma excitação de 560 nm e uma emissão de 590 nm.
- Análise de dados: As réplicas técnicas médias foram calculadas e corrigidas para o fundo antes de realizar uma análise dose-resposta usando uma regressão não linear para o efeito de inibição mostrando a inclinação log(inibidor) vs. variável de resposta normalizada sem restrição. Registre os valores de Hillslope e EC50 .
Resultados
Os NK-EVs possuem funções citotóxicas inerentes e demonstraram alta eficácia contra vários modelos de câncer. No entanto, é necessário haver mais padronização entre os estudos atuais sobre um fluxo de trabalho de biofabricação adequado para a produção em larga escala de NK-EVs 6,21. Nosso estudo anterior descreveu a viabilidade de um sistema de biorreator de fibra oca (HFB) de circuito fechado para produzir grandes quantidades de produtos NK-EV de alta pureza7. Como acompanhamento, este estudo baseado em protocolo detalha o fluxo de trabalho de biofabricação e demonstra sua reprodutibilidade produzindo e isolando o produto NK-EV (Figura 1). Além disso, a caracterização e validação essenciais do produto são necessárias antes da liberação do produto, por meio da qual dados novos e originais são apresentados neste estudo.
O sistema HFB foi selecionado para a produção de NK-EV devido à sua facilidade de uso, confiabilidade, escalabilidade e conformidade com GMP7. Em referência à configuração do sistema HFB, as células NK são injetadas através da porta ECS esquerda e semeadas no cartucho do biorreator (Figura 2). Ao mesmo tempo, a garrafa de mídia é conectada ao HFB através das portas laterais e a mídia pode fluir por todo o sistema. As células NK são cultivadas em meio sem soro, sem xeno, sem alimentador e sem antibióticos, onde o meio é substituído quando o teor de glicose cai abaixo de 50% para manter e maximizar a saúde celular ao longo do tempo. O CM é coletado diariamente, processado por centrifugação diferencial e mantido congelado (-80 °C) até que esteja pronto para processamento posterior. Posteriormente, o isolamento EV é conduzido por meio de uma combinação de centrifugações diferenciais e FPLC-SEC acopladas a UF e filtração (Figura 3). Isso resulta em um produto NK-EV concentrado e estéril com um volume final de aproximadamente 1,0 - 1,5 mL. Um cromatograma representativo do isolamento FPLC-SEC de NK-EVs é fornecido (Figura 4). Antes do processamento de FPLC-SEC, o CM rico em NK-EV é tratado com endonuclease, reduzindo significativamente os níveis de dsDNA, um potencial contaminante da célula hospedeira (NK)7. Assim, o fluxo de trabalho de isolamento EV descrito remove detritos celulares e contaminantes de RNA/DNA do produto NK-EV, o que é essencial para garantir um potencial imunogênico baixo e indesejado e que o produto final seja adequado para estudos a jusante.
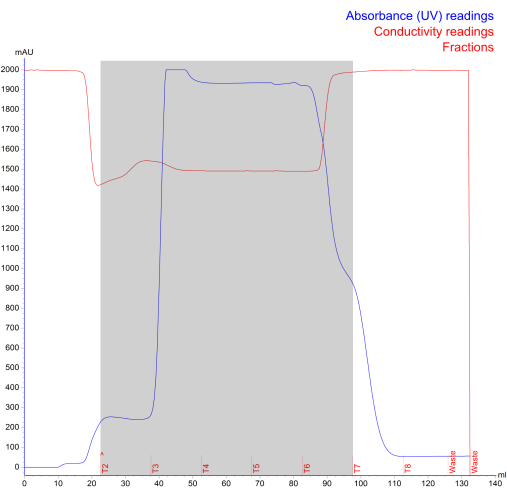
Figura 4: Cromatograma de isolamento NK-EV gerado durante a exclusão do tamanho da cromatografia líquida de proteína rápida. A linha azul representa a absorbância (mAU; leitura máxima de 2000 mAU), a linha vermelha representa a condutividade, o texto vermelho representa o log de execução e a área sombreada cinza representa os NK-EVs fracionados (denotados pelas frações T2 - T7). Clique aqui para ver uma versão maior desta figura.
Após o isolamento, a caracterização básica do NK-EV e os testes de garantia de qualidade são usados para avaliar se o produto NK-EV pode ser liberado para experimentação posterior a jusante. A faixa de tamanho e a concentração de partículas do produto NK-EV são medidas usando análise de rastreamento de nanopartículas (NTA), com tamanhos variando de 76,30 a 174,30 nm de diâmetro (D10 de 78,38 ± 2,07 nm, D50 de 106,72 ± 2,43 nm e D90 de 169,80 ± 4,17 nm) e uma concentração média de 1,39 x 1012 EVs/mL (Figura 5A-B). Além disso, a quantificação do fluorômetro mostrou uma concentração de proteína e dsDNA de 298,90 ± 66,62 mg/mL e 225,60 ± 37,7 ng/mL para o produto final, respectivamente (Figura 5C-D). Isso corresponde a uma proporção média de 5,06 x 106 EV / μg de proteína e 6,16 x 1012 EV / μg de DNA. Os testes microbiano e micoplasma retornaram resultados negativos (dados não mostrados). Esses resultados são consistentes com a caracterização de NK-EVs de trabalhos anteriores7. A publicação anterior7 também fornece uma caracterização mais aprofundada dos produtos NK-EV seguindo as diretrizes MISEV (ou seja, TEM, western blot, nível de endotoxina, entidades virais e citometria de fluxo para antígenos de superfície e citocinas).
Por fim, a funcionalidade do produto NK-EV (ou seja, citotoxicidade contra células cancerígenas) foi avaliada usando um ensaio de viabilidade celular validado à base de resazurina altamente sensível após o tratamento com NK-EV contra a linha celular leucêmica K562 7,20. O tratamento celular K562 com NK-EVs por 3 h produziu um efeito dose-dependente na viabilidade celular, correspondendo a um EC50 de 9,33 x 109 EVs/mL (ou seja, a dosagem que corresponde à morte de 50% da população celular; Figura 6A-B). Assim, seguindo os critérios de lançamento do produto descritos, o produto NK-EV é considerado adequado para experimentação posterior.
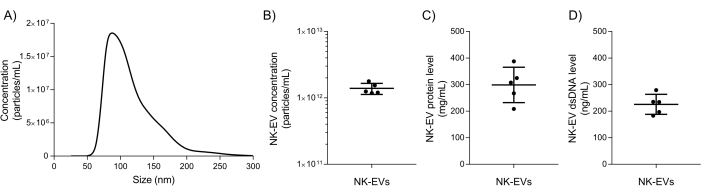
Figura 5: Caracterização do produto NK-EV purificado. (A) Distribuição do tamanho do produto NK-EV medida por NTA, mostrada como média de 5 experimentos independentes, cada um com 10 réplicas técnicas (5 capturas de vídeo x 2 diluições). (B) Concentração do produto da partícula NK-EV (partículas/mL) medida por NTA, apresentada como média ± DP de 5 experimentos independentes, cada um com duplicatas técnicas. (C) A concentração proteica do produto NK-EV (mg/mL) foi medida usando um fluorômetro, apresentado como média ± DP de 5 experimentos independentes, cada um com triplicatas técnicos. (D) Concentração de dsDNA do produto NK-EV (ng/mL) medida usando um fluorômetro, apresentada como média ± DP de 5 experimentos independentes, cada um com triplicados técnicos. Clique aqui para ver uma versão maior desta figura.
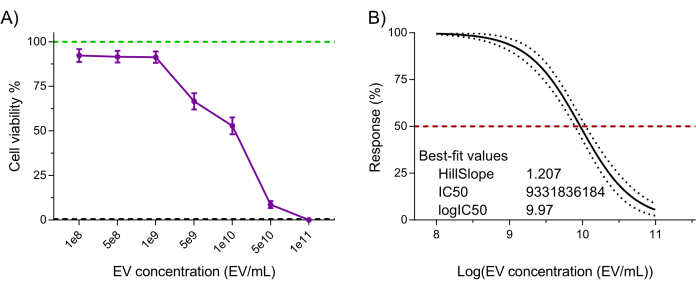
Figura 6: Validação funcional do produto NK-EV purificado. Os NK-EVs demonstram uma citotoxicidade dependente da dose contra células de leucemia K562 humanas tratadas em várias concentrações de NK-EV por 3 horas usando um ensaio de viabilidade celular baseado em resazurina de alta sensibilidade. (A) Leituras de ensaio normalizadas (a linha verde representa o controle de células de leucemia K562 não tratadas, e a linha tracejada preta representa o controle de células mortas de leucemia K562 lisada; tratado com detergente). Os dados são mostrados como média ± SEM de 11 experimentos independentes com triplicados técnicos. (B) Análise da curva EC50 com uma inclinação variável para o tratamento NK-EV com intervalo de confiança/bandas de previsão de 95% (a linha tracejada vermelha representa 50% de resposta). Clique aqui para ver uma versão maior desta figura.
Discussão
Vários estudos sugerem que os NK-EVs possuem vasto potencial como terapêutica anticancerígena 4,5,7,9,16,22,23,24,25,26,27,28,29,30 . No entanto, um sistema de biofabricação escalável compatível com GMP, capaz de produzir grandes quantidades de NK-EVs de alta pureza, é necessário para testes pré-clínicos adicionais e futuras aplicações clínicas. Para resolver esse problema, um estudo anterior usou um sistema HFB de circuito fechado para produzir continuamente células NK e CM ricas em NK-EV adequadas para experimentação a jusante. Devido ao seu design 3D, os sistemas HFB refletem de perto as condições do sistema vascular e possuem uma relação área-volume de superfície incrivelmente alta, permitindo que mais de um bilhão de células permaneçam em cultura, levando a uma melhor produção de EV 7,31,32. É importante ressaltar que este trabalho foi o primeiro a relatar o uso de um sistema HFB para cultura de células NK, provavelmente devido à autossuficiência da linha celular IL-27.
Medidas adicionais devem ser tomadas para garantir a esterilidade do sistema HFB e a produção de NK-EVs de alta pureza. Essas precauções são especialmente cruciais na ausência de uma sala limpa e estéril, o que pode ser o caso de várias instalações de pesquisa. Antes de entrar no gabinete de biossegurança, o sistema HFB é meticulosamente pulverizado com etanol 70% para desinfetar todas as superfícies externas. Além disso, o filme de cera é enrolado em todas as conexões Luer Lock para minimizar o risco de contaminação. Isso é particularmente importante, pois esse fluxo de trabalho de biofabricação não usa antibióticos, que são conhecidos por afetar o perfil bioquímico de células e produtos derivados de células33. Várias métricas foram usadas para avaliar a saúde celular durante a biofabricação de produtos celulares. Por exemplo, foram realizadas avaliações diárias dos níveis de pH, glicose e lactato do meio reservatório, pois são substitutos vitais da saúde celular para monitoramento. Além das avaliações quantitativas, as observações qualitativas do sistema HFB (por exemplo, cor da mídia e sinais visuais de contaminação, como turbidez) também são úteis para monitorar a saúde celular. A contagem de células no CM recuperado diariamente não foi considerada uma métrica representativa de viabilidade para a saúde da cultura (dados não mostrados). Isso é provavelmente resultado de células mortas recuperadas durante a amostragem de CM que foram encontradas dentro da tubulação onde o meio não podia circular (a pequena seção entre o ECS e a porta da seringa do ECS), subestimando assim a viabilidade da cultura celular geral. Somente células NK colhidas produzidas pelo HFB no final de um lote de produção podem fornecer uma métrica confiável da saúde da cultura. Essas células apresentaram consistentemente valores de viabilidade acima de 70% em todos os lotes de produção7. Juntos, esses métodos de avaliação de qualidade garantem a produção contínua de NK-EVs de alta pureza.
Várias técnicas de isolamento foram desenvolvidas para purificar e isolar EVs34. Um método, SEC, utiliza uma coluna embalada com um material poroso - resina - permitindo a separação de moléculas com base na discriminação de tamanho. Aqui, os EVs maiores são eluídos através da coluna mais rapidamente; Este método é conhecido como purificação de fluxo com base na exclusão de tamanho. Ao mesmo tempo, contaminantes menores (dsDNA, proteínas flutuantes como endonuclease, sais, vermelho de fenol, etc.) são deixados para trás e retidos dentro da resina por forças eletrostáticas (ou seja, uma resina bimodal foi usada). O processamento baseado em SEC remove proteínas não ligadas a EV, mantendo a estrutura e funcionalidade originais de EV 35,36. Além disso, a purificação baseada em SEC é facilmente escalável sem comprometer o alto rendimento e a pureza, tornando-a uma escolha adequada para isolar NK-EVs para usos bioterapêuticos. Apesar dessas vantagens, o SEC tem algumas desvantagens, como o fluxo relativamente diluído (eluente); portanto, o UF é necessário para a concentração do produto, mas também permite a troca de tampão. O aparelho UF não estéril é enxaguado com etanol 70% e PBS e mantido no gabinete de biossegurança antes do uso para garantir a esterilidade. Normalmente, o fluxo pode ser concentrado em 35x-50x do volume inicial, removendo pequenas moléculas que poderiam ter entrado no eluente. A centrifugação diferencial e o tratamento com endonuclease são realizados antes do FPLC-SEC acoplado ao UF para remover células residuais, detritos celulares e longas fitas de dsDNA antigênico7.
Após o isolamento do produto NK-EV, a caracterização e a validação funcional são realizadas de acordo com as diretrizes da MISEV2018 e MISEV2023 para determinar a adequação do produto para uso posterior 6,18. Cada isolamento produz 1,0 - 1,5 mL de produto NK-EV de alta pureza a uma concentração mínima de 1 x 1012 EVs/mL, com uma concentração média de 1,39 x 1012 partículas/mL. Anteriormente, Gupta et al. determinaram que a dosagem média de EV in vivo é de 3,37 x 108 EVs / kg de peso corporal de camundongos37. O tratamento com a dosagem mediana exigiria 8,43 x 106 EVs/camundongo com um peso corporal de 25 g, um valor muito abaixo do mínimo garantido (1 x 1012 partículas/mL) obtido por meio desse fluxo de trabalho. Assim, o fluxo de trabalho de biofabricação descrito pode produzir NK-EVs mais do que suficientes para experimentação pré-clínica ou para atender às metas de dosagem. Cada isolamento é testado quanto à presença de micoplasma e microbiana como parte da avaliação de controle de qualidade do produto. Além disso, um estudo anterior demonstrou a ausência de entidades virais comuns e endotoxina no produto final e a ausência de componentes celulares considerados contaminantes da célula hospedeira (por análise de western blot)7,34. Por fim, a avaliação funcional foi realizada usando um ensaio de viabilidade celular validado à base de resazurina altamente sensível para avaliar a funcionalidade dos NK-EVs20. O ensaio de viabilidade descrito funciona reduzindo a resazurina (fracamente fluorescente) a resorufin (altamente fluorescente) por células metabolicamente ativas, permitindo a avaliação da viabilidade celular após o tratamento com NK-EV. Em comparação com outros ensaios alternativos de viabilidade celular, o ensaio baseado em resazurina usado no estudo é altamente sensível a mudanças na viabilidade celular (ruído de fundo muito baixo) e permite um tempo de incubação mais curto para observar os resultados (menos de 30 minutos para obter resultados estatisticamente significativos)20. Geralmente, os NK-EVs exibem um efeito dose-dependente sobre a viabilidade do K562. Juntos, os resultados apresentados representam um produto NK-EV que atendeu aos critérios de liberação do produto para avaliação pré-clínica e é adequado para aplicações a jusante.
Em conclusão, este estudo baseado em protocolo descreve a biofabricação de NK-EVs com potencial de grau clínico. Conforme discutido, os NK-EVs são produzidos usando um sistema HFB de circuito fechado em condições sem soro, sem xeno, sem alimentador e sem antibióticos7. Uma combinação de FPLC-SEC/UF isola e purifica o produto NK-EV. Antes de liberar os produtos para aplicação a jusante, os NK-EVs devem ser caracterizados e validados funcionalmente para garantir que sejam adequados para uso. Conforme demonstrado, seguir este protocolo de biofabricação pode gerar com sucesso uma grande quantidade de NK-EVs de alta pureza que exibem citotoxicidade no alvo contra células cancerígenas. Portanto, o protocolo de biofabricação descrito pode ser um trunfo para estudos futuros que necessitem da produção de NK-EVs de grau clínico.
Divulgações
Todos os autores declaram não haver conflito de interesse ou divulgação.
Agradecimentos
Os autores gostariam de agradecer aos Drs. Simon Sauvé, Roger Tam e Xu Zhang por sua revisão crítica do manuscrito. Este trabalho foi apoiado por subsídios operacionais da Iniciativa de Pesquisa e Desenvolvimento Genômico (GRDI) Fase VII (2019-2025) do Governo do Canadá obtidos por JRL, LW, bem como subsídios operacionais do Conselho de Pesquisa em Ciências Naturais e Engenharia RGPIN-2019-05220, Sociedade de Pesquisa do Câncer/Universidade de Ottawa 24064, o Subsídio Operacional de Pesquisa dos Institutos Canadenses de Saúde (CIHR) 175177 obtido por LW, a Bolsa de Mestrado CIHR obtida pelo MK e as Bolsas de Estudo Rainha Elizabeth II em Ciência e Tecnologia (QEII-GSST) obtidas pelo FSDB.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.1 µm vacuum filtration unit Filtropur V50 | Sarstedt | 83,3941,002 | |
| 0.22 µm Acrodisc Syringe Filter | Pall Corporation | PN4612 | |
| 1 mL syringe | Thermo Fisher Scientific | MB9204560TF-LAB | |
| 10 kDa Centricon Plus-70 Centrifugal Filter | Sigma | UFC701008 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| 96-well Flat Clear Bottom Black Polystyrene TC-treated Microplates | Costar | 3603 | |
| Agarose | Thermo Fisher Scientific | R0491 | |
| AKTA Fast Protein Liquid Chromatograph | GE Lifesciences | 29022094 | |
| BD PrecisionGlide Needle - 18G | BD Biosciences | 305196 | |
| Benzonase Nuclease | Sigma | E1014-25KU | |
| BioTek Synergy H1 Multimode Reader | BioTek | SH1M2G-SN | |
| Blue Juice Gel Loading Buffer | Invitrogen | 10816015 | |
| CaptoCore 700 resin | Cytiva | 17548102 | |
| Cellometer Auto 2000 Viability Counter | Nexcelom BioScience LLC | ||
| CryoStor CS10 freezing medium | Sigma | C2874 | |
| DPBS−/− | Fisher | BP399-1 | |
| Dual LED Blue/White Light Transilluminator | Invitrogen | LB0100 | |
| Duet P3202 Flow Control Pump | FiberCell Systems | ||
| Dulbecco's phosphate-buffered saline | Gibco | 14190250 | |
| Ethanol | Commercial Alcohols | P006EAAN | |
| Exosome-Depleted FBS | Gibco | A2720803 | |
| Fluorobrite DMEM | Gibco | A18967-01 | |
| Glucose meter | AccuCheck | Model 930 | |
| HiScale chromatography column 10/40 | Cytiva | 29360550 | |
| ImmunoCult-XF (GMP medium alternative) | StemCell Technologies | 100-0956 | |
| ImmunoCult-XF T Cell Expansion Medium | StemCell Technologies | 10981 | |
| Isopropyl Alcohol | EMD | PX1834-1 | |
| K562 cells | ATCC | CCL-243 | |
| LB media | BioBasic | SD7002 | |
| L-Lactate Assay Kit | Abcam | ab65331 | |
| Medium hollow-fibre cartridge | FiberCell Systems | C2011 | |
| MgCl2 | Sigma | M1028 | |
| Mycoplasma PCR detection kit | Abcam | ab289834 | |
| NanoSight NS300 | Malvern | ||
| NaOH | Supelco | SX0607N-6 | |
| NK92-MI cells | ATCC | CRL-2408 | |
| pH Strips-Mquant | Sigma | 1,09533 | |
| PrestoBlue HS Cell Viability Reagent Assay | Invitrogen | P50200 | |
| Qubit 4 Fluorometer | Invitrogen | ||
| Qubit dsDNA BR Assay Kit | Invitrogen | Q33262 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q33231 | |
| Qubit Flex Assay Tube Strips | Invitrogen | Q33252 | |
| Qubit Flex Fluorometer | Invitrogen | Q33327 | |
| Qubit Protein BR Assay Kit | Invitrogen | A50669 | |
| Quick Load 1Kb Plus DNA ladder | NEB | N0469S | |
| SYBRSafe DNA Gel Stain Invitrogen | Invitrogen | S33102 | |
| Syringe pump | Harvard Apparatus | 984730 | |
| Triton-X 100 | Sigma | T-9284 | |
| UltraPure TAE Buffer | Invitrogen | 15558042 | |
| ViaStain Acridine Orange and Propidium Iodide (AO/PI) Staining Solution | ESBE Scientific | CS2-0106 |
Referências
- Cheng, M., Chen, Y., Xiao, W., Sun, R., Tian, Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 10 (3), 230-252 (2013).
- Sheridan, C. Industry appetite for natural killer cells intensifies. Nat Biotechnol. 41 (2), 159-161 (2023).
- Shimasaki, N., Coustan-Smith, E., Kamiya, T., Campana, D. Expanded and armed natural killer cells for cancer treatment. Cytotherapy. 18 (11), 1422-1434 (2016).
- Elsharkasy, O. M., et al. Extracellular vesicles as drug delivery systems: Why and how. Adv Drug Deliv Rev. 159, 332-343 (2020).
- St-Denis-Bissonnette, F., et al. Applications of extracellular vesicles in triple-negative breast cancer. Cancers. 14 (2), 451 (2022).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- St-Denis-Bissonnette, F., et al. A clinically relevant large-scale biomanufacturing workflow to produce natural killer cells and natural killer cell-derived extracellular vesicles for cancer immunotherapy. J Extracell Vesicles. 12 (12), e12387 (2023).
- Federici, C., et al. Natural-killer-derived extracellular vesicles: Immune sensors and interactors. Front Immunol. 11, 262 (2020).
- Lugini, L., et al. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 189 (6), 2833-2842 (2012).
- Zhu, L., et al. Novel alternatives to extracellular vesicle-based immunotherapy - exosome mimetics derived from natural killer cells. Artif Cells Nanomed Biotechnol. 46 (sup3), S166-S179 (2018).
- Cochran, A. M., Kornbluth, J. Extracellular vesicles from the human natural killer cell line NK3.3 have broad and potent anti-tumor activity. Front Cell Dev Biol. 9, 698639 (2021).
- Kim, H. Y., et al. Delivery of human natural killer cell-derived exosomes for liver cancer therapy: an in vivo study in subcutaneous and orthotopic animal models. Drug Deliv. 29 (1), 2897-2911 (2022).
- Alvarez-Erviti, L., et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 29 (4), 341-345 (2011).
- El-Sahli, S., et al. A triple-drug nanotherapy to target breast cancer cells, cancer stem cells, and tumor vasculature. Cell Death Dis. 12 (1), 8 (2021).
- Sulaiman, A., et al. Co-targeting bulk tumor and CSCs in clinically translatable TNBC patient-derived xenografts via combination nanotherapy. Mol Cancer Ther. 18 (10), 1755-1764 (2019).
- Farcas, M., Inngjerdingen, M. Natural killer cell-derived extracellular vesicles in cancer therapy. Scand J Immunol. 92 (4), e12938 (2020).
- Murphy, D. E., et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking. Exp Mol Med. 51, 1-12 (2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- FiberCell-Systems. . FiberCell systems user manual & quick start guide. , (2024).
- St-Denis-Bissonnette, F., et al. Evaluation of resazurin phenoxazine dye as a highly sensitive cell viability potency assay for natural killer cell-derived extracellular vesicle-based cancer biotherapeutics. J Extracell Biology. 3 (7), e166 (2024).
- Herrmann, I. K., Wood, M. J. A., Fuhrmann, G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol. 16 (7), 748-759 (2021).
- Andaloussi, E. L. A., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Federici, C., et al. Exosome release and low pH belong to a framework of resistance of human melanoma cells to cisplatin. PLoS One. 9 (2), e88193 (2014).
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4, 27066 (2015).
- Neviani, P., et al. Natural killer-derived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 79 (6), 1151-1164 (2019).
- Sun, H., et al. Natural killer cell-derived exosomal miR-3607-3p inhibits pancreatic cancer progression by targeting IL-26. Front Immunol. 10, 2819 (2019).
- Jiang, Y., et al. Engineered exosomes: a promising drug delivery strategy for brain disease. Curr Med Chem. 29 (17), 3111-3124 (2022).
- Dosil, S. G., et al. Natural killer (NK) cell-derived extracellular-vesicle shuttled microRNAs control T cell responses. Elife. 11, e76319 (2022).
- Geeurickx, E., et al. The generation and use of recombinant extracellular vesicles as biological reference material. Nat Commun. 10 (1), 3288 (2019).
- Nathani, A., et al. Combined role of interleukin-15 stimulated natural killer cell-derived extracellular vesicles and carboplatin in osimertinib-resistant H1975 lung cancer cells with EGFR mutations. Pharmaceutics. 16 (1), 83 (2024).
- Gobin, J., et al. Hollow-fiber bioreactor production of extracellular vesicles from human bone marrow mesenchymal stromal cells yields nanovesicles that mirrors the immuno-modulatory antigenic signature of the producer cell. Stem Cell Res Ther. 12 (1), 127 (2021).
- Sun, L., et al. A 3D culture system improves the yield of MSCs-derived extracellular vesicles and enhances their therapeutic efficacy for heart repair. Biomed Pharmacother. 161, 114557 (2023).
- Ryu, A. H., Eckalbar, W. L., Kreimer, A., Yosef, N., Ahituv, N. Use antibiotics in cell culture with caution: genome-wide identification of antibiotic-induced changes in gene expression and regulation. Sci Rep. 7 (1), 7533 (2017).
- Meng, W., et al. Prospects and challenges of extracellular vesicle-based drug delivery system: considering cell source. Drug Deliv. 27 (1), 585-598 (2020).
- Yang, Y., et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. J Transl Med. 19 (1), 104 (2021).
- Gamez-Valero, A., et al. Size-exclusion chromatography-based isolation minimally alters extracellular vesicles' characteristics compared to precipitating agents. Sci Rep. 6, 33641 (2016).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 178 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados