Method Article
Doğal öldürücü hücre kaynaklı hücre dışı vezikül bazlı kanser biyoterapötiklerini üretmek ve izole etmek için ölçeklenebilir biyoüretim iş akışı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Doğal öldürücü hücre kaynaklı hücre dışı veziküller (NK-EV'ler), kanser biyoterapötikleri olarak umut verici bir potansiyele sahiptir. Bu metodolojiye dayalı çalışma, büyük miktarlarda yüksek saflıkta NK-EV'leri sürekli olarak üretmek ve izole etmek için tasarlanmış, ölçeklenebilir bir kapalı döngü biyoüretim iş akışı sunmaktadır. Biyo-üretim iş akışı boyunca süreç içi kontrol testi gerçekleştirilir ve EV'lerin ürün piyasaya sürülmesi için kalite standartlarını karşılaması sağlanır.
Özet
Doğal öldürücü hücre kaynaklı hücre dışı veziküller (NK-EV'ler) kanser biyoterapötikleri olarak araştırılmaktadır. Kanser hücrelerini hedef alan sitotoksik nanoveziküller ve immünomodülatör iletişimciler olarak benzersiz özelliklere sahiptirler. Ölçeklenebilir bir biyoüretim iş akışı, klinik öncesi ve klinik talepleri karşılamak için büyük miktarlarda yüksek saflıkta NK-EV'lerin üretilmesini sağlar. İş akışı, İyi Üretim Uygulamaları standartlarına uygun olarak serumsuz, ksenosuz, besleyicisiz ve antibiyotiksiz koşullar altında NK92-MI hücre hattından NK-EV'lerin sürekli üretimini sağlayan kapalı döngü içi boş fiber bir biyoreaktör kullanır. Bu protokol odaklı çalışma, boyut dışlama kromatografisi, ultrafiltrasyon ve filtre tabanlı sterilizasyon kullanarak NK-EV'leri izole etmek için biyoüretim iş akışını özetlemektedir. Temel NK-EV ürün karakterizasyonu, nanopartikül izleme analizi yoluyla gerçekleştirilir ve işlevsellikleri, kanser hücrelerine karşı doğrulanmış hücre canlılığına dayalı bir potens testi yoluyla değerlendirilir. Bu ölçeklenebilir biyoüretim süreci, en iyi uygulamalara bağlı kalarak ve tekrarlanabilirliği sağlayarak NK-EV tabanlı kanser biyoterapötiklerinin klinik çevirisini ilerletmek için önemli bir potansiyele sahiptir.
Giriş
21. yüzyılda, kansere karşı savaşta kayda değer ilerlemeler kaydedilmiştir. Bu, esas olarak, kanserle savaşmak için bağışıklık sistemini kullanan bir ilaç sınıfı olan kanser immünoterapötiklerinin yükselişinden kaynaklanmaktadır. Doğal öldürücü hücre kaynaklı hücre dışı veziküller (NK-EV'ler), genişleyen immünoterapi alanında umut verici yarışmacıları temsil eder. Doğuştan gelen ve adaptif bağışıklığı bütünleştiren NK hücreleri, vücudun virüs bulaşmış, stresli ve kötü huylu hücrelere karşı savunmasında çok önemli bir rol oynar. Anormal hücreleri sitotoksik yollarla ortadan kaldırmak için kapsamlı bir anti-kanser makinesi cephaneliği kullanırlar 1,2,3. Bu mekanizmalar arasında, hücreler arası iletişimi kolaylaştırmak için çok önemli olan proteinler, RNA'lar ve DNA'lar gibi çeşitli biyomolekülleri içeren nano ölçekli çift katmanlı yapılar olan EV'lerin üretimi ve salgılanmasıyer alır 4,5,6. NK-EV'ler, benzersiz taşıyıcı özellikleri nedeniyle umut verici hücresiz terapötikler olarak ortaya çıkmaktadır. Bunlar, filtre bazlı sterilizasyona izin veren küçük boyutlarını, yüksek biyouyumluluğu, tümörler içinde tercihli birikimi, geniş kargo dağıtım spektrumunu, kan-beyin bariyeri gibi biyolojik engelleri aşma kapasitesini ve minimum toksisite profilini içerir. Çeşitli nedenlerden dolayı, NK-EV'ler uygulamadan önce kemoterapi yoluyla hasta lenfodeplesyon ihtiyacını ortadan kaldırır: 1) geleneksel olarak, lenfodeplesyon, hücre bazlı tedavi için daha misafirperver bir ortam yaratmak için kullanılır, bu da infüzyon hücrelerinin çoğalmasını ve terapötik etkilerini göstermesini sağlar; 2) hücrelerin aksine, EV'ler replikasyon kapasitesinden yoksundur ve ölçek olarak önemli ölçüde daha küçüktür; 3) EV'ler farklı mekanizmalarla çalışır vehücrelere kıyasla azalmış immünojenisite sergiler 5,6,7. Ayrıca, NK-EV'ler sürekli olarak çeşitli kanser modellerine karşı in vitro etkinlik sergilemiştir ve ayrıca anti-kanser yanıtlarını teşvik eden bağışıklık hücreleri üzerinde immünomodülatör etkiler göstermiştir 8,9. İn vivo sonuçlar bu bulguları doğrulayarak NK-EV tedavisini takiben kanser gerilemesi ve ihmal edilebilir toksisitelergöstermektedir 10,11,12. Bu nedenle, NK-EV bazlı terapötikler, soğuk, immünolojik olarak inert katı tümörlerin tedavisinin zorluklarını ele almak için büyük umut vaat etmektedir 13,14,15,16,17.
Son çalışmamız, NK-EV'lerin biyoüretim yoluyla klinik çevirisinde önemli bir darboğazı ele almaktadır7. Makale, proses içi kalite kontrol testini sağlamak için titizlikle tasarlanmış NK-EV'lerin uygun maliyetli ve ölçeklenebilir bir biyoüretim iş akışı için bir kavram kanıtı sunmaktadır. Bu yaklaşım, sürekli olarak büyük miktarlarda yüksek saflıkta NK-EV bazlı kanser biyoterapötikleri üretti ve MISEV2018 yönergelere göre kapsamlı ürün karakterizasyonu yapıldı18. Biyoüretim iş akışının ölçeklenebilirliği, kartuş boyutunun artırılması veya birden fazla biyoreaktörün paralel olarak çalışmasıyla sağlanabilir. Benzer şekilde, EV izolasyon iş akışının ölçeklenebilirliği, Hızlı Protein Sıvı Kromatografisi (FPLC) tabanlı boyut dışlama kromatografisi (SEC), ultrafiltrasyon (UF) ve filtre tabanlı sterilizasyon gibi teknikler kullanılarak kolayca elde edilebilir. Kapalı döngü içi boş fiber biyoreaktör (HFB) sistemi, serum takviyesi, besleyici sistem ve antibiyotik gerektirmeden IL-2 kendi kendine yeten NK hücre hattını (NK92-MI hücreleri) büyüttü. Bu, ticari olarak temin edilebilen kimyasal olarak tanımlanmış ve kseno içermeyen bir ortam kullanılarak gerçekleştirildi (bir GMP versiyonu şu anda ticari olarak temin edilebilir). Sonuç olarak, büyük miktarlarda NK hücreleri (109 canlı hücre) ve NK-EV'ler (1012 EV), tek bir orta boy biyoreaktör kartuşu kullanılarak 5-7 gün içinde başarıyla üretildi ve her iki ürün de kapsamlı bir şekilde karakterize edildi. Biyoüretim süreci boyunca, hücre sağlığı, hücre ve EV kalitesinin temel belirleyicileri olan ortam rengi ve herhangi bir kontaminasyon belirtisi gibi görsel göstergelerin yanı sıra pH, glikoz ve laktat seviyeleri gibi ölçülebilir ölçümler kullanılarak günlük olarak izlendi. HFB sisteminde üretilen NK hücre canlılığının ve işlevselliğinin, özellikle sitotoksisitenin hasat sonrası değerlendirmesi, şişe bazlı kültürlere kıyasla önemli bir gelişme olduğunu ortaya koydu7. Benzer şekilde, saflaştırılmış NK-EV'ler, bakteri, mikoplazma, yaygın viral varlıklar ve hücresel bileşenlerden yoksun ve ihmal edilebilir endotoksin seviyelerine sahip yüksek saflık profili sergiledi. Daha da önemlisi, saflaştırılmış NK-EV'ler, nihai üründe bulunan tüm nanopartiküllerin %99,9'undan fazlasını oluşturuyordu7. Son olarak, bu saflaştırılmış NK-EV'ler, yüzey belirteçleri (CD2, CD45, CD56), sitokin yükü (GzmB, PFN, IFN-g) dahil olmak üzere temel NK özelliklerini korudu ve lösemik K562 hücrelerine karşı güçlü sitotoksisite gösterdi, NK hücre sitotoksisitesini değerlendirmek için altın standart çizgi7.
Mevcut protokol, yukarıda tartışılan ölçeklenebilir biyoüretim iş akışını detaylandırmaktadır. UF ve filtre bazlı sterilizasyon ile birlikte FPLC-SEC kullanılarak üretilen NK-EV'lerin izole edilmesi için metodolojiyi açıklar. Ek olarak, protokol, nanopartikül izleme analizi (NTA) kullanılarak ürün karakterizasyonu, çeşitli araçlar kullanılarak kalite değerlendirmesi (protein/dsDNA miktar tayini ve mikrobiyal test) ve saflaştırılmış NK-EV ürününün hücre canlılığı testi ile kanser hücrelerine karşı fonksiyonel doğrulaması dahil olmak üzere önemli adımları açıklar. Tipik olarak bu iş akışı, ortalama 1,18 x 1012 EV/mL7 konsantrasyona sahip 1,0 - 1,5 mL NK-EV ürünü verir ve yaklaşık 40 mL EV açısından zengin CM'ye dayalı olarak toplamda minimum 1 x10 12 EV'dir. Bu süreç, araştırmacı, klinik öncesi ve multi-omik (proteomik, transkriptomik, genomik, metabolomik, lipidomik ve epigenomik) gibi çeşitli alt uygulamalar için ürün piyasaya sürülmesine izin verirken, klinik çeviri potansiyeli taşırken klinik çeviri potansiyeli taşırken kanıtlanmış tekrarlanabilirlik sağlar.
Protokol
1. Kapalı döngü biyoreaktör kullanarak NK92-MI hücrelerinden NK-EV biyoüretimi
NOT: NK-EV'ler, İyi Üretim Uygulamalarına (GMP) uyan ve NK92-MI hücrelerini kullanan ölçeklenebilir bir biyoüretim iş akışı kullanılarak üretilir (bkz. Şekil 1). Son yayınımız, biyoüretim prosedürü ve NK-EV ürünlerinin kimliği ve güvenlik profilleri hakkında ayrıntılı bilgiler içermektedir7.
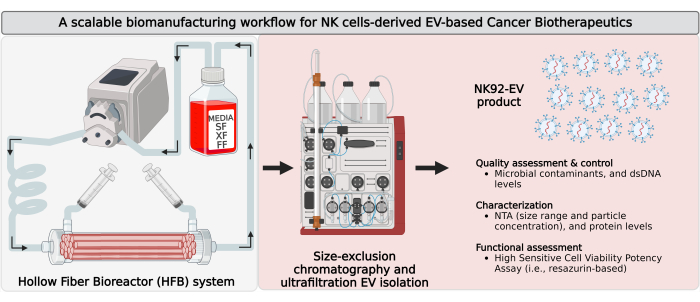
Şekil 1: Ölçeklenebilir izolasyon iş akışına sahip kapalı döngü içi boş fiber biyoreaktörde (HFB) doğal öldürücü hücreden türetilmiş hücre dışı veziküllerin (NK-EV'ler) biyoüretimi. Büyük miktarlarda yüksek saflıkta NK-EV ürünleri üretmek için biyo-üretim iş akışının şematik gösterimi. IL-2 kendi kendine yeten NK92-MI hücreleri, kapalı döngü bir HFB kartuşuna tohumlanır ve serumsuz (SF), kseno içermeyen (XF), besleyicisiz ve antibiyotik içermeyen koşullar altında kültürlenir ve burada sürekli EV açısından zengin şartlandırılmış ortam toplama için yetiştirilirler. EV açısından zengin CM'den NK-EV izolasyonu, ultrafiltrasyon (UF) ile birleştirilmiş Hızlı Protein Sıvı Kromatografisi tabanlı boyut dışlama kromatografisi (FPLC-SEC) ile gerçekleştirilir. NK-EV'ler çoklu deneylerle karakterize edilir ve değerlendirilir ve K562 lösemi hücrelerine karşı işlevsellikleri, bir canlılık potens testi kullanılarak değerlendirilir. Bu rakam7'den (Biorender.com ile oluşturuldu) değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- 1 - 5 x 106 NK92-MI hücrelerinden başlayarak ve hücre yoğunluğunu 3 - 8 x 105 hücre / mL arasında tutarak, hücreleri önceden ısıtılmış bir kültür ortamı kullanarak T25 - T175 şişelerinde kültürleyin. 37 ° C'de% 5 CO2 ile inkübe edin (Malzeme Tablosuna bakınız). Ortamı her 2-3 günde bir, 1 x 108 NK92-MI hücresi en az% 70 canlılıkta üretilene kadar değiştirin.
NOT: Uygun büyüme faktörleri içerdiğinden, hücreleri yeniden tohumlarken şartlandırılmış ortamın (CM) 1/5inci-1/3oranını koruyun. - Aşağıda açıklandığı gibi orta HFB kartuş hazırlığı ve NK hücre aşılaması gerçekleştirin.
NOT: Steriliteyi sağlamak ve sürdürmek için tüm manipülasyonlar sınıf II bir biyogüvenlik kabini içinde yapılmalıdır. Kartuş sistemini biyogüvenlik kabinine taşımadan önce, rezervuar darboğazına ve şırınga bağlantılarına özellikle dikkat ederek cömertçe %70 etanol püskürtün.- HFB kartuşunu üreticinin talimatlarınagöre 19 (bkz . Malzeme Tablosu; bkz. Şekil 2) aşağıda açıklandığı gibi hazırlayın.
- Luer Lock bağlantılarını mum film ile sarın ve pompa akış hızını üreticinin talimatlarınagöre ayarlayın 19. HFB kartuşunu, 150 mL steril fosfat tamponlu salinin (PBS; Malzeme Tablosuna bakınız) en az beş gün boyunca dolaşmasına izin vererek koşullandırın.
- Hücre dışı kılcal boşluktan (ECS; hacim yaklaşık 29 mL'dir) havayı çıkarmak için, sol ECS portundan yaklaşık 40 mL PBS enjekte edin ve havanın sağ ECS portundan kaçmasına izin verin. Bunu yaparken sol ve sağ uç port kelepçelerini kapatın. Şırınganın her zaman sol ve sağ ECS bağlantı noktalarına bağlı olduğundan emin olun.
- Tamamlandığında, kartuşu 37 °C ve %5 CO2'ye ayarlanmış inkübatörün içindeki akış pompasına (Malzeme Tablosuna bakın) koyun. Birkaç günlük dolaşımdan sonra sızıntı olmadığından emin olun.
- PBS'yi rezervuar şişesindeki 150 mL kültür ortamıyla ve hücreleri kartuşa yerleştirmeden 2 gün önce ECS'yi değiştirin. Kültür ortamını kullanarak, ancak 2 günlük dolaşım için önceki koşullandırma adımlarını (adım 1.2.1.) tekrarlayın.
- Hücreleri tohumlamadan önce, rezervuar şişesindeki ve ECS'deki içeriği 250 mL taze kültür ortamı ile değiştirin.
- Kültür şişesini inkübatörden alın ve hücreleri 50 mL'lik bir tüpe aktarın. 5 dakika boyunca 300 x g'da döndürün. 21 mL kültür ortamı kullanarak hücre peletini yeniden süspanse edin.
- Otomatik bir hücre sayacında hücre sayımı için hücre süspansiyonundan her biri 20.5 μL'lik iki alikot hazırlayın (Malzeme Tablosuna bakınız). Her 20.5 μL hücre süspansiyon alikotuna eşit miktarda AO / PI boyası ekleyin (Malzeme Tablosuna bakınız) ve en az 10 kez yukarı ve aşağı karıştırın.
NOT: Doğru NK hücre sayımı için Tripan Blue'yu önermiyoruz. Alternatif olarak, manuel sayma için bir hemositometre kullanın. - Sayma sürgüsünün her bir sayma haznesine 20 μL yükleyin ve uygun programı kullanarak otomatik hücre sayımı gerçekleştirin. Ortalama canlı hücre konsantrasyonunu hesaplayın ve canlılığı not edin.
- Steriliteyi korumak için 20 mL'lik bir şırınga ve 18 G'lik bir iğne kullanarak aspire etmeden önce NK hücre solüsyonunu birkaç kez karıştırın. Bu çözelti yaklaşık 20 mL'de yaklaşık 1 x10 8 canlı NK hücresi veya yaklaşık 5 x 106 hücre/mL içermelidir.
- İğneyi şırıngadan çıkardıktan sonra, NK hücrelerini sol ECS portundan kartuşa nazikçe enjekte edin. Kartuş boyunca eşit hücre dağılımını sağlamak için, sol ve sağ ECS bağlantı noktalarına bağlı şırıngaları kullanarak hücre çözeltisini en az 10 kat nazikçe ileri geri hareket ettirin.
NOT: çözelti, sol ve sağ uç portları kapalıyken her iki şırıngada eşit bulanıklığa sahip olmalıdır. - Sol ve sağ uç portu açın ve şırıngaların içinde kalanları enjekte edin. cl'yi kullanarak sol ve sağ ECS bağlantı noktalarını kapatınamps.
- Kartuşu inkübatöre aktarın ve akış pompasına düzgün şekilde takmadan önce 30 dakika bekletin. Kartuşu biyoüretim için içeride bırakın. Akış hızını üreticiye göre ayarlayın.
- Hücre sağlığı ölçümlerini izlemek için, rezervuar şişesindeki iyice karıştırılmış ortamdan günde 0.5 mL'lik bir alikot ortam alın ve glikoz ve pH seviyelerini doğruladıktan sonra -20 ° C'de saklayın. L-laktat seviyeleri daha sonra doğrulanabilir (bkz. Malzeme Tablosu).
- Glikoz içeriğini ortamda bulunan başlangıç seviyelerinin% 50'sinin üzerinde ve pH'ı 7.0'ın üzerinde (7.0 - 8.0 aralığında) tutmak için rezervuardaki ortamı (250 - 500 mL) her 1 - 2 günde bir değiştirin.
- HFB kartuşunu üreticinin talimatlarınagöre 19 (bkz . Malzeme Tablosu; bkz. Şekil 2) aşağıda açıklandığı gibi hazırlayın.
- Kartuşu aşağıda açıklandığı gibi ilk tohumlarken 1 günlük dinlenmeden sonra NK-EV açısından zengin CM toplama işlemini günlük olarak gerçekleştirin.
- Kartuş sistemini biyogüvenlik kabinine taşıyın. Eşdeğer hacimde EV açısından zengin CM'yi sağ ECS'den itmek için sol ECS portundan yaklaşık 21 mL kültür ortamını nazikçe enjekte edin - karıştırmayın (bkz. Şekil 3).
NOT: Kirlenmeyi önlemek için her zaman yeni plastik kaplar kullanın. - EV açısından zengin CM çözeltisini 50 mL'lik bir tüpe aktarın ve 5 dakika boyunca 300 x g'da santrifüjleyin. Bu arada, kartuş sistemini akış pompasındaki inkübatöre geri taşıyın.
- Süpernatanı yeni bir tüpe aktarın ve 10 dakika boyunca 2000 x g'da santrifüjleyin. Yine, süpernatanı yeni bir tüpe aktarın. Ardından, EV açısından zengin CM'yi 3, 50 mL'lik tüplere (~ 7 mL / tüp) eşit olarak ayırın ve daha sonraki işlemlere kadar -80 ° C'de saklayın.
NOT: Sıralı olarak hasat edilen EV açısından zengin CM, bu üç tüp arasında toplanır ve üç teknik kopya numune tüpü oluşturulur.
- Kartuş sistemini biyogüvenlik kabinine taşıyın. Eşdeğer hacimde EV açısından zengin CM'yi sağ ECS'den itmek için sol ECS portundan yaklaşık 21 mL kültür ortamını nazikçe enjekte edin - karıştırmayın (bkz. Şekil 3).
- Aşağıda açıklandığı gibi aynı HFB kartuşunu kullanarak EV açısından zengin CM üretmeye devam etmek için HFB-NK hücre hasadı gerçekleştirin.
NOT: NK hücreleri, kartuş birleşime ulaştığında (maksimum 1 x 109 hücre) HFB-NK hücre hasat protokolü "gerçekleştirilerek HFB'nin ECS'sinden hasat edilebilir. Bu, her lot için 5-7 gün sonra veya glikoz içeriğinin glikoz ölçüm cihazının tespit sınırının altında olduğu tespit edildiğinde (ör., art arda 2 gün boyunca okuma veya ~ 0 okuması) gerçekleşir. Bu son hücre hasadı ise, kartuşu yıkamak ve hücreleri almak için ortam PBS ile ikame edilebilir.- EV açısından zengin CM'yi tam olarak yukarıda adım 1.3'te ayrıntılı olarak açıklandığı gibi hasat edin.
- Sol ECS portundan yaklaşık 50 mL ortam enjekte edin. Kartuş boyunca homojen hücre dağılımını sağlamak için, hücreleri gevşetmek için sol ve sağ ECS bağlantı noktalarına bağlı şırıngaları kullanarak hücre çözeltisini en az 10x hafifçe ileri geri itin ve sonuçta bunları bir şırınga ile sağ ECS bağlantı noktasından itin ve toplayın. Hasat edilen EV açısından zengin CM'yi 50 mL'lik bir tüpe aktarın. Şimdilik 37 °C'de (su banyosu veya inkübatör) bir kenara koyun.
NOT: Geri itme eylemi, hücrelerin tamamen dışarı atılmadan ve sağ ECS portundan bir şırınga tarafından toplanmadan önce yerinden çıkmasına yardımcı olur. Çözelti, sol ve sağ uç portları kapalıyken her iki şırıngada eşit bulanıklığa sahip olmalıdır. Biyoreaktör kartuşuna dokunmak (fiziksel rahatsızlık), kartuşun altındaki hücre kümesinin önleyici olarak yerinden çıkmasına yardımcı olabilir. Hücre süspansiyonunun agresif bir şekilde ileri geri karıştırılması, geri kazanılan hücrelerin canlılığını olumsuz yönde etkileyebilir. Yaşayabilirliği en üst düzeye çıkarmak için özen ve sabır gösterilmelidir. - Son adımı 2x tekrarlayın. Toplamda, 150 mL hücre süspansiyonu geri kazanılmalıdır. 5 dakika boyunca 300 x g'da santrifüjleyin. Süpernatanı atın.
- Her iki hücre peletini her biri 20 mL taze ortamda yeniden süspanse edin ve birleştirin. Otomatik bir hücre sayacında hücre sayımı için hücre süspansiyonunun her biri 20.5 μL'lik iki alikot toplayın (bkz. Malzeme Tablosu).
NOT: Tipik olarak, seyreltici olarak PBS kullanan çok sayıda hücre seyreltmesinin, hücre sayacının dinamik aralığına girmesi gerekir. - 20.5 μL hücre süspansiyon alikotuna eşit miktarda AO / PI boyası ekleyin (Malzeme Tablosuna bakınız) ve en az 10x yukarı ve aşağı karıştırın. Sayma sürgüsünün her bir sayma haznesine 20 μL yükleyin ve uygun programı kullanarak otomatik hücre sayımı gerçekleştirin.
- Seyreltme ile düzeltilmiş tüm sayımların canlı hücre konsantrasyonunun ortalamasını alın, toplam canlı hücre miktarını belirleyin ve canlılığı kaydedin. Yukarıda ayrıntılı olarak açıklandığı gibi, aynı biyoreaktör kartuşunu kullanarak sürekli olarak EV açısından zengin CM üretmek için 1 x 108 HFB tarafından üretilen NK hücrelerini yeniden tohumlayın.
NOT: İstenirse, HFB tarafından üretilen NK hücreleri, dondurma hızını kontrol etmek için bir kriyoprezervasyon dondurma ortamı ve bir dondurma kabı kullanılarak saklanabilir (bkz. Malzeme Tablosu).

Şekil 2: İçi Boş Fiber Biyoreaktör (HFB) sistem bileşeni ve kurulumu. Rezervuar şişesi (1), pompa borusuna (2) etki eden bir peristaltik pompanın (gösterilmemiştir) etkisiyle biyoreaktör kartuşu (3) boyunca dolaşan eksiksiz ortamı içerir. Hücreler, sol (4) ve sağ (5) ECS yan portları aracılığıyla hücre dışı kılcal boşluğa (ECS) sokulur. ECS kayar kelepçeleri kapatıldıktan sonra, ortamın sistem boyunca dolaşmasına izin vermek için sol (6) ve sağ (7) uç yan bağlantı noktaları açılır. Olası kontaminasyonu önlemek için orta boy şişenin rezervuar kapağının yanındaki Luer Lock bağlantısına balmumu filmi eklendiğine dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
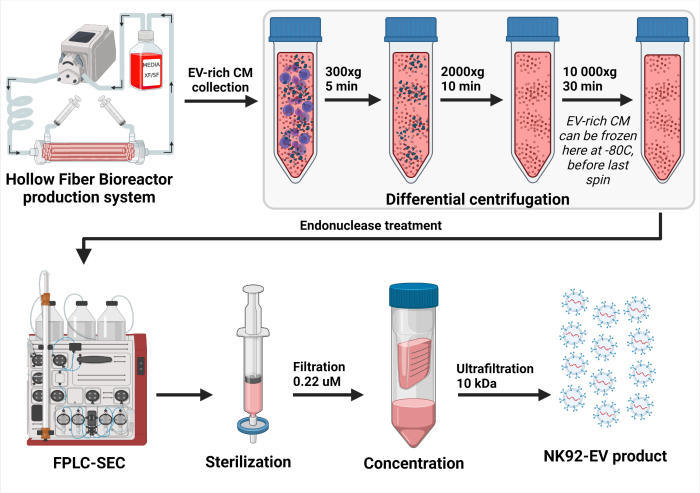
Şekil 3: NK-EV izolasyon işleminin şematik gösterimi. EV açısından zengin şartlandırılmış ortamın (CM) günlük toplanmasından sonra, çözelti, hücreleri (5 dakika boyunca 300 x g'da ilk dönüş) ve hücresel kalıntıları (10 dakika boyunca 2000 x g'da ikinci dönüş) çıkarmak için diferansiyel olarak santrifüjlendi. Temizlenmiş EV açısından zengin CM, daha sonraki işlemlere kadar -80 °C'de saklandı. NK-EV izolasyonu için hazır olduğunda, donmuş EV açısından zengin CM, hücresel kalıntıların uzaklaştırılmasını sağlamak için bir kez daha çözülür ve santrifüjlenir (30 dakika boyunca 10.000 x g'da üçüncü sıkma). Daha sonra, EV açısından zengin CM, konak hücre kontaminantları olarak kabul edilen nükleik asitleri sindirmek için 37 ° C'de 2-4 saat boyunca endonükleaz ile muamele edilir. Daha sonra, EV açısından zengin CM, bir bimodal reçine kullanılarak EV saflaştırması için Hızlı Protein Sıvı Kromatografisi tabanlı boyut dışlama kromatografisi (FPLC-SEC) ile işlenir. Yaklaşık 10 - 15 mL'lik ayrıştırılmış fraksiyonlar, nihai NK-EV ürününün sterilitesini sağlamak için 0,22 μM filtrelerle birleştirilir ve filtrelenir. Ultrafiltrasyon, ürünün yaklaşık 35 - 50X faktörü ile konsantre edilmesini sağlar ve 1 x 1012 EV / mL'nin üzerinde garantili bir konsantrasyon sağlar ve toplam 1,0 - 1,5 mL'dir. Bu rakam 7'den (Biorender.com ile oluşturuldu) değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. UF ve filtre bazlı sterilizasyon ile birleştirilmiş FPLC-SEC ile NK-EV saflaştırma
- Aşağıdaki çözeltileri hazırlayın ve 0,1 μm'lik bir filtre kullanarak iki kez filtreleyin (Malzeme Tablosuna bakınız): su (0 mS/cm iletkenlik), PBS: 50 mL 10x PBS + 450 mL su (iletkenlik yaklaşık 14,7 mS/cm), %20 etanol, temizleme solüsyonu (suda 0,5 M NaOH ve %30 izopropil alkol).
- FPLC sistem başlatmayı üreticinin talimatlarına göre gerçekleştirin (bkz. Malzeme Tablosu). Çalışma öncesi ve sonrası yerinde temizlik (CIP) adımlarını üreticinin talimatlarına göre gerçekleştirin. Tüm hatları ve kolon reçinesini yıkayın ve çift filtreli (DF) su, temizleme solüsyonu, DF-su ve DF-PBS kullanarak durulayın.
NOT: İhtiyaç duyulması halinde CIP'nin başka bir gün de yapılabileceğini belirtmekte fayda var. - Yatak yüksekliği 20 cm olan iki modlu reçine (Malzeme Tablosuna bakınız) ile paketlenmiş bir kromatografi sütunu kullanın. Kolonun içine hava girmediğinden emin olmak için damladan damlaya yöntemini kullanarak bağlantılar yapın.
- Fraksiyon toplayıcıyı uygun toplama tüpleri ile ayarlayın ve fraksiyonlama ayarlarını istenen toplama hacmine (örn. 15 mL) değiştirin. Tüm numune hacmini toplamak için yeterli sayıda tüp ve iki ek tüp yerleştirin.
- Numune hazırlamayı aşağıda açıklandığı gibi gerçekleştirin.
- -80 °C dondurucudan 40 - 80 mL EV açısından zengin CM alın ve 37 °C'de hızla çözdürün. Numuneyi ultrasantrifüje yükleyin ve 4 °C'de 30 dakika boyunca 10.000 x g'da döndürün.
NOT: Tüpler hacimce değil, ağırlıkça doğru bir şekilde dengelenmelidir. - Döndürdükten sonra, süpernatanı toplayın ve yeni bir tüpe aktarın. DsDNA seviyelerini azaltmak için, EV açısından zengin CM'yi 50 U / mL endonükleaz ve 1.5 mM MgCl2 ile tedavi edin (bkz. Bir inkübatörde (37 ° C) 2 - 4 saat inkübe edin, bu da orta derecede karıştırmaya izin verir.
- -80 °C dondurucudan 40 - 80 mL EV açısından zengin CM alın ve 37 °C'de hızla çözdürün. Numuneyi ultrasantrifüje yükleyin ve 4 °C'de 30 dakika boyunca 10.000 x g'da döndürün.
- Sistem (hatlar ve sütun) EV izolasyonu için hazır olduğunda, EV açısından zengin CM'yi 60 mL'lik bir şırıngaya yükleyin ve numune hattına bağlayın. Manuel Çalıştır'a tıklayarak sistemi başlatın ve akış hızını 0 olarak ayarlayın. Çalıştırmayı önceden kaydetmek için yazılım istemlerini izleyin ve ardından Başlat'a tıklayın.
- Hat B'yi (DF-PBS) seçin ve 150 cm/sa akış hızında (2,0 mL/dk akış hızı) çalıştırın. Çözümün sütundan geçtiğinden emin olun.
- İletkenlik stabilize olduğunda, Otomatik Sıfır UV'ye basın. Numuneyi kolondan önce atık şişesine yönlendirmek için akış yolunu değiştirin. Sisteme kabarcık girmediğinden emin olun.
- En fazla 5 - 20 saniye sonra numuneyi sütuna yönlendirin. UV okumaları yaklaşık 230 mAU'ya ulaştığında Fraksiyonlama'ya tıklayın.
- Numune sistemden tamamen enjekte edildikten sonra, saflaştırmaya devam etmek için tampon sistemini DF-PBS'ye (numune vanasında) geçirin. UV değeri yaklaşık 1600 mAU'ya ulaştığında Fraksiyonlama'yı tekrar tıklayın.
NOT: Bu, UV okumaları ile iletkenlik okumaları arasındaki kesişime karşılık gelir. Daha uzun fraksiyonlama, EV verimini artırmadan yalnızca retentatı seyreltir. - Tüm fraksiyonları (seyreltilmiş NK-EV'ler) birleştirin ve filtre bazlı sterilizasyon ve ultrafiltrasyon (UF) için hazır olana kadar 4 °C'de saklayın.
- UV değeri yaklaşık 1000 mAU'ya ulaşana kadar DF-PBS'yi çalıştırmaya devam edin. Bundan sonra, çalışmayı durdurun ve kromatogramı bir PDF belgesi olarak kaydedin.
3. NK-EV ürün filtresi bazlı sterilizasyon ve UF ile konsantrasyon
- Santrifüjü 10 °C'ye soğutun. UF aparatının her bileşenini ( Malzeme Tablosuna bakınız) 20 - 30 mL %90 etanol ile durulayarak sterilize edin. 4000 x g'da 5 - 10 dakika döndürün.
NOT: Filtre 10 kDa MWCO rejenere selülozdan yapılmıştır. - Akışı atın ve ardından cihazı dengelemek için steril PBS kullanarak durulamayı tekrarlayın. Toplamda 2 kez tekrarlayın.
- Steriliteyi en üst düzeye çıkarmak için, seyreltilmiş NK-EV solüsyonunu DF-PBS ile önceden ıslatılmış 0,22 μm'lik bir şırınga filtresi kullanarak filtreleyin (bkz. Süzüntüyü doğrudan sterilize edilmiş konsantrasyon aparatına toplayın.
- 15 - 40 dakika boyunca 4000 x g'da sıkın (sıkma süresi örneğe bağlıdır). Sıkma işleminden sonra serolojik bir pipet kullanarak çözeltiyi üst filtre bölmesinde karıştırın. 10 dakika daha 4000 x g'da döndürün.
NOT: Karıştırma adımı, membranın EV'ler tarafından tıkanmasını önleyerek konsantrasyon adımını kolaylaştırdığı için isteğe bağlıdır. - Akışı geçici olarak bir kenara bırakın ve filtrasyon cihazını ters çevirerek ve toplama cihazına takarak NK-EV numunesini toplayın.
- 2 dakika boyunca 2000 x g'da döndürün. Saflaştırılmış NK-EV ürününü 2 mL'lik bir tüpe aktarın. Saflaştırılmış NK-EV ürününü kısa süreli kullanım için 4 °C'de (≤ 7 gün) veya uzun süreli kullanım için -20 °C'de donmuş olarak saklayın.
4. Nanoparçacık İzleme Analizi (NTA) ile NK-EV karakterizasyonu
- Solüsyonu hazırlayın ve 0,1 μm'de iki kez filtreleyin (Malzeme Tablosuna bakınız): su, PBS, temizleme solüsyonu (suda% 10 çamaşır suyu (DİKKAT)).
- NTA sistemini üreticinin talimatlarına göre başlatın. Benzer şekilde, çalıştırma öncesi ve sonrası yerinde temizlik (CIP) adımlarını gerçekleştirin. Tüm hatları yıkayın ve çift filtreli (DF) su, temizleme solüsyonu ve DF suyu kullanarak durulayın. DF-PBS kullanarak hatları dengeleyin.
- Akış hücresini doğrulayın ve hava kabarcıkları olup olmadığını kontrol edin. Varsa baloncukları çıkarın. Temizlendikten sonra, akış hücresini NTA cihazına dikkatlice yeniden yerleştirin.
NOT: Üretici tarafından tavsiye edilmese de, çıkarılması çok zor olan hava kabarcıkları, %20 etanol ve ardından DF suyu ile durulanarak kolayca çıkarılabilir. - Akış hücresi yerleştirildikten ve kapı kapatıldıktan sonra Kamerayı Başlat'a tıklayın. DF-PBS ile doldurulmuş çizgilerle, ekran mutlak bir minimum parçacık sayısı göstermelidir.
- Yakalama ayarlarını ekran kazancı 2 ve kamera düzeyi 14 olarak değiştirin. Ayrıca, akış hücresini sıcaklıkta stabilize etmek için ısıtıcıyı açın.
- 30 parçacık/kare akış hızında ve 23 °C'de 1 dakika boyunca bir yakalama toplamak üzere SOP sekmesi altında bir komut dosyası oluşturmak için Standart ölçüm'e tıklayın.
- Hemen aşağıda, verileri kaydetmek için klasörü ve dosya adını yol adına ekleyin.
- Önceden DF-PBS kullanarak saflaştırılmış NK-EV ürününün seyreltmelerini hazırlayın. NTA'yı çalıştırırken, doğru miktar tayini 30 - 80 parçacık/çerçeve gerektirir.
- Numuneyi şırıngaya yüklemeden önce vorteksleyin (bkz. Malzeme Tablosu).
- 1 mL toplama şırıngasını cihaz yükleme hattına dikkatlice bağlayın. Edinimi ve analizi olumsuz etkileyeceği için hava bulunmamalıdır. Numunenin yarısını yavaşça itin ve şırıngada yaklaşık 0,5 mL bırakın.
- Parçacıklar ekranda göründüğünde, kamerayı her parçacığın etrafında en fazla bir hale olacak şekilde odaklayın. 5 s boyunca 1000 hızında Donanım sekmesi altında Demle'ye tıklayın. Ardından, 30 oranına indirin.
- Komut Dosyasını Çalıştır'a basın ve istemleri izleyin. Yazılım, sıcaklığın ayarlandığından emin olacak ve ayarların doğru olup olmadığını soracaktır. Evet'e tıklayın ve yazılım istemlerini izleyin.
- Yakalamayı tamamladıktan sonra, yazılım dosyaları işlemeyi veya dışa aktarmayı istediğinde İptal'e tıklayın. 10 - 15 sn boyunca 1000 hızında Donanım sekmesi altında Demle'ye tıklayın. Bu sırada ısıtıcıyı ve kamerayı tekrar açın. Ardından, parçacıklar hareket edene kadar oranı 30'a düşürün.
- Önceki adımları tekrarlayarak dört yakalama daha toplayın. Seyreltme başına toplam beş yakalama kaydedildikten sonra, beş yakalamanın tümünü içe aktardıktan sonra analiz gerçekleştirin.
- İşlenecek dosyaları vurgulayarak seçin. Seçili Dosyaları İşle'yi tıklatın. İşlem sekmesi altında, analiz ayarlarını 2 ekran kazancı ve 15 algılama eşiği olarak ayarlayın.
Ayarlar örneğe bağlıdır; Çerçeve başına 30 - 80 parçacığın görünür olduğundan emin olun. - Analiz için işaretleyin ve Tamam'ı tıklayın.
- Dosyalar işlendikten sonra, yazılım bunları dışa aktarmanızı isteyecektir. Ek kutulara tıklamadan Evet'e tıklayın veya Dışa Aktar'a tıklayın.
- Tüm EV seyreltmeleri veya numuneleri için tekrarlayın. Tüm numuneler tamamlandıktan ve CIP yapıldıktan sonra NTA cihazını kapatın.
5. Kalite güvence testi
- İki test kullanarak mikrobiyal test yapın: 1) saflaştırılmış NK-EV'lerin küçük bir alikotu otoklavlanmış LB suyu ortamına çivilenir ve 2) mikoplazma PCR tespiti için saflaştırılmış NK-EV'lerin küçük bir alikotu kullanılır (bkz.
- Test 1: Pozitif ve negatif kontroller dahil olmak üzere 5 güne kadar 37 ° C'de kültür LB ortamı. Gerekirse OD600'ü kaydedin.
- Test 2: üreticinin protokolüne göre mikoplazma PCR tespiti gerçekleştirin.
- Üreticinin talimatlarına göre florometre bazlı tahliller kullanarak saflaştırılmış NK-EV seyreltmelerinde protein ve dsDNA'yı ölçün (bkz. Malzeme Tablosu).
6. NK-EV ile tedavi edilen kanser hücrelerinin, doğrulanmış, yüksek derecede hassas resazurin bazlı hücre canlılığı testi kullanılarak potens değerlendirmesi 20
- İnsan K562 lösemi hücrelerini, potens testini gerçekleştirmeden önce birkaç gün boyunca% 10 ısıyla inaktive edilmiş FBS ile RPMI-1640 kullanarak kültürleyin (bkz. Malzeme Tablosu). Yoğunluğu 2 - 8 x 105 hücre / mL arasında tutun ve ortamı her 2-3 günde bir değiştirin.
- 96 oyuklu düz tabanlı bir plaka edinin (Malzeme Tablosuna bakınız) ve normalizasyon amaçları için gerekli olan tahlil ortamının hacmini (%5 EV tükenmiş FBS ile desteklenmiş) önceden ekleyin (bkz. Malzeme Tablosu). Son hacim 150 μL/kuyudur.
NOT: Kuyudan kuyuya varyasyonu azaltmak için bir tekrarlayıcı pipetleyici kullanın. - Hücre kültürünü elde edin ve hücreleri bir tüpe aktarın. 5 dakika boyunca 300 x g'da döndürün. Hücre peletini 2-5 mL tahlil ortamı kullanarak tek hücreli bir çözeltiye yeniden süspanse edin.
- Otomatik bir hücre sayacında hücre sayımı için 20.5 μL hücre süspansiyonunun bir alikotunu toplayın (Malzeme Tablosuna bakınız).
- 20.5 μL hücre süspansiyon alikotuna eşit miktarda AO / PI boyası ekleyin (Malzeme Tablosuna bakınız) ve en az 10x yukarı ve aşağı karıştırın.
NOT: Doğru hücre sayımı için AO/PI'yi öneririz. Alternatif olarak, manuel sayma için bir hemositometre kullanın. - Sayma sürgüsünün her bir sayma haznesine 20 μL yükleyin ve uygun programı kullanarak otomatik hücre sayımı gerçekleştirin. Canlı hücre konsantrasyonunun ortalamasını alın ve canlılığı kaydedin.
- Yaklaşık 1 x 106 hücreyi ikincil bir tüpe aktarın. Hücreleri tam olarak 7 mL tahlil ortamına seyreltin ve hücre sayımını tekrarlayın. Konsantrasyon yaklaşık 1.2 - 1.5 x 105canlı hücre / mL olmalıdır.
- Yukarıda ayrıntılı olarak açıklandığı gibi, tek hücreli süspansiyon konsantrasyonunu 1 x 105 canlı hücre / mL'ye ayarlayın ve gerekirse hücre sayımını tekrarlayın.
NOT: Teknik mükerrer sayımlar arasındaki varyasyon katsayısı %25'ten az olmalıdır; tipik olarak, AO/PI sayımı ile %5'ten azdır. - İstenen konsantrasyona ulaşıldığında, 5000 hücre / kuyuya (4900 - 5100 hücre / kuyu) mümkün olduğunca yaklaşmak için bu çözeltinin 50 μL'sini (± 1 μL) her bir kuyucuğa aktarın. Her tahlil koşulu için teknik üçlüler hazırlayın ve kuyudan kuyuya varyasyonu azaltmak için bir tekrarlayıcı pipetleyici kullanın.
- Plakayı 350 dakika boyunca bir orbital çalkalayıcıya (500 - 2 RPM) aktarın. NK-EV tedavisine devam etmeye hazır olana kadar hücreleri inkübatöre geri aktarın.
- Bir tahlil ortamı kullanarak gerekli NK-EV seyreltmelerini (1:5, 1:10 ve 1:100) hazırlayın.
- Bu seyreltmelerden aşağıdaki EV konsantrasyonlarını test edin: 1 x 108, 5 x 108, 1 x 109, 5 x 10 9, 1 x 1010, 5 x 1010 ve 1 x 1011 partikül / mL. Dozlama hacmi, toplam tahlil hacminin %20'si ile sınırlıdır.
- Hazır olduğunda, belirli bir seyreltmenin gerekli hacmini, tedavi için istenen bir EV konsantrasyonu gerektiren kuyucuklara aktarın. Pozitif kontrol kuyusuna 15 μL 10x Triton-X ekleyin (Malzeme Tablosuna bakın). Son kuyu hacmi 150 μL'ye normalize edilmelidir.
- Plakayı 2 dakika boyunca bir orbital çalkalayıcıya (350 - 500 RPM) ekleyin. Hücreleri 37 ° C'de% 5 CO2 inkübatörde 3 saat inkübe edin.
- Plaka okuyucuyu (Malzeme Tablosuna bakın) 37 °C'de önceden ısıtın ve aşağıdaki komut dosyasını yükleyin: 37 °C (sıcaklıkla ilgili değişimi azaltır), 1 dakika boyunca 450 RPM karıştırma (numune homojenliğini sağlar) ve okuyun.
- Her oyuğa 15 μL resazurin bazlı reaktif ekleyin (bkz . Malzeme Tablosu). Reaktifi ışıktan koruyun ve kuyudan kuyuya değişimi azaltmak için bir tekrarlayıcı pipetleyici kullanın.
- Plakayı 2 dakika boyunca bir orbital çalkalayıcıya (350 - 500 RPM) ekleyin. Plakayı inkübatöre aktarın ve 60 dakika inkübe edin. Etanole batırılmış bir pipet ucu kullanarak hava kabarcıklarını çıkarın. 560 nm'lik bir uyarma ve 590 nm'lik bir emisyon kullanarak plakayı okuyun.
- Veri analizi: Ortalama teknik replikaların ortalaması alındı ve inhibisyon etkisi için doğrusal olmayan bir regresyon kullanılarak bir doz-yanıt analizi yapılmadan önce arka plan için doğru yapıldı ve log(inhibitör) ile normalleştirilmiş yanıt değişkeni eğimini kısıtlama olmaksızın gösterdi. Hillslope ve EC50 değerlerini kaydedin.
Sonuçlar
NK-EV'ler doğal sitotoksik fonksiyonlara sahiptir ve çeşitli kanser modellerine karşı yüksek etkinlik göstermiştir. Bununla birlikte, NK-EV'lerin büyük ölçekli üretimi için uygun bir biyo-üretim iş akışına ilişkin mevcut çalışmalar arasında daha fazla standardizasyon olması gerekmektedir 6,21. Önceki çalışmamız, büyük miktarlarda yüksek saflıkta NK-EV ürünleri üretmek için kapalı döngülü içi boş fiber biyoreaktör (HFB) sisteminin fizibilitesini tanımladı7. Bir takip olarak, bu protokol tabanlı çalışma, biyoüretim iş akışını detaylandırır ve NK-EV ürününü üreterek ve izole ederek tekrarlanabilirliğini gösterir (Şekil 1). Ayrıca, ürün piyasaya sürülmeden önce temel ürün karakterizasyonu ve validasyonu gereklidir, bu nedenle bu çalışmada yeni ve orijinal veriler sunulmaktadır.
HFB sistemi, kullanım kolaylığı, güvenilirliği, ölçeklenebilirliği ve GMP uyumluluğu nedeniyle NK-EV üretimi için seçildi7. HFB sistem kurulumuna atıfta bulunarak, NK hücreleri sol ECS portundan enjekte edilir ve biyoreaktör kartuşuna tohumlanır (Şekil 2). Aynı zamanda, medya şişesi yan portlar aracılığıyla HFB'ye bağlanır ve medyanın sistem boyunca akmasına izin verilir. NK hücreleri, zaman içinde hücre sağlığını korumak ve en üst düzeye çıkarmak için glikoz içeriği %50'nin altına düştüğünde ortamın değiştirildiği serumsuz, kseno içermeyen, besleyici içermeyen ve antibiyotik içermeyen ortamda kültürlenir. CM günlük olarak toplanır, diferansiyel santrifüjlemelerle işlenir ve daha sonraki işlemlere hazır olana kadar donmuş halde (-80 °C) tutulur. Daha sonra, EV izolasyonu, UF ve filtrasyon ile birleştirilmiş diferansiyel santrifüjler ve FPLC-SEC'in bir kombinasyonu yoluyla gerçekleştirilir (Şekil 3). Bu, nihai hacmi yaklaşık 1.0 - 1.5 mL olan konsantre ve steril bir NK-EV ürünü ile sonuçlanır. NK-EV'lerin FPLC-SEC izolasyonunun temsili bir kromatogramı sağlanmıştır (Şekil 4). FPLC-SEC işleminden önce, NK-EV açısından zengin CM, potansiyel bir konak (NK) hücre kirleticisiolan dsDNA seviyelerini önemli ölçüde azaltan endonükleaz ile muamele edilir 7. Bu nedenle, açıklanan EV izolasyon iş akışı, düşük ve istenmeyen bir immünojenik potansiyel sağlamak ve nihai ürünün sonraki çalışmalar için uygun olmasını sağlamak için gerekli olan NK-EV ürününden hücresel kalıntıları ve RNA/DNA kirleticilerini giderir.
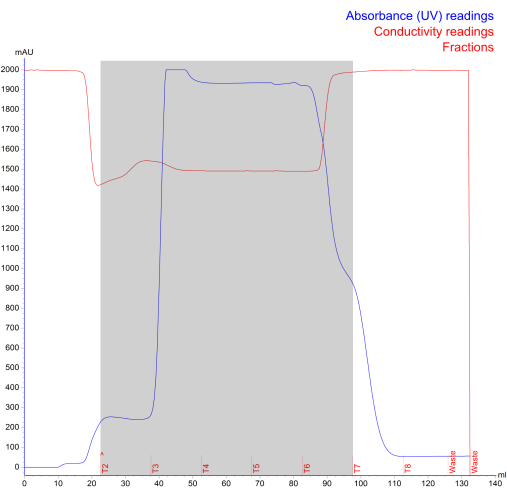
Şekil 4: Hızlı Protein Sıvı Kromatografisi boyut Dışlaması sırasında oluşturulan NK-EV izolasyon kromatogramı. Mavi çizgi absorbansı (mAU; maksimum okuma 2000 mAU), kırmızı çizgi iletkenliği, kırmızı metin çalışma günlüğünü ve gri gölgeli alan fraksiyonlu NK-EV'leri (T2 - T7 fraksiyonları ile gösterilir) temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
İzolasyonun ardından, NK-EV ürününün daha sonraki sonraki deneyler için piyasaya sürülüp sürülemeyeceğini değerlendirmek için temel NK-EV karakterizasyonu ve kalite güvence testi kullanılır. NK-EV ürün partikül boyutu aralığı ve konsantrasyonu, çapı 76.30 - 174.30 nm arasında değişen boyutlarda (D10 78.38 ± 2.07 nm, D50 106.72 ± 2.43 nm ve D90 169.80 ± 4.17 nm) ve ortalama 1.39 x 1012 EVs/mL konsantrasyonda nanopartikül izleme analizi (NTA) kullanılarak ölçülür (Şekil 5A-B). Ek olarak, florometre miktar tayini, nihai ürün için sırasıyla 298.90 ± 66.62 mg / mL ve 225.60 ± 37.7 ng / mL'lik bir protein ve dsDNA konsantrasyonu gösterdi (Şekil 5C-D). Bu, ortalama 5.06 x 106 EV/μg protein ve 6.16 x 1012 EV/μg DNA oranına karşılık gelir. Mikrobiyal ve mikoplazma testinin her ikisi de negatif sonuçlar verdi (veriler gösterilmedi). Bu sonuçlar, önceki çalışmalardan NK-EV'lerin karakterizasyonu ile tutarlıdır7. Daha önceki yayın7 ayrıca MISEV yönergelerini (yani, TEM, western blot, endotoksin seviyesi, viral varlıklar ve yüzey antijenleri ve sitokinler için akış sitometrisi) izleyerek NK-EV ürünlerinin daha derinlemesine bir karakterizasyonunu sağlar.
Son olarak, NK-EV ürününün işlevselliği (yani, kanser hücrelerine karşı sitotoksisite), lösemik hücre hattı K562 7,20'ye karşı NK-EV tedavisini takiben doğrulanmış, oldukça hassas bir resazurin bazlı hücre canlılığı testi kullanılarak değerlendirildi. 3 saat boyunca NK-EV'lerle K562 hücre tedavisi, hücre canlılığı üzerinde doza bağlı bir etki üretti, bu da 9.33 x 109 EV / mL'lik bir EC50'ye karşılık geldi (yani, hücre popülasyonunun% 50'sinin öldürülmesine karşılık gelen dozaj; Şekil 6A-B). Bu nedenle, belirtilen ürün serbest bırakma kriterlerini takiben, NK-EV ürününün daha fazla deney için uygun olduğu kabul edilir.
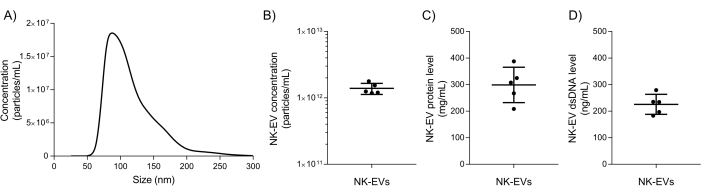
Şekil 5: Saflaştırılmış NK-EV ürün karakterizasyonu. (A) NTA tarafından ölçülen NK-EV ürün boyutu dağılımı, her biri 10 teknik kopyaya sahip 5 bağımsız deneyden ortalama olarak gösterilmiştir (5 video çekimi x 2 seyreltme). (B) NTA ile ölçülen NK-EV parçacık ürün konsantrasyonu (parçacıklar/mL), her biri teknik kopyalara sahip 5 bağımsız deneyden ortalama ± SD olarak sunulmuştur. (C) NK-EV ürünü protein konsantrasyonu (mg / mL), her biri teknik üçlü deneylere sahip 5 bağımsız deneyden ortalama ± SD olarak sunulan bir florometre kullanılarak ölçülmüştür. (D) Bir florometre kullanılarak ölçülen NK-EV ürünü dsDNA konsantrasyonu (ng/mL), her biri teknik üçlü olan 5 bağımsız deneyden ortalama ± SD olarak sunulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
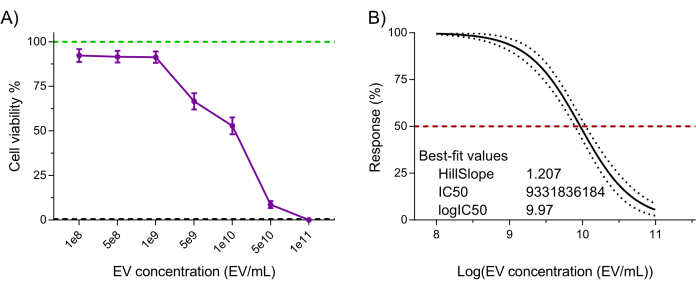
Şekil 6: Saflaştırılmış NK-EV ürün fonksiyonel doğrulaması. NK-EV'ler, yüksek hassasiyetli bir resazurin bazlı hücre canlılığı testi kullanılarak 3 saat boyunca çeşitli NK-EV konsantrasyonlarında tedavi edilen insan K562 lösemi hücrelerine karşı doza bağlı bir sitotoksisite gösterir. (A) Normalleştirilmiş tahlil okumaları (yeşil çizgi, tedavi edilmemiş K562 lösemi hücre kontrolünü temsil eder ve siyah kesikli çizgi, parçalanmış K562 lösemi ölü hücre kontrolünü temsil eder; deterjanla tedavi edilir). Veriler, teknik üçlü 11 bağımsız deneyden elde edilen ortalama ± SEM olarak gösterilmiştir. (B) %95 güven aralığı/tahmin bantları ile NK-EV tedavisi için değişken eğimli EC50 eğrisi analizi (kırmızı kesikli çizgi %50 yanıtı temsil eder). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Birkaç çalışma, NK-EV'lerin bir anti-kanser terapötik olarak büyük bir potansiyele sahip olduğunu göstermektedir 4,5,7,9,16,22,23,24,25,26,27,28,29,30 . Bununla birlikte, daha fazla klinik öncesi test ve gelecekteki klinik uygulamalar için büyük miktarlarda yüksek saflıkta NK-EV'ler verebilen, ölçeklenebilir GMP uyumlu bir biyoüretim sistemi gereklidir. Bu sorunu ele almak için, önceki bir çalışmada, sürekli olarak NK hücreleri ve aşağı akış deneyleri için uygun NK-EV açısından zengin CM üretmek için kapalı döngülü bir HFB sistemi kullanılmıştır. 3D tasarımları nedeniyle, HFB sistemleri vasküler sistemin koşullarını yakından yansıtır ve inanılmaz derecede yüksek bir yüzey alanı-hacim oranına sahiptir, bu da bir milyardan fazla hücrenin kültürde kalmasına izin verir ve sonuçta EV üretiminin artmasına yol açar 7,31,32. Daha da önemlisi, bu çalışma, muhtemelen hücre hattı IL-2 kendi kendine yeterliliği7 nedeniyle, NK hücrelerini kültürlemek için bir HFB sistemi kullandığını bildiren ilk çalışmaydı.
HFB sisteminin sterilitesini ve yüksek saflıkta NK-EV'lerin üretimini sağlamak için ek adımlar atılmalıdır. Bu önlemler, çeşitli araştırma tesisleri için geçerli olabilecek steril ve temiz bir odanın yokluğunda özellikle önemlidir. Biyogüvenlik kabinine girmeden önce HFB sistemi titizlikle %70 etanol ile püskürtülerek tüm dış yüzeyler dezenfekte edilir. Ek olarak, kontaminasyon riskini en aza indirmek için tüm Luer Lock bağlantılarının etrafına mum film sarılır. Bu biyo-üretim iş akışı, hücre ve hücre türevli ürünlerin biyokimyasal profilini etkilediği bilinen antibiyotikler kullanmadığı için bu özellikle önemlidir33. Hücre ürünü biyoüretimi sırasında hücre sağlığını değerlendirmek için çeşitli metrikler kullanıldı. Örneğin, rezervuar ortamının pH, glikoz ve laktat seviyelerinin günlük değerlendirmeleri, bunlar izleme için hayati hücre sağlığı vekilleri olduğu için yapılmıştır. Kantitatif değerlendirmelere ek olarak, HFB sisteminin kalitatif gözlemleri (örneğin, ortam rengi ve bulanıklık gibi görsel kontaminasyon belirtileri) de hücre sağlığının izlenmesi için yararlıdır. Günlük alınan CM'deki hücre sayımlarının, kültürün sağlığı için temsili bir canlılık ölçüsü olduğu bulunamamıştır (veriler gösterilmemiştir). Bu muhtemelen, ortamın dolaşımına izin verilmeyen tüp içinde (ECS ile ECS şırınga portu arasındaki küçük bölüm) bulunan CM örneklemesi sırasında elde edilen ölü hücrelerin bir sonucudur ve böylece genel hücre kültürünün canlılığını küçümser. Yalnızca bir üretim partisinin sonunda HFB tarafından üretilen hasat edilmiş NK hücreleri, kültürün sağlığının güvenilir bir ölçümünü sağlayabilir. Bu hücreler, üretim lotları7'de sürekli olarak %70'in üzerinde canlılık değerleri gösterdi. Bu kalite değerlendirme yöntemleri birlikte, yüksek saflıkta NK-EV'lerin sürekli üretimini sağlar.
EV'leri saflaştırmak ve izole etmek için çeşitli izolasyon teknikleri geliştirilmiştir34. Bir yöntem olan SEC, boyut ayrımına dayalı olarak molekül ayrımına izin veren gözenekli bir malzeme - reçine - ile paketlenmiş bir sütun kullanır. Burada, daha büyük EV'ler kolondan daha hızlı bir şekilde çıkarılır; Bu yöntem, boyut dışlamasına dayalı akış yoluyla saflaştırma olarak bilinir. Aynı zamanda, daha küçük kirleticiler (dsDNA, endonükleaz gibi serbest yüzen proteinler, tuzlar, fenol kırmızısı, vb.) geride bırakılır ve elektrostatik kuvvetler tarafından reçine içinde daha fazla tutulur (yani, iki modlu bir reçine kullanılmıştır). SEC tabanlı işleme, orijinal EV yapısını ve işlevselliğini korurken EV'ye bağlı olmayan proteinleri ortadan kaldırır35,36. Ayrıca, SEC bazlı saflaştırma, yüksek verim ve saflıktan ödün vermeden kolayca ölçeklenebilir, bu da onu biyoterapötik kullanımlar için NK-EV'leri izole etmek için uygun bir seçim haline getirir. Bu avantajlara rağmen, SEC'in nispeten seyreltilmiş akış (eluent) gibi bazı dezavantajları vardır; bu nedenle, ürün konsantrasyonu için UF gereklidir, ancak aynı zamanda tampon değişimine de izin verir. Steril olmayan UF aparatı %70 etanol ve PBS ile durulanır ve steriliteyi sağlamak için kullanımdan önce biyogüvenlik kabininde saklanır. Tipik olarak, akış, eluentin içine girebilecek küçük molekülleri uzaklaştırırken, başlangıç hacminin 35x-50x'ine konsantre edilebilir. Diferansiyel santrifüjleme ve endonükleaz tedavisi, kalıntı hücreleri, hücresel kalıntıları ve uzun antijenik dsDNA7 ipliklerini uzaklaştırmak için UF ile birleştirilmiş FPLC-SEC'den önce gerçekleştirilir.
NK-EV'yi takiben, ürünün daha fazla kullanıma uygunluğunu belirlemek için MISEV2018 ve MISEV2023'daki yönergelere göre ürün izolasyonu, karakterizasyonu ve işlevsel doğrulama gerçekleştirilir 6,18. Her izolasyon, minimum 1 x 1012 EVs/mL konsantrasyonda ve ortalama 1,39 x 1012 parçacık/mL konsantrasyonda 1,0 - 1,5 mL yüksek saflıkta NK-EV ürünü verir. Daha önce, Gupta ve ark. medyan EV dozajının in vivo olarak farelerin vücut ağırlığının 3.37 x 108 EV / kg olduğunu belirledi37. Medyan dozajla muamele etmek, bu iş akışıyla elde edilen garanti edilen minimumun (1 x 1012 partikül / mL) çok altında bir değer olan 25 g vücut ağırlığına sahip 8.43 x10 6 EV / fare gerektirecektir. Bu nedenle, açıklanan biyoüretim iş akışı, klinik öncesi deneyler için veya dozlama hedeflerini karşılamak için gereğinden fazla NK-EV üretebilir. Her izolasyon, ürünün kalite kontrol değerlendirmesinin bir parçası olarak mikoplazma ve mikrobiyal varlık açısından test edilir. Ek olarak, önceki bir çalışma, nihai üründe ortak viral varlıkların ve endotoksinin yokluğunu ve konak hücre kontaminantları olarak kabul edilen hücresel bileşenlerin yokluğunu göstermiştir (western blot analizi ile)7,34. Son olarak, NK-EV'lerin işlevselliğini değerlendirmek için doğrulanmış, oldukça hassas bir resazurin bazlı hücre canlılığı testi kullanılarak fonksiyonel değerlendirme yapıldı20. Tarif edilen canlılık testi, metabolik olarak aktif hücreler tarafından resazurini (zayıf floresan) resorufin'e (yüksek floresan) indirgeyerek işlev görür ve NK-EV tedavisini takiben hücre canlılığının değerlendirilmesine izin verir. Diğer alternatif hücre canlılığı testleriyle karşılaştırıldığında, çalışmada kullanılan resazurin bazlı test, hücre canlılığındaki değişikliklere (çok düşük arka plan gürültüsü) karşı oldukça hassastır ve sonuçları gözlemlemek için inkübasyon süresinin kısalmasına izin verir (istatistiksel olarak anlamlı sonuçlar elde etmek için 30 dakikadan az)20. Genel olarak, NK-EV'ler, K562 canlılığı üzerinde doza bağlı bir etki sergiler. Birlikte sunulan sonuçlar, klinik öncesi değerlendirme için ürün salım kriterlerini karşılayan ve sonraki uygulamalar için uygun olan bir NK-EV ürününü temsil etmektedir.
Sonuç olarak, bu protokol tabanlı çalışma, klinik düzeyde potansiyele sahip NK-EV'lerin biyoüretimini açıklamaktadır. Tartışıldığı gibi, NK-EV'ler serum içermeyen, kseno içermeyen, besleyici içermeyen ve antibiyotik içermeyen koşullar altında kapalı döngü bir HFB sistemi kullanılarak üretilir7. FPLC-SEC/UF'nin bir kombinasyonu NK-EV ürününü izole eder ve saflaştırır. Ürünleri sonraki uygulama için piyasaya sürmeden önce, NK-EV'lerin kullanıma uygun olduklarından emin olmak için karakterize edilmesi ve işlevsel olarak doğrulanması gerekir. Gösterildiği gibi, bu biyoüretim protokolünü takiben, kanser hücrelerine karşı hedef sitotoksisite sergileyen büyük miktarda yüksek saflıkta NK-EV'leri başarıyla üretebilir. Bu nedenle, açıklanan biyoüretim protokolü, klinik sınıf NK-EV'lerin üretimini gerektiren gelecekteki çalışmalar için bir varlık olabilir.
Açıklamalar
Tüm yazarlar herhangi bir çıkar çatışması veya açıklama beyan etmez.
Teşekkürler
Yazarlar, eleştirel makale incelemeleri için Dr. Simon Sauvé, Roger Tam ve Xu Zhang'a teşekkür eder. Bu çalışma, Kanada Hükümeti'nden JRL, LW tarafından alınan Genomik Araştırma ve Geliştirme Girişimi (GRDI) Faz VII (2019-2025) işletme hibelerinin yanı sıra Doğa Bilimleri ve Mühendislik Araştırma Konseyi RGPIN-2019-05220, Kanser Araştırma Derneği/Ottawa Üniversitesi 24064, LW tarafından alınan Kanada Sağlık Enstitüleri (CIHR) Araştırma İşletme Hibesi 175177, MK tarafından elde edilen CIHR Yüksek Lisans Bursu ve FSDB tarafından elde edilen Kraliçe II. Elizabeth Bilim ve Teknoloji Bursları (QEII-GSST).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.1 µm vacuum filtration unit Filtropur V50 | Sarstedt | 83,3941,002 | |
| 0.22 µm Acrodisc Syringe Filter | Pall Corporation | PN4612 | |
| 1 mL syringe | Thermo Fisher Scientific | MB9204560TF-LAB | |
| 10 kDa Centricon Plus-70 Centrifugal Filter | Sigma | UFC701008 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| 96-well Flat Clear Bottom Black Polystyrene TC-treated Microplates | Costar | 3603 | |
| Agarose | Thermo Fisher Scientific | R0491 | |
| AKTA Fast Protein Liquid Chromatograph | GE Lifesciences | 29022094 | |
| BD PrecisionGlide Needle - 18G | BD Biosciences | 305196 | |
| Benzonase Nuclease | Sigma | E1014-25KU | |
| BioTek Synergy H1 Multimode Reader | BioTek | SH1M2G-SN | |
| Blue Juice Gel Loading Buffer | Invitrogen | 10816015 | |
| CaptoCore 700 resin | Cytiva | 17548102 | |
| Cellometer Auto 2000 Viability Counter | Nexcelom BioScience LLC | ||
| CryoStor CS10 freezing medium | Sigma | C2874 | |
| DPBS−/− | Fisher | BP399-1 | |
| Dual LED Blue/White Light Transilluminator | Invitrogen | LB0100 | |
| Duet P3202 Flow Control Pump | FiberCell Systems | ||
| Dulbecco's phosphate-buffered saline | Gibco | 14190250 | |
| Ethanol | Commercial Alcohols | P006EAAN | |
| Exosome-Depleted FBS | Gibco | A2720803 | |
| Fluorobrite DMEM | Gibco | A18967-01 | |
| Glucose meter | AccuCheck | Model 930 | |
| HiScale chromatography column 10/40 | Cytiva | 29360550 | |
| ImmunoCult-XF (GMP medium alternative) | StemCell Technologies | 100-0956 | |
| ImmunoCult-XF T Cell Expansion Medium | StemCell Technologies | 10981 | |
| Isopropyl Alcohol | EMD | PX1834-1 | |
| K562 cells | ATCC | CCL-243 | |
| LB media | BioBasic | SD7002 | |
| L-Lactate Assay Kit | Abcam | ab65331 | |
| Medium hollow-fibre cartridge | FiberCell Systems | C2011 | |
| MgCl2 | Sigma | M1028 | |
| Mycoplasma PCR detection kit | Abcam | ab289834 | |
| NanoSight NS300 | Malvern | ||
| NaOH | Supelco | SX0607N-6 | |
| NK92-MI cells | ATCC | CRL-2408 | |
| pH Strips-Mquant | Sigma | 1,09533 | |
| PrestoBlue HS Cell Viability Reagent Assay | Invitrogen | P50200 | |
| Qubit 4 Fluorometer | Invitrogen | ||
| Qubit dsDNA BR Assay Kit | Invitrogen | Q33262 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q33231 | |
| Qubit Flex Assay Tube Strips | Invitrogen | Q33252 | |
| Qubit Flex Fluorometer | Invitrogen | Q33327 | |
| Qubit Protein BR Assay Kit | Invitrogen | A50669 | |
| Quick Load 1Kb Plus DNA ladder | NEB | N0469S | |
| SYBRSafe DNA Gel Stain Invitrogen | Invitrogen | S33102 | |
| Syringe pump | Harvard Apparatus | 984730 | |
| Triton-X 100 | Sigma | T-9284 | |
| UltraPure TAE Buffer | Invitrogen | 15558042 | |
| ViaStain Acridine Orange and Propidium Iodide (AO/PI) Staining Solution | ESBE Scientific | CS2-0106 |
Referanslar
- Cheng, M., Chen, Y., Xiao, W., Sun, R., Tian, Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 10 (3), 230-252 (2013).
- Sheridan, C. Industry appetite for natural killer cells intensifies. Nat Biotechnol. 41 (2), 159-161 (2023).
- Shimasaki, N., Coustan-Smith, E., Kamiya, T., Campana, D. Expanded and armed natural killer cells for cancer treatment. Cytotherapy. 18 (11), 1422-1434 (2016).
- Elsharkasy, O. M., et al. Extracellular vesicles as drug delivery systems: Why and how. Adv Drug Deliv Rev. 159, 332-343 (2020).
- St-Denis-Bissonnette, F., et al. Applications of extracellular vesicles in triple-negative breast cancer. Cancers. 14 (2), 451 (2022).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- St-Denis-Bissonnette, F., et al. A clinically relevant large-scale biomanufacturing workflow to produce natural killer cells and natural killer cell-derived extracellular vesicles for cancer immunotherapy. J Extracell Vesicles. 12 (12), e12387 (2023).
- Federici, C., et al. Natural-killer-derived extracellular vesicles: Immune sensors and interactors. Front Immunol. 11, 262 (2020).
- Lugini, L., et al. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 189 (6), 2833-2842 (2012).
- Zhu, L., et al. Novel alternatives to extracellular vesicle-based immunotherapy - exosome mimetics derived from natural killer cells. Artif Cells Nanomed Biotechnol. 46 (sup3), S166-S179 (2018).
- Cochran, A. M., Kornbluth, J. Extracellular vesicles from the human natural killer cell line NK3.3 have broad and potent anti-tumor activity. Front Cell Dev Biol. 9, 698639 (2021).
- Kim, H. Y., et al. Delivery of human natural killer cell-derived exosomes for liver cancer therapy: an in vivo study in subcutaneous and orthotopic animal models. Drug Deliv. 29 (1), 2897-2911 (2022).
- Alvarez-Erviti, L., et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 29 (4), 341-345 (2011).
- El-Sahli, S., et al. A triple-drug nanotherapy to target breast cancer cells, cancer stem cells, and tumor vasculature. Cell Death Dis. 12 (1), 8 (2021).
- Sulaiman, A., et al. Co-targeting bulk tumor and CSCs in clinically translatable TNBC patient-derived xenografts via combination nanotherapy. Mol Cancer Ther. 18 (10), 1755-1764 (2019).
- Farcas, M., Inngjerdingen, M. Natural killer cell-derived extracellular vesicles in cancer therapy. Scand J Immunol. 92 (4), e12938 (2020).
- Murphy, D. E., et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking. Exp Mol Med. 51, 1-12 (2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- FiberCell-Systems. . FiberCell systems user manual & quick start guide. , (2024).
- St-Denis-Bissonnette, F., et al. Evaluation of resazurin phenoxazine dye as a highly sensitive cell viability potency assay for natural killer cell-derived extracellular vesicle-based cancer biotherapeutics. J Extracell Biology. 3 (7), e166 (2024).
- Herrmann, I. K., Wood, M. J. A., Fuhrmann, G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol. 16 (7), 748-759 (2021).
- Andaloussi, E. L. A., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Federici, C., et al. Exosome release and low pH belong to a framework of resistance of human melanoma cells to cisplatin. PLoS One. 9 (2), e88193 (2014).
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4, 27066 (2015).
- Neviani, P., et al. Natural killer-derived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 79 (6), 1151-1164 (2019).
- Sun, H., et al. Natural killer cell-derived exosomal miR-3607-3p inhibits pancreatic cancer progression by targeting IL-26. Front Immunol. 10, 2819 (2019).
- Jiang, Y., et al. Engineered exosomes: a promising drug delivery strategy for brain disease. Curr Med Chem. 29 (17), 3111-3124 (2022).
- Dosil, S. G., et al. Natural killer (NK) cell-derived extracellular-vesicle shuttled microRNAs control T cell responses. Elife. 11, e76319 (2022).
- Geeurickx, E., et al. The generation and use of recombinant extracellular vesicles as biological reference material. Nat Commun. 10 (1), 3288 (2019).
- Nathani, A., et al. Combined role of interleukin-15 stimulated natural killer cell-derived extracellular vesicles and carboplatin in osimertinib-resistant H1975 lung cancer cells with EGFR mutations. Pharmaceutics. 16 (1), 83 (2024).
- Gobin, J., et al. Hollow-fiber bioreactor production of extracellular vesicles from human bone marrow mesenchymal stromal cells yields nanovesicles that mirrors the immuno-modulatory antigenic signature of the producer cell. Stem Cell Res Ther. 12 (1), 127 (2021).
- Sun, L., et al. A 3D culture system improves the yield of MSCs-derived extracellular vesicles and enhances their therapeutic efficacy for heart repair. Biomed Pharmacother. 161, 114557 (2023).
- Ryu, A. H., Eckalbar, W. L., Kreimer, A., Yosef, N., Ahituv, N. Use antibiotics in cell culture with caution: genome-wide identification of antibiotic-induced changes in gene expression and regulation. Sci Rep. 7 (1), 7533 (2017).
- Meng, W., et al. Prospects and challenges of extracellular vesicle-based drug delivery system: considering cell source. Drug Deliv. 27 (1), 585-598 (2020).
- Yang, Y., et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. J Transl Med. 19 (1), 104 (2021).
- Gamez-Valero, A., et al. Size-exclusion chromatography-based isolation minimally alters extracellular vesicles' characteristics compared to precipitating agents. Sci Rep. 6, 33641 (2016).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 178 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır