Method Article
Flusso di lavoro scalabile per la bioproduzione per la produzione e l'isolamento di bioterapici tumorali basati su vescicole extracellulari derivate da cellule natural killer
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Le vescicole extracellulari derivate da cellule natural killer (NK-EV) hanno un potenziale promettente come bioterapie antitumorali. Questo studio basato sulla metodologia presenta un flusso di lavoro scalabile di bioproduzione a circuito chiuso progettato per produrre e isolare continuamente grandi quantità di NK-EV ad alta purezza. I test di controllo in-process vengono eseguiti durante tutto il flusso di lavoro della bioproduzione, garantendo che i veicoli elettrici soddisfino gli standard di qualità per il rilascio del prodotto.
Abstract
Le vescicole extracellulari derivate da cellule natural killer (NK-EV) sono oggetto di studio come bioterapie antitumorali. Possiedono proprietà uniche come nanovescicole citotossiche che prendono di mira le cellule tumorali e come comunicatori immunomodulatori. Un flusso di lavoro scalabile per la bioproduzione consente la produzione di grandi quantità di NK-EV ad alta purezza per soddisfare le esigenze precliniche e cliniche. Il flusso di lavoro impiega un bioreattore a fibra cava a circuito chiuso, che consente la produzione continua di NK-EV dalla linea cellulare NK92-MI in condizioni prive di siero, xeno, feeder e antibiotici, in conformità con gli standard delle buone pratiche di fabbricazione. Questo studio basato su protocollo delinea il flusso di lavoro di bioproduzione per l'isolamento di NK-EV utilizzando la cromatografia ad esclusione dimensionale, l'ultrafiltrazione e la sterilizzazione basata su filtri. La caratterizzazione essenziale del prodotto NK-EV viene eseguita tramite l'analisi di tracciamento delle nanoparticelle e la loro funzionalità viene valutata attraverso un test di potenza convalidato basato sulla vitalità cellulare contro le cellule tumorali. Questo processo di bioproduzione scalabile ha un potenziale significativo per far progredire la traduzione clinica dei bioterapici tumorali basati su NK-EV, aderendo alle migliori pratiche e garantendone la riproducibilità.
Introduzione
Nel 21° secolo, sono stati raggiunti notevoli progressi nella battaglia contro il cancro. Ciò è dovuto principalmente all'aumento delle immunoterapie contro il cancro, una classe di farmaci che sfrutta il sistema immunitario per combattere il cancro. Le vescicole extracellulari derivate da cellule natural killer (NK-EV) rappresentano promettenti contendenti nel regno in espansione dell'immunoterapia. Integrative dell'immunità innata e adattativa, le cellule NK svolgono un ruolo cruciale nella difesa dell'organismo contro le cellule infettate da virus, stressate e maligne. Impiegano un arsenale completo di macchinari antitumorali per eliminare le cellule anormali attraverso mezzi citotossici 1,2,3. Tra questi meccanismi c'è la produzione e la secrezione di EV, strutture a doppio strato su scala nanometrica contenenti varie biomolecole, come proteine, RNA e DNA, cruciali per facilitare la comunicazione intercellulare 4,5,6. Le NK-EV emergono come promettenti terapie prive di cellule grazie alle loro proprietà di trasporto uniche. Questi includono le loro dimensioni ridotte, che consentono la sterilizzazione basata su filtri, l'elevata biocompatibilità, l'accumulo preferenziale all'interno dei tumori, l'ampio spettro di consegna del carico, la capacità di superare le barriere biologiche come la barriera emato-encefalica e il profilo di tossicità minimo. Per diversi motivi, le NK-EV ovviano alla necessità di linfodeplezione del paziente attraverso la chemioterapia prima della somministrazione: 1) convenzionalmente, la linfodeplezione viene impiegata per creare un ambiente più ospitale per la terapia cellulare, consentendo alle cellule infuse di proliferare ed esercitare i loro effetti terapeutici; 2) a differenza delle cellule, le vescicole extracellulari mancano della capacità di replicazione e sono sostanzialmente di dimensioni più piccole; 3) Le vescicole extracellulari operano attraverso meccanismi distinti e mostrano una ridotta immunogenicità rispetto alle cellule 5,6,7. Inoltre, le NK-EV hanno costantemente mostrato efficacia in vitro contro vari modelli di cancro e hanno anche mostrato effetti immunomodulatori sulle cellule immunitarie che favoriscono le risposte antitumorali 8,9. I risultati in vivo corroborano questi risultati, mostrando una regressione del cancro dopo il trattamento con NK-EV e tossicità trascurabili 10,11,12. Pertanto, le terapie basate su NK-EV sono molto promettenti per affrontare le sfide del trattamento dei tumori solidi freddi e immunologicamente inerti 13,14,15,16,17.
Il nostro recente studio affronta un significativo collo di bottiglia nella traduzione clinica delle NK-EV attraverso la bioproduzione7. L'articolo presenta un proof-of-concept per un flusso di lavoro di bioproduzione economico e scalabile di NK-EV, meticolosamente progettato per garantire test di controllo qualità durante il processo. Questo approccio ha prodotto continuamente grandi quantità di bioterapie antitumorali ad alta purezza basate su NK-EV, con un'accurata caratterizzazione del prodotto condotta secondo le linee guida MISEV201818. La scalabilità del flusso di lavoro della bioproduzione può essere ottenuta aumentando le dimensioni della cartuccia o facendo funzionare più bioreattori in parallelo. Allo stesso modo, la scalabilità del flusso di lavoro di isolamento delle vescicole extracellulari può essere facilmente raggiunta utilizzando tecniche come la cromatografia liquida proteica veloce (FPLC), l'ultrafiltrazione (UF) e la sterilizzazione basata su filtri. Il sistema di bioreattore a fibra cava (HFB) a circuito chiuso ha sviluppato la linea cellulare NK autosufficiente IL-2 (cellule NK92-MI) senza richiedere l'integrazione di siero, un sistema di alimentazione e antibiotici. Ciò è stato ottenuto utilizzando un mezzo chimicamente definito e privo di xeno disponibile in commercio (una versione GMP è ora disponibile in commercio). Di conseguenza, grandi quantità di cellule NK (10-9 cellule vitali) e NK-EV (10-12 EV) sono state prodotte con successo entro 5-7 giorni utilizzando una singola cartuccia di bioreattore di medie dimensioni, con entrambi i prodotti ampiamente caratterizzati. Durante tutto il processo di bioproduzione, la salute delle cellule è stata monitorata quotidianamente utilizzando metriche quantificabili come i livelli di pH, glucosio e lattato, insieme a indicatori visivi come il colore dei media e qualsiasi segno di contaminazione, che sono predittori essenziali della qualità delle cellule e delle vescicole extracellulari. La valutazione post-raccolta della vitalità e della funzionalità delle cellule NK generate nel sistema HFB, in particolare la citotossicità, ha rivelato un miglioramento significativo rispetto alle colture basate su fiasche7. Allo stesso modo, le NK-EV purificate hanno mostrato un profilo di purezza elevato, prive di batteri, micoplasmi, entità virali comuni e componenti cellulari e con livelli di endotossine trascurabili. È importante sottolineare che le NK-EV purificate costituivano oltre il 99,9% di tutte le nanoparticelle presenti nel prodotto finale7. Infine, queste NK-EV purificate hanno mantenuto le caratteristiche chiave di NK, tra cui i marcatori di superficie (CD2, CD45, CD56), il carico utile di citochine (GzmB, PFN, IFN-g) e hanno dimostrato una potente citotossicità contro le cellule leucemiche K562, la linea gold standard per la valutazione della citotossicità delle cellule NK7.
Il presente protocollo descrive in dettaglio il flusso di lavoro scalabile della bioproduzione discusso sopra. Chiarisce la metodologia per isolare le NK-EV prodotte utilizzando FPLC-SEC accoppiato con UF e sterilizzazione basata su filtro. Inoltre, il protocollo descrive le fasi fondamentali, tra cui la caratterizzazione del prodotto mediante l'analisi di tracciamento delle nanoparticelle (NTA), la valutazione della qualità utilizzando vari strumenti (quantificazione di proteine/dsDNA e test microbici) e la convalida funzionale del prodotto NK-EV purificato contro le cellule tumorali mediante test di vitalità cellulare. Tipicamente, questo flusso di lavoro produce 1,0 - 1,5 mL di prodotto NK-EV con una concentrazione media di 1,18 x 1012 EV/mL7, per un totale di un minimo di 1 x 1012 EV sulla base di circa 40 mL di CM ricco di EV. Questo processo consente il rilascio del prodotto per varie applicazioni a valle, come studi sperimentali, preclinici e multi-omici (proteomica, trascrittomica, genomica, metabolomica, lipidomica ed epigenomica) che richiedono elevate quantità di vescicole extracellulari di alta qualità, pur mantenendo un potenziale di traduzione clinica, con riproducibilità dimostrata.
Protocollo
1. Bioproduzione di NK-EV da cellule NK92-MI utilizzando un bioreattore a circuito chiuso
NOTA: Le NK-EV sono prodotte utilizzando un flusso di lavoro di bioproduzione scalabile che aderisce alle buone pratiche di fabbricazione (GMP) e utilizza le celle NK92-MI (vedere la Figura 1). La nostra recente pubblicazione contiene approfondimenti dettagliati sulla procedura di bioproduzione e sui profili di identità e sicurezza dei prodotti NK-EV7.
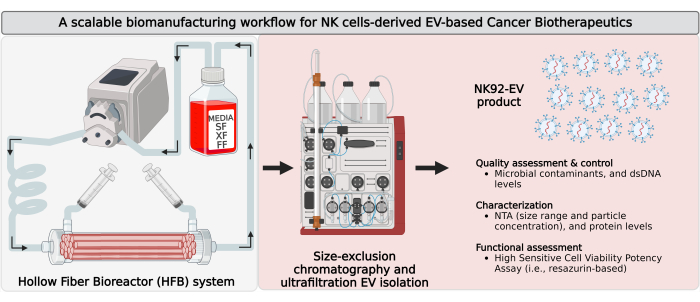
Figura 1: Bioproduzione di vescicole extracellulari derivate da cellule natural killer (NK-EV) in un bioreattore a fibre cave (HFB) a circuito chiuso con flusso di lavoro di isolamento scalabile. Rappresentazione schematica del flusso di lavoro della bioproduzione per generare grandi quantità di prodotti NK-EV ad alta purezza. Le cellule NK92-MI autosufficienti di IL-2 vengono seminate in una cartuccia HFB a circuito chiuso e coltivate in condizioni prive di siero (SF), xeno (XF), feeder-free e antibiotic-free, dove vengono coltivate per la raccolta continua di terreni condizionati ricchi di EV. L'isolamento di NK-EV da CM ricco di EV viene eseguito mediante cromatografia ad esclusione dimensionale basata sulla cromatografia liquida di proteine veloci (FPLC-SEC) accoppiata con ultrafiltrazione (UF). Le NK-EV sono caratterizzate e valutate attraverso più saggi e la loro funzionalità contro le cellule leucemiche K562 viene valutata utilizzando un test di vitalità della potenza. Questa cifra è stata modificata da7 (creato con Biorender.com). Clicca qui per visualizzare una versione più grande di questa figura.
- Partendo da 1 - 5 x 106 cellule NK92-MI e mantenendo una densità cellulare compresa tra 3 - 8 x 105 cellule/mL, coltivare le cellule in fiasche T25 - T175 utilizzando un terreno di coltura preriscaldato. Incubare a 37 °C con il 5% di CO2 (vedi Tabella dei materiali). Sostituire il terreno ogni 2 - 3 giorni fino a quando non vengono prodotte 1 x 108 cellule NK92-MI con almeno il 70% di vitalità.
NOTA: Mantenere 1/5-1/3 del terreno condizionato (CM) durante la risemina delle cellule, poiché contiene fattori di crescita favorevoli. - Eseguire la preparazione della cartuccia HFB del terreno e l'inoculazione delle cellule NK come descritto di seguito.
NOTA: Tutte le manipolazioni devono essere eseguite all'interno di una cappa di biosicurezza di classe II per garantire e mantenere la sterilità. Prima di spostare il sistema a cartuccia nella cabina di biosicurezza, spruzzare generosamente con etanolo al 70%, prestando particolare attenzione al collo di bottiglia del serbatoio e ai collegamenti della siringa.- Preparare la cartuccia HFB secondo le istruzioni del produttore19 (vedere la tabella dei materiali; vedere la Figura 2) come descritto di seguito.
- Avvolgere i collegamenti Luer Lock con un film di cera e regolare la portata della pompa secondo le istruzioni del produttore19. Condizionare la cartuccia HFB lasciando circolare 150 mL di soluzione salina sterile tamponata con fosfato (PBS; vedere la Tabella dei materiali) per almeno cinque giorni.
- Per rimuovere l'aria dallo spazio capillare extracellulare (ECS; il volume è di circa 29 mL), iniettare circa 40 mL di PBS attraverso la porta ECS sinistra e lasciare che l'aria fuoriesca attraverso la porta ECS destra. Mentre lo fai, chiudi i morsetti delle porte dell'estremità sinistra e destra. Assicurarsi che la siringa sia sempre collegata alle porte ECS sinistra e destra.
- Una volta completata, posizionare la cartuccia sulla pompa di flusso (vedi Tabella dei Materiali) all'interno dell'incubatrice impostata a 37 °C e 5% CO2. Assicurarsi che non ci siano perdite dopo alcuni giorni di circolazione.
- Sostituire il PBS con 150 mL di terreno di coltura nel flacone del serbatoio e l'ECS 2 giorni prima di seminare le cellule nella cartuccia. Ripetere i passaggi di condizionamento precedenti (passaggio 1.2.1.) utilizzando il terreno di coltura ma per 2 giorni di circolazione.
- Prima di seminare le cellule, sostituire il contenuto nel flacone del serbatoio e nell'ECS con 250 mL di terreno di coltura fresco.
- Acquisire il pallone di coltura dall'incubatore e trasferire le cellule in una provetta da 50 mL. Centrifugare a 300 x g per 5 min. Risospendere il pellet cellulare utilizzando 21 mL di terreno di coltura.
- Preparare due aliquote da 20,5 μl ciascuna dalla sospensione cellulare per il conteggio delle cellule su un contatore automatico di cellule (vedere la Tabella dei materiali). A ciascuna aliquota di sospensione cellulare da 20,5 μl, aggiungere una quantità uguale di colorante AO/PI (vedere la tabella dei materiali) e mescolare su e giù almeno 10 volte.
NOTA: Non consigliamo il Trypan Blue per un conteggio accurato delle cellule NK. In alternativa, utilizzare un emocitometro per il conteggio manuale. - Caricare 20 μl in ciascuna camera di conteggio del vetrino di conteggio ed eseguire il conteggio automatico delle celle utilizzando il programma appropriato. Calcola la concentrazione media di cellule vive e annota la vitalità.
- Mescolare la soluzione di cellule NK alcune volte prima di aspirarla utilizzando una siringa da 20 ml e un ago da 18 G per mantenere la sterilità. Questa soluzione deve contenere circa 1 x 108 cellule NK vive in circa 20 mL o circa 5 x 106 cellule/mL.
- Dopo aver rimosso l'ago dalla siringa, iniettare delicatamente le cellule NK nella cartuccia attraverso la porta ECS sinistra. Per garantire una dispersione uniforme delle cellule in tutta la cartuccia, ricambiare delicatamente la soluzione cellulare almeno 10 volte utilizzando le siringhe collegate alle porte ECS sinistra e destra.
NOTA: la soluzione deve avere la stessa torbidità su entrambe le siringhe, con le porte terminali sinistra e destra chiuse. - Aprire la porta terminale sinistra e destra e iniettare ciò che rimane all'interno delle siringhe. Chiudere le porte ECS sinistra e destra utilizzando i morsetti.
- Trasferire la cartuccia nell'incubatrice e lasciarla riposare per 30 minuti prima di installarla correttamente sulla pompa di flusso. Lasciare la cartuccia per la bioproduzione. Regolare la portata in base al produttore.
- Per monitorare le metriche di salute delle cellule, acquisire un'aliquota di 0,5 ml di terreno al giorno dal terreno accuratamente miscelato nel flacone del serbatoio e conservarla a -20 °C dopo aver verificato i livelli di glucosio e pH. I livelli di L-lattato possono essere verificati in seguito (vedi Tabella dei materiali).
- Sostituire il terreno nel serbatoio (250 - 500 ml) ogni 1 - 2 giorni per mantenere il contenuto di glucosio al di sopra del 50% dei livelli iniziali presenti nel terreno e il pH al di sopra di 7,0 (intervallo da 7,0 a 8,0).
- Preparare la cartuccia HFB secondo le istruzioni del produttore19 (vedere la tabella dei materiali; vedere la Figura 2) come descritto di seguito.
- Eseguire la raccolta di CM ricca di NK-EV ogni giorno dopo 1 giorno di riposo quando si semina per la prima volta la cartuccia come descritto di seguito.
- Spostare il sistema a cartuccia nella cabina di biosicurezza. Iniettare delicatamente circa 21 mL di terreno di coltura attraverso la porta sinistra del SEC per spingere un volume equivalente di CM ricco di EV attraverso il SEC destro - non miscelare (vedere Figura 3).
NOTA: Utilizzare sempre plastica nuova per evitare contaminazioni. - Trasferire la soluzione di CM ricca di EV in una provetta da 50 mL e centrifugare a 300 x g per 5 minuti. Nel frattempo, spostare nuovamente il sistema a cartuccia nell'incubatrice sulla pompa di flusso.
- Trasferire il surnatante in una nuova provetta e centrifugare a 2000 x g per 10 min. Anche in questo caso, trasferire il surnatante in una nuova provetta. Quindi, aliquotare il CM ricco di EV in modo uniforme su 3 provette da 50 mL (~7 mL/provetta) e conservarlo a -80 °C fino a ulteriore lavorazione.
NOTA: Il CM ricco di EV raccolto in sequenza viene raggruppato in questi tre tubi, generando tre provette di campioni replicati tecnici.
- Spostare il sistema a cartuccia nella cabina di biosicurezza. Iniettare delicatamente circa 21 mL di terreno di coltura attraverso la porta sinistra del SEC per spingere un volume equivalente di CM ricco di EV attraverso il SEC destro - non miscelare (vedere Figura 3).
- Eseguire la raccolta delle cellule HFB-NK per continuare a produrre CM ricco di EV utilizzando la stessa cartuccia HFB come descritto di seguito.
NOTA: Le cellule NK possono essere raccolte dall'ECS dell'HFB eseguendo il protocollo di raccolta delle cellule HFB-NK" una volta che la cartuccia raggiunge la confluenza (massimo 1 x 109 celle). Ciò accade dopo 5-7 giorni per ogni lotto o quando il contenuto di glucosio risulta essere inferiore al limite di rilevamento del glucometro (ad esempio, nessuna lettura o letture di ~ 0) per 2 giorni consecutivi. Se questo è il prelievo finale di cellule, il terreno può essere sostituito con il PBS per lavare la cartuccia e recuperare le cellule.- Raccogli CM ricco di EV esattamente come descritto sopra nel passaggio 1.3.
- Iniettare circa 50 mL di terreno attraverso la porta ECS sinistra. Per garantire una dispersione cellulare omogenea in tutta la cartuccia, spingere delicatamente avanti e indietro la soluzione cellulare utilizzando le siringhe collegate alle porte ECS sinistra e destra almeno 10 volte per allentare le cellule prima di spingerle e raccoglierle con una siringa attraverso la porta ECS destra. Trasferire il CM ricco di EV raccolto in una provetta da 50 mL. Mettere da parte a 37 °C (bagnomaria o incubatrice) per ora.
NOTA: L'azione di push-back aiuta a rimuovere le cellule prima che vengano completamente espulse e raccolte da una siringa attraverso la porta ECS destra. La soluzione deve avere la stessa torbidità su entrambe le siringhe, con le porte terminali sinistra e destra chiuse. Toccare la cartuccia del bioreattore (disturbo fisico) può aiutare a rimuovere preventivamente il gruppo di cellule nella parte inferiore della cartuccia. La miscelazione aggressiva della sospensione cellulare può influire negativamente sulla vitalità delle cellule recuperate. Cura e pazienza dovrebbero essere applicate per massimizzare la vitalità. - Ripetere l'ultimo passaggio 2 volte. In totale, devono essere recuperati 150 mL di sospensione cellulare. Centrifugare a 300 x g per 5 min. Scartare il surnatante.
- Risospendere entrambi i pellet cellulari in 20 mL di terreno fresco ciascuno e combinarli. Raccogliere due aliquote da 20,5 μl ciascuna della sospensione cellulare per il conteggio delle cellule su un contatore di cellule automatizzato (vedere la tabella dei materiali).
NOTA: In genere, sono necessarie numerose diluizioni cellulari utilizzando PBS come diluente per rientrare nell'intervallo dinamico del contatore di cellule. - All'aliquota di sospensione cellulare da 20,5 μl, aggiungere una quantità uguale di colorante AO/PI (vedere la tabella dei materiali) e mescolare su e giù almeno 10 volte. Caricare 20 μl in ciascuna camera di conteggio del vetrino di conteggio ed eseguire il conteggio automatico delle celle utilizzando il programma appropriato.
- Fare la media della concentrazione di cellule vive di tutti i conteggi corretti per la diluizione, determinare la quantità totale di cellule vive e registrare la vitalità. Come descritto in precedenza, per produrre continuamente CM ricco di EV utilizzando la stessa cartuccia del bioreattore, riseminare 1 x 108 cellule NK prodotte da HFB.
NOTA: Se lo si desidera, le cellule NK prodotte con HFB possono essere conservate utilizzando un mezzo di congelamento per crioconservazione e un contenitore di congelamento per controllare il tasso di congelamento (vedere la Tabella dei materiali).

Figura 2: Componente e configurazione del sistema del bioreattore a fibra cava (HFB). Il flacone del serbatoio (1) contiene il mezzo completo che circola attraverso la cartuccia del bioreattore (2) per l'azione di una pompa peristaltica (non raffigurata) che agisce sul tubo della pompa (3). Le cellule vengono introdotte nello spazio capillare extracellulare (ECS) attraverso le porte laterali sinistra (4) e destra (5) del SEC. Una volta chiusi i morsetti di scorrimento ECS, le porte laterali laterali sinistra (6) e destra (7) sono aperte per consentire al fluido di circolare in tutto il sistema. Notare l'aggiunta di una pellicola di cera sulla connessione Luer Lock vicino al tappo del serbatoio della bottiglia media per evitare potenziali contaminazioni. Clicca qui per visualizzare una versione più grande di questa figura.
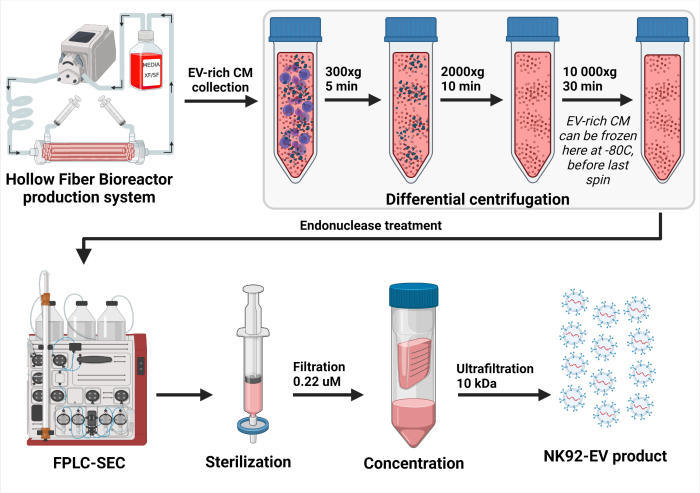
Figura 3: Rappresentazione schematica del processo di isolamento NK-EV. Dopo la raccolta giornaliera di terreno condizionato ricco di EV (CM), la soluzione è stata centrifugata in modo differenziale per rimuovere le cellule (prima centrifuga a 300 x g per 5 min) e i detriti cellulari (seconda centrifuga a 2000 x g per 10 min). Il CM ricco di EV eliminato è stato conservato a -80 °C fino a un'ulteriore elaborazione. Una volta pronto per l'isolamento di NK-EV, il CM congelato ricco di EV viene scongelato e centrifugato ancora una volta per garantire la rimozione dei detriti cellulari (terza centrifuga a 10.000 x g per 30 minuti). Quindi, il CM ricco di EV viene trattato per 2 - 4 ore a 37 °C con endonucleasi per digerire gli acidi nucleici considerati contaminanti della cellula ospite. Successivamente, il CM ricco di EV viene elaborato mediante cromatografia ad esclusione dimensionale basata sulla cromatografia liquida Fast Protein Chromatography (FPLC-SEC) per la purificazione delle EV utilizzando una resina bimodale. Le frazioni eluite di circa 10 - 15 mL vengono combinate e filtrate con filtri da 0,22 μM per garantire la sterilità del prodotto finale NK-EV. L'ultrafiltrazione consente di concentrare il prodotto di un fattore di circa 35 - 50X, ottenendo una concentrazione garantita di oltre 1 x 1012 EV/mL, per un totale di 1,0 - 1,5 mL. Questa cifra è stata modificata da7 (creato con Biorender.com). Clicca qui per visualizzare una versione più grande di questa figura.
2. Purificazione NK-EV mediante FPLC-SEC abbinata a sterilizzazione UF e basata su filtro
- Preparare le seguenti soluzioni e filtrarle due volte utilizzando un filtro da 0,1 μm (vedi Tabella dei materiali): acqua (conducibilità di 0 mS/cm), PBS: 50 mL di 10x PBS + 450 mL di acqua (conducibilità circa 14,7 mS/cm), 20% di etanolo, soluzione detergente (0,5 M NaOH e 30% di alcol isopropilico in acqua).
- Eseguire l'avvio del sistema FPLC secondo le istruzioni del produttore (vedere la tabella dei materiali). Eseguire le operazioni di pulizia in loco (CIP) pre e post corsa secondo le istruzioni del produttore. Lavare tutte le linee e la resina della colonna e risciacquare con acqua a doppio filtro (DF), soluzione detergente, acqua DF e DF-PBS.
NOTA: Vale la pena notare che il CIP può essere eseguito in un altro giorno, se necessario. - Utilizzare una colonna cromatografica impacchettata con una resina bimodale (vedi Tabella dei materiali) con un'altezza del letto di 20 cm. Effettuare i collegamenti utilizzando il metodo drip-to-drip per garantire che non venga introdotta aria all'interno della colonna.
- Impostare il raccoglitore di frazioni con provette di raccolta appropriate e modificare le impostazioni di frazionamento sul volume di raccolta desiderato (ad es. 15 mL). Posizionare un numero sufficiente di provette e due provette aggiuntive per raccogliere l'intero volume del campione.
- Eseguire la preparazione del campione come descritto di seguito.
- Prelevare 40 - 80 mL di CM ricco di EV dal congelatore a -80 °C e scongelare rapidamente a 37 °C. Caricare il campione nell'ultracentrifuga e centrifugare a 10.000 x g per 30 minuti a 4 °C.
NOTA: I tubi devono essere bilanciati accuratamente in base al peso, non al volume. - Dopo la centrifuga, raccogliere il surnatante e trasferirlo in un nuovo tubo. Per ridurre i livelli di dsDNA, trattare il CM ricco di EV con 50 U/mL di endonucleasi e 1,5 mM di MgCl2 (vedi Tabella dei materiali). Incubare per 2 - 4 ore in un incubatore (37 °C), consentendo una miscelazione moderata.
- Prelevare 40 - 80 mL di CM ricco di EV dal congelatore a -80 °C e scongelare rapidamente a 37 °C. Caricare il campione nell'ultracentrifuga e centrifugare a 10.000 x g per 30 minuti a 4 °C.
- Una volta che il sistema (linee e colonna) è pronto per l'isolamento delle vescicole extracellulari, caricare il CM ricco di vescicole extracellulari in una siringa da 60 ml e collegarlo alla linea del campione. Avviare il sistema facendo clic su Esecuzione manuale e impostare la portata su 0. Seguire le istruzioni del software per salvare l'esecuzione in modo preventivo, quindi fare clic su Avvia.
- Selezionare la linea B (DF-PBS) e funzionare a una velocità di flusso di 150 cm/h (portata di 2,0 mL/min). Assicurarsi che la soluzione attraversi la colonna.
- Una volta che la conduttività si stabilizza, premere Auto Zero UV. Modificare il percorso del flusso per indirizzare il campione verso la bottiglia di scarto prima della colonna. Assicurarsi che non vengano introdotte bolle nel sistema.
- Dopo un massimo di 5 - 20 s, dirigere il campione verso la colonna. Fare clic su Frazionamento quando le letture UV raggiungono circa 230 mAU.
- Una volta che il campione è stato completamente iniettato attraverso il sistema, passare il sistema tampone a DF-PBS (sulla valvola del campione) per continuare la purificazione. Fare nuovamente clic su Frazionamento quando il valore UV raggiunge circa 1600 mAU.
NOTA: Corrisponde all'intersezione tra le letture UV e le letture di conducibilità. Un frazionamento più lungo diluisce solo il retentato senza aumentare la resa delle vescicole extracellulari. - Combinare tutte le frazioni (NK-EV diluite) e conservarle a 4 °C fino al momento della sterilizzazione e dell'ultrafiltrazione (UF) con filtro.
- Continuare a far funzionare DF-PBS fino a quando il valore UV raggiunge circa 1000 mAU. Successivamente, interrompere l'esecuzione e salvare il cromatogramma come documento PDF.
3. Sterilizzazione e concentrazione basata su filtro del prodotto NK-EV mediante UF
- Raffreddare la centrifuga a 10 °C. Sanificare ogni componente dell'apparecchio UF (vedi Tabella dei materiali) risciacquando con 20 - 30 ml di etanolo al 90%. Centrifugare a 4000 x g per 5 - 10 min.
NOTA: Il filtro è realizzato in cellulosa rigenerata MWCO da 10 kDa. - Eliminare il flusso e quindi ripetere il risciacquo utilizzando PBS sterile per equilibrare il dispositivo. Ripeti 2 volte in totale.
- Per massimizzare la sterilità, filtrare la soluzione diluita di NK-EV utilizzando un filtro per siringa da 0,22 μm pre-bagnato con DF-PBS (vedere la Tabella dei materiali). Raccogliere il filtrato direttamente nell'apparecchio di concentrazione sterilizzato.
- Centrifugare a 4000 x g per 15 - 40 min (il tempo di centrifuga dipende dal campione). Miscelare la soluzione all'interno dello scomparto superiore del filtro utilizzando una pipetta sierologica dopo la centrifuga. Centrifugare a 4000 x g per altri 10 min.
NOTA: La fase di miscelazione è facoltativa in quanto facilita semplicemente la fase di concentrazione evitando che la membrana venga ostruita dalle vescicole extracellulari. - Mettere temporaneamente da parte il flusso continuo e raccogliere il campione NK-EV capovolgendo il dispositivo di filtrazione e collegandolo al dispositivo di raccolta.
- Centrifugare a 2000 x g per 2 min. Trasferire il prodotto NK-EV purificato in una provetta da 2 mL. Conservare il prodotto NK-EV purificato a 4 °C per un uso a breve termine (≤ 7 giorni) o congelato a -20 °C per un uso a lungo termine.
4. Caratterizzazione di NK-EV mediante analisi di tracciamento di nanoparticelle (NTA)
- Preparare la soluzione e filtrarla due volte a 0,1 μm (vedi Tabella dei materiali): acqua, PBS, soluzione detergente (10% di candeggina (ATTENZIONE) in acqua).
- Avviare il sistema NTA secondo le istruzioni del produttore. Analogamente, eseguire i passaggi CIP (Clean-In-Place) prima e dopo l'esecuzione. Lavare tutte le linee e risciacquare con acqua a doppio filtro (DF), soluzione detergente e acqua DF. Equilibrare le linee utilizzando DF-PBS.
- Verificare la presenza di bolle d'aria nella cella di flusso. Rimuovere le bolle se presenti. Una volta pulita, reinserire con cautela la cella di flusso nello strumento NTA.
NOTA: Sebbene non sia raccomandato dal produttore, le bolle d'aria molto difficili da rimuovere possono essere facilmente rimosse risciacquando con etanolo al 20% e poi con acqua DF. - Una volta che la cella di flusso è in posizione e lo sportello è chiuso, fare clic su Avvia telecamera. Con le linee riempite con DF-PBS, lo schermo dovrebbe mostrare un numero minimo assoluto di particelle.
- Modificare le impostazioni di acquisizione impostando un guadagno dello schermo di 2 e un livello della fotocamera di 14. Inoltre, accendere il riscaldatore per stabilizzare la temperatura della cella di flusso.
- Fare clic su Misurazione standard per creare uno script nella scheda SOP per la raccolta di una cattura in 1 minuto a una velocità di flusso di 30 particelle/fotogramma e 23 °C.
- Appena sotto, aggiungi la cartella e il nome del file al nome del percorso per salvare i dati.
- Preparare in anticipo le diluizioni del prodotto NK-EV purificato utilizzando DF-PBS. Quando si esegue NTA, la quantificazione accurata richiede 30 - 80 particelle/fotogramma.
- Agitare il campione prima di caricarlo nella siringa (vedere la Tabella dei materiali).
- Collegare con cautela la siringa di acquisizione da 1 mL alla linea di caricamento dello strumento. Non dovrebbe essere presente aria in quanto influirà negativamente sull'acquisizione e sull'analisi. Spingere lentamente metà del campione, lasciando circa 0,5 ml nella siringa.
- Una volta che le particelle sono visibili sullo schermo, metti a fuoco la fotocamera in modo da avere un massimo di un alone attorno a ciascuna particella. Fare clic su Infondere nella scheda Hardware a una velocità di 1000 per 5 s. Quindi, abbassalo a una velocità di 30.
- Premere Esegui script e seguire le istruzioni. Il software si assicurerà che la temperatura sia impostata e chiederà se le impostazioni sono corrette. Fare clic su Sì e seguire le istruzioni del software.
- Dopo aver completato l'acquisizione, fare clic su Annulla quando il software richiede di elaborare o esportare i file. Fare clic su Infondere nella scheda Hardware a una velocità di 1000 per 10 - 15 s. Nel frattempo, riaccendere il riscaldatore e la fotocamera. Quindi, abbassa la velocità a 30 fino a quando le particelle non si muovono.
- Raccogli altre quattro acquisizioni ripetendo i passaggi precedenti. Una volta registrato un totale di cinque catture per diluizione, eseguire l'analisi dopo aver importato tutte e cinque le catture.
- Seleziona i file da elaborare evidenziandoli. Fare clic su Elabora file selezionati. Nella scheda Processo, regolare le impostazioni di analisi su un guadagno dello schermo di 2 e una soglia di rilevamento di 15.
Le impostazioni dipendono dal campione. Assicurarsi che siano visibili 30 - 80 particelle per fotogramma. - Selezionare e fare clic su OK per l'analisi.
- Una volta elaborati i file, il software chiederà di esportarli. Fare clic su Sì senza fare clic su caselle aggiuntive oppure fare clic su Esporta.
- Ripetere l'operazione per tutte le diluizioni o i campioni EV. Spegnere lo strumento NTA dopo che tutti i campioni sono stati completati e il CIP è terminato.
5. Test di garanzia della qualità
- Eseguire il test microbico utilizzando due test: 1) una piccola aliquota di NK-EV purificati viene addizionata in un mezzo di brodo LB autoclavato e 2) una piccola aliquota di NK-EV purificati viene utilizzata per la rilevazione della PCR del micoplasma (vedere la Tabella dei materiali).
- Test 1: coltura LB medium a 37 °C per un massimo di 5 giorni con controlli positivi e negativi inclusi. Registrare l'OD600, se necessario.
- Test 2: eseguire il rilevamento della PCR del micoplasma secondo il protocollo del produttore.
- Quantificare le proteine e il dsDNA sulle diluizioni purificate di NK-EV utilizzando saggi basati su fluorometri secondo le istruzioni del produttore (vedere la Tabella dei materiali).
6. Valutazione della potenza di cellule tumorali trattate con NK-EV utilizzando un saggio di vitalità cellulare convalidato a base di resazurina altamente sensibile 20
- Coltura di cellule leucemiche umane K562 utilizzando RPMI-1640 con FBS inattivato termicamente al 10% per alcuni giorni prima di eseguire il test di potenza (vedere la Tabella dei materiali). Mantenere la densità tra 2 e 8 x 105 cellule/mL e sostituire il terreno ogni 2-3 giorni.
- Acquistare una piastra a fondo piatto a 96 pozzetti (vedere la Tabella dei materiali) e aggiungere preventivamente il volume di terreno di prova (integrato con FBS impoverito al 5% di EV) necessario ai fini della normalizzazione (vedere la Tabella dei materiali). Il volume finale è di 150 μL/pozzetto.
NOTA: Utilizzare un pipettatore a ripetizione per ridurre la variazione da pozzetto a pozzetto. - Acquisire la coltura cellulare e trasferire le cellule in una provetta. Centrifugare a 300 x g per 5 min. Risospendere il pellet cellulare in una soluzione a cellula singola utilizzando 2 - 5 mL di terreno di prova.
- Raccogliere un'aliquota di 20,5 μl della sospensione cellulare per il conteggio delle cellule su un contatore di cellule automatizzato (vedere la Tabella dei materiali).
- All'aliquota di sospensione cellulare da 20,5 μl, aggiungere una quantità uguale di colorante AO/PI (vedere la tabella dei materiali) e mescolare su e giù almeno 10 volte.
NOTA: Si consiglia AO/PI per un conteggio accurato delle cellule. In alternativa, utilizzare un emocitometro per il conteggio manuale. - Caricare 20 μl in ciascuna camera di conteggio del vetrino di conteggio ed eseguire il conteggio automatico delle celle utilizzando il programma appropriato. Fare la media della concentrazione di cellule vive e registrare la vitalità.
- Trasferire circa 1 x 106 cellule in una provetta secondaria. Diluire le cellule con precisione a 7 mL di terreno di prova e ripetere il conteggio delle cellule. La concentrazione dovrebbe essere di circa 1,2 - 1,5 x 105cellule vive/mL.
- Come descritto in precedenza, regolare la concentrazione della sospensione di una singola cellula su 1 x 105 cellule vive/mL e, se necessario, ripetere il conteggio delle cellule.
NOTA: Il coefficiente di variazione tra i conteggi tecnici dei duplicati deve essere inferiore al 25%; in genere, è inferiore al 5% con il conteggio AO/PI. - Una volta raggiunta la concentrazione desiderata, trasferire 50 μL (± 1 μL) di questa soluzione in ciascun pozzetto per avvicinarsi il più possibile a 5000 cellule/pozzetto (4900 - 5100 cellule/pozzetto). Preparare triplicati tecnici per ogni condizione di analisi e utilizzare un pipettatore a ripetizione per ridurre la variazione da pozzetto a pozzetto.
- Trasferire la piastra in un agitatore orbitale (350 - 500 giri/min) per 2 minuti. Trasferire nuovamente le cellule nell'incubatore fino al momento di procedere con il trattamento NK-EV.
- Preparare le diluizioni NK-EV richieste (1:5, 1:10 e 1:100) utilizzando un mezzo di analisi.
- Da queste diluizioni, testare le seguenti concentrazioni di EV: 1 x 108, 5 x 108, 1 x 109, 5 x 109, 1 x 1010, 5 x 1010 e 1 x 1011 particelle/mL. Il volume di dosaggio è limitato al 20% del volume totale del saggio.
- Una volta pronto, trasferire il volume richiesto di una data diluizione nei pozzetti che richiedono una concentrazione di EV desiderata per il trattamento. Aggiungere 15 μl di 10x Triton-X al pozzetto di controllo positivo (vedere la tabella dei materiali). Il volume finale del pozzetto deve essere normalizzato a 150 μL.
- Aggiungere la piastra a un agitatore orbitale (350 - 500 giri/min) per 2 minuti. Incubare le cellule a 37 °C nell'incubatore al 5% di CO2 per 3 ore.
- Preriscaldare il lettore di piastre (vedere la tabella dei materiali) a 37 °C e caricare il seguente script: 37 °C (riduce la variazione correlata alla temperatura), miscelazione a 450 giri/min per 1 minuto (garantisce l'omogeneità del campione) e lettura.
- Aggiungere 15 μl di reagente a base di resazurina in ciascun pozzetto (vedere la tabella dei materiali). Proteggere il reagente dalla luce e utilizzare un pipettatore a ripetizione per ridurre la variazione da pozzetto a pozzetto.
- Aggiungere la piastra a un agitatore orbitale (350 - 500 giri/min) per 2 minuti. Trasferire la piastra nell'incubatrice e incubare per 60 minuti. Rimuovere le bolle d'aria utilizzando un puntale per pipetta imbevuto di etanolo. Leggere la lastra utilizzando un'eccitazione di 560 nm e un'emissione di 590 nm.
- Analisi dei dati: le repliche tecniche medie sono state mediate e corrette per il background prima di eseguire un'analisi dose-risposta utilizzando una regressione non lineare per l'effetto di inibizione che mostra la pendenza log(inibitore) rispetto alla variabile di risposta normalizzata senza vincoli. Registrare i valori di pendenza e EC50 .
Risultati
Le NK-EV possiedono funzioni citotossiche intrinseche e hanno dimostrato un'elevata efficacia contro vari modelli di cancro. Tuttavia, è necessaria una maggiore standardizzazione tra gli studi attuali riguardanti un flusso di lavoro di bioproduzione adatto alla produzione su larga scala di NK-EV 6,21. Il nostro studio precedente descriveva la fattibilità di un sistema di bioreattore a fibra cava (HFB) a circuito chiuso per produrre grandi quantità di prodotti NK-EV ad alta purezza7. Come follow-up, questo studio basato su protocollo descrive in dettaglio il flusso di lavoro della bioproduzione e ne dimostra la riproducibilità producendo e isolando il prodotto NK-EV (Figura 1). Inoltre, prima di eseguire il rilascio del prodotto, sono necessarie la caratterizzazione e la convalida essenziali del prodotto, per cui in questo studio vengono presentati dati nuovi e originali.
Il sistema HFB è stato scelto per la produzione di NK-EV per la sua facilità d'uso, affidabilità, scalabilità e conformità alle GMP7. In riferimento alla configurazione del sistema HFB, le cellule NK vengono iniettate attraverso la porta ECS sinistra e seminate nella cartuccia del bioreattore (Figura 2). Allo stesso tempo, il flacone del terreno è collegato all'HFB attraverso le porte laterali e il fluido può fluire in tutto il sistema. Le cellule NK vengono coltivate in terreno privo di siero, xeno, alimentatore e antibiotico, dove il terreno viene sostituito quando il contenuto di glucosio scende al di sotto del 50% per mantenere e massimizzare la salute delle cellule nel tempo. Il CM viene raccolto quotidianamente, lavorato attraverso centrifugazioni differenziali e mantenuto congelato (-80 °C) fino al momento di essere pronto per un'ulteriore lavorazione. Successivamente, l'isolamento delle vescicole extracellulari viene condotto attraverso una combinazione di centrifugazioni differenziali e FPLC-SEC accoppiate con UF e filtrazione (Figura 3). Ciò si traduce in un prodotto NK-EV concentrato e sterile con un volume finale di circa 1,0 - 1,5 mL. Viene fornito un cromatogramma rappresentativo dell'isolamento FPLC-SEC delle NK-EV (Figura 4). Prima dell'elaborazione FPLC-SEC, il CM ricco di NK-EV viene trattato con endonucleasi, riducendo significativamente i livelli di dsDNA, un potenziale contaminante delle cellule ospiti (NK)7. Pertanto, il flusso di lavoro di isolamento delle vescicole extracellulari descritto rimuove i detriti cellulari e i contaminanti RNA/DNA dal prodotto NK-EV, il che è essenziale per garantire un potenziale immunogenico basso e indesiderato e che il prodotto finale sia adatto per gli studi a valle.
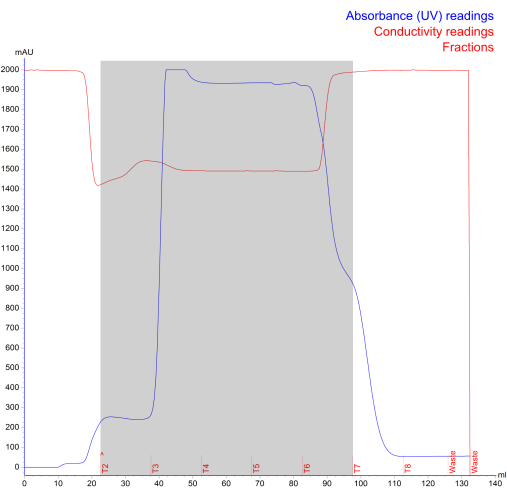
Figura 4: Cromatogramma di isolamento NK-EV generato durante l'esclusione delle dimensioni della cromatografia liquida di proteine veloci. La linea blu rappresenta l'assorbanza (mAU; lettura massima di 2000 mAU), la linea rossa rappresenta la conducibilità, il testo rosso rappresenta il log di esecuzione e l'area ombreggiata grigia rappresenta le NK-EV frazionate (indicate con le frazioni T2 - T7). Clicca qui per visualizzare una versione più grande di questa figura.
Dopo l'isolamento, la caratterizzazione di base di NK-EV e i test di garanzia della qualità vengono utilizzati per valutare se il prodotto NK-EV può essere rilasciato per ulteriori sperimentazioni a valle. L'intervallo di dimensioni e la concentrazione delle particelle del prodotto NK-EV sono misurati utilizzando l'analisi di tracciamento delle nanoparticelle (NTA), con dimensioni comprese tra 76,30 e 174,30 nm di diametro (D10 di 78,38 ± 2,07 nm, D50 di 106,72 ± 2,43 nm e D90 di 169,80 ± 4,17 nm) e una concentrazione media di 1,39 x 1012 EV/mL (Figura 5A-B). Inoltre, la quantificazione con fluorimetro ha mostrato una concentrazione di proteine e dsDNA rispettivamente di 298,90 ± 66,62 mg/mL e 225,60 ± 37,7 ng/mL per il prodotto finale (Figura 5C-D). Ciò corrisponde a un rapporto medio di 5,06 x 106 EV/μg di proteine e 6,16 x 1012 EV/μg di DNA. Il test microbico e il test del micoplasma hanno entrambi restituito risultati negativi (dati non mostrati). Questi risultati sono coerenti con la caratterizzazione delle NK-EV dal lavoro precedente7. La precedente pubblicazione7 fornisce anche un'ulteriore caratterizzazione approfondita dei prodotti NK-EV seguendo le linee guida MISEV (ad esempio, TEM, western blot, livello di endotossine, entità virali e citometria a flusso per antigeni di superficie e citochine).
Infine, la funzionalità del prodotto NK-EV (cioè la citotossicità contro le cellule tumorali) è stata valutata utilizzando un test di vitalità cellulare altamente sensibile convalidato a base di resazurina dopo il trattamento con NK-EV contro la linea cellulare leucemica K562 7,20. Il trattamento cellulare K562 con NK-EV per 3 ore ha prodotto un effetto dose-dipendente sulla vitalità cellulare, corrispondente a un EC50 di 9,33 x 109 EV/mL (cioè, il dosaggio che corrisponde all'uccisione del 50% della popolazione cellulare; Figura 6A-B). Pertanto, seguendo i criteri di rilascio del prodotto delineati, il prodotto NK-EV è ritenuto adatto per ulteriori sperimentazioni.
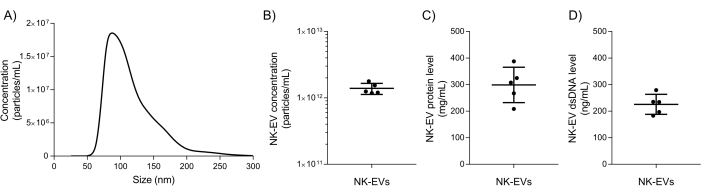
Figura 5: Caratterizzazione del prodotto NK-EV purificato. (A) Distribuzione dimensionale del prodotto NK-EV misurata mediante NTA, mostrata come media di 5 esperimenti indipendenti, ciascuno con 10 repliche tecniche (5 catture video x 2 diluizioni). (B) Concentrazione di particelle NK-EV (particelle/mL) misurata mediante NTA, presentata come media ± SD da 5 esperimenti indipendenti, ciascuno con duplicati tecnici. (C) La concentrazione proteica del prodotto NK-EV (mg/mL) è stata misurata utilizzando un fluorimetro, presentata come media ± SD da 5 esperimenti indipendenti, ciascuno con triplicati tecnici. (D) Concentrazione di dsDNA (ng/mL) del prodotto NK-EV misurata utilizzando un fluorimetro, presentata come media ± SD da 5 esperimenti indipendenti, ciascuno con triplicati tecnici. Clicca qui per visualizzare una versione più grande di questa figura.
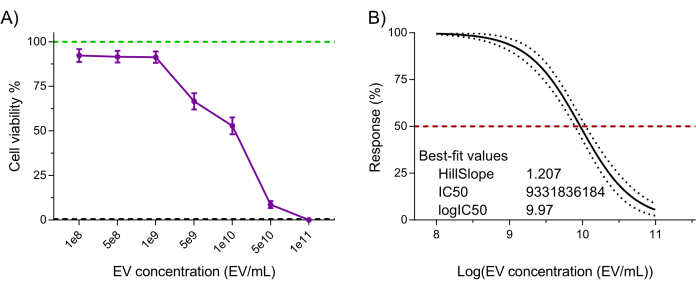
Figura 6: Convalida funzionale del prodotto NK-EV purificato. Le NK-EV dimostrano una citotossicità dose-dipendente contro le cellule di leucemia umana K562 trattate a varie concentrazioni di NK-EV per 3 ore utilizzando un saggio di vitalità cellulare basato su resazurina ad alta sensibilità. (A) Letture normalizzate dei saggi (la linea verde rappresenta il controllo delle cellule leucemiche K562 non trattate e la linea tratteggiata nera rappresenta il controllo delle cellule morte leucemiche K562 lirate; trattato con detergente). I dati sono mostrati come media ± SEM da 11 esperimenti indipendenti con triplicati tecnici. (B) Analisi della curva EC50 con pendenza variabile per il trattamento NK-EV con intervallo di confidenza/bande di previsione del 95% (la linea tratteggiata rossa rappresenta la risposta del 50%). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Diversi studi suggeriscono che le NK-EV possiedono un vasto potenziale come terapia antitumorale 4,5,7,9,16,22,23,24,25,26,27,28,29,30 . Tuttavia, per ulteriori test preclinici e future applicazioni cliniche è necessario un sistema di bioproduzione scalabile conforme alle GMP in grado di produrre grandi quantità di NK-EV ad alta purezza. Per affrontare questo problema, uno studio precedente ha utilizzato un sistema HFB a circuito chiuso per produrre continuamente cellule NK e CM ricco di NK-EV adatto per la sperimentazione a valle. Grazie al loro design 3D, i sistemi HFB riflettono fedelmente le condizioni del sistema vascolare e possiedono un rapporto superficie/volume incredibilmente elevato, che consente a oltre un miliardo di cellule di rimanere in coltura, portando in ultima analisi a un miglioramento della produzione di EV 7,31,32. È importante sottolineare che questo lavoro è stato il primo in assoluto a riportare l'utilizzo di un sistema HFB per la coltura di cellule NK, probabilmente a causa dell'autosufficienza della linea cellulare IL-27.
È necessario adottare ulteriori misure per garantire la sterilità del sistema HFB e la produzione di NK-EV di elevata purezza. Queste precauzioni sono particolarmente cruciali in assenza di una camera sterile e pulita, come può essere il caso di diverse strutture di ricerca. Prima di entrare nella cabina di biosicurezza, il sistema HFB viene meticolosamente spruzzato con etanolo al 70% per disinfettare tutte le superfici esterne. Inoltre, il film di cera è avvolto attorno a tutte le connessioni Luer Lock per ridurre al minimo il rischio di contaminazione. Ciò è particolarmente importante in quanto questo flusso di lavoro di bioproduzione non utilizza antibiotici, che sono noti per influenzare il profilo biochimico delle cellule e dei prodotti derivati dalle cellule33. Varie metriche sono state utilizzate per valutare la salute delle cellule durante la bioproduzione di prodotti cellulari. Ad esempio, sono state condotte valutazioni giornaliere del pH, del glucosio e del lattato del mezzo di serbatoio, in quanto si tratta di surrogati vitali per il monitoraggio della salute cellulare. Oltre alle valutazioni quantitative, anche le osservazioni qualitative del sistema HFB (ad esempio, il colore dei media e i segni visivi di contaminazione come la torbidità) sono utili per monitorare la salute delle cellule. La conta cellulare sul CM recuperato giornalmente non è risultata essere una metrica rappresentativa della vitalità per la salute della coltura (dati non mostrati). Questo è probabilmente il risultato di cellule morte recuperate durante il campionamento di CM che sono state trovate all'interno del tubo dove il terreno non era autorizzato a circolare (la piccola sezione tra il SEC e la porta della siringa del SEC), sottovalutando così la vitalità dell'intera coltura cellulare. Solo le cellule NK raccolte e prodotte dall'HFB alla fine di un lotto di produzione possono fornire una metrica affidabile dello stato di salute della coltura. Queste celle hanno mostrato costantemente valori di vitalità superiori al 70% in tutti i lotti di produzione7. Insieme, questi metodi di valutazione della qualità garantiscono la produzione continua di NK-EV ad alta purezza.
Sono state sviluppate diverse tecniche di isolamento per purificare e isolare le vescicole extracellulari34. Un metodo, SEC, utilizza una colonna impaccata con un materiale poroso - la resina - che consente la separazione delle molecole in base alla discriminazione dimensionale. In questo caso, le EV più grandi vengono eluite più velocemente attraverso la colonna; Questo metodo è noto come purificazione a flusso continuo basata sull'esclusione dimensionale. Allo stesso tempo, i contaminanti più piccoli (dsDNA, proteine fluttuanti come l'endonucleasi, i sali, il rosso fenolo, ecc.) vengono lasciati indietro e ulteriormente trattenuti all'interno della resina dalle forze elettrostatiche (ad esempio, è stata utilizzata una resina bimodale). L'elaborazione basata su SEC rimuove le proteine non legate alle EV mantenendo la struttura e la funzionalità originalidelle EV 35,36. Inoltre, la purificazione basata su SEC è facilmente scalabile senza compromettere l'elevata resa e purezza, il che la rende una scelta adatta per isolare le NK-EV per usi bioterapeutici. Nonostante questi vantaggi, il SEC presenta alcuni inconvenienti, come il flusso relativamente diluito (eluente); quindi, l'UF è necessario per la concentrazione del prodotto, ma consente anche lo scambio di tampone. L'apparecchio UF non sterile viene risciacquato con etanolo al 70% e PBS e conservato nella cabina di biosicurezza prima dell'uso per garantire la sterilità. In genere, il flusso può essere concentrato a 35x-50x del volume iniziale, rimuovendo piccole molecole che avrebbero potuto farsi strada nell'eluente. La centrifugazione differenziale e il trattamento con endonucleasi vengono eseguiti prima di FPLC-SEC accoppiato con UF per rimuovere cellule residue, detriti cellulari e lunghi filamenti di dsDNA antigenico7.
Successivamente, l'isolamento, la caratterizzazione e la convalida funzionale del prodotto NK-EV vengono eseguiti secondo le linee guida di MISEV2018 e MISEV2023 per determinare l'idoneità del prodotto per un ulteriore utilizzo 6,18. Ogni isolamento produce 1,0 - 1,5 mL di prodotto NK-EV ad alta purezza a una concentrazione minima di 1 x 1012 EV/mL, con una concentrazione media di 1,39 x 1012 particelle/mL. In precedenza, Gupta et al. hanno determinato che il dosaggio medio di EV in vivo è di 3,37 x 108 EV/kg di peso corporeo dei topi37. Il trattamento con il dosaggio mediano richiederebbe 8,43 x 106 EV/topo con un peso corporeo di 25 g, un valore molto inferiore al minimo garantito (1 x 1012 particelle/mL) ottenuto attraverso questo flusso di lavoro. Pertanto, il flusso di lavoro di bioproduzione descritto può produrre NK-EV più che sufficienti per la sperimentazione preclinica o per raggiungere gli obiettivi di dosaggio. Ogni isolamento viene testato per rilevare la presenza di micoplasma e microbi nell'ambito della valutazione del controllo qualità del prodotto. Inoltre, uno studio precedente ha dimostrato l'assenza di entità virali comuni e di endotossine nel prodotto finale e l'assenza di componenti cellulari considerati contaminanti della cellula ospite (mediante analisi western blot)7,34. Infine, la valutazione funzionale è stata eseguita utilizzando un saggio di vitalità cellulare convalidato a base di resazurina altamente sensibile per valutare la funzionalità delle NK-EV20. Il test di vitalità descritto funziona riducendo la resazurina (debolmente fluorescente) a resorufina (altamente fluorescente) da parte delle cellule metabolicamente attive, consentendo la valutazione della vitalità cellulare dopo il trattamento con NK-EV. Rispetto ad altri saggi alternativi di vitalità cellulare, il test a base di resazurina utilizzato nello studio è altamente sensibile ai cambiamenti nella vitalità cellulare (rumore di fondo molto basso) e consente di ridurre il tempo di incubazione per osservare i risultati (meno di 30 minuti per ottenere risultati statisticamente significativi)20. Generalmente, le NK-EV mostrano un effetto dose-dipendente sulla vitalità di K562. Insieme, i risultati presentati rappresentano un prodotto NK-EV che ha soddisfatto i criteri di rilascio del prodotto per la valutazione preclinica ed è adatto per applicazioni a valle.
In conclusione, questo studio basato su protocollo descrive la bioproduzione di NK-EV con potenziale di livello clinico. Come discusso, le NK-EV sono prodotte utilizzando un sistema HFB a circuito chiuso in condizioni prive di siero, xeno, alimentatore e antibiotici7. Una combinazione di FPLC-SEC/UF isola e purifica il prodotto NK-EV. Prima di rilasciare i prodotti per l'applicazione a valle, gli NK-EV devono essere caratterizzati e convalidati funzionalmente per garantire che siano adatti all'uso. Come dimostrato, seguendo questo protocollo di bioproduzione è possibile generare con successo una grande quantità di NK-EV ad alta purezza che mostrano citotossicità on-target contro le cellule tumorali. Pertanto, il protocollo di bioproduzione descritto potrebbe essere una risorsa per studi futuri che richiedono la produzione di NK-EV di grado clinico.
Divulgazioni
Tutti gli autori dichiarano di non avere conflitti di interesse o divulgazioni.
Riconoscimenti
Gli autori ringraziano i dottori Simon Sauvé, Roger Tam e Xu Zhang per la loro revisione critica del manoscritto. Questo lavoro è stato sostenuto da sovvenzioni operative della Genomics Research and Development Initiative (GRDI) Phase VII (2019-2025) del governo del Canada ottenute da JRL, LW, nonché da sovvenzioni operative del Natural Sciences and Engineering Research Council RGPIN-2019-05220, della Cancer Research Society/University of Ottawa 24064, della Canadian Institutes of Health (CIHR) Research Operating Grant 175177 ottenuta da LW, la borsa di studio CIHR MSc ottenuta da MK e la borsa di studio Queen Elizabeth II in Scienza e Tecnologia (QEII-GSST) ottenuta da FSDB.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.1 µm vacuum filtration unit Filtropur V50 | Sarstedt | 83,3941,002 | |
| 0.22 µm Acrodisc Syringe Filter | Pall Corporation | PN4612 | |
| 1 mL syringe | Thermo Fisher Scientific | MB9204560TF-LAB | |
| 10 kDa Centricon Plus-70 Centrifugal Filter | Sigma | UFC701008 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| 96-well Flat Clear Bottom Black Polystyrene TC-treated Microplates | Costar | 3603 | |
| Agarose | Thermo Fisher Scientific | R0491 | |
| AKTA Fast Protein Liquid Chromatograph | GE Lifesciences | 29022094 | |
| BD PrecisionGlide Needle - 18G | BD Biosciences | 305196 | |
| Benzonase Nuclease | Sigma | E1014-25KU | |
| BioTek Synergy H1 Multimode Reader | BioTek | SH1M2G-SN | |
| Blue Juice Gel Loading Buffer | Invitrogen | 10816015 | |
| CaptoCore 700 resin | Cytiva | 17548102 | |
| Cellometer Auto 2000 Viability Counter | Nexcelom BioScience LLC | ||
| CryoStor CS10 freezing medium | Sigma | C2874 | |
| DPBS−/− | Fisher | BP399-1 | |
| Dual LED Blue/White Light Transilluminator | Invitrogen | LB0100 | |
| Duet P3202 Flow Control Pump | FiberCell Systems | ||
| Dulbecco's phosphate-buffered saline | Gibco | 14190250 | |
| Ethanol | Commercial Alcohols | P006EAAN | |
| Exosome-Depleted FBS | Gibco | A2720803 | |
| Fluorobrite DMEM | Gibco | A18967-01 | |
| Glucose meter | AccuCheck | Model 930 | |
| HiScale chromatography column 10/40 | Cytiva | 29360550 | |
| ImmunoCult-XF (GMP medium alternative) | StemCell Technologies | 100-0956 | |
| ImmunoCult-XF T Cell Expansion Medium | StemCell Technologies | 10981 | |
| Isopropyl Alcohol | EMD | PX1834-1 | |
| K562 cells | ATCC | CCL-243 | |
| LB media | BioBasic | SD7002 | |
| L-Lactate Assay Kit | Abcam | ab65331 | |
| Medium hollow-fibre cartridge | FiberCell Systems | C2011 | |
| MgCl2 | Sigma | M1028 | |
| Mycoplasma PCR detection kit | Abcam | ab289834 | |
| NanoSight NS300 | Malvern | ||
| NaOH | Supelco | SX0607N-6 | |
| NK92-MI cells | ATCC | CRL-2408 | |
| pH Strips-Mquant | Sigma | 1,09533 | |
| PrestoBlue HS Cell Viability Reagent Assay | Invitrogen | P50200 | |
| Qubit 4 Fluorometer | Invitrogen | ||
| Qubit dsDNA BR Assay Kit | Invitrogen | Q33262 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q33231 | |
| Qubit Flex Assay Tube Strips | Invitrogen | Q33252 | |
| Qubit Flex Fluorometer | Invitrogen | Q33327 | |
| Qubit Protein BR Assay Kit | Invitrogen | A50669 | |
| Quick Load 1Kb Plus DNA ladder | NEB | N0469S | |
| SYBRSafe DNA Gel Stain Invitrogen | Invitrogen | S33102 | |
| Syringe pump | Harvard Apparatus | 984730 | |
| Triton-X 100 | Sigma | T-9284 | |
| UltraPure TAE Buffer | Invitrogen | 15558042 | |
| ViaStain Acridine Orange and Propidium Iodide (AO/PI) Staining Solution | ESBE Scientific | CS2-0106 |
Riferimenti
- Cheng, M., Chen, Y., Xiao, W., Sun, R., Tian, Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 10 (3), 230-252 (2013).
- Sheridan, C. Industry appetite for natural killer cells intensifies. Nat Biotechnol. 41 (2), 159-161 (2023).
- Shimasaki, N., Coustan-Smith, E., Kamiya, T., Campana, D. Expanded and armed natural killer cells for cancer treatment. Cytotherapy. 18 (11), 1422-1434 (2016).
- Elsharkasy, O. M., et al. Extracellular vesicles as drug delivery systems: Why and how. Adv Drug Deliv Rev. 159, 332-343 (2020).
- St-Denis-Bissonnette, F., et al. Applications of extracellular vesicles in triple-negative breast cancer. Cancers. 14 (2), 451 (2022).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- St-Denis-Bissonnette, F., et al. A clinically relevant large-scale biomanufacturing workflow to produce natural killer cells and natural killer cell-derived extracellular vesicles for cancer immunotherapy. J Extracell Vesicles. 12 (12), e12387 (2023).
- Federici, C., et al. Natural-killer-derived extracellular vesicles: Immune sensors and interactors. Front Immunol. 11, 262 (2020).
- Lugini, L., et al. Immune surveillance properties of human NK cell-derived exosomes. J Immunol. 189 (6), 2833-2842 (2012).
- Zhu, L., et al. Novel alternatives to extracellular vesicle-based immunotherapy - exosome mimetics derived from natural killer cells. Artif Cells Nanomed Biotechnol. 46 (sup3), S166-S179 (2018).
- Cochran, A. M., Kornbluth, J. Extracellular vesicles from the human natural killer cell line NK3.3 have broad and potent anti-tumor activity. Front Cell Dev Biol. 9, 698639 (2021).
- Kim, H. Y., et al. Delivery of human natural killer cell-derived exosomes for liver cancer therapy: an in vivo study in subcutaneous and orthotopic animal models. Drug Deliv. 29 (1), 2897-2911 (2022).
- Alvarez-Erviti, L., et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 29 (4), 341-345 (2011).
- El-Sahli, S., et al. A triple-drug nanotherapy to target breast cancer cells, cancer stem cells, and tumor vasculature. Cell Death Dis. 12 (1), 8 (2021).
- Sulaiman, A., et al. Co-targeting bulk tumor and CSCs in clinically translatable TNBC patient-derived xenografts via combination nanotherapy. Mol Cancer Ther. 18 (10), 1755-1764 (2019).
- Farcas, M., Inngjerdingen, M. Natural killer cell-derived extracellular vesicles in cancer therapy. Scand J Immunol. 92 (4), e12938 (2020).
- Murphy, D. E., et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking. Exp Mol Med. 51, 1-12 (2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- FiberCell-Systems. . FiberCell systems user manual & quick start guide. , (2024).
- St-Denis-Bissonnette, F., et al. Evaluation of resazurin phenoxazine dye as a highly sensitive cell viability potency assay for natural killer cell-derived extracellular vesicle-based cancer biotherapeutics. J Extracell Biology. 3 (7), e166 (2024).
- Herrmann, I. K., Wood, M. J. A., Fuhrmann, G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol. 16 (7), 748-759 (2021).
- Andaloussi, E. L. A., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Federici, C., et al. Exosome release and low pH belong to a framework of resistance of human melanoma cells to cisplatin. PLoS One. 9 (2), e88193 (2014).
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4, 27066 (2015).
- Neviani, P., et al. Natural killer-derived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 79 (6), 1151-1164 (2019).
- Sun, H., et al. Natural killer cell-derived exosomal miR-3607-3p inhibits pancreatic cancer progression by targeting IL-26. Front Immunol. 10, 2819 (2019).
- Jiang, Y., et al. Engineered exosomes: a promising drug delivery strategy for brain disease. Curr Med Chem. 29 (17), 3111-3124 (2022).
- Dosil, S. G., et al. Natural killer (NK) cell-derived extracellular-vesicle shuttled microRNAs control T cell responses. Elife. 11, e76319 (2022).
- Geeurickx, E., et al. The generation and use of recombinant extracellular vesicles as biological reference material. Nat Commun. 10 (1), 3288 (2019).
- Nathani, A., et al. Combined role of interleukin-15 stimulated natural killer cell-derived extracellular vesicles and carboplatin in osimertinib-resistant H1975 lung cancer cells with EGFR mutations. Pharmaceutics. 16 (1), 83 (2024).
- Gobin, J., et al. Hollow-fiber bioreactor production of extracellular vesicles from human bone marrow mesenchymal stromal cells yields nanovesicles that mirrors the immuno-modulatory antigenic signature of the producer cell. Stem Cell Res Ther. 12 (1), 127 (2021).
- Sun, L., et al. A 3D culture system improves the yield of MSCs-derived extracellular vesicles and enhances their therapeutic efficacy for heart repair. Biomed Pharmacother. 161, 114557 (2023).
- Ryu, A. H., Eckalbar, W. L., Kreimer, A., Yosef, N., Ahituv, N. Use antibiotics in cell culture with caution: genome-wide identification of antibiotic-induced changes in gene expression and regulation. Sci Rep. 7 (1), 7533 (2017).
- Meng, W., et al. Prospects and challenges of extracellular vesicle-based drug delivery system: considering cell source. Drug Deliv. 27 (1), 585-598 (2020).
- Yang, Y., et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. J Transl Med. 19 (1), 104 (2021).
- Gamez-Valero, A., et al. Size-exclusion chromatography-based isolation minimally alters extracellular vesicles' characteristics compared to precipitating agents. Sci Rep. 6, 33641 (2016).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 178, 178 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon