Method Article
Caracterización de espectros de absorción biológica que abarcan desde el visible hasta el infrarrojo de onda corta
En este artículo
Resumen
Las muestras biológicas tienen características ópticas distintas en los rangos de longitud de onda infrarrojo de onda corta (SWIR) en comparación con los rangos de longitud de onda visible (VIS) e infrarrojo cercano (NIR). Sin embargo, el registro de espectros de absorción SWIR puros es un desafío y rara vez se lleva a cabo para moléculas biológicas. Este artículo presenta un método para caracterizar los espectros de absorción VIS-SWIR de absorbentes biológicos.
Resumen
Para la monitorización fisiológica no invasiva basada en la luz, se pueden identificar las longitudes de onda óptimas de los componentes individuales del tejido mediante espectroscopia de absorción. Sin embargo, debido a la falta de sensibilidad del hardware en longitudes de onda más largas, la espectroscopia de absorción se ha aplicado típicamente para longitudes de onda en el rango visible (VIS) e infrarrojo cercano (NIR) de 400 a 1.000 nm. Los avances de hardware en el rango de infrarrojo de onda corta (SWIR) han permitido a los investigadores explorar longitudes de onda en el rango de ~ 1,000 nm a 3,000 nm en las que caen picos de absorción característicos de lípidos, proteínas y agua. Estas moléculas son difíciles de visualizar en el VIS-NIR y pueden proporcionar fuentes de contraste biológico sin marcadores. Además, se ha observado una menor absorción de SWIR para la melanina, el principal cromóforo responsable de la pigmentación de la piel. Se ha descubierto que los dispositivos ópticos in vivo, como los oxímetros de pulso clínicamente estándar, tienen una precisión reducida en personas con piel con pigmentación oscura, posiblemente debido a la mayor absorción de melanina en el rango VIS. Por lo tanto, el error asociado con la pigmentación de la piel podría reducirse mediante el uso de dispositivos que operan en el SWIR. El diseño de instrumentos ópticos se ve facilitado por la comprensión de las propiedades de absorción de los componentes del tejido central desde el VIS hasta el rango SWIR. Este artículo describe los protocolos e instrumentación para la obtención de espectros de absorción VIS-SWIR de absorbentes de tejidos comunes: hemoglobina oxigenada, hemoglobina desoxigenada, melanina, agua y lípidos.
Introducción
La mayoría de los absorbentes biológicos se han caracterizado ópticamente en los rangos espectrales visible (VIS, ~400-700 nm) e infrarrojo cercano (NIR, ~700-1.000 nm), pero no en el infrarrojo de onda corta (SWIR, ~1.000-3.000 nm)1,2,3,4 (Figura 1). Esto es así a pesar de que el SWIR ofrece una penetración de luz más profunda debido a una menor dispersión de los tejidos y una menor absorción de melanina, así como un contraste biológico adicional sin etiquetas para el agua, los lípidos y las proteínas 1,5,6. La falta de espectros de absorción que abarquen el VIS-SWIR ha creado una brecha en el conocimiento que impide el desarrollo de dispositivos ópticos biomédicos que aprovechen estos beneficios del SWIR. Si bien en el pasado se han presentado varios intentos de caracterizar los espectros, faltan espectros de absorción VIS-SWIR de alta calidad de componentes puros sin artefactos significativos de solvente 1,7,8. Por ejemplo, las sustancias solubles en agua, como la hemoglobina, se han caracterizado en el SWIR utilizando agua como disolvente y restando la absorción de agua pura de los espectros resultantes9. Sin embargo, la precisión de este enfoque no está clara porque el agua es un absorbente dominante en esta región.
Trabajar en el SWIR tiene la ventaja adicional de reducir o posiblemente eliminar el sesgo causado por la fuerte absorción de melanina en el VIS cuando se utilizan diagnósticos ópticos in vivo. Numerosos estudios han encontrado que los oxímetros de pulso sobreestiman la oxigenación en pacientes negros y, como tales, los pacientes negros tienen más probabilidades de tener niveles de oxígeno peligrosamente bajos que los oxímetros de pulsono detectaron. Este sesgo de pigmentación de la piel ha dado lugar a un tratamiento médico tardío e inadecuado de muchos pacientes hipóxicos negros11,12 y ha provocado un llamamiento a la acción en las comunidades de óptica e ingeniería para mejorar la precisión de los dispositivos ópticos para todos los tonos de piel13. Pasar de las longitudes de onda VIS de alta absorción de melanina a NIR y SWIR es una innovación técnica emocionante que podría reducir las disparidades raciales en las tecnologías de óptica biomédica de importancia crítica.
El registro de los espectros de absorción de biomoléculas es esencial para comprender las propiedades ópticas de las muestras de tejido que se utilizan en una variedad de aplicaciones biomédicas y de ingeniería14. La espectroscopia de absorción mide la absorción de luz específica de la molécula en función de la longitud de onda. El método de referencia para adquirir mediciones de absorción en solución es dirigir la luz monocromática colimada a través de una muestra disuelta y registrar la luz transmitida con un detector colocado en el lado opuesto de la muestra a la fuente de luz. La absorción (A) de la muestra se define entonces por la Ec. (1).
A = logaritmo10(I,0/I) (1)
Donde Io es la intensidad de la luz incidente en la muestra, e I es la intensidad de la luz transmitida a través de la muestra que incide en el detector. La espectroscopia de absorción proporciona propiedades cuantitativas de absorción y se rige por la Ley de Beer-Lambert (Ec. 2), que no se aplica a las muestras que tienen dispersión óptica. Esta ecuación establece que la absorción óptica está determinada por el coeficiente de absorción molar de una muestra (ε, unidades L·mol−1·cm−1) a la longitud de onda λ multiplicado por su concentración molar (C, unidades mol∙L-1) y la longitud del camino (L, unidades cm), que se define como la distancia recorrida a través de la muestra15:
A(λ) = ε(λ)*L*C (2)
Es importante destacar que el coeficiente de absorción molar es único para cada absorbente biológico e indica la fuerza con la que una muestra absorbe la luz a una longitud de onda particular16.
Al tomar mediciones de espectroscopia de absorción que abarcan desde el VIS hasta el SWIR, se requieren ajustes en el hardware, la preparación de la muestra y el posprocesamiento espectral más allá de los espectros VIS-NIR estándar:
Hardware
Las mediciones VIS-NIR suelen utilizar un detector de silicio o tubos fotomultiplicadores (PMT) con fotocátodos sensibles a los fotones UV-VIS, mientras que la absorbancia SWIR requiere un fotodetector que sea sensible a los fotones SWIR, como un detector de arseniuro de indio y galio (InGaAs)17. Los sistemas VIS, NIR y SWIR también suelen requerir elementos de dispersión específicos de la longitud de onda, como rejillas ópticas, para la dispersión de la luz en estos rangos ópticos. Además, la absorción SWIR requiere cubetas de vidrio o cuarzo, que tienen una mayor transmisión que las cubetas de plástico en el SWIR, lo que las hace más adecuadas para los espectros VIS-SWIR. Se debe seleccionar una fuente o fuentes de luz con una emisión amplia y relativamente uniforme que cubra el VIS-SWIR, como una lámpara halógena de tungsteno (utilizada en este protocolo). Ajustar la potencia de la luz incidente, el tiempo de exposición o la duración de la exposición del fotodetector a la luz puede ayudar a optimizar las mediciones de absorbancia.
Preparación de la muestra
La concentración de la muestra o la longitud del camino de la cubeta alterarán linealmente la cantidad de absorción que se produce como se describe anteriormente en la Ec (2) y, por lo tanto, cualquiera de las dos se puede cambiar para lograr una alta relación señal-ruido (SNR, aquí calculada como la relación de la amplitud de pico dividida por la desviación estándar de una región del espectro sin tendencia, típicamente SNR > 30 se considera de alta calidad) en diferentes secciones del espectro con mediciones relativamente altas o bajas absorbancia. Para optimizar las mediciones de SWIR en una solución acuosa, se puede utilizar óxido de deuterio (D2O), también conocido como agua pesada o agua deuterada, en lugar de agua (H2O), ya que tiene picos de absorción significativamente más bajos en el SWIR1. Esto permite la caracterización del soluto sin interferencia de la absorción de agua dominante en el SWIR.
Postprocesamiento espectral
El posprocesamiento es necesario porque los espectros VIS-SWIR requieren dos detectores, uno para el NIR visible (normalmente PMT sensible al silicio o a los rayos UV-VIS) y otro para el SWIR (normalmente InGaAs), y los espectros deben unirse para lograr un espectro VIS-SWIR completo. Cuando los espectros abarcan el VIS-SWIR, la absorción puede variar significativamente dependiendo de la región de longitud de onda, y puede ser necesario diluir la muestra o disminuir la longitud de la ruta en algunas áreas para evitar la saturación. Los espectros deben escalarse linealmente para tener en cuenta los cambios en la concentración de la muestra o la longitud de la trayectoria y, a continuación, unirse para crear un único espectro que incluya dos regiones de longitud de onda.
Los siguientes protocolos detallarán la preparación y medición espectroscópica desde el VIS hasta el SWIR de cinco ejemplos de absorbentes biológicos: agua (comprende ~ 60% del peso corporal), melanina (absorbente primario para la pigmentación de la piel), aceite de maíz (utilizado como análogo de los lípidos humanos porque tiene baja variabilidad entre lotes, composición química cercana a los lípidos humanos y animales, y dispersión mínima) y hemoglobina oxigenada y desoxigenada (los principales absorbentes de la sangre).
Protocolo
1. Preparación de las muestras
- Preparación de la muestra de agua
- Para preparar la muestra, llene un recipiente limpio con agua ultrapura y fíltrela con un filtro de jeringa de 0,22 μm. Asegúrese de que la salida de la jeringa se dirija a una cubeta de vidrio o cuarzo limpia para tomar medidas de espectroscopia de absorción de la muestra.
- Para preparar la referencia, llene un recipiente limpio con agua deuterada y fíltrela con un filtro de jeringa de 0,22 μm. Asegúrese de que la salida de la jeringa se dirija a una cubeta de vidrio o cuarzo limpio idéntica a la cubeta de muestra para que sirva como referencia.
NOTA: El paso de filtrado minimizará la dispersión óptica de la muestra al filtrar las partículas pequeñas en el agua, que tienen fuertes contribuciones en la región visible.
- Preparación de la muestra de melanina
- Prepare una solución de 1,7 mg/ml de melanina añadiendo melanina en polvo a un tubo de centrífuga lleno de 3,5 ml de dimetilsulfóxido (DMSO). Para empezar, las mediciones deben comenzar en las longitudes de onda con la absorción esperada más baja, donde se requiere la mayor concentración de melanina. Comience las mediciones de melanina con aproximadamente 1,7 mg/mL para el SWIR y dilúyalo con DMSO posteriormente hasta una dilución de 10x (aproximadamente 0,17 mg/mL) para las regiones VIS/NIR.
- Sonicar el tubo durante 10 minutos para asegurarse de que la melanina en polvo se disuelva en el DMSO y transfiera la solución a una cubeta limpia de vidrio o cuarzo para las mediciones espectroscópicas.
- Permanezca dentro del rango de absorbancia lineal del espectrómetro y garantice mediciones de SNR altas cambiando la concentración y/o la longitud del camino (por ejemplo, cambiando de una longitud de paso corta (1 o 2 mm) a una cubeta de 10 mm de longitud de paso). La absorción de melanina tiene una amplia gama que abarca desde VIS hasta SWIR. Para el VIS, utilice la cubeta de melanina de menor concentración y/o longitud de vía debido a su alto coeficiente de extinción molar; para el SWIR, utilice la concentración más alta de melanina y/o cubeta de longitud de vía para obtener una medición espectroscópica cualitativamente limpia.
- Preparación de la muestra de aceite de maíz
- Agregue aceite de maíz a una cubeta limpia de vidrio o cuarzo para mediciones espectroscópicas.
- Utiliza el aire libre como referencia. No se utilizará ninguna cubeta o solución como referencia.
- Preparación de una muestra de hemoglobina oxigenada con sangre humana heparinizada entera
NOTA: Se compró sangre humana heparinizada entera y se recolectó en centros de recolección autorizados por la FDA ubicados en los Estados Unidos.- Para aislar la hemoglobina de los glóbulos rojos (RBC) y eliminar la mayor cantidad de agua posible de la sangre, primero pipetee 1.800 μL de sangre humana heparinizada entera en tubos de microcentrífuga y centrifugue a 9,6 × g durante 10 min.
NOTA: Se recomiendan aproximadamente 4-6 tubos de microcentrífuga - Después de la centrifugación, retire los tubos de la microcentrífuga, luego retire y deseche el sobrenadante (será de aproximadamente 850 μL) de la muestra de sangre centrifugada sin alterar el gránulo (Figura 2). El sobrenadante comprende el líquido (principalmente plasma y plaquetas) por encima de la gránula de glóbulos rojos. Busque la bolita de glóbulos rojos en la parte inferior del tubo de microcentrífuga.
- Reconstituya cada pellet con el mismo volumen de agua deuterada que el volumen de sobrenadante que se desechó. Vuelva a centrifugar a 9,6 × g durante 10 min.
- Retire los tubos de la centrífuga y luego deseche el sobrenadante sin alterar el pellet.
- Reconstituya el pellet con el mismo volumen de agua deuterada que el volumen de sobrenadante que se desechó. Vuelva a centrifugar a 9,6 × g durante 10 min.
- Retire los tubos de la centrífuga, luego retire el sobrenadante con una pipeta y deséchelo.
- Lisación de glóbulos rojos (RBC): Reconstituya los gránulos de RBC con un gran volumen (4,5 mL) de agua deuterada, lo que provocará un estallido hipotónico. Si el pellet se pega al tubo, enjuáguelo con un poco de los 4,5 mL de agua deuterada medidos para aflojarlo.
NOTA: El volumen de sobrenadante aumentará después de cada paso de centrifugación. Este volumen de sobrenadante puede oscilar entre 800 μL y 1.600 μL. El volumen de agua deuterada para lisis puede cambiar dependiendo de la concentración de muestra deseada, pero debe ser lo suficientemente alto como para causar un estallido hipotónico. - Retire la solución de sangre lisada del tubo con una aguja y una jeringa; Luego, retire con cuidado la aguja de la jeringa de punta roma y deséchela en un recipiente para objetos punzocortantes de riesgo biológico. Conecte la jeringa a un filtro de jeringa de 0,22 μm y empuje el contenido de la jeringa a través del filtro hacia una cubeta de vidrio o cuarzo de 3,5 ml de longitud de 10 mm.
NOTA: El paso de filtrado minimizará la dispersión óptica de la muestra al filtrar los orgánulos celulares y las membranas de la solución. Si la muestra está muy concentrada y el filtro de la jeringa se vuelve difícil de empujar, use varios filtros de jeringa. - Asegure la cubeta con un tapón hermético sobre la cubeta para evitar que el vapor de agua del aire contamine la muestra. Parafilm el exterior del tapón para evitar aún más la contaminación y garantizar un sellado hermético.
NOTA: Para mediciones de 600 nm a 1.600 nm, aproximadamente 1.200-1.600 μL de pellet disuelto en 4,5 mL de agua deuterada darán mediciones cualitativamente limpias.
NOTA: Para regiones espectrales con alta absorbancia esperada (400 nm a 600 nm), las muestras deberán diluirse con agua deuterada para obtener valores de absorbancia no saturada y garantizar que los valores de absorbancia estén dentro del rango lineal del detector. Además, las muestras y la referencia deben colocarse en cubetas de longitud corta (1 o 2 mm). Para los espectros que se muestran en este documento, las muestras se diluyeron 10 veces para 400-500 nm y 5 veces para 500-600 nm y se midieron en cubetas de 2 mm de longitud de paso.
La longitud de paso más corta (1 o 2 mm) permitirá una menor absorción de luz en longitudes de onda altamente absorbentes, lo que ayuda a garantizar que algunos fotones se transmitan al detector y permanezcan dentro del rango de detección lineal. - Obtenga una cubeta limpia con la misma longitud de paso y volumen que la cubeta de muestra que contiene la solución de sangre filtrada y llénela con agua deuterada para las mediciones de referencia y de referencia. Si cambia las longitudes de las trayectorias de las cubetas para diferentes rangos espectrales, registre un nuevo espectro de referencia para cada longitud de las trayectorias de la cubeta.
- Para aislar la hemoglobina de los glóbulos rojos (RBC) y eliminar la mayor cantidad de agua posible de la sangre, primero pipetee 1.800 μL de sangre humana heparinizada entera en tubos de microcentrífuga y centrifugue a 9,6 × g durante 10 min.
- Preparación de una muestra de hemoglobina desoxigenada con sangre humana heparinizada entera
- Siga los pasos 1.4.1-1.4.8.
- Agregue ditionito de sodio a la solución sanguínea en la cubeta y revuelva suavemente. Asegure la cubeta con un tapón hermético sobre la cubeta para evitar que el vapor de agua del aire contamine la muestra. Parafilm el exterior del tapón para evitar aún más la contaminación y garantizar un sellado hermético. Incline con cuidado la cubeta de lado a lado para asegurarse de que el ditionito de sodio se disuelva en la solución; La solución sanguínea cambiará de un color rojo a un color rojo púrpura más oscuro.
NOTA: Para desoxigenar completamente la hemoglobina, la masa de ditionito de sodio que se requiere es de aproximadamente 0,007 g por ml de solución sanguínea. Según Briley-Sӕbø y Bjørnerud, se necesitan al menos 2,5 mg de ditionita de sodio/g de sangre para desoxigenar completamente la sangre entera18. Sin embargo, se encontró que esta concentración era insuficiente en los estudios aquí. Se encontró que una concentración de aproximadamente 3,4 mg/g de sangre total desoxigenaba completamente la solución sanguínea sin la introducción de dispersión óptica. Para mediciones de 400 a 600 nm, la solución sanguínea deberá diluirse con agua deuterada. Calcule la masa de ditionito de sodio requerida en función del volumen de la solución de bood utilizada y no del volumen después de la dilución. Para mediciones de 600 nm a 1.600 nm, aproximadamente 1.200-1.600 μL de pellet disuelto en 4,5 mL de agua deuterada darán mediciones de SNR altas.
Una cubeta de longitud de paso más corta (1 o 2 mm) permitirá una menor absorción de luz en longitudes de onda altamente absorbentes, lo que ayuda a garantizar que algunos fotones se transmitan al detector y permanezcan dentro del rango de detección lineal. - Llene otra cubeta con la misma longitud de paso que la cubeta con solución de sangre filtrada con agua deuterada para las mediciones de referencia y de referencia. Si cambia las longitudes de las trayectorias de las cubetas para diferentes rangos espectrales, registre un nuevo espectro de referencia para cada longitud de las trayectorias de la cubeta.
2. Obtención de mediciones de absorción de alta calidad
- Prepare las muestras y la referencia como se describe en la sección 1 y colóquelas en cubetas de vidrio o cuarzo para mediciones VIS NIR-SWIR. Encienda la lámpara del espectrómetro y los detectores y deje que el sistema se caliente durante al menos 5-20 minutos, dependiendo del sistema del espectrómetro y de la fuente de luz.
NOTA: Cinco minutos proporcionaron suficiente enfriamiento del detector y estabilidad de salida de la lámpara para los espectros recopilados en este documento, pero esto debe caracterizarse para cada sistema antes de la captura de las mediciones de absorbancia.
Mantenga la muestra y la referencia a mano durante este período de recolección. Asegúrese de que las tapas de las cubetas estén seguras. Mantenga el espacio de medición lo más oscuro posible para evitar la distorsión de las mediciones de absorción por la luz ambiental. - Repita los siguientes pasos para diferentes regiones del espectro debido a la amplia variación en la absorción a través del VIS-SWIR.
- Si utiliza una configuración de doble haz (dos detectores separados para la muestra y la referencia), asegúrese de que el sistema esté en la línea de base. Adquiera la línea de base colocando muestras de referencia idénticas que contengan el disolvente frente a cada detector y recopile una medición de absorbancia utilizando los parámetros de adquisición exactos que se utilizarán para la recopilación del espectro de absorbancia de la muestra. Si bien los detectores deberían mostrar teóricamente una absorción cero, por lo general no es perfecto. Reste el espectro de absorbancia resultante de todos los espectros de absorbancia de muestra que se adquieran utilizando los mismos ajustes.
NOTA: La línea de base debe repetirse cada vez que se cambie la configuración de adquisición para la recopilación de datos. - Coloque la muestra en el espectrómetro y elija el detector que sea relevante para la región que se va a medir (VIS-NIR = silicio o UV-VIS PMT, SWIR = InGaAs) y vea la absorbancia en modo en vivo, en el que la medición se actualiza continuamente a medida que se ajustan los parámetros de medición.
- Comenzando con los parámetros predeterminados del espectrómetro, ajuste la potencia de la luz incidente y el tiempo de exposición hasta obtener un espectro de absorción cualitativamente limpio sin saturación.
- Si el ajuste de los parámetros no da como resultado espectros cualitativamente limpios, modifique parámetros como la potencia de la luz incidente, el tiempo de exposición, la longitud de la trayectoria y la concentración de la muestra. Primero, intente ajustar la potencia y el tiempo de exposición. Si el ajuste de estos parámetros no da como resultado un espectro SNR alto, cambie la concentración de la muestra o la longitud de la ruta de la muestra y la referencia.
NOTA: Los parámetros predeterminados utilizados en la recopilación de los espectros que se muestran en este documento fueron una potencia de luz incidente de 15 nW a 400 nm y 20 nW a 1.000 nm, un tiempo de exposición de 30 ms, una longitud de paso de la cubeta de 10 mm y concentraciones específicas de la muestra: 100% agua, melanina 1,7 mg/mL, 100% aceite de maíz, hemoglobina oxigenada (15,9 g/dL), y hemoglobina desoxigenada (15,9 g/dL). - Para aumentar la SNR, aumente el número de lecturas de datos promediadas por punto de datos. Cuanto mayor sea el número de lecturas de datos promediadas, mayor será el tiempo por medición.
- Para aumentar la resolución espectral, reduzca el tamaño del paso (nm) de la medición hasta el límite de resolución del espectrómetro. Esto aumentará el tiempo por medición. Además, reduzca elancho de banda de la potencia de la luz incidente a 1/10 del ancho total del pico más estrecho a la mitad de19 como máximo.
- Una vez que los ajustes de medición estén optimizados para la muestra, documente los ajustes para cada espectro adquirido.
- Para obtener un espectro, utilice la configuración optimizada para tomar una medida de la referencia únicamente. A continuación, sustituya la cubeta de referencia por la cubeta de muestra y realice otra medición. Asegúrese de guardar las mediciones de referencia y de muestra por separado.
NOTA: Es imperativo que la medición de referencia no sature. Si es así, reduzca la potencia de la luz incidente y/o el tiempo de exposición hasta que no haya saturación. Mantenga todos los parámetros del sistema iguales entre las mediciones de referencia y de muestra; Si es necesario cambiar uno, también será necesario repetir el otro para que coincida. - Para cada conjunto emparejado de mediciones de referencia y muestra, calcule la absorbancia A (Ec 1) tratando la medición de referencia como Io y la medición de la muestra como I.
- Para unir diferentes regiones que requerían diferencias en la concentración de la muestra o la longitud de la trayectoria, aplique un factor de multiplicación a una de las regiones espectrales. Por ejemplo, para una primera región que tenía 1/10 de la concentración y una longitud de camino idéntica a la de una segunda región, multiplique la primera región espectral por 10 para escalar adecuadamente las dos regiones juntas.
NOTA: El factor de multiplicación debe ser la diferencia de concentración y/o longitud de camino entre las regiones. - Una vez que se hayan corregido los espectros para las diferencias en la longitud de ruta o la concentración, elija una longitud de onda superpuesta en las dos regiones espectrales para unir las dos regiones.
- Trunque los dos espectros para que terminen en la longitud de onda de superposición; Elija un espectro para incluir su valor espectral de transición. Concatene los dos espectros truncados para crear un único espectro resultante de un rango de longitud de onda más amplio.
- Si el ajuste de los parámetros no da como resultado espectros cualitativamente limpios, modifique parámetros como la potencia de la luz incidente, el tiempo de exposición, la longitud de la trayectoria y la concentración de la muestra. Primero, intente ajustar la potencia y el tiempo de exposición. Si el ajuste de estos parámetros no da como resultado un espectro SNR alto, cambie la concentración de la muestra o la longitud de la ruta de la muestra y la referencia.
- Si utiliza una configuración de doble haz (dos detectores separados para la muestra y la referencia), asegúrese de que el sistema esté en la línea de base. Adquiera la línea de base colocando muestras de referencia idénticas que contengan el disolvente frente a cada detector y recopile una medición de absorbancia utilizando los parámetros de adquisición exactos que se utilizarán para la recopilación del espectro de absorbancia de la muestra. Si bien los detectores deberían mostrar teóricamente una absorción cero, por lo general no es perfecto. Reste el espectro de absorbancia resultante de todos los espectros de absorbancia de muestra que se adquieran utilizando los mismos ajustes.
Resultados
Los datos están disponibles a través del Repositorio de Materiales de Investigación Digital (DRMR) de WUSTL doi: https://doi.org/10.7936/6RXS-108249
Caracterización espectral del agua
El agua, uno de los absorbentes biológicos más comunes, tiene picos característicos y altamente absorbentes en el NIR y el SWIR. Estos picos característicos son tan fuertes que al medir la absorbancia del agua, a menudo debe diluirse con agua deuterada para evitar la saturación. La diferencia en la absorbancia entre el agua y el agua deuterada se muestra en la Figura 3, destacando un aumento de más de un orden de magnitud en la absorbancia del agua sobre el agua deuterada. La fuerte absorción de agua en el SWIR también dificulta la obtención de los espectros de absorción de otros absorbentes biológicos que contienen agua en la muestra o que utilizan agua como disolvente y referencia. Como solución a este problema, se puede utilizar agua deuterada en lugar de agua. El agua deuterada actúa de manera similar al agua, aunque es un absorbente SWIR mucho más débil, lo que la convierte en un reemplazo ideal para el agua en las mediciones de espectroscopia SWIR.
Para medir el espectro de absorción del agua, se utilizó agua como muestra y agua deuterada como referencia. Para evitar la saturación en el SWIR, la muestra se diluyó con agua deuterada en la región SWIR. El espectro de absorción de agua resultante muestra una baja absorción en el VIS, que aumenta a longitudes de onda más largas. Los picos de absorción característicos se pueden ver aproximadamente a 750 nm, 970 nm, 1.200 nm y 1.450 nm (Figura 4). El espectro de agua resultante tiene una SNR de 3536.6 y se comparó con el espectro de absorción de agua20 de Hale y Querry, mostrando una curva de absorción similar de ~500 nm a 1,600 nm. Sin embargo, de 400 a 500 nm, las curvas de absorción difieren, con Hale y Querry mostrando un valor de absorbancia más alto a longitudes de onda más bajas. Esta diferencia podría deberse a pequeñas partículas residuales en el agua que tendrán una mayor dispersión en longitudes de onda más cortas en comparación con longitudes de onda más largas3 y puede invalidar las suposiciones de que no hay dispersión en las mediciones de absorción basadas en la ley de Beer-Lambert.
Caracterización espectral de la melanina
La melanina, el principal absorbente óptico de la piel, se caracterizó espectralmente utilizando melanina en polvo como muestra y DMSO como disolvente y referencia. El espectro resultante tiene una SNR de 172 y se comparó con los datos de eumelanina de Sarna et al.21,22 y Crippa et al.23 (Figura 5). La eumelanina es el pigmento principal responsable del color de la piel y, por lo tanto, proporciona los datos más precisos sobre cómo la melanina afectará a los dispositivos ópticos. El espectro recolectado mediante el protocolo descrito en este trabajo muestra una alta correlación con estos valores de la literatura.
Caracterización espectral del aceite de maíz
Para investigar el espectro de absorción de un lípido, se eligió el aceite de maíz debido a su mínima dispersión óptica en comparación con otros lípidos y su conocida similitud en la composición química con las grasas animales1. Para tomar el espectro de absorción del aceite de maíz, se utilizó aceite de maíz como muestra con aire como referencia. Como se ve en la Figura 6, el espectro del aceite de maíz contiene picos característicos a aproximadamente 930 nm, 1.210 nm y 1.410 nm. El espectro de aceite de maíz resultante tiene un SNR de 10363.1 y se superpuso con el espectro de aceite de maíz1 de Cao et al., mostrando una fuerte correlación.
Caracterización espectral de hemoglobina oxigenada y desoxigenada
Si bien la caracterización de la absorción de hemoglobina oxigenada y desoxigenada es una de las hazañas más importantes en óptica biomédica, sus espectros de absorción que abarcan desde el VIS hasta el SWIR siguen siendo poco conocidos. Uno de los aspectos más desafiantes para determinar el espectro de absorción de hemoglobina oxigenada y desoxigenada en el SWIR es la eliminación del agua en la sangre, lo que abruma la absorción de hemoglobina relativamente pequeña. Para desenredar la absorbancia de la hemoglobina y el agua, primero se aisló la hemoglobina de la sangre entera humana mediante centrifugación y se eliminó el sobrenadante y se reemplazó con agua deuterada. También se utilizó como referencia el agua deuterada y el disolvente en el que se reconstituyó la hemoglobina para provocar el estallido hipotónico. Como se muestra en la Figura 3, el agua deuterada tiene una absorción óptica mucho menor que el agua, lo que la convierte en un solvente ideal y una referencia para las mediciones de absorción SWIR. El espectro de hemoglobina oxigenada resultante abarca desde el VIS hasta el SWIR con una SNR de 23118.7 y coincide muy estrechamente conel espectro de hemoglobina oxigenada 4 publicado por Prahl (Figura 7). En el VIS, el espectro de hemoglobina oxigenada muestra una alta absorción con picos de absorción característicos de aproximadamente 415 nm y un pico doblete de aproximadamente 540 a 575 nm. En el NIR, el espectro de la hemoglobina oxigenada muestra un pico característico que abarca un rango más amplio de longitudes de onda, aproximadamente de 800 nm a 1.100 nm. En el SWIR, la absorción de hemoglobina es baja. Sin embargo, desde aproximadamente 1.400 nm a 1.600 nm, el espectro de la hemoglobina muestra una mayor absorción con picos, probablemente debido al agua en la hemoglobina que no pudo eliminarse por completo durante el proceso de centrifugación.
Para la hemoglobina desoxigenada, se agregó ditionito de sodio a la solución de hemoglobina para introducir la disociación del dioxígeno de la hemoglobina oxigenada y convertir la muestra en hemoglobina desoxigenada. El espectro resultante tiene una SNR de 9813.9 y se comparó con el espectro de hemoglobina desoxigenada de Prahl y muestra una correlación muy fuerte entre 400 nm y 1,000 nm4 (Figura 8). El espectro de hemoglobina desoxigenada resultante muestra picos de absorción característicos a aproximadamente 430 nm, 560 nm y 760 nm. Después de esto, la absorción de hemoglobina desoxigenada disminuye, pero contiene picos de absorción más pequeños alrededor de 1.200 nm y de 1.400 nm a 1.600 nm. Es probable que la absorbancia entre 1.400 y 1.600 nm se deba al agua que no se eliminó completamente de la muestra de hemoglobina durante el proceso de centrifugación.
Comparación de absorbentes biológicos del VIS-SWIR
En la Figura 9 se muestran los espectros VIS-SWIR completos de todos los absorbentes biológicos caracterizados en este protocolo, escalados en función de su concentración biológica en el tejido2, que ponen de manifiesto las distintas diferencias espectrales entre los absorbentes biológicos. Por ejemplo, la melanina, la hemoglobina oxigenada y la hemoglobina desoxigenada tienen una absorción fuerte y característica en el VIS que generalmente disminuye con la longitud de onda, mientras que el agua y los lípidos muestran picos característicos en el NIR y el SWIR. En el tejido biológico, la combinación de disminuciones en la melanina y la hemoglobina, así como disminuciones en la dispersión óptica, proporciona una mayor profundidad de penetración óptica en el NIR y SWIR. Además, la absorción reducida de melanina del NIR y el SWIR permiten la investigación óptica de la hemoglobina, los lípidos y el agua oxigenados y desoxigenados con efectos mínimos debido a la pigmentación de la piel.
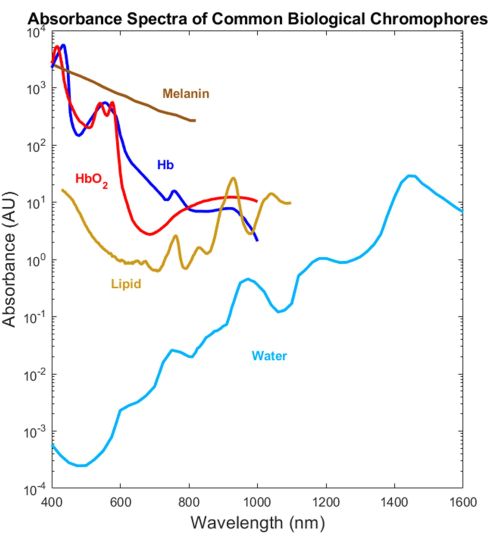
Figura 1: Espectros publicados anteriormente de absorbentes biológicos comunes a través del UV al SWIR. Los espectros de hemoglobina oxigenada y desoxigenada se graficaron utilizando datos de Prahl4. El espectro de melanina se graficó utilizando datos de Sarna21 y Crippa23. El espectro lipídico se trazó utilizando datos de van Veen24. El espectro del agua se trazó utilizando datos de Hale y Querry20. Abreviatura: SWIR = infrarrojo de onda corta. Haga clic aquí para ver una versión más grande de esta figura.
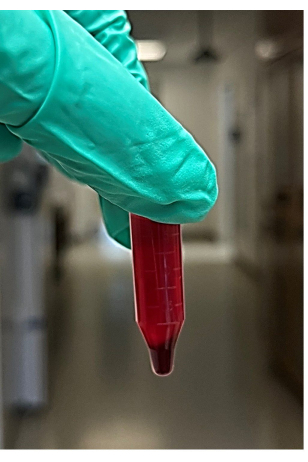
Figura 2: Foto del sobrenadante y la bolita de glóbulos rojos de la sangre entera centrifugada. Haga clic aquí para ver una versión más grande de esta figura.
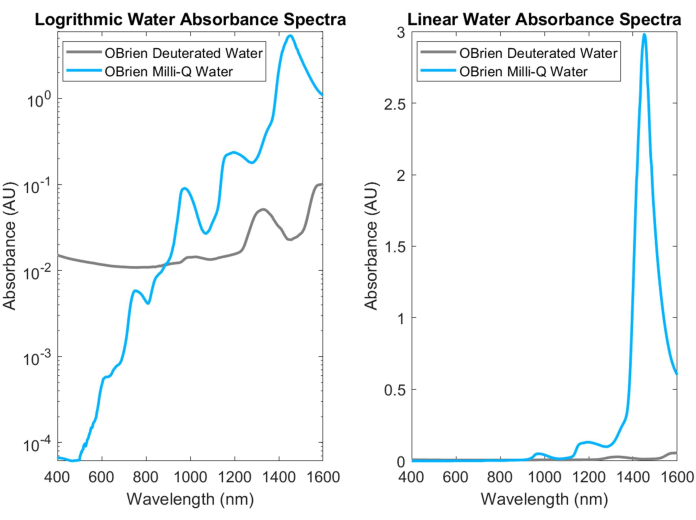
Figura 3: Comparación del espectro de absorbancia de agua y agua deuterada recolectada con configuraciones de adquisición idénticas en escala de absorbancia logarítmica (izquierda) y lineal (derecha). Haga clic aquí para ver una versión más grande de esta figura.
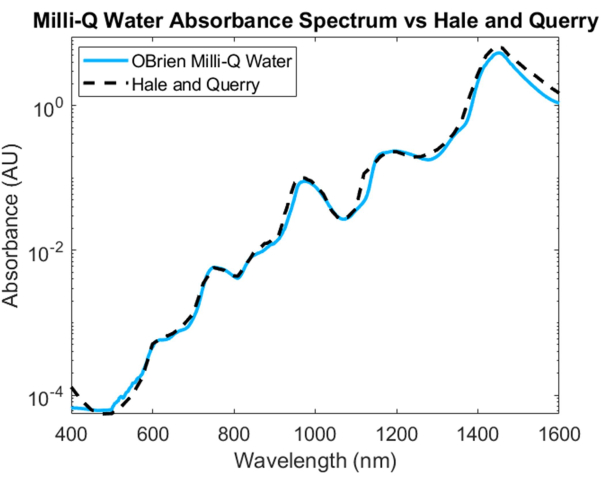
Figura 4: Comparación del espectro de absorbancia de agua adquirido utilizando los métodos descritos en este documento frente a Hale y Querry20. Haga clic aquí para ver una versión más grande de esta figura.
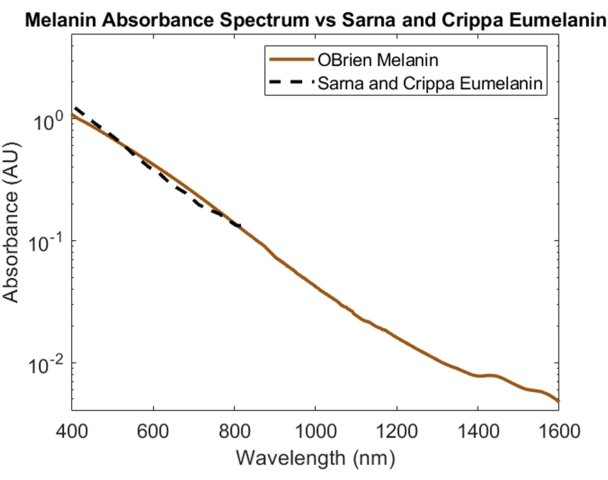
Figura 5: Comparación del espectro de absorbancia de melanina adquirido mediante los métodos aquí descritos frente a Sarna et al.21,22 y Crippa et al.23. Haga clic aquí para ver una versión más grande de esta figura.
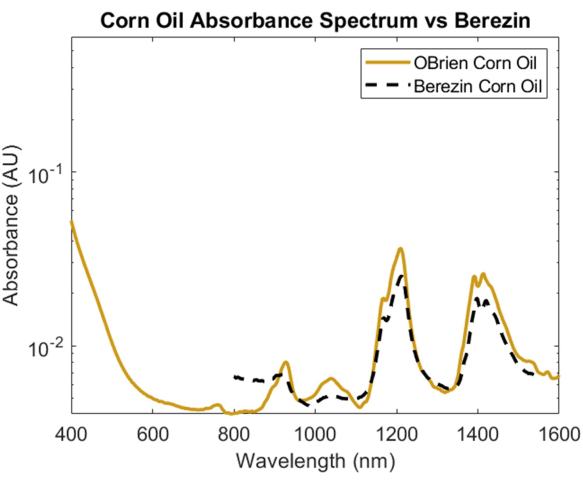
Figura 6: Comparación del espectro de absorbancia del aceite de maíz adquirido utilizando los métodos descritos en este documento frente a Cao et al.1. Haga clic aquí para ver una versión más grande de esta figura.
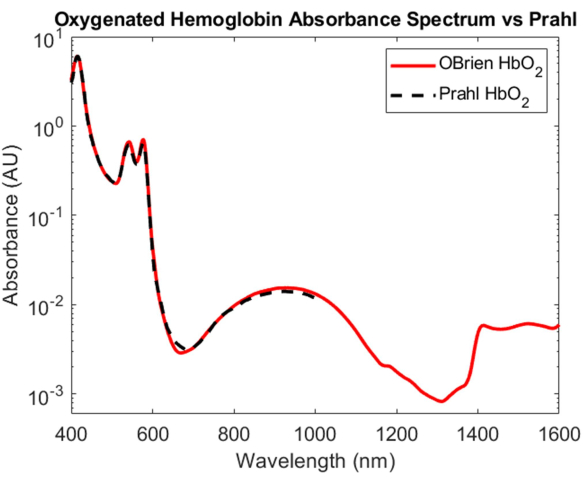
Figura 7: Comparación del espectro de absorbancia de hemoglobina oxigenada adquirido mediante los métodos descritos en este documento frente a Prahl4. Las características espectrales de 1.400 a 1.600 nm probablemente se atribuyen al agua residual en la muestra. Haga clic aquí para ver una versión más grande de esta figura.
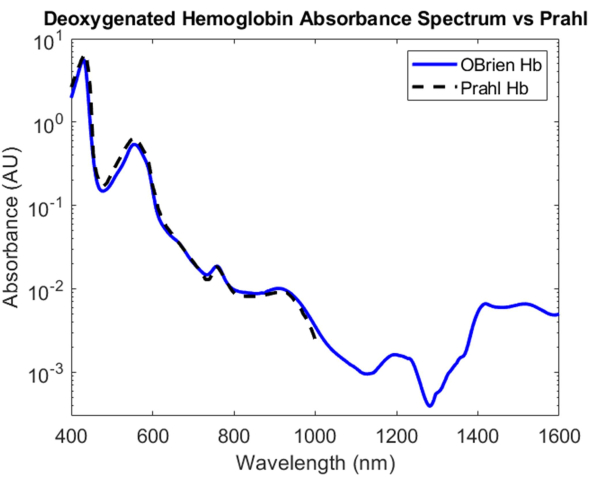
Figura 8: Comparación del espectro de absorbancia de hemoglobina desoxigenada adquirido mediante los métodos descritos en este documento frente a Prahl4. Las características espectrales de 1.400 a 1.600 nm probablemente se atribuyen al agua residual en la muestra. Haga clic aquí para ver una versión más grande de esta figura.
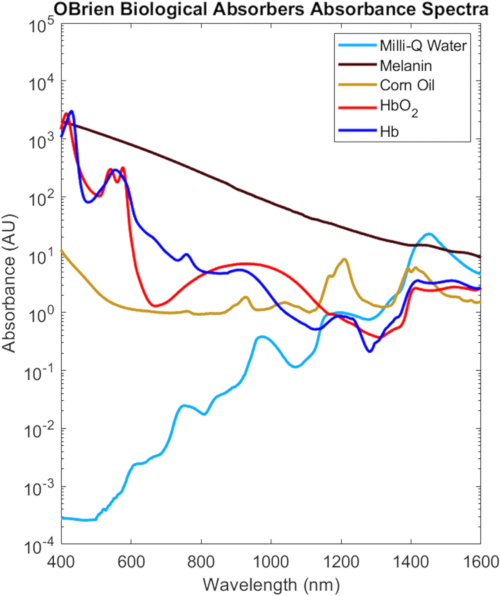
Figura 9: Espectros VIS-SWIR de absorbentes biológicos comunes. Abreviatura: VIS-SWIR = infrarrojo visible de onda corta. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los protocolos descritos en este artículo se pueden utilizar para obtener espectros de absorción VIS-SWIR de absorbentes biológicos y agentes de contraste. En este artículo, mostramos los pasos específicos para obtener espectros de agua, melanina, aceite de maíz, hemoglobina oxigenada y hemoglobina desoxigenada que abarcan desde 400 nm hasta 1.600 nm. La siguiente discusión cubre los pasos críticos, consejos para la optimización de la medición, las limitaciones del método y las aplicaciones de este protocolo dentro de la biomedicina.
Si bien todos los pasos del protocolo son importantes, se deben seguir algunos pasos críticos para obtener espectros precisos con este protocolo. En primer lugar, la muestra no debe dispersarse; Por ejemplo, cuando se obtiene hemoglobina oxigenada y desoxigenada de la sangre, los dispersores de la muestra deben filtrarse (en este caso, se utilizó un filtro de jeringa de 0,22 μm). Al preparar hemoglobina desoxigenada, la cantidad de ditionito de sodio agregada no debe exceder el peso proporcionado, ya que hará que la muestra se vuelva turbia a porcentajes de peso más altos e invalidará los requisitos de la ley de Beer-Lambert.
En segundo lugar, se debe utilizar agua deuterada como disolvente de muestra y referencia para solutos solubles en agua, como la hemoglobina. En el SWIR, la absorción de agua es fuerte y puede enmascarar otros absorbentes. En tercer lugar, las mediciones deben adquirirse dentro del rango lineal del detector, definido como la región en la que un cambio en los fotones que llegan al detector da como resultado un cambio lineal en la señal del detector. Si se produce una absorción mínima, el detector puede registrar una absorbancia de cero, incluso si se produce una absorbancia. Esto ocurre cuando la muestra está demasiado diluida, el tiempo de exposición es demasiado bajo y/o la longitud de la trayectoria de la cubeta es demasiado corta, pero puede remediarse mediante un aumento en la concentración de la muestra, la longitud de la cubeta y/o el tiempo de exposición. Del mismo modo, si se produce una alta absorción, es posible que el detector no registre ningún fotón y produzca una línea plana denominada "saturación" que no es sensible a los cambios en la absorbancia. Esto ocurre cuando la muestra está demasiado concentrada, el tiempo de exposición es demasiado bajo y/o la longitud de la trayectoria es demasiado larga, pero se puede solucionar aumentando la concentración de la muestra, aumentando el tiempo de exposición y/o disminuyendo la longitud de la ruta de la cubeta.
En cuarto lugar, los detectores utilizados deben ser lineales. Si no se sabe con certeza si el detector muestra una respuesta lineal al número de fotones que llegan al detector, se pueden medir varias diluciones de una muestra con los mismos ajustes de adquisición para comprobar si sus valores de absorbancia muestran la tendencia lineal esperada entre la absorbancia y la concentración. Alternativamente, se puede medir una sola muestra y aumentar el tiempo de exposición para probar si hay un aumento lineal en la intensidad del detector. Ambas pruebas deben producir una relación lineal si el usuario está operando dentro de sus límites lineales (véase el tercer punto crítico anterior).
En quinto lugar, para permanecer dentro del rango lineal del detector para todo el rango espectral VIS-SWIR, la concentración de la muestra, el tiempo de exposición del detector y/o la longitud del camino de la cubeta deberán cambiarse para diferentes regiones espectrales con una absorbancia significativamente mayor o menor de la región espectral inicial.
En sexto lugar, los espectros adquiridos utilizando diferentes concentraciones de muestra o longitudes de trayectoria para diferentes regiones espectrales deben unirse mediante un escalado lineal de una región en función de los cambios conocidos en la concentración o la longitud de la trayectoria. Después de escalar, los espectros deben unirse en una longitud de onda superpuesta entre las dos regiones. Si una medición abarcará mediciones de diferentes detectores, debe haber espectros de absorbancia superpuestos que contengan la longitud de onda de transición del detector deseada (800 nm se usa comúnmente cuando se unen regiones UV-VIS y SWIR). Cada espectro se trunca en la longitud de onda de transición del detector y se elige un espectro para incluir su valor de absorbancia de transición original del detector. Luego, los dos espectros truncados se concatenan para crear un solo espectro alargado.
Los consejos adicionales para adquirir espectros de absorción de alta calidad incluyen el uso de un espectro publicado previamente de la muestra de interés, incluso si no cubre todo el rango espectral que se va a medir, para guiar las mediciones. Conociendo a priori el rango de longitudes de onda con la absorbancia más baja, las mediciones se pueden iniciar en esta región con la muestra de mayor concentración y luego ajustar y diluir a partir de ahí. Puede ayudar a informar cuántas regiones separadas deberán medirse en función de la magnitud de los cambios de absorbancia esperados. También puede proporcionar la confianza de que se ha obtenido el espectro esperado si coincide con los espectros publicados, o si no coincide con los espectros publicados, el método de preparación de la muestra se puede volver a examinar junto con los problemas que podrían estar distorsionando el espectro.
Los espectros de absorción pueden requerir posprocesamiento. Por ejemplo, se puede utilizar un filtro de media móvil digital para suavizar las mediciones de absorción y los puntos de error conocido se pueden eliminar con una reparación de conjunto de datos en la que se eliminan los puntos erróneos y se realiza la interpolación entre puntos no erróneos.
Las limitaciones de este método incluyen la inexactitud de las muestras con dispersión óptica, como la sangre entera. Para medir con precisión la hemoglobina, la muestra de sangre se lisa y luego se filtra con una jeringa para eliminar la mayoría de los otros componentes celulares residuales que causan la dispersión óptica. Del mismo modo, este método no se utiliza in vivo debido a la dispersión de los tejidos. Si bien las mediciones de absorbancia basadas en la ley de Beer-Lambert pueden ser tediosas y, a veces, difíciles de realizar, es el método de referencia para las mediciones de absorción óptica pura. Además, algunos solventes hacen que sea particularmente difícil adquirir un espectro de absorbancia pura de ciertos solutos. Por ejemplo, el solvente nativo de la hemoglobina oxigenada y desoxigenada es el agua, pero la absorción del agua es fuerte en el SWIR, dominando la absorción de la hemoglobina oxigenada. Por lo tanto, intentamos eliminar el agua de la sangre a través de la centrifugación repetida, la eliminación del sobrenadante y la reconstitución con agua deuterada que tiene una absorción SWIR más débil. Se sospecha que los espectros de hemoglobina oxigenada y desoxigenada resultantes de sangre humana heparinizada completa contienen una pequeña absorción residual debido a la absorción de agua de aproximadamente 1.300 nm a 1.600 nm, como se ve en la Figura 3. Si bien es probable que no sea un desenredo perfecto del agua de la hemoglobina oxigenada y desoxigenada, observamos una estrecha alineación con los espectros de hemoglobina oxigenada y desoxigenada publicados altamente citados de 400 nm a 1.000 nm y ampliamos el espectro en varios cientos de nanómetros 2,3.
Los protocolos descritos en este documento ayudarán a los investigadores a ampliar las bibliotecas de espectros de absorción para incluir espectros VIS-SWIR de una gran cantidad de componentes biológicos y agentes de contraste. Este conocimiento se puede utilizar para mejorar la comprensión de la biología y la fisiología básicas a través de imágenes biomédicas no invasivas y la detección en longitudes de onda más profundas que la mayoría de los sistemas que operan actualmente. La adición de longitudes de onda SWIR amplía el tipo de componentes tisulares que se pueden monitorear de manera no invasiva y podría informar el desarrollo de nuevos monitoreos y diagnósticos. Además, los dispositivos que operan en los rangos NIR y SWIR deberían ayudar a minimizar el sesgo de pigmentación de la piel que se ha reportado para los dispositivos ópticos que operan en los rangos VIS y NIR y es una estrategia prometedora para crear dispositivos médicos equitativos.
Divulgaciones
Christine O'Brien y Leonid Shmuylovich tienen una participación financiera en Armor Medical Inc. y pueden beneficiarse financieramente si la compañía tiene éxito en la comercialización de sus productos relacionados con esta investigación.
Agradecimientos
Este trabajo cuenta con el apoyo de subvenciones de los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) R00HD103954 y R21EB035823. La investigación reportada en esta publicación fue apoyada por la subvención del Instituto de Ciencias Clínicas y Traslacionales de la Universidad de Washington UL1TR002345 del Centro Nacional para el Avance de las Ciencias Traslacionales (NCATS) de los Institutos Nacionales de Salud (NIH). El contenido es responsabilidad exclusiva de los autores y no representa necesariamente la opinión oficial de los NIH. Los autores desean agradecer la ayuda de los miembros del Laboratorio O'Brien, Michael Vahey y sus miembros de laboratorio, y Huanzhu Jiang.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm diameter syringe Filters | Sigma-Aldrich | SLGPM33RS | |
| 1000 µL Pipette | Millipore Sigma | EP3124000121 | |
| 200 µL Pipette | Millipore Sigma | EP3124000083 | |
| Conical Tubes | Avantor VWR | 21008-089 | |
| Corn Oil | Happy Belly | n/a | 48 Fl Oz |
| Deuterium Oxide | Cambridge Isotope Laboratories | DLM-4-100 | |
| Deuterium Oxide | Sigma-Aldrich | 7789-20-0 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D5879-1L | |
| Disposable 1 mL Syringe | BH Supplies | BH1LL | |
| Disposable Needle | Atshuhut/Amazon | 66941 | |
| Freezer (-80 °C) | Fisher Scientific | IUE386FARK | |
| Glass Beakers | Millipore Sigma | CLS1000PACK | |
| Glass or Quartz Cuvettes | Sigma-Aldrich | Z802875-1EA | 700 µL volume |
| Glass or Quartz Cuvettes | Thorlabs | CV10Q35EP | 3500 mL volume |
| Heparinized Human Blood | Lampire | 7203710 | |
| Microcentrifuge Tubes | Costar | 3213 | |
| Microcentrifuge--accuSpin Micro 17 | Fisher Scientific | 13-100-675 | |
| MilliQ Water | Millipore Sigma | ZMQSP0D01 | |
| OSRAM FCS 64640 150 W 24 V HLX Halogen Light Bulb | Amazon | B0001221DG | |
| Parafilm | Millipore Sigma | HS234526B | |
| Pipette Tips | Eppendorf | 22492055 | |
| Powdered Synthetic Melanin | Sigma-Aldrich | 8049-97-6 | |
| Scale | Sartorius | UX-11976-09 | |
| Sodium Dithionite | Sigma-Aldrich | 1065070500 | |
| Sonicator | Fisher Scientific | CPX1800 | |
| Spatula | Aozita | 000 00 0 1 2 3 | |
| UV/VIS/SWIR Spectrophotometer | On Line Instrument Systems | Olis Cary 14 | |
| Weigh Boats | Amazon | B07M5RMNPF |
Referencias
- Cao, Q., Zhegalova, N. G., Wang, S. T., Akers, W. J., Berezin, M. Y. Multispectral imaging in the extended near-infrared window based on endogenous chromophores. J Biomed Opt. 18 (10), 101318 (2013).
- Yao, J., Wang, L. V. Sensitivity of photoacoustic microscopy. Photoacoustics. 2 (2), 87-101 (2014).
- Jacques, S. L. Optical properties of biological tissues: a review. Phys Med Biol. 58 (11), R37 (2013).
- . Optical absorption of hemoglobin Available from: https://omlc.org/spectra/hemoglobin/ (1999)
- Zhang, H., et al. Penetration depth of photons in biological tissues from hyperspectral imaging in shortwave infrared in transmission and reflection geometries. J Biomed Opt. 21 (12), 126006 (2016).
- Du, T., et al. Hyperspectral imaging and characterization of allergic contact dermatitis in the short-wave infrared. J Biophotonics. 13 (9), e202000040 (2020).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Mueller, G. J. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J Biomed Opt. 4 (1), 36-46 (1999).
- Kuenstner, J. T., Norris, K. H. Spectrophotometry of human hemoglobin in the near infrared region from 1000 to 2500 nm. J Near Infrared Spectrosc. 2 (2), 59-65 (1994).
- Spectral subtraction. Available from: https://www.spectroscopyonline.com/view/spectral-subtraction (2021)
- Sjoding, M. W., Dickson, R. P., Iwashyna, T. J., Gay, S. E., Valley, T. S. Racial bias in pulse oximetry measurement. N Engl J Med. 383 (25), 2477-2478 (2020).
- Fawzy, A., et al. Racial and ethnic discrepancy in pulse oximetry and delayed identification of treatment eligibility among patients with COVID-19. JAMA Intern Med. 182 (7), 730-738 (2022).
- Sudat, S. E. K., et al. Racial disparities in pulse oximeter device inaccuracy and estimated clinical impact on COVID-19 treatment course. Am J Epidemiol. 192 (5), 703-713 (2023).
- Keller, M. D., Harrison-Smith, B., Patil, C., Arefin, M. S. Skin colour affects the accuracy of medical oxygen sensors. Nature. 610 (7932), 449-451 (2022).
- Butler, W. L. Absorption spectroscopy of biological materials. Methods Enzymol. 24, 3-25 (1972).
- Tang, J., et al. Calculation extinction cross sections and molar attenuation coefficient of small gold nanoparticles and experimental observation of their UV-vis spectral properties. Spectrochim Acta A Mol Biomol Spectrosc. 191, 513-520 (2018).
- Rossman, G. R. Optical spectroscopy. Rev Mineral Geochem. 78 (1), 371-398 (2014).
- Thimsen, E., Sadtler, B., Berezin, M. Y. Shortwave-infrared (SWIR) emitters for biological imaging: a review of challenges and opportunities. Nanophotonics. 6 (5), 1043-1054 (2017).
- Briely-Sabo, K., Bjornerud, A. Accurate de-oxygenation of ex-vivo whole blood using sodium dithionite. Proc Intl Sot Mag Reson Med. 8, 2025 (2020).
- Skoog, D. A., Holler, F. J., Crouch, S. R. Principles of instrumental analysis. Cengage Leaning. , (2019).
- Hale, G. M., Querry, M. R. Optical constants of water in the 200-nm to 200-microm wavelength region. Appl Opt. 12 (3), 555-563 (1973).
- Sarna, T., Sealy, R. Photoinduced oxygen consumption in melanin systems. Action spectra and quantum yields for eumelanin and synthetic melanin. Photochem Photobiol. 39 (1), 69-74 (1984).
- Sarna, T., Swartz, H. A., Nordlund, J. J. The physical properties of melanins. The pigmentary system: Physiology and pathophysiology. , 311-341 (2006).
- Crippa, P., Cristofoletti, V., Romeo, N. A band model for melanin deduced from optical absorption and photoconductivity experiments. Biochim Biophys Acta. 538 (1), 164-170 (1978).
- van Veen, R., et al. Determination of visible near-IR absorption coefficients of mammalian fat using time- and spatially resolved diffuse reflectance and transmission spectroscopy. J Biomed Opt. 10 (5), 054004 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados