Method Article
Caratterizzazione degli spettri di assorbimento biologico che vanno dal visibile all'infrarosso a onde corte
In questo articolo
Riepilogo
I campioni biologici hanno caratteristiche ottiche distinte nell'infrarosso a onde corte (SWIR) rispetto alle gamme di lunghezze d'onda del visibile (VIS) e del vicino infrarosso (NIR). Tuttavia, la registrazione degli spettri di assorbimento SWIR puri è impegnativa e raramente condotta per le molecole biologiche. Questo articolo presenta un metodo per caratterizzare gli spettri di assorbimento VIS-SWIR degli assorbitori biologici.
Abstract
Per il monitoraggio fisiologico non invasivo basato sulla luce, le lunghezze d'onda ottimali dei singoli componenti tissutali possono essere identificate utilizzando la spettroscopia di assorbimento. Tuttavia, a causa della mancanza di sensibilità dell'hardware a lunghezze d'onda più lunghe, la spettroscopia di assorbimento è stata tipicamente applicata per lunghezze d'onda nell'intervallo del visibile (VIS) e del vicino infrarosso (NIR) da 400 a 1.000 nm. I progressi hardware nella gamma dell'infrarosso a onde corte (SWIR) hanno permesso ai ricercatori di esplorare lunghezze d'onda comprese tra ~1.000 nm e 3.000 nm in cui scendono picchi di assorbimento caratteristici per lipidi, proteine e acqua. Queste molecole sono difficili da visualizzare nel VIS-NIR e possono fornire fonti di contrasto biologico prive di marcatura. Inoltre, è stato osservato un minore assorbimento di SWIR per la melanina, il cromoforo primario responsabile della pigmentazione cutanea. È stato riscontrato che i dispositivi ottici in vivo, come i pulsossimetri clinicamente standard, hanno una precisione ridotta nelle persone con pelle pigmentata scura, probabilmente a causa del maggiore assorbimento della melanina nell'intervallo VIS. Pertanto, l'errore associato alla pigmentazione della pelle potrebbe essere ridotto utilizzando dispositivi che operano nello SWIR. La progettazione degli strumenti ottici è facilitata dalla comprensione delle proprietà di assorbimento dei componenti tissutali principali dalla gamma VIS alla gamma SWIR. Questo articolo descrive i protocolli e la strumentazione per ottenere spettri di assorbimento VIS-SWIR dei comuni assorbitori tissutali: emoglobina ossigenata, emoglobina deossigenata, melanina, acqua e lipidi.
Introduzione
La maggior parte degli assorbitori biologici è stata caratterizzata otticamente nelle gamme spettrali del visibile (VIS, ~400-700 nm) e del vicino infrarosso (NIR, ~700-1.000 nm), ma non nell'infrarosso a onde corte (SWIR, ~1.000-3.000 nm)1,2,3,4 (Figura 1). Questo nonostante lo SWIR offra una penetrazione della luce più profonda a causa della minore dispersione tissutale e del ridotto assorbimento della melanina, nonché di un ulteriore contrasto biologico senza marcatura per acqua, lipidi e proteine 1,5,6. La mancanza di spettri di assorbimento che coprono il VIS-SWIR ha creato una lacuna nelle conoscenze che impedisce lo sviluppo di dispositivi ottici biomedici che sfruttano questi vantaggi SWIR. Sebbene in passato siano stati presentati diversi tentativi di caratterizzare gli spettri, mancano spettri di assorbimento VIS-SWIR di alta qualità di componenti puri senza artefatti significativi del solvente 1,7,8. Ad esempio, sostanze idrosolubili come l'emoglobina sono state caratterizzate nello SWIR utilizzando l'acqua come solvente e sottraendo l'assorbimento di acqua pura dagli spettri risultanti9. Tuttavia, l'accuratezza di questo approccio non è chiara perché l'acqua è un assorbitore dominante in questa regione.
Lavorare nello SWIR ha l'ulteriore vantaggio di ridurre o eventualmente rimuovere le distorsioni causate da un forte assorbimento di melanina nel VIS quando si utilizza la diagnostica ottica in vivo. Numerosi studi hanno scoperto che i pulsossimetri sovrastimano l'ossigenazione nei pazienti neri e, come tale, i pazienti neri hanno maggiori probabilità di avere livelli di ossigeno pericolosamente bassi che i pulsossimetri non hanno rilevato10. Questo pregiudizio della pigmentazione della pelle ha portato a un trattamento medico ritardato e inadeguato di molti pazienti ipossici neri11,12 e ha spinto all'azione le comunità ottiche e ingegneristiche per migliorare l'accuratezza dei dispositivi ottici per tutte le tonalità della pelle13. Il passaggio dalle lunghezze d'onda VIS ad alto assorbimento di melanina al NIR e allo SWIR è un'entusiasmante innovazione tecnica che potrebbe ridurre le disparità razziali nelle tecnologie ottiche biomediche di importanza critica.
La registrazione degli spettri di assorbimento delle biomolecole è essenziale per comprendere le proprietà ottiche dei campioni di tessuto utilizzati in una varietà di applicazioni ingegneristiche e biomediche14. La spettroscopia di assorbimento misura l'assorbimento della luce specifica della molecola in funzione della lunghezza d'onda. Il metodo gold standard per l'acquisizione di misure di assorbimento in soluzione consiste nel dirigere la luce monocromatica collimata attraverso un campione disciolto e registrare la luce trasmessa con un rivelatore posizionato sul lato opposto del campione rispetto alla sorgente luminosa. L'assorbimento (A) del campione è quindi definito dall'Eq. (1).
A = log10(I0/I) (1)
Dove Io è l'intensità della luce incidente sul campione e I è l'intensità della luce trasmessa attraverso il campione che colpisce il rivelatore. L'Io viene acquisito misurando un riferimento, che è tipicamente il solvente del soluto di interesse, utilizzando le stesse impostazioni di acquisizione dell'I. La spettroscopia di assorbimento fornisce proprietà di assorbimento quantitative ed è governata dalla legge di Beer-Lambert (Eq. 2), che non si applica ai campioni che hanno scattering ottico. Questa equazione afferma che l'assorbimento ottico è determinato dal coefficiente di assorbività molare di un campione (ε, unità L·mol−1·cm−1) alla lunghezza d'onda λ moltiplicato per la sua concentrazione molare (C, unità mol∙L-1) e la lunghezza del percorso (L, unità cm), che è definita come la distanza percorsa attraverso il campione15:
A(λ) = ε(λ)*L*C (2)
È importante sottolineare che il coefficiente di assorbività molare è unico per ciascun assorbitore biologico e indica la forza con cui un campione assorbe la luce a una particolare lunghezza d'onda16.
Quando si effettuano misure di spettroscopia di assorbimento che vanno dal VIS allo SWIR, sono necessarie regolazioni dell'hardware, della preparazione del campione e della post-elaborazione spettrale oltre agli spettri VIS-NIR standard:
Hardware
Le misure VIS-NIR utilizzano tipicamente un rivelatore al silicio o tubi fotomoltiplicatori (PMT) con fotocatodi sensibili ai fotoni UV-VIS, mentre l'assorbanza SWIR richiede un fotorivelatore sensibile ai fotoni SWIR, come un rivelatore di arseniuro di indio gallio (InGaAs)17. I sistemi VIS, NIR e SWIR richiedono in genere elementi di dispersione specifici per lunghezza d'onda, come i reticoli ottici, per la dispersione della luce in questi intervalli ottici. Inoltre, l'assorbimento dello SWIR richiede cuvette di vetro o quarzo, che hanno una trasmissione maggiore rispetto alle cuvette di plastica nello SWIR, rendendole più adatte per gli spettri VIS-SWIR. Dovrebbe essere selezionata una o più sorgenti luminose con un'emissione ampia e relativamente uniforme che copra il VIS-SWIR, come una lampada alogena al tungsteno (utilizzata in questo protocollo). La regolazione della potenza della luce incidente, del tempo di esposizione o della durata per la quale il fotorivelatore è esposto alla luce può aiutare a ottimizzare le misure di assorbanza.
Preparazione del campione
La concentrazione del campione o la lunghezza del percorso della cuvetta altereranno linearmente la quantità di assorbimento che si verifica come descritto sopra nell'Eq (2) e, quindi, entrambe possono essere modificate per ottenere un elevato rapporto segnale/rumore (SNR, qui calcolato come il rapporto tra l'ampiezza del picco divisa per la deviazione standard di una regione detrendata dello spettro, tipicamente SNR > 30 è considerato di alta qualità) in diverse sezioni dello spettro con misure relativamente alte o basse assorbanza. Per ottimizzare le misure SWIR in una soluzione acquosa, l'ossido di deuterio (D2O), noto anche come acqua pesante o acqua deuterata, può essere utilizzato al posto dell'acqua (H2O), perché ha picchi di assorbimento significativamente più bassi nello SWIR1. Ciò consente la caratterizzazione del soluto senza interferenza dell'assorbimento d'acqua dominante nello SWIR.
Post-elaborazione spettrale
La post-elaborazione è necessaria perché gli spettri VIS-SWIR richiedono due rivelatori, uno per il NIR visibile (tipicamente PMT sensibile al silicio o UV-VIS) e uno per lo SWIR (tipicamente InGaAs), e gli spettri devono essere uniti per ottenere uno spettro VIS-SWIR completo. Quando gli spettri attraversano il VIS-SWIR, l'assorbimento può variare in modo significativo a seconda della regione della lunghezza d'onda e potrebbe essere necessario diluire il campione o diminuire la lunghezza del percorso in alcune aree per evitare la saturazione. Gli spettri devono essere scalati linearmente per tenere conto delle variazioni nella concentrazione del campione o nella lunghezza del percorso e quindi cuciti insieme per creare un unico spettro che includa due regioni di lunghezza d'onda.
I seguenti protocolli descriveranno in dettaglio la preparazione e la misurazione spettroscopica dal VIS allo SWIR di cinque esempi di assorbitori biologici: acqua (comprende ~60% del peso corporeo), melanina (assorbitore primario per la pigmentazione della pelle), olio di mais (usato come analogo per i lipidi umani perché ha una bassa variabilità tra i lotti, composizione chimica vicina ai lipidi umani e animali, e dispersione minima) ed emoglobina ossigenata e deossigenata (i principali assorbitori nel sangue).
Protocollo
1. Preparazione dei campioni
- Preparazione del campione d'acqua
- Per preparare il campione, riempire un contenitore pulito con acqua ultrapura e filtrarlo utilizzando un filtro per siringa da 0,22 μm. Assicurarsi che l'uscita della siringa sia diretta verso una cuvetta di vetro o quarzo pulita per effettuare misurazioni della spettroscopia di assorbimento del campione.
- Per preparare il riferimento, riempire un contenitore pulito con acqua deuterata e filtrarlo utilizzando un filtro per siringa da 0,22 μm. Assicurarsi che l'uscita della siringa sia diretta verso una cuvetta di vetro o quarzo pulita identica a quella del campione che funga da riferimento.
NOTA: La fase di filtraggio ridurrà al minimo la dispersione ottica dal campione filtrando le piccole particelle nell'acqua, che hanno un forte contributo nella regione visibile.
- Preparazione del campione di melanina
- Preparare una soluzione di melanina da 1,7 mg/mL aggiungendo melanina in polvere a una provetta da centrifuga riempita con 3,5 mL di dimetilsolfossido (DMSO). Per iniziare, le misurazioni dovrebbero iniziare dalle lunghezze d'onda con il più basso assorbimento previsto, dove è richiesta la massima concentrazione di melanina. Iniziare le misurazioni della melanina con circa 1,7 mg/mL per lo SWIR e diluirlo con DMSO successivamente a una diluizione di 10x (circa 0,17 mg/mL) per le regioni VIS/NIR.
- Sonicare la provetta per 10 minuti per assicurarsi che la melanina in polvere si dissolva nel DMSO e trasferire la soluzione in una cuvetta di vetro o quarzo pulita per le misure spettroscopiche.
- Rimanere all'interno dell'intervallo di assorbanza lineare dello spettrometro e garantire misure SNR elevate modificando la concentrazione e/o la lunghezza del percorso (ad esempio, passando da una cuvetta con percorso corto (1 o 2 mm) a una con percorso di 10 mm). L'assorbimento della melanina ha un'ampia gamma che va dalla VIS alla SWIR. Per il VIS, utilizzare la più bassa concentrazione e/o lunghezza del percorso di melanina a causa del suo alto coefficiente di estinzione molare; per lo SWIR, utilizzare la più alta concentrazione di melanina e/o la cuvetta della lunghezza del percorso per ottenere una misurazione spettroscopica qualitativamente pulita.
- Preparazione del campione di olio di mais
- Aggiungere l'olio di mais a una cuvetta di vetro o quarzo pulita per le misure spettroscopiche.
- Usa l'aria aperta come riferimento. Nessuna cuvetta o soluzione verrà utilizzata come riferimento.
- Preparazione di un campione di emoglobina ossigenata con sangue umano intero eparinizzato
NOTA: Il sangue umano intero eparinizzato è stato acquistato ed è stato raccolto in centri di raccolta autorizzati dalla FDA situati negli Stati Uniti.- Per isolare l'emoglobina dai globuli rossi (RBC) e rimuovere quanta più acqua possibile dal sangue, pipettare prima 1.800 μl di sangue umano intero eparinizzato in provette da microcentrifuga e centrifugare a 9,6 × g per 10 minuti.
NOTA: Si consigliano circa 4-6 provette per microcentrifuga - Dopo la centrifugazione, rimuovere le provette dalla microcentrifuga, quindi rimuovere ed eliminare il surnatante (sarà di circa 850 μl) dal campione di sangue centrifugato senza disturbare il pellet (Figura 2). Il surnatante comprende il liquido (principalmente plasma e piastrine) sopra il pellet dei globuli rossi. Cerca il pellet di globuli rossi sul fondo della provetta della microcentrifuga.
- Ricostituire ogni pellet con lo stesso volume di acqua deuterata del volume di surnatante che è stato scartato. Centrifugare nuovamente a 9,6 × g per 10 min.
- Rimuovere le provette dalla centrifuga, quindi scartare il surnatante senza disturbare il pellet.
- Ricostituire il pellet con lo stesso volume di acqua deuterata del volume di surnatante che è stato scartato. Ricentrifugare a 9,6 × g per 10 min.
- Rimuovere le provette dalla centrifuga, quindi rimuovere il surnatante utilizzando una pipetta ed eliminarlo.
- Globuli rossi lissanti (RBC): ricostituire i pellet di globuli rossi con un grande volume (4,5 ml) di acqua deuterata, che causerà uno scoppio ipotonico. Se il pellet si attacca al tubo, sciacquarlo con un po' dei 4,5 ml misurati di acqua deuterata per allentarlo.
NOTA: Il volume del surnatante aumenterà dopo ogni fase di centrifugazione. Questo volume di surnatante può variare da 800 μl a 1.600 μl. Il volume dell'acqua deuterata per la lisi può variare a seconda della concentrazione del campione desiderata, ma deve essere sufficientemente alto da causare uno scoppio ipotonico. - Rimuovere la soluzione di sangue lisizzato dal tubo con un ago e una siringa; Quindi, rimuovere con cautela l'ago della siringa a punta smussata e gettarlo in un contenitore per oggetti taglienti a rischio biologico. Collegare la siringa a un filtro per siringa da 0,22 μm e spingere il contenuto della siringa attraverso il filtro in una cuvetta di vetro o quarzo da 3,5 mL di lunghezza del percorso di 10 mm.
NOTA: La fase di filtraggio ridurrà al minimo la dispersione ottica dal campione filtrando gli organelli cellulari e le membrane nella soluzione. Se il campione è altamente concentrato e il filtro della siringa diventa difficile da spingere, utilizzare più filtri per siringa. - Fissare la cuvetta con un tappo ermetico sopra la cuvetta per evitare che il vapore acqueo dell'aria contamini il campione. Parafilm all'esterno del tappo per prevenire ulteriormente la contaminazione e garantire una tenuta ermetica.
NOTA: Per misurazioni da 600 nm a 1.600 nm, circa 1.200-1.600 μL di pellet disciolto in 4,5 mL di acqua deuterata forniranno misurazioni qualitativamente pulite.
NOTA: Per le regioni spettrali con un'elevata assorbanza attesa (da 400 nm a 600 nm), i campioni dovranno essere diluiti utilizzando acqua deuterata per ottenere valori di assorbanza non saturi e garantire che i valori di assorbanza rientrino nell'intervallo lineare del rivelatore. Inoltre, i campioni e il riferimento devono essere collocati in cuvette a percorso corto (1 o 2 mm). Per gli spettri qui mostrati, i campioni sono stati diluiti 10 volte per 400-500 nm e 5 volte per 500-600 nm e misurati in cuvette di 2 mm di lunghezza del percorso.
La lunghezza del percorso più corta (1 o 2 mm) consentirà un minore assorbimento della luce in lunghezze d'onda altamente assorbenti, contribuendo a garantire che alcuni fotoni trasmettano attraverso il rivelatore e rimangano all'interno dell'intervallo di rilevamento lineare. - Ottenere una cuvetta pulita con la stessa lunghezza e volume della cuvetta del campione contenente la soluzione di sangue filtrato e riempirla con acqua deuterata per le misurazioni di base e di riferimento. Se si modificano le lunghezze del percorso della cuvetta per intervalli spettrali diversi, registrare un nuovo spettro di riferimento per ciascuna lunghezza del percorso della cuvetta.
- Per isolare l'emoglobina dai globuli rossi (RBC) e rimuovere quanta più acqua possibile dal sangue, pipettare prima 1.800 μl di sangue umano intero eparinizzato in provette da microcentrifuga e centrifugare a 9,6 × g per 10 minuti.
- Preparazione di un campione di emoglobina deossigenata con sangue umano intero eparinizzato
- Segui i passaggi 1.4.1-1.4.8.
- Aggiungere il ditionito di sodio alla soluzione di sangue nella cuvetta e mescolare delicatamente. Fissare la cuvetta con un tappo ermetico sopra la cuvetta per evitare che il vapore acqueo dell'aria contamini il campione. Parafilm all'esterno del tappo per prevenire ulteriormente la contaminazione e garantire una tenuta ermetica. Inclinare con cautela la cuvetta da un lato all'altro per assicurarsi che il ditionito di sodio si dissolva nella soluzione; La soluzione di sangue cambierà da un colore rosso a un colore viola-rosso più scuro.
NOTA: Per deossigenare completamente l'emoglobina, la massa di ditionito di sodio necessaria è di circa 0,007 g per mL di soluzione ematica. Secondo Briley-Sӕbø e Bjørnerud, sono necessari almeno 2,5 mg di ditionito di sodio/g di sangue per deossigenare completamente il sangue intero18. Tuttavia, questa concentrazione è risultata insufficiente negli studi qui presentati. È stato riscontrato che una concentrazione di circa 3,4 mg/g di sangue intero deossigena completamente la soluzione ematica senza l'introduzione di dispersione ottica. Per misurazioni da 400 a 600 nm, la soluzione di sangue dovrà essere diluita con acqua deuterata. Calcolare la massa di ditionito di sodio richiesta in base al volume della soluzione bood utilizzata e non al volume dopo la diluizione. Per misure da 600 nm a 1.600 nm, circa 1.200-1.600 μL di pellet disciolto in 4,5 mL di acqua deuterata forniranno misure SNR elevate.
Una cuvetta con percorso più corto (1 o 2 mm) consentirà un minore assorbimento della luce in lunghezze d'onda altamente assorbenti, contribuendo a garantire che alcuni fotoni trasmettano attraverso il rivelatore e rimangano all'interno dell'intervallo di rilevamento lineare. - Riempire un'altra cuvetta con la stessa lunghezza del percorso della cuvetta con soluzione di sangue filtrato con acqua deuterata per le misurazioni di base e di riferimento. Se si modificano le lunghezze del percorso della cuvetta per intervalli spettrali diversi, registrare un nuovo spettro di riferimento per ciascuna lunghezza del percorso della cuvetta.
2. Ottenere misure di assorbimento di alta qualità
- Preparare i campioni e fare riferimento come descritto nella sezione 1 e metterli in cuvette di vetro o quarzo per le misure VIS NIR-SWIR. Accendere la lampada dello spettrometro e i rivelatori e lasciare che il sistema si riscaldi per almeno 5-20 minuti, a seconda del sistema spettrometrico e della sorgente luminosa.
NOTA: Cinque minuti hanno fornito un raffreddamento del rivelatore e una stabilità dell'uscita della lampada sufficienti per gli spettri qui raccolti, ma questo dovrebbe essere caratterizzato per ciascun sistema prima dell'acquisizione delle misure di assorbanza.
Tenere a portata di mano il campione e il riferimento durante questo periodo di raccolta. Assicurati che i coperchi delle cuvette siano ben saldi. Mantenere lo spazio di misura il più buio possibile per evitare la distorsione delle misure di assorbimento da parte della luce ambientale. - Ripetere i passaggi seguenti per diverse regioni dello spettro a causa dell'ampia varianza nell'assorbimento attraverso il VIS-SWIR.
- Se si utilizza una configurazione a doppio raggio (due rivelatori separati per il campione e il riferimento), assicurarsi che il sistema sia in linea di base. Acquisire la linea di base posizionando campioni di riferimento identici contenenti il solvente davanti a ciascun rivelatore e raccogliere una misura dell'assorbanza utilizzando gli esatti parametri di acquisizione da utilizzare per la raccolta dello spettro di assorbanza del campione. Sebbene i rilevatori dovrebbero teoricamente mostrare un assorbimento zero, di solito non è perfetto. Sottrarre lo spettro di assorbanza risultante da tutti gli spettri di assorbanza del campione acquisiti utilizzando le stesse impostazioni.
NOTA: La linea di base deve essere ripetuta ogni volta che si modificano le impostazioni di acquisizione per la raccolta dei dati. - Posizionare il campione nello spettrometro e scegliere il rivelatore pertinente alla regione da misurare (VIS-NIR = silicio o UV-VIS PMT, SWIR = InGaAs) e visualizzare l'assorbanza in modalità Live, in cui la misurazione si aggiorna continuamente man mano che i parametri di misura vengono regolati.
- Partendo dai parametri predefiniti dello spettrometro, regolare la potenza della luce incidente e il tempo di esposizione fino a ottenere uno spettro di assorbimento qualitativamente pulito senza saturazione.
- Se la regolazione dei parametri non produce spettri qualitativamente puliti, modificare parametri come la potenza della luce incidente, il tempo di esposizione, la lunghezza del percorso e la concentrazione del campione. Innanzitutto, prova a regolare la potenza e il tempo di esposizione. Se la regolazione di questi parametri non produce uno spettro SNR elevato, modificare la concentrazione del campione o la lunghezza del percorso del campione e il riferimento.
NOTA: I parametri predefiniti utilizzati nella raccolta degli spettri mostrati nel presente documento erano la potenza della luce incidente di 15 nW a 400 nm e 20 nW a 1.000 nm, il tempo di esposizione di 30 ms, la lunghezza del percorso della cuvetta di 10 mm e le concentrazioni specifiche del campione: 100% acqua, melanina 1,7 mg/mL, 100% olio di mais, emoglobina ossigenata (15,9 g/dL), ed emoglobina deossigenata (15,9 g/dL). - Per aumentare l'SNR, aumentare il numero di letture di dati in media per punto dati. Maggiore è il numero medio di letture dei dati, maggiore è il tempo per misurazione.
- Per aumentare la risoluzione spettrale, ridurre la dimensione del passo (nm) della misura fino al limite di risoluzione dello spettrometro. Ciò aumenterà il tempo per misurazione. Inoltre, ridurre lalarghezza di banda della potenza della luce incidente a 1/10 della larghezza completa del picco più stretto a metà massimo19.
- Una volta ottimizzate le impostazioni di misura per il campione, documentare le impostazioni per ogni spettro acquisito.
- Per ottenere uno spettro, utilizzare le impostazioni ottimizzate per effettuare una misurazione solo del riferimento. Quindi, sostituire la cuvetta di riferimento con la cuvetta campione ed eseguire un'altra misurazione. Assicurarsi di salvare separatamente sia le misurazioni di riferimento che quelle del campione.
NOTA: È imperativo che la misurazione di riferimento non si saturi. In tal caso, ridurre la potenza della luce incidente e/o il tempo di esposizione fino a quando non c'è saturazione. Mantenere gli stessi parametri del sistema tra le misure di riferimento e quelle del campione; Se uno deve essere modificato, anche l'altro dovrà essere ripetuto per abbinarlo. - Per ogni serie accoppiata di misurazioni di riferimento e campione, calcolare l'assorbanza A (Eq 1) trattando la misura di riferimento come Io e la misurazione del campione come I.
- Per unire diverse regioni che richiedevano differenze nella concentrazione del campione o nella lunghezza del percorso, applicare un fattore di moltiplicazione a una delle regioni spettrali. Ad esempio, per una prima regione che aveva 1/10 della concentrazione e una lunghezza del percorso identica a quella di una seconda regione, moltiplicare la prima regione spettrale per 10 per scalare in modo appropriato le due regioni.
NOTA: Il fattore di moltiplicazione dovrebbe essere la differenza di concentrazione e/o lunghezza del percorso tra le regioni. - Una volta che gli spettri sono stati corretti per le differenze nella lunghezza del percorso o nella concentrazione, scegliere una lunghezza d'onda sovrapposta nelle due regioni spettrali per unire le due regioni.
- Troncare i due spettri in modo che terminino alla lunghezza d'onda di sovrapposizione; Scegli uno spettro per includere il suo valore spettrale di transizione. Concatena i due spettri troncati per creare un unico spettro risultante di una gamma di lunghezze d'onda più ampia.
- Se la regolazione dei parametri non produce spettri qualitativamente puliti, modificare parametri come la potenza della luce incidente, il tempo di esposizione, la lunghezza del percorso e la concentrazione del campione. Innanzitutto, prova a regolare la potenza e il tempo di esposizione. Se la regolazione di questi parametri non produce uno spettro SNR elevato, modificare la concentrazione del campione o la lunghezza del percorso del campione e il riferimento.
- Se si utilizza una configurazione a doppio raggio (due rivelatori separati per il campione e il riferimento), assicurarsi che il sistema sia in linea di base. Acquisire la linea di base posizionando campioni di riferimento identici contenenti il solvente davanti a ciascun rivelatore e raccogliere una misura dell'assorbanza utilizzando gli esatti parametri di acquisizione da utilizzare per la raccolta dello spettro di assorbanza del campione. Sebbene i rilevatori dovrebbero teoricamente mostrare un assorbimento zero, di solito non è perfetto. Sottrarre lo spettro di assorbanza risultante da tutti gli spettri di assorbanza del campione acquisiti utilizzando le stesse impostazioni.
Risultati
I dati sono disponibili tramite il WUSTL Digital Research Materials Repository (DRMR) doi: https://doi.org/10.7936/6RXS-108249
Caratterizzazione spettrale dell'acqua
L'acqua, uno dei più comuni assorbitori biologici, ha picchi caratteristici e altamente assorbenti nel NIR e nello SWIR. Questi picchi caratteristici sono così forti che quando si misura l'assorbanza dell'acqua, spesso deve essere diluita con acqua deuterata per evitare la saturazione. La differenza di assorbanza tra acqua e acqua deuterata è mostrata nella Figura 3, evidenziando un aumento di oltre un ordine di grandezza dell'assorbanza dell'acqua rispetto all'acqua deuterata. Il forte assorbimento d'acqua nello SWIR rende inoltre difficile ottenere gli spettri di assorbimento di altri assorbitori biologici che contengono acqua nel campione o che utilizzano l'acqua come solvente e riferimento. Come soluzione a questo problema, l'acqua deuterata può essere utilizzata al posto dell'acqua. L'acqua deuterata agisce in modo simile all'acqua pur essendo un assorbitore SWIR molto più debole, il che la rende un sostituto ideale dell'acqua nelle misure di spettroscopia SWIR.
Per misurare lo spettro di assorbimento dell'acqua, l'acqua è stata utilizzata come campione e l'acqua deuterata come riferimento. Per prevenire la saturazione nello SWIR, il campione è stato diluito con acqua deuterata nella regione SWIR. Lo spettro di assorbimento dell'acqua risultante mostra un basso assorbimento nel VIS, che aumenta a lunghezze d'onda più lunghe. I picchi di assorbimento caratteristici possono essere osservati a circa 750 nm, 970 nm, 1.200 nm e 1.450 nm (Figura 4). Lo spettro dell'acqua risultante ha un SNR di 3536,6 ed è stato confrontato con lo spettro di assorbimento dell'acqua20 di Hale e Querry, mostrando una curva di assorbimento simile da ~500 nm a 1.600 nm. Tuttavia, da 400 a 500 nm, le curve di assorbimento differiscono, con Hale e Querry che mostrano un valore di assorbanza più elevato a lunghezze d'onda più basse. Questa differenza potrebbe essere dovuta a piccole particelle residue nell'acqua che avranno una dispersione più elevata a lunghezze d'onda più corte rispetto a lunghezze d'onda più lunghe3 e potrebbero invalidare le ipotesi di assenza di dispersione nelle misure di assorbimento basate sulla legge di Beer-Lambert.
Caratterizzazione spettrale della melanina
La melanina, il principale assorbitore ottico della pelle, è stata caratterizzata spettralmente utilizzando la melanina in polvere come campione e il DMSO come solvente e riferimento. Lo spettro risultante ha un SNR di 172 ed è stato confrontato con i dati sull'eumelanina di Sarna et al.21,22 e Crippa et al.23 (Figura 5). L'eumelanina è il pigmento principale responsabile del colore della pelle e, pertanto, fornisce i dati più accurati su come la melanina influirà sui dispositivi ottici. Lo spettro raccolto utilizzando il protocollo qui descritto mostra un'elevata correlazione con questi valori di letteratura.
Caratterizzazione spettrale dell'olio di mais
Per studiare lo spettro di assorbimento di un lipide, l'olio di mais è stato scelto per la sua minima dispersione ottica rispetto ad altri lipidi e per la sua nota somiglianza nella composizione chimica con i grassi animali1. Per prendere lo spettro di assorbimento dell'olio di mais, l'olio di mais è stato utilizzato come campione con l'aria come riferimento. Come si vede nella Figura 6, lo spettro dell'olio di mais contiene picchi caratteristici a circa 930 nm, 1.210 nm e 1.410 nm. Lo spettro dell'olio di mais risultante ha un SNR di 10363.1 ed è stato sovrapposto allo spettro 1 dell'olio di maisdi Cao et al., mostrando una forte correlazione.
Caratterizzazione spettrale dell'emoglobina ossigenata e deossigenata
Mentre la caratterizzazione dell'assorbimento dell'emoglobina ossigenata e deossigenata è una delle più importanti prodezze nell'ottica biomedica, i loro spettri di assorbimento che vanno dal VIS allo SWIR rimangono poco compresi. Uno degli aspetti più impegnativi della determinazione dello spettro di assorbimento dell'emoglobina ossigenata e deossigenata nello SWIR è la rimozione dell'acqua nel sangue, che travolge l'assorbimento relativamente piccolo dell'emoglobina. Per districare l'assorbanza dell'emoglobina e dell'acqua, l'emoglobina è stata prima isolata dal sangue intero umano mediante centrifugazione e il surnatante è stato rimosso e sostituito con acqua deuterata. L'acqua deuterata è stata anche utilizzata come riferimento e solvente in cui l'emoglobina è stata ricostituita per causare l'esplosione ipotonica. Come mostrato nella Figura 3, l'acqua deuterata ha un assorbimento ottico molto inferiore rispetto all'acqua, il che la rende un solvente ideale e un riferimento per le misure di assorbimento SWIR. Lo spettro dell'emoglobina ossigenata risultante si estende dal VIS allo SWIR con un SNR di 23118.7 e corrisponde molto da vicinoallo spettro dell'emoglobina ossigenata 4 pubblicato da Prahl (Figura 7). Nel VIS, lo spettro dell'emoglobina ossigenata mostra un elevato assorbimento con picchi di assorbimento caratteristici a circa 415 nm e un picco di doppietto da circa 540 a 575 nm. Nel NIR, lo spettro dell'emoglobina ossigenata mostra un picco caratteristico che abbraccia una gamma più ampia di lunghezze d'onda, da circa 800 nm a 1.100 nm. Nella SWIR, l'assorbimento dell'emoglobina è basso. Tuttavia, da circa 1.400 nm a 1.600 nm, lo spettro dell'emoglobina mostra un assorbimento più elevato con picchi, probabilmente a causa dell'acqua nell'emoglobina che non è stata in grado di essere completamente rimossa durante il processo di centrifugazione.
Per l'emoglobina deossigenata, il ditionito di sodio è stato aggiunto alla soluzione di emoglobina per introdurre la dissociazione del diossigeno dall'emoglobina ossigenata e convertire il campione in emoglobina deossigenata. Lo spettro risultante ha un SNR di 9813,9 ed è stato confrontato con lo spettro dell'emoglobina deossigenata di Prahl e mostra una correlazione molto forte tra 400 nm e 1.000 nm4 (Figura 8). Lo spettro dell'emoglobina deossigenata risultante mostra picchi di assorbimento caratteristici a circa 430 nm, 560 nm e 760 nm. Successivamente, l'assorbimento dell'emoglobina deossigenata diminuisce ma contiene picchi di assorbimento più piccoli intorno a 1.200 nm e da 1.400 nm a 1.600 nm. L'assorbanza tra 1.400 e 1.600 nm è probabilmente dovuta all'acqua che non è stata completamente rimossa dal campione di emoglobina durante il processo di centrifugazione.
Confronto tra gli assorbitori biologici del VIS-SWIR
Gli spettri VIS-SWIR completi di tutti gli assorbitori biologici caratterizzati in questo protocollo sono mostrati nella Figura 9, scalati in base alla loro concentrazione biologica nel tessuto2, che evidenziano le distinte differenze spettrali tra gli assorbitori biologici. Ad esempio, la melanina, l'emoglobina ossigenata e l'emoglobina deossigenata hanno un forte assorbimento caratteristico nel VIS che generalmente diminuisce con la lunghezza d'onda, mentre l'acqua e i lipidi mostrano picchi caratteristici nel NIR e nello SWIR. Nei tessuti biologici, la combinazione di diminuzioni di melanina ed emoglobina e diminuzioni della diffusione ottica fornisce una maggiore profondità di penetrazione ottica nel NIR e nello SWIR. Inoltre, il ridotto assorbimento di melanina di NIR e SWIR consente l'indagine ottica dell'emoglobina, dei lipidi e dell'acqua ossigenati e deossigenati con effetti minimi dovuti alla pigmentazione della pelle.
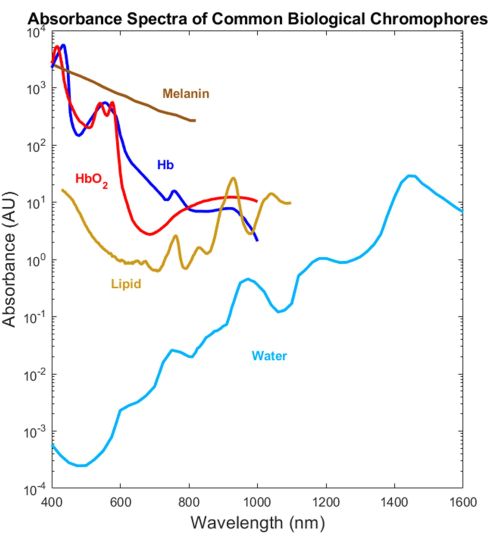
Figura 1: Spettri precedentemente pubblicati di assorbitori biologici comuni attraverso l'UV fino allo SWIR. Gli spettri dell'emoglobina ossigenata e deossigenata sono stati tracciati utilizzando i dati di Prahl4. Lo spettro della melanina è stato tracciato utilizzando i dati di Sarna21 e Crippa23. Lo spettro lipidico è stato tracciato utilizzando i dati di van Veen24. Lo spettro dell'acqua è stato tracciato utilizzando i dati di Hale e Querry20. Abbreviazione: SWIR = infrarosso a onde corte. Clicca qui per visualizzare una versione più grande di questa figura.
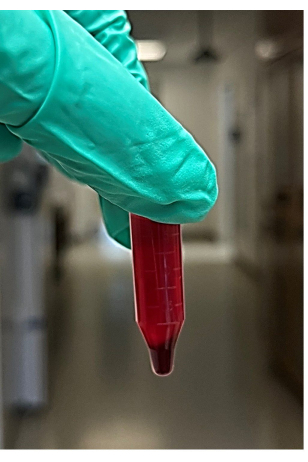
Figura 2: Foto del surnatante e del pellet di globuli rossi da sangue intero centrifugato. Clicca qui per visualizzare una versione più grande di questa figura.
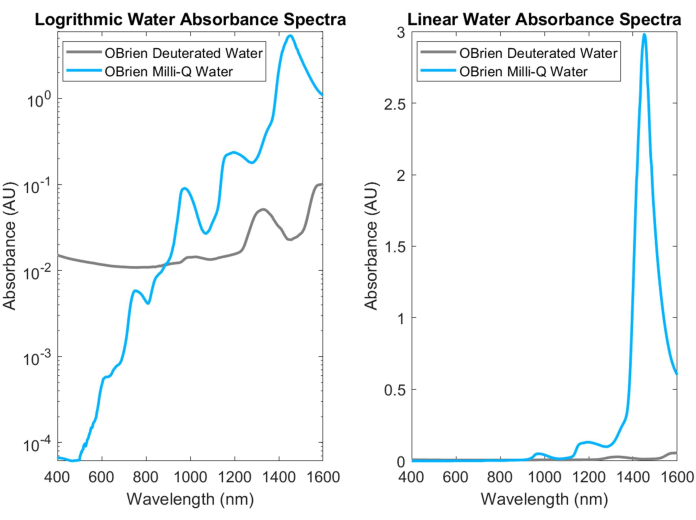
Figura 3: Confronto dello spettro di assorbanza dell'acqua e dell'acqua deuterata raccolte con impostazioni di acquisizione identiche nella scala di assorbanza logaritmica (a sinistra) e lineare (a destra). Clicca qui per visualizzare una versione più grande di questa figura.
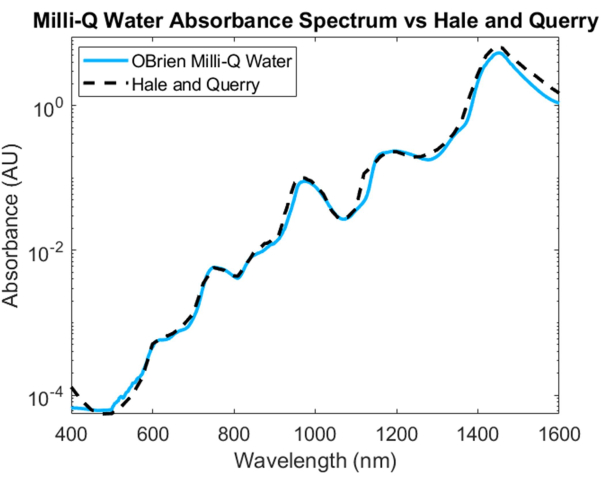
Figura 4: Confronto dello spettro di assorbanza dell'acqua acquisito utilizzando i metodi descritti nel presente documento rispetto a Hale e Querry20. Fare clic qui per visualizzare una versione più ampia di questa figura.
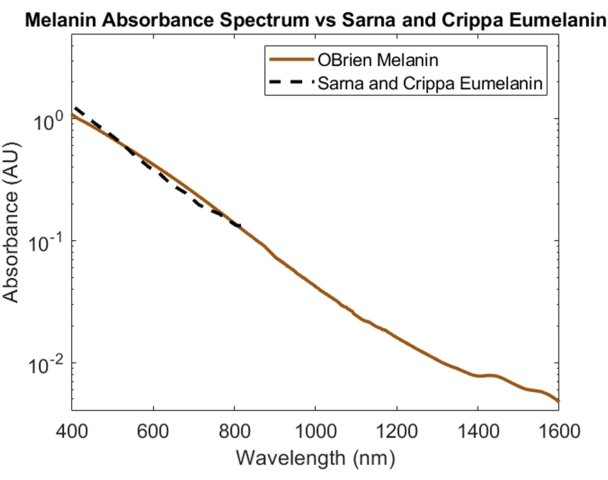
Figura 5: Confronto dello spettro di assorbanza della melanina acquisito utilizzando i metodi qui descritti rispetto a Sarna et al.21,22 e Crippa et al.23. Clicca qui per visualizzare una versione più grande di questa figura.
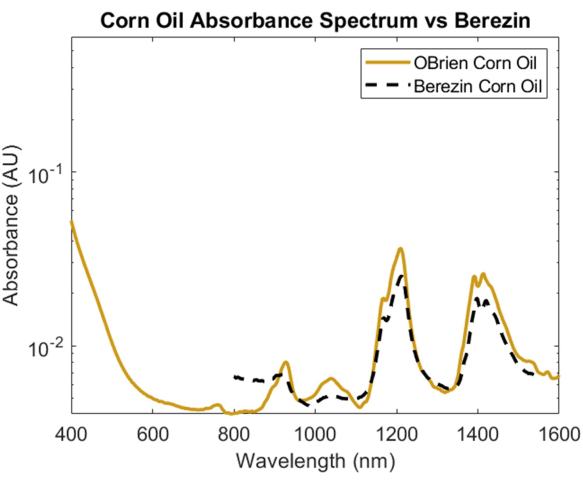
Figura 6: Confronto tra lo spettro di assorbanza dell'olio di mais acquisito utilizzando i metodi qui descritti rispetto a Cao et al.1. Fare clic qui per visualizzare una versione più ampia di questa figura.
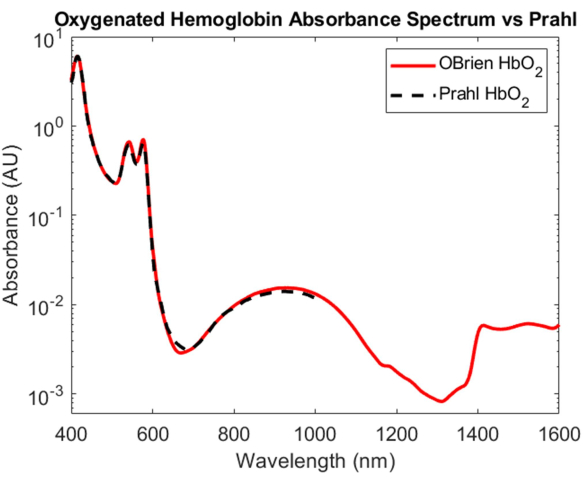
Figura 7: Confronto dello spettro di assorbanza dell'emoglobina ossigenata acquisito utilizzando i metodi qui descritti rispetto a Prahl4. Caratteristiche spettrali da 1.400 a 1.600 nm probabilmente attribuite all'acqua residua nel campione. Clicca qui per visualizzare una versione più grande di questa figura.
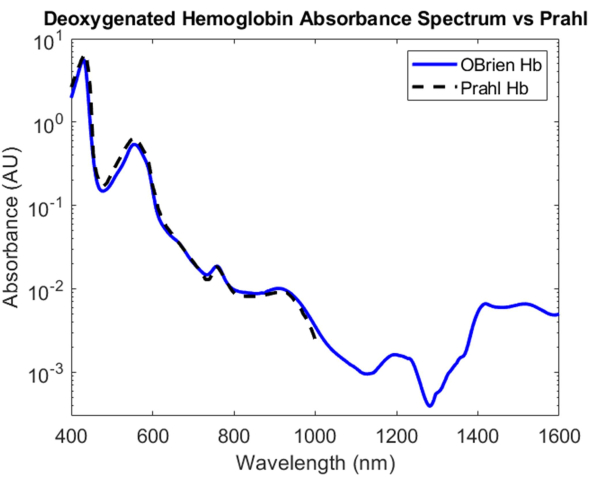
Figura 8: Confronto dello spettro di assorbanza dell'emoglobina deossigenata acquisito utilizzando i metodi qui descritti rispetto a Prahl4. Caratteristiche spettrali da 1.400 a 1.600 nm probabilmente attribuite all'acqua residua nel campione. Clicca qui per visualizzare una versione più grande di questa figura.
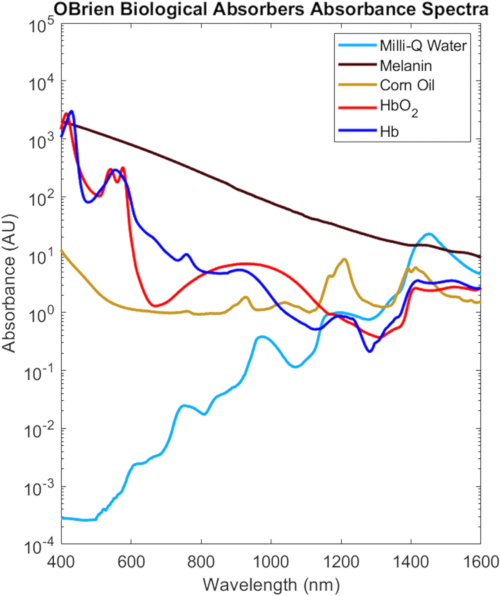
Figura 9: Spettri VIS-SWIR dei comuni assorbitori biologici. Abbreviazione: VIS-SWIR = infrarosso a onde corte visibili. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
I protocolli descritti in questo articolo possono essere utilizzati per ottenere spettri di assorbimento VIS-SWIR di assorbitori biologici e agenti di contrasto. In questo articolo, mostriamo i passaggi specifici per ottenere spettri di acqua, melanina, olio di mais, emoglobina ossigenata ed emoglobina deossigenata che vanno da 400 nm a 1.600 nm. La discussione che segue copre i passaggi critici, i suggerimenti per l'ottimizzazione delle misurazioni, i limiti del metodo e le applicazioni di questo protocollo in biomedicina.
Sebbene tutti i passaggi del protocollo siano importanti, è necessario seguire alcuni passaggi critici per ottenere spettri accurati con questo protocollo. Innanzitutto, il campione deve essere non dispersivo; Ad esempio, quando si ottiene l'emoglobina ossigenata e deossigenata dal sangue, i dispersori nel campione devono essere filtrati (in questo caso è stato utilizzato un filtro per siringa da 0,22 μm). Quando si prepara l'emoglobina deossigenata, la quantità di ditionito di sodio aggiunta non deve superare il peso fornito, poiché renderà il campione torbido a percentuali di peso più elevate e invaliderà i requisiti della legge di Beer-Lambert.
In secondo luogo, l'acqua deuterata deve essere utilizzata come solvente del campione e di riferimento per i soluti idrosolubili come l'emoglobina. Nello SWIR, l'assorbimento d'acqua è forte e può mascherare altri assorbitori. In terzo luogo, le misure devono essere acquisite all'interno dell'intervallo lineare del rivelatore, definito come la regione in cui un cambiamento nei fotoni che raggiungono il rivelatore si traduce in un cambiamento lineare nel segnale del rivelatore. Se si verifica un assorbimento minimo, il rivelatore può registrare un'assorbanza pari a zero, anche se si verifica un'assorbanza. Ciò si verifica quando il campione è troppo diluito, il tempo di esposizione è troppo basso e/o la lunghezza del percorso della cuvetta troppo breve, ma può essere rimediato da un aumento della concentrazione del campione, della lunghezza del percorso della cuvetta e/o del tempo di esposizione. Allo stesso modo, se si verifica un elevato assorbimento, il rivelatore potrebbe non registrare alcun fotone e produrre una linea piatta chiamata "saturazione" che non è sensibile ai cambiamenti di assorbanza. Ciò si verifica quando il campione è troppo concentrato, il tempo di esposizione è troppo basso e/o la lunghezza del percorso è troppo lunga, ma può essere risolto aumentando la concentrazione del campione, aumentando il tempo di esposizione e/o diminuendo la lunghezza del percorso della cuvetta.
In quarto luogo, i rilevatori utilizzati devono essere lineari. Se non si è certi che il rivelatore mostri una risposta lineare al numero di fotoni che raggiungono il rivelatore, è possibile misurare varie diluizioni di un campione con le stesse impostazioni di acquisizione per verificare se i loro valori di assorbanza mostrano l'andamento lineare previsto tra assorbanza e concentrazione. In alternativa, è possibile misurare un singolo campione e aumentare il tempo di esposizione per verificare se vi è un aumento lineare dell'intensità del rivelatore. Entrambi i test dovrebbero produrre una relazione lineare se l'utente opera entro i suoi limiti lineari (vedi il terzo punto critico sopra).
In quinto luogo, per rimanere all'interno dell'intervallo lineare del rivelatore per l'intero intervallo spettrale VIS-SWIR, la concentrazione del campione, il tempo di esposizione del rivelatore e/o la lunghezza del percorso della cuvetta dovranno essere modificati per diverse regioni spettrali con assorbanza significativamente più alta o più bassa rispetto alla regione spettrale di partenza.
In sesto luogo, gli spettri acquisiti utilizzando diverse concentrazioni di campioni o lunghezze di percorso per diverse regioni spettrali devono essere cuciti insieme mediante scala lineare di una regione in base a cambiamenti noti nella concentrazione o nella lunghezza del percorso. Dopo il ridimensionamento, gli spettri devono essere cuciti insieme a una lunghezza d'onda sovrapposta tra le due regioni. Se una misura si estenderà su misure provenienti da diversi rivelatori, dovrebbero esserci spettri di assorbanza sovrapposti che contengano la lunghezza d'onda di transizione del rivelatore desiderata (800 nm è comunemente usato quando si uniscono le regioni UV-VIS e SWIR). Ogni spettro viene troncato alla lunghezza d'onda di transizione del rivelatore e uno spettro viene scelto per includere il valore di assorbanza di transizione originale del rivelatore. Quindi, i due spettri troncati vengono concatenati per creare un unico spettro allungato.
Ulteriori suggerimenti per l'acquisizione di spettri di assorbimento di alta qualità includono l'utilizzo di uno spettro precedentemente pubblicato del campione di interesse, anche se non copre l'intero intervallo spettrale da misurare, per guidare le misurazioni. Conoscendo a priori l'intervallo di lunghezze d'onda con l'assorbanza più bassa, le misurazioni possono essere avviate in questa regione con il campione a più alta concentrazione e quindi regolate e diluite da lì. Può aiutare a capire quante regioni separate dovranno essere misurate in base all'entità delle variazioni di assorbanza previste. Può anche fornire la certezza che lo spettro atteso sia stato ottenuto se corrisponde agli spettri pubblicati, o se non corrisponde agli spettri pubblicati, il metodo di preparazione del campione può essere riesaminato insieme a problemi che potrebbero distorcere lo spettro.
Gli spettri di assorbimento possono richiedere la post-elaborazione. Ad esempio, un filtro digitale della media mobile può essere utilizzato per uniformare le misurazioni dell'assorbimento e i punti di errore noto possono essere rimossi con una riparazione del set di dati in cui i punti errati vengono eliminati e l'interpolazione viene eseguita tra punti non errati.
I limiti di questo metodo includono l'imprecisione per i campioni con diffusione ottica, come il sangue intero. Per misurare con precisione l'emoglobina, il campione di sangue viene lisato e quindi filtrato con una siringa per rimuovere la maggior parte degli altri componenti cellulari residui che causano la dispersione ottica. Allo stesso modo, questo metodo non viene utilizzato in vivo a causa della dispersione tissutale. Sebbene le misure di assorbanza basate sulla legge di Beer-Lambert possano essere noiose e talvolta difficili da eseguire, è il metodo gold standard per le misure di assorbimento ottico puro. Inoltre, alcuni solventi rendono particolarmente difficile l'acquisizione di uno spettro di assorbanza puro di alcuni soluti. Ad esempio, il solvente nativo dell'emoglobina ossigenata e deossigenata è l'acqua, ma l'assorbimento dell'acqua è forte nello SWIR, dominando l'assorbimento dell'emoglobina ossigenata. Pertanto, tentiamo di rimuovere l'acqua dal sangue attraverso centrifugazioni ripetute, rimozione del surnatante e ricostituzione con acqua deuterata che ha un assorbimento SWIR più debole. Si sospetta che gli spettri dell'emoglobina ossigenata e deossigenata risultanti dal sangue umano intero eparinizzato contengano un piccolo assorbimento residuo dovuto all'assorbimento di acqua da circa 1.300 nm a 1.600 nm, come mostrato nella Figura 3. Anche se probabilmente non si tratta di un perfetto distacco dell'acqua dall'emoglobina ossigenata e deossigenata, osserviamo uno stretto allineamento con gli spettri dell'emoglobina ossigenata e deossigenata da 400 nm a 1.000 nm ed estendiamo lo spettro di diverse centinaia di nanometri 2,3.
I protocolli qui descritti aiuteranno i ricercatori ad espandere le librerie di spettri di assorbimento per includere gli spettri VIS-SWIR di una serie di componenti biologici e agenti di contrasto. Queste conoscenze possono essere utilizzate per migliorare la comprensione della biologia e della fisiologia di base attraverso l'imaging biomedico non invasivo e il rilevamento a lunghezze d'onda più profonde rispetto alla maggior parte dei sistemi attualmente in funzione. L'aggiunta di lunghezze d'onda SWIR amplia il tipo di componenti tissutali che possono essere monitorati in modo non invasivo e potrebbe informare lo sviluppo di nuovi sistemi di monitoraggio e diagnostica. Inoltre, i dispositivi che operano nel NIR e nello SWIR dovrebbero contribuire a ridurre al minimo il pregiudizio della pigmentazione cutanea che è stato segnalato per i dispositivi ottici che operano nelle gamme VIS e NIR ed è una strategia promettente per la creazione di dispositivi medici equi.
Divulgazioni
Christine O'Brien e Leonid Shmuylovich hanno una partecipazione finanziaria in Armor Medical Inc. e potrebbero trarre vantaggio finanziario se l'azienda riuscisse a commercializzare i suoi prodotti correlati a questa ricerca.
Riconoscimenti
Questo lavoro è sostenuto da sovvenzioni del National Institutes of Health (NIH) R00HD103954 e R21EB035823. La ricerca riportata in questa pubblicazione è stata supportata dal UL1TR002345 di sovvenzioni dell'Istituto di Scienze Cliniche e Traslazionali dell'Università di Washington dal National Center for Advancing Translational Sciences (NCATS) del National Institutes of Health (NIH). Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente il punto di vista ufficiale del NIH. Gli autori desiderano ringraziare i membri dell'O'Brien Lab, Michael Vahey e i suoi membri del laboratorio e Huanzhu Jiang.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm diameter syringe Filters | Sigma-Aldrich | SLGPM33RS | |
| 1000 µL Pipette | Millipore Sigma | EP3124000121 | |
| 200 µL Pipette | Millipore Sigma | EP3124000083 | |
| Conical Tubes | Avantor VWR | 21008-089 | |
| Corn Oil | Happy Belly | n/a | 48 Fl Oz |
| Deuterium Oxide | Cambridge Isotope Laboratories | DLM-4-100 | |
| Deuterium Oxide | Sigma-Aldrich | 7789-20-0 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D5879-1L | |
| Disposable 1 mL Syringe | BH Supplies | BH1LL | |
| Disposable Needle | Atshuhut/Amazon | 66941 | |
| Freezer (-80 °C) | Fisher Scientific | IUE386FARK | |
| Glass Beakers | Millipore Sigma | CLS1000PACK | |
| Glass or Quartz Cuvettes | Sigma-Aldrich | Z802875-1EA | 700 µL volume |
| Glass or Quartz Cuvettes | Thorlabs | CV10Q35EP | 3500 mL volume |
| Heparinized Human Blood | Lampire | 7203710 | |
| Microcentrifuge Tubes | Costar | 3213 | |
| Microcentrifuge--accuSpin Micro 17 | Fisher Scientific | 13-100-675 | |
| MilliQ Water | Millipore Sigma | ZMQSP0D01 | |
| OSRAM FCS 64640 150 W 24 V HLX Halogen Light Bulb | Amazon | B0001221DG | |
| Parafilm | Millipore Sigma | HS234526B | |
| Pipette Tips | Eppendorf | 22492055 | |
| Powdered Synthetic Melanin | Sigma-Aldrich | 8049-97-6 | |
| Scale | Sartorius | UX-11976-09 | |
| Sodium Dithionite | Sigma-Aldrich | 1065070500 | |
| Sonicator | Fisher Scientific | CPX1800 | |
| Spatula | Aozita | 000 00 0 1 2 3 | |
| UV/VIS/SWIR Spectrophotometer | On Line Instrument Systems | Olis Cary 14 | |
| Weigh Boats | Amazon | B07M5RMNPF |
Riferimenti
- Cao, Q., Zhegalova, N. G., Wang, S. T., Akers, W. J., Berezin, M. Y. Multispectral imaging in the extended near-infrared window based on endogenous chromophores. J Biomed Opt. 18 (10), 101318 (2013).
- Yao, J., Wang, L. V. Sensitivity of photoacoustic microscopy. Photoacoustics. 2 (2), 87-101 (2014).
- Jacques, S. L. Optical properties of biological tissues: a review. Phys Med Biol. 58 (11), R37 (2013).
- . Optical absorption of hemoglobin Available from: https://omlc.org/spectra/hemoglobin/ (1999)
- Zhang, H., et al. Penetration depth of photons in biological tissues from hyperspectral imaging in shortwave infrared in transmission and reflection geometries. J Biomed Opt. 21 (12), 126006 (2016).
- Du, T., et al. Hyperspectral imaging and characterization of allergic contact dermatitis in the short-wave infrared. J Biophotonics. 13 (9), e202000040 (2020).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Mueller, G. J. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J Biomed Opt. 4 (1), 36-46 (1999).
- Kuenstner, J. T., Norris, K. H. Spectrophotometry of human hemoglobin in the near infrared region from 1000 to 2500 nm. J Near Infrared Spectrosc. 2 (2), 59-65 (1994).
- Spectral subtraction. Available from: https://www.spectroscopyonline.com/view/spectral-subtraction (2021)
- Sjoding, M. W., Dickson, R. P., Iwashyna, T. J., Gay, S. E., Valley, T. S. Racial bias in pulse oximetry measurement. N Engl J Med. 383 (25), 2477-2478 (2020).
- Fawzy, A., et al. Racial and ethnic discrepancy in pulse oximetry and delayed identification of treatment eligibility among patients with COVID-19. JAMA Intern Med. 182 (7), 730-738 (2022).
- Sudat, S. E. K., et al. Racial disparities in pulse oximeter device inaccuracy and estimated clinical impact on COVID-19 treatment course. Am J Epidemiol. 192 (5), 703-713 (2023).
- Keller, M. D., Harrison-Smith, B., Patil, C., Arefin, M. S. Skin colour affects the accuracy of medical oxygen sensors. Nature. 610 (7932), 449-451 (2022).
- Butler, W. L. Absorption spectroscopy of biological materials. Methods Enzymol. 24, 3-25 (1972).
- Tang, J., et al. Calculation extinction cross sections and molar attenuation coefficient of small gold nanoparticles and experimental observation of their UV-vis spectral properties. Spectrochim Acta A Mol Biomol Spectrosc. 191, 513-520 (2018).
- Rossman, G. R. Optical spectroscopy. Rev Mineral Geochem. 78 (1), 371-398 (2014).
- Thimsen, E., Sadtler, B., Berezin, M. Y. Shortwave-infrared (SWIR) emitters for biological imaging: a review of challenges and opportunities. Nanophotonics. 6 (5), 1043-1054 (2017).
- Briely-Sabo, K., Bjornerud, A. Accurate de-oxygenation of ex-vivo whole blood using sodium dithionite. Proc Intl Sot Mag Reson Med. 8, 2025 (2020).
- Skoog, D. A., Holler, F. J., Crouch, S. R. Principles of instrumental analysis. Cengage Leaning. , (2019).
- Hale, G. M., Querry, M. R. Optical constants of water in the 200-nm to 200-microm wavelength region. Appl Opt. 12 (3), 555-563 (1973).
- Sarna, T., Sealy, R. Photoinduced oxygen consumption in melanin systems. Action spectra and quantum yields for eumelanin and synthetic melanin. Photochem Photobiol. 39 (1), 69-74 (1984).
- Sarna, T., Swartz, H. A., Nordlund, J. J. The physical properties of melanins. The pigmentary system: Physiology and pathophysiology. , 311-341 (2006).
- Crippa, P., Cristofoletti, V., Romeo, N. A band model for melanin deduced from optical absorption and photoconductivity experiments. Biochim Biophys Acta. 538 (1), 164-170 (1978).
- van Veen, R., et al. Determination of visible near-IR absorption coefficients of mammalian fat using time- and spatially resolved diffuse reflectance and transmission spectroscopy. J Biomed Opt. 10 (5), 054004 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon