Method Article
Charakterisierung biologischer Absorptionsspektren vom sichtbaren bis zum kurzwelligen Infrarot
In diesem Artikel
Zusammenfassung
Biologische Proben weisen im kurzwelligen Infrarot (SWIR) im Vergleich zu den Wellenlängenbereichen im sichtbaren (VIS) und nahen Infrarot (NIR) unterschiedliche optische Eigenschaften auf. Die Aufzeichnung reiner SWIR-Absorptionsspektren ist jedoch eine Herausforderung und wird bei biologischen Molekülen nur selten durchgeführt. In diesem Artikel wird eine Methode zur Charakterisierung der VIS-SWIR-Absorptionsspektren biologischer Absorber vorgestellt.
Zusammenfassung
Für das nicht-invasive lichtbasierte physiologische Monitoring können mittels Absorptionsspektroskopie optimale Wellenlängen einzelner Gewebebestandteile identifiziert werden. Aufgrund der mangelnden Empfindlichkeit der Hardware bei längeren Wellenlängen wurde die Absorptionsspektroskopie jedoch in der Regel für Wellenlängen im sichtbaren (VIS) und nahen Infrarotbereich (NIR) von 400 bis 1.000 nm eingesetzt. Hardware-Fortschritte im Bereich des kurzwelligen Infrarots (SWIR) haben es den Forschern ermöglicht, Wellenlängen im Bereich von ~1.000 nm bis 3.000 nm zu erforschen, in denen charakteristische Absorptionsspitzen für Lipide, Proteine und Wasser fallen. Diese Moleküle sind im VIS-NIR schwer sichtbar zu machen und können markierungsfreie Quellen für biologischen Kontrast darstellen. Darüber hinaus wurde eine geringere SWIR-Absorption für Melanin beobachtet, das primäre Chromophor, das für die Hautpigmentierung verantwortlich ist. Es wurde festgestellt, dass optische In-vivo-Geräte wie klinische Standard-Pulsoximeter bei Menschen mit dunkel pigmentierter Haut eine verringerte Genauigkeit aufweisen, möglicherweise aufgrund der stärkeren Melaninabsorption im VIS-Bereich. So könnten Fehler im Zusammenhang mit der Hautpigmentierung durch die Verwendung von Geräten, die im SWIR arbeiten, reduziert werden. Das Design optischer Instrumente wird durch das Verständnis der Absorptionseigenschaften von Kerngewebekomponenten vom VIS- bis zum SWIR-Bereich erleichtert. In diesem Artikel werden Protokolle und Instrumente zur Erstellung von VIS-SWIR-Absorptionsspektren gängiger Gewebeabsorber beschrieben: sauerstoffreiches Hämoglobin, sauerstoffarmes Hämoglobin, Melanin, Wasser und Lipid.
Einleitung
Die meisten biologischen Absorber wurden optisch im sichtbaren (VIS, ~400-700 nm) und nahen Infrarot (NIR, ~700-1.000 nm) Spektralbereich charakterisiert, nicht jedoch im kurzwelligen Infrarot (SWIR, ~1.000-3.000 nm)1,2,3,4 (Abbildung 1). Und das, obwohl das SWIR aufgrund der geringeren Gewebestreuung und der reduzierten Melaninabsorption sowie eines zusätzlichen markierungsfreien biologischen Kontrasts für Wasser, Lipid und Protein eine tiefere Lichtdurchdringung bietet 1,5,6. Der Mangel an Absorptionsspektren, die sich über das VIS-SWIR erstrecken, hat eine Wissenslücke geschaffen, die die Entwicklung biomedizinischer optischer Geräte verhindert, die diese SWIR-Vorteile nutzen. Obwohl in der Vergangenheit mehrere Versuche zur Charakterisierung der Spektren vorgestellt wurden, fehlen qualitativ hochwertige VIS-SWIR-Absorptionsspektren von reinen Komponenten ohne signifikante Lösungsmittelartefakte 1,7,8. Zum Beispiel wurden wasserlösliche Substanzen wie Hämoglobin im SWIR unter Verwendung von Wasser als Lösungsmittel charakterisiert und die Reinwasserabsorption von den resultierenden Spektren9 subtrahiert. Die Genauigkeit dieses Ansatzes ist jedoch unklar, da Wasser in dieser Region ein dominanter Absorber ist.
Die Arbeit im SWIR hat den zusätzlichen Vorteil, dass die Verzerrung, die durch eine starke Melaninabsorption im VIS verursacht wird, bei der optischen In-vivo-Diagnostik reduziert oder möglicherweise beseitigt wird. Zahlreiche Studien haben ergeben, dass Pulsoximeter die Sauerstoffversorgung bei schwarzen Patienten überschätzen, und daher haben schwarze Patienten mit größerer Wahrscheinlichkeit gefährlich niedrige Sauerstoffwerte, die Pulsoximeter nicht erkannt haben10. Diese Verzerrung der Hautpigmentierung hat zu einer verzögerten und unzureichenden medizinischen Behandlung vieler schwarzer hypoxischer Patienten geführt11,12 und veranlasste die Optik- und Ingenieurskreise zu einem Aufruf zum Handeln, um die Genauigkeit optischer Geräte für alle Hauttöne zu verbessern13. Der Übergang von den VIS-Wellenlängen mit hohem Melanin-absorbierenden zu NIR und SWIR ist eine aufregende technische Innovation, die Rassenunterschiede bei äußerst wichtigen biomedizinischen Optiktechnologien verringern könnte.
Die Aufzeichnung von Ground-Truth-Absorptionsspektren von Biomolekülen ist essentiell für das Verständnis der optischen Eigenschaften von Gewebeproben, die in einer Vielzahl von technischen und biomedizinischen Anwendungen eingesetzt werden14. Die Absorptionsspektroskopie misst die molekülspezifische Lichtabsorption in Abhängigkeit von der Wellenlänge. Die Goldstandardmethode zur Erfassung von Absorptionsmessungen in Lösung besteht darin, kollimiertes, monochromatisches Licht durch eine gelöste Probe zu leiten und das durchgelassene Licht mit einem Detektor aufzuzeichnen, der auf der gegenüberliegenden Seite der Probe von der Lichtquelle platziert ist. Die Absorption (A) der Probe wird dann durch Gl. (1) definiert.
A = Logarithmus10(I0/I) (1)
Wobei Io die Intensität des einfallenden Lichts auf die Probe ist, und I die Intensität des Lichts, das durch die Probe durchgelassen wird und auf den Detektor trifft. Io wird durch Messung einer Referenz erfasst, bei der es sich typischerweise um das Lösungsmittel des interessierenden gelösten Stoffes handelt, wobei die gleichen Erfassungseinstellungen wie I verwendet werden. Die Absorptionsspektroskopie liefert quantitative Absorptionseigenschaften und unterliegt dem Beer-Lambert-Gesetz (Gl. 2), das nicht für Proben mit optischer Streuung gilt. Diese Gleichung besagt, dass die optische Absorption bestimmt wird durch den molaren Absorptionskoeffizienten einer Probe (ε, Einheiten L·mol−1·cm−1) bei der Wellenlänge λ multipliziert mit ihrer molaren Konzentration (C, Einheiten mol∙L-1) und der Weglänge (L, Einheiten cm), die definiert ist als die durch die Probezurückgelegte Strecke 15:
A(λ) = ε(λ)*L*C (2)
Wichtig ist, dass der molare Absorptionskoeffizient für jeden biologischen Absorber einzigartig ist und angibt, wie stark eine Probe Licht bei einer bestimmten Wellenlängeabsorbiert 16.
Bei absorptionsspektroskopie-Messungen, die vom VIS bis zum SWIR reichen, sind Anpassungen an der Hardware, der Probenvorbereitung und der spektralen Nachbearbeitung erforderlich, die über die Standard-VIS-NIR-Spektren hinausgehen:
Hardware
VIS-NIR-Messungen verwenden typischerweise einen Siliziumdetektor oder Photomultiplier-Röhren (PMT) mit Photokathoden, die für UV-VIS-Photonen empfindlich sind, während die SWIR-Absorption einen Photodetektor erfordert, der für SWIR-Photonen empfindlich ist, wie z. B. einen Indium-Gallium-Arsenid-Detektor (InGaAs)17. VIS-, NIR- und SWIR-Systeme benötigen in der Regel auch wellenlängenspezifische Dispersionselemente, wie z. B. optische Gitter, für die Lichtdispersion in diesen optischen Bereichen. Darüber hinaus erfordert die SWIR-Absorption Glas- oder Quarzküvetten, die eine höhere Transmission als Kunststoffküvetten im SWIR aufweisen und daher besser für VIS-SWIR-Spektren geeignet sind. Es sollte eine oder mehrere Lichtquellen mit einer breiten und relativ gleichmäßigen Emission ausgewählt werden, die den VIS-SWIR abdecken, wie z. B. eine Wolfram-Halogenlampe (die in diesem Protokoll verwendet wird). Die Anpassung der Leistung des einfallenden Lichts, der Belichtungszeit oder der Dauer, für die der Fotodetektor dem Licht ausgesetzt ist, kann zur Optimierung der Absorptionsmessungen beitragen.
Probenvorbereitung
Die Konzentration der Probe oder die Weglänge der Küvette ändert linear die Menge der Absorption, die auftritt, wie oben in Gl (2) beschrieben, und daher kann beides geändert werden, um ein hohes Signal-Rausch-Verhältnis (SNR, hierin berechnet als das Verhältnis der Spitzenamplitude dividiert durch die Standardabweichung eines trendbereinigten Bereichs des Spektrums, typischerweise SNR > 30 gilt als qualitativ hochwertig) Messungen in verschiedenen Abschnitten des Spektrums mit relativ hohen oder niedrigen Extinktion. Zur Optimierung der SWIR-Messungen in wässriger Lösung kann anstelle von Wasser (H2O) Deuteriumoxid (D2O), auch als schweres Wasser oder deuteriertes Wasser bezeichnet, verwendet werden, da es deutlich geringere Absorptionspeaks im SWIR1 aufweist. Dies ermöglicht die Charakterisierung des gelösten Stoffes ohne Beeinträchtigung der dominanten Wasseraufnahme im SWIR.
Spektrale Nachbearbeitung
Eine Nachbearbeitung ist erforderlich, da für VIS-SWIR-Spektren zwei Detektoren erforderlich sind, einer für das sichtbare NIR (typischerweise Silizium oder UV-VIS-empfindliches PMT) und einer für das SWIR (typischerweise InGaAs), und die Spektren müssen zusammengefügt werden, um ein vollständiges VIS-SWIR-Spektrum zu erhalten. Wenn sich Spektren über den VIS-SWIR erstrecken, kann die Absorption je nach Wellenlängenbereich erheblich variieren, und die Probe muss möglicherweise verdünnt oder die Weglänge in einigen Bereichen verringert werden, um eine Sättigung zu verhindern. Spektren müssen linear skaliert werden, um Änderungen der Probenkonzentration oder der Weglänge zu berücksichtigen, und dann zusammengefügt werden, um ein einzelnes Spektrum zu erzeugen, das zwei Wellenlängenbereiche umfasst.
In den folgenden Protokollen wird die Vorbereitung und spektroskopische Messung von fünf biologischen Beispielabsorbern vom VIS zum SWIR detailliert beschrieben: Wasser (umfasst ~60 % des Körpergewichts), Melanin (primärer Absorber für die Hautpigmentierung), Maisöl (wird als Analogon für menschliche Lipide verwendet, da es eine geringe Variabilität zwischen den Chargen aufweist, eine enge chemische Zusammensetzung zu menschlichen und tierischen Lipiden, und minimale Streuung) sowie sauerstoffreiches und sauerstoffarmes Hämoglobin (die primären Absorber im Blut).
Protokoll
1. Vorbereitung der Proben
- Vorbereitung der Wasserprobe
- Zur Vorbereitung der Probe wird ein sauberes Gefäß mit Reinstwasser gefüllt und mit einem 0,22 μm Spritzenfilter filtriert. Stellen Sie sicher, dass der Ausgang der Spritze auf eine saubere Glas- oder Quarzküvette gerichtet ist, um absorptionsspektroskopierische Messungen der Probe durchzuführen.
- Um die Referenz vorzubereiten, füllen Sie ein sauberes Gefäß mit deuteriertem Wasser und filtern Sie es mit einem 0,22 μm Spritzenfilter. Stellen Sie sicher, dass die Ausgabe der Spritze auf eine identische saubere Glas- oder Quarzküvette wie die Probenküvette gerichtet ist, die als Referenz dient.
HINWEIS: Der Filterschritt minimiert die optische Streuung aus der Probe, indem kleine Partikel im Wasser herausgefiltert werden, die im sichtbaren Bereich einen starken Beitrag leisten.
- Vorbereitung der Melaninprobe
- Bereiten Sie eine Melaninlösung von 1,7 mg/ml vor, indem Sie pulverförmiges Melanin in ein Zentrifugenröhrchen geben, das mit 3,5 ml Dimethylsulfoxid (DMSO) gefüllt ist. Zu Beginn sollten die Messungen bei den Wellenlängen mit der geringsten erwarteten Absorption beginnen, bei denen die höchste Melaninkonzentration erforderlich ist. Beginnen Sie die Melaninmessung mit ca. 1,7 mg/ml für das SWIR und verdünnen Sie es später mit DMSO auf eine 10-fache Verdünnung (ca. 0,17 mg/ml) für die VIS/NIR-Regionen.
- Beschallen Sie das Röhrchen 10 Minuten lang, um sicherzustellen, dass sich das pulverförmige Melanin im DMSO auflöst, und überführen Sie die Lösung für Spektroskopiemessungen in eine saubere Glas- oder Quarzküvette.
- Bleiben Sie innerhalb des linearen Absorptionsbereichs des Spektrometers und stellen Sie hohe SNR-Messungen sicher, indem Sie die Konzentration und/oder die Schichtdicke ändern (z. B. durch Umschalten von einer kurzen Schichtdicke (1 oder 2 mm) auf eine Küvette mit 10 mm Schichtdicke). Die Melaninabsorption hat einen weiten Bereich, der von VIS bis SWIR reicht. Für das VIS ist die Melaninküvette mit der niedrigsten Konzentration und/oder Weglänge zu verwenden, da sie einen hohen molaren Extinktionskoeffizienten aufweist. Verwenden Sie für das SWIR die höchste Konzentration an Melanin und/oder Weglängenküvetten, um eine qualitativ saubere Spektroskopiemessung zu erhalten.
- Vorbereitung der Maisölprobe
- Geben Sie Maisöl in eine saubere Glas- oder Quarzküvette für Spektroskopiemessungen.
- Verwenden Sie Open Air als Referenz. Es wird keine Küvette oder Lösung als Referenz verwendet.
- Aufbereitung einer sauerstoffhaltigen Hämoglobinprobe mit heparinisiertem menschlichem Vollblut
HINWEIS: Heparinisiertes menschliches Vollblut wurde in von der FDA lizenzierten Entnahmezentren in den Vereinigten Staaten gekauft und gesammelt.- Um Hämoglobin aus den roten Blutkörperchen (RBCs) zu isolieren und so viel Wasser wie möglich aus dem Blut zu entfernen, pipettieren Sie zunächst 1.800 μl heparinisiertes menschliches Vollblut in Mikrozentrifugenröhrchen und zentrifugieren Sie 10 Minuten lang bei 9,6 × g .
HINWEIS: Es werden ca. 4-6 Mikrozentrifugenröhrchen empfohlen - Entfernen Sie nach der Zentrifugation die Röhrchen aus der Mikrozentrifuge, entfernen Sie dann den Überstand (beträgt ca. 850 μl) aus der zentrifugierten Blutprobe und entsorgen Sie ihn, ohne das Pellet zu stören (Abbildung 2). Der Überstand besteht aus der Flüssigkeit (hauptsächlich Plasma und Blutplättchen) über dem Pellet der roten Blutkörperchen. Suchen Sie nach dem Pellet der roten Blutkörperchen am Boden des Mikrozentrifugenröhrchens.
- Jedes Pellet wird mit dem gleichen Volumen deuteriertem Wasser rekonstituiert, wie das Volumen des Überstands, das verworfen wurde. Erneut bei 9,6 × g für 10 min zentrifugieren.
- Nehmen Sie die Röhrchen aus der Zentrifuge und entsorgen Sie dann den Überstand, ohne das Pellet zu stören.
- Rekonstituieren Sie das Pellet mit dem gleichen Volumen deuteriertem Wasser wie das Volumen des Überstands, das verworfen wurde. Bei 9,6 × g für 10 min erneut zentrifugieren.
- Nehmen Sie die Röhrchen aus der Zentrifuge, entfernen Sie dann den Überstand mit einer Pipette und entsorgen Sie ihn.
- Lysierende rote Blutkörperchen (RBCs): Rekonstituieren Sie die Erythrozytenpellets mit einem großen Volumen (4,5 ml) deuteriertem Wasser, was zu einem hypotonen Ausbruch führt. Wenn das Pellet an der Tube klebt, spülen Sie es mit etwas von den gemessenen 4,5 mL deuteriertem Wasser ab, um es zu lösen.
HINWEIS: Das Volumen des Überstands nimmt nach jedem Zentrifugationsschritt zu. Dieses Volumen des Überstands kann zwischen 800 μl und 1.600 μl liegen. Das Volumen des deuterierten Wassers für die Lyse kann sich je nach gewünschter Probenkonzentration ändern, muss aber hoch genug sein, um einen hypotonen Burst zu verursachen. - Entfernen Sie die lysierte Blutlösung mit einer Nadel und einer Spritze aus dem Röhrchen. Entfernen Sie dann vorsichtig die Spritzennadel mit stumpfer Spitze und entsorgen Sie sie in einem Behälter für biologisch gefährliche scharfe Gegenstände. Schließen Sie die Spritze an einen 0,22 μm Spritzenvorsatzfilter an und schieben Sie den Spritzeninhalt durch den Filter in eine 3,5 mL Glas- oder Quarzküvette mit einer Schichtdicke von 10 mm.
HINWEIS: Der Filterschritt minimiert die optische Streuung aus der Probe, indem die zellulären Organellen und Membranen in der Lösung herausgefiltert werden. Wenn die Probe hochkonzentriert ist und sich der Spritzenvorsatzfilter nur schwer schieben lässt, verwenden Sie mehrere Spritzenvorsatzfilter. - Befestigen Sie die Küvette mit einem luftdichten Stopfen über der Küvette, um zu verhindern, dass Wasserdampf aus der Luft die Probe verunreinigt. Parafilm an der Außenseite des Stopfens, um eine Kontamination weiter zu verhindern und einen luftdichten Verschluss zu gewährleisten.
HINWEIS: Bei Messungen von 600 nm bis 1.600 nm ergeben ca. 1.200-1.600 μl Pellet, gelöst in 4,5 mL deuteriertem Wasser, qualitativ saubere Messungen.
HINWEIS: Für Spektralbereiche mit hoher erwarteter Extinktion (400 nm bis 600 nm) müssen die Proben mit deuteriertem Wasser verdünnt werden, um ungesättigte Absorptionswerte zu erhalten und sicherzustellen, dass die Absorptionswerte innerhalb des linearen Bereichs des Detektors liegen. Darüber hinaus sollten die Proben und die Referenz in Küvetten mit kurzer Weglänge (1 oder 2 mm) gegeben werden. Für die hierin gezeigten Spektren wurden die Proben 10x für 400-500 nm und 5x für 500-600 nm verdünnt und in 2 mm Weglängenküvetten gemessen.
Die kürzere Weglänge (1 oder 2 mm) ermöglicht eine geringere Lichtabsorption bei stark absorbierenden Wellenlängen und trägt dazu bei, dass einige Photonen zum Detektor durchgelassen werden und innerhalb des linearen Nachweisbereichs bleiben. - Besorgen Sie sich eine saubere Küvette mit der gleichen Schichtdicke und dem gleichen Volumen wie die Probenküvette mit der gefilterten Blutlösung und füllen Sie sie mit deuteriertem Wasser für Ausgangs- und Referenzmessungen. Wenn Sie die Weglängen der Küvetten für verschiedene Spektralbereiche ändern, zeichnen Sie für jede Weglänge der Küvette ein neues Referenzspektrum auf.
- Um Hämoglobin aus den roten Blutkörperchen (RBCs) zu isolieren und so viel Wasser wie möglich aus dem Blut zu entfernen, pipettieren Sie zunächst 1.800 μl heparinisiertes menschliches Vollblut in Mikrozentrifugenröhrchen und zentrifugieren Sie 10 Minuten lang bei 9,6 × g .
- Präparation einer sauerstoffarmen Hämoglobinprobe mit heparinisiertem menschlichem Vollblut
- Führen Sie die Schritte 1.4.1-1.4.8 aus.
- Geben Sie Natriumdithionit zur Blutlösung in der Küvette und rühren Sie vorsichtig um. Befestigen Sie die Küvette mit einem luftdichten Stopfen über der Küvette, um zu verhindern, dass Wasserdampf aus der Luft die Probe verunreinigt. Parafilm an der Außenseite des Stopfens, um eine Kontamination weiter zu verhindern und einen luftdichten Verschluss zu gewährleisten. Kippen Sie die Küvette vorsichtig von einer Seite zur anderen, um sicherzustellen, dass sich der Natriumdithionit in der Lösung auflöst. Die Blutlösung ändert sich von einer roten Farbe zu einer dunkleren violett-roten Farbe.
HINWEIS: Um das Hämoglobin vollständig zu desoxygenieren, beträgt die erforderliche Masse an Natriumdithionit etwa 0,007 g pro ml Blutlösung. Laut Briley-Sӕbø und Bjørnerud werden mindestens 2,5 mg Natriumdithionit/g Blut benötigt, um Vollblut vollständig sauerstoffarm zu machen18. Diese Konzentration erwies sich in den vorliegenden Studien jedoch als unzureichend. Es wurde festgestellt, dass eine Konzentration von etwa 3,4 mg/g Vollblut die Blutlösung vollständig sauerstoffarm macht, ohne dass optische Streuung eingeführt wurde. Bei Messungen von 400 bis 600 nm muss die Blutlösung mit deuteriertem Wasser verdünnt werden. Berechnen Sie die erforderliche Natriumdithionitmasse auf der Grundlage des Volumens der verwendeten Schaumlösung und nicht des Volumens nach der Verdünnung. Bei Messungen von 600 nm bis 1.600 nm ergeben etwa 1.200-1.600 μl Pellet, gelöst in 4,5 mL deuteriertem Wasser, Messungen mit hohem SNR-Wert.
Eine Küvette mit kürzerer Weglänge (1 oder 2 mm) ermöglicht eine geringere Lichtabsorption bei stark absorbierenden Wellenlängen und trägt dazu bei, dass einige Photonen zum Detektor durchgelassen werden und innerhalb des linearen Nachweisbereichs bleiben. - Füllen Sie eine weitere Küvette mit der gleichen Schichtdicke wie die Küvette mit gefilterter Blutlösung mit deuteriertem Wasser für Ausgangs- und Referenzmessungen. Wenn Sie die Weglängen der Küvetten für verschiedene Spektralbereiche ändern, zeichnen Sie für jede Weglänge der Küvette ein neues Referenzspektrum auf.
2. Qualitativ hochwertige Absorptionsmessungen erhalten
- Bereiten Sie Proben und Referenzen wie in Abschnitt 1 beschrieben vor und legen Sie sie in Glas- oder Quarzküvetten für VIS NIR-SWIR-Messungen. Schalten Sie die Spektrometerlampe und die Detektoren ein und lassen Sie das System je nach Spektrometersystem und Lichtquelle mindestens 5-20 Minuten lang aufwärmen.
ANMERKUNG: Fünf Minuten boten eine ausreichende Detektorkühlung und Stabilität der Lampenleistung für die hier gesammelten Spektren, aber dies sollte für jedes System charakterisiert werden, bevor Absorptionsmessungen erfasst werden.
Halten Sie die Probe und die Referenz während dieser Zeit der Sammlung griffbereit. Stellen Sie sicher, dass die Deckel der Küvetten fest sitzen. Halten Sie den Messraum so dunkel wie möglich, um eine Verzerrung der Absorptionsmessungen durch Umgebungslicht zu vermeiden. - Wiederholen Sie die folgenden Schritte für verschiedene Bereiche des Spektrums, da die Absorption im VIS-SWIR sehr unterschiedlich ist.
- Wenn Sie eine Dual-Beam-Konfiguration verwenden (zwei separate Detektoren für Probe und Referenz), stellen Sie sicher, dass das System auf Basis ausgelegt ist. Erfassen Sie die Basislinie, indem Sie identische Referenzproben, die das Lösungsmittel enthalten, vor jeden Detektor legen und eine Absorptionsmessung mit den genauen Erfassungsparametern durchführen, die für die Entnahme des Absorptionsspektrums der Probe verwendet werden sollen. Während die Detektoren theoretisch eine Nullabsorption zeigen sollten, ist dies in der Regel nicht perfekt. Subtrahieren Sie das resultierende Absorptionsspektrum von allen Probenabsorptionsspektren, die mit denselben Einstellungen erfasst wurden.
HINWEIS: Die Baseline sollte jedes Mal wiederholt werden, wenn die Erfassungseinstellungen für die Datenerfassung geändert werden. - Legen Sie die Probe in das Spektrometer und wählen Sie den Detektor aus, der für die zu messende Region relevant ist (VIS-NIR = Silizium oder UV-VIS PMT, SWIR = InGaAs) und betrachten Sie die Absorption im Live-Modus, in dem die Messung kontinuierlich aktualisiert wird, wenn die Messparameter abgestimmt werden.
- Ausgehend von den Standardparametern des Spektrometers passen Sie die Leistung des einfallenden Lichts und die Belichtungszeit an, bis ein qualitativ sauberes Absorptionsspektrum ohne Sättigung erhalten wird.
- Wenn die Abstimmung der Parameter nicht zu qualitativ sauberen Spektren führt, ändern Sie Parameter wie die Leistung des einfallenden Lichts, die Belichtungszeit, die Weglänge und die Probenkonzentration. Versuchen Sie zunächst, die Leistung und die Belichtungszeit anzupassen. Wenn die Abstimmung dieser Parameter nicht zu einem hohen SNR-Spektrum führt, ändern Sie die Probenkonzentration oder die Schichtdicke der Probe und der Referenz.
HINWEIS: Die Standardparameter, die bei der Erfassung der hier gezeigten Spektren verwendet wurden, waren eine Auflichtleistung von 15 nW bei 400 nm und 20 nW bei 1.000 nm, eine Belichtungszeit von 30 ms, eine Weglänge der Küvette von 10 mm und probenspezifische Konzentrationen: 100 % Wasser, Melanin 1,7 mg/ml, 100 % Maisöl, sauerstoffreiches Hämoglobin (15,9 g/dl), und sauerstoffarmes Hämoglobin (15,9 g/dl). - Um das SNR zu erhöhen, erhöhen Sie die Anzahl der Datenlesevorgänge, die pro Datenpunkt gemittelt werden . Je höher die Anzahl der gemittelten Lesevorgänge ist, desto länger ist die Zeit pro Messung.
- Um die spektrale Auflösung zu erhöhen, reduzieren Sie die Schrittweite (nm) der Messung bis zur Auflösungsgrenze des Spektrometers. Dadurch erhöht sich die Zeit pro Messung. Reduzieren Sie außerdem die Leistungsbandbreite des einfallenden Lichts auf 1/10 der vollen Breite des schmalsten Peaks bei halbem Maximum19.
- Sobald die Messeinstellungen für die Probe optimiert sind, dokumentieren Sie die Einstellungen für jedes erfasste Spektrum.
- Um ein Spektrum zu erhalten, verwenden Sie die optimierten Einstellungen, um nur die Referenz zu messen. Ersetzen Sie anschließend die Referenzküvette durch die Probenküvette und nehmen Sie eine weitere Messung vor. Stellen Sie sicher, dass Sie sowohl die Referenz- als auch die Probenmessungen separat speichern.
HINWEIS: Es ist zwingend erforderlich, dass die Referenzmessung nicht gesättigt wird. Wenn dies der Fall ist, reduzieren Sie die Leistung des einfallenden Lichts und/oder die Belichtungszeit, bis keine Sättigung mehr vorhanden ist. Halten Sie alle Systemparameter zwischen der Referenz- und der Probenmessung gleich. Wenn eines geändert werden muss, muss auch das andere wiederholt werden, um es anzupassen. - Berechnen Sie für jeden gepaarten Satz von Referenz- und Stichprobenmessungen die Extinktion A (Gl 1), indem Sie die Referenzmessung als Io und die Stichprobenmessung als I behandeln.
- Um verschiedene Bereiche zusammenzufügen, die Unterschiede in der Probenkonzentration oder Weglänge erfordern, wenden Sie einen Multiplikationsfaktor auf einen der Spektralbereiche an. Multiplizieren Sie z. B. für eine erste Region, die 1/10 der Konzentration und die identische Pfadlänge wie eine zweite Region aufweist, die erste Spektralregion mit 10, um die beiden Bereiche entsprechend zusammen zu skalieren.
HINWEIS: Der Multiplikationsfaktor sollte die Differenz in der Konzentration und/oder Weglänge zwischen den Regionen sein. - Nachdem die Spektren um Unterschiede in der Weglänge oder Konzentration korrigiert wurden, wählen Sie eine überlappende Wellenlänge in den beiden Spektralbereichen, um die beiden Bereiche miteinander zu verbinden.
- Kürzen Sie die beiden Spektren so, dass sie bei der Überlappungswellenlänge enden. Wählen Sie ein Spektrum aus, das den spektralen Übergangswert einbeziehen soll. Verketten Sie die beiden abgeschnittenen Spektren, um ein einzelnes Spektrum mit einem breiteren Wellenlängenbereich zu erstellen.
- Wenn die Abstimmung der Parameter nicht zu qualitativ sauberen Spektren führt, ändern Sie Parameter wie die Leistung des einfallenden Lichts, die Belichtungszeit, die Weglänge und die Probenkonzentration. Versuchen Sie zunächst, die Leistung und die Belichtungszeit anzupassen. Wenn die Abstimmung dieser Parameter nicht zu einem hohen SNR-Spektrum führt, ändern Sie die Probenkonzentration oder die Schichtdicke der Probe und der Referenz.
- Wenn Sie eine Dual-Beam-Konfiguration verwenden (zwei separate Detektoren für Probe und Referenz), stellen Sie sicher, dass das System auf Basis ausgelegt ist. Erfassen Sie die Basislinie, indem Sie identische Referenzproben, die das Lösungsmittel enthalten, vor jeden Detektor legen und eine Absorptionsmessung mit den genauen Erfassungsparametern durchführen, die für die Entnahme des Absorptionsspektrums der Probe verwendet werden sollen. Während die Detektoren theoretisch eine Nullabsorption zeigen sollten, ist dies in der Regel nicht perfekt. Subtrahieren Sie das resultierende Absorptionsspektrum von allen Probenabsorptionsspektren, die mit denselben Einstellungen erfasst wurden.
Ergebnisse
Die Daten sind über das WUSTL Digital Research Materials Repository (DRMR) doi: https://doi.org/10.7936/6RXS-108249 verfügbar.
Spektrale Charakterisierung von Wasser
Wasser, einer der gebräuchlichsten biologischen Absorber, hat charakteristische, stark absorbierende Peaks im NIR und SWIR. Diese charakteristischen Peaks sind so stark, dass bei der Messung der Absorption von Wasser oft mit deuteriertem Wasser verdünnt werden muss, um eine Sättigung zu verhindern. Der Unterschied in der Absorption zwischen Wasser und deuteriertem Wasser ist in Abbildung 3 dargestellt, was eine Zunahme der Wasserabsorption im Vergleich zu deuteriertem Wasser um mehr als eine Größenordnung zeigt. Die starke Wasseraufnahme im SWIR macht es auch schwierig, die Absorptionsspektren anderer biologischer Absorber zu erhalten, die Wasser in der Probe enthalten oder Wasser als Lösungsmittel und Referenz verwenden. Als Lösung für dieses Problem kann deuteriertes Wasser anstelle von Wasser verwendet werden. Deuteriertes Wasser verhält sich ähnlich wie Wasser, ist aber ein viel schwächerer SWIR-Absorber, was es zu einem idealen Ersatz für Wasser in SWIR-Spektroskopie-Messungen macht.
Um das Absorptionsspektrum von Wasser zu messen, wurde Wasser als Probe und deuteriertes Wasser als Referenz verwendet. Um eine Sättigung im SWIR zu verhindern, wurde die Probe mit deuteriertem Wasser im SWIR-Bereich verdünnt. Das resultierende Wasserabsorptionsspektrum zeigt eine geringe Absorption im VIS, die bei längeren Wellenlängen zunimmt. Charakteristische Absorptionsspitzen sind bei etwa 750 nm, 970 nm, 1.200 nm und 1.450 nm zu sehen (Abbildung 4). Das resultierende Wasserspektrum hat ein SNR von 3536,6 und wurde mit dem Wasserabsorptionsspektrum20 von Hale und Querry verglichen, das eine ähnliche Absorptionskurve von ~500 nm bis 1.600 nm zeigt. Von 400 bis 500 nm unterscheiden sich die Absorptionskurven jedoch, wobei Hale und Querry einen höheren Absorptionswert bei niedrigeren Wellenlängen zeigen. Dieser Unterschied könnte darauf zurückzuführen sein, dass kleine Restpartikel im Wasser eine höhere Streuung bei kürzeren Wellenlängen aufweisen als bei längeren Wellenlängen3 und die Annahmen einer fehlenden Streuung in Absorptionsmessungen nach dem Beer-Lambert-Gesetz ungültig machen könnten.
Spektrale Charakterisierung von Melanin
Melanin, der primäre optische Absorber der Haut, wurde spektral charakterisiert, wobei pulverisiertes Melanin als Probe und DMSO als Lösungsmittel und Referenz verwendet wurden. Das resultierende Spektrum hat ein SNR von 172 und wurde mit Eumelanin-Daten von Sarna et al.21,22 und Crippa et al.23 verglichen (Abbildung 5). Eumelanin ist das primäre Pigment, das für die Hautfarbe verantwortlich ist, und liefert daher die genauesten Daten darüber, wie Melanin optische Geräte beeinflusst. Das Spektrum, das unter Verwendung des hierin beschriebenen Protokolls gesammelt wurde, zeigt eine hohe Korrelation mit diesen Literaturwerten.
Spektrale Charakterisierung von Maisöl
Um das Absorptionsspektrum eines Lipids zu untersuchen, wurde Maisöl aufgrund seiner minimalen optischen Streuung im Vergleich zu anderen Lipiden und seiner bekannten Ähnlichkeit in der chemischen Zusammensetzung mit tierischen Fettenausgewählt 1. Um das Absorptionsspektrum von Maisöl zu ermitteln, wurde Maisöl als Probe mit Luft als Referenz verwendet. Wie in Abbildung 6 zu sehen ist, enthält das Maisölspektrum charakteristische Peaks bei etwa 930 nm, 1.210 nm und 1.410 nm. Das resultierende Maisölspektrum hat ein SNR von 10363,1 und wurde mit dem Maisölspektrum1 von Cao et al. überlagert, was eine starke Korrelation zeigt.
Spektrale Charakterisierung von oxygeniertem und desoxygeniertem Hämoglobin
Während die Charakterisierung der Absorption von sauerstoffreichem und sauerstoffarmem Hämoglobin eine der wichtigsten Errungenschaften in der biomedizinischen Optik ist, sind ihre Absorptionsspektren, die sich vom VIS bis zum SWIR erstrecken, noch wenig verstanden. Einer der schwierigsten Aspekte bei der Bestimmung des Absorptionsspektrums von sauerstoffreichem und sauerstoffarmem Hämoglobin im SWIR ist die Entfernung des Wassers im Blut, das die relativ geringe Hämoglobinabsorption überwältigt. Um die Absorption von Hämoglobin und Wasser zu entwirren, wurde Hämoglobin zunächst durch Zentrifugation aus menschlichem Vollblut isoliert und der Überstand entfernt und durch deuteriertes Wasser ersetzt. Deuteriertes Wasser wurde auch als Referenz und Lösungsmittel verwendet, in dem das Hämoglobin rekonstituiert wurde, um einen hypotonen Ausbruch zu verursachen. Wie in Abbildung 3 gezeigt, hat deuteriertes Wasser eine viel geringere optische Absorption als Wasser, was es zu einem idealen Lösungsmittel und Referenz für SWIR-Absorptionsmessungen macht. Das resultierende sauerstoffreiche Hämoglobinspektrum erstreckt sich mit einem SNR von 23118,7 vom VIS bis zum SWIR und stimmt sehr gut mit dem von Prahl veröffentlichten sauerstoffhaltigen Hämoglobinspektrum4 überein (Abbildung 7). Im VIS zeigt das sauerstoffhaltige Hämoglobinspektrum eine hohe Absorption mit charakteristischen Absorptionsspitzen bei etwa 415 nm und einem Dublett-Peak von etwa 540 bis 575 nm. Im NIR zeigt das sauerstoffhaltige Hämoglobinspektrum einen charakteristischen Peak, der sich über einen breiteren Wellenlängenbereich erstreckt, etwa 800 nm bis 1.100 nm. Im SWIR ist die Resorption von Hämoglobin gering. Von etwa 1.400 nm bis 1.600 nm zeigt das Hämoglobinspektrum jedoch eine höhere Absorption mit Spitzen, was wahrscheinlich auf das Wasser im Hämoglobin zurückzuführen ist, das während des Zentrifugationsprozesses nicht vollständig entfernt werden konnte.
Bei sauerstoffarmem Hämoglobin wurde der Hämoglobinlösung Natriumdithionit zugesetzt, um die Dissoziation von Sauerstoff von sauerstoffhaltigem Hämoglobin einzuführen und die Probe in sauerstoffarmes Hämoglobin umzuwandeln. Das resultierende Spektrum hat ein SNR von 9813,9 und wurde mit dem desoxygenierten Hämoglobinspektrum von Prahl verglichen und zeigt eine sehr starke Korrelation zwischen 400 nm und 1.000 nm4 (Abbildung 8). Das resultierende desoxygenierte Hämoglobinspektrum zeigt charakteristische Absorptionsspitzen bei etwa 430 nm, 560 nm und 760 nm. Danach nimmt die Absorption von sauerstoffarmem Hämoglobin ab, enthält aber kleinere Absorptionsspitzen um 1.200 nm und von 1.400 nm bis 1.600 nm. Die Extinktion zwischen 1.400 und 1.600 nm ist wahrscheinlich darauf zurückzuführen, dass Wasser während des Zentrifugationsprozesses nicht vollständig aus der Hämoglobinprobe entfernt wurde.
Vergleich der biologischen Absorber aus dem VIS-SWIR
Die vollständigen VIS-SWIR-Spektren aller in diesem Protokoll charakterisierten biologischen Absorber sind in Abbildung 9 dargestellt, skaliert auf der Grundlage ihrer biologischen Konzentration in Gewebe2, was die deutlichen spektralen Unterschiede zwischen biologischen Absorbern hervorhebt. Zum Beispiel haben Melanin, sauerstoffreiches Hämoglobin und sauerstoffarmes Hämoglobin eine starke, charakteristische Absorption im VIS, die im Allgemeinen mit der Wellenlänge abnimmt, während Wasser und Lipid charakteristische Peaks im NIR und SWIR aufweisen. In biologischem Gewebe sorgt die Kombination aus einer Abnahme von Melanin und Hämoglobin sowie einer Abnahme der optischen Streuung für eine erhöhte optische Eindringtiefe im NIR und SWIR. Darüber hinaus ermöglichen die reduzierte Melaninabsorption des NIR und des SWIR die optische Untersuchung von sauerstoff- und sauerstoffarmem Hämoglobin, Lipid und Wasser mit minimalen Auswirkungen aufgrund der Hautpigmentierung.
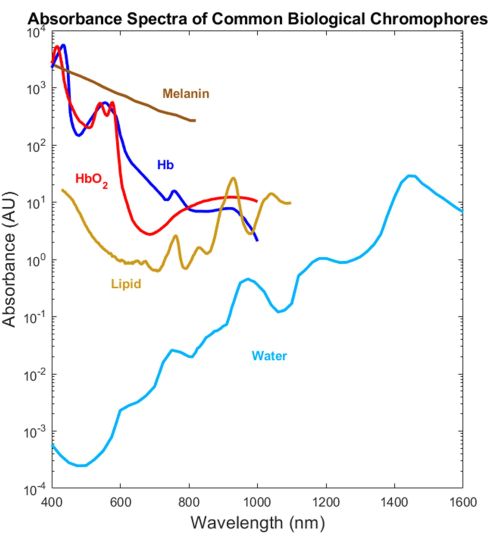
Abbildung 1: Zuvor veröffentlichte Spektren gängiger biologischer Absorber über das UV zum SWIR. Die sauerstoffhaltigen und desoxygenierten Hämoglobinspektren wurden unter Verwendung von Daten von Prahl4 aufgetragen. Das Melaninspektrum wurde unter Verwendung von Daten von Sarna21 und Crippa23 aufgetragen. Das Lipidspektrum wurde mit Daten von van Veen24 aufgetragen. Das Wasserspektrum wurde mit Hilfe von Daten von Hale und Querry20 dargestellt. Abkürzung: SWIR = kurzwelliges Infrarot. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
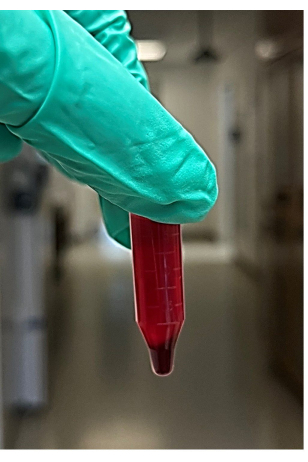
Abbildung 2: Foto des Überstands und des Pellets der roten Blutkörperchen aus zentrifugiertem Vollblut. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
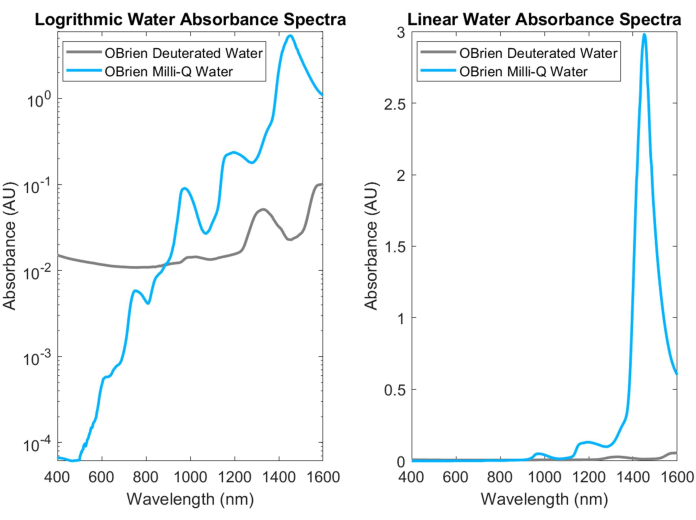
Abbildung 3: Vergleich des Absorptionsspektrums von Wasser und deuteriertem Wasser, das mit identischen Erfassungseinstellungen in der logarithmischen (links) und linearen (rechts) Absorptionsskala gesammelt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
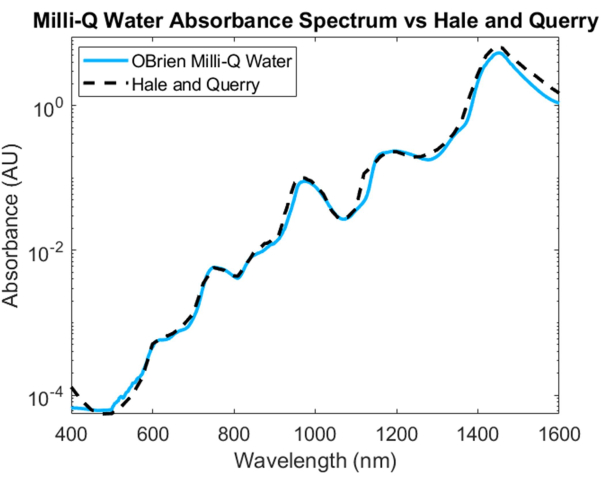
Abbildung 4: Vergleich des Wasserabsorptionsspektrums, das mit den hier beschriebenen Methoden erfasst wurde, mit Hale und Querry20. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
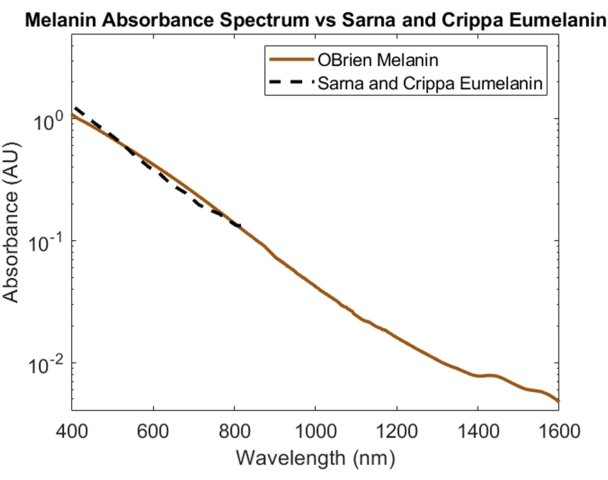
Abbildung 5: Vergleich des Melaninabsorptionsspektrums, das mit den hier beschriebenen Methoden erfasst wurde, mit Sarna et al.21,22 und Crippa et al.23. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
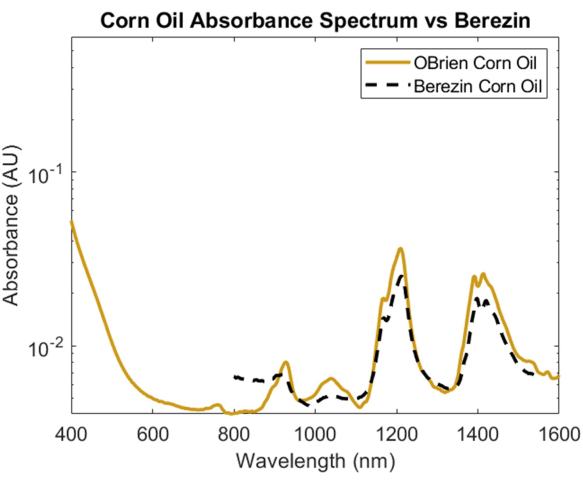
Abbildung 6: Vergleich des Maisöl-Absorptionsspektrums, das mit den hier beschriebenen Methoden erfasst wurde, mit Cao et al.1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
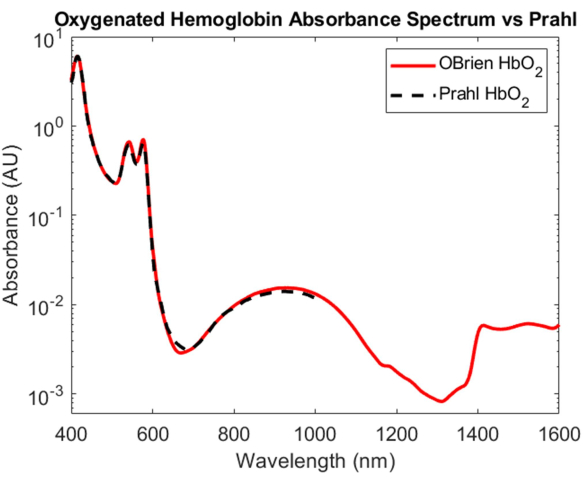
Abbildung 7: Vergleich des sauerstoffhaltigen Hämoglobin-Absorptionsspektrums, das mit den hier beschriebenen Methoden erfasst wurde, mit Prahl4. Spektrale Merkmale von 1.400 bis 1.600 nm sind wahrscheinlich auf das Restwasser in der Probe zurückzuführen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
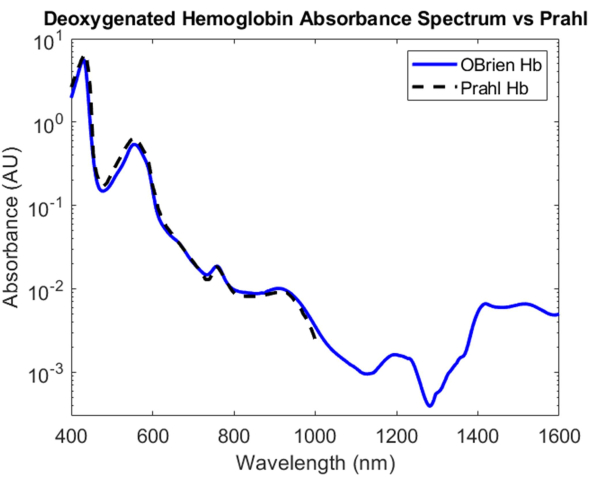
Abbildung 8: Vergleich des deoxygenierten Hämoglobin-Absorptionsspektrums, das mit den hier beschriebenen Methoden erfasst wurde, mit Prahl4. Spektrale Merkmale von 1.400 bis 1.600 nm sind wahrscheinlich auf das Restwasser in der Probe zurückzuführen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
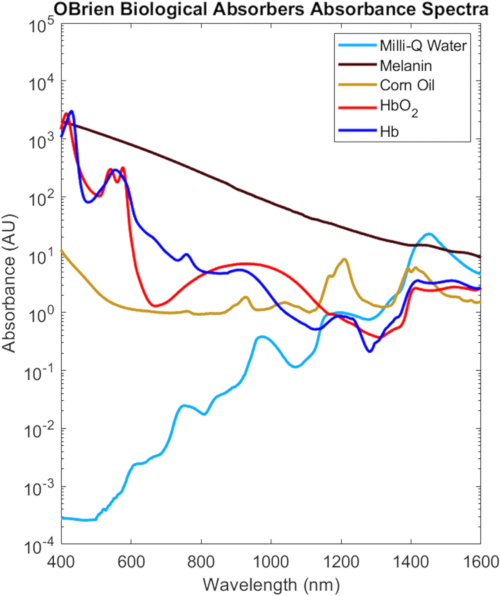
Abbildung 9: VIS-SWIR-Spektren gängiger biologischer Absorber. Abkürzung: VIS-SWIR = sichtbar-kurzwelliges Infrarot. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die in diesem Artikel beschriebenen Protokolle können verwendet werden, um VIS-SWIR-Absorptionsspektren von biologischen Absorbern und Kontrastmitteln zu erhalten. Darin zeigen wir spezifische Schritte zur Gewinnung von Spektren von Wasser, Melanin, Maisöl, sauerstoffreichem Hämoglobin und sauerstoffarmem Hämoglobin im Bereich von 400 nm bis 1.600 nm. Die folgende Diskussion behandelt kritische Schritte, Tipps zur Messoptimierung, Einschränkungen der Methode und Anwendungen dieses Protokolls in der Biomedizin.
Obwohl alle Protokollschritte wichtig sind, müssen einige kritische Schritte befolgt werden, um mit diesem Protokoll genaue Spektren zu erhalten. Zunächst muss die Probe nicht streuend sein; So müssen z.B. bei der Gewinnung von sauerstoffhaltigem und sauerstoffarmem Hämoglobin aus dem Blut die Streuer in der Probe herausgefiltert werden (hier wurde ein 0,22 μm Spritzenvorsatzfilter verwendet). Bei der Herstellung von sauerstoffarmem Hämoglobin sollte die Menge an zugesetztem Natriumdithionit das angegebene Gewicht nicht überschreiten, da dies die Probe bei höheren Gewichtsprozentsätzen trübt und die Anforderungen des Beer-Lambert-Gesetzes ungültig macht.
Zweitens muss deuteriertes Wasser als Probenlösungsmittel und Referenz für wasserlösliche gelöste Stoffe wie Hämoglobin verwendet werden. Im SWIR ist die Wasseraufnahme stark und kann andere Absorber maskieren. Drittens müssen Messungen innerhalb des linearen Bereichs des Detektors erfolgen, der als der Bereich definiert ist, in dem eine Änderung der Photonen, die den Detektor erreichen, zu einer linearen Änderung des Detektorsignals führt. Wenn eine minimale Absorption auftritt, kann der Detektor eine Absorption von Null registrieren, selbst wenn eine Absorption auftritt. Dies tritt auf, wenn die Probe zu verdünnt, die Expositionszeit zu kurz und/oder die Weglänge der Küvette zu kurz ist, kann aber durch eine Erhöhung der Probenkonzentration, der Küvettenweglänge und/oder der Expositionszeit behoben werden. In ähnlicher Weise kann es sein, dass der Detektor bei hoher Absorption keine Photonen registriert und eine flache Linie erzeugt, die als "Sättigung" bezeichnet wird und nicht empfindlich auf Änderungen der Absorption reagiert. Dies tritt auf, wenn die Probe zu konzentriert ist, die Expositionszeit zu kurz ist und/oder die Weglänge zu lang ist, kann aber durch Erhöhung der Probenkonzentration, Verlängerung der Expositionszeit und/oder Verringerung der Schichtdicke der Küvette behoben werden.
Viertens müssen die verwendeten Detektoren linear sein. Wenn unsicher ist, ob der Detektor eine lineare Reaktion auf die Anzahl der Photonen zeigt, die den Detektor erreichen, können verschiedene Verdünnungen einer Probe mit den gleichen Erfassungseinstellungen gemessen werden, um zu überprüfen, ob ihre Absorptionswerte den erwarteten linearen Trend zwischen Absorption und Konzentration zeigen. Alternativ kann eine einzelne Probe gemessen und die Belichtungszeit erhöht werden, um zu testen, ob es zu einem linearen Anstieg der Detektorintensität kommt. Beide Tests sollten einen linearen Zusammenhang ergeben, wenn der Benutzer innerhalb seiner linearen Grenzen arbeitet (siehe den dritten kritischen Punkt oben).
Fünftens müssen die Probenkonzentration, die Belichtungszeit des Detektors und/oder die Weglänge der Küvette für verschiedene Spektralbereiche mit deutlich höherer oder niedrigerer Extinktion aus dem Ausgangsspektralbereich geändert werden, um innerhalb des linearen Bereichs des Detektors für den gesamten VIS-SWIR-Spektralbereich zu bleiben.
Sechstens müssen Spektren, die mit unterschiedlichen Probenkonzentrationen oder Pfadlängen für verschiedene Spektralbereiche aufgenommen wurden, durch lineare Skalierung einer Region auf der Grundlage bekannter Änderungen der Konzentration oder Pfadlänge zusammengefügt werden. Nach der Skalierung sollten die Spektren bei einer überlappenden Wellenlänge zwischen den beiden Bereichen zusammengefügt werden. Wenn sich eine Messung über Messungen von verschiedenen Detektoren erstreckt, sollten sich überlappende Absorptionsspektren vorhanden sein, die die gewünschte Detektorübergangswellenlänge enthalten (800 nm wird üblicherweise beim Stitching von UV-VIS- und SWIR-Bereichen verwendet). Jedes Spektrum wird bei der Detektorübergangswellenlänge abgeschnitten, und ein Spektrum wird so ausgewählt, dass es seinen ursprünglichen Absorptionswert für den Detektorübergang enthält. Dann werden die beiden abgeschnittenen Spektren verkettet, um ein einzelnes längliches Spektrum zu erzeugen.
Zu den zusätzlichen Tipps für die Erfassung hochwertiger Absorptionsspektren gehört die Verwendung eines zuvor veröffentlichten Spektrums der interessierenden Probe, auch wenn es nicht den gesamten zu messenden Spektralbereich abdeckt, um die Messungen zu leiten. Da der Wellenlängenbereich mit der geringsten Extinktion von vornherein bekannt ist, können Messungen in diesem Bereich mit der Probe mit der höchsten Konzentration begonnen und dann von dort aus angepasst und verdünnt werden. Es kann Aufschluss darüber geben, wie viele separate Regionen basierend auf dem Ausmaß der erwarteten Absorptionsänderungen gemessen werden müssen. Es kann auch die Gewissheit geben, dass das erwartete Spektrum erhalten wurde, wenn es mit veröffentlichten Spektren übereinstimmt, oder wenn es nicht mit veröffentlichten Spektren übereinstimmt, kann die Probenvorbereitungsmethode zusammen mit Problemen, die das Spektrum verzerren könnten, erneut überprüft werden.
Absorptionsspektren müssen möglicherweise nachbearbeitet werden. Zum Beispiel kann ein digitaler Filter für den gleitenden Durchschnitt verwendet werden, um Absorptionsmessungen zu glätten, und Punkte mit bekannten Fehlern können mit einer Datensatzreparatur entfernt werden, bei der die fehlerhaften Punkte gelöscht und eine Interpolation zwischen nicht fehlerhaften Punkten durchgeführt wird.
Zu den Einschränkungen dieser Methode gehört die Ungenauigkeit bei Proben mit optischer Streuung, wie z. B. Vollblut. Um das Hämoglobin genau zu messen, wird die Blutprobe lysiert und dann spritzenfiltriert, um die meisten anderen zellulären Restbestandteile zu entfernen, die optische Streuung verursachen. Ebenso wird diese Methode aufgrund der Gewebestreuung in vivo nicht angewendet. Obwohl Absorptionsmessungen, die auf dem Beer-Lambert-Gesetz basieren, langwierig und manchmal schwierig durchzuführen sein können, sind sie die Goldstandardmethode für rein optische Absorptionsmessungen. Darüber hinaus ist es bei einigen Lösungsmitteln besonders schwierig, ein reines Absorptionsspektrum bestimmter gelöster Stoffe zu erhalten. Zum Beispiel ist das native Lösungsmittel von sauerstoffreichem und sauerstoffarmem Hämoglobin Wasser, aber die Absorption von Wasser ist im SWIR stark und dominiert die sauerstoffreiche Hämoglobinabsorption. Daher versuchen wir, Wasser aus dem Blut durch wiederholte Zentrifugation, Entfernung des Überstands und Rekonstitution mit deuteriertem Wasser zu entfernen, das eine schwächere SWIR-Absorption aufweist. Es wird vermutet, dass die resultierenden sauerstoff- und desoxygenierten Hämoglobinspektren aus heparinisiertem menschlichem Vollblut eine geringe Restabsorption aufgrund der Wasserabsorption von etwa 1.300 nm bis 1.600 nm enthalten, wie in Abbildung 3 zu sehen ist. Obwohl dies wahrscheinlich keine perfekte Entflechtung von Wasser von sauerstoffreichem und sauerstoffarmem Hämoglobin ist, beobachten wir eine enge Übereinstimmung mit den viel zitierten veröffentlichten veröffentlichten Hämoglobinspektren von 400 nm bis 1.000 nm und wir erweitern das Spektrum um mehrere hundert Nanometer 2,3.
Die hierin beschriebenen Protokolle werden den Forschern helfen, die Absorptionsspektrenbibliotheken um VIS-SWIR-Spektren einer Vielzahl von biologischen Komponenten und Kontrastmitteln zu erweitern. Dieses Wissen kann genutzt werden, um das Verständnis der grundlegenden Biologie und Physiologie durch nicht-invasive biomedizinische Bildgebung und Sensorik bei tieferen Wellenlängen zu verbessern, als die meisten Systeme derzeit arbeiten. Die Hinzufügung von SWIR-Wellenlängen erweitert die Art der Gewebekomponenten, die nicht-invasiv überwacht werden können, und könnte die Entwicklung neuartiger Überwachungs- und Diagnostika beeinflussen. Darüber hinaus sollten Geräte, die im NIR- und SWIR-Bereich betrieben werden, dazu beitragen, die Verzerrung der Hautpigmentierung zu minimieren, die für optische Geräte im VIS- und NIR-Bereich berichtet wurde, und eine vielversprechende Strategie für die Entwicklung gerechter Medizinprodukte darstellt.
Offenlegungen
Christine O'Brien und Leonid Shmuylovich haben eine finanzielle Beteiligung an Armor Medical Inc. und könnten finanziell davon profitieren, wenn das Unternehmen seine Produkte, die mit dieser Forschung in Verbindung stehen, erfolgreich vermarktet.
Danksagungen
Diese Arbeit wird durch Zuschüsse der National Institutes of Health (NIH) R00HD103954 und R21EB035823 unterstützt. Die in dieser Veröffentlichung berichtete Forschung wurde durch den Zuschuss des Washington University Institute of Clinical and Translational Sciences unterstützt, der vom National Center for Advancing Translational Sciences (NCATS) der National Institutes of Health (NIH) UL1TR002345 wurde. Der Inhalt liegt ausschließlich in der Verantwortung der Autoren und stellt nicht unbedingt die offizielle Meinung der NIH dar. Die Autoren danken den Mitgliedern des O'Brien-Labors, Michael Vahey und seinen Labormitgliedern sowie Huanzhu Jiang für ihre Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm diameter syringe Filters | Sigma-Aldrich | SLGPM33RS | |
| 1000 µL Pipette | Millipore Sigma | EP3124000121 | |
| 200 µL Pipette | Millipore Sigma | EP3124000083 | |
| Conical Tubes | Avantor VWR | 21008-089 | |
| Corn Oil | Happy Belly | n/a | 48 Fl Oz |
| Deuterium Oxide | Cambridge Isotope Laboratories | DLM-4-100 | |
| Deuterium Oxide | Sigma-Aldrich | 7789-20-0 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D5879-1L | |
| Disposable 1 mL Syringe | BH Supplies | BH1LL | |
| Disposable Needle | Atshuhut/Amazon | 66941 | |
| Freezer (-80 °C) | Fisher Scientific | IUE386FARK | |
| Glass Beakers | Millipore Sigma | CLS1000PACK | |
| Glass or Quartz Cuvettes | Sigma-Aldrich | Z802875-1EA | 700 µL volume |
| Glass or Quartz Cuvettes | Thorlabs | CV10Q35EP | 3500 mL volume |
| Heparinized Human Blood | Lampire | 7203710 | |
| Microcentrifuge Tubes | Costar | 3213 | |
| Microcentrifuge--accuSpin Micro 17 | Fisher Scientific | 13-100-675 | |
| MilliQ Water | Millipore Sigma | ZMQSP0D01 | |
| OSRAM FCS 64640 150 W 24 V HLX Halogen Light Bulb | Amazon | B0001221DG | |
| Parafilm | Millipore Sigma | HS234526B | |
| Pipette Tips | Eppendorf | 22492055 | |
| Powdered Synthetic Melanin | Sigma-Aldrich | 8049-97-6 | |
| Scale | Sartorius | UX-11976-09 | |
| Sodium Dithionite | Sigma-Aldrich | 1065070500 | |
| Sonicator | Fisher Scientific | CPX1800 | |
| Spatula | Aozita | 000 00 0 1 2 3 | |
| UV/VIS/SWIR Spectrophotometer | On Line Instrument Systems | Olis Cary 14 | |
| Weigh Boats | Amazon | B07M5RMNPF |
Referenzen
- Cao, Q., Zhegalova, N. G., Wang, S. T., Akers, W. J., Berezin, M. Y. Multispectral imaging in the extended near-infrared window based on endogenous chromophores. J Biomed Opt. 18 (10), 101318 (2013).
- Yao, J., Wang, L. V. Sensitivity of photoacoustic microscopy. Photoacoustics. 2 (2), 87-101 (2014).
- Jacques, S. L. Optical properties of biological tissues: a review. Phys Med Biol. 58 (11), R37 (2013).
- . Optical absorption of hemoglobin Available from: https://omlc.org/spectra/hemoglobin/ (1999)
- Zhang, H., et al. Penetration depth of photons in biological tissues from hyperspectral imaging in shortwave infrared in transmission and reflection geometries. J Biomed Opt. 21 (12), 126006 (2016).
- Du, T., et al. Hyperspectral imaging and characterization of allergic contact dermatitis in the short-wave infrared. J Biophotonics. 13 (9), e202000040 (2020).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Mueller, G. J. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J Biomed Opt. 4 (1), 36-46 (1999).
- Kuenstner, J. T., Norris, K. H. Spectrophotometry of human hemoglobin in the near infrared region from 1000 to 2500 nm. J Near Infrared Spectrosc. 2 (2), 59-65 (1994).
- Spectral subtraction. Available from: https://www.spectroscopyonline.com/view/spectral-subtraction (2021)
- Sjoding, M. W., Dickson, R. P., Iwashyna, T. J., Gay, S. E., Valley, T. S. Racial bias in pulse oximetry measurement. N Engl J Med. 383 (25), 2477-2478 (2020).
- Fawzy, A., et al. Racial and ethnic discrepancy in pulse oximetry and delayed identification of treatment eligibility among patients with COVID-19. JAMA Intern Med. 182 (7), 730-738 (2022).
- Sudat, S. E. K., et al. Racial disparities in pulse oximeter device inaccuracy and estimated clinical impact on COVID-19 treatment course. Am J Epidemiol. 192 (5), 703-713 (2023).
- Keller, M. D., Harrison-Smith, B., Patil, C., Arefin, M. S. Skin colour affects the accuracy of medical oxygen sensors. Nature. 610 (7932), 449-451 (2022).
- Butler, W. L. Absorption spectroscopy of biological materials. Methods Enzymol. 24, 3-25 (1972).
- Tang, J., et al. Calculation extinction cross sections and molar attenuation coefficient of small gold nanoparticles and experimental observation of their UV-vis spectral properties. Spectrochim Acta A Mol Biomol Spectrosc. 191, 513-520 (2018).
- Rossman, G. R. Optical spectroscopy. Rev Mineral Geochem. 78 (1), 371-398 (2014).
- Thimsen, E., Sadtler, B., Berezin, M. Y. Shortwave-infrared (SWIR) emitters for biological imaging: a review of challenges and opportunities. Nanophotonics. 6 (5), 1043-1054 (2017).
- Briely-Sabo, K., Bjornerud, A. Accurate de-oxygenation of ex-vivo whole blood using sodium dithionite. Proc Intl Sot Mag Reson Med. 8, 2025 (2020).
- Skoog, D. A., Holler, F. J., Crouch, S. R. Principles of instrumental analysis. Cengage Leaning. , (2019).
- Hale, G. M., Querry, M. R. Optical constants of water in the 200-nm to 200-microm wavelength region. Appl Opt. 12 (3), 555-563 (1973).
- Sarna, T., Sealy, R. Photoinduced oxygen consumption in melanin systems. Action spectra and quantum yields for eumelanin and synthetic melanin. Photochem Photobiol. 39 (1), 69-74 (1984).
- Sarna, T., Swartz, H. A., Nordlund, J. J. The physical properties of melanins. The pigmentary system: Physiology and pathophysiology. , 311-341 (2006).
- Crippa, P., Cristofoletti, V., Romeo, N. A band model for melanin deduced from optical absorption and photoconductivity experiments. Biochim Biophys Acta. 538 (1), 164-170 (1978).
- van Veen, R., et al. Determination of visible near-IR absorption coefficients of mammalian fat using time- and spatially resolved diffuse reflectance and transmission spectroscopy. J Biomed Opt. 10 (5), 054004 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten