Method Article
Realistic Absorption Spectra Spantra Spanling Spaning the Visible to the Short-Wave Infrared(생물학적 흡수 스펙트럼의 특성화: 가시광선에서 단파 적외선까지)
요약
생물학적 샘플은 가시광선(VIS) 및 근적외선(NIR) 파장 범위와 비교하여 단파 적외선(SWIR)에서 뚜렷한 광학 특성을 가지고 있습니다. 그러나 순수한 SWIR 흡수 스펙트럼을 기록하는 것은 까다로우며 생물학적 분자에 대해 수행되는 경우가 거의 없습니다. 이 논문에서는 생물학적 흡수체의 VIS-SWIR 흡수 스펙트럼을 특성화하는 방법을 제시합니다.
초록
비침습적 광 기반 생리학적 모니터링을 위해 흡수 분광법을 사용하여 개별 조직 구성 요소의 최적 파장을 식별할 수 있습니다. 그러나 장파장에서는 하드웨어의 감도가 부족하기 때문에 흡수 분광법은 일반적으로 400nm에서 1,000nm의 가시광선(VIS) 및 근적외선(NIR) 범위의 파장에 적용되었습니다. 단파 적외선(SWIR) 범위의 하드웨어 발전으로 연구자들은 ~1,000nm에서 3,000nm 범위의 파장을 탐색할 수 있게 되었으며, 여기서 지질, 단백질 및 물에 대한 낙하 특성 흡수 피크를 탐색할 수 있었습니다. 이러한 분자는 VIS-NIR에서 시각화하기 어렵고 생물학적 대비의 표지가 없는 소스를 제공할 수 있습니다. 또한, 피부 색소 침착을 담당하는 주요 발색단인 멜라닌에 대한 낮은 SWIR 흡수가 관찰되었습니다. 임상적으로 표준적인 맥박 산소 측정기와 같은 생체 내 광학 장치는 VIS 범위에서 더 강한 멜라닌 흡수 때문일 수 있는 어두운 색소 피부를 가진 사람들에서 정확도가 감소하는 것으로 밝혀졌습니다. 따라서, 피부 색소 침착과 관련된 오류는 SWIR에서 작동하는 장치를 사용함으로써 감소될 수 있다. 광학 기기 설계는 VIS에서 SWIR 범위에 이르는 핵심 조직 구성 요소의 흡수 특성을 이해함으로써 촉진됩니다. 이 문서에서는 일반적인 조직 흡수체(산소화 헤모글로빈, 탈산소화 헤모글로빈, 멜라닌, 수분 및 지질)의 VIS-SWIR 흡수 스펙트럼을 얻기 위한 프로토콜 및 기기에 대해 설명합니다.
서문
대부분의 생물학적 흡수체는 가시광선(VIS, ~400-700nm) 및 근적외선(NIR, ~700-1,000nm) 스펙트럼 범위에서 광학적으로 특성화되었지만 단파 적외선(SWIR, ~1,000-3,000nm)1,2,3,4는 그렇지 않습니다(그림 1). 이는 SWIR이 조직 산란이 적고 멜라닌 흡수가 감소하여 더 깊은 빛 투과를 제공할 뿐만 아니라 물, 지질 및 단백질에 대한 추가적인 무표지 생물학적 대조를 제공함에도 불구하고발생합니다 1,5,6. VIS-SWIR에 걸친 흡수 스펙트럼의 부족으로 인해 이러한 SWIR의 이점을 활용하는 생체 의학 광학 장치의 개발을 방해하는 지식의 격차가 발생했습니다. 과거에 스펙트럼을 특성화하려는 여러 시도가 제시되었지만, 유의미한 용매 인공물이 없는 순수 성분의 고품질 VIS-SWIR 흡수 스펙트럼은 부족합니다 1,7,8. 예를 들어, 헤모글로빈과 같은 수용성 물질은 물을 용매로 사용하고 결과 스펙트럼9에서 순수한 물 흡수를 뺀 SWIR에서 특성화되었습니다. 그러나 물이 이 지역에서 지배적인 흡수체이기 때문에 이 접근 방식의 정확성은 불분명합니다.
SWIR에서 작업하면 in vivo 광학 진단을 사용할 때 VIS의 강력한 멜라닌 흡수로 인한 바이어스를 줄이거나 제거할 수 있는 추가적인 이점이 있습니다. 수많은 연구에서 맥박 산소 측정기가 흑인 환자의 산소 농도를 과대평가한다는 사실이 밝혀졌으며, 따라서 흑인 환자는 산소 농도계가 감지하지 못한 위험할 정도로 낮은 산소 농도를 가질 가능성이 더 높습니다10. 이러한 피부 색소 편향은 많은 흑인 저산소 환자에 대한 의학적 치료가 지연되고 부적절한 결과를 낳았으며, 11,12 모든 피부색에 대한 광학 장치의 정확도를 개선하기 위해 광학 및 엔지니어링 커뮤니티에 행동을 촉구했습니다13. 멜라닌을 많이 흡수하는 VIS 파장에서 NIR 및 SWIR로 전환하는 것은 매우 중요한 생체 의학 광학 기술에서 인종 간 격차를 줄일 수 있는 흥미로운 기술 혁신 중 하나입니다.
생체 분자의 실측 흡수 스펙트럼을 기록하는 것은 다양한 엔지니어링 및 생물 의학 응용 분야에 사용되는 조직 샘플의 광학적 특성을 이해하는 데 필수적입니다14. 흡수 분광법(Absorption spectroscopy)은 파장의 함수로서 분자 특이적 광 흡수를 측정합니다. 용액에서 흡수 측정을 획득하는 황금 표준 방법은 용해된 샘플을 통해 시준된 단색 광을 유도하고 광원에서 샘플의 반대쪽에 배치된 검출기로 투과광을 기록하는 것입니다. 그런 다음 샘플의 흡수(A)는 식 (1)에 의해 정의됩니다.
A = 로그10(I0/I) (1)
여기서 Io 는 샘플의 입사광 강도이고 I는 샘플을 통해 투과되어 검출기에 부딪히는 빛의 강도입니다. Io 는 I와 동일한 획득 설정을 사용하여 일반적으로 관심 용질의 용매인 기준을 측정하여 획득합니다. 흡수 분광법은 정량적 흡수 특성을 제공하며 광학 산란이 있는 샘플에는 적용되지 않는 Beer-Lambert 법칙(식 2)의 적용을 받습니다. 이 방정식은 광학 흡수가 파장 λ에서 샘플의 몰 흡수 계수(ε, 단위 L·mol−1·cm−1)에 몰 농도(C, 단위 mol∙L-1) 및 경로 길이(L, 단위 cm)를 곱한 값에 의해 결정되며, 이는 샘플15를 통해 이동한 거리로 정의됩니다.
ᅡ(λ) = ε(λ)*L*C (2)
중요한 것은 몰 흡수 계수(molar absorpity coefficient)가 각 생물학적 흡수체마다 고유하며 샘플이 특정 파장16에서 빛을 얼마나 강하게 흡수하는지를 나타낸다는 것입니다.
VIS에서 SWIR에 이르는 흡수 분광법 측정을 수행할 때 표준 VIS-NIR 스펙트럼 이상으로 하드웨어, 시료 전처리 및 스펙트럼 후처리에 대한 조정이 필요합니다.
하드웨어
VIS-NIR 측정은 일반적으로 UV-VIS 광자에 민감한 광음극이 있는 실리콘 검출기 또는 광전자 증배관(PMT)을 사용하는 반면, SWIR 흡광도에는 InGaAs(Indium Gallium Arsenide) 검출기17와 같이 SWIR 광자에 민감한 광검출기가 필요합니다. 또한 VIS, NIR 및 SWIR 시스템은 일반적으로 이러한 광학 범위에서 광 분산을 위해 광학 격자와 같은 파장별 분산 요소를 필요로 합니다. 또한 SWIR 흡수에는 유리 또는 석영 큐벳이 필요한데, 이는 SWIR의 플라스틱 큐벳보다 투과율이 높기 때문에 VIS-SWIR 스펙트럼에 더 적합합니다. 광원 또는 VIS-SWIR을 포괄하는 광범위하고 비교적 균일한 방출을 가진 광원(예: 텅스텐 할로겐 램프(이 프로토콜에 사용됨)을 선택해야 합니다. 입사광의 강도, 노출 시간 또는 광검출기가 빛에 노출되는 시간을 조정하면 흡광도 측정을 최적화하는 데 도움이 될 수 있습니다.
시료 전처리
샘플의 농도 또는 큐벳의 경로 길이는 상기 식 (2)에서 기술된 바와 같이 발생하는 흡수량을 선형적으로 변경하며, 따라서 상대적으로 높거나 낮은 스펙트럼의 다른 섹션에서 높은 신호 대 잡음비(SNR, 본 명세서에서 피크 진폭의 비율을 스펙트럼의 디트랜드된 영역의 표준 편차로 나눈 값으로 계산됨, 일반적으로 SNR > 30은 고품질로 간주됨) 측정을 달성하기 위해 변경될 수 있습니다 흡 광도. 수용액에서 SWIR 측정을 최적화하기 위해SWIR 1에서 흡수 피크가 현저히 낮기 때문에 중수 또는 중수소수라고도 하는 중수소 산화물(D2O)을 물(H2O) 대신 사용할 수 있습니다. 이를 통해 SWIR에서 지배적인 수분 흡수의 간섭 없이 용질의 특성을 분석할 수 있습니다.
스펙트럼 후처리
VIS-SWIR 스펙트럼에는 가시광선-NIR(일반적으로 실리콘 또는 UV-VIS에 민감한 PMT)과 SWIR(일반적으로 InGaAs)에 대한 검출기 두 개가 필요하기 때문에 후처리가 필요하며, 전체 VIS-SWIR 스펙트럼을 얻기 위해 스펙트럼을 함께 연결해야 합니다. 스펙트럼이 VIS-SWIR에 걸쳐 있을 때 흡수는 파장 영역에 따라 크게 달라질 수 있으며, 포화를 방지하기 위해 일부 영역에서 샘플을 희석하거나 경로 길이를 줄여야 할 수 있습니다. 스펙트럼은 시료 농도 또는 경로 길이의 변화를 고려하여 선형으로 확장한 다음 두 개의 파장 영역을 포함하는 단일 스펙트럼을 생성하기 위해 함께 연결해야 합니다.
다음 프로토콜은 VIS에서 5가지 예시 생물학적 흡수제의 SWIR에 이르는 준비 및 분광 측정을 자세히 설명합니다: 물(체중의 ~60%를 차지함), 멜라닌(피부 색소 침착을 위한 1차 흡수제), 옥수수 오일(배치 간 변동성이 낮고 화학 성분이 인간과 동물의 지질에 가깝기 때문에 인간 지질의 유사체로 사용됨), 및 최소 산란), 산소화 및 탈산소화 헤모글로빈(혈액의 주요 흡수체).
프로토콜
1. 샘플 준비
- 물 샘플의 준비
- 샘플을 준비하려면 깨끗한 용기에 초순수를 채우고 0.22μm 주사기 필터를 사용하여 여과합니다. 주사기의 출력이 깨끗한 유리 또는 석영 큐벳으로 향하도록 하여 샘플의 흡수 분광법 측정을 수행하는지 확인하십시오.
- 참조를 준비하려면 깨끗한 용기에 중수소수를 채우고 0.22μm 주사기 필터를 사용하여 여과합니다. 주사기의 출력이 샘플과 동일한 깨끗한 유리 또는 석영 큐벳으로 향하는지 확인하십시오.amp참조 역할을 하는 큐벳.
참고: 여과 단계는 가시 영역에서 강한 기여를 하는 물 속의 작은 미립자를 걸러냄으로써 샘플의 광학 산란을 최소화합니다.
- 멜라닌 시료의 제조
- 3.5mL의 디메틸설폭사이드(DMSO)로 채워진 원심분리 튜브에 분말 멜라닌을 첨가하여 1.7mg/mL의 멜라닌 용액을 준비합니다. 시작하려면 측정은 가장 높은 농도의 멜라닌이 필요한 가장 낮은 예상 흡수를 가진 파장에서 시작해야 합니다. SWIR에 대해 약 1.7 mg/mL로 멜라닌 측정을 시작하고 나중에 DMSO로 희석하여 VIS/NIR 영역에 대해 10배 희석(약 0.17 mg/mL)합니다.
- 튜브를 10분 동안 초음파 처리하여 분말화된 멜라닌이 DMSO에 용해되도록 하고 분광학 측정을 위해 용액을 깨끗한 유리 또는 석영 큐벳으로 옮깁니다.
- 분광기의 선형 흡광도 범위 내에서 농도 및/또는 경로 길이를 변경하여(예: 짧은 경로 길이(1 또는 2mm)에서 10mm 경로 길이 큐벳으로 전환하여) 높은 SNR 측정을 보장합니다. 멜라닌 흡수는 VIS에서 SWIR에 이르기까지 광범위한 범위를 가지고 있습니다. VIS의 경우, 높은 몰 소광 계수로 인해 가장 낮은 농도 및/또는 경로 길이의 멜라닌 큐벳을 사용합니다. SWIR의 경우 가장 높은 농도의 멜라닌 및/또는 경로 길이 큐벳을 사용하여 정성적으로 깨끗한 분광법 측정을 얻습니다.
- 옥수수 기름 샘플의 제조
- 분광학 측정을 위해 깨끗한 유리잔이나 석영 큐벳에 옥수수 기름을 첨가합니다.
- 야외를 참조로 사용하십시오. 큐벳이나 용액은 참조로 사용되지 않습니다.
- 전체 heparinized human blood를 사용한 산소화된 헤모글로빈 샘플의 준비
참고: 헤파린화된 인간 혈액 전체를 구입하여 미국에 위치한 FDA 허가 수집 센터에서 수집했습니다.- 적혈구(RBC)에서 헤모글로빈을 분리하고 혈액에서 가능한 한 많은 수분을 제거하기 위해 먼저 헤파린화된 인간 혈액 1,800μL를 마이크로 원심분리기 튜브에 넣고 9.6× g 에서 10분 동안 원심분리합니다.
참고: 약 4-6개의 마이크로 원심분리기 튜브가 권장됩니다. - 원심분리 후 마이크로 원심분리기에서 튜브를 제거한 다음 펠릿을 방해하지 않고 원심분리된 혈액 샘플에서 상층액(약 850μL)을 제거하고 폐기합니다(그림 2). 상등액은 적혈구 펠릿 위의 액체(주로 혈장과 혈소판)를 포함합니다. 마이크로 원심분리기 튜브 바닥에 있는 적혈구 펠릿을 찾으십시오.
- 폐기된 상등액의 부피와 동일한 부피의 중수소수로 각 펠릿을 재구성합니다. 9.6 ×g에서 10 분 동안 다시 원심분리기를 사용합니다.
- 원심분리기에서 튜브를 제거한 다음 펠릿을 방해하지 않고 상등액을 버립니다.
- 폐기된 상등액의 부피와 동일한 부피의 중수소수로 펠릿을 재구성합니다. 9.6×g에서 10 분 동안 재 원심분리합니다.
- 원심분리기에서 튜브를 제거한 다음 피펫을 사용하여 상층액을 제거하고 폐기합니다.
- 적혈구(RBC) 용해: 적혈구 펠릿을 다량(4.5mL)의 중수소수로 재구성하면 저장성 폭발이 발생합니다. 펠릿이 튜브에 달라붙으면 측정된 4.5mL의 중수소수로 헹구어 느슨하게 합니다.
알림: 상등액의 부피는 각 원심분리 단계 후에 증가합니다. 이 상층액의 부피는 800 μL에서 1,600 μL까지 다양합니다. 용해를 위한 중수소수의 양은 원하는 샘플 농도에 따라 변경될 수 있지만 저장성 파열을 일으킬 수 있을 만큼 충분히 높아야 합니다. - 바늘과 주사기로 튜브에서 용해된 혈액 용액을 제거합니다. 그런 다음 끝이 뭉툭한 주사기 바늘을 조심스럽게 제거하고 생물학적 위험 날카로운 물건 용기에 버립니다. 주사기를 0.22μm 주사기 필터에 연결하고 주사기 내용물을 필터를 통해 10mm 경로 길이, 3.5mL 유리 또는 석영 큐벳으로 밀어 넣습니다.
참고: 여과 단계는 용액의 세포 소기관과 멤브레인을 필터링하여 샘플의 광학 산란을 최소화합니다. 샘플의 농도가 높고 주사기 필터를 밀기 어려워지면 여러 개의 주사기 필터를 사용하십시오. - 공기로 인한 수증기가 샘플을 오염시키는 것을 방지하기 위해 큐벳 위에 밀폐 마개로 큐벳을 고정합니다. 마개 외부를 파라필름으로 처리하여 오염을 더욱 방지하고 기밀 밀봉을 보장합니다.
참고: 600nm에서 1,600nm까지 측정하기 위해 4.5mL의 중수소수에 용해된 약 1,200-1,600μL의 펠릿은 질적으로 깨끗한 측정을 제공합니다.
참고: 기대 흡광도(400nm - 600nm)가 높은 스펙트럼 영역의 경우 samp불포화 흡광도 값을 얻고 흡광도 값이 검출기의 선형 범위 내에 있는지 확인하기 위해 중수소수를 사용하여 샘플을 희석해야 합니다. 또한 샘플과 참조는 짧은 경로 길이의 큐벳(1mm 또는 2mm)에 배치해야 합니다. 본원에 나타난 스펙트럼에 대해, 샘플은 400-500 nm에 대해 10배 및 500-600 nm에 대해 5배를 희석하고, 2 mm 경로 길이의 큐벳에서 측정하였다.
경로 길이(1mm 또는 2mm)가 짧으면 흡수율이 높은 파장에서 광 흡수율이 낮아 일부 광자가 검출기로 투과하고 선형 검출 범위 내에 유지되도록 할 수 있습니다. - 여과된 혈액 용액이 들어 있는 샘플 큐벳과 경로 길이 및 부피가 동일한 깨끗한 큐벳을 얻고 기준선 및 참조 측정을 위해 중수소화된 물로 채웁니다. 서로 다른 스펙트럼 범위에 대한 큐벳 경로 길이를 변경하는 경우 각 큐벳 경로 길이에 대한 새 참조 스펙트럼을 기록합니다.
- 적혈구(RBC)에서 헤모글로빈을 분리하고 혈액에서 가능한 한 많은 수분을 제거하기 위해 먼저 헤파린화된 인간 혈액 1,800μL를 마이크로 원심분리기 튜브에 넣고 9.6× g 에서 10분 동안 원심분리합니다.
- 전체 헤파린화된 인간 혈액을 사용한 탈산소화된 헤모글로빈 샘플의 준비
- 1.4.1-1.4.8 단계를 수행합니다.
- 큐벳의 혈액 용액에 디티오나이트나트륨을 넣고 부드럽게 저어줍니다. 공기로 인한 수증기가 샘플을 오염시키는 것을 방지하기 위해 큐벳 위에 밀폐 마개로 큐벳을 고정합니다. 마개 외부를 파라필름으로 처리하여 오염을 더욱 방지하고 기밀 밀봉을 보장합니다. 큐벳을 조심스럽게 좌우로 기울여 디티오나이트 나트륨이 용액에 용해되도록 합니다. 혈액 용액은 빨간색에서 더 어두운 자주색-빨간색으로 바뀝니다.
참고: 헤모글로빈을 완전히 탈산소화하기 위해 필요한 디티오나이트나트륨의 질량은 혈액 용액 mL당 약 0.007g입니다. Briley-Sӕbø와 Bjørnerud에 따르면, 전혈을 완전히 탈산소화하려면 최소 2.5mg의 디티오나이트나트륨/혈액 g이 필요합니다18. 그러나 본 연구에서는 이 농도가 불충분한 것으로 밝혀졌다. 약 3.4mg/g의 전혈 농도는 광학 산란의 도입 없이 혈액 용액을 완전히 탈산소화하는 것으로 밝혀졌습니다. 400 - 600 nm에서 측정하려면 혈액 용액을 중수소수로 희석해야 합니다. 희석 후의 부피가 아닌 사용된 bood 용액의 부피를 기준으로 필요한 sodium dithionite 질량을 계산합니다. 600 nm에서 1,600 nm까지의 측정의 경우, 4.5 mL의 중수소수에 용해된 약 1,200-1,600 μL의 펠릿은 높은 SNR 측정을 제공합니다.
경로 길이가 짧은 큐벳(1mm 또는 2mm)은 흡수율이 높은 파장에서 광 흡수를 줄여 일부 광자가 검출기를 통해 전달되고 선형 검출 범위 내에 유지되도록 합니다. - 기준선 및 참조 측정을 위해 여과된 혈액 용액이 있는 큐벳과 경로 길이가 일치하는 다른 큐벳을 중수소수로 채웁니다. 서로 다른 스펙트럼 범위에 대한 큐벳 경로 길이를 변경하는 경우 각 큐벳 경로 길이에 대한 새 참조 스펙트럼을 기록합니다.
2. 고품질 흡수 측정 얻기
- 섹션 1에 설명된 대로 샘플과 참조 자료를 준비하고 VIS NIR-SWIR 측정을 위해 유리 또는 석영 큐벳에 넣습니다. 분광계 램프를 켜고 감지기를 사용하고 분광계 시스템과 광원에 따라 시스템이 최소 5-20분 동안 예열되도록 합니다.
참고: 5분은 여기에 수집된 스펙트럼에 대해 충분한 검출기 냉각 및 램프 출력 안정성을 제공했지만, 이는 흡광도 측정을 캡처하기 전에 각 시스템에 대해 특성화되어야 합니다.
이 수집 기간 동안 샘플과 참고 자료를 가까운 곳에 보관하십시오. 큐벳의 뚜껑이 단단히 고정되어 있는지 확인하십시오. 주변광에 의한 흡수 측정의 왜곡을 방지하기 위해 측정 공간을 가능한 한 어둡게 유지하십시오. - VIS-SWIR에서 흡수의 큰 변동으로 인해 스펙트럼의 다른 영역에 대해 다음 단계를 반복합니다.
- 이중 빔 구성(샘플 및 참조를 위한 두 개의 별도 검출기)을 사용하는 경우 시스템이 기준선인지 확인하십시오. 용매가 포함된 동일한 참조 샘플을 각 검출기 앞에 배치하여 기준선을 획득하고 샘플 흡광도 스펙트럼 수집에 사용할 정확한 수집 파라미터를 사용하여 흡광도 측정을 수집합니다. 검출기는 이론적으로 흡수율이 0인 것으로 표시되어야 하지만 일반적으로 완벽하지는 않습니다. 동일한 설정을 사용하여 획득한 모든 시료 흡광도 스펙트럼에서 결과 흡광도 스펙트럼을 뺍니다.
참고: 데이터 수집을 위한 수집 설정이 변경될 때마다 기준선을 반복해야 합니다. - 샘플을 분광계에 놓고 측정할 영역과 관련된 검출기(VIS-NIR = 실리콘 또는 UV-VIS PMT, SWIR = InGaAs)를 선택하고 측정 매개변수가 조정됨에 따라 측정이 지속적으로 업데이트되는 라이브 모드에서 흡광도를 확인합니다.
- 기본 분광계 매개변수부터 시작하여 포화 없이 질적으로 깨끗한 흡수 스펙트럼을 얻을 때까지 입사광 출력 과 노출 시간을 조정합니다.
- 파라미터를 튜닝해도 스펙트럼이 질적으로 깨끗해지지 않으면 입사광 파워, 노출 시간, 경로 길이 및 샘플 농도와 같은 파라미터를 수정하십시오. 먼저 파워 와 노출 시간을 조정해 보십시오. 이러한 파라미터를 조정해도 높은 SNR 스펙트럼이 생성되지 않으면 샘플 농도 또는 샘플과 참조의 경로 길이를 변경합니다.
참고: 본 명세서에 나타난 스펙트럼 수집에 사용된 기본 매개변수는 400nm에서 15nW , 1,000nm에서 20nW 의 입사광 출력, 노출 시간 30ms, 큐벳 경로 길이 10mm 및 시료 특이적 농도: 100% 물, 멜라닌 1.7mg/mL, 100% 옥수수유, 산소화 헤모글로빈(15.9g /dL), 및 탈산소화 헤모글로빈(15.9g /dL). - SNR을 늘리려면 데이터 포인트당 평균 데이터 읽기 수를 늘립니다. 평균 데이터 읽기 수가 많을수록 측정당 시간이 길어집니다.
- 스펙트럼 분해능을 높이려면 측정의 단계 크기(nm)를 분광계의 분해능 한계까지 줄이십시오. 이렇게 하면 측정당 시간이 늘어납니다. 또한 입사광 전력 대역폭을 가장 좁은 피크의 전체너비의 1/10(절반 최대19)로 줄입니다.
- 측정 설정이 샘플에 최적화되면 수집된 각 스펙트럼에 대한 설정을 문서화합니다.
- 스펙트럼을 얻으려면 최적화된 설정을 사용하여 기준만 측정하십시오. 다음으로, 기준 큐벳을 샘플 큐벳으로 교체하고 다시 측정합니다. reference 와 sample 측정값을 모두 별도로 저장해야 합니다.
참고: 기준 측정이 포화되지 않아야 합니다. 그렇다면 포화가 없을 때까지 입사광 전력 및/또는 노출 시간을 줄이십시오. 모든 시스템 매개변수를 기준과 샘플 측정 간에 동일하게 유지하십시오. 하나를 변경해야 하는 경우 다른 하나도 일치하도록 반복해야 합니다. - 참조 및 샘플 측정의 각 쌍 세트에 대해 참조 측정값을 Io로 처리하고 샘플 측정값을 I로 처리하여 흡광도 A(Eq 1)를 계산합니다.
- 샘플 농도 또는 경로 길이의 차이가 필요한 여러 영역을 함께 연결하려면 스펙트럼 영역 중 하나에 곱셈 계수를 적용하십시오. 예를 들어, 농도의 1/10을 가지며 두 번째 영역과 동일한 경로 길이를 가진 첫 번째 영역의 경우 첫 번째 스펙트럼 영역에 10을 곱하여 두 영역을 적절하게 함께 스케일링합니다.
참고: 곱셈 계수는 영역 간의 농도 및/또는 경로 길이의 차이여야 합니다. - 스펙트럼이 경로 길이 또는 농도의 차이에 대해 보정되면 두 스펙트럼 영역에서 중첩되는 파장을 선택하여 두 영역을 함께 스티칭합니다.
- 두 스펙트럼을 겹침 파장에서 끝내도록 자릅니다. 천이 스펙트럼 값을 포함할 스펙트럼을 하나 선택합니다. 두 개의 잘린 스펙트럼을 결합하여 더 넓은 파장 범위의 단일 결과 스펙트럼을 생성합니다.
- 파라미터를 튜닝해도 스펙트럼이 질적으로 깨끗해지지 않으면 입사광 파워, 노출 시간, 경로 길이 및 샘플 농도와 같은 파라미터를 수정하십시오. 먼저 파워 와 노출 시간을 조정해 보십시오. 이러한 파라미터를 조정해도 높은 SNR 스펙트럼이 생성되지 않으면 샘플 농도 또는 샘플과 참조의 경로 길이를 변경합니다.
- 이중 빔 구성(샘플 및 참조를 위한 두 개의 별도 검출기)을 사용하는 경우 시스템이 기준선인지 확인하십시오. 용매가 포함된 동일한 참조 샘플을 각 검출기 앞에 배치하여 기준선을 획득하고 샘플 흡광도 스펙트럼 수집에 사용할 정확한 수집 파라미터를 사용하여 흡광도 측정을 수집합니다. 검출기는 이론적으로 흡수율이 0인 것으로 표시되어야 하지만 일반적으로 완벽하지는 않습니다. 동일한 설정을 사용하여 획득한 모든 시료 흡광도 스펙트럼에서 결과 흡광도 스펙트럼을 뺍니다.
결과
데이터는 WUSTL DRMR(Digital Research Materials Repository) doi: https://doi.org/10.7936/6RXS-108249
물의 스펙트럼 특성화
가장 일반적인 생물학적 흡수제 중 하나인 물은 NIR과 SWIR에서 특징적으로 흡수율이 높은 피크를 가지고 있습니다. 이러한 특징적인 피크는 너무 강하여 물의 흡광도를 측정할 때 포화를 방지하기 위해 종종 중수소 물로 희석해야 합니다. 물과 중수소 물의 흡광도 차이는 그림 3에 나와 있으며, 이는 중수소 물에 비해 물 흡수도가 한 자릿수 이상 증가했음을 강조합니다. 또한 SWIR의 강한 수분 흡수는 샘플에 물을 포함하거나 물을 용매 및 기준으로 사용하는 다른 생물학적 흡수제의 흡수 스펙트럼을 얻기 어렵게 만듭니다. 이 문제에 대한 해결책으로 물 대신 중수소수를 사용할 수 있습니다. 중수소 처리된 물은 물과 유사한 방식으로 작용하지만 훨씬 약한 SWIR 흡수체이므로 SWIR 분광법 측정에서 물을 대체하는 데 이상적입니다.
물의 흡수 스펙트럼을 측정하기 위해 물을 샘플로, 중수소 물을 기준으로 사용했습니다. SWIR의 포화를 방지하기 위해 샘플을 SWIR 영역에서 중수소수로 희석했습니다. 그 결과 수분 흡수 스펙트럼은 VIS에서 낮은 흡수를 보여주며, 이는 더 긴 파장에서 증가합니다. 특징적인 흡수 피크는 약 750nm, 970nm, 1,200nm 및 1,450nm에서 볼 수 있습니다(그림 4). 그 결과 생성된 물 스펙트럼은 3536.6의 SNR을 가지며 Hale과 Querry의 수분 흡수 스펙트럼20과 비교하여 ~500nm에서 1,600nm까지 유사한 흡수 곡선을 보여주었습니다. 그러나 400nm에서 500nm까지는 흡수 곡선이 다르며 Hale과 Querry는 더 낮은 파장에서 더 높은 흡광도 값을 보여줍니다. 이러한 차이는 물 속에 남아 있는 작은 입자가 긴 파장에 비해 짧은 파장에서 더 높은 산란을 일으키기 때문일 수 있으며3 Beer-Lambert 법칙 기반 흡수 측정에서 산란이 없다는 가정을 무효화할 수 있습니다.
멜라닌의 스펙트럼 특성화
피부의 주요 광학 흡수체인 멜라닌은 분말 멜라닌을 샘플로, DMSO를 용매 및 참조로 사용하여 스펙트럼 특성화되었습니다. 결과 스펙트럼은 172의 SNR을 가지며 Sarna et al.21,22 및 Crippa et al.23의 유멜라닌 데이터와 비교되었습니다(그림 5). 유멜라닌은 피부색을 담당하는 1차 색소이므로 멜라닌이 광학 장치에 어떤 영향을 미치는지에 대한 가장 정확한 데이터를 제공합니다. 본 명세서에 기술된 프로토콜을 사용하여 수집된 스펙트럼은 이러한 문헌 값들에 대한 높은 상관관계를 보여준다.
옥수수 기름의 스펙트럼 특성화
지질의 흡수 스펙트럼을 조사하기 위해 옥수수 기름은 다른 지질과 비교할 때 광학 산란이 최소화되고 동물성 지방과 화학적 조성이 유사한 것으로 알려져 있기 때문에 선택되었습니다1. 옥수수 기름의 흡수 스펙트럼을 취하기 위해 옥수수 기름을 샘플로 사용하고 공기를 기준으로 사용했습니다. 그림 6에서 볼 수 있듯이 옥수수 기름 스펙트럼에는 약 930nm, 1,210nm 및 1,410nm에서 특징적인 피크가 포함되어 있습니다. 그 결과 생성된 옥수수 기름 스펙트럼은 SNR이 10363.1이며 Cao et al.의 옥수수 기름 스펙트럼1과 중첩되어 강한 상관 관계를 보여주었습니다.
산소화된 헤모글로빈과 탈산소화된 헤모글로빈의 스펙트럼 특성화
산소화된 헤모글로빈과 탈산소화된 헤모글로빈의 흡수를 규명하는 것은 생체 의학 광학에서 가장 중요한 업적 중 하나이지만, VIS에서 SWIR에 이르는 흡수 스펙트럼은 여전히 잘 이해되지 않고 있습니다. SWIR에서 산소화된 헤모글로빈과 탈산소화된 헤모글로빈의 흡수 스펙트럼을 결정하는 데 있어 가장 어려운 측면 중 하나는 상대적으로 작은 헤모글로빈 흡수를 압도하는 혈액 속의 수분을 제거하는 것입니다. 헤모글로빈과 물의 흡수력을 풀기 위해 먼저 원심분리를 사용하여 인간 전혈에서 헤모글로빈을 분리하고 상층액을 제거하고 중수소수로 대체했습니다. 중수소화된 물은 또한 헤모글로빈이 저장성 파열을 일으키기 위해 재구성되는 기준 및 용매로 사용되었습니다. 그림 3에서 볼 수 있듯이 중수소화된 물은 물보다 광학 흡수율이 훨씬 낮기 때문에 SWIR 흡수 측정에 이상적인 용매 및 기준이 됩니다. 그 결과 생성된 산소화 헤모글로빈 스펙트럼은 SNR이 23118.7인 VIS에서 SWIR까지 확장되며 Prahl이 발표한 산소화 헤모글로빈 스펙트럼4 (그림 7)와 매우 밀접하게 일치했습니다. VIS에서 산소화된 헤모글로빈 스펙트럼은 약 415nm에서 특징적인 흡수 피크와 약 540 - 575nm에서 이중 피크로 높은 흡수를 보여줍니다. NIR에서 산소화된 헤모글로빈 스펙트럼은 약 800nm에서 1,100nm의 더 넓은 파장 범위에 걸쳐 특징적인 피크를 보여줍니다. SWIR에서는 헤모글로빈의 흡수가 낮습니다. 그러나 약 1,400 nm에서 1,600 nm까지 헤모글로빈 스펙트럼은 피크에서 더 높은 흡수율을 보였는데, 이는 원심분리 과정에서 헤모글로빈의 수분을 완전히 제거할 수 없었기 때문일 수 있습니다.
탈산소화된 헤모글로빈의 경우, 디티오나이트나트륨을 헤모글로빈 용액에 첨가하여 산소화된 헤모글로빈에서 이산소를 해리시키고 샘플을 탈산소화된 헤모글로빈으로 전환시켰습니다. 결과 스펙트럼은 9813.9의 SNR을 가지며 Prahl의 탈산소화 헤모글로빈 스펙트럼과 비교되었으며 400nm와 1,000nm 사이에 매우 강한 상관 관계를 보여줍니다4 (그림 8). 그 결과 탈산소화된 헤모글로빈 스펙트럼은 약 430nm, 560nm 및 760nm에서 특징적인 흡수 피크를 보여줍니다. 그 후, 탈산소화된 헤모글로빈의 흡수는 떨어지지만 약 1,200nm 및 1,400nm에서 1,600nm까지 더 작은 흡수 피크를 포함합니다. 1,400 nm에서 1,600 nm 사이의 흡광도는 원심분리 과정에서 헤모글로빈 샘플에서 완전히 제거되지 않은 물 때문일 수 있습니다.
VIS-SWIR의 생물학적 흡수제 비교
이 프로토콜에 특성화된 모든 생물학적 흡수제의 전체 VIS-SWIR 스펙트럼은 조직2의 생물학적 농도를 기반으로 조정된 그림 9에 나와 있으며, 이는 생물학적 흡수제 간의 뚜렷한 스펙트럼 차이를 강조합니다. 예를 들어, 멜라닌, 산소화된 헤모글로빈, 탈산소화된 헤모글로빈은 일반적으로 파장에 따라 감소하는 VIS에서 강력하고 특징적인 흡수를 갖는 반면, 물과 지질은 NIR 및 SWIR에서 특징적인 피크를 보여줍니다. 생물학적 조직에서 멜라닌과 헤모글로빈의 감소와 광학 산란의 감소가 결합되어 NIR 및 SWIR의 광학 침투 깊이가 증가합니다. 또한 NIR 및 SWIR의 멜라닌 흡수 감소로 인해 피부 색소 침착으로 인한 영향을 최소화하면서 산소화 및 탈산소화 헤모글로빈, 지질 및 물의 광학적 조사가 가능합니다.
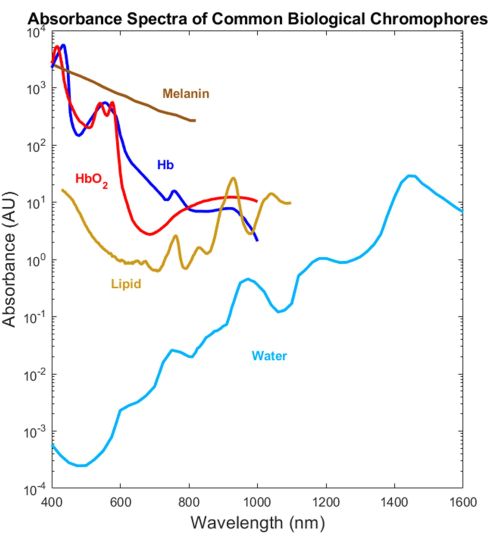
그림 1: 이전에 발표된 UV에서 SWIR에 이르는 일반적인 생물학적 흡수제의 스펙트럼. 산소화 및 탈산소화 헤모글로빈 스펙트럼은 Prahl4의 데이터를 사용하여 표시되었습니다. 멜라닌 스펙트럼은 Sarna21 및 Crippa23의 데이터를 사용하여 표시되었습니다. 지질 스펙트럼은 van Veen24의 데이터를 사용하여 표시되었습니다. 물 스펙트럼은 Hale과 Querry20의 데이터를 사용하여 표시되었습니다. 약어: SWIR = 단파 적외선. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
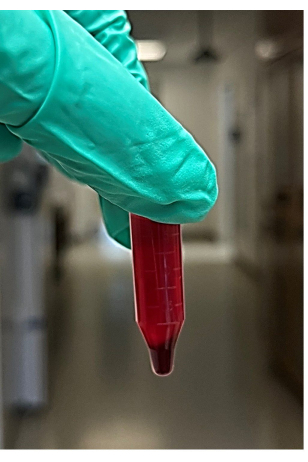
그림 2: 원심분리된 전혈에서 추출한 상층액과 적혈구 펠릿 사진. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
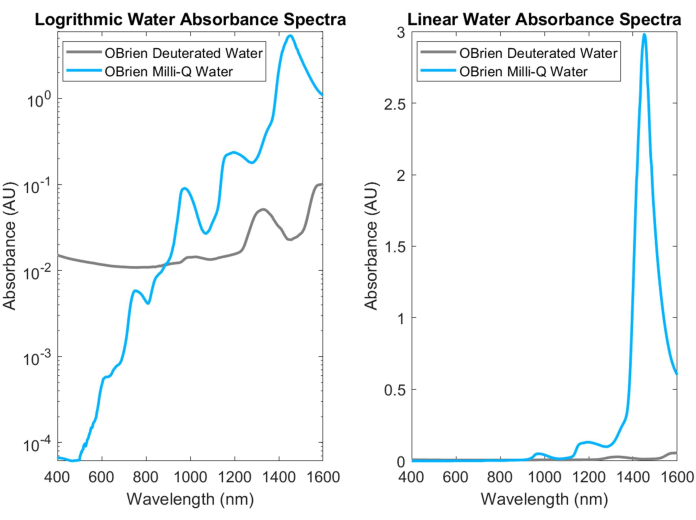
그림 3: log(왼쪽) 및 선형(오른쪽) 흡광도 척도에서 동일한 획득 설정으로 수집된 물과 중수소 물의 흡광도 스펙트럼 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
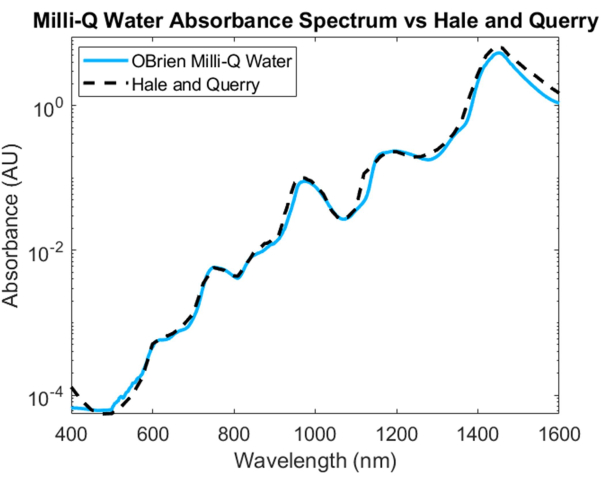
그림 4: 본 명세서에 기술된 방법을 사용하여 획득한 수분 흡수 스펙트럼과 Hale 및 Querry20의 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
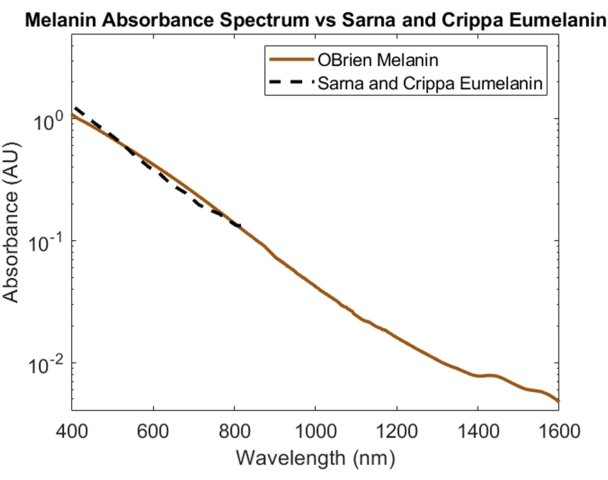
그림 5: 본원에 기술된 방법을 사용하여 획득한 멜라닌 흡광도 스펙트럼을 Sarna et al.21,22 및 Crippa et al.23과 비교.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
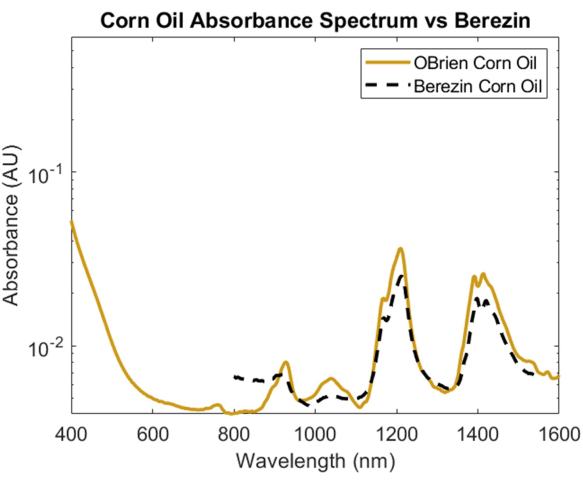
그림 6: 본 명세서에 기술된 방법을 사용하여 획득한 옥수수 기름 흡광도 스펙트럼과 Cao et al.1의 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
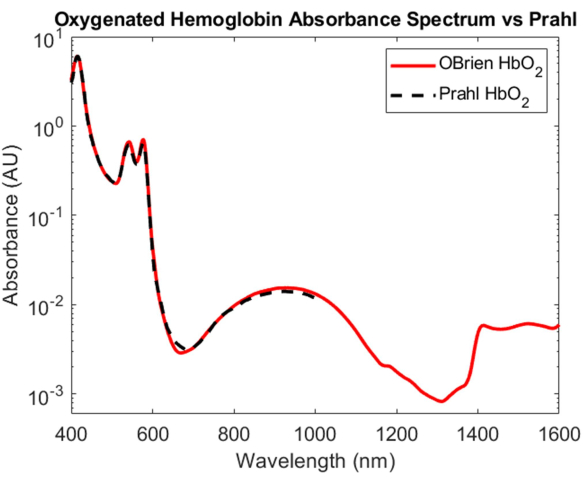
그림 7: 본원에 기술된 방법을 사용하여 획득한 산소화된 헤모글로빈 흡광도 스펙트럼과 Prahl4의 비교. 1,400 nm에서 1,600 nm까지의 스펙트럼 특징은 샘플에 남아 있는 물에 기인할 가능성이 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
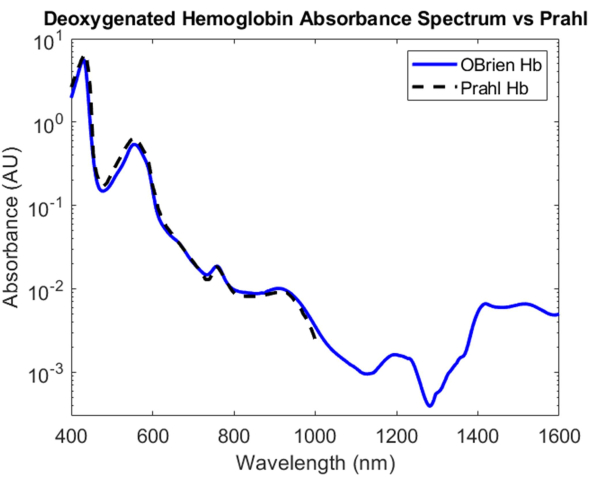
그림 8: 본원에 기술된 방법을 사용하여 획득한 탈산소화된 헤모글로빈 흡광도 스펙트럼과 Prahl4의 비교. 1,400 nm에서 1,600 nm까지의 스펙트럼 특징은 샘플에 남아 있는 물에 기인할 가능성이 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
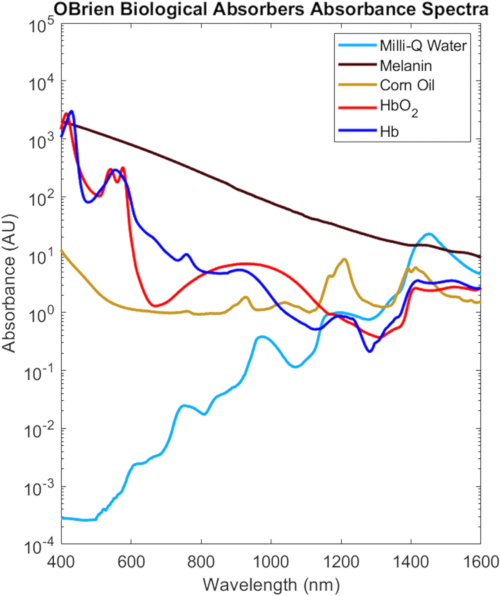
그림 9: 일반적인 생물학적 흡수제의 VIS-SWIR 스펙트럼. 약어: VIS-SWIR = 가시광선-단파 적외선. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 기사에 설명된 프로토콜은 생물학적 흡수제 및 조영제의 VIS-SWIR 흡수 스펙트럼을 얻는 데 사용할 수 있습니다. 여기에서는 400nm에서 1,600nm에 이르는 물, 멜라닌, 옥수수 기름, 산소화 헤모글로빈 및 탈산소화 헤모글로빈의 스펙트럼을 얻기 위한 구체적인 단계를 보여줍니다. 다음 논의에서는 중요한 단계, 측정 최적화를 위한 팁, 방법의 한계 및 생물의학 내에서 이 프로토콜의 적용을 다룹니다.
모든 프로토콜 단계가 중요하지만, 이 프로토콜로 정확한 스펙트럼을 얻으려면 몇 가지 중요한 단계를 따라야 합니다. 첫째, 샘플은 산란되지 않아야 합니다. 예를 들어, 혈액에서 산소화 및 탈산소화된 헤모글로빈을 얻을 때 샘플의 산란체를 걸러내야 합니다(여기서는 0.22μm 주사기 필터가 사용됨). 탈산소화된 헤모글로빈을 준비할 때 첨가된 디티오나이트나트륨의 양은 샘플을 더 높은 중량 비율로 혼탁하게 만들고 Beer-Lambert 법칙 요구 사항을 무효화하므로 제공된 무게를 초과해서는 안 됩니다.
둘째, 중수소수는 헤모글로빈과 같은 수용성 용질에 대한 샘플 용매 및 참조로 사용되어야 합니다. SWIR에서는 수분 흡수가 강하여 다른 흡수체를 가릴 수 있습니다. 셋째, 측정은 검출기의 선형 범위 내에서 획득되어야 하며, 이는 검출기에 도달하는 광자의 변화가 검출기 신호의 선형 변화를 초래하는 영역으로 정의됩니다. 최소한의 흡수가 발생하면 검출기는 흡광도가 발생하더라도 0의 흡광도를 등록할 수 있습니다. 이는 샘플이 너무 희석되거나, 노출 시간이 너무 짧거나, 큐벳 경로 길이가 너무 짧을 때 발생하지만, 샘플 농도, 큐벳 경로 길이 및/또는 노출 시간을 증가시켜 해결할 수 있습니다. 마찬가지로, 높은 흡수가 발생하면 검출기는 광자를 등록하지 않고 흡광도의 변화에 민감하지 않은 "포화"라는 평평한 선을 생성할 수 있습니다. 이는 샘플이 너무 집중되어 있거나, 노출 시간이 너무 짧거나, 경로 길이가 너무 길면 발생하지만, 샘플 농도를 높이거나, 노출 시간을 늘리거나, 큐벳 경로 길이를 줄임으로써 해결할 수 있습니다.
넷째, 사용되는 검출기는 선형이어야 합니다. 검출기가 검출기에 도달하는 광자 수에 대해 선형 반응을 보이는지 여부가 불확실한 경우, 동일한 획득 설정으로 샘플의 다양한 희석을 측정하여 흡광도 값이 흡광도와 농도 사이의 예상 선형 추세를 나타내는지 확인할 수 있습니다. 또는 단일 샘플을 측정하고 노출 시간을 늘려 검출기 강도가 선형적으로 증가하는지 여부를 테스트할 수 있습니다. 두 테스트 모두 사용자가 선형 한계 내에서 작동하는 경우 선형 관계를 생성해야 합니다(위의 세 번째 임계 지점 참조).
다섯째, 전체 VIS-SWIR 스펙트럼 범위 동안 검출기의 선형 범위 내를 유지하려면 시작 스펙트럼 영역에서 상당히 높거나 낮은 흡광도를 가진 다른 스펙트럼 영역에 대해 샘플 농도, 검출기 노출 시간 및/또는 큐벳 경로 길이를 변경해야 합니다.
여섯째, 서로 다른 스펙트럼 영역에 대해 서로 다른 샘플 농도 또는 경로 길이를 사용하여 획득한 스펙트럼은 농도 또는 경로 길이의 알려진 변화를 기반으로 한 영역의 선형 스케일링으로 함께 결합되어야 합니다. 스케일링 후 스펙트럼은 두 영역 사이의 중첩 파장에서 함께 스티칭되어야 합니다. 측정이 서로 다른 검출기의 측정에 걸쳐 수행되는 경우 원하는 검출기 전이 파장을 포함하는 중첩 흡광도 스펙트럼이 있어야 합니다(UV-VIS 및 SWIR 영역을 스티칭할 때 800nm가 일반적으로 사용됨). 각 스펙트럼은 검출기 전이 파장에서 잘리며, 원래 검출기 전이 흡광도 값을 포함하도록 하나의 스펙트럼이 선택됩니다. 그런 다음 두 개의 잘린 스펙트럼을 연결하여 하나의 길쭉한 스펙트럼을 생성합니다.
고품질 흡수 스펙트럼을 얻기 위한 추가 팁에는 측정할 전체 스펙트럼 범위를 커버하지 않더라도 이전에 발표된 관심 샘플의 스펙트럼을 사용하여 측정을 안내하는 것이 포함됩니다. 가장 낮은 흡광도를 가진 파장 범위를 선험 적으로 알면 가장 높은 농도의 샘플로 이 영역에서 측정을 시작한 다음 거기에서 조정하고 희석할 수 있습니다. 예상되는 흡광도 변화의 크기에 따라 측정해야 하는 개별 영역의 수를 알려주는 데 도움이 될 수 있습니다. 또한 예상 스펙트럼이 발표된 스펙트럼과 일치하거나 발표된 스펙트럼과 일치하지 않는 경우 스펙트럼을 왜곡할 수 있는 문제와 함께 시료 전처리 방법을 다시 검사할 수 있다는 확신을 제공할 수 있습니다.
흡수 스펙트럼은 후처리가 필요할 수 있습니다. 예를 들어, 디지털 이동 평균 필터를 사용하여 흡수 측정을 평활화할 수 있으며, 알려진 오류 지점은 오류 지점을 삭제하고 오류가 아닌 지점 간에 보간을 수행하는 데이터 세트 수정으로 제거할 수 있습니다.
이 방법의 한계는 전혈과 같은 광학 산란이 있는 샘플에 대한 부정확성을 포함합니다. 헤모글로빈을 정확하게 측정하기 위해 혈액 샘플을 용해한 다음 주사기 여과하여 광학 산란을 유발하는 대부분의 다른 잔류 세포 성분을 제거합니다. 유사하게, 이 방법은 조직 산란으로 인해 in vivo에서 사용되지 않습니다. Beer-Lambert 법칙에 기반한 흡광도 측정은 지루하고 때로는 수행하기 어려울 수 있지만, 순수한 광학 흡수 측정을 위한 황금 표준 방법입니다. 또한 일부 용매는 특정 용질의 순수한 흡광도 스펙트럼을 획득하는 것을 특히 어렵게 만듭니다. 예를 들어, 산소화 및 탈산소화 헤모글로빈의 천연 용매는 물이지만 SWIR에서 물의 흡수가 강하여 산소화된 헤모글로빈 흡수를 지배합니다. 따라서 반복적인 원심분리, 상층액 제거, SWIR 흡수가 약한 중수소수로 재구성을 통해 혈액에서 수분을 제거하려고 합니다. 헤파린화된 인간 혈액 전체로부터 생성된 산소화 및 탈산소화된 헤모글로빈 스펙트럼은 그림 3에서 볼 수 있듯이 약 1,300nm에서 1,600nm까지의 수분 흡수로 인한 작은 잔류 흡수를 포함하는 것으로 의심됩니다. 산소화 및 탈산소화 헤모글로빈에서 물의 완벽한 분리는 불가능할 가능성이 높지만, 우리는 400nm에서 1,000nm까지 많이 인용된 발표된 산소화 및 탈산소화 헤모글로빈 스펙트럼과 밀접한 일치를 관찰하고 스펙트럼을 수백 나노미터 2,3로 확장합니다.
본 명세서에 기술된 프로토콜은 연구자들이 흡수 스펙트럼 라이브러리를 확장하여 다수의 생물학적 성분 및 조영제의 VIS-SWIR 스펙트럼을 포함하는 데 도움이 될 것입니다. 이 지식은 비침습적 생체 의학 이미징 및 현재 대부분의 시스템이 작동하는 것보다 더 깊은 파장에서 감지를 통해 기본 생물학 및 생리학에 대한 이해를 향상시키는 데 사용할 수 있습니다. SWIR 파장의 추가는 비침습적으로 모니터링할 수 있는 조직 구성 요소의 유형을 확장하며 새로운 모니터링 및 진단의 개발에 영향을 줄 수 있습니다. 또한, NIR 및 SWIR에서 작동하는 기기는 VIS 및 NIR 범위에서 작동하는 광학 기기에 대해 보고된 피부 색소 침착 편향을 최소화하는 데 도움이 되어야 하며, 이는 공평한 의료기기를 만들기 위한 유망한 전략입니다.
공개
크리스틴 오브라이언(Christine O'Brien)과 레오니드 슈무일로비치(Leonid Shmuylovich)는 Armor Medical Inc.의 재정적 소유권 지분을 가지고 있으며, 이 회사가 이 연구와 관련된 제품 마케팅에 성공할 경우 재정적 이익을 얻을 수 있습니다.
감사의 말
이 작업은 미국 국립보건원(NIH) R00HD103954 및 R21EB035823의 보조금으로 지원됩니다. 이 간행물에 보고된 연구는 미국 국립보건원(NIH) 산하 국립중개과학발전센터(NCATS)의 워싱턴 대학교 임상중개과학연구소(Washington University Institute of Clinical and Translational Sciences) 보조금 UL1TR002345의 지원을 받았습니다. 이 내용은 전적으로 저자의 책임이며 반드시 NIH의 공식 견해를 나타내는 것은 아닙니다. 저자들은 오브라이언 연구소 멤버들, 마이클 바헤이(Michael Vahey)와 그의 연구실 멤버들, 그리고 Huanzhu Jiang의 도움에 감사를 표한다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 µm diameter syringe Filters | Sigma-Aldrich | SLGPM33RS | |
| 1000 µL Pipette | Millipore Sigma | EP3124000121 | |
| 200 µL Pipette | Millipore Sigma | EP3124000083 | |
| Conical Tubes | Avantor VWR | 21008-089 | |
| Corn Oil | Happy Belly | n/a | 48 Fl Oz |
| Deuterium Oxide | Cambridge Isotope Laboratories | DLM-4-100 | |
| Deuterium Oxide | Sigma-Aldrich | 7789-20-0 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D5879-1L | |
| Disposable 1 mL Syringe | BH Supplies | BH1LL | |
| Disposable Needle | Atshuhut/Amazon | 66941 | |
| Freezer (-80 °C) | Fisher Scientific | IUE386FARK | |
| Glass Beakers | Millipore Sigma | CLS1000PACK | |
| Glass or Quartz Cuvettes | Sigma-Aldrich | Z802875-1EA | 700 µL volume |
| Glass or Quartz Cuvettes | Thorlabs | CV10Q35EP | 3500 mL volume |
| Heparinized Human Blood | Lampire | 7203710 | |
| Microcentrifuge Tubes | Costar | 3213 | |
| Microcentrifuge--accuSpin Micro 17 | Fisher Scientific | 13-100-675 | |
| MilliQ Water | Millipore Sigma | ZMQSP0D01 | |
| OSRAM FCS 64640 150 W 24 V HLX Halogen Light Bulb | Amazon | B0001221DG | |
| Parafilm | Millipore Sigma | HS234526B | |
| Pipette Tips | Eppendorf | 22492055 | |
| Powdered Synthetic Melanin | Sigma-Aldrich | 8049-97-6 | |
| Scale | Sartorius | UX-11976-09 | |
| Sodium Dithionite | Sigma-Aldrich | 1065070500 | |
| Sonicator | Fisher Scientific | CPX1800 | |
| Spatula | Aozita | 000 00 0 1 2 3 | |
| UV/VIS/SWIR Spectrophotometer | On Line Instrument Systems | Olis Cary 14 | |
| Weigh Boats | Amazon | B07M5RMNPF |
참고문헌
- Cao, Q., Zhegalova, N. G., Wang, S. T., Akers, W. J., Berezin, M. Y. Multispectral imaging in the extended near-infrared window based on endogenous chromophores. J Biomed Opt. 18 (10), 101318 (2013).
- Yao, J., Wang, L. V. Sensitivity of photoacoustic microscopy. Photoacoustics. 2 (2), 87-101 (2014).
- Jacques, S. L. Optical properties of biological tissues: a review. Phys Med Biol. 58 (11), R37 (2013).
- . Optical absorption of hemoglobin Available from: https://omlc.org/spectra/hemoglobin/ (1999)
- Zhang, H., et al. Penetration depth of photons in biological tissues from hyperspectral imaging in shortwave infrared in transmission and reflection geometries. J Biomed Opt. 21 (12), 126006 (2016).
- Du, T., et al. Hyperspectral imaging and characterization of allergic contact dermatitis in the short-wave infrared. J Biophotonics. 13 (9), e202000040 (2020).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Mueller, G. J. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J Biomed Opt. 4 (1), 36-46 (1999).
- Kuenstner, J. T., Norris, K. H. Spectrophotometry of human hemoglobin in the near infrared region from 1000 to 2500 nm. J Near Infrared Spectrosc. 2 (2), 59-65 (1994).
- Spectral subtraction. Available from: https://www.spectroscopyonline.com/view/spectral-subtraction (2021)
- Sjoding, M. W., Dickson, R. P., Iwashyna, T. J., Gay, S. E., Valley, T. S. Racial bias in pulse oximetry measurement. N Engl J Med. 383 (25), 2477-2478 (2020).
- Fawzy, A., et al. Racial and ethnic discrepancy in pulse oximetry and delayed identification of treatment eligibility among patients with COVID-19. JAMA Intern Med. 182 (7), 730-738 (2022).
- Sudat, S. E. K., et al. Racial disparities in pulse oximeter device inaccuracy and estimated clinical impact on COVID-19 treatment course. Am J Epidemiol. 192 (5), 703-713 (2023).
- Keller, M. D., Harrison-Smith, B., Patil, C., Arefin, M. S. Skin colour affects the accuracy of medical oxygen sensors. Nature. 610 (7932), 449-451 (2022).
- Butler, W. L. Absorption spectroscopy of biological materials. Methods Enzymol. 24, 3-25 (1972).
- Tang, J., et al. Calculation extinction cross sections and molar attenuation coefficient of small gold nanoparticles and experimental observation of their UV-vis spectral properties. Spectrochim Acta A Mol Biomol Spectrosc. 191, 513-520 (2018).
- Rossman, G. R. Optical spectroscopy. Rev Mineral Geochem. 78 (1), 371-398 (2014).
- Thimsen, E., Sadtler, B., Berezin, M. Y. Shortwave-infrared (SWIR) emitters for biological imaging: a review of challenges and opportunities. Nanophotonics. 6 (5), 1043-1054 (2017).
- Briely-Sabo, K., Bjornerud, A. Accurate de-oxygenation of ex-vivo whole blood using sodium dithionite. Proc Intl Sot Mag Reson Med. 8, 2025 (2020).
- Skoog, D. A., Holler, F. J., Crouch, S. R. Principles of instrumental analysis. Cengage Leaning. , (2019).
- Hale, G. M., Querry, M. R. Optical constants of water in the 200-nm to 200-microm wavelength region. Appl Opt. 12 (3), 555-563 (1973).
- Sarna, T., Sealy, R. Photoinduced oxygen consumption in melanin systems. Action spectra and quantum yields for eumelanin and synthetic melanin. Photochem Photobiol. 39 (1), 69-74 (1984).
- Sarna, T., Swartz, H. A., Nordlund, J. J. The physical properties of melanins. The pigmentary system: Physiology and pathophysiology. , 311-341 (2006).
- Crippa, P., Cristofoletti, V., Romeo, N. A band model for melanin deduced from optical absorption and photoconductivity experiments. Biochim Biophys Acta. 538 (1), 164-170 (1978).
- van Veen, R., et al. Determination of visible near-IR absorption coefficients of mammalian fat using time- and spatially resolved diffuse reflectance and transmission spectroscopy. J Biomed Opt. 10 (5), 054004 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유