Method Article
Caracterização de espectros de absorção biológica abrangendo o visível ao infravermelho de ondas curtas
Neste Artigo
Resumo
As amostras biológicas têm características ópticas distintas no infravermelho de ondas curtas (SWIR) em comparação com as faixas de comprimento de onda do visível (VIS) e do infravermelho próximo (NIR). No entanto, o registro de espectros de absorção SWIR puros é desafiador e raramente conduzido para moléculas biológicas. Este artigo apresenta um método para caracterizar os espectros de absorção VIS-SWIR de absorvedores biológicos.
Resumo
Para monitoramento fisiológico não invasivo baseado em luz, os comprimentos de onda ideais de componentes individuais do tecido podem ser identificados usando espectroscopia de absorção. No entanto, devido à falta de sensibilidade do hardware em comprimentos de onda mais longos, a espectroscopia de absorção tem sido normalmente aplicada para comprimentos de onda na faixa visível (VIS) e infravermelho próximo (NIR) de 400 a 1.000 nm. Os avanços de hardware na faixa de infravermelho de ondas curtas (SWIR) permitiram que os investigadores explorassem comprimentos de onda na faixa de ~ 1.000 nm a 3.000 nm, nos quais os picos de absorção característicos de queda para lipídios, proteínas e água. Essas moléculas são difíceis de visualizar no VIS-NIR e podem fornecer fontes de contraste biológico sem marcadores. Além disso, foi observada menor absorção de SWIR para a melanina, o cromóforo primário responsável pela pigmentação da pele. Descobriu-se que dispositivos ópticos in vivo, como oxímetros de pulso clinicamente padrão, têm precisão reduzida em pessoas com pele pigmentada escura, possivelmente devido à absorção mais forte de melanina na faixa VIS. Assim, o erro associado à pigmentação da pele pode ser reduzido com o uso de dispositivos operando no SWIR. O projeto do instrumento óptico é facilitado pela compreensão das propriedades de absorção dos componentes do tecido central do VIS à faixa SWIR. Este artigo descreve protocolos e instrumentação para obter espectros de absorção VIS-SWIR de absorvedores de tecidos comuns: hemoglobina oxigenada, hemoglobina desoxigenada, melanina, água e lipídios.
Introdução
A maioria dos absorvedores biológicos foi caracterizada opticamente nas faixas espectrais visível (VIS, ~ 400-700 nm) e infravermelho próximo (NIR, ~ 700-1.000 nm), mas não no infravermelho de ondas curtas (SWIR, ~ 1.000-3.000 nm) 1 , 2 , 3 , 4 (Figura 1 ). Isso ocorre apesar do SWIR oferecer uma penetração de luz mais profunda devido ao menor espalhamento do tecido e à redução da absorção de melanina, bem como contraste biológico adicional sem rótulo para água, lipídios e proteínas 1,5,6. A falta de espectros de absorção abrangendo o VIS-SWIR criou uma lacuna no conhecimento que impede o desenvolvimento de dispositivos ópticos biomédicos que aproveitam esses benefícios do SWIR. Embora várias tentativas de caracterizar os espectros tenham sido apresentadas no passado, faltam espectros de absorção VIS-SWIR de alta qualidade de componentes puros sem artefatos de solvente significativos 1,7,8. Por exemplo, substâncias solúveis em água, como a hemoglobina, foram caracterizadas no SWIR usando água como solvente e subtraindo a absorção de água pura dos espectros resultantes9. No entanto, a precisão dessa abordagem não é clara porque a água é um absorvedor dominante nessa região.
Trabalhar no SWIR tem a vantagem adicional de reduzir ou possivelmente remover o viés causado pela forte absorção de melanina no VIS ao usar diagnósticos ópticos in vivo. Numerosos estudos descobriram que os oxímetros de pulso superestimam a oxigenação em pacientes negros e, como tal, os pacientes negros são mais propensos a ter níveis de oxigênio perigosamente baixos que os oxímetros de pulso não detectaram10. Esse viés de pigmentação da pele resultou em tratamento médico tardio e inadequado de muitos pacientes hipóxicos negros11,12 e levou a um apelo à ação nas comunidades de óptica e engenharia para melhorar a precisão dos dispositivos ópticos para todos os tons de pele13. Passar dos comprimentos de onda VIS de alta absorção de melanina para o NIR e SWIR é uma inovação técnica empolgante que pode reduzir as disparidades raciais em tecnologias ópticas biomédicas criticamente importantes.
O registro de espectros de absorção de biomoléculas é essencial para entender as propriedades ópticas de amostras de tecido que são usadas em uma variedade de aplicações biomédicas e de engenharia14. A espectroscopia de absorção mede a absorção de luz específica da molécula em função do comprimento de onda. O método padrão-ouro de aquisição de medições de absorção em solução é direcionar a luz monocromática colimada através de uma amostra dissolvida e registrar a luz transmitida com um detector colocado no lado oposto da amostra da fonte de luz. A absorção (A) da amostra é então definida pela Eq. (1).
A = log10(I0/I) (1)
Onde Io é a intensidade da luz incidente na amostra e I é a intensidade da luz transmitida através da amostra que atinge o detector. Io é adquirido medindo uma referência, que normalmente é o solvente do soluto de interesse, usando as mesmas configurações de aquisição que I. A espectroscopia de absorção fornece propriedades de absorção quantitativa e é regida pela Lei de Beer-Lambert (Eq. 2), que não se aplica a amostras que possuem espalhamento óptico. Esta equação afirma que a absorção óptica é determinada pelo coeficiente de absortividade molar de uma amostra (ε, unidades L·mol−1·cm−1) no comprimento de onda λ multiplicado por sua concentração molar (C, unidades mol∙L-1) e o comprimento do caminho (L, unidades cm), que é definido como a distância percorrida através da amostra15:
A(λ) = ε(λ)*L*C (2)
É importante ressaltar que o coeficiente de absortividade molar é exclusivo para cada absorvedor biológico e indica a força com que uma amostra absorve luz em um determinado comprimento de onda16.
Ao fazer medições de espectroscopia de absorção que vão do VIS ao SWIR, são necessários ajustes no hardware, preparação de amostras e pós-processamento espectral além dos espectros VIS-NIR padrão:
Hardware
As medições VIS-NIR normalmente usam um detector de silício ou tubos fotomultiplicadores (PMT) com fotocátodos sensíveis aos fótons UV-VIS, enquanto a absorbância SWIR requer um fotodetector sensível aos fótons SWIR, como um detector de arseneto de índio e gálio (InGaAs)17. Os sistemas VIS, NIR e SWIR também requerem elementos de dispersão específicos de comprimento de onda, como grades ópticas, para dispersão de luz nessas faixas ópticas. Além disso, a absorção de SWIR requer cubetas de vidro ou quartzo, que têm maior transmissão do que as cubetas de plástico no SWIR, tornando-as mais adequadas para espectros VIS-SWIR. Deve ser selecionada uma fonte ou fontes de luz com uma emissão ampla e relativamente uniforme que cubra o VIS-SWIR, como uma lâmpada de tungstênio e halogênio (usada neste protocolo). Ajustar a potência da luz incidente, o tempo de exposição ou a duração durante a qual o fotodetector é exposto à luz pode ajudar a otimizar as medições de absorbância.
Preparação da amostra
A concentração da amostra ou o comprimento do caminho da cubeta alterará linearmente a quantidade de absorção que ocorre conforme descrito acima na Eq (2) e, portanto, pode ser alterada para atingir uma alta relação sinal-ruído (SNR, aqui calculada como a razão da amplitude de pico dividida pelo desvio padrão de uma região sem tendência do espectro, normalmente SNR > 30 é considerada de alta qualidade) medições em diferentes seções do espectro com medições relativamente altas ou baixas Absorvância. Para otimizar as medições de SWIR em uma solução aquosa, o óxido de deutério (D2O), também conhecido como água pesada ou água deuterada, pode ser usado em vez de água (H2O), porque tem picos de absorção significativamente mais baixos no SWIR1. Isso permite a caracterização do soluto sem interferência da absorção de água dominante no SWIR.
Pós-processamento espectral
O pós-processamento é necessário porque os espectros VIS-SWIR requerem dois detectores, um para o NIR visível (normalmente PMT sensível ao silício ou UV-VIS) e outro para o SWIR (normalmente InGaAs), e os espectros devem ser costurados para obter um espectro VIS-SWIR completo. Quando os espectros abrangem o VIS-SWIR, a absorção pode variar significativamente dependendo da região do comprimento de onda, e a amostra pode precisar ser diluída ou o comprimento do caminho diminuído em algumas áreas para evitar a saturação. Os espectros devem ser dimensionados linearmente para levar em conta as mudanças na concentração da amostra ou no comprimento do caminho e, em seguida, costurados para criar um único espectro que inclua duas regiões de comprimento de onda.
Os protocolos a seguir detalharão a preparação e medição espectroscópica do VIS ao SWIR de cinco exemplos de absorvedores biológicos: água (compreende ~ 60% do peso corporal), melanina (absorvedor primário para pigmentação da pele), óleo de milho (usado como análogo para lipídios humanos porque tem baixa variabilidade entre lotes, composição química próxima aos lipídios humanos e animais, e dispersão mínima) e hemoglobina oxigenada e desoxigenada (os principais absorvedores no sangue).
Protocolo
1. Preparação de amostras
- Preparação da amostra de água
- Para preparar a amostra, encha um recipiente limpo com água ultrapura e filtre-o usando um filtro de seringa de 0,22 μm. Certifique-se de que a saída da seringa seja direcionada para um vidro limpo ou cubeta de quartzo para fazer medições de espectroscopia de absorção da amostra.
- Para preparar a referência, encha um recipiente limpo com água deuterada e filtre-o usando um filtro de seringa de 0,22 μm. Certifique-se de que a saída da seringa seja direcionada para uma cubeta de vidro ou quartzo limpa idêntica à cubeta de amostra para servir de referência.
NOTA: A etapa de filtragem minimizará o espalhamento óptico da amostra, filtrando pequenas partículas na água, que têm fortes contribuições na região visível.
- Preparação da amostra de melanina
- Prepare uma solução de 1,7 mg / mL de melanina adicionando melanina em pó a um tubo de centrífuga cheio de 3,5 mL de dimetilsulfóxido (DMSO). Para começar, as medições devem começar nos comprimentos de onda com a menor absorção esperada, onde a maior concentração de melanina é necessária. Inicie as medições de melanina com aproximadamente 1,7 mg / mL para o SWIR e dilua-o com DMSO posteriormente para uma diluição de 10x (aproximadamente 0,17 mg / mL) para as regiões VIS / NIR.
- Sonicar o tubo por 10 min para garantir que a melanina em pó se dissolva no DMSO e transfira a solução para um vidro limpo ou cubeta de quartzo para medições de espectroscopia.
- Mantenha-se dentro da faixa de absorbância linear do espectrômetro e garanta altas medições de SNR alterando a concentração e/ou o comprimento do caminho (por exemplo, mudando de um comprimento de caminho curto (1 ou 2 mm) para uma cubeta de 10 mm de comprimento de caminho). A absorção de melanina tem uma ampla faixa que vai do VIS ao SWIR. Para o VIS, utilizar a cubeta de melanina com a menor concentração e/ou trajeto devido ao seu elevado coeficiente de extinção molar; para o SWIR, use a concentração mais alta de melanina e / ou cubeta de comprimento de caminho para obter uma medição de espectroscopia qualitativamente limpa.
- Preparação da amostra de óleo de milho
- Adicione óleo de milho a um vidro limpo ou cubeta de quartzo para medições de espectroscopia.
- Use o ar livre como referência. Nenhuma cubeta ou solução será usada como referência.
- Preparo de amostra de hemoglobina oxigenada com sangue humano heparinizado total
NOTA: O sangue humano heparinizado total foi comprado e coletado em centros de coleta licenciados pela FDA localizados nos Estados Unidos.- Para isolar a hemoglobina dos glóbulos vermelhos (hemácias) e remover o máximo de água possível do sangue, primeiro pipete 1.800 μL de sangue humano heparinizado total em tubos de microcentrífuga e centrifugue a 9,6 × g por 10 min.
NOTA: Recomenda-se aproximadamente 4-6 tubos de microcentrífuga - Após a centrifugação, remova os tubos da microcentrífuga e, em seguida, remova e descarte o sobrenadante (será de aproximadamente 850 μL) da amostra de sangue centrifugada sem perturbar o pellet (Figura 2). O sobrenadante compreende o líquido (principalmente plasma e plaquetas) acima do grânulo vermelho. Procure o grânulo vermelho na parte inferior do tubo da microcentrífuga.
- Reconstitua cada pellet com o mesmo volume de água deuterada que o volume de sobrenadante que foi descartado. Centrifugue novamente a 9,6 × g por 10 min.
- Retirar os tubos da centrífuga e, em seguida, rejeitar o sobrenadante sem perturbar o sedimento.
- Reconstituir o pellet com o mesmo volume de água deuterada que o volume de sobrenadante que foi descartado. Centrifugue novamente a 9,6 × g por 10 min.
- Retirar os tubos da centrífuga e, em seguida, retirar o sobrenadante com uma pipeta e eliminá-lo.
- Lise de glóbulos vermelhos (RBCs): Reconstitua os grânulos de hemácias com um grande volume (4,5 mL) de água deuterada, o que causará uma explosão hipotônica. Se o pellet estiver grudado no tubo, enxágue-o com um pouco dos 4,5 mL medidos de água deuterada para soltá-lo.
NOTA: O volume do sobrenadante aumentará após cada etapa de centrifugação. Este volume de sobrenadante pode variar de 800 μL a 1.600 μL. O volume de água deuterada para lisagem pode mudar dependendo da concentração desejada da amostra, mas precisa ser alto o suficiente para causar explosão hipotônica. - Remova a solução de sangue lisada do tubo com uma agulha e seringa; Em seguida, remova cuidadosamente a agulha da seringa de ponta romba e descarte-a em um recipiente para objetos cortantes de risco biológico. Ligue a seringa a um filtro de seringa de 0,22 μm e empurre o conteúdo da seringa através do filtro para uma cubeta de vidro ou quartzo de 10 mm de comprimento de caminho, 3,5 ml.
NOTA: A etapa de filtragem minimizará o espalhamento óptico da amostra, filtrando as organelas e membranas celulares na solução. Se a amostra estiver muito concentrada e o filtro da seringa se tornar difícil de empurrar, use vários filtros de seringa. - Prenda a cubeta com uma rolha hermética sobre a cubeta para evitar que o vapor de água do ar contamine a amostra. Parafilme a parte externa da rolha para evitar ainda mais a contaminação e garantir uma vedação hermética.
NOTA: Para medições de 600 nm a 1,600 nm, aproximadamente 1,200-1,600 μL de pellet dissolvido em 4.5 mL de água deuterada fornecerão medições qualitativamente limpas.
NOTA: Para regiões espectrais com alta absorbância esperada (400 nm a 600 nm), as amostras precisarão ser diluídas usando água deuterada para obter valores de absorbância não saturados e garantir que os valores de absorbância estejam dentro da faixa linear do detector. Além disso, as amostras e a referência devem ser colocadas em cubetas curtas (1 ou 2 mm). Para os espectros aqui mostrados, as amostras foram diluídas 10x para 400-500 nm e 5x para 500-600 nm e medidas em cubetas de 2 mm de comprimento de caminho.
O comprimento de caminho mais curto (1 ou 2 mm) permitirá menos absorção de luz em comprimentos de onda altamente absorventes, ajudando a garantir que alguns fótons sejam transmitidos para o detector e permaneçam dentro da faixa de detecção linear. - Obtenha uma cubeta limpa com o mesmo comprimento de percurso e volume que a cubeta de amostra contendo a solução de sangue filtrada e encha-a com água deuterada para medições de linha de base e de referência. Se alterar os comprimentos de caminho da cubeta para diferentes faixas espectrais, registre um novo espectro de referência para cada comprimento de caminho da cubeta.
- Para isolar a hemoglobina dos glóbulos vermelhos (hemácias) e remover o máximo de água possível do sangue, primeiro pipete 1.800 μL de sangue humano heparinizado total em tubos de microcentrífuga e centrifugue a 9,6 × g por 10 min.
- Preparo de amostra de hemoglobina desoxigenada com sangue humano heparinizado total
- Siga as etapas 1.4.1-1.4.8.
- Adicione ditionito de sódio à solução de sangue na cubeta e mexa suavemente. Prenda a cubeta com uma rolha hermética sobre a cubeta para evitar que o vapor de água do ar contamine a amostra. Parafilme a parte externa da rolha para evitar ainda mais a contaminação e garantir uma vedação hermética. Incline cuidadosamente a cubeta de um lado para o outro para garantir que o ditionito de sódio se dissolva na solução; A solução de sangue mudará de uma cor vermelha para uma cor vermelho-púrpura mais escura.
NOTA: Para desoxigenar totalmente a hemoglobina, a massa de ditionito de sódio necessária é de aproximadamente 0,007 g por mL de solução sanguínea. De acordo com Briley-Sӕbø e Bjørnerud, são necessários pelo menos 2,5 mg de ditionita de sódio/g de sangue para desoxigenar completamente o sangue total18. No entanto, essa concentração foi considerada insuficiente nos estudos aqui. Uma concentração de aproximadamente 3,4 mg / g de sangue total foi encontrada para desoxigenar completamente a solução sanguínea sem a introdução de espalhamento óptico. Para medições de 400 a 600 nm, a solução sanguínea precisará ser diluída com água deuterada. Calcular a massa de ditionito de sódio necessária com base no volume da solução de bood utilizada e não no volume após a diluição. Para medições de 600 nm a 1.600 nm, aproximadamente 1.200-1.600 μL de pellet dissolvido em 4,5 mL de água deuterada fornecerão altas medições de SNR.
Uma cubeta de comprimento de caminho mais curto (1 ou 2 mm) permitirá menos absorção de luz em comprimentos de onda altamente absorventes, ajudando a garantir que alguns fótons sejam transmitidos para o detector e permaneçam dentro da faixa de detecção linear. - Encha outra cubeta com comprimento de caminho correspondente como a cubeta com solução de sangue filtrado com água deuterada para medições de linha de base e referência. Se alterar os comprimentos de caminho da cubeta para diferentes faixas espectrais, registre um novo espectro de referência para cada comprimento de caminho da cubeta.
2. Obtenção de medições de absorção de alta qualidade
- Prepare amostras e referências conforme descrito na seção 1 e coloque-as em cubetas de vidro ou quartzo para medições VIS NIR-SWIR. Ligue a lâmpada do espectrômetro e os detectores e deixe o sistema aquecer por pelo menos 5 a 20 minutos, dependendo do sistema do espectrômetro e da fonte de luz.
NOTA: Cinco minutos forneceram resfriamento suficiente do detector e estabilidade de saída da lâmpada para os espectros aqui coletados, mas isso deve ser caracterizado para cada sistema antes da captura das medições de absorbância.
Mantenha a amostra e a referência à mão durante este período de coleta. Certifique-se de que as tampas das cubetas estejam seguras. Mantenha o espaço de medição o mais escuro possível para evitar distorção das medições de absorção pela luz ambiente. - Repita as etapas a seguir para diferentes regiões do espectro devido à grande variação na absorção através do VIS-SWIR.
- Se estiver usando uma configuração de feixe duplo (dois detectores separados para amostra e referência), certifique-se de que o sistema esteja na linha de base. Adquirir a linha de base colocando amostras de referência idênticas contendo o solvente na frente de cada detector e coletar uma medição de absorbância usando os parâmetros de aquisição exatos a serem usados para a coleta do espectro de absorbância da amostra. Embora os detectores devam teoricamente mostrar absorção zero, geralmente não são perfeitos. Subtraia o espectro de absorbância resultante de todos os espectros de absorbância da amostra que são adquiridos usando as mesmas configurações.
NOTA: A linha de base deve ser repetida sempre que as configurações de aquisição para coleta de dados forem alteradas. - Coloque a amostra no espectrômetro e escolha o detector que é relevante para a região a ser medida (VIS-NIR = silício ou UV-VIS PMT, SWIR = InGaAs) e visualize a absorbância no modo Live, no qual a medição é atualizada continuamente à medida que os parâmetros de medição são ajustados.
- Começando com os parâmetros padrão do espectrômetro, ajuste a potência da luz incidente e o tempo de exposição até obter um espectro de absorção qualitativamente limpo sem saturação.
- Se o ajuste dos parâmetros não resultar em espectros qualitativamente limpos, modifique parâmetros como potência da luz incidente, tempo de exposição, comprimento do caminho e concentração da amostra. Primeiro, tente ajustar a potência e o tempo de exposição. Se o ajuste desses parâmetros não resultar em um espectro SNR alto, altere a concentração da amostra ou o comprimento do caminho da amostra e a referência.
NOTA: Os parâmetros padrão usados na coleta dos espectros mostrados aqui foram potência de luz incidente de 15 nW a 400 nm e 20 nW a 1.000 nm, tempo de exposição de 30 ms, comprimento do caminho da cubeta de 10 mm e concentrações específicas da amostra: 100% de água, melanina 1,7 mg/mL, 100% de óleo de milho, hemoglobina oxigenada (15,9 g/dL), e hemoglobina desoxigenada (15,9 g/dL). - Para aumentar o SNR, aumente o número de leituras de dados em média por ponto de dados. Quanto maior o número de leituras de dados em média, maior o tempo por medição.
- Para aumentar a resolução espectral, reduza o tamanho do passo (nm) da medição até o limite de resolução do espectrômetro. Isso aumentará o tempo por medição. Além disso, reduza a largura de banda de energia da luz incidente para 1/10da largura total do pico mais estreito na metade do máximo19.
- Depois que as configurações de medição forem otimizadas para a amostra, documente as configurações para cada espectro adquirido.
- Para obter um espectro, use as configurações otimizadas para medir apenas a referência. Em seguida, substitua a cubeta de referência pela cubeta de amostra e faça outra medição. Certifique-se de salvar as medidas de referência e de amostra separadamente.
NOTA: É imperativo que a medição de referência não sature. Em caso afirmativo, reduza a potência da luz incidente e/ou o tempo de exposição até que não haja saturação. Mantenha todos os parâmetros do sistema iguais entre as medições de referência e amostra; Se um precisar ser alterado, o outro também precisará ser repetido para combiná-lo. - Para cada conjunto emparelhado de medições de referência e de amostra, calcular a absorvância A (Eq 1) tratando a medição de referência como Io e a medição da amostra como I.
- Para unir diferentes regiões que exigiam diferenças na concentração da amostra ou no comprimento do caminho, aplique um fator de multiplicação a uma das regiões espectrais. Por exemplo, para uma primeira região que tinha 1/10 da concentração e comprimento de caminho idêntico a uma segunda região, multiplique a primeira região espectral por 10 para dimensionar adequadamente as duas regiões juntas.
NOTA: O fator de multiplicação deve ser a diferença de concentração e/ou comprimento do caminho entre as regiões. - Uma vez que os espectros tenham sido corrigidos para diferenças no comprimento do caminho ou concentração, escolha um comprimento de onda sobreposto nas duas regiões espectrais para unir as duas regiões.
- Truncar os dois espectros para terminar no comprimento de onda de sobreposição; Escolha um espectro para incluir seu valor espectral de transição. Concatene os dois espectros truncados para criar um único espectro resultante de uma faixa de comprimento de onda mais ampla.
- Se o ajuste dos parâmetros não resultar em espectros qualitativamente limpos, modifique parâmetros como potência da luz incidente, tempo de exposição, comprimento do caminho e concentração da amostra. Primeiro, tente ajustar a potência e o tempo de exposição. Se o ajuste desses parâmetros não resultar em um espectro SNR alto, altere a concentração da amostra ou o comprimento do caminho da amostra e a referência.
- Se estiver usando uma configuração de feixe duplo (dois detectores separados para amostra e referência), certifique-se de que o sistema esteja na linha de base. Adquirir a linha de base colocando amostras de referência idênticas contendo o solvente na frente de cada detector e coletar uma medição de absorbância usando os parâmetros de aquisição exatos a serem usados para a coleta do espectro de absorbância da amostra. Embora os detectores devam teoricamente mostrar absorção zero, geralmente não são perfeitos. Subtraia o espectro de absorbância resultante de todos os espectros de absorbância da amostra que são adquiridos usando as mesmas configurações.
Resultados
Os dados estão disponíveis através do Repositório Digital de Materiais de Pesquisa (DRMR) da WUSTL doi: https://doi.org/10.7936/6RXS-108249
Caracterização espectral da água
A água, um dos absorvedores biológicos mais comuns, tem picos característicos e altamente absorventes no NIR e SWIR. Esses picos característicos são tão fortes que, ao medir a absorbância da água, ela geralmente deve ser diluída com água deuterada para evitar a saturação. A diferença na absorbância entre água e água deuterada é mostrada na Figura 3, destacando mais de uma ordem de magnitude de aumento na absorbância de água em relação à água deuterada. A forte absorção de água no SWIR também dificulta a obtenção dos espectros de absorção de outros absorvedores biológicos que contêm água na amostra ou que usam água como solvente e referência. Como solução para este problema, água deuterada pode ser usada em vez de água. A água deuterada age de maneira semelhante à água, sendo um absorvedor SWIR muito mais fraco, tornando-a um substituto ideal para a água nas medições de espectroscopia SWIR.
Para medir o espectro de absorção da água, a água foi usada como amostra e a água deuterada como referência. Para evitar a saturação no SWIR, a amostra foi diluída com água deuterada na região SWIR. O espectro de absorção de água resultante mostra baixa absorção no VIS, que aumenta em comprimentos de onda mais longos. Picos de absorção característicos podem ser vistos em aproximadamente 750 nm, 970 nm, 1.200 nm e 1.450 nm (Figura 4). O espectro de água resultante tem um SNR de 3536,6 e foi comparado ao espectro de absorção de água20 de Hale e Querry, mostrando uma curva de absorção semelhante de ~ 500 nm a 1.600 nm. No entanto, de 400 a 500 nm, as curvas de absorção diferem, com Hale e Querry mostrando um valor de absorbância mais alto em comprimentos de onda mais baixos. Essa diferença pode ser devido a pequenas partículas residuais na água que terão maior dispersão em comprimentos de onda mais curtos em comparação com comprimentos de onda mais longos3 e pode invalidar as suposições de não dispersão nas medições de absorção baseadas na lei de Beer-Lambert.
Caracterização espectral da melanina
A melanina, o principal absorvedor óptico da pele, foi espectralmente caracterizada usando melanina em pó como amostra e DMSO como solvente e referência. O espectro resultante tem uma SNR de 172 e foi comparado aos dados de eumelanina de Sarna et al.21,22 e Crippa et al.23 (Figura 5). A eumelanina é o principal pigmento responsável pela cor da pele e, portanto, fornece os dados mais precisos sobre como a melanina afetará os dispositivos ópticos. O espectro coletado usando o protocolo aqui descrito mostra alta correlação com esses valores da literatura.
Caracterização espectral do óleo de milho
Para investigar o espectro de absorção de um lipídio, o óleo de milho foi escolhido devido ao seu mínimo espalhamento óptico quando comparado a outros lipídios e sua conhecida semelhança na composição química com as gorduras animais1. Para tomar o espectro de absorção do óleo de milho, o óleo de milho foi usado como amostra com ar como referência. Como visto na Figura 6, o espectro de óleo de milho contém picos característicos em aproximadamente 930 nm, 1.210 nm e 1.410 nm. O espectro de óleo de milho resultante tem um SNR de 10363,1 e foi sobreposto ao espectro de óleo de milho1 de Cao et al., mostrando uma forte correlação.
Caracterização espectral da hemoglobina oxigenada e desoxigenada
Embora a caracterização da absorção de hemoglobina oxigenada e desoxigenada seja um dos feitos mais importantes na óptica biomédica, seus espectros de absorção abrangendo o VIS ao SWIR permanecem pouco compreendidos. Um dos aspectos mais desafiadores da determinação do espectro de absorção da hemoglobina oxigenada e desoxigenada no SWIR é a remoção da água no sangue, o que sobrecarrega a absorção relativamente pequena de hemoglobina. Para desembaraçar a absorbância da hemoglobina e da água, a hemoglobina foi primeiro isolada do sangue total humano usando centrifugação e o sobrenadante foi removido e substituído por água deuterada. A água deuterada também foi usada como referência e solvente em que a hemoglobina foi reconstituída para causar explosão hipotônica. Conforme mostrado na Figura 3, a água deuterada tem uma absorção óptica muito menor do que a água, tornando-a um solvente ideal e referência para medições de absorção SWIR. O espectro de hemoglobina oxigenada resultante abrange o VIS até o SWIR com um SNR de 23118,7 e correspondeu muito de pertoao espectro de hemoglobina oxigenada 4 publicado por Prahl (Figura 7). No VIS, o espectro da hemoglobina oxigenada mostra alta absorção com picos de absorção característicos em aproximadamente 415 nm e um pico duplo de aproximadamente 540 a 575 nm. No NIR, o espectro da hemoglobina oxigenada mostra um pico característico abrangendo uma faixa mais ampla de comprimentos de onda, aproximadamente 800 nm a 1.100 nm. No SWIR, a absorção de hemoglobina é baixa. No entanto, de aproximadamente 1.400 nm a 1.600 nm, o espectro da hemoglobina apresenta maior absorção com picos, provavelmente devido à água na hemoglobina que não pôde ser totalmente removida durante o processo de centrifugação.
Para hemoglobina desoxigenada, o ditionito de sódio foi adicionado à solução de hemoglobina para introduzir a dissociação do dioxigênio da hemoglobina oxigenada e converter a amostra em hemoglobina desoxigenada. O espectro resultante tem uma SNR de 9813,9 e foi comparado com o espectro de hemoglobina desoxigenada de Prahl e mostra uma correlação muito forte entre 400 nm e 1.000 nm4 (Figura 8). O espectro de hemoglobina desoxigenada resultante mostra picos de absorção característicos em aproximadamente 430 nm, 560 nm e 760 nm. Depois disso, a absorção de hemoglobina desoxigenada cai, mas contém picos de absorção menores em torno de 1.200 nm e de 1.400 nm a 1.600 nm. A absorbância entre 1.400 e 1.600 nm é provavelmente devido à água que não foi totalmente removida da amostra de hemoglobina durante o processo de centrifugação.
Comparação de absorvedores biológicos do VIS-SWIR
Os espectros completos do VIS-SWIR de todos os absorvedores biológicos caracterizados neste protocolo são mostrados na Figura 9, dimensionados com base em sua concentração biológica no tecido2, que destacam as diferenças espectrais distintas entre os absorvedores biológicos. Por exemplo, melanina, hemoglobina oxigenada e hemoglobina desoxigenada têm forte absorção característica no VIS que geralmente diminui com o comprimento de onda, enquanto a água e os lipídios mostram picos característicos no NIR e SWIR. No tecido biológico, a combinação de diminuições na melanina e hemoglobina, bem como diminuições no espalhamento óptico, proporcionam maior profundidade de penetração óptica no NIR e SWIR. Além disso, a absorção reduzida de melanina do NIR e do SWIR permite a investigação óptica de hemoglobina oxigenada e desoxigenada, lipídios e água com efeitos mínimos devido à pigmentação da pele.
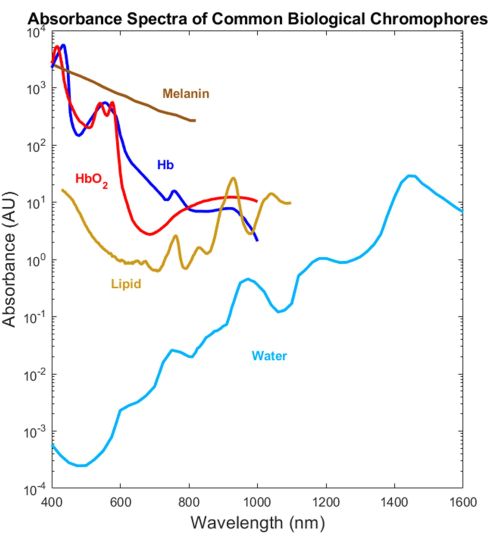
Figura 1: Espectros publicados anteriormente de absorvedores biológicos comuns através do UV ao SWIR. Os espectros de hemoglobina oxigenada e desoxigenada foram plotados usando dados de Prahl4. O espectro de melanina foi plotado usando dados de Sarna21 e Crippa23. O espectro lipídico foi plotado usando dados de van Veen24. O espectro da água foi plotado usando dados de Hale e Querry20. Abreviatura: SWIR = infravermelho de ondas curtas. Clique aqui para ver uma versão maior desta figura.
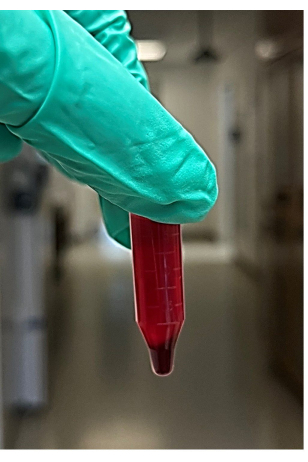
Figura 2: Foto do sobrenadante e do grânulo vermelho do sangue total centrifugado. Clique aqui para ver uma versão maior desta figura.
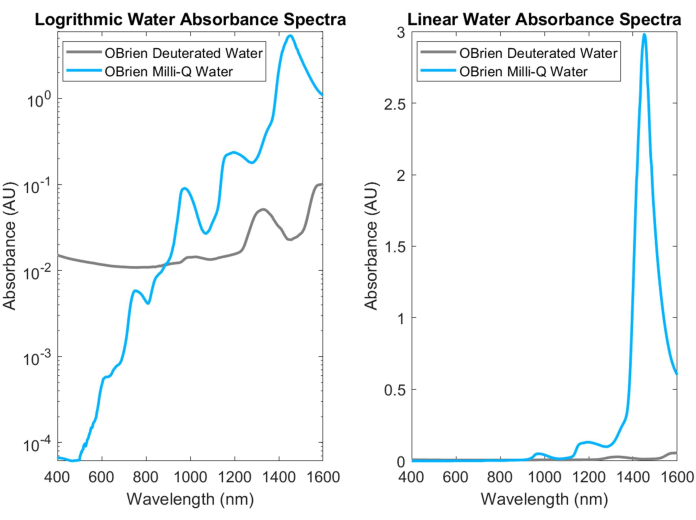
Figura 3: Comparação do espectro de absorbância da água e da água deuterada coletada com configurações de aquisição idênticas na escala de absorbância logarítmica (esquerda) e linear (direita). Clique aqui para ver uma versão maior desta figura.
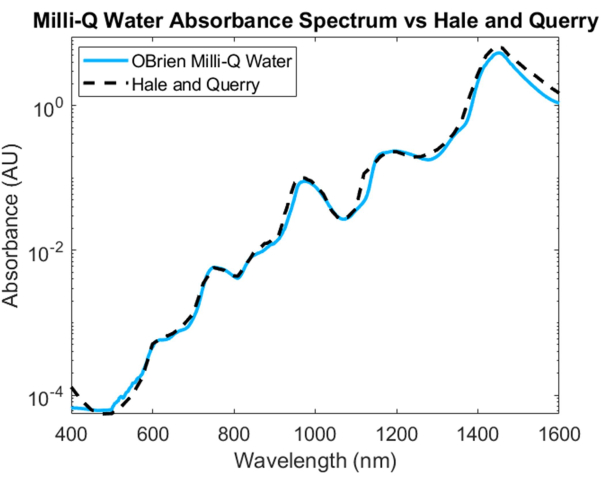
Figura 4: Comparação do espectro de absorbância de água adquirido usando os métodos aqui descritos versus Hale e Querry20. Clique aqui para ver uma versão maior desta figura.
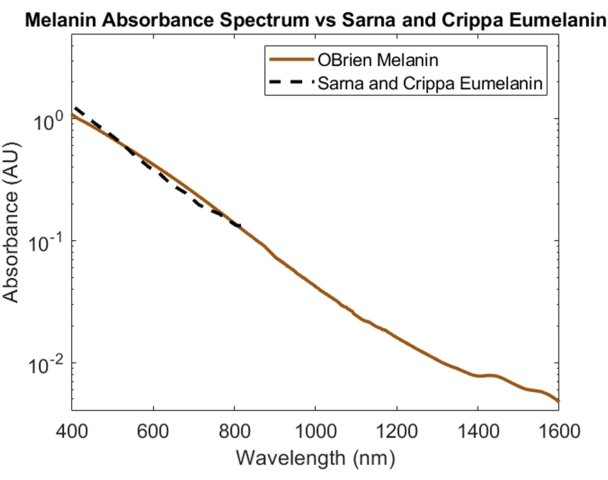
Figura 5: Comparação do espectro de absorbância de melanina adquirido usando os métodos aqui descritos versus Sarna et al.21,22 e Crippa et al.23. Clique aqui para ver uma versão maior desta figura.
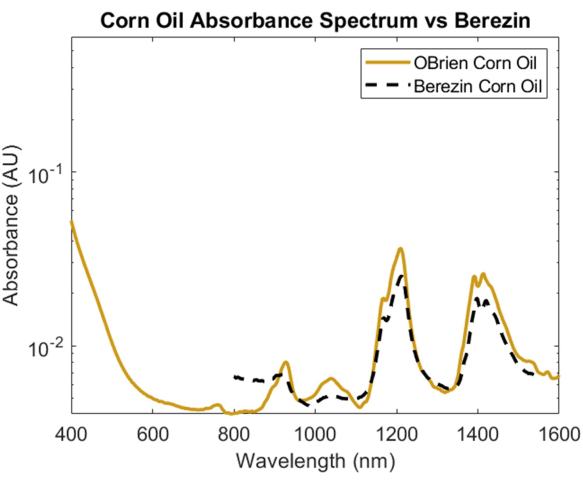
Figura 6: Comparação do espectro de absorbância de óleo de milho adquirido usando os métodos aqui descritos versus Cao et al.1. Clique aqui para ver uma versão maior desta figura.
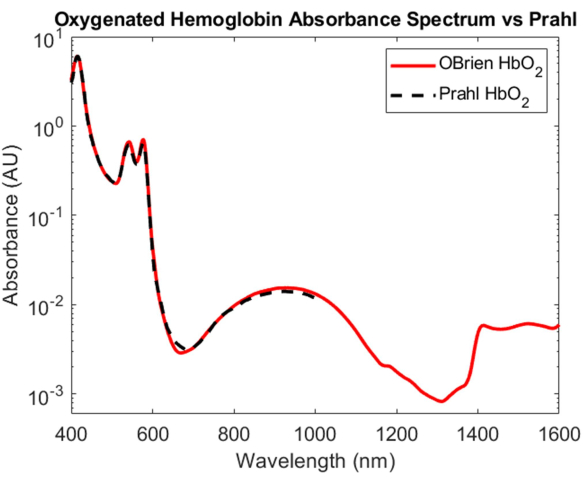
Figura 7: Comparação do espectro de absorbância da hemoglobina oxigenada adquirida usando os métodos aqui descritos versus Prahl4. Características espectrais de 1.400 a 1.600 nm provavelmente atribuídas à água residual na amostra. Clique aqui para ver uma versão maior desta figura.
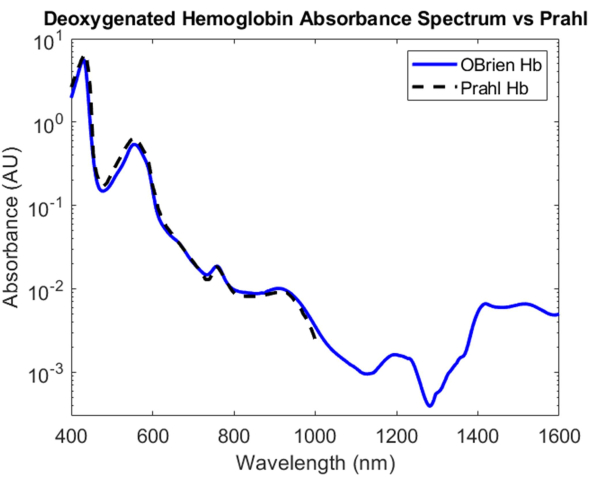
Figura 8: Comparação do espectro de absorbância da hemoglobina desoxigenada adquirida pelos métodos aqui descritos versus Prahl4. Características espectrais de 1.400 a 1.600 nm provavelmente atribuídas à água residual na amostra. Clique aqui para ver uma versão maior desta figura.
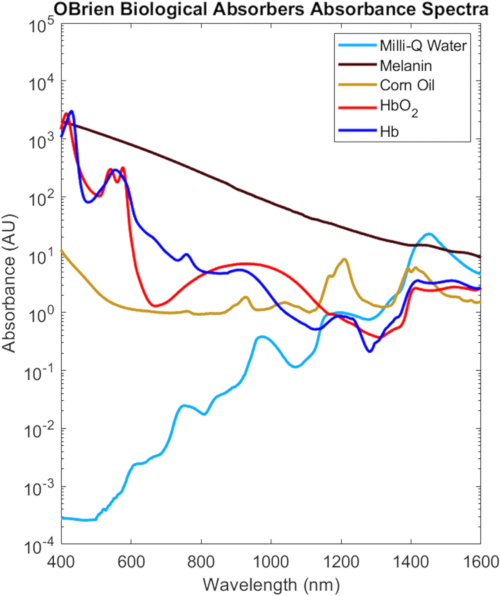
Figura 9: Espectros VIS-SWIR de absorvedores biológicos comuns. Abreviatura: VIS-SWIR = infravermelho visível de ondas curtas. Clique aqui para ver uma versão maior desta figura.
Discussão
O(s) protocolo(s) descrito(s) neste artigo pode(m) ser usado(s) para obter espectros de absorção VIS-SWIR de absorvedores biológicos e agentes de contraste. Aqui, mostramos etapas específicas para obter espectros de água, melanina, óleo de milho, hemoglobina oxigenada e hemoglobina desoxigenada abrangendo de 400 nm a 1.600 nm. A discussão a seguir abrange etapas críticas, dicas para otimização de medição, limitações do método e aplicações desse protocolo na biomedicina.
Embora todas as etapas do protocolo sejam importantes, algumas etapas críticas devem ser seguidas para obter espectros precisos com este protocolo. Primeiro, a amostra deve não ser espalhada; Por exemplo, ao obter hemoglobina oxigenada e desoxigenada do sangue, os dispersores na amostra devem ser filtrados (aqui, um filtro de seringa de 0,22 μm foi usado). Ao preparar a hemoglobina desoxigenada, a quantidade de ditionito de sódio adicionada não deve exceder o peso fornecido, pois isso tornará a amostra turva em porcentagens de peso mais altas e invalidará os requisitos da lei de Beer-Lambert.
Em segundo lugar, a água deuterada deve ser usada como solvente de amostra e referência para solutos solúveis em água, como a hemoglobina. No SWIR, a absorção de água é forte e pode mascarar outros absorvedores. Em terceiro lugar, as medições devem ser adquiridas dentro da faixa linear do detector, definida como a região em que uma mudança nos fótons que atingem o detector resulta em uma mudança linear no sinal do detector. Se ocorrer absorção mínima, o detector pode registrar uma absorbância de zero, mesmo que ocorra absorbância. Isso ocorre quando a amostra está muito diluída, o tempo de exposição é muito baixo e/ou o comprimento do caminho da cubeta é muito curto, mas pode ser remediado por um aumento na concentração da amostra, comprimento do caminho da cubeta e/ou tempo de exposição. Da mesma forma, se ocorrer alta absorção, o detector pode não registrar nenhum fóton e produzir uma linha plana denominada "saturação" que não é sensível a mudanças na absorbância. Isso ocorre quando a amostra está muito concentrada, o tempo de exposição é muito baixo e/ou o comprimento do caminho é muito longo, mas pode ser corrigido aumentando a concentração da amostra, aumentando o tempo de exposição e/ou diminuindo o comprimento do caminho da cubeta.
Quarto, os detectores usados devem ser lineares. Se não tiver certeza se o detector mostra uma resposta linear ao número de fótons que atingem o detector, várias diluições de uma amostra podem ser medidas com as mesmas configurações de aquisição para verificar se seus valores de absorbância mostram a tendência linear esperada entre absorbância e concentração. Alternativamente, uma única amostra pode ser medida e o tempo de exposição aumentado para testar se há um aumento linear na intensidade do detector. Ambos os testes devem produzir uma relação linear se o usuário estiver operando dentro de seus limites lineares (veja o terceiro ponto crítico acima).
Quinto, para permanecer dentro da faixa linear do detector para toda a faixa espectral do VIS-SWIR, a concentração da amostra, o tempo de exposição do detector e/ou o comprimento do caminho da cubeta precisarão ser alterados para diferentes regiões espectrais com absorbância significativamente maior ou menor da região espectral inicial.
Sexto, os espectros adquiridos usando diferentes concentrações de amostra ou comprimentos de caminho para diferentes regiões espectrais devem ser costurados por escala linear de uma região com base em mudanças conhecidas na concentração ou comprimento do caminho. Após a escala, os espectros devem ser costurados em um comprimento de onda sobreposto entre as duas regiões. Se uma medição abranger medições de diferentes detectores, deve haver espectros de absorbância sobrepostos que contenham o comprimento de onda de transição do detector desejado (800 nm é comumente usado ao costurar regiões UV-VIS e SWIR). Cada espectro é truncado no comprimento de onda de transição do detector e um espectro é escolhido para incluir seu valor original de absorbância de transição do detector. Em seguida, os dois espectros truncados são concatenados para criar um único espectro alongado.
Dicas adicionais para adquirir espectros de absorção de alta qualidade incluem o uso de um espectro publicado anteriormente da amostra de interesse, mesmo que não cubra toda a faixa espectral a ser medida, para orientar as medições. Conhecendo a priori a faixa de comprimento de onda com a menor absorbância, as medições podem ser iniciadas nesta região com a amostra de maior concentração e depois ajustadas e diluídas a partir daí. Pode ajudar a informar quantas regiões separadas precisarão ser medidas com base na magnitude das mudanças de absorbância esperadas. Também pode fornecer confiança de que o espectro esperado foi obtido se corresponder aos espectros publicados, ou se não corresponder aos espectros publicados, o método de preparação da amostra pode ser reexaminado junto com questões que podem estar distorcendo o espectro.
Os espectros de absorção podem exigir pós-processamento. Por exemplo, um filtro de média móvel digital pode ser usado para suavizar as medições de absorção e os pontos de erro conhecidos podem ser removidos com um reparo do conjunto de dados no qual os pontos errados são excluídos e a interpolação é realizada entre pontos não errôneos.
As limitações deste método incluem imprecisão para amostras com espalhamento óptico, como sangue total. Para medir com precisão a hemoglobina, a amostra de sangue é lisada e, em seguida, filtrada por seringa para remover a maioria dos outros componentes celulares residuais que causam espalhamento óptico. Da mesma forma, este método não é usado in vivo devido à dispersão do tecido. Embora as medições de absorbância baseadas na Lei de Beer-Lambert possam ser tediosas e às vezes difíceis de realizar, é o método padrão-ouro para medições de absorção óptica pura. Além disso, alguns solventes tornam particularmente difícil adquirir um espectro de absorbância pura de certos solutos. Por exemplo, o solvente nativo da hemoglobina oxigenada e desoxigenada é a água, mas a absorção da água é forte no SWIR, dominando a absorção da hemoglobina oxigenada. Portanto, tentamos remover a água do sangue por meio de centrifugação repetida, remoção do sobrenadante e reconstituição com água deuterada que tem absorção SWIR mais fraca. Suspeita-se que os espectros de hemoglobina oxigenada e desoxigenada resultantes do sangue humano heparinizado total contenham pequena absorção residual devido à absorção de água de aproximadamente 1.300 nm a 1.600 nm, conforme visto na Figura 3. Embora provavelmente não seja um desemaranhamento perfeito da água da hemoglobina oxigenada e desoxigenada, observamos um alinhamento próximo com os espectros de hemoglobina oxigenada e desoxigenada publicados altamente citados de 400 nm a 1.000 nm e estendemos o espectro em várias centenas de nanômetros 2,3.
Os protocolos aqui descritos ajudarão os pesquisadores a expandir as bibliotecas de espectros de absorção para incluir espectros VIS-SWIR de uma série de componentes biológicos e agentes de contraste. Esse conhecimento pode ser usado para melhorar a compreensão da biologia e fisiologia básicas por meio de imagens biomédicas não invasivas e detecção em comprimentos de onda mais profundos do que a maioria dos sistemas opera atualmente. A adição de comprimentos de onda SWIR amplia o tipo de componentes do tecido que podem ser monitorados de forma não invasiva e pode informar o desenvolvimento de novos monitoramentos e diagnósticos. Além disso, os dispositivos que operam no NIR e SWIR devem ajudar a minimizar o viés de pigmentação da pele que foi relatado para dispositivos ópticos que operam nas faixas VIS e NIR e é uma estratégia promissora para a criação de dispositivos médicos equitativos.
Divulgações
Christine O'Brien e Leonid Shmuylovich têm participação financeira na Armor Medical Inc. e podem se beneficiar financeiramente se a empresa for bem-sucedida na comercialização de seus produtos relacionados a esta pesquisa.
Agradecimentos
Este trabalho é apoiado por doações do National Institutes of Health (NIH) R00HD103954 e R21EB035823. A pesquisa relatada nesta publicação foi apoiada pelo Instituto de Ciências Clínicas e Translacionais da Universidade de Washington UL1TR002345 do Centro Nacional para o Avanço das Ciências Translacionais (NCATS) dos Institutos Nacionais de Saúde (NIH). O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a visão oficial do NIH. Os autores gostariam de agradecer a assistência dos membros do O'Brien Lab, Michael Vahey e seus membros do laboratório e Huanzhu Jiang.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm diameter syringe Filters | Sigma-Aldrich | SLGPM33RS | |
| 1000 µL Pipette | Millipore Sigma | EP3124000121 | |
| 200 µL Pipette | Millipore Sigma | EP3124000083 | |
| Conical Tubes | Avantor VWR | 21008-089 | |
| Corn Oil | Happy Belly | n/a | 48 Fl Oz |
| Deuterium Oxide | Cambridge Isotope Laboratories | DLM-4-100 | |
| Deuterium Oxide | Sigma-Aldrich | 7789-20-0 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D5879-1L | |
| Disposable 1 mL Syringe | BH Supplies | BH1LL | |
| Disposable Needle | Atshuhut/Amazon | 66941 | |
| Freezer (-80 °C) | Fisher Scientific | IUE386FARK | |
| Glass Beakers | Millipore Sigma | CLS1000PACK | |
| Glass or Quartz Cuvettes | Sigma-Aldrich | Z802875-1EA | 700 µL volume |
| Glass or Quartz Cuvettes | Thorlabs | CV10Q35EP | 3500 mL volume |
| Heparinized Human Blood | Lampire | 7203710 | |
| Microcentrifuge Tubes | Costar | 3213 | |
| Microcentrifuge--accuSpin Micro 17 | Fisher Scientific | 13-100-675 | |
| MilliQ Water | Millipore Sigma | ZMQSP0D01 | |
| OSRAM FCS 64640 150 W 24 V HLX Halogen Light Bulb | Amazon | B0001221DG | |
| Parafilm | Millipore Sigma | HS234526B | |
| Pipette Tips | Eppendorf | 22492055 | |
| Powdered Synthetic Melanin | Sigma-Aldrich | 8049-97-6 | |
| Scale | Sartorius | UX-11976-09 | |
| Sodium Dithionite | Sigma-Aldrich | 1065070500 | |
| Sonicator | Fisher Scientific | CPX1800 | |
| Spatula | Aozita | 000 00 0 1 2 3 | |
| UV/VIS/SWIR Spectrophotometer | On Line Instrument Systems | Olis Cary 14 | |
| Weigh Boats | Amazon | B07M5RMNPF |
Referências
- Cao, Q., Zhegalova, N. G., Wang, S. T., Akers, W. J., Berezin, M. Y. Multispectral imaging in the extended near-infrared window based on endogenous chromophores. J Biomed Opt. 18 (10), 101318 (2013).
- Yao, J., Wang, L. V. Sensitivity of photoacoustic microscopy. Photoacoustics. 2 (2), 87-101 (2014).
- Jacques, S. L. Optical properties of biological tissues: a review. Phys Med Biol. 58 (11), R37 (2013).
- . Optical absorption of hemoglobin Available from: https://omlc.org/spectra/hemoglobin/ (1999)
- Zhang, H., et al. Penetration depth of photons in biological tissues from hyperspectral imaging in shortwave infrared in transmission and reflection geometries. J Biomed Opt. 21 (12), 126006 (2016).
- Du, T., et al. Hyperspectral imaging and characterization of allergic contact dermatitis in the short-wave infrared. J Biophotonics. 13 (9), e202000040 (2020).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Mueller, G. J. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J Biomed Opt. 4 (1), 36-46 (1999).
- Kuenstner, J. T., Norris, K. H. Spectrophotometry of human hemoglobin in the near infrared region from 1000 to 2500 nm. J Near Infrared Spectrosc. 2 (2), 59-65 (1994).
- Spectral subtraction. Available from: https://www.spectroscopyonline.com/view/spectral-subtraction (2021)
- Sjoding, M. W., Dickson, R. P., Iwashyna, T. J., Gay, S. E., Valley, T. S. Racial bias in pulse oximetry measurement. N Engl J Med. 383 (25), 2477-2478 (2020).
- Fawzy, A., et al. Racial and ethnic discrepancy in pulse oximetry and delayed identification of treatment eligibility among patients with COVID-19. JAMA Intern Med. 182 (7), 730-738 (2022).
- Sudat, S. E. K., et al. Racial disparities in pulse oximeter device inaccuracy and estimated clinical impact on COVID-19 treatment course. Am J Epidemiol. 192 (5), 703-713 (2023).
- Keller, M. D., Harrison-Smith, B., Patil, C., Arefin, M. S. Skin colour affects the accuracy of medical oxygen sensors. Nature. 610 (7932), 449-451 (2022).
- Butler, W. L. Absorption spectroscopy of biological materials. Methods Enzymol. 24, 3-25 (1972).
- Tang, J., et al. Calculation extinction cross sections and molar attenuation coefficient of small gold nanoparticles and experimental observation of their UV-vis spectral properties. Spectrochim Acta A Mol Biomol Spectrosc. 191, 513-520 (2018).
- Rossman, G. R. Optical spectroscopy. Rev Mineral Geochem. 78 (1), 371-398 (2014).
- Thimsen, E., Sadtler, B., Berezin, M. Y. Shortwave-infrared (SWIR) emitters for biological imaging: a review of challenges and opportunities. Nanophotonics. 6 (5), 1043-1054 (2017).
- Briely-Sabo, K., Bjornerud, A. Accurate de-oxygenation of ex-vivo whole blood using sodium dithionite. Proc Intl Sot Mag Reson Med. 8, 2025 (2020).
- Skoog, D. A., Holler, F. J., Crouch, S. R. Principles of instrumental analysis. Cengage Leaning. , (2019).
- Hale, G. M., Querry, M. R. Optical constants of water in the 200-nm to 200-microm wavelength region. Appl Opt. 12 (3), 555-563 (1973).
- Sarna, T., Sealy, R. Photoinduced oxygen consumption in melanin systems. Action spectra and quantum yields for eumelanin and synthetic melanin. Photochem Photobiol. 39 (1), 69-74 (1984).
- Sarna, T., Swartz, H. A., Nordlund, J. J. The physical properties of melanins. The pigmentary system: Physiology and pathophysiology. , 311-341 (2006).
- Crippa, P., Cristofoletti, V., Romeo, N. A band model for melanin deduced from optical absorption and photoconductivity experiments. Biochim Biophys Acta. 538 (1), 164-170 (1978).
- van Veen, R., et al. Determination of visible near-IR absorption coefficients of mammalian fat using time- and spatially resolved diffuse reflectance and transmission spectroscopy. J Biomed Opt. 10 (5), 054004 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados