Method Article
Görünür olandan kısa dalga kızılötesine kadar uzanan biyolojik absorpsiyon spektrumlarının karakterizasyonu
Bu Makalede
Özet
Biyolojik numuneler, görünür (VIS) ve yakın kızılötesi (NIR) dalga boyu aralıklarına kıyasla kısa dalga kızılötesinde (SWIR) farklı optik özelliklere sahiptir. Bununla birlikte, saf SWIR absorpsiyon spektrumlarının kaydedilmesi zordur ve biyolojik moleküller için nadiren gerçekleştirilir. Bu makale, biyolojik emicilerin VIS-SWIR absorpsiyon spektrumlarını karakterize etmek için bir yöntem sunmaktadır.
Özet
İnvaziv olmayan ışık tabanlı fizyolojik izleme için, absorpsiyon spektroskopisi kullanılarak tek tek doku bileşenlerinin optimal dalga boyları tanımlanabilir. Bununla birlikte, daha uzun dalga boylarında donanımın hassasiyetinin olmaması nedeniyle, absorpsiyon spektroskopisi tipik olarak 400 ila 1.000 nm arasındaki görünür (VIS) ve yakın kızılötesi (NIR) aralığındaki dalga boyları için uygulanmıştır. Kısa dalga kızılötesi (SWIR) aralığındaki donanım gelişmeleri, araştırmacıların lipit, protein ve su için düşme karakteristik absorpsiyon zirvelerinin bulunduğu ~ 1.000 nm ila 3.000 nm aralığındaki dalga boylarını keşfetmelerini sağlamıştır. Bu moleküllerin VIS-NIR'de görselleştirilmesi zordur ve etiketsiz biyolojik kontrast kaynakları sağlayabilir. Ayrıca, cilt pigmentasyonundan sorumlu birincil kromofor olan melanin için daha düşük SWIR emilimi gözlenmiştir. Klinik olarak standart nabız oksimetreleri gibi in vivo optik cihazların, muhtemelen VIS aralığındaki daha güçlü melanin emilimi nedeniyle, koyu pigmentli cilde sahip kişilerde doğruluğun azaldığı bulunmuştur. Bu nedenle, cilt pigmentasyonu ile ilişkili hata, SWIR'de çalışan cihazlar kullanılarak azaltılabilir. Optik alet tasarımı, VIS'ten SWIR aralığına kadar çekirdek doku bileşenlerinin absorpsiyon özelliklerinin anlaşılmasıyla kolaylaştırılır. Bu makale, yaygın doku emicilerinin VIS-SWIR absorpsiyon spektrumlarını elde etmek için protokolleri ve enstrümantasyonu açıklamaktadır: oksijenli hemoglobin, oksijensiz hemoglobin, melanin, su ve lipid.
Giriş
Çoğu biyolojik emici, görünür (VIS, ~ 400-700 nm) ve yakın kızılötesi (NIR, ~ 700-1.000 nm) spektral aralıklarda optik olarak karakterize edilmiştir, ancak kısa dalga kızılötesi (SWIR, ~ 1.000-3.000 nm) 1,2,3,4 (Şekil 1). Bu, SWIR'nin daha düşük doku saçılımı ve azaltılmış melanin emiliminin yanı sıra su, lipit ve protein 1,5,6 için ek etiketsiz biyolojik kontrast nedeniyle daha derin ışık penetrasyonu sunmasına rağmen. VIS-SWIR'ı kapsayan absorpsiyon spektrumlarının eksikliği, bu SWIR avantajlarından yararlanan biyomedikal optik cihazların geliştirilmesini engelleyen bir bilgi boşluğu yaratmıştır. Geçmişte spektrumları karakterize etmek için çeşitli girişimler sunulmuş olsa da, önemli çözücü artefaktları olmayan saf bileşenlerin yüksek kaliteli VIS-SWIR absorpsiyon spektrumları 1,7,8'den yoksundur. Örneğin, hemoglobin gibi suda çözünür maddeler, SWIR'de suyu bir çözücü olarak kullanarak ve elde edilen spektrumlardan saf su emilimini çıkararak karakterize edilmiştir9. Bununla birlikte, bu yaklaşımın doğruluğu belirsizdir çünkü su bu bölgede baskın bir emicidir.
SWIR'de çalışmak, in vivo optik tanılama kullanılırken VIS'deki güçlü melanin emiliminin neden olduğu yanlılığı azaltma veya muhtemelen ortadan kaldırma gibi ek bir avantaja sahiptir. Çok sayıda çalışma, nabız oksimetrelerinin Siyah hastalarda oksijenasyonu abarttığını ve bu nedenle Siyah hastaların, nabız oksimetrelerinin tespit etmediği tehlikeli derecede düşük oksijen seviyelerine sahip olma olasılığının daha yüksek olduğunu bulmuştur10. Bu cilt pigmentasyon yanlılığı, birçok Siyah hipoksik hastanın11,12 gecikmiş ve yetersiz tıbbi tedavisine neden olmuş ve tüm cilt tonları için optik cihazların doğruluğunu artırmak için optik ve mühendislik topluluklarında bir eylem çağrısına yol açmıştır13. Yüksek melanin emici VIS dalga boylarından NIR ve SWIR'a geçmek, kritik öneme sahip biyomedikal optik teknolojilerindeki ırksal eşitsizlikleri azaltabilecek heyecan verici bir teknik yeniliktir.
Biyomoleküllerin temel-gerçek absorpsiyon spektrumlarının kaydedilmesi, çeşitli mühendislik ve biyomedikal uygulamalarda kullanılan doku örneklerinin optik özelliklerini anlamak için gereklidir14. Absorpsiyon spektroskopisi, dalga boyunun bir fonksiyonu olarak moleküle özgü ışık absorpsiyonunu ölçer. Çözelti içinde absorpsiyon ölçümlerini elde etmenin altın standart yöntemi, çözünmüş bir numuneden kolimasyonlu, monokromatik ışığı yönlendirmek ve iletilen ışığı, ışık kaynağından numunenin karşı tarafına yerleştirilen bir dedektör ile kaydetmektir. Numunenin absorpsiyonu (A) daha sonra Eşitlik (1) ile tanımlanır.
A = günlük10(I0/I) (1)
Burada Io , numune üzerindeki gelen ışık yoğunluğudur ve I, dedektöre çarpan numune boyunca iletilen ışığın yoğunluğudur. Io , tipik olarak ilgilenilen çözünen maddenin çözücüsü olan bir referansın ölçülmesiyle elde edilir, I ile aynı edinim ayarları kullanılarak. Absorpsiyon spektroskopisi, kantitatif absorpsiyon özellikleri sağlar ve optik saçılmaya sahip numuneler için geçerli olmayan Beer-Lambert Yasası (Eşitlik 2) tarafından yönetilir. Bu denklem, optik absorpsiyonun bir numunenin molar absorptivite katsayısının (ε, birim L·mol−1·cm−1) λ dalga boyunda molar konsantrasyonu (C, birim mol∙L-1) ve yol uzunluğu (L, birim cm) ile çarpılmasıyla belirlendiğini belirtir ve bu da numune15 boyunca kat edilen mesafe olarak tanımlanır:
A(λ) = ε(λ)*L*C (2)
Daha da önemlisi, molar absorptivite katsayısı her biyolojik emici için benzersizdir ve bir numunenin belirli bir dalga boyunda16 ışığı ne kadar güçlü emdiğini gösterir.
VIS'ten SWIR'a kadar uzanan absorpsiyon spektroskopisi ölçümleri alınırken, standart VIS-NIR spektrumlarının ötesinde donanımda ayarlamalar, numune hazırlama ve spektral son işlem gereklidir:
Donanım
VIS-NIR ölçümleri tipik olarak UV-VIS fotonlarına duyarlı fotokatotlara sahip bir silikon dedektör veya fotoçoğaltıcı tüpler (PMT) kullanırken, SWIR absorbasyonu, İndiyum Galyum Arsenit (InGaAs) dedektörü17 gibi SWIR fotonlarına duyarlı bir fotodetektör gerektirir. VIS, NIR ve SWIR sistemleri ayrıca tipik olarak bu optik aralıklarda ışık dağılımı için optik ızgaralar gibi dalga boyuna özgü dispersiyon elemanlarına ihtiyaç duyar. Ek olarak, SWIR absorpsiyonu, SWIR'deki plastik küvetlerden daha yüksek geçirgenliğe sahip cam veya kuvars küvetler gerektirir ve bu da onları VIS-SWIR spektrumları için daha uygun hale getirir. Tungsten-halojen lamba (bu protokolde kullanılan) gibi VIS-SWIR'ı kaplayan geniş ve nispeten homojen bir emisyona sahip bir ışık kaynağı veya kaynakları seçilmelidir. Gelen ışık gücünün, maruz kalma süresinin veya fotodetektörün ışığa maruz kaldığı sürenin ayarlanması, absorbans ölçümlerinin optimize edilmesine yardımcı olabilir.
Numune hazırlama
Numunenin konsantrasyonu veya küvetin yol uzunluğu, yukarıda Eşitlik (2)'de açıklandığı gibi meydana gelen absorpsiyon miktarını doğrusal olarak değiştirecektir ve bu nedenle, her ikisi de yüksek bir sinyal-gürültü oranı elde etmek için değiştirilebilir (SNR, burada tepe genliğinin oranı olarak hesaplanır ve spektrumun trendi bozulmuş bir bölgesinin standart sapmasına bölünür, tipik olarak SNR > 30 yüksek kalite olarak kabul edilir) spektrumun farklı bölümlerinde nispeten yüksek veya düşük ölçümler emicilik. Sulu bir çözeltide SWIR ölçümlerini optimize etmek için, SWIR1'de önemli ölçüde daha düşük absorpsiyon tepe noktalarına sahip olduğu için su (H 2 O) yerine ağır su veya döteryumlu su olarak da adlandırılan döteryum oksit(D2O) kullanılabilir. Bu, SWIR'deki baskın su emiliminin müdahalesi olmadan çözünen maddenin karakterizasyonuna izin verir.
Spektral son işleme
VIS-SWIR spektrumları, biri görünür-NIR (tipik olarak silikon veya UV-VIS'e duyarlı PMT) ve diğeri SWIR (tipik olarak InGaAs) için olmak üzere iki dedektör gerektirdiğinden ve tam bir VIS-SWIR spektrumu elde etmek için spektrumların birbirine dikilmesi gerektiğinden, son işlem gereklidir. Spektrumlar VIS-SWIR'ı kapladığında, absorpsiyon dalga boyu bölgesine bağlı olarak önemli ölçüde değişebilir ve doygunluğu önlemek için numunenin seyreltilmesi veya bazı alanlarda yol uzunluğunun azaltılması gerekebilir. Spektrumlar, numune konsantrasyonundaki veya yol uzunluğundaki değişiklikleri hesaba katmak için doğrusal olarak ölçeklendirilmeli ve daha sonra iki dalga boyu bölgesi içeren tek bir spektrum oluşturmak için bir araya getirilmelidir.
Aşağıdaki protokoller, beş örnek biyolojik emicinin VIS'ten SWIR'ye hazırlanmasını ve spektroskopik ölçümünü detaylandıracaktır: su (vücut ağırlığının ~% 60'ını oluşturur), melanin (cilt pigmentasyonu için birincil emici), mısır yağı (insan lipitleri için bir analog olarak kullanılır, çünkü partiler arasında düşük değişkenliğe sahiptir, insan ve hayvan lipitlerine yakın kimyasal bileşime sahiptir, ve minimum saçılma) ve oksijenli ve oksijeni alınmış hemoglobin (kandaki birincil emiciler).
Protokol
1. Numunelerin hazırlanması
- Su numunesinin hazırlanması
- Numuneyi hazırlamak için temiz bir kabı ultra saf suyla doldurun ve 0,22 μm'lik bir şırınga filtresi kullanarak filtreleyin. Numunenin absorpsiyon spektroskopisi ölçümlerini almak için şırınganın çıkışının temiz bir cam veya kuvars küvete yönlendirildiğinden emin olun.
- Referansı hazırlamak için temiz bir kabı döteryumlu su ile doldurun ve 0,22 μm'lik bir şırınga filtresi kullanarak filtreleyin. Şırınganın çıkışının, referans olarak hizmet etmesi için numune küveti ile aynı temiz cam veya kuvars küvete yönlendirildiğinden emin olun.
NOT: Filtreleme adımı, görünür bölgede güçlü katkıları olan sudaki küçük partikülleri filtreleyerek numuneden optik saçılmayı en aza indirecektir.
- Melanin örneğinin hazırlanması
- 3.5 mL dimetil sülfoksit (DMSO) ile doldurulmuş bir santrifüj tüpüne toz haline getirilmiş melanin ekleyerek 1.7 mg / mL'lik bir melanin çözeltisi hazırlayın. Başlamak için ölçümler, en yüksek melanin konsantrasyonunun gerekli olduğu, beklenen en düşük absorpsiyona sahip dalga boylarında başlamalıdır. SWIR için melanin ölçümlerine yaklaşık 1.7 mg / mL ile başlayın ve daha sonra VIS / NIR bölgeleri için 10x seyreltmeye (yaklaşık 0.17 mg / mL) kadar DMSO ile seyreltin.
- Toz haline getirilmiş melaninin DMSO'da çözünmesini sağlamak için tüpü 10 dakika boyunca sonikasyon yapın ve çözeltiyi spektroskopi ölçümleri için temiz bir cam veya kuvars küvete aktarın.
- Spektrometrenin doğrusal absorbans aralığı içinde kalın ve konsantrasyonu ve/veya yol uzunluğunu değiştirerek (örneğin, kısa yol uzunluğundan (1 veya 2 mm) 10 mm yol uzunluğuna geçiş yaparak) yüksek SNR ölçümleri sağlayın. Melanin emilimi, VIS'ten SWIR'a kadar uzanan geniş bir yelpazeye sahiptir. VIS için, yüksek molar sönme katsayısı nedeniyle en düşük konsantrasyon ve/veya yol uzunluğu küvetini kullanın; SWIR için, kalitatif olarak temiz bir spektroskopi ölçümü elde etmek için en yüksek melanin konsantrasyonu ve/veya yol uzunluğu küvetini kullanın.
- Mısır yağı numunesinin hazırlanması
- Spektroskopi ölçümleri için temiz bir bardağa veya kuvars küvete mısır yağı ekleyin.
- Referans olarak açık hava kullanın. Referans olarak herhangi bir küvet veya çözelti kullanılmayacaktır.
- Tam heparinize insan kanı ile oksijenli hemoglobin örneğinin hazırlanması
NOT: Heparinize insan kanının tamamı satın alınmış ve Amerika Birleşik Devletleri'nde bulunan FDA lisanslı toplama merkezlerinde toplanmıştır.- Hemoglobini kırmızı kan hücrelerinden (RBC'ler) izole etmek ve kandan mümkün olduğunca fazla su çıkarmak için, önce 1.800 μL tam heparinize insan kanını mikrosantrifüj tüplerine pipetleyin ve 10 dakika boyunca 9.6 × g'da santrifüjleyin.
NOT: Yaklaşık 4-6 mikrosantrifüj tüpü önerilir - Santrifüjlemeden sonra, tüpleri mikrosantrifüjden çıkarın, ardından peleti bozmadan süpernatanı (yaklaşık 850 μL olacaktır) santrifüjlenmiş kan örneğinden çıkarın ve atın (Şekil 2). Süpernatant, kırmızı kan hücresi peletinin üzerindeki sıvıyı (esas olarak plazma ve trombositler) içerir. Mikrosantrifüj tüpünün altındaki kırmızı kan hücresi peletini arayın.
- Her bir peleti, atılan süpernatant hacmi ile aynı hacimde döteryumlu su ile sulandırın. 9.6 × g'da 10 dakika boyunca tekrar santrifüjleyin.
- Tüpleri santrifüjden çıkarın, ardından peleti bozmadan süpernatanı atın.
- Peletleri, atılan süpernatant hacmi ile aynı hacimde döteryumlu su ile sulandırın. 9.6 × g'da 10 dakika boyunca yeniden santrifüjleyin.
- Tüpleri santrifüjden çıkarın, ardından süpernatanı bir pipet kullanarak çıkarın ve atın.
- Kırmızı kan hücrelerinin (RBC'ler) parçalanması: RBC peletlerini büyük hacimli (4,5 mL) döteryumlu su ile sulandırın, bu da hipotonik bir patlamaya neden olur. Pelet tüpe yapışıyorsa, gevşetmek için ölçülen 4.5 mL döteryumlu suyun bir kısmı ile durulayın.
NOT: Her santrifüjleme adımından sonra süpernatant hacmi artacaktır. Bu süpernatan hacmi 800 μL ila 1.600 μL arasında değişebilir. Parçalama için döteryumlu su hacmi, istenen numune konsantrasyonuna bağlı olarak değişebilir, ancak hipotonik patlamaya neden olacak kadar yüksek olması gerekir. - Parçalanmış kan çözeltisini bir iğne ve şırınga ile tüpten çıkarın; Ardından, kör uçlu şırınga iğnesini dikkatlice çıkarın ve biyolojik tehlike içeren bir keskin nişancı kabına atın. Şırıngayı 0,22 μm'lik bir şırınga filtresine bağlayın ve şırınga içeriğini filtreden 10 mm'lik bir yol uzunluğuna, 3,5 mL cama veya kuvars küvete itin.
NOT: Filtreleme adımı, çözeltideki hücresel organelleri ve zarları filtreleyerek numuneden optik saçılmayı en aza indirecektir. Numune çok konsantre olmuşsa ve şırınga filtresinin itilmesi zorlaşırsa, birden fazla şırınga filtresi kullanın. - Havadan gelen su buharının numuneyi kirletmesini önlemek için küveti küvetin üzerine hava geçirmez bir tıpa ile sabitleyin. Kontaminasyonu daha da önlemek ve hava geçirmez bir sızdırmazlık sağlamak için durdurucunun dışını parafilm ile filme alın.
NOT: 600 nm ila 1.600 nm arasındaki ölçümler için, 4,5 mL döteryumlu suda çözünen yaklaşık 1.200-1.600 μL pelet, kalitatif olarak temiz ölçümler verecektir.
NOT: Beklenen yüksek absorbansa (400 nm ila 600 nm) sahip spektral bölgeler için, doymamış absorbans değerleri elde etmek ve absorbans değerlerinin dedektörün doğrusal aralığı içinde olduğundan emin olmak için numunelerin döteryumlu su kullanılarak seyreltilmesi gerekecektir. Ek olarak, numuneler ve referans, kısa yol uzunluğundaki küvetlere (1 veya 2 mm) yerleştirilmelidir. Burada gösterilen spektrumlar için, numuneler 400-500 nm için 10x ve 500-600 nm için 5x seyreltildi ve 2 mm yol uzunluğuna sahip küvetlerde ölçüldü.
Daha kısa yol uzunluğu (1 veya 2 mm), yüksek emici dalga boylarında daha az ışık emilimine izin vererek, bazı fotonların dedektöre iletilmesini ve doğrusal algılama aralığında kalmasını sağlamaya yardımcı olur. - Filtrelenmiş kan solüsyonunu içeren numune küveti ile aynı yol uzunluğuna ve hacmine sahip temiz bir küvet elde edin ve temel ve referans ölçümler için döteryumlu su ile doldurun. Farklı spektral aralıklar için küvet yol uzunluklarını değiştiriyorsanız, her küvet yol uzunluğu için yeni bir referans spektrumu kaydedin.
- Hemoglobini kırmızı kan hücrelerinden (RBC'ler) izole etmek ve kandan mümkün olduğunca fazla su çıkarmak için, önce 1.800 μL tam heparinize insan kanını mikrosantrifüj tüplerine pipetleyin ve 10 dakika boyunca 9.6 × g'da santrifüjleyin.
- Tam heparinize insan kanı ile oksijeni giderilmiş hemoglobin örneğinin hazırlanması
- 1.4.1-1.4.8 adımlarını izleyin.
- Küvetteki kan çözeltisine sodyum ditiyonit ekleyin ve hafifçe karıştırın. Havadan gelen su buharının numuneyi kirletmesini önlemek için küveti küvetin üzerine hava geçirmez bir tıpa ile sabitleyin. Kontaminasyonu daha da önlemek ve hava geçirmez bir sızdırmazlık sağlamak için durdurucunun dışını parafilm ile filme alın. Sodyum ditiyonitin çözelti içinde çözünmesini sağlamak için küveti dikkatlice yan yana eğin; Kan çözeltisi kırmızı renkten daha koyu mor-kırmızı bir renge değişecektir.
NOT: Hemoglobini tamamen oksijenden arındırmak için gerekli olan sodyum ditiyonit kütlesi, mL kan çözeltisi başına yaklaşık 0.007 g'dır. Briley-Sӕbø ve Bjørnerud'a göre, tam kanın oksijenini tamamen gidermek için en az 2,5 mg sodyum ditiyonit/g kan gereklidir18. Ancak burada yapılan çalışmalarda bu konsantrasyonun yetersiz olduğu tespit edilmiştir. Yaklaşık 3.4 mg / g tam kan konsantrasyonunun, optik saçılma olmadan kan çözeltisini tamamen oksijenden arındırdığı bulunmuştur. 400 ila 600 nm arasındaki ölçümler için, kan çözeltisinin döteryumlu su ile seyreltilmesi gerekecektir. Gerekli sodyum ditiyonit kütlesini, seyreltmeden sonraki hacme değil, kullanılan bood çözeltisinin hacmine göre hesaplayın. 600 nm ila 1.600 nm arasındaki ölçümler için, 4,5 mL döteryumlu suda çözünen yaklaşık 1.200-1.600 μL pelet yüksek SNR ölçümleri verecektir.
Daha kısa bir yol uzunluğuna sahip küvet (1 veya 2 mm), yüksek emici dalga boylarında daha az ışık emilimine izin vererek, bazı fotonların dedektöre iletilmesini ve doğrusal algılama aralığında kalmasını sağlamaya yardımcı olur. - Temel ve referans ölçümler için filtrelenmiş kan solüsyonu ile döteryumlu su ile küvet olarak eşleşen yol uzunluğuna sahip başka bir küveti doldurun. Farklı spektral aralıklar için küvet yol uzunluklarını değiştiriyorsanız, her küvet yol uzunluğu için yeni bir referans spektrumu kaydedin.
2. Yüksek kaliteli absorpsiyon ölçümlerinin elde edilmesi
- Numuneleri ve referansı bölüm 1'de açıklandığı gibi hazırlayın ve VIS NIR-SWIR ölçümleri için cam veya kuvars küvetlere yerleştirin. Spektrometre lambasını ve dedektörleri açın ve spektrometre sistemine ve ışık kaynağına bağlı olarak sistemin en az 5-20 dakika ısınmasını bekleyin.
NOT: Beş dakika, burada toplanan spektrumlar için yeterli dedektör soğutması ve lamba çıkış kararlılığı sağladı, ancak bu, absorbans ölçümlerinin yakalanmasından önce her sistem için karakterize edilmelidir.
Bu toplama süresi boyunca numuneyi ve referansı elinizin altında bulundurun. Küvetlerin kapaklarının sağlam olduğundan emin olun. Absorpsiyon ölçümlerinin ortam ışığı tarafından bozulmasını önlemek için ölçüm alanını mümkün olduğunca karanlık tutun. - VIS-SWIR boyunca absorpsiyondaki geniş farklılık nedeniyle spektrumun farklı bölgeleri için aşağıdaki adımları tekrarlayın.
- Çift ışınlı bir konfigürasyon kullanıyorsanız (numune ve referans için iki ayrı dedektör), sistemin temel alındığından emin olun. Her bir dedektörün önüne çözücü içeren özdeş referans numuneleri yerleştirerek referans değeri elde edin ve numune absorbans spektrumu toplama için kullanılacak tam toplama parametrelerini kullanarak bir absorbans ölçümü toplayın. Dedektörlerin teorik olarak sıfır absorpsiyon göstermesi gerekirken, genellikle mükemmel değildir. Elde edilen absorbans spektrumunu, aynı ayarlar kullanılarak elde edilen tüm numune absorbans spektrumlarından çıkarın.
NOT: Veri toplama için alım ayarları her değiştirildiğinde taban çizgisi tekrarlanmalıdır. - Numuneyi spektrometreye yerleştirin ve ölçülecek bölgeyle ilgili dedektörü seçin (VIS-NIR = silikon veya UV-VIS PMT, SWIR = InGaAs) ve ölçüm parametreleri ayarlandıkça ölçümün sürekli olarak güncellendiği Canlı Modda absorbasyonu görüntüleyin.
- Varsayılan spektrometre parametrelerinden başlayarak, doygunluk olmadan niteliksel olarak temiz bir absorpsiyon spektrumu elde edilene kadar gelen ışık gücünü ve maruz kalma süresini ayarlayın.
- Parametrelerin ayarlanması niteliksel olarak temiz spektrumlarla sonuçlanmazsa, gelen ışık gücü, maruz kalma süresi, yol uzunluğu ve numune konsantrasyonu gibi parametreleri değiştirin. İlk olarak, gücü ve pozlama süresini ayarlamayı deneyin. Bu parametrelerin ayarlanması yüksek bir SNR spektrumu ile sonuçlanmazsa, numune konsantrasyonunu veya numunenin ve referansın yol uzunluğunu değiştirin.
NOT: Burada gösterilen spektrumların toplanmasında kullanılan varsayılan parametreler, 400 nm'de 15 nW ve 1.000 nm'de 20 nW gelen ışık gücü, 30 ms'lik maruz kalma süresi, 10 mm'lik küvet yolu uzunluğu ve numuneye özgü konsantrasyonlardır: %100 su, melanin 1.7 mg/mL, %100 mısır yağı, oksijenli hemoglobin (15.9 g/dL), ve oksijeni giderilmiş hemoglobin (15.9 g / dL). - SNR'yi artırmak için, veri noktası başına ortalama veri okuma sayısını artırın. Ortalama veri okuma sayısı ne kadar yüksek olursa, ölçüm başına süre o kadar uzun olur.
- Spektral çözünürlüğü artırmak için, ölçümün adım boyutunu (nm) spektrometrenin çözünürlük sınırına düşürün. Bu, ölçüm başına süreyi artıracaktır. Ek olarak, gelen ışık gücü bant genişliğini, en dar zirvenin tamgenişliğinin 1/10'una maksimum19'un yarısında düşürün.
- Ölçüm ayarları numune için optimize edildikten sonra, elde edilen her spektrum için ayarları belgeleyin.
- Bir spektrum elde etmek için, yalnızca referansın bir ölçümünü almak için optimize edilmiş ayarları kullanın. Ardından, referans küveti numune küveti ile değiştirin ve başka bir ölçüm yapın. Hem referans hem de numune ölçümlerini ayrı ayrı kaydettiğinizden emin olun.
NOT: Referans ölçümün doygunluk yapmaması zorunludur. Varsa, gelen ışık gücünü ve/veya maruz kalma süresini doygunluk olmayana kadar azaltın. Referans ve numune ölçümleri arasında tüm sistem parametrelerini aynı tutun; Birinin değiştirilmesi gerekiyorsa, diğerinin de eşleşmesi için tekrarlanması gerekecektir. - Her eşleştirilmiş referans ve numune ölçüm seti için, referans ölçümünü Io ve numune ölçümünü I olarak ele alarak absorbans A'yı (Eşitlik 1) hesaplayın.
- Numune konsantrasyonunda veya yol uzunluğunda farklılıklar gerektiren farklı bölgeleri bir araya getirmek için, spektral bölgelerden birine bir çarpma faktörü uygulayın. Örneğin, konsantrasyonun 1/10'una ve ikinci bir bölgeyle aynı yol uzunluğuna sahip bir birinci bölge için, iki bölgeyi birlikte uygun şekilde ölçeklendirmek için ilk spektral bölgeyi 10 ile çarpın.
NOT: Çarpma faktörü, bölgeler arasındaki konsantrasyon ve/veya yol uzunluğu farkı olmalıdır. - Spektrumlar, yol uzunluğu veya konsantrasyondaki farklılıklar için düzeltildikten sonra, iki bölgeyi bir araya getirmek için iki spektral bölgede çakışan bir dalga boyu seçin.
- Örtüşme dalga boyunda sona erecek şekilde iki spektrumu kesin; Geçiş spektral değerini dahil etmek için bir spektrum seçin. Daha geniş bir dalga boyu aralığında ortaya çıkan tek bir spektrum oluşturmak için iki kesilmiş spektrumu birleştirin.
- Parametrelerin ayarlanması niteliksel olarak temiz spektrumlarla sonuçlanmazsa, gelen ışık gücü, maruz kalma süresi, yol uzunluğu ve numune konsantrasyonu gibi parametreleri değiştirin. İlk olarak, gücü ve pozlama süresini ayarlamayı deneyin. Bu parametrelerin ayarlanması yüksek bir SNR spektrumu ile sonuçlanmazsa, numune konsantrasyonunu veya numunenin ve referansın yol uzunluğunu değiştirin.
- Çift ışınlı bir konfigürasyon kullanıyorsanız (numune ve referans için iki ayrı dedektör), sistemin temel alındığından emin olun. Her bir dedektörün önüne çözücü içeren özdeş referans numuneleri yerleştirerek referans değeri elde edin ve numune absorbans spektrumu toplama için kullanılacak tam toplama parametrelerini kullanarak bir absorbans ölçümü toplayın. Dedektörlerin teorik olarak sıfır absorpsiyon göstermesi gerekirken, genellikle mükemmel değildir. Elde edilen absorbans spektrumunu, aynı ayarlar kullanılarak elde edilen tüm numune absorbans spektrumlarından çıkarın.
Sonuçlar
Veriler, WUSTL Dijital Araştırma Materyalleri Deposu (DRMR) doi aracılığıyla edinilebilir: https://doi.org/10.7936/6RXS-108249
Suyun spektral karakterizasyonu
En yaygın biyolojik emicilerden biri olan su, NIR ve SWIR'de karakteristik, oldukça emici zirvelere sahiptir. Bu karakteristik tepe noktaları o kadar güçlüdür ki, suyun emilimini ölçerken, doygunluğu önlemek için genellikle döteryumlu su ile seyreltilmelidir. Su ve döteryumlu su arasındaki absorbans farkı, Şekil 3'te gösterilmekte ve döteryumlu suya göre su emmesinde bir büyüklük mertebesinden daha fazla artış vurgulanmaktadır. SWIR'deki güçlü su emme, numunede su içeren veya çözücü ve referans olarak su kullanan diğer biyolojik emicilerin absorpsiyon spektrumlarının elde edilmesini de zorlaştırır. Bu soruna çözüm olarak su yerine döteryumlu su kullanılabilir. Döteryumlu su, çok daha zayıf bir SWIR emici iken suya benzer şekilde hareket eder ve bu da onu SWIR spektroskopisi ölçümlerinde su için ideal bir alternatif haline getirir.
Suyun absorpsiyon spektrumunu ölçmek için numune olarak su ve referans olarak döteryumlu su kullanılmıştır. SWIR'da doygunluğu önlemek için numune, SWIR bölgesinde döteryumlu su ile seyreltildi. Elde edilen su emme spektrumu, VIS'de daha uzun dalga boylarında artan düşük absorpsiyon gösterir. Karakteristik absorpsiyon zirveleri yaklaşık 750 nm, 970 nm, 1,200 nm ve 1,450 nm'de görülebilir (Şekil 4). Elde edilen su spektrumu 3536.6'lık bir SNR'ye sahiptir ve Hale ve Querry'nin su emme spektrumu20 ile karşılaştırılmıştır ve ~ 500 nm ila 1.600 nm arasında benzer bir absorpsiyon eğrisi göstermiştir. Bununla birlikte, 400 ila 500 nm arasında, absorpsiyon eğrileri farklılık gösterir, Hale ve Querry daha düşük dalga boylarında daha yüksek bir absorbans değeri gösterir. Bu fark, daha uzun dalga boylarına3 kıyasla daha kısa dalga boylarında daha yüksek saçılmaya sahip olacak sudaki artık küçük parçacıklardan kaynaklanabilir ve Beer-Lambert yasasına dayalı absorpsiyon ölçümlerinde saçılma olmadığı varsayımlarını geçersiz kılabilir.
Melaninin spektral karakterizasyonu
Cildin birincil optik emicisi olan melanin, numune olarak toz haline getirilmiş melanin ve çözücü ve referans olarak DMSO kullanılarak spektral olarak karakterize edildi. Elde edilen spektrumun SNR'si 172'dir ve Sarna ve ark.21,22 ve Crippa ve ark.23'ten alınan eumelanin verileriyle karşılaştırılmıştır (Şekil 5). Eumelanin, cildin renginden sorumlu birincil pigmenttir ve bu nedenle, melaninin optik cihazları nasıl etkileyeceğine dair en doğru verileri sağlar. Burada açıklanan protokol kullanılarak toplanan spektrum, bu literatür değerleriyle yüksek korelasyon göstermektedir.
Mısır yağının spektral karakterizasyonu
Bir lipitin absorpsiyon spektrumunu araştırmak için, diğer lipitlerle karşılaştırıldığında minimum optik saçılımı ve kimyasal bileşimde hayvansal yağlara bilinen benzerliği nedeniyle mısır yağı seçilmiştir1. Mısır yağının absorpsiyon spektrumunu almak için, referans olarak hava ile numune olarak mısır yağı kullanıldı. Şekil 6'da görüldüğü gibi, mısır yağı spektrumu yaklaşık 930 nm, 1,210 nm ve 1,410 nm'de karakteristik zirveler içerir. Elde edilen mısır yağı spektrumu 10363.1'lik bir SNR'ye sahiptir ve Cao ve ark.'nın mısır yağı spektrumu1 ile kaplanmıştır ve güçlü bir korelasyon göstermiştir.
Oksijenli ve oksijensiz hemoglobinin spektral karakterizasyonu
Oksijenli ve oksijensiz hemoglobinin emiliminin karakterizasyonu biyomedikal optikteki en önemli başarılardan biri olsa da, VIS'ten SWIR'ye kadar uzanan absorpsiyon spektrumları tam olarak anlaşılamamıştır. SWIR'deki oksijenli ve oksijensiz hemoglobinin absorpsiyon spektrumunu belirlemenin en zorlu yönlerinden biri, nispeten küçük hemoglobin emilimini bastıran kandaki suyun uzaklaştırılmasıdır. Hemoglobin ve suyun emilimini çözmek için, hemoglobin önce santrifüjleme kullanılarak insan tam kanından izole edildi ve süpernatan çıkarıldı ve döteryumlu su ile değiştirildi. Döteryumlu su, hipotonik patlamaya neden olmak için hemoglobinin yeniden oluşturulduğu referans ve çözücü olarak da kullanıldı. Şekil 3'te gösterildiği gibi, döteryumlu su, sudan çok daha düşük bir optik absorpsiyona sahiptir, bu da onu SWIR absorpsiyon ölçümleri için ideal bir çözücü ve referans haline getirir. Elde edilen oksijenli hemoglobin spektrumu, 23118.7'lik bir SNR ile VIS'den SWIR'ye kadar uzanır ve Prahl'ın yayınlanmış oksijenli hemoglobin spektrumu4 ile çok yakından eşleşir (Şekil 7). VIS'de, oksijenli hemoglobin spektrumu, yaklaşık 415 nm'de karakteristik absorpsiyon zirveleri ve yaklaşık 540 ila 575 nm'de bir çift tepe noktası ile yüksek absorpsiyon gösterir. NIR'de, oksijenli hemoglobin spektrumu, yaklaşık 800 nm ila 1.100nm arasında daha geniş bir dalga boyu aralığını kapsayan karakteristik bir tepe gösterir. SWIR'de hemoglobin emilimi düşüktür. Bununla birlikte, yaklaşık 1.400 nm ila 1.600 nm arasında, hemoglobin spektrumu, muhtemelen santrifüjleme işlemi sırasında tam olarak çıkarılamayan hemoglobindeki su nedeniyle, zirvelerle daha yüksek emilim gösterir.
Oksijeni alınmış hemoglobin için, dioksijenin oksijenli hemoglobinden ayrışmasını sağlamak ve numuneyi oksijeni alınmış hemoglobine dönüştürmek için hemoglobin çözeltisine sodyum ditiyonit eklendi. Elde edilen spektrumun SNR'si 9813.9'dur ve Prahl'ın oksijeni alınmış hemoglobin spektrumu ile karşılaştırılmıştır ve 400 nm ile 1.000 nm arasında çok güçlü bir korelasyon göstermektedir4 (Şekil 8). Elde edilen oksijensiz hemoglobin spektrumu, yaklaşık 430 nm, 560 nm ve 760 nm'de karakteristik absorpsiyon zirveleri gösterir. Bundan sonra, oksijeni alınmış hemoglobinin emilimi düşer, ancak 1.200 nm civarında ve 1.400 nm ila 1.600 nm arasında daha küçük absorpsiyon zirveleri içerir. 1.400 ila 1.600 nm arasındaki absorbans, muhtemelen santrifüjleme işlemi sırasında hemoglobin örneğinden tam olarak çıkarılmayan sudan kaynaklanmaktadır.
VIS-SWIR'den biyolojik emicilerin karşılaştırılması
Bu protokolde karakterize edilen tüm biyolojik emicilerden gelen tam VIS-SWIR spektrumları, biyolojik emiciler arasındaki belirgin spektral farklılıkları vurgulayan doku 2'deki biyolojik konsantrasyonlarına göre ölçeklendirilmiş Şekil 9'da gösterilmektedir. Örneğin, melanin, oksijenli hemoglobin ve oksijensiz hemoglobin, VIS'de genellikle dalga boyu ile azalan güçlü, karakteristik absorpsiyona sahipken, su ve lipit, NIR ve SWIR'de karakteristik zirveler gösterir. Biyolojik dokuda, melanin ve hemoglobindeki azalmaların yanı sıra optik saçılmadaki azalmaların kombinasyonu, NIR ve SWIR'de artan optik penetrasyon derinliği sağlar. Ek olarak, NIR ve SWIR'in azaltılmış melanin emilimi, cilt pigmentasyonuna bağlı olarak oksijenli ve oksijensiz hemoglobin, lipid ve suyun minimum etkilerle optik olarak incelenmesini sağlar.
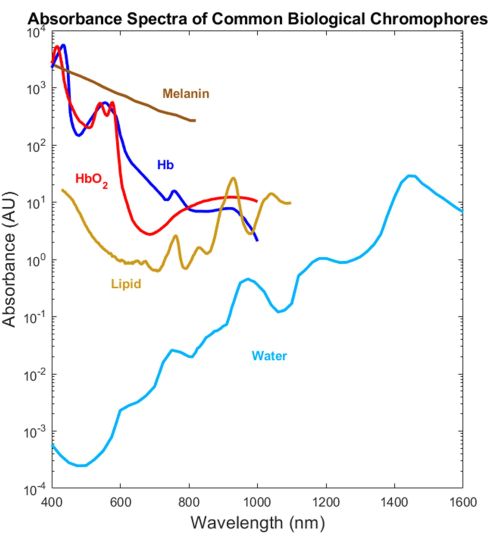
Şekil 1: UV'den SWIR'a kadar yaygın biyolojik emicilerin daha önce yayınlanmış spektrumları. Oksijenli ve oksijensiz hemoglobin spektrumları, Prahl4'ten gelen veriler kullanılarak çizildi. Melanin spektrumu, Sarna21 ve Crippa23'ten gelen veriler kullanılarak çizildi. Lipid spektrumu, van Veen24'ten alınan veriler kullanılarak çizildi. Su spektrumu, Hale ve Querry20'den gelen veriler kullanılarak çizildi. Kısaltma: SWIR = kısa dalga kızılötesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
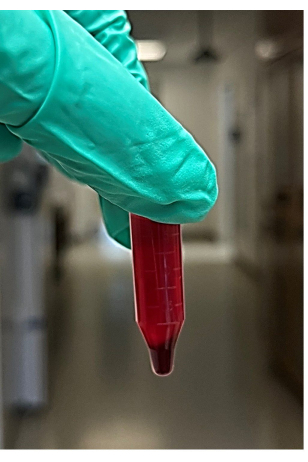
Şekil 2: Santrifüjlenmiş tam kandan elde edilen süpernatan ve kırmızı kan hücresi peletinin fotoğrafı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
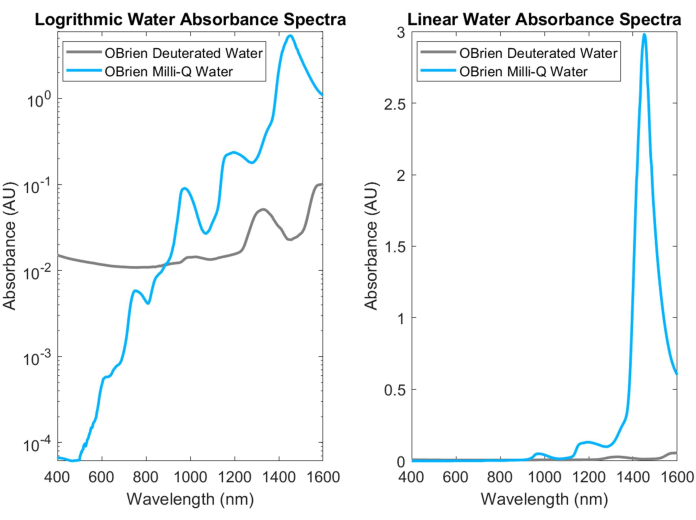
Şekil 3: Log (solda) ve doğrusal (sağda) absorbans ölçeğinde aynı toplama ayarlarıyla toplanan su ve döteryumlu suyun absorbans spektrumu karşılaştırması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
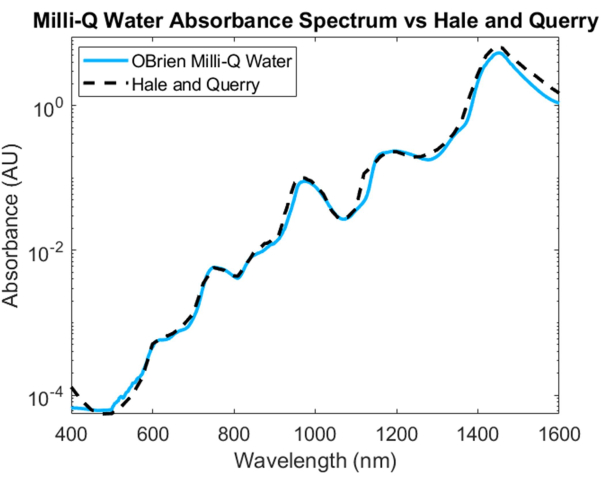
Şekil 4: Burada açıklanan yöntemler kullanılarak elde edilen su emme spektrumunun Hale ve Querry20 ile karşılaştırılması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
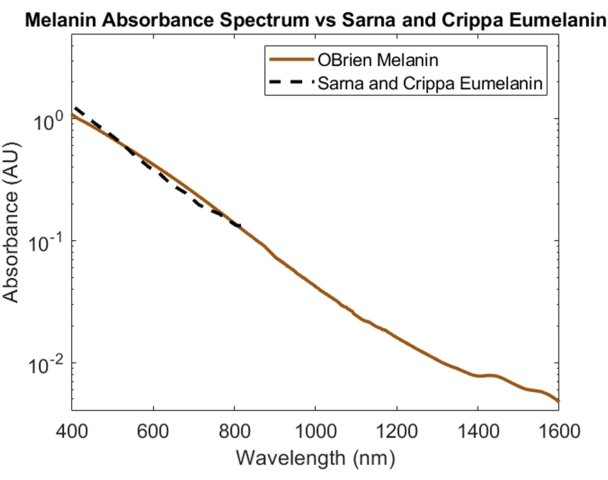
Şekil 5: Burada açıklanan yöntemler kullanılarak elde edilen melanin absorbans spektrumunun Sarna ve ark.21,22 ve Crippa ve ark.23 ile karşılaştırılması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
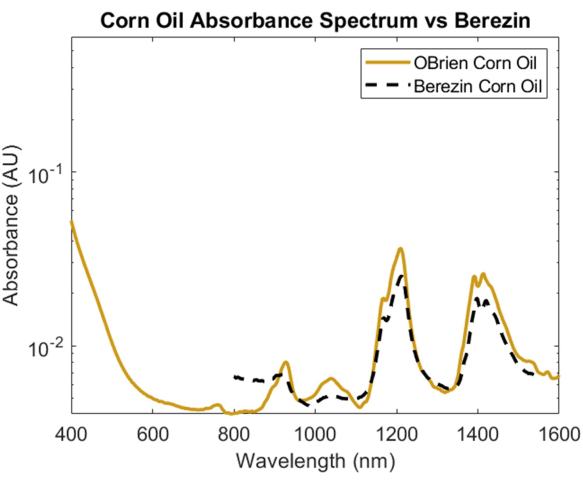
Şekil 6: Burada açıklanan yöntemler kullanılarak elde edilen mısır yağı absorbans spektrumunun Cao ve ark.1 ile karşılaştırılması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
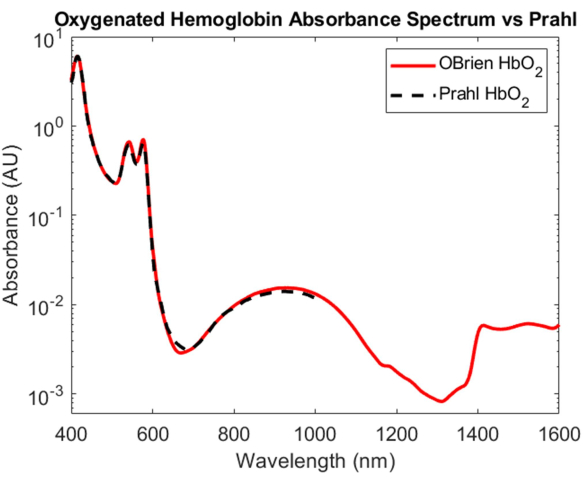
Şekil 7: Burada açıklanan yöntemler kullanılarak elde edilen oksijenli hemoglobin absorbans spektrumunun Prahl4 ile karşılaştırılması. 1.400 ila 1.600 nm arasındaki spektral özellikler, muhtemelen numunedeki artık suya atfedilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
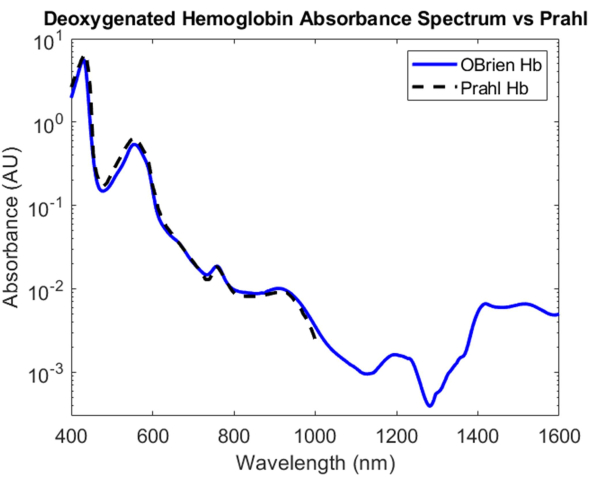
Şekil 8: Burada açıklanan yöntemler kullanılarak elde edilen oksijensiz hemoglobin absorbans spektrumunun Prahl4 ile karşılaştırılması. 1.400 ila 1.600 nm arasındaki spektral özellikler, muhtemelen numunedeki artık suya atfedilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
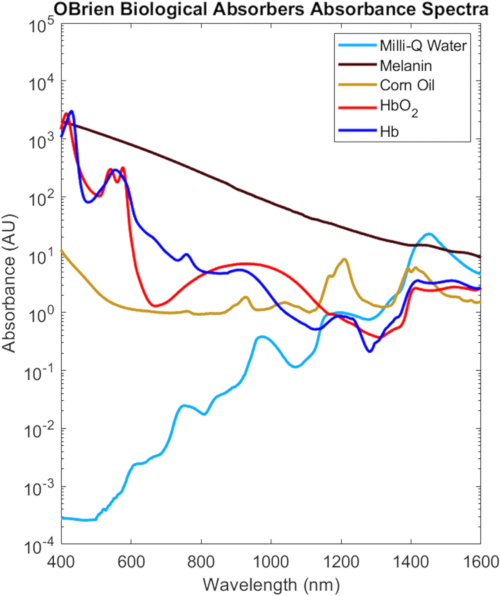
Şekil 9: Yaygın biyolojik emicilerin VIS-SWIR spektrumları. Kısaltma: VIS-SWIR = görünür-kısa dalga kızılötesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu makalede özetlenen protokol(ler), biyolojik emicilerin ve kontrast maddelerin VIS-SWIR absorpsiyon spektrumlarını elde etmek için kullanılabilir. Burada, 400 nm ila 1.600 nm arasında değişen su, melanin, mısır yağı, oksijenli hemoglobin ve oksijensiz hemoglobin spektrumlarını elde etmek için özel adımlar gösteriyoruz. Aşağıdaki tartışma, kritik adımları, ölçüm optimizasyonu için ipuçlarını, yöntemin sınırlamalarını ve bu protokolün biyotıp içindeki uygulamalarını kapsar.
Tüm protokol adımları önemli olsa da, bu protokol ile doğru spektrumlar elde etmek için birkaç kritik adımın izlenmesi gerekir. İlk olarak, numune saçılmamış olmalıdır; Örneğin, kandan oksijenli ve oksijeni alınmış hemoglobin elde edilirken, numunedeki dağıtıcılar filtrelenmelidir (burada 0.22 μm'lik bir şırınga filtresi kullanılmıştır). Oksijeni alınmış hemoglobin hazırlanırken, eklenen sodyum ditiyonit miktarı, numuneyi daha yüksek ağırlık yüzdelerinde bulanıklaştıracağı ve Beer-Lambert yasası gerekliliklerini geçersiz kılacak şekilde sağlanan ağırlığı aşmamalıdır.
İkinci olarak, döteryumlu su, numune çözücüsü ve hemoglobin gibi suda çözünür çözünen maddeler için referans olarak kullanılmalıdır. SWIR'da su emilimi güçlüdür ve diğer emicileri maskeleyebilir. Üçüncüsü, ölçümler, dedektöre ulaşan fotonlardaki bir değişikliğin dedektör sinyalinde doğrusal bir değişiklikle sonuçlandığı bölge olarak tanımlanan dedektörün doğrusal aralığı içinde elde edilmelidir. Minimum absorpsiyon meydana gelirse, absorbans meydana gelse bile dedektör sıfır absorbans kaydedebilir. Bu, numune çok seyreltik olduğunda, maruz kalma süresi çok düşük olduğunda ve/veya küvet yol uzunluğu çok kısa olduğunda meydana gelir, ancak numune konsantrasyonunda, küvet yol uzunluğunda ve/veya maruz kalma süresinde bir artışla düzeltilebilir. Benzer şekilde, yüksek absorpsiyon meydana gelirse, dedektör herhangi bir foton kaydedemez ve absorbanstaki değişikliklere duyarlı olmayan "doygunluk" olarak adlandırılan düz bir çizgi verebilir. Bu, numune çok konsantre olduğunda, maruz kalma süresi çok düşük olduğunda ve/veya yol uzunluğu çok uzun olduğunda meydana gelir, ancak numune konsantrasyonu artırılarak, maruz kalma süresi artırılarak ve/veya küvet yol uzunluğu azaltılarak düzeltilebilir.
Dördüncüsü, kullanılan dedektörler doğrusal olmalıdır. Dedektörün, dedektöre ulaşan foton sayısına doğrusal bir tepki gösterip göstermediği belirsizse, absorbans değerlerinin absorbans ve konsantrasyon arasında beklenen doğrusal eğilimi gösterip göstermediğini kontrol etmek için bir numunenin çeşitli seyreltmeleri aynı edinme ayarlarıyla ölçülebilir. Alternatif olarak, dedektör yoğunluğunda doğrusal bir artış olup olmadığını test etmek için tek bir numune ölçülebilir ve maruz kalma süresi artırılabilir. Kullanıcı doğrusal sınırları içinde çalışıyorsa her iki test de doğrusal bir ilişki vermelidir (yukarıdaki üçüncü kritik noktaya bakın).
Beşincisi, tüm VIS-SWIR spektral aralığı için dedektörün doğrusal aralığı içinde kalmak için, numune konsantrasyonunun, dedektör maruz kalma süresinin ve/veya küvet yolu uzunluğunun, başlangıç spektral bölgesinden önemli ölçüde daha yüksek veya daha düşük absorbansa sahip farklı spektral bölgeler için değiştirilmesi gerekecektir.
Altıncısı, farklı spektral bölgeler için farklı numune konsantrasyonları veya yol uzunlukları kullanılarak elde edilen spektrumlar, konsantrasyon veya yol uzunluğundaki bilinen değişikliklere dayalı olarak bir bölgenin doğrusal ölçeklendirilmesiyle birleştirilmelidir. Ölçeklendirmeden sonra, spektrumlar iki bölge arasında örtüşen bir dalga boyunda birbirine dikilmelidir. Bir ölçüm, farklı dedektörlerden gelen ölçümleri kapsayacaksa, istenen dedektör geçiş dalga boyunu içeren örtüşen absorbans spektrumları olmalıdır (UV-VIS ve SWIR bölgeleri dikilirken yaygın olarak 800 nm kullanılır). Her spektrum, dedektör geçiş dalga boyunda kesilir ve orijinal dedektör geçiş absorbans değerini içerecek şekilde bir spektrum seçilir. Daha sonra, iki kesilmiş spektrum, tek bir uzun spektrum oluşturmak için birleştirilir.
Yüksek kaliteli absorpsiyon spektrumları elde etmek için ek ipuçları, ölçümlere rehberlik etmek için, ölçülecek tüm spektral aralığı kapsamasa bile, ilgilenilen numunenin daha önce yayınlanmış bir spektrumunun kullanılmasını içerir. En düşük absorbansa sahip dalga boyu aralığını önceden bilerek, ölçümler bu bölgede en yüksek konsantrasyonlu numune ile başlatılabilir ve daha sonra oradan ayarlanabilir ve seyreltilebilir. Beklenen absorbans değişikliklerinin büyüklüğüne bağlı olarak kaç ayrı bölgenin ölçülmesi gerektiğini bildirmeye yardımcı olabilir. Ayrıca, yayınlanan spektrumlarla eşleşiyorsa beklenen spektrumun elde edildiğine dair güven sağlayabilir veya yayınlanmış spektrumlarla eşleşmiyorsa, numune hazırlama yöntemi, spektrumu bozabilecek konularla birlikte yeniden incelenebilir.
Absorpsiyon spektrumları son işlem gerektirebilir. Örneğin, absorpsiyon ölçümlerini yumuşatmak için bir dijital hareketli ortalama filtresi kullanılabilir ve hatalı noktaların silindiği ve hatalı olmayan noktalar arasında enterpolasyonun gerçekleştirildiği bir veri seti onarımı ile bilinen hata noktaları kaldırılabilir.
Bu yöntemin sınırlamaları, tam kan gibi optik saçılmaya sahip numuneler için yanlışlığı içerir. Hemoglobini doğru bir şekilde ölçmek için, kan örneği parçalanır ve daha sonra optik saçılmaya neden olan diğer kalıntı hücresel bileşenlerin çoğunu çıkarmak için şırınga ile filtrelenir. Benzer şekilde, bu yöntem doku saçılması nedeniyle in vivo olarak kullanılmaz. Beer-Lambert Yasasına dayalı absorbans ölçümleri sıkıcı ve bazen gerçekleştirilmesi zor olsa da, saf optik absorpsiyon ölçümleri için altın standart yöntemdir. Ek olarak, bazı çözücüler, belirli çözünen maddelerin saf bir absorbans spektrumunu elde etmeyi özellikle zorlaştırır. Örneğin, oksijenli ve oksijensiz hemoglobinin doğal çözücüsü sudur, ancak suyun emilimi SWIR'de güçlüdür ve oksijenli hemoglobin emilimine hakimdir. Bu nedenle, tekrarlanan santrifüjleme, süpernatantın uzaklaştırılması ve SWIR absorpsiyonu daha zayıf olan döteryumlu su ile yeniden yapılandırma yoluyla kandaki suyu çıkarmaya çalışıyoruz. Bütün heparinize insan kanından elde edilen oksijenli ve oksijensiz hemoglobin spektrumlarının, Şekil 3'te görüldüğü gibi yaklaşık 1.300 nm ila 1.600 nm arasında su absorpsiyonu nedeniyle küçük kalıntı absorpsiyon içerdiğinden şüphelenilmektedir. Suyun oksijenli ve oksijensiz hemoglobinden mükemmel bir şekilde çözülmesi muhtemel olmasa da, 400 nm'den 1.000 nm'ye kadar yüksek oranda alıntı yapılan yayınlanmış oksijenli ve oksijensiz hemoglobin spektrumları ile yakın hizalama gözlemliyoruz ve spektrumu birkaç yüz nanometreuzatıyoruz 2,3.
Burada açıklanan protokoller, araştırmacıların absorpsiyon spektrum kütüphanelerini bir dizi biyolojik bileşen ve kontrast maddenin VIS-SWIR spektrumlarını içerecek şekilde genişletmelerine yardımcı olacaktır. Bu bilgi, invaziv olmayan biyomedikal görüntüleme ve çoğu sistemin şu anda işlettiğinden daha derin dalga boylarında algılama yoluyla temel biyoloji ve fizyolojinin anlaşılmasını geliştirmek için kullanılabilir. SWIR dalga boylarının eklenmesi, non-invaziv olarak izlenebilen doku bileşenlerinin türünü genişletir ve yeni izleme ve teşhislerin geliştirilmesini bilgilendirebilir. Ayrıca, NIR ve SWIR'de çalışan cihazlar, VIS ve NIR aralıklarında çalışan optik cihazlar için bildirilen cilt pigmentasyon yanlılığını en aza indirmeye yardımcı olmalıdır ve adil tıbbi cihazlar oluşturmak için umut verici bir stratejidir.
Açıklamalar
Christine O'Brien ve Leonid Shmuylovich, Armor Medical Inc.'de finansal mülkiyet payına sahiptir ve şirketin bu araştırmayla ilgili ürünlerini pazarlamada başarılı olması durumunda finansal olarak fayda sağlayabilir.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri (NIH) R00HD103954 ve R21EB035823'ndan alınan hibelerle desteklenmektedir. Bu yayında bildirilen araştırmalar, Ulusal Sağlık Enstitüleri'nin (NIH) Ulusal Translasyonel Bilimleri Geliştirme Merkezi'nden (NCATS) Washington Üniversitesi Klinik ve Translasyonel Bilimler Enstitüsü hibe UL1TR002345 tarafından desteklenmiştir. İçerik yalnızca yazarların sorumluluğundadır ve NIH'nin resmi görüşünü temsil etmek zorunda değildir. Yazarlar, O'Brien Lab üyeleri, Michael Vahey ve laboratuvar üyeleri ve Huanzhu Jiang'ın yardımlarına teşekkür etmek isterler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm diameter syringe Filters | Sigma-Aldrich | SLGPM33RS | |
| 1000 µL Pipette | Millipore Sigma | EP3124000121 | |
| 200 µL Pipette | Millipore Sigma | EP3124000083 | |
| Conical Tubes | Avantor VWR | 21008-089 | |
| Corn Oil | Happy Belly | n/a | 48 Fl Oz |
| Deuterium Oxide | Cambridge Isotope Laboratories | DLM-4-100 | |
| Deuterium Oxide | Sigma-Aldrich | 7789-20-0 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D5879-1L | |
| Disposable 1 mL Syringe | BH Supplies | BH1LL | |
| Disposable Needle | Atshuhut/Amazon | 66941 | |
| Freezer (-80 °C) | Fisher Scientific | IUE386FARK | |
| Glass Beakers | Millipore Sigma | CLS1000PACK | |
| Glass or Quartz Cuvettes | Sigma-Aldrich | Z802875-1EA | 700 µL volume |
| Glass or Quartz Cuvettes | Thorlabs | CV10Q35EP | 3500 mL volume |
| Heparinized Human Blood | Lampire | 7203710 | |
| Microcentrifuge Tubes | Costar | 3213 | |
| Microcentrifuge--accuSpin Micro 17 | Fisher Scientific | 13-100-675 | |
| MilliQ Water | Millipore Sigma | ZMQSP0D01 | |
| OSRAM FCS 64640 150 W 24 V HLX Halogen Light Bulb | Amazon | B0001221DG | |
| Parafilm | Millipore Sigma | HS234526B | |
| Pipette Tips | Eppendorf | 22492055 | |
| Powdered Synthetic Melanin | Sigma-Aldrich | 8049-97-6 | |
| Scale | Sartorius | UX-11976-09 | |
| Sodium Dithionite | Sigma-Aldrich | 1065070500 | |
| Sonicator | Fisher Scientific | CPX1800 | |
| Spatula | Aozita | 000 00 0 1 2 3 | |
| UV/VIS/SWIR Spectrophotometer | On Line Instrument Systems | Olis Cary 14 | |
| Weigh Boats | Amazon | B07M5RMNPF |
Referanslar
- Cao, Q., Zhegalova, N. G., Wang, S. T., Akers, W. J., Berezin, M. Y. Multispectral imaging in the extended near-infrared window based on endogenous chromophores. J Biomed Opt. 18 (10), 101318 (2013).
- Yao, J., Wang, L. V. Sensitivity of photoacoustic microscopy. Photoacoustics. 2 (2), 87-101 (2014).
- Jacques, S. L. Optical properties of biological tissues: a review. Phys Med Biol. 58 (11), R37 (2013).
- . Optical absorption of hemoglobin Available from: https://omlc.org/spectra/hemoglobin/ (1999)
- Zhang, H., et al. Penetration depth of photons in biological tissues from hyperspectral imaging in shortwave infrared in transmission and reflection geometries. J Biomed Opt. 21 (12), 126006 (2016).
- Du, T., et al. Hyperspectral imaging and characterization of allergic contact dermatitis in the short-wave infrared. J Biophotonics. 13 (9), e202000040 (2020).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Mueller, G. J. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J Biomed Opt. 4 (1), 36-46 (1999).
- Kuenstner, J. T., Norris, K. H. Spectrophotometry of human hemoglobin in the near infrared region from 1000 to 2500 nm. J Near Infrared Spectrosc. 2 (2), 59-65 (1994).
- Spectral subtraction. Available from: https://www.spectroscopyonline.com/view/spectral-subtraction (2021)
- Sjoding, M. W., Dickson, R. P., Iwashyna, T. J., Gay, S. E., Valley, T. S. Racial bias in pulse oximetry measurement. N Engl J Med. 383 (25), 2477-2478 (2020).
- Fawzy, A., et al. Racial and ethnic discrepancy in pulse oximetry and delayed identification of treatment eligibility among patients with COVID-19. JAMA Intern Med. 182 (7), 730-738 (2022).
- Sudat, S. E. K., et al. Racial disparities in pulse oximeter device inaccuracy and estimated clinical impact on COVID-19 treatment course. Am J Epidemiol. 192 (5), 703-713 (2023).
- Keller, M. D., Harrison-Smith, B., Patil, C., Arefin, M. S. Skin colour affects the accuracy of medical oxygen sensors. Nature. 610 (7932), 449-451 (2022).
- Butler, W. L. Absorption spectroscopy of biological materials. Methods Enzymol. 24, 3-25 (1972).
- Tang, J., et al. Calculation extinction cross sections and molar attenuation coefficient of small gold nanoparticles and experimental observation of their UV-vis spectral properties. Spectrochim Acta A Mol Biomol Spectrosc. 191, 513-520 (2018).
- Rossman, G. R. Optical spectroscopy. Rev Mineral Geochem. 78 (1), 371-398 (2014).
- Thimsen, E., Sadtler, B., Berezin, M. Y. Shortwave-infrared (SWIR) emitters for biological imaging: a review of challenges and opportunities. Nanophotonics. 6 (5), 1043-1054 (2017).
- Briely-Sabo, K., Bjornerud, A. Accurate de-oxygenation of ex-vivo whole blood using sodium dithionite. Proc Intl Sot Mag Reson Med. 8, 2025 (2020).
- Skoog, D. A., Holler, F. J., Crouch, S. R. Principles of instrumental analysis. Cengage Leaning. , (2019).
- Hale, G. M., Querry, M. R. Optical constants of water in the 200-nm to 200-microm wavelength region. Appl Opt. 12 (3), 555-563 (1973).
- Sarna, T., Sealy, R. Photoinduced oxygen consumption in melanin systems. Action spectra and quantum yields for eumelanin and synthetic melanin. Photochem Photobiol. 39 (1), 69-74 (1984).
- Sarna, T., Swartz, H. A., Nordlund, J. J. The physical properties of melanins. The pigmentary system: Physiology and pathophysiology. , 311-341 (2006).
- Crippa, P., Cristofoletti, V., Romeo, N. A band model for melanin deduced from optical absorption and photoconductivity experiments. Biochim Biophys Acta. 538 (1), 164-170 (1978).
- van Veen, R., et al. Determination of visible near-IR absorption coefficients of mammalian fat using time- and spatially resolved diffuse reflectance and transmission spectroscopy. J Biomed Opt. 10 (5), 054004 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır