Method Article
Caractérisation des spectres d’absorption biologique allant du visible à l’infrarouge à ondes courtes
Dans cet article
Résumé
Les échantillons biologiques ont des caractéristiques optiques distinctes dans les gammes de longueurs d’onde infrarouge à ondes courtes (SWIR) par rapport aux gammes de longueurs d’onde visible (VIS) et proche infrarouge (NIR). Cependant, l’enregistrement des spectres d’absorption SWIR purs est difficile et rarement réalisé pour les molécules biologiques. Cet article présente une méthode pour caractériser les spectres d’absorption VIS-SWIR des absorbeurs biologiques.
Résumé
Pour la surveillance physiologique non invasive basée sur la lumière, les longueurs d’onde optimales des composants tissulaires individuels peuvent être identifiées à l’aide de la spectroscopie d’absorption. Cependant, en raison du manque de sensibilité du matériel aux longueurs d’onde plus longues, la spectroscopie d’absorption a généralement été appliquée pour les longueurs d’onde dans la gamme visible (VIS) et proche infrarouge (NIR) de 400 à 1 000 nm. Les progrès matériels dans la gamme infrarouge à ondes courtes (SWIR) ont permis aux chercheurs d’explorer des longueurs d’onde dans la gamme de ~1 000 nm à 3 000 nm dans lesquelles tombent des pics d’absorption caractéristiques pour les lipides, les protéines et l’eau. Ces molécules sont difficiles à visualiser dans le VIS-NIR et peuvent fournir des sources de contraste biologique sans marquage. De plus, une absorption plus faible de SWIR a été observée pour la mélanine, le chromophore primaire responsable de la pigmentation de la peau. Il a été constaté que les dispositifs optiques in vivo tels que les oxymètres de pouls standard cliniques avaient une précision réduite chez les personnes à la peau foncée, peut-être en raison de la plus forte absorption de mélanine dans la gamme VIS. Ainsi, l’erreur associée à la pigmentation de la peau pourrait être réduite en utilisant des appareils fonctionnant dans le SWIR. La conception d’instruments optiques est facilitée par la compréhension des propriétés d’absorption des composants tissulaires de base de la gamme VIS à la gamme SWIR. Cet article décrit les protocoles et les instruments permettant d’obtenir les spectres d’absorption VIS-SWIR des absorbeurs tissulaires courants : hémoglobine oxygénée, hémoglobine désoxygénée, mélanine, eau et lipides.
Introduction
La plupart des absorbeurs biologiques ont été caractérisés optiquement dans les gammes spectrales visible (VIS, ~400-700 nm) et proche infrarouge (NIR, ~700-1 000 nm), mais pas dans l’infrarouge à ondes courtes (SWIR, ~1 000-3 000 nm)1,2,3,4 (Figure 1). Et ce, malgré le fait que le SWIR offre une pénétration plus profonde de la lumière en raison d’une diffusion tissulaire plus faible et d’une absorption réduite de la mélanine, ainsi que d’un contraste biologique supplémentaire sans marquage pour l’eau, les lipides et les protéines 1,5,6. L’absence de spectres d’absorption couvrant le VIS-SWIR a créé un manque de connaissances qui empêche le développement de dispositifs optiques biomédicaux qui tirent parti de ces avantages SWIR. Bien que plusieurs tentatives de caractérisation des spectres aient été présentées dans le passé, il manque des spectres d’absorption VIS-SWIR de haute qualité de composants purs sans artefacts de solvant significatifs 1,7,8. Par exemple, des substances solubles dans l’eau telles que l’hémoglobine ont été caractérisées dans le SWIR en utilisant l’eau comme solvant et en soustrayant l’absorption d’eau pure des spectres résultants9. Cependant, la précision de cette approche n’est pas claire car l’eau est un absorbeur dominant dans cette région.
Travailler dans le SWIR présente l’avantage supplémentaire de réduire, voire d’éliminer, le biais causé par une forte absorption de mélanine dans le VIS lors de l’utilisation de diagnostics optiques in vivo. De nombreuses études ont montré que les oxymètres de pouls surestiment l’oxygénation chez les patients noirs, et en tant que tels, les patients noirs sont plus susceptibles d’avoir des niveaux d’oxygène dangereusement bas que les oxymètres de pouls n’ont pas détectés10. Ce biais de pigmentation de la peau a entraîné un traitement médical retardé et inadéquat de nombreux patients hypoxiques noirs11,12 et a suscité un appel à l’action dans les communautés de l’optique et de l’ingénierie pour améliorer la précision des dispositifs optiques pour tous les tons de peau13. Le passage des longueurs d’onde VIS absorbant la mélanine élevées au NIR et au SWIR est une innovation technique passionnante qui pourrait réduire les disparités raciales dans les technologies d’optique biomédicale d’une importance cruciale.
L’enregistrement des spectres d’absorption des biomolécules est essentiel pour comprendre les propriétés optiques des échantillons de tissus utilisés dans diverses applications d’ingénierie et biomédicales14. La spectroscopie d’absorption mesure l’absorption de la lumière spécifique à une molécule en fonction de la longueur d’onde. La méthode de référence pour acquérir des mesures d’absorption en solution consiste à diriger la lumière monochromatique collimatée à travers un échantillon dissous et à enregistrer la lumière transmise à l’aide d’un détecteur placé du côté opposé de l’échantillon par rapport à la source lumineuse. L’absorption (A) de l’échantillon est alors définie par l’équation (1).
A = log10(I0/I) (1)
Où Io est l’intensité de la lumière incidente sur l’échantillon, et I est l’intensité de la lumière transmise à travers l’échantillon qui frappe le détecteur. Io est acquis en mesurant une référence, qui est généralement le solvant du soluté d’intérêt, en utilisant les mêmes paramètres d’acquisition que I. La spectroscopie d’absorption fournit des propriétés d’absorption quantitatives et est régie par la loi de Beer-Lambert (équation 2), qui ne s’applique pas aux échantillons qui ont une diffusion optique. Cette équation stipule que l’absorption optique est déterminée par le coefficient d’absorption molaire d’un échantillon (ε, unités L·mol−1·cm−1) à la longueur d’onde λ multiplié par sa concentration molaire (C, unités mol∙L-1) et la longueur du trajet (L, unités cm), qui est définie comme la distance parcourue à travers l’échantillon15 :
A(λ) = ε(λ)*L*C (2)
Il est important de noter que le coefficient d’absorption molaire est unique à chaque absorbeur biologique et indique la force avec laquelle un échantillon absorbe la lumière à une longueur d’onde particulière16.
Lors de la prise de mesures par spectroscopie d’absorption allant du VIS au SWIR, des ajustements du matériel, de la préparation des échantillons et du post-traitement spectral sont nécessaires au-delà des spectres VIS-NIR standard :
Matériel
Les mesures VIS-NIR utilisent généralement un détecteur au silicium ou des tubes photomultiplicateurs (PMT) avec des photocathodes sensibles aux photons UV-VIS, tandis que l’absorbance SWIR nécessite un photodétecteur sensible aux photons SWIR, tel qu’un détecteur d’arséniure d’indium et de gallium (InGaAs)17. Les systèmes VIS, NIR et SWIR nécessitent également généralement des éléments de dispersion spécifiques à la longueur d’onde, tels que des réseaux optiques, pour la dispersion de la lumière dans ces gammes optiques. De plus, l’absorption SWIR nécessite des cuvettes en verre ou en quartz, qui ont une transmission plus élevée que les cuvettes en plastique dans le SWIR, ce qui les rend plus adaptées aux spectres VIS-SWIR. Il convient de choisir une ou plusieurs sources lumineuses à émission large et relativement uniforme couvrant le VIS-SWIR, comme une lampe tungstène-halogène (utilisée dans le présent protocole). Le réglage de la puissance lumineuse incidente, du temps d’exposition ou de la durée d’exposition du photodétecteur à la lumière peut aider à optimiser les mesures d’absorbance.
Préparation des échantillons
La concentration de l’échantillon ou la longueur du trajet de la cuvette modifiera linéairement la quantité d’absorption qui se produit comme décrit ci-dessus dans l’équation (2), et donc, l’un ou l’autre peut être modifié pour obtenir un rapport signal/bruit élevé (SNR, calculé ici comme le rapport de l’amplitude de crête divisée par l’écart-type d’une région du spectre sans tendance, généralement SNR > 30 est considéré comme de haute qualité) dans différentes sections du spectre avec des mesures relativement élevées ou faibles absorbance. Pour optimiser les mesures SWIR dans une solution aqueuse, l’oxyde de deutérium (D2O), également appelé eau lourde ou eau deutérée, peut être utilisé à la place de l’eau (H2O), car il a des pics d’absorption nettement plus faibles dans le SWIR1. Cela permet de caractériser le soluté sans interférence de l’absorption d’eau dominante dans le SWIR.
Post-traitement spectral
Le post-traitement est nécessaire car les spectres VIS-SWIR nécessitent deux détecteurs, l’un pour le visible proche infrarouge (généralement au silicium ou sensible aux UV-VIS) et l’autre pour le SWIR (généralement InGaAs), et les spectres doivent être assemblés pour obtenir un spectre VIS-SWIR complet. Lorsque les spectres couvrent le VIS-SWIR, l’absorption peut varier considérablement en fonction de la région de longueur d’onde, et il peut être nécessaire de diluer l’échantillon ou de diminuer la longueur du trajet dans certaines zones pour éviter la saturation. Les spectres doivent être mis à l’échelle linéairement pour tenir compte des changements de concentration de l’échantillon ou de la longueur du trajet, puis assemblés pour créer un spectre unique comprenant deux régions de longueurs d’onde.
Les protocoles suivants détailleront la préparation et la mesure spectroscopique du VIS au SWIR de cinq exemples d’absorbeurs biologiques : l’eau (comprend ~60 % du poids corporel), la mélanine (absorbeur primaire pour la pigmentation de la peau), l’huile de maïs (utilisée comme analogue des lipides humains car elle présente une faible variabilité entre les lots, une composition chimique proche des lipides humains et animaux, et une diffusion minimale), et de l’hémoglobine oxygénée et désoxygénée (les principaux absorbeurs dans le sang).
Protocole
1. Préparation des échantillons
- Préparation de l’échantillon d’eau
- Pour préparer l’échantillon, remplissez un récipient propre avec de l’eau ultrapure et filtrez-le à l’aide d’un filtre à seringue de 0,22 μm. Assurez-vous que la sortie de la seringue est dirigée vers une cuvette en verre ou en quartz propre pour prendre des mesures par spectroscopie d’absorption de l’échantillon.
- Pour préparer la référence, remplissez un récipient propre avec de l’eau deutérée et filtrez-le à l’aide d’un filtre à seringue de 0,22 μm. Assurez-vous que la sortie de la seringue est dirigée vers une cuvette en verre ou en quartz propre identique à celle de la cuvette d’échantillon pour servir de référence.
REMARQUE : L’étape de filtrage minimisera la diffusion optique de l’échantillon en filtrant les petites particules dans l’eau, qui ont de fortes contributions dans la région visible.
- Préparation de l’échantillon de mélanine
- Préparez une solution de 1,7 mg/mL de mélanine en ajoutant de la mélanine en poudre dans un tube à centrifuger rempli de 3,5 mL de diméthylsulfoxyde (DMSO). Pour commencer, les mesures doivent commencer aux longueurs d’onde avec l’absorption attendue la plus faible, où la concentration la plus élevée de mélanine est requise. Commencer les mesures de mélanine avec environ 1,7 mg/mL pour le SWIR et la diluer plus tard avec du DMSO jusqu’à une dilution de 10x (environ 0,17 mg/mL) pour les régions VIS/NIR.
- Sonicez le tube pendant 10 minutes pour vous assurer que la mélanine en poudre se dissout dans le DMSO et transférez la solution dans une cuvette en verre ou en quartz propre pour les mesures par spectroscopie.
- Restez dans la plage d’absorbance linéaire du spectromètre et assurez des mesures à rapport signal/bruit élevé en modifiant la concentration et/ou la longueur du trajet (par exemple, en passant d’une cuvette de 1 ou 2 mm à une cuvette de 10 mm). L’absorption de la mélanine a une large gamme allant du VIS au SWIR. Pour le VIS, utiliser la concentration et/ou la cuvette de mélanine la plus faible en raison de son coefficient d’extinction molaire élevé ; pour le SWIR, utilisez la plus forte concentration de mélanine et/ou la cuvette PathLength pour obtenir une mesure spectroscopique qualitativement propre.
- Préparation de l’échantillon d’huile de maïs
- Ajoutez de l’huile de maïs dans une cuvette en verre ou en quartz propre pour les mesures par spectroscopie.
- Utilisez l’air libre comme référence. Aucune cuvette ou solution ne sera utilisée comme référence.
- Préparation d’un échantillon d’hémoglobine oxygénée avec du sang humain hépariné entier
REMARQUE : Du sang humain hépariné entier a été acheté et prélevé dans des centres de prélèvement agréés par la FDA situés aux États-Unis.- Pour isoler l’hémoglobine des globules rouges (GR) et éliminer autant d’eau que possible du sang, pipetez d’abord 1 800 μL de sang humain entier hépariné dans des tubes de microcentrifugation et centrifugez à 9,6 × g pendant 10 min.
REMARQUE : Environ 4 à 6 tubes de microcentrifugation sont recommandés - Après la centrifugation, retirer les tubes de la microcentrifugeuse, puis retirer et jeter le surnageant (environ 850 μL) de l’échantillon de sang centrifugé sans perturber la pastille (figure 2). Le surnageant comprend le liquide (principalement le plasma et les plaquettes) situé au-dessus de la pastille de globules rouges. Recherchez la pastille de globule rouge au fond du tube de la microcentrifugeuse.
- Reconstituez chaque pastille avec le même volume d’eau deutérée que le volume de surnageant qui a été jeté. Centrifuger à nouveau à 9,6 × g pendant 10 min.
- Retirez les tubes de la centrifugeuse, puis jetez le surnageant sans déranger la pastille.
- Reconstituez la pastille avec le même volume d’eau deutérée que le volume de surnageant qui a été jeté. Recentrifuger à 9,6 × g pendant 10 min.
- Retirez les tubes de la centrifugeuse, puis retirez le surnageant à l’aide d’une pipette et jetez-le.
- Lyse des globules rouges (GR) : Reconstituez les pastilles de globules rouges avec un grand volume (4,5 ml) d’eau deutérée, ce qui provoquera une explosion hypotonique. Si la pastille colle au tube, rincez-la avec une partie des 4,5 ml d’eau deutérée mesurés pour la détacher.
REMARQUE : Le volume de surnageant augmentera après chaque étape de centrifugation. Ce volume de surnageant peut varier de 800 μL à 1 600 μL. Le volume d’eau deutérée pour la lyse peut changer en fonction de la concentration souhaitée de l’échantillon, mais doit être suffisamment élevé pour provoquer une explosion hypotonique. - Retirez la solution de sang lysé du tube à l’aide d’une aiguille et d’une seringue ; Ensuite, retirez délicatement l’aiguille de la seringue à embout émoussé et jetez-la dans un contenant pour objets tranchants et présentant un risque biologique. Connectez la seringue à un filtre de seringue de 0,22 μm et poussez le contenu de la seringue à travers le filtre dans une cuvette en verre ou en quartz de 10 mm de longueur, de 3,5 ml.
REMARQUE : L’étape de filtrage minimisera la diffusion optique de l’échantillon en filtrant les organites cellulaires et les membranes dans la solution. Si l’échantillon est très concentré et que le filtre de la seringue devient difficile à pousser, utilisez plusieurs filtres de seringue. - Fixez la cuvette à l’aide d’un bouchon étanche à l’air sur la cuvette pour éviter que la vapeur d’eau de l’air ne contamine l’échantillon. Parafilmez l’extérieur du bouchon pour éviter toute contamination et assurer une étanchéité à l’air.
REMARQUE : Pour des mesures de 600 nm à 1 600 nm, environ 1 200 à 1 600 μL de granulés dissous dans 4,5 mL d’eau deutérée donneront des mesures qualitativement propres.
REMARQUE : Pour les régions spectrales où l’absorbance attendue est élevée (400 nm à 600 nm), les échantillons devront être dilués à l’aide d’eau deutérée pour obtenir des valeurs d’absorbance non saturées et s’assurer que les valeurs d’absorbance sont dans la plage linéaire du détecteur. De plus, les échantillons et la référence doivent être placés dans des cuvettes de courte longueur (1 ou 2 mm). Pour les spectres présentés ici, les échantillons ont été dilués 10x pour 400-500 nm et 5x pour 500-600 nm et mesurés dans des cuvettes de 2 mm de longueur.
La longueur du trajet plus courte (1 ou 2 mm) permettra une absorption moindre de la lumière dans les longueurs d’onde très absorbantes, ce qui permet de s’assurer que certains photons passent au détecteur et restent dans la plage de détection linéaire. - Procurez-vous une cuvette propre avec la même longueur de trajet et le même volume que la cuvette d’échantillon contenant la solution de sang filtrée et remplissez-la d’eau deutérée pour les mesures de base et de référence. Si vous modifiez les longueurs de trajet de cuvette pour différentes plages spectrales, enregistrez un nouveau spectre de référence pour chaque longueur de trajet de cuvette.
- Pour isoler l’hémoglobine des globules rouges (GR) et éliminer autant d’eau que possible du sang, pipetez d’abord 1 800 μL de sang humain entier hépariné dans des tubes de microcentrifugation et centrifugez à 9,6 × g pendant 10 min.
- Préparation d’un échantillon d’hémoglobine désoxygénée avec du sang humain hépariné entier
- Suivez les étapes 1.4.1 à 1.4.8.
- Ajoutez de la dithionite de sodium à la solution sanguine dans la cuvette et remuez doucement. Fixez la cuvette à l’aide d’un bouchon étanche à l’air sur la cuvette pour éviter que la vapeur d’eau de l’air ne contamine l’échantillon. Parafilmez l’extérieur du bouchon pour éviter toute contamination et assurer une étanchéité à l’air. Inclinez soigneusement la cuvette d’un côté à l’autre pour vous assurer que la dithionite de sodium se dissout dans la solution ; La solution sanguine passera d’une couleur rouge à une couleur violet-rouge plus foncée.
REMARQUE : Pour désoxygéner complètement l’hémoglobine, la masse de dithionite de sodium nécessaire est d’environ 0,007 g par mL de solution sanguine. Selon Briley-Sӕbø et Bjørnerud, au moins 2,5 mg de dithionite de sodium/g de sang sont nécessaires pour désoxygéner complètement le sang total18. Cependant, cette concentration s’est avérée insuffisante dans les études ici. Une concentration d’environ 3,4 mg/g de sang total a permis de désoxygéner complètement la solution sanguine sans introduction de diffusion optique. Pour des mesures de 400 à 600 nm, la solution sanguine devra être diluée avec de l’eau deutérée. Calculer la masse de dithionite de sodium requise en fonction du volume de solution de sodium utilisé et non du volume après dilution. Pour des mesures de 600 nm à 1 600 nm, environ 1 200 à 1 600 μL de pastilles dissoutes dans 4,5 mL d’eau deutérée donneront des mesures de SNR élevées.
Une cuvette plus courte (1 ou 2 mm) permettra une absorption moindre de la lumière dans les longueurs d’onde très absorbantes, ce qui permet de s’assurer que certains photons passent au détecteur et restent dans la plage de détection linéaire. - Remplissez une autre cuvette avec la même longueur de trajet que la cuvette avec une solution de sang filtrée avec de l’eau deutérée pour les mesures de base et de référence. Si vous modifiez les longueurs de trajet de cuvette pour différentes plages spectrales, enregistrez un nouveau spectre de référence pour chaque longueur de trajet de cuvette.
2. Obtenir des mesures d’absorption de haute qualité
- Préparez les échantillons et les références comme décrit à la section 1 et placez-les dans des cuvettes en verre ou en quartz pour les mesures VIS NIR-SWIR. Allumez la lampe du spectromètre et les détecteurs et laissez le système se réchauffer pendant au moins 5 à 20 minutes, selon le système de spectromètre et la source lumineuse.
REMARQUE : Cinq minutes ont permis d’obtenir un refroidissement du détecteur et une stabilité de sortie de la lampe suffisants pour les spectres collectés dans le présent document, mais cela doit être caractérisé pour chaque système avant la saisie des mesures d’absorbance.
Gardez l’échantillon et la référence à portée de main pendant cette période de collecte. Assurez-vous que les couvercles des cuvettes sont bien fixés. Gardez l’espace de mesure aussi sombre que possible pour éviter la distorsion des mesures d’absorption par la lumière ambiante. - Répétez les étapes suivantes pour différentes régions du spectre en raison de la grande variation d’absorption dans le VIS-SWIR.
- Si vous utilisez une configuration à double faisceau (deux détecteurs distincts pour l’échantillon et la référence), assurez-vous que le système est de référence. Acquérez la ligne de base en plaçant des échantillons de référence identiques contenant le solvant devant chaque détecteur et collectez une mesure d’absorbance en utilisant les paramètres d’acquisition exacts à utiliser pour la collecte du spectre d’absorbance de l’échantillon. Bien que les détecteurs devraient théoriquement montrer une absorption nulle, ce n’est généralement pas parfait. Soustrayez le spectre d’absorbance résultant de tous les spectres d’absorbance d’échantillon acquis à l’aide des mêmes paramètres.
REMARQUE : La ligne de base doit être répétée chaque fois que les paramètres d’acquisition pour la collecte de données sont modifiés. - Placez l’échantillon dans le spectromètre et choisissez le détecteur pertinent pour la région à mesurer (VIS-NIR = silicium ou UV-VIS PMT, SWIR = InGaAs) et visualisez l’absorbance en mode Live, dans lequel la mesure est continuellement mise à jour au fur et à mesure que les paramètres de mesure sont réglés.
- En commençant par les paramètres par défaut du spectromètre, ajustez la puissance de la lumière incidente et le temps d’exposition jusqu’à ce qu’un spectre d’absorption qualitativement propre sans saturation soit obtenu.
- Si le réglage des paramètres n’aboutit pas à des spectres qualitativement propres, modifiez les paramètres tels que la puissance lumineuse incidente, le temps d’exposition, la longueur du trajet et la concentration de l’échantillon. Tout d’abord, essayez de régler la puissance et le temps d’exposition. Si le réglage de ces paramètres n’entraîne pas un spectre SNR élevé, modifiez la concentration de l’échantillon ou la longueur du trajet de l’échantillon et de la référence.
REMARQUE : Les paramètres par défaut utilisés pour la collecte des spectres présentés ici étaient une puissance lumineuse incidente de 15 nW à 400 nm et de 20 nW à 1 000 nm, un temps d’exposition de 30 ms, une longueur de trajet de cuvette de 10 mm et des concentrations spécifiques à l’échantillon : 100 % d’eau, mélanine 1,7 mg/mL, 100 % d’huile de maïs, hémoglobine oxygénée (15,9 g/dL), et hémoglobine désoxygénée (15,9 g/dL). - Pour augmenter le SNR, augmentez le nombre moyen de lectures de données par point de données. Plus le nombre moyen de lectures de données est élevé, plus le temps par mesure est long.
- Pour augmenter la résolution spectrale, réduisez la taille du pas (nm) de la mesure jusqu’à la limite de résolution du spectromètre. Cela augmentera le temps par mesure. De plus, réduisez la bandepassante de la puissance de la lumière incidente à 1/10e de la largeur totale du pic le plus étroit à la moitié de19 maximum.
- Une fois que les paramètres de mesure sont optimisés pour l’échantillon, documentez les paramètres pour chaque spectre acquis.
- Pour obtenir un spectre, utilisez les paramètres optimisés pour prendre une mesure de la référence uniquement. Ensuite, remplacez la cuvette de référence par la cuvette d’échantillon et effectuez une autre mesure. Assurez-vous d’enregistrer les mesures de référence et d’échantillon séparément.
REMARQUE : Il est impératif que la mesure de référence ne sature pas. Si c’est le cas, réduisez la puissance lumineuse incidente et/ou le temps d’exposition jusqu’à ce qu’il n’y ait plus de saturation. Maintenir tous les paramètres du système inchangés entre les mesures de référence et les mesures de l’échantillon ; Si l’un doit être modifié, l’autre devra également être répété pour qu’il corresponde. - Pour chaque ensemble apparié de mesures de référence et d’échantillon, calculez l’absorbance A (Eq 1) en traitant la mesure de référence comme Io et la mesure de l’échantillon comme I.
- Pour assembler différentes régions qui nécessitaient des différences de concentration d’échantillon ou de longueur de trajet, appliquez un facteur de multiplication à l’une des régions spectrales. Par exemple, pour une première région dont la concentration était de 1/10 et dont la longueur du trajet était identique à celle d’une deuxième région, multipliez la première région spectrale par 10 pour mettre correctement à l’échelle les deux régions.
REMARQUE : Le facteur multiplicateur doit être la différence de concentration et/ou de longueur de trajet entre les régions. - Une fois que les spectres ont été corrigés pour les différences de longueur de trajet ou de concentration, choisissez une longueur d’onde qui se chevauche dans les deux régions spectrales pour assembler les deux régions.
- Tronquez les deux spectres pour qu’ils se terminent à la longueur d’onde de chevauchement ; Choisissez un spectre pour inclure sa valeur spectrale de transition. Concaténez les deux spectres tronqués pour créer un spectre unique d’une gamme de longueurs d’onde plus large.
- Si le réglage des paramètres n’aboutit pas à des spectres qualitativement propres, modifiez les paramètres tels que la puissance lumineuse incidente, le temps d’exposition, la longueur du trajet et la concentration de l’échantillon. Tout d’abord, essayez de régler la puissance et le temps d’exposition. Si le réglage de ces paramètres n’entraîne pas un spectre SNR élevé, modifiez la concentration de l’échantillon ou la longueur du trajet de l’échantillon et de la référence.
- Si vous utilisez une configuration à double faisceau (deux détecteurs distincts pour l’échantillon et la référence), assurez-vous que le système est de référence. Acquérez la ligne de base en plaçant des échantillons de référence identiques contenant le solvant devant chaque détecteur et collectez une mesure d’absorbance en utilisant les paramètres d’acquisition exacts à utiliser pour la collecte du spectre d’absorbance de l’échantillon. Bien que les détecteurs devraient théoriquement montrer une absorption nulle, ce n’est généralement pas parfait. Soustrayez le spectre d’absorbance résultant de tous les spectres d’absorbance d’échantillon acquis à l’aide des mêmes paramètres.
Résultats
Les données sont disponibles via le dépôt numérique de matériaux de recherche (DRMR) de WUSTL doi : https://doi.org/10.7936/6RXS-108249
Caractérisation spectrale de l’eau
L’eau, l’un des absorbeurs biologiques les plus courants, présente des pics caractéristiques et très absorbants dans le proche infrarouge et le SWIR. Ces pics caractéristiques sont si forts que lors de la mesure de l’absorbance de l’eau, il faut souvent la diluer avec de l’eau deutérée pour éviter la saturation. La différence d’absorbance entre l’eau et l’eau deutérée est illustrée à la figure 3, mettant en évidence une augmentation de plus d’un ordre de grandeur de l’absorbance de l’eau par rapport à l’eau deutérée. La forte absorption d’eau dans le SWIR rend également difficile l’obtention des spectres d’absorption d’autres absorbeurs biologiques qui contiennent de l’eau dans l’échantillon ou qui utilisent l’eau comme solvant et référence. Comme solution à ce problème, l’eau deutérée peut être utilisée à la place de l’eau. L’eau deutérée agit de la même manière que l’eau tout en étant un absorbeur SWIR beaucoup plus faible, ce qui en fait un substitut idéal de l’eau dans les mesures de spectroscopie SWIR.
Pour mesurer le spectre d’absorption de l’eau, l’eau a été utilisée comme échantillon et l’eau deutérée comme référence. Pour éviter la saturation dans le SWIR, l’échantillon a été dilué avec de l’eau deutérée dans la région SWIR. Le spectre d’absorption d’eau qui en résulte montre une faible absorption dans le VIS, qui augmente à des longueurs d’onde plus longues. Des pics d’absorption caractéristiques peuvent être observés à environ 750 nm, 970 nm, 1 200 nm et 1 450 nm (figure 4). Le spectre de l’eau résultant a un SNR de 3536,6 et a été comparé au spectre d’absorption de l’eaude Hale et Querry 20, montrant une courbe d’absorption similaire de ~500 nm à 1 600 nm. Cependant, de 400 à 500 nm, les courbes d’absorption diffèrent, Hale et Querry montrant une valeur d’absorbance plus élevée aux longueurs d’onde inférieures. Cette différence pourrait être due à de petites particules résiduelles dans l’eau qui auront une diffusion plus élevée aux longueurs d’onde plus courtes par rapport aux longueurs d’onde plus longues3 et pourrait invalider les hypothèses de l’absence de diffusion dans les mesures d’absorption basées sur la loi de Beer-Lambert.
Caractérisation spectrale de la mélanine
La mélanine, principal absorbeur optique de la peau, a été caractérisée spectralement à l’aide de mélanine en poudre comme échantillon et de DMSO comme solvant et référence. Le spectre résultant a un SNR de 172 et a été comparé aux données sur l’eumélanine de Sarna et al.21,22 et de Crippa et al.23 (Figure 5). L’eumélanine est le principal pigment responsable de la couleur de la peau et, par conséquent, fournit les données les plus précises sur l’impact de la mélanine sur les dispositifs optiques. Le spectre collecté à l’aide du protocole décrit dans le présent document montre une forte corrélation avec ces valeurs de la littérature.
Caractérisation spectrale de l’huile de maïs
Pour étudier le spectre d’absorption d’un lipide, l’huile de maïs a été choisie en raison de sa diffusion optique minimale par rapport à d’autres lipides et de sa similitude connue dans sa composition chimique avec les graisses animales1. Pour prendre le spectre d’absorption de l’huile de maïs, l’huile de maïs a été utilisée comme échantillon avec l’air comme référence. Comme le montre la figure 6, le spectre de l’huile de maïs contient des pics caractéristiques à environ 930 nm, 1 210 nm et 1 410 nm. Le spectre d’huile de maïs résultant a un SNR de 10363,1 et a été superposé au spectre d’huile de maïs1 de Cao et al., montrant une forte corrélation.
Caractérisation spectrale de l’hémoglobine oxygénée et désoxygénée
Alors que la caractérisation de l’absorption de l’hémoglobine oxygénée et désoxygénée est l’une des prouesses les plus importantes de l’optique biomédicale, leurs spectres d’absorption allant du VIS au SWIR restent mal compris. L’un des aspects les plus difficiles de la détermination du spectre d’absorption de l’hémoglobine oxygénée et désoxygénée dans le SWIR est l’élimination de l’eau dans le sang, ce qui submerge l’absorption relativement faible de l’hémoglobine. Pour démêler l’absorbance de l’hémoglobine et de l’eau, l’hémoglobine a d’abord été isolée du sang total humain par centrifugation et le surnageant a été retiré et remplacé par de l’eau deutérée. L’eau deutérée a également été utilisée comme référence et solvant dans lequel l’hémoglobine a été reconstituée pour provoquer une poussée hypotonique. Comme le montre la figure 3, l’eau deutérée a une absorption optique beaucoup plus faible que l’eau, ce qui en fait un solvant idéal et une référence pour les mesures d’absorption SWIR. Le spectre de l’hémoglobine oxygénée qui en résulte s’étend du VIS au SWIR avec un SNR de 23118,7 et correspond très étroitementau spectre 4 de l’hémoglobine oxygénée publié par Prahl (Figure 7). Dans le VIS, le spectre de l’hémoglobine oxygénée présente une absorption élevée avec des pics d’absorption caractéristiques à environ 415 nm et un pic doublet d’environ 540 à 575 nm. Dans le proche infrarouge, le spectre de l’hémoglobine oxygénée présente un pic caractéristique couvrant une gamme plus large de longueurs d’onde, d’environ 800 nm à 1 100 nm. Dans le SWIR, l’absorption de l’hémoglobine est faible. Cependant, d’environ 1 400 nm à 1 600 nm, le spectre de l’hémoglobine montre une absorption plus élevée avec des pics, probablement en raison de l’eau contenue dans l’hémoglobine qui n’a pas pu être complètement éliminée pendant le processus de centrifugation.
Pour l’hémoglobine désoxygénée, de la dithionite de sodium a été ajoutée à la solution d’hémoglobine pour introduire la dissociation du dioxygène de l’hémoglobine oxygénée et convertir l’échantillon en hémoglobine désoxygénée. Le spectre résultant a un SNR de 9813,9 et a été comparé au spectre de l’hémoglobine désoxygénée de Prahl et montre une très forte corrélation entre 400 nm et 1 000 nm4 (Figure 8). Le spectre de l’hémoglobine désoxygénée qui en résulte présente des pics d’absorption caractéristiques à environ 430 nm, 560 nm et 760 nm. Après cela, l’absorption de l’hémoglobine désoxygénée diminue mais contient des pics d’absorption plus petits autour de 1 200 nm et de 1 400 nm à 1 600 nm. L’absorbance entre 1 400 et 1 600 nm est probablement due à l’eau qui n’a pas été complètement éliminée de l’échantillon d’hémoglobine pendant le processus de centrifugation.
Comparaison des absorbeurs biologiques du VIS-SWIR
Les spectres VIS-SWIR complets de tous les absorbeurs biologiques caractérisés dans ce protocole sont illustrés à la figure 9, mis à l’échelle en fonction de leur concentration biologique dans le tissu2, qui mettent en évidence les différences spectrales distinctes entre les absorbeurs biologiques. Par exemple, la mélanine, l’hémoglobine oxygénée et l’hémoglobine désoxygénée ont une absorption forte et caractéristique dans le VIS qui diminue généralement avec la longueur d’onde, tandis que l’eau et les lipides présentent des pics caractéristiques dans le NIR et le SWIR. Dans les tissus biologiques, la combinaison de diminutions de la mélanine et de l’hémoglobine ainsi que des diminutions de la diffusion optique permet d’augmenter la profondeur de pénétration optique dans le proche infrarouge et le SWIR. De plus, l’absorption réduite de mélanine dans le NIR et le SWIR permettent une étude optique de l’hémoglobine oxygénée et désoxygénée, des lipides et de l’eau avec des effets minimes dus à la pigmentation de la peau.
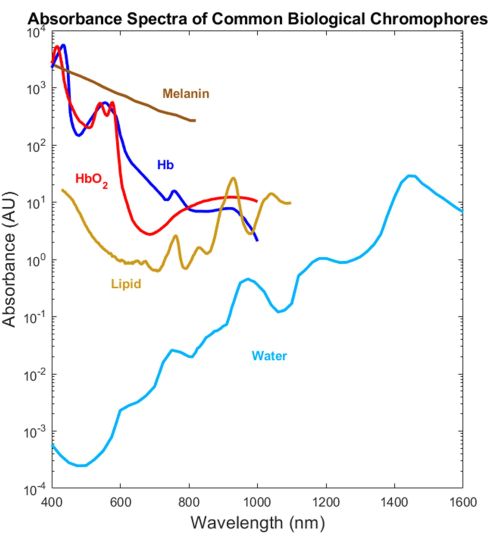
Figure 1 : Spectres précédemment publiés d’absorbeurs biologiques courants dans l’UV jusqu’au SWIR. Les spectres d’hémoglobine oxygénée et désoxygénée ont été tracés à l’aide des données de Prahl4. Le spectre de la mélanine a été tracé à l’aide des données de Sarna21 et Crippa23. Le spectre lipidique a été tracé à l’aide des données de van Veen24. Le spectre de l’eau a été tracé à l’aide des données de Hale et Querry20. Abréviation : SWIR = infrarouge à ondes courtes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
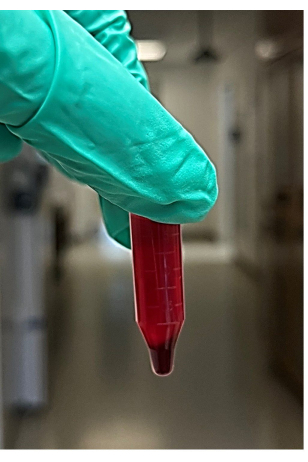
Figure 2 : Photo du surnageant et de la pastille de globules rouges à partir de sang total centrifugé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
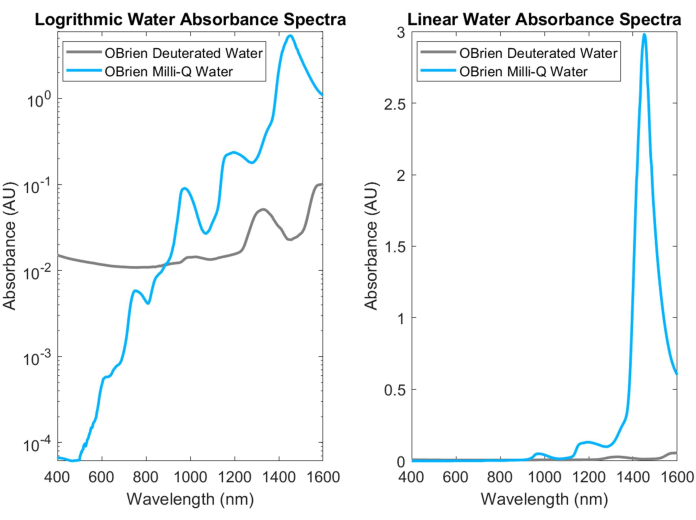
Figure 3 : Comparaison du spectre d’absorbance de l’eau et de l’eau deutérée collectée avec des paramètres d’acquisition identiques sur l’échelle d’absorbance logarithmique (à gauche) et linéaire (à droite). Veuillez cliquer ici pour voir une version agrandie de cette figure.
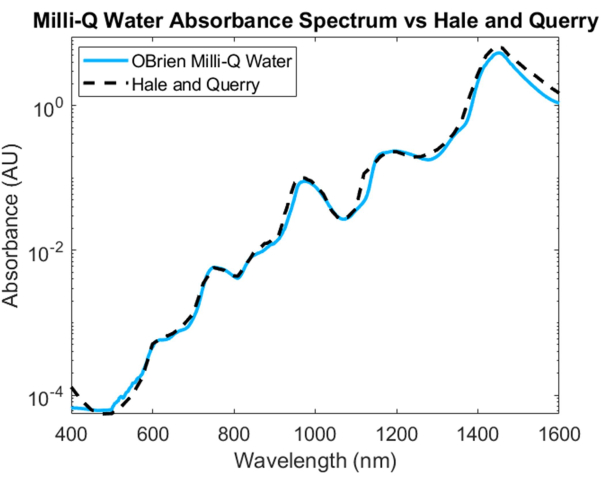
Figure 4 : Comparaison du spectre d’absorbance de l’eau acquis à l’aide des méthodes décrites dans le présent document par rapport à Hale et Querry20. Veuillez cliquer ici pour voir une version agrandie de cette figure.
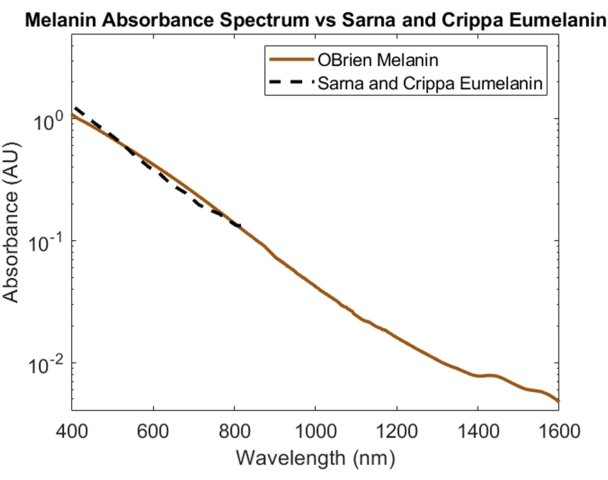
Figure 5 : Comparaison du spectre d’absorbance de la mélanine acquis à l’aide des méthodes décrites dans le présent document par rapport à Sarna et al.21,22 et Crippa et al.23. Veuillez cliquer ici pour voir une version agrandie de cette figure.
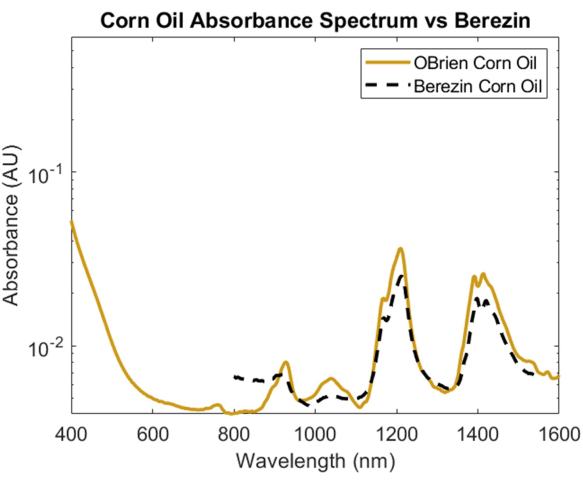
Figure 6 : Comparaison du spectre d’absorbance de l’huile de maïs acquis à l’aide des méthodes décrites dans le présent document par rapport à Cao et al.1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
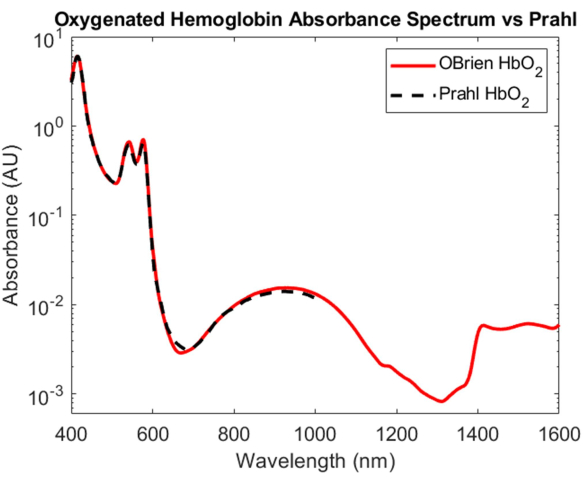
Figure 7 : Comparaison du spectre d’absorbance de l’hémoglobine oxygénée acquis à l’aide des méthodes décrites dans le présent document par rapport à Prahl4. Caractéristiques spectrales de 1 400 à 1 600 nm probablement attribuées à l’eau résiduelle dans l’échantillon. Veuillez cliquer ici pour voir une version agrandie de cette figure.
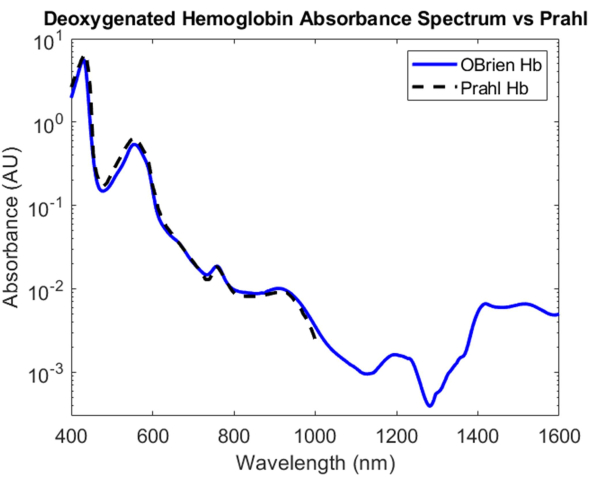
Figure 8 : Comparaison du spectre d’absorbance de l’hémoglobine désoxygénée acquis à l’aide des méthodes décrites dans le présent document par rapport à Prahl4. Caractéristiques spectrales de 1 400 à 1 600 nm probablement attribuées à l’eau résiduelle dans l’échantillon. Veuillez cliquer ici pour voir une version agrandie de cette figure.
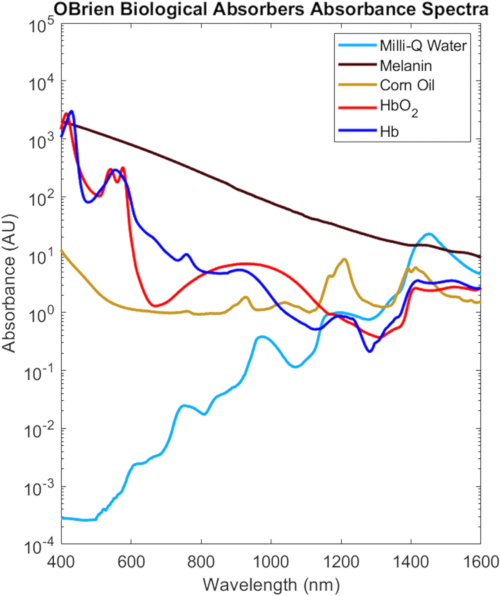
Figure 9 : Spectres VIS-SWIR des absorbeurs biologiques courants. Abréviation : VIS-SWIR = infrarouge visible à ondes courtes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le ou les protocoles décrits dans cet article peuvent être utilisés pour obtenir des spectres d’absorption VIS-SWIR des absorbeurs biologiques et des agents de contraste. Dans cet article, nous montrons des étapes spécifiques pour obtenir des spectres d’eau, de mélanine, d’huile de maïs, d’hémoglobine oxygénée et d’hémoglobine désoxygénée allant de 400 nm à 1 600 nm. La discussion suivante couvre les étapes critiques, les conseils pour l’optimisation des mesures, les limites de la méthode et les applications de ce protocole en biomédecine.
Bien que toutes les étapes du protocole soient importantes, quelques étapes critiques doivent être suivies pour obtenir des spectres précis avec ce protocole. Tout d’abord, l’échantillon doit être non diffusé ; Par exemple, lors de l’obtention d’hémoglobine oxygénée et désoxygénée à partir de sang, les diffuseurs de l’échantillon doivent être filtrés (ici, un filtre de seringue de 0,22 μm a été utilisé). Lors de la préparation de l’hémoglobine désoxygénée, la quantité de dithionite de sodium ajoutée ne doit pas dépasser le poids fourni, car elle rendra l’échantillon trouble à des pourcentages de poids plus élevés et invalidera les exigences de la loi de Beer-Lambert.
Deuxièmement, l’eau deutérée doit être utilisée comme solvant d’échantillon et comme référence pour les solutés solubles dans l’eau tels que l’hémoglobine. Dans le SWIR, l’absorption d’eau est forte et peut masquer d’autres absorbeurs. Troisièmement, les mesures doivent être acquises dans la plage linéaire du détecteur, définie comme la région dans laquelle un changement de photons atteignant le détecteur entraîne un changement linéaire du signal du détecteur. Si l’absorption est minimale, le détecteur peut enregistrer une absorbance de zéro, même s’il y a une absorbance. Cela se produit lorsque l’échantillon est trop dilué, que le temps d’exposition est trop faible et/ou que la longueur du trajet de la cuvette est trop courte, mais peut être corrigé par une augmentation de la concentration de l’échantillon, de la longueur du trajet de la cuvette et/ou du temps d’exposition. De même, si une absorption élevée se produit, le détecteur peut ne pas enregistrer de photons et produire une ligne plate appelée « saturation » qui n’est pas sensible aux changements d’absorbance. Cela se produit lorsque l’échantillon est trop concentré, que le temps d’exposition est trop faible et/ou que la longueur du trajet est trop longue, mais peut être résolu en augmentant la concentration de l’échantillon, en augmentant le temps d’exposition et/ou en diminuant la longueur du trajet de la cuvette.
Quatrièmement, les détecteurs utilisés doivent être linéaires. S’il n’est pas certain que le détecteur présente une réponse linéaire au nombre de photons atteignant le détecteur, diverses dilutions d’un échantillon peuvent être mesurées avec les mêmes paramètres d’acquisition pour vérifier si leurs valeurs d’absorbance montrent la tendance linéaire attendue entre l’absorbance et la concentration. Alternativement, un seul échantillon peut être mesuré et le temps d’exposition augmenté pour tester s’il y a une augmentation linéaire de l’intensité du détecteur. Les deux tests devraient produire une relation linéaire si l’utilisateur opère dans ses limites linéaires (voir le troisième point critique ci-dessus).
Cinquièmement, pour rester dans la plage linéaire du détecteur pour l’ensemble de la plage spectrale VIS-SWIR, la concentration de l’échantillon, le temps d’exposition du détecteur et/ou la longueur du trajet de la cuvette devront être modifiés pour différentes régions spectrales avec une absorbance nettement supérieure ou inférieure à la région spectrale de départ.
Sixièmement, les spectres acquis à l’aide de différentes concentrations d’échantillons ou longueurs de trajet pour différentes régions spectrales doivent être assemblés par une mise à l’échelle linéaire d’une région basée sur les changements connus de concentration ou de longueur de trajet. Après la mise à l’échelle, les spectres doivent être assemblés à une longueur d’onde qui se chevauche entre les deux régions. Si une mesure doit couvrir des mesures provenant de différents détecteurs, il doit y avoir des spectres d’absorbance qui se chevauchent et qui contiennent la longueur d’onde de transition du détecteur souhaitée (800 nm est couramment utilisé lors de l’assemblage des régions UV-VIS et SWIR). Chaque spectre est tronqué à la longueur d’onde de transition du détecteur, et un spectre est choisi pour inclure sa valeur d’absorbance de transition de détecteur d’origine. Ensuite, les deux spectres tronqués sont concaténés pour créer un seul spectre allongé.
D’autres conseils pour acquérir des spectres d’absorption de haute qualité incluent l’utilisation d’un spectre précédemment publié de l’échantillon d’intérêt, même s’il ne couvre pas toute la gamme spectrale à mesurer, pour guider les mesures. Connaissant a priori la gamme de longueurs d’onde avec l’absorbance la plus faible, les mesures peuvent être commencées dans cette région avec l’échantillon le plus concentré, puis ajustées et diluées à partir de là. Cela peut aider à déterminer combien de régions distinctes devront être mesurées en fonction de l’ampleur des changements d’absorbance attendus. Il peut également fournir l’assurance que le spectre attendu a été obtenu s’il correspond aux spectres publiés, ou s’il ne correspond pas aux spectres publiés, la méthode de préparation des échantillons peut être réexaminée ainsi que les problèmes qui pourraient déformer le spectre.
Les spectres d’absorption peuvent nécessiter un post-traitement. Par exemple, un filtre numérique de moyenne mobile peut être utilisé pour lisser les mesures d’absorption et les points d’erreur connus peuvent être supprimés avec une réparation d’ensemble de données dans laquelle les points erronés sont supprimés et l’interpolation est effectuée entre les points non erronés.
Les limites de cette méthode comprennent l’imprécision des échantillons à diffusion optique tels que le sang total. Pour mesurer avec précision l’hémoglobine, l’échantillon de sang est lysé, puis filtré à l’aide d’une seringue afin d’éliminer la plupart des autres composants cellulaires résiduels à l’origine de la diffusion optique. De même, cette méthode n’est pas utilisée in vivo en raison de la diffusion tissulaire. Bien que les mesures d’absorbance basées sur la loi de Beer-Lambert puissent être fastidieuses et parfois difficiles à réaliser, il s’agit de la méthode de référence pour les mesures d’absorption optique pure. De plus, certains solvants rendent particulièrement difficile l’acquisition d’un spectre d’absorbance pure de certains solutés. Par exemple, le solvant natif de l’hémoglobine oxygénée et désoxygénée est l’eau, mais l’absorption de l’eau est forte dans le SWIR, dominant l’absorption de l’hémoglobine oxygénée. Par conséquent, nous essayons d’éliminer l’eau du sang par centrifugation répétée, en éliminant le surnageant et en la reconstituant avec de l’eau deutérée qui a une absorption SWIR plus faible. Les spectres d’hémoglobine oxygénée et désoxygénée résultants du sang humain hépariné entier sont soupçonnés de contenir une faible absorption résiduelle due à l’absorption d’eau d’environ 1 300 nm à 1 600 nm, comme le montre la figure 3. Bien qu’il ne s’agisse probablement pas d’un désenchevêtrement parfait de l’eau de l’hémoglobine oxygénée et désoxygénée, nous observons un alignement étroit avec les spectres d’hémoglobine oxygénée et désoxygénée publiés de 400 nm à 1 000 nm et nous étendons le spectre de plusieurs centaines de nanomètres 2,3.
Les protocoles décrits dans le présent document aideront les chercheurs à élargir les bibliothèques de spectres d’absorption pour inclure les spectres VIS-SWIR d’une foule de composants biologiques et d’agents de contraste. Ces connaissances peuvent être utilisées pour améliorer la compréhension de la biologie et de la physiologie fondamentales grâce à l’imagerie biomédicale non invasive et à la détection à des longueurs d’onde plus profondes que celles utilisées actuellement par la plupart des systèmes. L’ajout de longueurs d’onde SWIR élargit le type de composants tissulaires qui peuvent être surveillés de manière non invasive et pourrait éclairer le développement de nouvelles surveillances et diagnostics. De plus, les dispositifs fonctionnant dans le NIR et le SWIR devraient aider à minimiser le biais de pigmentation de la peau qui a été signalé pour les dispositifs optiques fonctionnant dans les gammes VIS et NIR et constitue une stratégie prometteuse pour créer des dispositifs médicaux équitables.
Déclarations de divulgation
Christine O’Brien et Leonid Shmuylovich détiennent une participation financière dans Armor Medical Inc. et pourraient en tirer des avantages financiers si l’entreprise réussit à commercialiser ses produits liés à cette recherche.
Remerciements
Ce travail est soutenu par des subventions des National Institutes of Health (NIH) R00HD103954 et R21EB035823. La recherche rapportée dans cette publication a été soutenue par l’Institut des sciences cliniques et translationnelles de l’Université de Washington UL1TR002345 par le National Center for Advancing Translational Sciences (NCATS) des National Institutes of Health (NIH). Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement le point de vue officiel du NIH. Les auteurs tiennent à remercier les membres du laboratoire O’Brien, Michael Vahey et les membres de son laboratoire, ainsi que Huanzhu Jiang.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm diameter syringe Filters | Sigma-Aldrich | SLGPM33RS | |
| 1000 µL Pipette | Millipore Sigma | EP3124000121 | |
| 200 µL Pipette | Millipore Sigma | EP3124000083 | |
| Conical Tubes | Avantor VWR | 21008-089 | |
| Corn Oil | Happy Belly | n/a | 48 Fl Oz |
| Deuterium Oxide | Cambridge Isotope Laboratories | DLM-4-100 | |
| Deuterium Oxide | Sigma-Aldrich | 7789-20-0 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D5879-1L | |
| Disposable 1 mL Syringe | BH Supplies | BH1LL | |
| Disposable Needle | Atshuhut/Amazon | 66941 | |
| Freezer (-80 °C) | Fisher Scientific | IUE386FARK | |
| Glass Beakers | Millipore Sigma | CLS1000PACK | |
| Glass or Quartz Cuvettes | Sigma-Aldrich | Z802875-1EA | 700 µL volume |
| Glass or Quartz Cuvettes | Thorlabs | CV10Q35EP | 3500 mL volume |
| Heparinized Human Blood | Lampire | 7203710 | |
| Microcentrifuge Tubes | Costar | 3213 | |
| Microcentrifuge--accuSpin Micro 17 | Fisher Scientific | 13-100-675 | |
| MilliQ Water | Millipore Sigma | ZMQSP0D01 | |
| OSRAM FCS 64640 150 W 24 V HLX Halogen Light Bulb | Amazon | B0001221DG | |
| Parafilm | Millipore Sigma | HS234526B | |
| Pipette Tips | Eppendorf | 22492055 | |
| Powdered Synthetic Melanin | Sigma-Aldrich | 8049-97-6 | |
| Scale | Sartorius | UX-11976-09 | |
| Sodium Dithionite | Sigma-Aldrich | 1065070500 | |
| Sonicator | Fisher Scientific | CPX1800 | |
| Spatula | Aozita | 000 00 0 1 2 3 | |
| UV/VIS/SWIR Spectrophotometer | On Line Instrument Systems | Olis Cary 14 | |
| Weigh Boats | Amazon | B07M5RMNPF |
Références
- Cao, Q., Zhegalova, N. G., Wang, S. T., Akers, W. J., Berezin, M. Y. Multispectral imaging in the extended near-infrared window based on endogenous chromophores. J Biomed Opt. 18 (10), 101318 (2013).
- Yao, J., Wang, L. V. Sensitivity of photoacoustic microscopy. Photoacoustics. 2 (2), 87-101 (2014).
- Jacques, S. L. Optical properties of biological tissues: a review. Phys Med Biol. 58 (11), R37 (2013).
- . Optical absorption of hemoglobin Available from: https://omlc.org/spectra/hemoglobin/ (1999)
- Zhang, H., et al. Penetration depth of photons in biological tissues from hyperspectral imaging in shortwave infrared in transmission and reflection geometries. J Biomed Opt. 21 (12), 126006 (2016).
- Du, T., et al. Hyperspectral imaging and characterization of allergic contact dermatitis in the short-wave infrared. J Biophotonics. 13 (9), e202000040 (2020).
- Roggan, A., Friebel, M., Dörschel, K., Hahn, A., Mueller, G. J. Optical properties of circulating human blood in the wavelength range 400-2500 nm. J Biomed Opt. 4 (1), 36-46 (1999).
- Kuenstner, J. T., Norris, K. H. Spectrophotometry of human hemoglobin in the near infrared region from 1000 to 2500 nm. J Near Infrared Spectrosc. 2 (2), 59-65 (1994).
- Spectral subtraction. Available from: https://www.spectroscopyonline.com/view/spectral-subtraction (2021)
- Sjoding, M. W., Dickson, R. P., Iwashyna, T. J., Gay, S. E., Valley, T. S. Racial bias in pulse oximetry measurement. N Engl J Med. 383 (25), 2477-2478 (2020).
- Fawzy, A., et al. Racial and ethnic discrepancy in pulse oximetry and delayed identification of treatment eligibility among patients with COVID-19. JAMA Intern Med. 182 (7), 730-738 (2022).
- Sudat, S. E. K., et al. Racial disparities in pulse oximeter device inaccuracy and estimated clinical impact on COVID-19 treatment course. Am J Epidemiol. 192 (5), 703-713 (2023).
- Keller, M. D., Harrison-Smith, B., Patil, C., Arefin, M. S. Skin colour affects the accuracy of medical oxygen sensors. Nature. 610 (7932), 449-451 (2022).
- Butler, W. L. Absorption spectroscopy of biological materials. Methods Enzymol. 24, 3-25 (1972).
- Tang, J., et al. Calculation extinction cross sections and molar attenuation coefficient of small gold nanoparticles and experimental observation of their UV-vis spectral properties. Spectrochim Acta A Mol Biomol Spectrosc. 191, 513-520 (2018).
- Rossman, G. R. Optical spectroscopy. Rev Mineral Geochem. 78 (1), 371-398 (2014).
- Thimsen, E., Sadtler, B., Berezin, M. Y. Shortwave-infrared (SWIR) emitters for biological imaging: a review of challenges and opportunities. Nanophotonics. 6 (5), 1043-1054 (2017).
- Briely-Sabo, K., Bjornerud, A. Accurate de-oxygenation of ex-vivo whole blood using sodium dithionite. Proc Intl Sot Mag Reson Med. 8, 2025 (2020).
- Skoog, D. A., Holler, F. J., Crouch, S. R. Principles of instrumental analysis. Cengage Leaning. , (2019).
- Hale, G. M., Querry, M. R. Optical constants of water in the 200-nm to 200-microm wavelength region. Appl Opt. 12 (3), 555-563 (1973).
- Sarna, T., Sealy, R. Photoinduced oxygen consumption in melanin systems. Action spectra and quantum yields for eumelanin and synthetic melanin. Photochem Photobiol. 39 (1), 69-74 (1984).
- Sarna, T., Swartz, H. A., Nordlund, J. J. The physical properties of melanins. The pigmentary system: Physiology and pathophysiology. , 311-341 (2006).
- Crippa, P., Cristofoletti, V., Romeo, N. A band model for melanin deduced from optical absorption and photoconductivity experiments. Biochim Biophys Acta. 538 (1), 164-170 (1978).
- van Veen, R., et al. Determination of visible near-IR absorption coefficients of mammalian fat using time- and spatially resolved diffuse reflectance and transmission spectroscopy. J Biomed Opt. 10 (5), 054004 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon