Method Article
Cribado de moléculas pequeñas y pruebas de toxicidad en larvas de pez cebra en fase inicial
En este artículo
Resumen
Este protocolo describe un procedimiento de cribado de fármacos en larvas de pez cebra 3-7 días después de la fecundación, seguido de una evaluación morfológica.
Resumen
El pez cebra se ha convertido en un organismo modelo destacado para la investigación traslacional humana, las pruebas de toxicidad de moléculas pequeñas y contaminantes ambientales, el descubrimiento de fármacos terapéuticos y otras aplicaciones de investigación biomédica. El protocolo presentado tiene como objetivo proporcionar una guía clara para el cribado de fármacos y las pruebas de toxicidad en larvas de pez cebra en fase temprana (de 3 a 7 días después de la fecundación, dpf). Se han publicado varias metodologías que describen las pruebas de toxicidad en larvas de pez cebra, aunque carecen de un protocolo estandarizado para la duración de la exposición, la tasa de cambios de medio y la puntuación de la morfología, entre otros. Determinamos experimentalmente las edades ideales de las larvas para realizar los experimentos, los tamaños de placa que funcionan mejor para esas edades, la tasa de cambios de medio que proporcionan resultados confiables al tiempo que limitan el desperdicio de compuesto de prueba y un sistema de puntuación de morfología que es fácilmente cuantificable de manera estadística. El manuscrito describe en detalle un protocolo para las pruebas de toxicidad en larvas de pez cebra de entre 3 y 7 dpf, con el objetivo de abordar la brecha en las pruebas de toxicidad de medicamentos y dar el primer paso hacia un método estandarizado similar a la prueba de toxicidad aguda en embriones de peces.
Introducción
El pez cebra (Danio rerio) ha emergido recientemente como un poderoso organismo vertebrado modelo, volviéndose cada vez más popular para los estudios que avanzanen la investigación biomédica. Alrededor del 70% de los genes codificadores de proteínas humanas tienen al menos un ortólogo de pez cebra, y ~ 82% de los genes causantes de enfermedades humanas tienen al menos un gen ortólogo en el pez cebra2. La conservación genética, junto con un patrón y morfología de órganos básicos similares, hacen del pez cebra un modelo interesante para la investigación de enfermedades humanas, lo que permite comparaciones entre especies a nivel molecular 1,2,3, que es crucial para el desarrollo de fármacos.
El pez cebra se desarrolla rápidamente con la yema de la cola que se forma a las 10 h después de la fertilización (hpf) y los primeros somitas aparecen a las 16 hpf. Los embriones emergen del corion a ~2-3 días después de la fertilización (dpf). A los 4 dpf, su tracto digestivo está completamente desarrollado y a los 5 dpf, su vejiga natatoria se ha inflado, lo que les permite nadar libremente y buscar comida. A pesar de la capacidad de alimentarse a los 5 dpf, las larvas que no se alimentan pueden sobrevivir únicamente con nutrientes derivados de la yema hasta al menos 7 dpf, evitando la necesidad de alimentación externa que puede causar contaminación e interferir con la detección de medicamentos, la toxicología y las pruebas de comportamiento4. A los 7 dpf, las larvas también desarrollan un plan corporal completo con varios sistemas de órganos rudimentarios, incluyendo el corazón y la vasculatura, el músculo y el hueso 5,6. Los embriones de pez cebra también se fertilizan ex vivo, desarrollándose externamente, y son ópticamente transparentes en las primeras etapas de la vida, lo que los hace muy accesibles para la edición de genes y el cribado de moléculas pequeñas3. Además, su pequeño tamaño y alta tasa de fecundidad permiten la inclusión de más réplicas, lo que aumenta el poder estadístico, así como el uso de placas de pocillos múltiples, lo que ahorra en volúmenes de fármaco y aumenta el rendimiento.
El cribado de nuevas moléculas pequeñas en un modelo animal es importante para determinar la capacidad de los fármacos para producir efectos beneficiosos o adversos, identificando así qué compuestos son viables para realizar pruebas posteriores y otros que podrían requerir modificación para alterar su actividad. Como parte del proceso de cribado de fármacos, es necesario identificar la concentración letal 50 (LC50) del compuesto o compuestos objetivo. Esto proporciona una concentración de trabajo que causa la muerte en el 50% de los animales de experimentación como parte de las pruebas preliminares de toxicidad.
Existe un protocolo estandarizado para las pruebas de toxicidad en embriones de pez cebra hasta 96 h después de la fertilización (hpf), a saber, la prueba de toxicidad aguda en embriones de peces (FET) (TG236)7. En la prueba FET, los óvulos recién fertilizados se exponen a cinco concentraciones de una sustancia química durante un máximo de 96 horas y se observan signos de letalidad, a saber, (i) coagulación del huevo, (ii) falta de formación de somitas, (iii) falta de desprendimiento de la yema de la cola del saco vitelino y (iv) falta de latidos cardíacos. La prueba permite determinar la toxicidad aguda y el LC50. Además, también aconseja sobre los tamaños de las cámaras de prueba a utilizar para el cribado (placas de 24 pocillos), la distribución de los huevos en la cámara de prueba y las condiciones de alojamiento, entre otros, asegurando resultados válidos y reproducibles7.
Si bien la prueba FET es adecuada para las pruebas de toxicidad en la etapa embrionaria, no supera los 4 dpf. Para los fenotipos que comienzan a desarrollarse alrededor de este punto de tiempo (por ejemplo, mineralización de la notocorda6), el cribado de fármacos debe proceder más allá de 4 dpf para permitir la evaluación morfológica de dicho tejido. Además, recomendamos que la exposición al fármaco comience al menos un día antes del desarrollo del fenotipo de interés. Hasta donde sabemos, no existe un protocolo estandarizado similar al FET para el cribado de fármacos en larvas de pez cebra en etapa temprana, específicamente en pez cebra de 3 a 7 dpf. Si bien se han publicado varios estudios que describen las pruebas de drogas en larvas de pez cebra más allá de 4 dpf, existe una falta de consistencia en la metodología utilizada, incluido el tamaño de las cámaras de prueba, el número de réplicas biológicas y técnicas, la tasa de cambios en los medios, la duración de la exposición y los defectos morfológicos evaluados 8,9,10,11,12,13 . Por esta razón, desarrollamos un protocolo validado para pruebas de toxicidad estandarizadas seguidas de observación visual de cambios morfológicos en larvas de pez cebra a 3-7 dpf. El protocolo propuesto se puede utilizar posteriormente para otros ensayos de fenotipado posteriores, como el análisis del comportamiento, el perfil de expresión génica y la histomorfometría.
Protocolo
El pez cebra se manipuló de acuerdo con la Directiva de la UE 2010/63/UE. Todos los experimentos fueron aprobados por el Comité de Ética de Investigación de la Facultad (FREC) y el Subcomité Sectorial de Investigación Animal Conjunto del FREC (JFARSS) de la Universidad de Malta. En la Figura 1 se puede encontrar un diagrama de flujo del protocolo propuesto.
1. Producción, recolección y mantenimiento de huevos
- Coloque los peces en tanques de cría el día anterior, al menos una hora después de la última alimentación, con divisores colocados que separen a los machos de las hembras. Para obtener mejores resultados en la producción de huevos, utilice una mayor proporción de hembras y machos. Coloque el pez en una habitación equipada con un ciclo de luz/oscuridad de 14 h:10 h y a una temperatura ambiente de 27-28 °C.
NOTA: Un tanque de cría de 1 L puede contener tres peces adultos, mientras que un tanque de cría de 1,7 L puede contener cinco peces adultos. - A la mañana siguiente, después del inicio de la luz, reemplace el agua en los tanques de cría y retire los divisores. En caso de que el tanque de cría no esté fácilmente inclinado, colóquelo en una posición inclinada para asegurarse de que haya aguas poco profundas disponibles para promover el apareamiento. En caso de baja producción de huevos y actividad de apareamiento, reemplace el agua en los tanques de cría cada 45 min. Deje que los peces se apareen hasta por 3 horas o según sea necesario.
- Una vez que se complete el apareamiento, apriete suavemente las hembras que no produjeron huevos para evitar la unión de huevos a largo plazo. Vuelva a colocar los peces en sus respectivos tanques.
- Recoja los huevos en los tanques de cría con un colador de malla, enjuague con agua de embriones (E3) y colóquelos en una placa de Petri con E3. Para preparar E3, mezcle 16,67 mL de 60x E3 (300 mM de NaCl; 10 mM de KCl; 20 mM de CaCl2,2H 2O; 20 mM de MgSO 4,7H2O) con 1 mL de azul de metileno al 0,01% y 982 mL de agua desionizada. Retire los huevos o desechos no fertilizados. Asegúrese de que las placas de Petri no estén abarrotadas, con 50 huevos por placa de Petri de 100 mm x 15 mm y 120 huevos por placa de Petri de 150 mm x 15 mm.
- Mantenga los huevos en una incubadora ajustada a 28,5 °C y equipada con un ciclo día/noche de 14 h: 10 h. A 1 dpf, refresque el E3 y elimine los huevos no viables para limitar el crecimiento de hongos.
2. Preparación de la placa de prueba
- A 3 dpf, transfiera un embrión eclosionado de aspecto saludable a cada pocillo en una placa de 96 pocillos utilizando una micropipeta de 1.000 μL ajustada a un volumen de 100 μL.
NOTA: No se deben utilizar embriones no eclosionados, ya que esto puede dar lugar a una absorción variable de compuestos. El uso de embriones que parecen sanos también limita el sesgo durante las pruebas. El tamaño de la punta de la pipeta permite una fácil recolección del embrión de pez cebra sin causar ningún daño físico. Además, una micropipeta permite un mejor control del volumen que se dispensa en el pocillo en comparación con una pipeta de transferencia. - En una placa de 12 pocillos, prepare la(s) concentración(es) deseada(s) para cada producto problema en pocillos separados (en este caso, Bosutinib en un rango de concentración de 100 μM a 6,25 μM). En cada pocillo, añada el volumen necesario de producto problema con micropipetas y haga hasta 2,4 ml con E3.
NOTA: Debe llevarse a cabo una búsqueda bibliográfica para determinar las concentraciones adecuadas que deben utilizarse para los productos problema pertinentes. Si no se dispone de información, se pueden ensayar varias concentraciones hasta que se determine un intervalo de concentración adecuado. Se debe utilizar un mínimo de cinco concentraciones, de las cuales la concentración más alta causa una mortalidad del 100% y la concentración más baja no causa ningún efecto observable7. - Prepare un control del vehículo en función del disolvente utilizado para disolver el producto químico de prueba de stock.
NOTA: Muchos compuestos de prueba no son solubles en agua y, por esta razón, deben disolverse en solventes específicos ("vehículos") como etanol o dimetilsulfóxido (DMSO) para generar una solución acuosa. Preferiblemente, el DMSO no debe exceder una concentración del 1% cuando se usa como control de vehículos, que es la concentración que se considera segura en el pez cebra14. - Retire cualquier solución E3 presente en la placa de 96 pocillos con una micropipeta de 200 μL y reemplácela con 100 μL del medio correspondiente que se esté probando. Asegúrese de analizar un total de 24 larvas por concentración. Utilice una micropipeta de 200 μl de uno o 8 canales para transferir los productos problema a los pocillos de la placa de ensayo correspondientes. Incluya controles (por ejemplo, E3, vehículo químico, controles positivos, etc.).
NOTA: La configuración de la placa admite hasta cuatro productos químicos de prueba diferentes o cuatro concentraciones diferentes del mismo producto químico. En la Figura 1 se muestra un ejemplo de las placas de prueba configuradas para la investigación de cinco concentraciones de la misma sustancia química (por ejemplo, Bosutinib) acompañadas de controles. - A las 24 h después de la exposición, realice un marcado morfológico (como se describe en la sección 3) y medio cambio de medio, eliminando 50 μL de medio y sustituyéndolo por medio recién preparado. Retire y registre cualquier larva muerta en el proceso. Mantenga las larvas en una incubadora ajustada a 28,5 °C y equipada con un ciclo día/noche de 14 h: 10 h. Repita el proceso hasta 7 dpf.
3. Evaluación morfológica
- Con un microscopio óptico estereoscópico, observe cada una de las larvas de prueba con un aumento adecuado.
NOTA: En la Tabla 1 se proporcionan ejemplos de defectos morfológicos que pueden evaluarse. - Hacer que la morfología sea evaluada por dos evaluadores independientes, y se consultará a un tercero en caso de desacuerdos entre los dos evaluadores.
- Puntúe la morfología utilizando un método binario (es decir, presente/ausente), donde 'ausente' indica morfología normal (puntuado como '0') y 'presente' indica la presencia de anomalía morfológica (puntuado como '1'). La Figura 2 muestra ejemplos de pez cebra a 5 dpf después de 2 días de exposición al medicamento, incluyendo un pez cebra no afectado (Figura 2A), un pez cebra con edema pericárdico leve (Figura 2B), edema pericárdico severo con hemorragia vitelia y extensión de la yema (Figura 2C), retraso en el desarrollo con pigmentación reducida, vejiga natatoria y longitud total (Figura 2D), yema hinchada y una aleta caudal retorcida (Figura 2E), ausencia de aleta caudal (Figura 2F), notocorda curvada (Figura 2G), truncamiento (Figura 2H) y muerte con necrosis (Figura 2I). Puntúe todos los fenotipos anormales como '1' y el pez cebra no afectado como '0'.
4. Determinación LC50
- Después de la evaluación de la morfología, trace el porcentaje acumulado de mortalidad a 7 dpf frente a la concentración. En la Figura 3 se muestra un ejemplo. Utilice la curva de concentración para estimar la concentración que causa el 50% de mortalidad.
- Una vez estimada la concentración de LC50 , repita el experimento descrito anteriormente exponiendo 24 larvas replicadas en una placa de 96 pocillos a esta única concentración estimada de LC50 .
5. Réplicas técnicas
- Repita todo el procedimiento utilizando las cinco concentraciones seleccionadas del mismo producto químico al menos dos veces más en dos ocasiones separadas para asegurarse de que los resultados sean reproducibles.
Resultados
Las anormalidades se pueden observar individualmente o acumulativamente a lo largo de la línea de tiempo experimental hasta 7 dpf. La puntuación morfológica máxima por anomalía se puede utilizar para calcular las anomalías morfológicas como porcentaje del número de larvas utilizadas. Por ejemplo, si en el día 7 las puntuaciones de morfología del edema pericárdico son de 19 y 20 para los puntuadores 1 y 2, respectivamente, de una puntuación posible de 24, lo que significa que 19 o 20 larvas de 24 muestran edema pericárdico, la puntuación porcentual se puede calcular como:
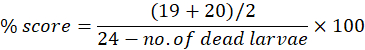
La Tabla Suplementaria S1 muestra los resultados de la puntuación morfológica (de ambos evaluadores) a 4 dpf después de las pruebas de toxicidad para el compuesto Bosutinib, un inhibidor de la tirosina cinasa indicado para el tratamiento de la leucemia mieloide crónica15. La misma puntuación morfológica se repite para los peces expuestos de 5 dpf a 7 dpf. El compuesto se probó utilizando un rango de concentración de 100 μM a 6,25 μM. Se realizaron tres réplicas técnicas en diferentes puntos temporales, y se utilizó la tasa de mortalidad acumulada promedio a 7 dpf para determinar LC50, la concentración a la que sobrevive el 50% de las larvas. El LC50 se puede determinar en cualquier punto de tiempo de exposición. Sin embargo, recomendamos calcular esto a 7 dpf.
Se utilizó la mortalidad promedio acumulada a 7 dpf para generar una curva LC50 , que se puede observar en la Figura 3. Para Bosutinib, la concentración de LC50 se estimó en 37,95 μM.
NOTA: Esta concentración estimada de LC50 se aplica estrictamente a este sistema modelo y luego se puede utilizar para ensayos de fenotipado posteriores posteriores.
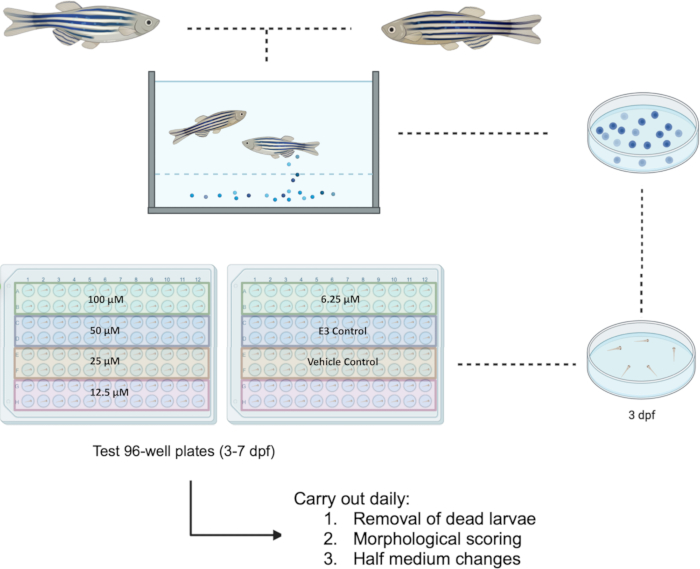
Figura 1: Esquema del cribado de fármacos propuesto en larvas a 3-7 dpf. Las placas de prueba de 96 pocillos están configuradas para la investigación de cinco concentraciones que van desde 100 μM hasta 6,25 μM para el compuesto Bosutinib. Abreviatura: dpf = días después de la fecundación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Defectos morfológicos representativos observados en larvas de pez cebra a 5 dpf expuestas a diversas concentraciones químicas (a los 2 días después de la exposición). (A) Pez cebra control (no afectado), (B) Larva de pez cebra que muestra edema pericárdico leve, (C) Pez cebra con edema pericárdico severo y hemorragia vitelita, (D) Pez cebra con retraso en el desarrollo, pigmentación reducida, (E) Pez cebra con yema hinchada y una aleta caudal retorcida, (F) Pez cebra con ausencia de aleta caudal, (G) Pez cebra con notocorda curvada, (H) Pez cebra con cola truncada, y (I) Pez cebra muerto con necrosis. Los defectos se señalan con puntas de flecha rojas. Barras de escala = 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
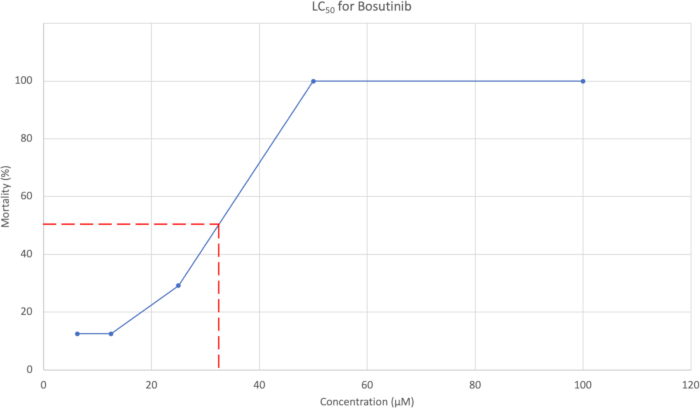
Figura 3: Curva LC50 que muestra la concentración frente al % de mortalidad. Las cinco concentraciones ensayadas fueron 100 μM, 50 μM, 25 μM, 12,5 μM y 6,25 μM, con un porcentaje de mortalidad de 100%, 100%, 29,2%, 12,5% y 12,5%, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
| Defectos morfológicos | Descripción |
| Edema pericárdico | Acumulación de líquido alrededor del corazón con un corazón estirado y mal funcionamiento de la circulación sanguínea |
| Latidos del corazón (por minuto) | Reducción del número de pulsaciones por minuto |
| Yema | Presencia o ausencia de edema o hemorragia vitelino que puede ocurrir simultáneamente con defectos cardíacos |
| Extensión de yema | Yema hinchada, delgada o ausente |
| Notocordio curvo | Presencia de una notocorda retorcida u ondulada, y/o cola curvada |
| Vejiga natatoria | Presencia, ausencia o desarrollo parcial de la vejiga natatoria |
| Pigmentación | Menos o ningún melanocitos en comparación con los peces no tratados de la misma edad |
| Necrosis | Presencia (leve o grave) o ausencia de necrosis en cualquier parte del cuerpo |
| Retraso en el desarrollo | Desarrollo tardío o estancado en comparación con los controles de tipo salvaje de la misma edad. |
| Respuesta al tacto | Respuesta tardía o nula después de un sobresalto (p. ej., usando la punta de una pipeta) |
| Truncamiento | Ausencia de cuerpo de pez cebra posterior (es decir, formación de la cola) |
| Aletas | Presencia o ausencia de la aleta caudal que puede ir acompañada de una fina extensión de la yema |
| Eje corporal reducido | Peces que parecen normales, pero que cuando se miden son más cortos de longitud |
Tabla 1: Lista de defectos morfológicos visuales que se pueden observar después de los estudios de exposición a fármacos.
Tabla complementaria S1: Resultados morfológicos representativos de Bosutinib a 4 dpf (1 día después de la exposición). Haga clic aquí para descargar esta tabla.
Discusión
El pez cebra se ha convertido en un modelo importante para la detección de drogas. Al tratar de determinar una metodología para llevar a cabo los ensayos de toxicidad, encontramos varios métodos contrastantes de diferentes laboratorios 8,9,10,11,12,13. Los métodos descritos utilizan larvas a diferentes edades, líneas de tiempo experimentales variables, diferentes tasas de cambios en el medio y diferentes sistemas de puntuación morfológica. A través de prueba y error, establecimos la metodología descrita, la cual ha proporcionado resultados confiables y reproducibles.
Elegir un tamaño de plato
Inicialmente, los experimentos se realizaron en una placa de 24 pocillos para asegurarse de que las larvas tuvieran suficiente espacio para moverse y crecer. Las placas se dispusieron con 10 larvas por pocillo, dos pocillos por concentración y 1 mL de solución de fármaco por pocillo. Esta disposición no proporcionó resultados reproducibles, lo que llevó a la inferencia de que las larvas no estaban absorbiendo cantidades iguales de medicamento del pozo. A continuación, se llevaron a cabo ensayos utilizando una placa de 96 pocillos y una placa de 48 pocillos con una larva por pocillo, lo que demostró que las larvas en placas de 96 pocillos no mostraban problemas de crecimiento. Por lo tanto, los experimentos continuaron en una placa de 96 pocillos utilizando menos espacio y volúmenes de fármaco.
Cambio diario de medio
Dado que el pez cebra está absorbiendo el fármaco del medio, determinamos que se necesita un grado de cambio de medio para mantener una concentración constante del fármaco en el medio. Además, un cambio medio elimina el posible material de desecho acumulado en el pozo, que puede proporcionar un entorno tóxico y dar lugar a resultados sesgados. Se llevó a cabo un ensayo con bosutinib, en el que se colocaron tres placas para el mismo fármaco, una sin cambio diario de medio, otra con medio cambio diario y otra con un cambio diario completo de medio. Mientras que las placas sin cambios en el medio mostraron mayores tasas de mortalidad, las placas con cambios medios medios y completos dieron como resultado el mismo resultado a los 7 dpf. Por lo tanto, se optó por un medio cambio diario de medio. Esta elección garantiza un menor consumo del costoso y limitado material de prueba, que podría ser necesario para experimentos posteriores.
Duración de la exposición
La edad de las larvas de prueba utilizadas y la duración de la exposición al fármaco seleccionada en este protocolo fueron impulsadas por nuestro fenotipo de interés, que es la mineralización ósea. Dado que la formación ósea comienza a ~4 dpf, elegimos comenzar con el pez cebra a 3 dpf para determinar si los productos de prueba afectaban el inicio del desarrollo óseo. Posteriormente, finalizamos los estudios de exposición al fármaco a los 7 dpf, ya que se observó un alto grado de mortalidad a partir de los 8 dpf ante la falta de alimentación que podría sesgar los resultados. No obstante, los plazos pueden ajustarse en función de la naturaleza del estudio y del fenotipo de interés.
Limitaciones
Esta metodología tiene algunas limitaciones. La transferencia de pez cebra de 3 dpf a placas de prueba de pocillos múltiples lleva mucho tiempo. Retirar el medio de los pozos sin recoger las larvas es igualmente laborioso. El medio debe eliminarse lentamente de cada pocillo con una pipeta de un solo canal, asegurándose de que las larvas no se dañen en el proceso. Además, si bien un cambio diario de medio medio repone el compuesto de prueba y asegura la eliminación del material de desecho del pocillo, no garantiza que se pueda mantener una concentración estable del fármaco en el pocillo durante los 5 días de exposición. Si bien el análisis de cromatografía líquida de alta resolución podría proporcionar más información sobre la cantidad real de fármaco que absorbe cada larva, la prueba ya no calificaría como un método de detección de alto rendimiento.
En conclusión, esta metodología tiene como objetivo abordar la brecha en las pruebas de toxicidad con pez cebra más allá de 4 dpf, dando pasos hacia un protocolo estandarizado aplicable a líneas de pez cebra de tipo salvaje, mutantes y transgénicos, y que esté a la par con el FET en la etapa embrionaria. Esto abre vías para otros ensayos de fenotipado posteriores que podrían no ser posibles en etapas anteriores.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Los autores cuentan con el apoyo de los proyectos ZeEBRA (R&I-2019-018), un fondo del Programa de Desarrollo Tecnológico (TDP), STRONG (R&I-2024-007L), un fondo TDPLite, NASDAC (SINO-MALTA-2022-08), una subvención de Cooperación Científica y Tecnológica, y DEMONSTRATE (R&I-2018-007A), una subvención Go2Market, todos financiados por XjenzaMalta para y en nombre de la Fundación para la Ciencia y la Tecnología. La Figura 1 se creó utilizando BioRender.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Starlab | E1415-1510 | |
| 10 µL micropipette (P10) | Gilson | F144802 | |
| 10/20 µL pipette tips | Starlab | S1110-3810 | |
| 1000 µL micropipette (P1000) | Gilson | F123602 | |
| 1000 µL pipette tips | Starlab | S1111-6001 | |
| 12-well plate | Starlab | CC7672-7512 | Sterile, single-wrapped, non-treated, with lid |
| 20 µL micropipette (P20) | Gilson | F123600 | |
| 200 µL micropipette (P200) | Gilson | F123601 | |
| 200 µL multi-channel pipette | Gilson | F81024 | |
| 200 µL pipette tips | Starlab | S1113-1006 | |
| 96-well plate | Starlab | CC7672-7596 | Sterile, single-wrapped, flat-bottom, non-treated, with lid |
| Breeding tanks with inside grid sloping bottom, tank dividers and lids | Tecniplast | ZB17BTISLOP, ZB17BTE, ZB17BTL, ZB17BTD | Sloped inner tank |
| Mesh strainer | / | / | |
| Nitrile gloves | Mercator | / | / |
| Petri-dish | Starlab | CC7672-3394/CC7672-3359 | 100 x 20 mm or 60 x 15 mm |
| Leica M205 FCA Fluorescence stereo microscope | Leica | 10450826 | |
| Peltier-cooled incubator including 2 shelves with light module cold white | Memmert | IPP110ecoplus, T8 | Equipped with day/night cycle |
| Dimethyl Sulfoxide | Biochem Chemopharma | 504341000 | To prepare a 1% solution in E3 |
| Calcium chlorided dihydrate | Biochem Chemopharma | 303080500 | To prepare E3 |
| Magnesium sulfate heptahydrate | Biochem Chemopharma | 313060500 | To prepare E3 |
| Potassium Chloride | Biochem Chemopharma | 316030500 | To prepare E3 |
| SCREEN-WELL Wnt Pathway library (Bosutinib) | Enzo | BML-2838-0500 | |
| Sodium Chloride | Fisher Scientific | S/3161/53 | To prepare E3 |
Referencias
- Teame, T., et al. The use of zebrafish (Danio rerio) as biomedical models. Anim Front. 9 (3), 68-77 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: From preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- Clift, D., Richendrfer, H., Thorn, R. J., Colwill, R. M., Creton, R. High-throughput analysis of behavior in zebrafish larvae: Effects of feeding. Zebrafish. 11 (5), 455-461 (2014).
- Keenan, S. R., Currie, P. D. The developmental phases of zebrafish myogenesis. J Dev Biol. 7 (2), 12 (2019).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders. Front Endocrinol (Lausanne). 11, 489 (2020).
- OECD. . Test no. 236: Fish embryo acute toxicity (FET). , (2013).
- Chen, J. R., Lai, Y. H., Tsai, J. J., Hsiao, C. D. Live fluorescent staining platform for drug-screening and mechanism-analysis in zebrafish for bone mineralization. Molecules. 22 (12), 2068 (2017).
- He, H., Wang, C., Tang, Q., Yang, F., Xu, Y. Possible mechanisms of prednisolone-induced osteoporosis in zebrafish larva. Biomed Pharmacother. 101, 981-987 (2018).
- Huang, H. X., et al. Application of bone transgenic zebrafish in anti-osteoporosis chemical screening. Animal Model Exp Med. 1 (1), 53-61 (2018).
- Haney, M. G., Moore, L. H., Blackburn, J. S. Drug screening of primary patient derived tumor xenografts in zebrafish. J Vis Exp. (158), e60996 (2020).
- Nishimura, Y., et al. Using zebrafish in systems toxicology for developmental toxicity testing. Congenit Anom (Kyoto). 56 (1), 18-27 (2016).
- Hayot, G., et al. Evaluating toxicity of chemicals using a zebrafish vibration startle response screening system. J Vis Exp. (203), e66153 (2024).
- Hoyberghs, J., et al. DMSO concentrations up to 1% are safe to be used in the zebrafish embryo developmental toxicity assay. Front Toxicol. 3, 804033 (2021).
- Lipton, J. H., Brümmendorf, T. H., Sweet, K., Apperley, J. F., Cortes, J. E. Practical considerations in the management of patients treated with bosutinib for chronic myeloid leukemia. Ann Hematol. 103 (9), 3429-3442 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados