Method Article
早期斑马鱼幼虫的小分子筛选和毒性试验
摘要
该方案描述了受精后 3-7 天斑马鱼幼虫的药物筛选程序,然后进行形态学评估。
摘要
斑马鱼已成为人类转化研究、小分子和环境污染物毒性测试、治疗药物发现和其他生物医学研究应用的重要模式生物。所提出的方案旨在为早期斑马鱼幼虫(受精后 3-7 天,dpf)的药物筛选和毒性测试提供明确的指导。已经发布了几种描述斑马鱼幼虫毒性测试的方法,尽管缺乏暴露持续时间、培养基变化率和形态学评分等的标准化方案。我们通过实验确定了进行实验的理想幼虫年龄、最适合这些年龄的板尺寸、提供可靠结果同时限制测试化合物浪费的培养基变化率,以及易于以统计方式量化的形态学评分系统。该手稿详细描述了对 3 至 7 dpf 的斑马鱼幼虫进行毒性测试的方案,旨在解决药物毒性测试的空白,并朝着类似于鱼胚胎急性毒性测试的标准化方法迈出第一步。
引言
斑马鱼 (Danio rerio) 最近成为一种强大的脊椎动物模式生物,在推进生物医学研究的研究中越来越受欢迎1。大约 70% 的人类蛋白质编码基因至少有一个斑马鱼直系同源物,~82% 的人类致病基因在斑马鱼2 中至少有一个直系同源基因。遗传保守性,加上相似的基本器官模式和形态,使斑马鱼成为人类疾病研究的有趣模型,允许在分子水平上进行跨物种比较 1,2,3,这对药物开发至关重要。
斑马鱼发育迅速,尾芽在受精后 10 小时 (hpf) 形成,第一个体节出现在 16 hpf 时。胚胎在受精后 ~2-3 天 (dpf) 从绒毛膜中出现。到 4 dpf 时,它们的消化道发育完全,到 5 dpf 时,它们的鱼鳔已经膨胀,使它们可以自由游动并寻找食物。尽管能够以 5 dpf 进食,但未喂食的幼虫可以仅靠蛋黄衍生的营养物质存活,直到至少 7 dpf ,从而规避了可能导致污染并干扰药物筛选、毒理学和行为测试的外部喂养需求4。到 7 dpf 时,幼虫还发育出一个完整的身体计划,其中包含几个基本器官系统,包括心脏和脉管系统、肌肉和骨骼 5,6。斑马鱼胚胎也在体外受精,在体外发育,并且在生命早期阶段是光学透明的,这使得它们很容易用于基因编辑和小分子筛选3。此外,它们的小尺寸和高繁殖率允许包含更多的重复,从而提高统计能力,以及使用多孔板,从而节省药物量并提高通量。
在动物模型中筛选新型小分子对于确定药物产生有益或不利影响的能力非常重要,从而确定哪些化合物可用于进一步测试,而其他化合物可能需要修饰以改变其活性。作为药物筛选过程的一部分,需要确定目标化合物的致死浓度 50 (LC50)。这提供了一个工作浓度,作为初步毒性测试的一部分,该浓度会导致 50% 的试验动物死亡。
存在一种标准化方案,用于对斑马鱼胚胎进行受精后 96 小时 (hpf) 的毒性测试,即鱼胚胎急性毒性 (FET) 测试 (TG236)7。在 FET 测试中,新受精的鸡蛋暴露于五种浓度的化学物质中长达 96 小时,并观察是否有致死迹象,即 (i) 鸡蛋凝固,(ii) 缺乏体节形成,(iii) 尾芽没有从卵黄囊中分离,以及 (iv) 缺乏心跳。该测试允许测定急性毒性和 LC50。此外,它还建议了用于筛选的测试室尺寸(24 孔板)、测试室中的鸡蛋分布和外壳条件等,以确保结果有效且可重复7。
虽然 FET 测试适用于胚胎阶段的毒性测试,但它不会超过 4 dpf。对于在此时间点左右开始发展的表型(例如,脊索6 的矿化),药物筛选必须进一步进行 4 dpf 以上,以便能够对此类组织进行形态学评估。此外,我们建议药物暴露至少在目标表型发展前一天开始。据我们所知,不存在类似于 FET 的标准化方案用于早期斑马鱼幼虫的药物筛选,特别是在 3 至 7 dpf 的斑马鱼中。虽然已经发表了几项研究描述了斑马鱼幼虫中超过 4 dpf 的药物测试,但所使用的方法缺乏一致性,包括测试室的大小、生物和技术重复的数量、培养基变化率、暴露持续时间和评估的形态缺陷 8,9,10,11,12,13 .出于这个原因,我们开发了一种经过验证的标准化毒性测试方案,然后在 3-7 dpf 下目视观察斑马鱼幼虫的形态变化。拟议的方案随后可用于其他下游表型分析,例如行为分析、基因表达分析和组织形态测定。
研究方案
斑马鱼根据欧盟指令 2010/63/EU 进行处理。所有实验均已获得马耳他大学教师研究伦理委员会 (FREC) 和 FREC 动物研究部门联合小组委员会 (JFARSS) 的批准。图 1 中提供了拟议协议的流程图。
1. 鸡蛋生产、收集和维护
- 在前一天将鱼放在繁殖箱中,至少在最后一次喂食后一个小时,用隔板将雄鱼和雌鱼分开。为了获得更好的产蛋结果,请使用更高的雌性与雄性比例。将鱼放在配备 14 小时:10 小时光照/黑暗循环和 27-28 °C 环境温度下的房间中。
注意:一个 1 升的繁殖箱可以容纳三条成年鱼,而一个 1.7 升的繁殖箱可以容纳五条成年鱼。 - 第二天早上,天亮后,更换饲养池中的水并拆除隔板。如果繁殖池不容易倾斜,请将其放置在倾斜位置,以确保有浅水区以促进交配。如果产蛋和交配活动缓慢,每 45 分钟更换一次饲养箱中的水。让鱼交配长达 3 小时或根据需要交配。
- 交配完成后,轻轻挤压任何未产卵的雌性,以防止长期结合卵。将鱼放回各自的鱼缸中。
- 使用网状过滤器收集育种罐中的任何鸡蛋,用胚胎水 (E3) 冲洗,然后放入装有 E3 的培养皿中。要制备 E3,将 16.67 mL 的 60x E3(300 mM NaCl;10 mM KCl;20 mM CaCl2.2H 2O;20 mM MgSO 4.7H2O)与 1 mL 的 0.01% 亚甲蓝和 982 mL 去离子水混合。清除任何未受精的鸡蛋或碎屑。确保培养皿不拥挤,每 100 毫米 x 15 毫米培养皿 50 个鸡蛋,每 150 毫米 x 15 毫米培养皿 120 个鸡蛋。
- 将鸡蛋保存在设置为 28.5 °C 的培养箱中,并配备 14 小时:10 小时昼夜循环。在 1 dpf 时,刷新 E3 并去除无活力的鸡蛋以限制真菌生长。
2. 试板准备
- 在 3 dpf 下,使用设置为 100 μL 体积的 1,000 μL 微量移液器将一个看起来健康的孵化胚胎转移到 96 孔板中的每个孔中。
注意:不应使用未孵化的胚胎,因为这可能会导致不同的化合物摄取。使用看起来健康的胚胎也可以限制测试过程中的偏倚。移液器吸头的尺寸允许轻松收集斑马鱼胚胎,而不会造成任何物理损伤。此外,与移液管相比,微量移液器可以更好地控制分配到孔中的体积。 - 在 12 孔板中,在单独的孔中为每种测试化学品制备所需浓度(此处为 Bosutinib,浓度范围为 100 μM 至 6.25 μM)。在每个孔中,使用微量移液器添加必要体积的测试化学品,并使用 E3 补足至 2.4 mL。
注意:应进行文献搜索以确定用于相关测试化学品的适当浓度。如果没有可用信息,可以尝试多种浓度,直到确定合适的浓度范围。应至少使用五种浓度,最高浓度导致 100% 的死亡率,最低浓度导致无可观察到的影响7。 - 根据用于溶解原液测试化学品的溶剂准备载体对照。
注:许多测试化合物不溶于水,因此,它们需要溶解在乙醇或二甲基亚砜 (DMSO) 等特定溶剂("载体")中以生成水溶液。当用作载体对照时,DMSO 的浓度最好不超过 1%,这是在斑马鱼14 中发现的安全浓度。 - 使用 200 μL 微量移液器去除 96 孔板中存在的任何 E3 溶液,并用 100 μL 相应的待测培养基替换。确保每个浓度总共测试 24 只幼虫。使用单个或 8 通道 200 μL 微量移液器将测试化学品转移到相应的测试板孔中。包括对照(例如,E3、化学载体、阳性对照等)。
注:该板设置最多可容纳四种不同的测试化学品或四种不同浓度的相同化学品。 图 1 显示了用于研究五种浓度的相同化学品(例如,Bosutinib)与对照品一起设置的测试板的实例。 - 在暴露后 24 小时,进行形态学评分(如第 3 节所述)和半培养基更换,去除 50 μL 培养基并用新鲜制备的培养基替换。在此过程中去除并记录任何死亡的幼虫。将幼虫保存在设定为 28.5 °C 的培养箱中,并配备 14 小时:10 小时昼夜循环。重复此过程,直到 7 dpf。
3. 形态学评估
- 使用立体光学显微镜,以适当的放大倍率观察单个测试幼虫。
注: 表 1 提供了可以评估的形态缺陷示例。 - 让两名独立的评分员评估形态,如果两名评分员之间存在分歧,请咨询第三名评分员。
- 使用二进制方法(即存在/不存在)对形态进行评分,其中"不存在"表示形态正常(评分为"0"),"存在"表示存在形态异常(评分为"1")。 图 2 显示了药物暴露 2 天后 5 dpf 的斑马鱼的例子,包括未受影响的斑马鱼(图 2A)、轻度心包水肿的斑马鱼(图 2B)、严重的心包水肿伴蛋黄出血和卵黄延伸(图 2C)、发育延迟伴色素沉着减少、鱼鳔和总长度(图 2D)、蛋黄肿胀和扭结的尾鳍(图 2E), 尾鳍缺失(图 2F)、弯曲的脊索(图 2G)、截断(图 2H)和坏死死亡(图 2I)。将所有异常表型评分为 "1",未受影响的斑马鱼评分为 "0"。
4. LC50 测定
- 在形态学评估之后,绘制 7 dpf 时相对于浓度的累积百分比死亡率。 图 3 显示了一个示例。使用浓度曲线估计导致 50% 死亡率的浓度。
- 一旦估计了 LC50 浓度,通过将 96 孔板中的 24 只复制幼虫暴露于这个单一估计的 LC50 浓度来重复上述实验。
5. 技术复制
- 在两个不同的场合,使用选定的五种浓度的相同化学品至少再重复两次,以确保结果的可重复性。
结果
可以在实验时间表上单独或累积查看异常,直到 7 dpf。每个异常的最大形态学评分可用于计算形态学异常占所用幼虫数量的百分比。例如,如果在第 7 天,评分者 1 和 2 的心包水肿形态学评分分别为 19 和 20,而可能的评分为 24,这意味着 24 只幼虫中有 19 或 20 只幼虫显示心包水肿,则百分比评分可计算为:
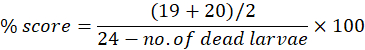
补充表 S1 显示了化合物 Bosutinib(一种用于治疗慢性粒细胞白血病的酪氨酸激酶抑制剂)毒性测试后 4 dpf 时的形态学评分结果(两个评分者)15。对于 5 dpf 至 7 dpf 的暴露鱼重复相同的形态评分。使用 100 μM 至 6.25 μM 的浓度范围对化合物进行测试。在不同时间点进行了 3 次技术重复,并使用 7 dpf 时的平均累积死亡率来确定 LC50,即 50% 幼虫存活的浓度。LC50 可以在任何曝光时间点测定。但是,我们建议以 7 dpf 计算。
使用 7 dpf 时的累积平均死亡率生成 LC50 曲线,如图 3 所示。对于 Bosutinib,LC50 浓度估计为 37.95 μM。
注:该估计的 LC50 浓度严格适用于该模型系统,然后可用于进一步的下游表型分析。
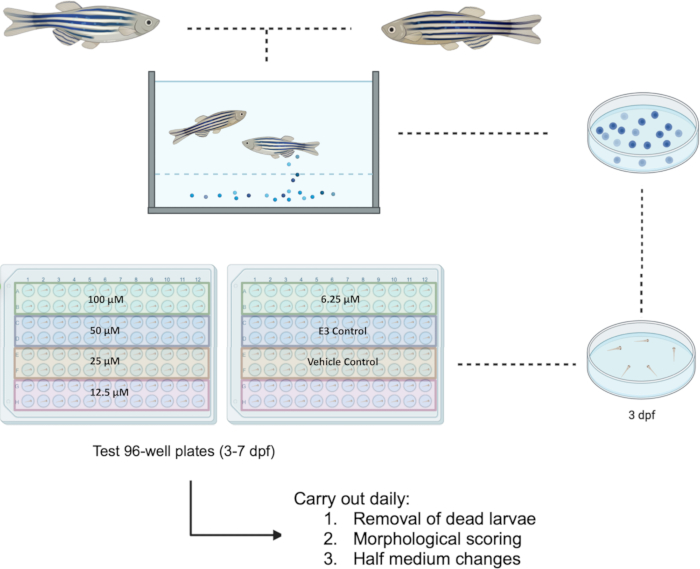
图 1:在 3-7 dpf 的幼虫中拟议的药物筛选示意图。 96 孔测试板用于研究化合物 Bosutinib 的 5 种浓度范围为 100 μM 至 6.25 μM。缩写:dpf = 受精后天数。 请单击此处查看此图的较大版本。

图 2:在暴露于各种化学浓度的 5 dpf 下(暴露后 2 天)在斑马鱼幼虫中观察到的典型形态缺陷。(A) 对照(未受影响的)斑马鱼,(B) 斑马鱼幼虫显示轻度心包水肿,(C) 有严重心包水肿和蛋黄出血的斑马鱼,(D) 发育迟缓、色素沉着减少、鱼鳔小的斑马鱼,(E) 蛋黄肿胀和尾鳍扭结的斑马鱼,(F) 没有尾鳍的斑马鱼,(G) 弯曲的脊索的斑马鱼,(H) 尾巴截短的斑马鱼, (I) 坏死的斑马鱼。缺陷用红色箭头表示。比例尺 = 1 毫米。 请单击此处查看此图的较大版本。
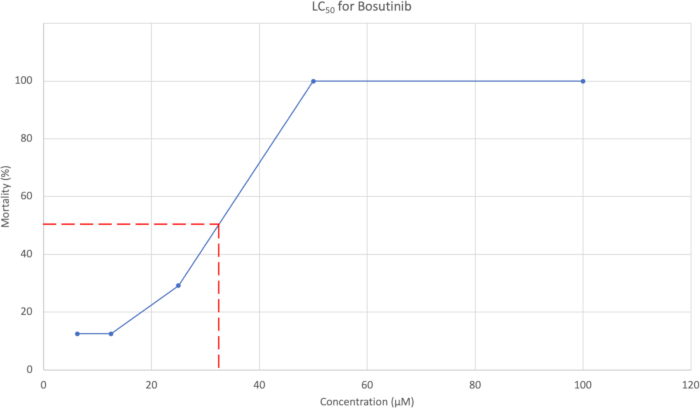
图 3: LC50 曲线显示浓度与死亡率百分比的关系。 测试的 5 种浓度分别为 100 μM、50 μM、25 μM、12.5 μM 和 6.25 μM,死亡率分别为 100%、100%、29.2%、12.5% 和 12.5%。 请单击此处查看此图的较大版本。
| 形态缺陷 | 描述 |
| 心包水肿 | 心脏周围积液,心脏拉紧,血液循环功能障碍 |
| 心跳次数(每分钟) | 减少每分钟的心跳次数 |
| 蛋黄 | 是否存在可能与心脏缺陷同时发生的蛋黄水肿或出血 |
| 蛋黄延伸 | 蛋黄肿胀、变薄或不存在 |
| 弯曲脊索 | 存在扭结或起伏的脊索,和/或弯曲的尾巴 |
| 鳔 | 鱼鳔的存在、缺失或部分发育 |
| 着色 | 与同龄未处理的鱼相比,黑色素细胞更少或没有 |
| 坏死 | 身体任何部位存在(轻度或严重)或不存在坏死 |
| 发育迟缓 | 与同龄野生型对照相比,发育延迟或停滞。 |
| 对触摸的响应 | 惊吓后延迟或无反应(例如,使用移液器吸头) |
| 截断 | 斑马鱼后体缺失(即形成尾巴) |
| 鳍 | 尾鳍的存在与否,可能伴有薄的卵黄延伸 |
| 减少的体轴 | 看起来正常但测量时长度较短的鱼 |
表 1:药物暴露研究后可以观察到的视觉形态学缺陷列表。
补充表 S1: Bosutinib 在 4 dpf 时的代表性形态学结果(暴露后 1 天)。请点击此处下载此表格。
讨论
斑马鱼已成为药物筛选的重要模型。在尝试确定进行毒性测试的方法时,我们发现了来自不同实验室的几种对比方法8、9、10、11、12、13。所描述的方法使用不同年龄的幼虫、不同的实验时间表、不同的培养基变化率和不同的形态学评分系统。通过反复试验,我们建立了所描述的方法,该方法提供了可靠且可重复的结果。
选择印版尺寸
最初,在 24 孔板中进行实验,以确保幼虫有足够的空间移动和生长。板布置为每孔 10 只幼虫,每种浓度 2 孔,每孔 1 mL 药物溶液。这种安排没有提供可重复的结果,导致推断幼虫没有从孔中吸收等量的药物。然后使用 96 孔和 48 孔板进行试验,每孔 1 只幼虫,结果表明 96 孔板中的幼虫没有生长问题。因此,在 96 孔板中继续实验,使用更少的空间和药物体积。
每日介质变化
由于斑马鱼从培养基中吸收药物,我们确定需要一定程度的培养基变化才能使培养基中的药物浓度保持一致。此外,介质更换会去除井中积聚的潜在废料,这些废料会提供有毒环境并导致结果有偏差。对 Bosutinib 进行了一项试验,其中为同一药物设置了三个板,一个没有每日培养基更换量,一个每日半培养基更换量,一个每日完全更换培养基。虽然没有培养基变化的平板表现出更高的死亡率,但培养基变化一半和完全的平板导致相同的结果,增加了 7 dpf。因此,选择了每日半培养基变化。这种选择可确保减少昂贵且有限的测试材料的消耗,而这些材料可能是进一步下游实验所必需的。
曝光持续时间
该方案中使用的测试幼虫的年龄和选择的药物暴露持续时间是由我们感兴趣的表型驱动的,即骨矿化。由于骨骼形成在 ~4 dpf 时开始,我们选择从 3 dpf 的斑马鱼开始,以确定测试化学物质是否影响骨骼发育的开始。随后,我们在 7 dpf 时结束了药物暴露研究,因为鉴于缺乏喂养可能会使结果产生偏倚,从 8 dpf 开始观察到高死亡率。尽管如此,时间框架可能会根据研究的性质和感兴趣的表型进行调整。
局限性
此方法有一些局限性。将 3 dpf 斑马鱼转移到多孔测试板非常耗时。从孔中取出培养基而不拾取幼虫同样费力。需要使用单通道移液器从每个孔中缓慢去除培养基,以确保在此过程中不会损坏幼虫。此外,虽然每天更换半培养基可以补充测试化合物并确保从孔中清除废料,但并不能保证在暴露的 5 天内可以在孔中保持稳定的药物浓度。虽然高效液相色谱分析可以进一步了解每个幼虫吸收的实际药物量,但该测试不再符合高通量筛选方法的条件。
总之,该方法旨在针对使用斑马鱼超过 4 dpf 的毒性测试中的差距,逐步实现适用于野生型、突变体和转基因斑马鱼品系的标准化方案,这与胚胎阶段的 FET 相当。这为其他下游表型分析开辟了途径,而这些分析在早期阶段可能无法进行。
披露声明
作者声明没有利益冲突。
致谢
作者得到了 ZeEBRA (R&I-2019-018) 项目的支持,这是一个技术发展计划 (TDP) 基金,STRONG (R&I-2024-007L),一个 TDPLite 基金,NASDAC (SINO-MALTA-2022-08),一个科技合作赠款,以及 DEMONSTRATE (R&I-2018-007A),一个 Go2Market 赠款,所有这些都由 XjenzaMalta 为并代表科学技术基金会资助。 图 1 是使用 BioRender 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Starlab | E1415-1510 | |
| 10 µL micropipette (P10) | Gilson | F144802 | |
| 10/20 µL pipette tips | Starlab | S1110-3810 | |
| 1000 µL micropipette (P1000) | Gilson | F123602 | |
| 1000 µL pipette tips | Starlab | S1111-6001 | |
| 12-well plate | Starlab | CC7672-7512 | Sterile, single-wrapped, non-treated, with lid |
| 20 µL micropipette (P20) | Gilson | F123600 | |
| 200 µL micropipette (P200) | Gilson | F123601 | |
| 200 µL multi-channel pipette | Gilson | F81024 | |
| 200 µL pipette tips | Starlab | S1113-1006 | |
| 96-well plate | Starlab | CC7672-7596 | Sterile, single-wrapped, flat-bottom, non-treated, with lid |
| Breeding tanks with inside grid sloping bottom, tank dividers and lids | Tecniplast | ZB17BTISLOP, ZB17BTE, ZB17BTL, ZB17BTD | Sloped inner tank |
| Mesh strainer | / | / | |
| Nitrile gloves | Mercator | / | / |
| Petri-dish | Starlab | CC7672-3394/CC7672-3359 | 100 x 20 mm or 60 x 15 mm |
| Leica M205 FCA Fluorescence stereo microscope | Leica | 10450826 | |
| Peltier-cooled incubator including 2 shelves with light module cold white | Memmert | IPP110ecoplus, T8 | Equipped with day/night cycle |
| Dimethyl Sulfoxide | Biochem Chemopharma | 504341000 | To prepare a 1% solution in E3 |
| Calcium chlorided dihydrate | Biochem Chemopharma | 303080500 | To prepare E3 |
| Magnesium sulfate heptahydrate | Biochem Chemopharma | 313060500 | To prepare E3 |
| Potassium Chloride | Biochem Chemopharma | 316030500 | To prepare E3 |
| SCREEN-WELL Wnt Pathway library (Bosutinib) | Enzo | BML-2838-0500 | |
| Sodium Chloride | Fisher Scientific | S/3161/53 | To prepare E3 |
参考文献
- Teame, T., et al. The use of zebrafish (Danio rerio) as biomedical models. Anim Front. 9 (3), 68-77 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: From preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- Clift, D., Richendrfer, H., Thorn, R. J., Colwill, R. M., Creton, R. High-throughput analysis of behavior in zebrafish larvae: Effects of feeding. Zebrafish. 11 (5), 455-461 (2014).
- Keenan, S. R., Currie, P. D. The developmental phases of zebrafish myogenesis. J Dev Biol. 7 (2), 12 (2019).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders. Front Endocrinol (Lausanne). 11, 489 (2020).
- OECD. . Test no. 236: Fish embryo acute toxicity (FET). , (2013).
- Chen, J. R., Lai, Y. H., Tsai, J. J., Hsiao, C. D. Live fluorescent staining platform for drug-screening and mechanism-analysis in zebrafish for bone mineralization. Molecules. 22 (12), 2068 (2017).
- He, H., Wang, C., Tang, Q., Yang, F., Xu, Y. Possible mechanisms of prednisolone-induced osteoporosis in zebrafish larva. Biomed Pharmacother. 101, 981-987 (2018).
- Huang, H. X., et al. Application of bone transgenic zebrafish in anti-osteoporosis chemical screening. Animal Model Exp Med. 1 (1), 53-61 (2018).
- Haney, M. G., Moore, L. H., Blackburn, J. S. Drug screening of primary patient derived tumor xenografts in zebrafish. J Vis Exp. (158), e60996 (2020).
- Nishimura, Y., et al. Using zebrafish in systems toxicology for developmental toxicity testing. Congenit Anom (Kyoto). 56 (1), 18-27 (2016).
- Hayot, G., et al. Evaluating toxicity of chemicals using a zebrafish vibration startle response screening system. J Vis Exp. (203), e66153 (2024).
- Hoyberghs, J., et al. DMSO concentrations up to 1% are safe to be used in the zebrafish embryo developmental toxicity assay. Front Toxicol. 3, 804033 (2021).
- Lipton, J. H., Brümmendorf, T. H., Sweet, K., Apperley, J. F., Cortes, J. E. Practical considerations in the management of patients treated with bosutinib for chronic myeloid leukemia. Ann Hematol. 103 (9), 3429-3442 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。