Method Article
Screening kleiner Moleküle und Toxizitätstests an Zebrafischlarven im Frühstadium
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein Wirkstoffscreening-Verfahren bei Zebrafischlarven 3-7 Tage nach der Befruchtung, gefolgt von einer morphologischen Beurteilung.
Zusammenfassung
Zebrafische sind zu einem prominenten Modellorganismus für die translationale Forschung am Menschen, Toxizitätstests von kleinen Molekülen und Umweltschadstoffen, die therapeutische Wirkstoffforschung und andere biomedizinische Forschungsanwendungen geworden. Das vorgestellte Protokoll zielt darauf ab, einen klaren Leitfaden für das Wirkstoffscreening und die Toxizitätsprüfung bei Zebrafischlarven im Frühstadium (im Alter von 3-7 Tagen nach der Befruchtung, dpf) zu bieten. Es wurden mehrere Methoden zur Beschreibung von Toxizitätstests an Zebrafischlarven veröffentlicht, allerdings fehlt ein standardisiertes Protokoll für die Expositionsdauer, die Rate der Medienveränderungen und die Morphologiebewertung. Wir bestimmten experimentell das ideale Alter der Larven für die Durchführung der Experimente, die Plattengrößen, die für dieses Alter am besten geeignet sind, die Rate der Medienwechsel, die zuverlässige Ergebnisse liefern und gleichzeitig die Verschwendung der Testsubstanz begrenzen, und ein morphologisches Bewertungssystem, das auf statistische Weise leicht quantifizierbar ist. Das Manuskript beschreibt detailliert ein Protokoll für Toxizitätstests an Zebrafischlarven im Alter zwischen 3 und 7 dpf, das darauf abzielt, die Lücke in der Arzneimitteltoxizitätsprüfung zu schließen und den ersten Schritt zu einer standardisierten Methode ähnlich dem Fish Embryo Acute Toxicity Test zu machen.
Einleitung
Der Zebrafisch (Danio rerio) hat sich in jüngster Zeit zu einem leistungsfähigen Modellorganismus für Wirbeltiere entwickelt, der für Studien zur Förderung der biomedizinischen Forschung immer beliebterwird 1. Etwa 70 % der menschlichen proteinkodierenden Gene haben mindestens ein Zebrafisch-Ortholog, wobei ~82 % der menschlichen krankheitsverursachenden Gene mindestens ein orthologes Gen im Zebrafischhaben 2. Die genetische Konservierung, gepaart mit ähnlichen grundlegenden Organmustern und Morphologien, machen den Zebrafisch zu einem interessanten Modell für die Erforschung menschlicher Krankheiten, das artübergreifende Vergleiche auf molekularer Ebeneermöglicht 1,2,3, was für die Arzneimittelentwicklung von entscheidender Bedeutung ist.
Zebrafische entwickeln sich schnell, wobei sich die Schwanzknospe 10 h nach der Befruchtung (hpf) bildet und die ersten Somiten bei 16 hpf erscheinen. Die Embryonen schlüpfen ~2-3 Tage nach der Befruchtung (dpf) aus dem Chorion. Bei 4 dpf ist ihr Verdauungstrakt voll entwickelt und bei 5 dpf hat sich ihre Schwimmblase aufgebläht, so dass sie frei herumschwimmen und nach Nahrung jagen können. Trotz der Fähigkeit, sich mit 5 dpf zu ernähren, können Larven, die nicht gefüttert werden, ausschließlich mit Nährstoffen aus dem Dotter bis zu mindestens 7 dpf überleben, wodurch die Notwendigkeit einer externen Fütterung umgangen wird, die eine Kontamination verursachen und das Drogenscreening, die Toxikologie und Verhaltenstests beeinträchtigen kann4. Bei 7 dpf entwickeln die Larven auch einen vollständigen Körperbau mit mehreren rudimentären Organsystemen, einschließlich Herz und Gefäßen, Muskeln und Knochen 5,6. Zebrafischembryonen werden auch ex vivo befruchtet, entwickeln sich extern und sind in den frühen Lebensstadien optisch transparent, was sie für die Genbearbeitung und das Screening kleiner Moleküle sehr zugänglich macht3. Darüber hinaus ermöglichen ihre geringe Größe und ihre hohe Fruchtbarkeitsrate die Einbeziehung von mehr Replikaten, was die statistische Aussagekraft erhöht, sowie die Verwendung von Multi-Well-Platten, was das Wirkstoffvolumen einspart und den Durchsatz erhöht.
Das Screening neuartiger kleiner Moleküle in einem Tiermodell ist wichtig, um die Fähigkeit des Arzneimittels zu bestimmen, sowohl positive als auch unerwünschte Wirkungen hervorzurufen, und um so zu identifizieren, welche Verbindungen für weitere Tests geeignet sind und andere, die möglicherweise modifiziert werden müssen, um ihre Aktivität zu verändern. Im Rahmen des Wirkstoffscreenings muss die letale Konzentration 50 (LC50) der Zielsubstanz(en) identifiziert werden. Dies ergibt eine Arbeitskonzentration, die bei 50 % der Versuchstiere im Rahmen der vorläufigen Toxizitätsprüfung zum Tod führt.
Für Toxizitätstests an Zebrafischembryonen bis zu 96 h nach der Befruchtung (hpf) gibt es ein standardisiertes Protokoll, nämlich den Fish Embryo Acute Toxicity (FET) Test (TG236)7. Im FET-Test werden neu befruchtete Eier bis zu 96 Stunden lang fünf Konzentrationen einer Chemikalie ausgesetzt und auf Anzeichen von Letalität beobachtet, nämlich (i) Gerinnung der Eizellen, (ii) fehlende Somitbildung, (iii) fehlende Ablösung der Schwanzknospe vom Dottersack und (iv) fehlender Herzschlag. Der Test ermöglicht die Bestimmung der akuten Toxizität und des LC50. Darüber hinaus gibt es unter anderem Ratschläge zu den für das Screening zu verwendenden Testkammergrößen (24-Well-Platten), zur Verteilung der Eizellen in der Testkammer und zu den Haltungsbedingungen, um gültige und reproduzierbare Ergebnisse zu gewährleisten7.
Der FET-Test eignet sich zwar für Toxizitätstests im Embryonalstadium, geht aber nicht über 4 dpf hinaus. Bei Phänotypen, die sich zu diesem Zeitpunkt zu entwickeln beginnen (z. B. Mineralisierung der Notochord6), muss das Wirkstoffscreening weiter als 4 dpf gehen, um die morphologische Beurteilung dieses Gewebes zu ermöglichen. Darüber hinaus empfehlen wir, dass die Arzneimittelexposition mindestens einen Tag vor der Entwicklung des interessierenden Phänotyps beginnt. Unseres Wissens gibt es kein standardisiertes Protokoll ähnlich dem FET für das Wirkstoffscreening bei Zebrafischlarven im Frühstadium, insbesondere bei Zebrafischen im Alter von 3 bis 7 dpf. Obwohl mehrere Studien veröffentlicht wurden, in denen Drogentests an Zebrafischlarven jenseits von 4 dpf beschrieben wurden, mangelt es an Konsistenz in der verwendeten Methodik, einschließlich der Größe der Testkammern, der Anzahl der biologischen und technischen Replikate, der Rate der Medienwechsel, der Expositionsdauer und der bewerteten morphologischen Defekte 8,9,10,11,12,13 . Aus diesem Grund haben wir ein validiertes Protokoll für standardisierte Toxizitätstests entwickelt, gefolgt von der visuellen Beobachtung morphologischer Veränderungen in Zebrafischlarven bei 3-7 dpf. Das vorgeschlagene Protokoll kann anschließend für andere nachgelagerte Phänotypisierungsassays verwendet werden, wie z. B. Verhaltensanalysen, Genexpressionsprofile und Histomorphometrie.
Protokoll
Die Zebrafische wurden gemäß der EU-Richtlinie 2010/63/EU behandelt. Alle Versuche wurden von der Ethikkommission der Fakultät für Forschung (FREC) und dem Joint FREC Animal Research Sectoral Subcommittee (JFARSS) der Universität Malta genehmigt. Ein Flussdiagramm des vorgeschlagenen Protokolls ist in Abbildung 1 zu finden.
1. Herstellung, Sammlung und Pflege von Eiern
- Setzen Sie die Fische am Vortag, mindestens eine Stunde nach der letzten Fütterung, in Aufzuchtbecken ein, wobei Trennwände zwischen Männchen und Weibchen angebracht sind. Für bessere Ergebnisse bei der Eiproduktion verwenden Sie ein höheres Verhältnis von Weibchen zu Männchen. Setzen Sie die Fische in einem Raum auf, der mit einem Hell-Dunkel-Rhythmus von 14 h:10 h und einer Umgebungstemperatur von 27-28 °C ausgestattet ist.
HINWEIS: Ein 1-Liter-Zuchtbecken kann drei erwachsene Fische aufnehmen, während ein 1,7-Liter-Zuchtbecken fünf erwachsene Fische aufnehmen kann. - Ersetzen Sie am nächsten Morgen nach Einbruch des Lichts das Wasser in den Aufzuchtbecken und entfernen Sie die Trennwände. Falls das Zuchtbecken nicht leicht geneigt ist, stellen Sie es in eine schräge Position, um sicherzustellen, dass flaches Wasser zur Verfügung steht, um die Paarung zu fördern. Bei langsamer Eiproduktion und Paarungsaktivität das Wasser in den Zuchtbecken alle 45 Minuten austauschen. Lassen Sie den Fisch bis zu 3 Stunden oder nach Bedarf paaren.
- Sobald die Paarung abgeschlossen ist, drücke vorsichtig alle Weibchen, die keine Eier produziert haben, um eine langfristige Eibindung zu verhindern. Setze die Fische wieder in ihre jeweiligen Aquarien.
- Sammeln Sie alle Eier in den Zuchtbecken mit einem Netzsieb, spülen Sie es mit Embryowasser (E3) ab und legen Sie es in eine Petrischale mit E3. Zur Herstellung von E3 mischen Sie 16,67 mL 60x E3 (300 mM NaCl; 10 mM KCl; 20 mM CaCl2,2H 2O; 20 mM MgSO4,7H 2O) mit 1 mL 0,01 % Methylenblau und 982 mL deionisiertem Wasser. Entferne alle unbefruchteten Eier oder Ablagerungen. Stellen Sie sicher, dass die Petrischalen nicht überfüllt sind, mit 50 Eiern pro 100 mm x 15 mm Petrischale und 120 Eiern pro 150 mm x 15 mm Petrischale.
- Bewahren Sie die Eier in einem auf 28,5 °C eingestellten Brutkasten auf, der mit einem Tag-Nacht-Zyklus von 14 h:10 h ausgestattet ist. Bei 1 dpf den E3 auffrischen und nicht lebensfähige Eier entfernen, um das Pilzwachstum zu begrenzen.
2. Vorbereitung der Testplatte
- Bei 3 dpf übertragen Sie einen gesund aussehenden, geschlüpften Embryo in jede Vertiefung in einer 96-Well-Platte mit einer 1.000-μl-Mikropipette, die auf ein Volumen von 100 μl eingestellt ist.
HINWEIS: Nicht geschlüpfte Embryonen sollten nicht verwendet werden, da dies zu einer variablen Aufnahme von Verbindungen führen kann. Die Verwendung von Embryonen, die gesund erscheinen, begrenzt auch die Verzerrung während der Tests. Die Größe der Pipettenspitze ermöglicht eine einfache Entnahme des Zebrafischembryos, ohne dass es zu körperlichen Schäden kommt. Darüber hinaus ermöglicht eine Mikropipette im Gegensatz zu einer Transferpipette eine bessere Kontrolle des Volumens, das in die Vertiefung abgegeben wird. - Bereiten Sie in einer 12-Well-Platte die gewünschte(n) Konzentration(en) für jede Prüfchemikalie(n) in separaten Vertiefungen vor (hier Bosutinib in einem Konzentrationsbereich von 100 μM bis 6,25 μM). In jede Vertiefung das erforderliche Volumen der Prüfchemikalie mit Mikropipetten geben und mit E3 auf bis zu 2,4 ml auffüllen.
HINWEIS: Es sollte eine Literaturrecherche durchgeführt werden, um die geeigneten Konzentrationen für die relevanten Prüfchemikalien zu bestimmen. Liegen keine Informationen vor, können mehrere Konzentrationen getestet werden, bis ein geeigneter Konzentrationsbereich bestimmt ist. Es sollten mindestens fünf Konzentrationen verwendet werden, wobei die höchste Konzentration eine Mortalität von 100 % und die niedrigste Konzentration keine beobachtbare Wirkung hat7. - Bereiten Sie eine Fahrzeugsteuerung in Abhängigkeit von dem Lösungsmittel vor, das zum Auflösen der Stammprüfchemikalie verwendet wird.
HINWEIS: Viele Testverbindungen sind nicht wasserlöslich und müssen aus diesem Grund in bestimmten Lösungsmitteln ("Vehikel") wie Ethanol oder Dimethylsulfoxid (DMSO) gelöst werden, um eine wässrige Lösung zu erzeugen. DMSO sollte vorzugsweise eine Konzentration von 1 % nicht überschreiten, wenn es als Vehikel zur Kontrolle verwendet wird, was der Konzentration entspricht, die im Zebrafisch als sicher befundenwurde 14. - Entfernen Sie alle in der 96-Well-Platte vorhandenen E3-Lösungen mit einer 200-μl-Mikropipette und ersetzen Sie sie durch 100 μl des entsprechenden zu testenden Mediums. Achten Sie darauf, insgesamt 24 Larven pro Konzentration zu testen. Verwenden Sie eine Ein- oder 8-Kanal-Mikropipette mit 200 μl, um die Testchemikalien in die entsprechenden Testplatten-Wells zu übertragen. Einschließlich Kontrollen (z. B. E3, chemisches Vehikel, Positivkontrollen usw.).
HINWEIS: Die Platte kann bis zu vier verschiedene Prüfchemikalien oder vier verschiedene Konzentrationen derselben Chemikalie aufnehmen. Abbildung 1 zeigt ein Beispiel für die Prüfplatten, die für die Untersuchung von fünf Konzentrationen derselben Chemikalie (z. B. Bosutinib) in Verbindung mit Kontrollen aufgestellt sind. - 24 Stunden nach der Exposition ist eine morphologische Bewertung (wie in Abschnitt 3 beschrieben) und ein halber Mediumwechsel durchzuführen, wobei 50 μl des Mediums entfernt und durch frisch zubereitetes Medium ersetzt werden. Entfernen und erfassen Sie dabei alle toten Larven. Bewahren Sie die Larven in einem auf 28,5 °C eingestellten Brutkasten auf, der mit einem Tag-Nacht-Zyklus von 14 h:10 h ausgestattet ist. Wiederholen Sie den Vorgang bis 7 dpf.
3. Morphologische Beurteilung
- Beobachten Sie die einzelnen Testlarven mit einem Stereolichtmikroskop in geeigneter Vergrößerung.
HINWEIS: Beispiele für morphologische Defekte, die beurteilt werden können, sind in Tabelle 1 aufgeführt. - Lassen Sie die Morphologie von zwei unabhängigen Bewertern beurteilen, wobei ein dritter bei Meinungsverschiedenheiten zwischen den beiden Bewertern konsultiert wird.
- Bewerten Sie die Morphologie mit einer binären Methode (d. h. vorhanden/abwesend), wobei "abwesend" eine normale Morphologie anzeigt (bewertet als "0") und "vorhanden" das Vorhandensein einer morphologischen Anomalie (bewertet als "1"). Abbildung 2 zeigt Beispiele von Zebrafischen mit 5 dpf nach 2 Tagen Arzneimittelexposition, darunter ein nicht betroffener Zebrafisch (Abbildung 2A), ein Zebrafisch mit leichtem Perikardödem (Abbildung 2B), schweres Perikardödem mit Dotterblutung und Dotterausdehnung (Abbildung 2C), verzögerter Entwicklung mit verminderter Pigmentierung, Schwimmblase und Gesamtlänge (Abbildung 2D), geschwollenem Eigelb und einer geknickten Schwanzflosse (Abbildung 2E), fehlende Schwanzflosse (Abbildung 2F), gekrümmte Chorda (Abbildung 2G), Trunkierung (Abbildung 2H) und Tod mit Nekrose (Abbildung 2I). Bewerten Sie alle abnormalen Phänotypen mit "1" und die nicht betroffenen Zebrafische mit "0".
4. LC50 Bestimmung
- Nach der morphologischen Bewertung ist die kumulative prozentuale Mortalität bei 7 dpf gegen die Konzentration aufzuzeichnen. Ein Beispiel ist in Abbildung 3 dargestellt. Verwenden Sie die Konzentrationskurve, um die Konzentration zu schätzen, die eine Mortalität von 50 % verursacht.
- Sobald die LC50-Konzentration geschätzt ist, wiederholen Sie das oben beschriebene Experiment, indem Sie 24 replizierte Larven in einer 96-Well-Platte dieser einzigen geschätzten LC50-Konzentration aussetzen.
5. Technische Repliken
- Wiederholen Sie den gesamten Vorgang mit den ausgewählten fünf Konzentrationen derselben Chemikalie mindestens zwei weitere Male bei zwei verschiedenen Gelegenheiten, um sicherzustellen, dass die Ergebnisse reproduzierbar sind.
Ergebnisse
Die Anomalien können einzeln oder kumulativ über den experimentellen Zeitraum bis 7 dpf betrachtet werden. Der maximale Morphologie-Score pro Anomalie kann verwendet werden, um morphologische Anomalien als Prozentsatz der Anzahl der verwendeten Larven zu berechnen. Wenn beispielsweise an Tag 7 die Morphologiewerte des Perikardödems bei 19 bzw. 20 für die Bewerter 1 bzw. 2 von 24 liegen, was bedeutet, dass 19 oder 20 Larven von 24 ein Perikardödem aufweisen, kann der prozentuale Wert wie folgt berechnet werden:
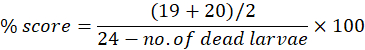
Die ergänzende Tabelle S1 zeigt die morphologischen Bewertungsergebnisse (beider Bewerter) bei 4 dpf nach Toxizitätstests für die Substanz Bosutinib, einen Tyrosinkinase-Inhibitor, der zur Behandlung der chronischen myeloischen Leukämie indiziert ist15. Die gleiche morphologische Bewertung wird für exponierte Fische im Alter von 5 dpf bis 7 dpf wiederholt. Die Verbindung wurde in einem Konzentrationsbereich von 100 μM bis 6,25 μM getestet. Drei technische Replikate wurden zu unterschiedlichen Zeitpunkten durchgeführt, und die durchschnittliche kumulative Mortalitätsrate bei 7 dpf wurde verwendet, um LC50 zu bestimmen, die Konzentration, bei der 50 % der Larven überleben. Der LC50 kann zu jedem beliebigen Expositionszeitpunkt bestimmt werden. Wir empfehlen jedoch, diesen mit 7 dpf zu berechnen.
Die kumulative durchschnittliche Mortalität bei 7 dpf wurde verwendet, um eine LC50-Kurve zu erstellen, die in Abbildung 3 zu sehen ist. Für Bosutinib wurde die LC50-Konzentration auf 37,95 μM geschätzt.
HINWEIS: Diese geschätzte LC50-Konzentration gilt ausschließlich für dieses Modellsystem und kann dann für weitere nachgelagerte Phänotypisierungsassays verwendet werden.
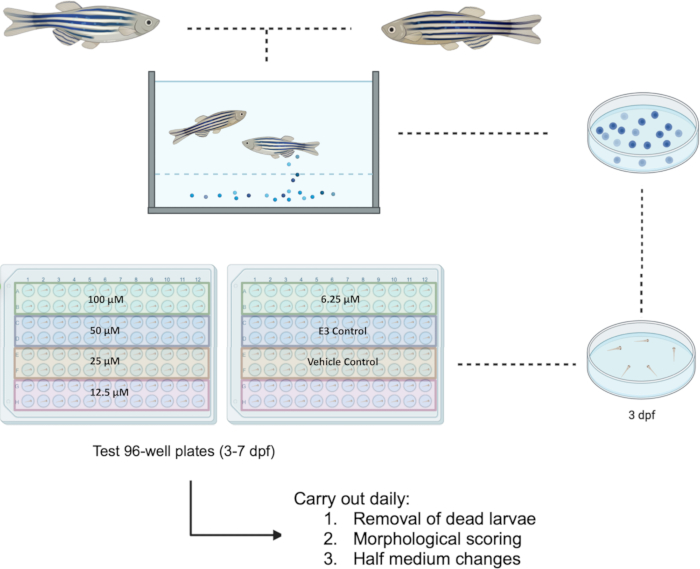
Abbildung 1: Schematische Darstellung des vorgeschlagenen Wirkstoffscreenings bei Larven bei 3-7 dpf. Die 96-Well-Testplatten sind für die Untersuchung von fünf Konzentrationen im Bereich von 100 μM bis 6,25 μM für die Substanz Bosutinib ausgelegt. Abkürzung: dpf = Tage nach der Befruchtung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative morphologische Defekte, die bei Zebrafischlarven bei 5 dpf bei verschiedenen chemischen Konzentrationen (2 Tage nach der Exposition) beobachtet wurden. (A) Kontroll-Zebrafisch (nicht betroffen), (B) Zebrafischlarve mit leichtem Perikardödem, (C) Zebrafisch mit schwerem Perikardödem und Dotterblutung, (D) Zebrafisch mit Entwicklungsverzögerung, verminderter Pigmentierung, kleiner Schwimmblase, (E) Zebrafisch mit geschwollenem Eigelb und geknickter Schwanzflosse, (F) Zebrafisch ohne Schwanzflosse, (G) Zebrafisch mit gebogenem Notochord, (H) Zebrafisch mit abgeschnittenem Schwanz, und (I) toter Zebrafisch mit Nekrose. Fehler sind mit roten Pfeilspitzen gekennzeichnet. Maßstabsleisten = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
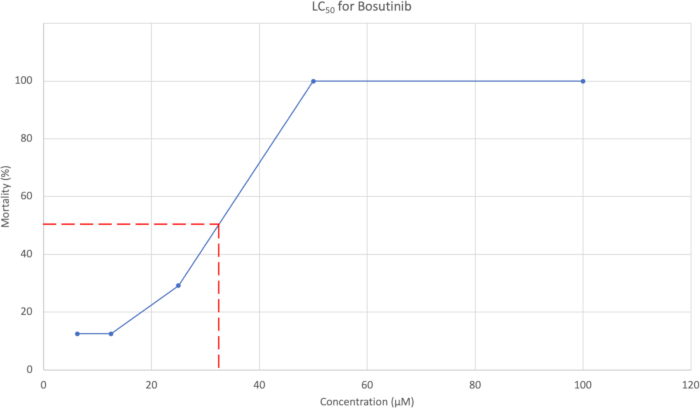
Abbildung 3: LC50-Kurve, die die Konzentration im Verhältnis zur %-Mortalität zeigt. Die fünf getesteten Konzentrationen betrugen 100 μM, 50 μM, 25 μM, 12,5 μM und 6,25 μM, wobei die Mortalität in % 100 %, 100 %, 29,2 %, 12,5 % bzw. 12,5 % betrug. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Morphologische Defekte | Beschreibung |
| Perikardödem | Flüssigkeitsansammlung um das Herz herum bei gestrecktem Herzen und Fehlfunktion der Durchblutung |
| Herzschläge (pro Minute) | Reduzierte Anzahl von Schlägen pro Minute |
| Eidotter | Vorhandensein oder Fehlen von Dotterödemen oder Blutungen, die gleichzeitig mit Herzfehlern auftreten können |
| Yolk Erweiterung | Eigelb, das geschwollen, dünn oder nicht vorhanden ist |
| Gekrümmtes Notochord | Vorhandensein eines geknickten oder wellenförmigen Notochords und/oder eines gekrümmten Schwanzes |
| Schwimmblase | Vorhandensein, Fehlen oder teilweise Entwicklung der Schwimmblase |
| Pigmentierung | Weniger oder keine Melanozyten im Vergleich zu den unbehandelten Fischen gleichen Alters |
| Nekrose | Vorhandensein (leicht oder schwer) oder Abwesenheit von Nekrose in irgendeinem Teil des Körpers |
| Verzögerte Entwicklung | Verzögerte oder verzögerte Entwicklung im Vergleich zu Wildtyp-Kontrollen gleichen Alters. |
| Reaktion auf Berührung | Verzögerte oder keine Reaktion nach einem Schreck (z. B. mit einer Pipettenspitze) |
| Abschneiden | Fehlen eines hinteren Zebrafischkörpers (d.h. Bildung des Schwanzes) |
| Flossen | Vorhandensein oder Fehlen der Schwanzflosse, die von einer dünnen Dotterverlängerung begleitet sein kann |
| Reduzierte Körperachse | Fische, die normal aussehen, aber bei der Messung kürzer sind |
Tabelle 1: Eine Liste der visuellen morphologischen Defekte, die nach Studien zur Arzneimittelexposition beobachtet werden können.
Ergänzende Tabelle S1: Repräsentative morphologische Ergebnisse für Bosutinib bei 4 dpf (1 Tag nach Exposition). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Zebrafische sind zu einem wichtigen Modell für das Drogenscreening geworden. Bei dem Versuch, eine Methodik zur Durchführung von Toxizitätstests zu bestimmen, fanden wir mehrere gegensätzliche Methoden aus verschiedenen Laboratorien 8,9,10,11,12,13. Die beschriebenen Methoden verwenden Larven in unterschiedlichem Alter, variablen experimentellen Zeitplänen, unterschiedlichen Raten von Mediumveränderungen und unterschiedlichen morphologischen Bewertungssystemen. Durch Versuch und Irrtum haben wir die beschriebene Methodik etabliert, die zuverlässige und reproduzierbare Ergebnisse geliefert hat.
Auswählen einer Plattengröße
Zunächst wurden die Versuche in einer 24-Well-Platte durchgeführt, um sicherzustellen, dass die Larven genügend Platz zum Bewegen und Wachsen hatten. Die Platten wurden mit 10 Larven pro Vertiefung, zwei Vertiefungen pro Konzentration und 1 ml Arzneimittellösung pro Vertiefung angeordnet. Diese Anordnung lieferte keine reproduzierbaren Ergebnisse, was zu der Schlussfolgerung führte, dass die Larven nicht die gleichen Mengen des Medikaments aus der Vertiefung aufnahmen. Die Versuche wurden dann mit einer 96-Well- und einer 48-Well-Platte mit einer Larve pro Well durchgeführt, die zeigten, dass Larven in 96-Well-Platten keine Wachstumsprobleme zeigten. Daher wurden die Experimente in einer 96-Well-Platte mit weniger Platz und Wirkstoffvolumen fortgesetzt.
Täglicher Mediumwechsel
Da Zebrafische das Arzneimittel aus dem Medium aufnehmen, stellten wir fest, dass ein gewisses Maß an Medienwechsel erforderlich ist, um eine konstante Konzentration des Arzneimittels im Medium aufrechtzuerhalten. Darüber hinaus werden durch einen Mediumwechsel potenzielle Abfallstoffe entfernt, die sich in der Vertiefung angesammelt haben und eine toxische Umgebung schaffen und zu verzerrten Ergebnissen führen können. Es wurde eine Studie mit Bosutinib durchgeführt, in der drei Platten für dasselbe Medikament aufgestellt wurden, eine ohne täglichen Mediumwechsel, eine mit einem täglichen halben Mediumwechsel und eine mit einem vollständigen täglichen Mediumwechsel. Während die Platte ohne Mediumwechsel eine erhöhte Mortalitätsrate aufwies, führten die Platten mit halbem und vollem Mediumwechsel zum gleichen Ergebnis um 7 dpf. So wurde ein täglicher halber Mediumwechsel gewählt. Diese Wahl sorgt für einen geringeren Verbrauch des teuren und begrenzten Testmaterials, das für weitere nachgelagerte Experimente benötigt werden könnte.
Dauer der Exposition
Das Alter der verwendeten Testlarven und die Dauer der Arzneimittelexposition, die in diesem Protokoll ausgewählt wurde, wurden durch unseren Phänotyp von Interesse, die Knochenmineralisierung, bestimmt. Da die Knochenbildung bei ~4 dpf beginnt, haben wir uns entschieden, mit dem Zebrafisch bei 3 dpf zu beginnen, um festzustellen, ob die Testchemikalien den Beginn der Knochenentwicklung beeinflussen. Anschließend beendeten wir die Studien zur Arzneimittelexposition bei 7 dph, da ab 8 dpf eine hohe Mortalität beobachtet wurde, da die mangelnde Fütterung die Ergebnisse verzerren könnte. Dennoch können die Zeitrahmen je nach Art der Studie und dem Phänotyp des Interesses angepasst werden.
Begrenzungen
Diese Methodik hat einige Einschränkungen. Das Übertragen von 3 dpf Zebrafischen auf Multi-Well-Testplatten ist zeitaufwändig. Ebenso mühsam ist es, das Medium aus den Vertiefungen zu entfernen, ohne die Larven aufzunehmen. Das Medium muss langsam mit einer Einkanalpipette aus jeder Vertiefung entnommen werden, um sicherzustellen, dass die Larven dabei nicht beschädigt werden. Darüber hinaus wird die Testverbindung zwar durch einen täglichen halben Wechsel des Mediums wieder aufgefüllt und die Entfernung von Abfallmaterial aus der Vertiefung sichergestellt, es ist jedoch keine Garantie, dass eine stabile Arzneimittelkonzentration in der Vertiefung während der 5-tägigen Exposition aufrechterhalten werden kann. Während die Hochleistungsflüssigkeitschromatographie-Analyse weitere Einblicke in die tatsächliche Menge des Medikaments geben könnte, die von jeder Larve absorbiert wird, würde der Test nicht mehr als Hochdurchsatz-Screening-Methode gelten.
Zusammenfassend lässt sich sagen, dass diese Methodik darauf abzielt, die Lücke in der Toxizitätsprüfung mit Zebrafischen jenseits von 4 dpf zu schließen, indem Schritte in Richtung eines standardisierten Protokolls unternommen werden, das auf Wildtyp-, Mutanten- und transgene Zebrafischlinien anwendbar ist und dem FET im Embryonalstadium ebenbürtig ist. Dies eröffnet Wege für andere nachgelagerte Phänotypisierungsassays, die in früheren Stadien möglicherweise nicht möglich sind.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Die Autoren werden durch die Projekte ZeEBRA (R&I-2019-018), einen Fonds des Technology Development Programme (TDP), STRONG (R&I-2024-007L), einen TDPLite-Fonds, NASDAC (SINO-MALTA-2022-08), einen Zuschuss für wissenschaftliche und technologische Zusammenarbeit, und DEMONSTRATE (R&I-2018-007A), einen Go2Market-Zuschuss, unterstützt, die alle von XjenzaMalta für und im Namen der Stiftung für Wissenschaft und Technologie finanziert werden. Abbildung 1 wurde mit BioRender erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Starlab | E1415-1510 | |
| 10 µL micropipette (P10) | Gilson | F144802 | |
| 10/20 µL pipette tips | Starlab | S1110-3810 | |
| 1000 µL micropipette (P1000) | Gilson | F123602 | |
| 1000 µL pipette tips | Starlab | S1111-6001 | |
| 12-well plate | Starlab | CC7672-7512 | Sterile, single-wrapped, non-treated, with lid |
| 20 µL micropipette (P20) | Gilson | F123600 | |
| 200 µL micropipette (P200) | Gilson | F123601 | |
| 200 µL multi-channel pipette | Gilson | F81024 | |
| 200 µL pipette tips | Starlab | S1113-1006 | |
| 96-well plate | Starlab | CC7672-7596 | Sterile, single-wrapped, flat-bottom, non-treated, with lid |
| Breeding tanks with inside grid sloping bottom, tank dividers and lids | Tecniplast | ZB17BTISLOP, ZB17BTE, ZB17BTL, ZB17BTD | Sloped inner tank |
| Mesh strainer | / | / | |
| Nitrile gloves | Mercator | / | / |
| Petri-dish | Starlab | CC7672-3394/CC7672-3359 | 100 x 20 mm or 60 x 15 mm |
| Leica M205 FCA Fluorescence stereo microscope | Leica | 10450826 | |
| Peltier-cooled incubator including 2 shelves with light module cold white | Memmert | IPP110ecoplus, T8 | Equipped with day/night cycle |
| Dimethyl Sulfoxide | Biochem Chemopharma | 504341000 | To prepare a 1% solution in E3 |
| Calcium chlorided dihydrate | Biochem Chemopharma | 303080500 | To prepare E3 |
| Magnesium sulfate heptahydrate | Biochem Chemopharma | 313060500 | To prepare E3 |
| Potassium Chloride | Biochem Chemopharma | 316030500 | To prepare E3 |
| SCREEN-WELL Wnt Pathway library (Bosutinib) | Enzo | BML-2838-0500 | |
| Sodium Chloride | Fisher Scientific | S/3161/53 | To prepare E3 |
Referenzen
- Teame, T., et al. The use of zebrafish (Danio rerio) as biomedical models. Anim Front. 9 (3), 68-77 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: From preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- Clift, D., Richendrfer, H., Thorn, R. J., Colwill, R. M., Creton, R. High-throughput analysis of behavior in zebrafish larvae: Effects of feeding. Zebrafish. 11 (5), 455-461 (2014).
- Keenan, S. R., Currie, P. D. The developmental phases of zebrafish myogenesis. J Dev Biol. 7 (2), 12 (2019).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders. Front Endocrinol (Lausanne). 11, 489 (2020).
- OECD. . Test no. 236: Fish embryo acute toxicity (FET). , (2013).
- Chen, J. R., Lai, Y. H., Tsai, J. J., Hsiao, C. D. Live fluorescent staining platform for drug-screening and mechanism-analysis in zebrafish for bone mineralization. Molecules. 22 (12), 2068 (2017).
- He, H., Wang, C., Tang, Q., Yang, F., Xu, Y. Possible mechanisms of prednisolone-induced osteoporosis in zebrafish larva. Biomed Pharmacother. 101, 981-987 (2018).
- Huang, H. X., et al. Application of bone transgenic zebrafish in anti-osteoporosis chemical screening. Animal Model Exp Med. 1 (1), 53-61 (2018).
- Haney, M. G., Moore, L. H., Blackburn, J. S. Drug screening of primary patient derived tumor xenografts in zebrafish. J Vis Exp. (158), e60996 (2020).
- Nishimura, Y., et al. Using zebrafish in systems toxicology for developmental toxicity testing. Congenit Anom (Kyoto). 56 (1), 18-27 (2016).
- Hayot, G., et al. Evaluating toxicity of chemicals using a zebrafish vibration startle response screening system. J Vis Exp. (203), e66153 (2024).
- Hoyberghs, J., et al. DMSO concentrations up to 1% are safe to be used in the zebrafish embryo developmental toxicity assay. Front Toxicol. 3, 804033 (2021).
- Lipton, J. H., Brümmendorf, T. H., Sweet, K., Apperley, J. F., Cortes, J. E. Practical considerations in the management of patients treated with bosutinib for chronic myeloid leukemia. Ann Hematol. 103 (9), 3429-3442 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten