Method Article
Скрининг малых молекул и тестирование токсичности личинок данио-рерио на ранних стадиях
В этой статье
Резюме
Этот протокол описывает процедуру скрининга лекарственных средств у личинок рыбок данио через 3-7 дней после оплодотворения с последующей морфологической оценкой.
Аннотация
Рыбки данио стали выдающимся модельным организмом для трансляционных исследований человека, тестирования токсичности малых молекул и загрязнителей окружающей среды, разработки терапевтических лекарств и других биомедицинских исследований. Представленный протокол направлен на то, чтобы предоставить четкое руководство по скринингу лекарственных средств и тестированию токсичности на ранних стадиях у личинок данио-рерио (в возрасте 3-7 дней после оплодотворения, dpf). Было опубликовано несколько методологий, описывающих тестирование токсичности личинок рыбок данио, хотя в них отсутствует стандартизированный протокол по продолжительности воздействия, скорости изменения среды и оценке морфологии, среди прочего. Мы экспериментально определили идеальный возраст личинок для проведения экспериментов, размеры пластин, которые лучше всего подходят для этих возрастов, скорость изменения среды, которая обеспечивает надежные результаты при ограничении потерь исследуемого соединения, а также морфологическую систему оценки, которую легко количественно измерить статистическим образом. В рукописи подробно описывается протокол тестирования на токсичность личинок рыбок данио в возрасте от 3 до 7 dpf, направленный на устранение пробела в тестировании токсичности лекарств и первый шаг к стандартизированному методу, аналогичному тесту на острую токсичность рыбьих эмбрионов.
Введение
Рыбки данио-рерио (Danio rerio) в последнее время стали мощным модельным организмом позвоночных, становясь все более популярными для исследований, направленных на продвижение биомедицинскихисследований. Около 70% генов, кодирующих белки человека, имеют по крайней мере один ортолог данио-рерио, при этом ~82% генов, вызывающих заболевания человека, имеют по крайней мере один ортологичный ген уданио-рерио 2. Генетическое сохранение в сочетании с аналогичными основными структурами и морфологией органов делают рыбок данио интересной моделью для исследования заболеваний человека, позволяя проводить межвидовые сравнения на молекулярном уровне 1,2,3, что имеет решающее значение для разработки лекарств.
Рыбки данио развиваются быстро, хвостовая почка формируется через 10 часов после оплодотворения (HPF), а первые сомиты появляются через 16 HPF. Эмбрионы появляются из хориона через ~2-3 дня после оплодотворения (dpf). К 4 dpf их пищеварительный тракт полностью развит, а к 5 dpf их плавательный пузырь надувается, что позволяет им свободно плавать и охотиться за пищей. Несмотря на способность питаться на 5 dpf, личинки, которых не кормят, могут выжить исключительно на питательных веществах, полученных из желтка, по крайней мере, до 7 dpf, обходя потребность во внешнем питании, которое может вызвать загрязнение и помешать скринингу лекарств, токсикологии и поведенческому тестированию. К 7 dpf личинки также развивают полный план тела с несколькими рудиментарными системами органов, включая сердце и сосудистую систему, мышцы и кости 5,6. Эмбрионы рыбок данио также оплодотворяются ex vivo, развиваясь внешне, и оптически прозрачны на ранних стадиях жизни, что делает их очень доступными для редактирования генов и скрининга малых молекул3. Кроме того, их небольшой размер и высокая скорость плодовитости позволяют включать больше репликатов, что увеличивает статистическую мощность, а также использовать многолуночные планшеты, что позволяет экономить объемы препарата и увеличивать производительность.
Скрининг новых малых молекул на животной модели важен для определения способности лекарств оказывать как положительные, так и неблагоприятные эффекты, тем самым определяя, какие соединения жизнеспособны для дальнейшего тестирования, а какие могут потребовать модификации для изменения их активности. В рамках процесса скрининга лекарственных средств необходимо определить летальную концентрацию 50 (ЛК50) целевого соединения/соединений. Это обеспечивает рабочую концентрацию, которая вызывает смерть у 50% подопытных животных в рамках предварительных испытаний на токсичность.
Существует стандартизированный протокол тестирования на токсичность эмбрионов рыбок данио через 96 ч после оплодотворения (HPF), а именно тест на острую токсичность для эмбрионов рыб (FET) (TG236)7. В тесте FET только что оплодотворенные яйца подвергались воздействию пяти концентраций химического вещества в течение 96 ч и наблюдались признаки летальности, а именно: (i) свертываемость яйцеклеток, (ii) отсутствие образования сомитов, (iii) отсутствие отслоения зачатков хвоста от желточного мешка и (iv) отсутствие сердцебиения. Тест позволяет определить острую токсичность и LC50. Кроме того, в нем также содержатся рекомендации по размерам испытательных камер для использования для скрининга (24-луночные планшеты), распределения яиц в испытательной камере и условий содержания, среди прочего, что обеспечивает достоверные и воспроизводимые результаты.
Хотя тест FET подходит для тестирования на токсичность на эмбриональной стадии, он не превышает 4 dpf. Для фенотипов, которые начинают развиваться примерно в этот момент времени (например, минерализация хорды6), скрининг лекарственных препаратов должен продолжаться дольше 4 dpf, чтобы можно было провести морфологическую оценку такой ткани. Кроме того, мы рекомендуем начинать воздействие препарата по крайней мере за сутки до развития фенотипа, представляющего интерес. Насколько нам известно, не существует стандартизированного протокола, аналогичного FET, для скрининга лекарственных препаратов у личинок данио-рерио на ранних стадиях, в частности у рыбок данио в возрасте от 3 до 7 dpf. Несмотря на то, что было опубликовано несколько исследований, описывающих тестирование лекарственных препаратов на личинках рыбок данио рерио более 4 доз, существует недостаточная последовательность используемой методологии, включая размер испытательных камер, количество биологических и технических реплик, скорость изменения среды, продолжительность воздействия и оцениваемые морфологические дефекты 8,9,10,11,12,13 . По этой причине мы разработали валидированный протокол стандартизированных испытаний на токсичность с последующим визуальным наблюдением за морфологическими изменениями у личинок данио-рерио при дозе 3-7 dpf. Предложенный протокол впоследствии может быть использован для других последующих анализов фенотипирования, таких как поведенческий анализ, профилирование экспрессии генов и гистоморфометрия.
протокол
Рыбки данио обрабатывались в соответствии с Директивой ЕС 2010/63/ЕС. Все эксперименты были одобрены Комитетом по этике научных исследований факультета (FREC) и Объединенным секторальным подкомитетом FREC по исследованиям животных (JFARSS) Университета Мальты. Блок-схема предлагаемого протокола представлена на рисунке 1.
1. Производство, сбор и содержание яиц
- Посадите рыб в аквариумы для разведения накануне, по крайней мере, через час после последнего кормления, с разделителями, разделяющими самцов и самок. Для улучшения результатов яйценоскости используйте более высокое соотношение самок и самцов. Поместите рыб в помещение, оборудованное циклом свет/темнота 14 ч:10 ч и температурой окружающей среды 27-28 °C.
ПРИМЕЧАНИЕ: Аквариум для разведения объемом 1 л может вместить трех взрослых рыб, в то время как аквариум для разведения объемом 1,7 л может вместить пять взрослых рыб. - На следующее утро, после наступления света, замените воду в резервуарах для разведения и снимите разделители. В случае, если аквариум для разведения не имеет легкого наклона, поместите его в наклонное положение, чтобы обеспечить мелководье для содействия спариванию. В случае медленной яйценоскости и брачной активности заменяйте воду в семенных емкостях каждые 45 минут. Оставьте рыбу для спаривания на срок до 3 часов или по мере необходимости.
- Как только спаривание будет завершено, осторожно сожмите всех самок, которые не произвели икру, чтобы предотвратить долгосрочное связывание яиц. Поместите рыб обратно в соответствующие аквариумы.
- Соберите все яйца в емкости для разведения с помощью сетчатого ситечка, промойте водой для эмбрионов (E3) и поместите в чашку Петри с E3. Для приготовления Е3 смешайте 16,67 мл 60-кратного Е3 (300 мМ NaCl; 10 мМ KCl; 20 мМ CaCl2,2Н 2О; 20 мМ MgSO4,7Н 2О) с 1 мл 0,01% метиленового синего и 982 мл деионизированной воды. Удалите все неоплодотворенные яйца или мусор. Убедитесь, что чашки Петри не переполнены: 50 яиц на чашку Петри 100 мм x 15 мм и 120 яиц на чашку Петри 150 мм x 15 мм.
- Храните яйца в инкубаторе, установленном при температуре 28,5 °C и оснащенном циклом 14 ч:10 ч день/ночь. При 1 dpf обновите E3 и удалите нежизнеспособные яйца, чтобы ограничить рост грибков.
2. Подготовка тестовой пластины
- При 3 dpf перенесите по одному здоровому на вид вылупившемуся эмбриону в каждую лунку в 96-луночном планшете с помощью микропипетки объемом 1000 μл объемом 100 μл.
ПРИМЕЧАНИЕ: Не следует использовать невылупившиеся эмбрионы, так как это может привести к переменному поглощению соединений. Использование эмбрионов, которые выглядят здоровыми, также ограничивает систематическую ошибку во время тестирования. Размер наконечника пипетки позволяет легко собрать эмбрион данио-рерио, не причиняя никакого физического ущерба. Кроме того, микропипетка позволяет лучше контролировать объем, подаваемый в лунку, в отличие от трансферной пипетки. - В 12-луночном планшете приготовьте желаемую концентрацию (концентрации) для каждого испытуемого химического вещества в отдельных лунках (в данном случае босутиниб в диапазоне концентраций от 100 мкМ до 6,25 мкМ). В каждую лунку добавьте необходимый объем исследуемого химиката с помощью микропипеток и сделайте до 2,4 мл с помощью Е3.
ПРИМЕЧАНИЕ: Следует провести поиск литературы для определения адекватных концентраций для использования для соответствующих исследуемых химических веществ. Если информация отсутствует, можно опробовать несколько концентраций до тех пор, пока не будет определен подходящий диапазон концентраций. Следует использовать как минимум пять концентраций, при этом самая высокая концентрация вызывает 100% смертность, а самая низкая концентрация не вызывает наблюдаемогоэффекта. - Подготовьте систему управления автомобилем в зависимости от растворителя, используемого для растворения исходного тестового химиката.
ПРИМЕЧАНИЕ: Многие испытуемые соединения не растворяются в воде, и по этой причине их необходимо растворять в определенных растворителях («носителях»), таких как этанол или диметилсульфоксид (ДМСО), для получения водного раствора. Концентрация ДМСО предпочтительно не должна превышать 1% при использовании в качестве средства контроля транспортного средства, что является концентрацией, признанной безопасной у рыбокданио-рерио 14. - Удалите раствор Е3, присутствующий в 96-луночном планшете, с помощью микропипетки объемом 200 мкл и замените его 100 мкл соответствующей испытуемой среды. Обязательно протестируйте в общей сложности 24 личинки на одну концентрацию. Используйте одно- или 8-канальную микропипетку объемом 200 мкл для переноса исследуемых химических веществ в соответствующие лунки испытательной пластины. Включите элементы управления (например, E3, химический транспорт, положительный контроль и т. д.).
ПРИМЕЧАНИЕ: Планшет может вместить до четырех различных испытуемых химических веществ или четырех различных концентраций одного и того же химического вещества. Пример тестовых планшетов, предназначенных для исследования пяти концентраций одного и того же химического вещества (например, босутиниба) в сопровождении контрольной группы, показан на рисунке 1. - Через 24 ч после воздействия проводят морфологическую оценку (как описано в разделе 3) и полусреднюю замену, удаляя 50 мкл среды и заменяя ее свежеприготовленной средой. Удалите и запишите все мертвые личинки в процессе. Держите личинок в инкубаторе, настроенном на температуру 28,5 °C и оснащенном циклом день/ночь 14 ч:10 ч. Повторяйте процесс до 7 dpf.
3. Морфологическая оценка
- С помощью стереофонического микроскопа наблюдайте за отдельными испытуемыми личинками при соответствующем увеличении.
Примечание: Примеры морфологических дефектов, которые можно оценить, приведены в таблице 1. - Оценивайте морфологию у двух независимых судей, а в случае разногласий между двумя судьями консультируйтесь с третьим.
- Оцените морфологию с помощью бинарного метода (т.е. присутствует/отсутствует), где «отсутствует» указывает на нормальную морфологию (оценивается как «0»), а «присутствует» указывает на наличие морфологической аномалии (оценивается как «1»). На рисунке 2 приведены примеры рыбок данио рерио при дозе 5 dpf после 2 дней воздействия препарата, в том числе непораженных рыбок данио рерио (рисунок 2A), рыбок данио рерио с легким отеком перикарда (рисунок 2B), тяжелым отеком перикарда с кровоизлиянием в желток и расширением желтка (рисунок 2C), задержкой развития со сниженной пигментацией, плавательным пузырем и общей длиной (рисунок 2D), опухшим желтком и искривленным хвостовым плавником (рисунок 2E), отсутствие хвостового плавника (рисунок 2F), искривленная хорда (рисунок 2G), усечение (рисунок 2H) и смерть с некрозом (рисунок 2I). Оцените все аномальные фенотипы как «1», а непораженных рыбок данио — как «0».
4. Определение LC50
- После морфологической оценки построите график зависимости кумулятивного процента смертности при 7 dpf от концентрации. Пример показан на рисунке 3. Используйте кривую концентрации для оценки концентрации, вызывающей 50% смертности.
- После того, как концентрация LC50 оценена, повторите описанный выше эксперимент, подвергнув воздействию этой единственной расчетной концентрации LC50 на 24 реплики в 96-луночном планшете.
5. Технические репликации
- Повторите всю процедуру, используя выбранные пять концентраций одного и того же химического вещества, по крайней мере, еще два раза, чтобы убедиться в воспроизводимости результатов.
Результаты
Аномалии можно рассматривать по отдельности или кумулятивно в течение экспериментального периода времени до 7 dpf. Максимальный показатель морфологии для каждой аномалии может быть использован для расчета морфологических аномалий в процентах от количества использованных личинок. Например, если на 7-й день оценка морфологии отека перикарда составляет 19 и 20 для оценщиков 1 и 2 соответственно, из возможных 24, что означает, что у 19 или 20 личинок из 24 наблюдается отек перикарда, процентный балл можно рассчитать следующим образом:
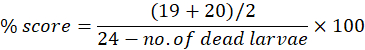
В дополнительной таблице S1 приведены результаты оценки морфологии (обоих оценщиков) при 4 dpf после тестирования на токсичность соединения босутиниба, ингибитора тирозинкиназы, показанного для лечения хронического миелоидного лейкоза15. Такая же морфологическая оценка повторяется для рыб в возрасте от 5 до 7 dpf. Соединение было протестировано с использованием диапазона концентраций от 100 μМ до 6,25 μМ. В разные моменты времени были проведены три технических повтора, и средний кумулятивный коэффициент смертности при 7 dpf был использован для определения LC50, концентрации, при которой выживают 50% личинок. LC50 можно определить в любой момент времени экспозиции. Однако мы рекомендуем рассчитать это значение при 7 dpf.
Кумулятивная средняя смертность при 7 dpf была использована для построения кривой LC50 , которую можно увидеть на рисунке 3. Для босутиниба концентрация LC50 была оценена в 37,95 мкМ.
ПРИМЕЧАНИЕ: Эта расчетная концентрация LC50 строго применима к данной модельной системе и затем может быть использована для дальнейших анализов фенотипирования.
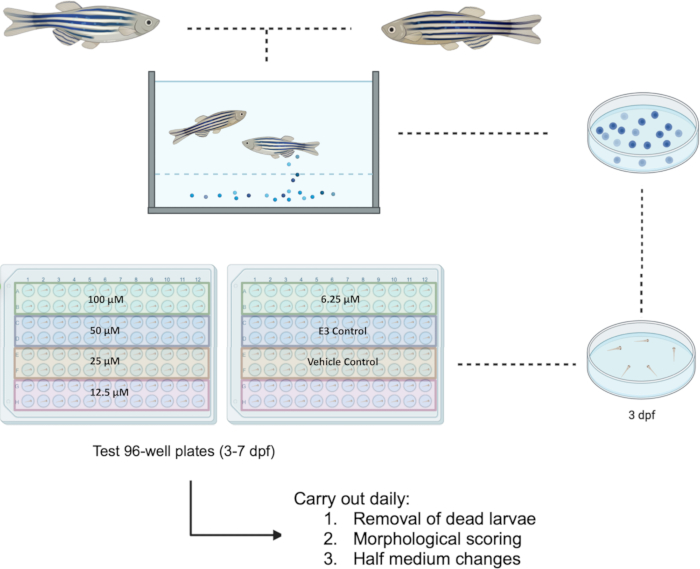
Рисунок 1: Схема предлагаемого скрининга лекарственных средств у личинок при дозе 3-7 dpf. 96-луночные испытательные планшеты предназначены для исследования пяти концентраций в диапазоне от 100 мкМ до 6,25 мкМ для соединения босутиниб. Сокращение: dpf = дни после оплодотворения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Репрезентативные морфологические дефекты, наблюдаемые у личинок данио-рерио при воздействии различных химических концентраций при 5 dpf (через 2 дня после воздействия). (A) Контрольная (непораженная) данио-рерио, (B) Личинка данио-рерио с легким отеком перикарда, (C) Данио рерио с сильным отеком перикарда и кровоизлиянием из желтка, (D) Данио рерио с задержкой развития, сниженной пигментацией, маленьким плавательным пузырем, (E) Данио-рерио с набухшим желтком и изогнутым хвостовым плавником, (F) Данио рерио с отсутствием хвостового плавника, (G) Данио рерио с изогнутой хордой, (H) Данио-рерио с усеченным хвостом, и (I) Мертвые рыбки данио-рерио с некрозом. Дефекты отмечены красными стрелками. Масштабные линейки = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
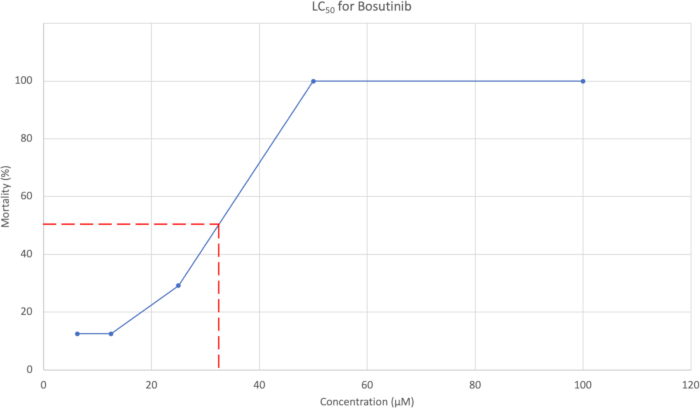
Рисунок 3: Кривая LC50, показывающая концентрацию в зависимости от % смертности. Пять протестированных концентраций были 100 μМ, 50 μМ, 25 μМ, 12,5 μМ и 6,25 μМ, при этом процент смертности составил 100%, 100%, 29,2%, 12,5% и 12,5% соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Морфологические дефекты | Описание |
| Отек перикарда | Скопление жидкости вокруг сердца с растянутым сердцем и нарушением кровообращения |
| Удары сердца (в минуту) | Уменьшено количество ударов в минуту |
| Желток | Наличие или отсутствие отека желтка или кровоизлияния, которые могут возникать одновременно с пороками сердца |
| Наращивание желтка | Желток, который набух, жидкий или отсутствует |
| Изогнутая хорда | Наличие изогнутой или волнистой хорды и/или изогнутого хвоста |
| Плавательный пузырь | Наличие, отсутствие или частичное развитие плавательного пузыря |
| Пигментация | Меньше меланоцитов или их отсутствие по сравнению с необработанными рыбами того же возраста |
| Некроз | Наличие (легкая или тяжелая) или отсутствие некроза в любой части тела |
| Задержка в разработке | Задержка в развитии или задержка по сравнению с контрольной группой дикого типа того же возраста. |
| Реакция на прикосновение | Задержка или отсутствие реакции после испуга (например, при использовании наконечника для пипетки) |
| Усечение | Отсутствие заднего тела данио-рерио (т.е. формирование хвоста) |
| Плавники | Наличие или отсутствие хвостового плавника, что может сопровождаться удлинением тонкого желтка |
| Уменьшенная ось кузова | Рыба, которая выглядит нормальной, но при измерении короче по длине |
Таблица 1: Список визуальных морфологических дефектов, которые могут наблюдаться после исследований воздействия лекарственных средств.
Дополнительная таблица S1: Репрезентативные морфологические результаты для босутиниба при дозе 4 dpf (через 1 день после воздействия). Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Рыбки данио стали важной моделью для скрининга наркотиков. При попытке определить методологию проведения испытаний на токсичность мы обнаружили несколько контрастных методов из разных лабораторий 8,9,10,11,12,13. В описанных методах используются личинки разного возраста, переменные экспериментальные сроки, разные скорости изменений среды и разные морфологические системы оценки. Путем проб и ошибок мы установили описанную методологию, которая обеспечила надежные и воспроизводимые результаты.
Выбор размера пластины
Первоначально эксперименты проводились в 24-луночной тарелке, чтобы убедиться, что личинкам достаточно места для движения и роста. Планшеты располагали по 10 личинок на лунку, две лунки на концентрацию и 1 мл раствора препарата на лунку. Такое расположение не дало воспроизводимых результатов, что привело к выводу о том, что личинки не поглощали равные количества лекарства из скважины. Затем были проведены испытания с использованием 96-луночных и 48-луночных планшетов с одной личинкой в лунке, которые показали, что личинки в 96-луночных планшетах не проявляли проблем с ростом. Следовательно, эксперименты были продолжены в 96-луночном планшете с меньшим использованием пространства и объемов препарата.
Ежедневная смена среды
Поскольку рыбки данио поглощают лекарственный препарат из среды, мы установили, что для поддержания постоянной концентрации препарата в среде требуется определенное изменение среды. Кроме того, изменение среды удаляет потенциальные отходы, накопленные в скважине, которые могут создать токсичную среду и привести к необъективным результатам. Было проведено испытание с босутинибом, в котором для одного и того же препарата были установлены три планшета: один без ежедневной смены среды, один с ежедневной половиной средней подмены и один с полной суточной сменой среды. В то время как планшеты без изменений среды показали повышенную смертность, планшеты с половинными и полными средними изменениями привели к тому же результату на 7 dpf. Таким образом, была выбрана ежедневная смена на половину средней. Такой выбор обеспечивает меньший расход дорогостоящего и ограниченного исследуемого материала, который может потребоваться для дальнейших экспериментов.
Продолжительность воздействия
Возраст используемых испытуемых личинок и продолжительность воздействия препарата, выбранные в этом протоколе, были обусловлены нашим фенотипом — минерализацией костей. Поскольку формирование кости начинается при ~4 dpf, мы решили начать с рыбок данио с 3 dpf, чтобы определить, влияют ли испытуемые химические вещества на начало развития костей. Впоследствии мы завершили исследования воздействия препарата при дозе 7 dpf, поскольку высокая степень смертности наблюдалась начиная с 8 dpf и далее, учитывая отсутствие кормления, которое могло повлиять на результаты. Тем не менее, временные рамки могут быть скорректированы в зависимости от характера исследования и фенотипа интереса.
Ограничения
Эта методология имеет некоторые ограничения. Перенос 3 рыбок данио-рерио dpf на многолуночные испытательные планшеты занимает много времени. Извлечение среды из лунок без подхватывания личинок столь же трудоемко. Среду необходимо медленно удалять из каждой лунки с помощью одноканальной пипетки, следя за тем, чтобы личинки не были повреждены в процессе. Более того, в то время как ежедневная смена половины среды пополняет исследуемый состав и обеспечивает удаление отработанного материала из скважины, это не гарантирует, что стабильная концентрация препарата может поддерживаться в скважине в течение 5 дней воздействия. В то время как высокоэффективный анализ жидкостной хроматографии может дать дополнительное представление о фактическом количестве препарата, поглощаемого каждой личинкой, этот тест больше не будет квалифицироваться как метод скрининга с высокой пропускной способностью.
В заключение следует отметить, что данная методология направлена на устранение пробела в тестировании на токсичность с использованием рыбок данио-рерио более 4 dpf, предпринимая шаги в направлении стандартизированного протокола, применимого к линиям дикого типа, мутантных и трансгенных линий данио-рерио, который находится на одном уровне с FET на эмбриональной стадии. Это открывает возможности для других последующих анализов фенотипирования, которые могут быть невозможны на более ранних стадиях.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы поддержаны проектами ZeEBRA (R&I-2019-018), фондом программы развития технологий (TDP), STRONG (R&I-2024-007L), фондом TDPLite, NASDAC (SINO-MALTA-2022-08), грантом научно-технического сотрудничества и DEMONSTRATE (R&I-2018-007A), грантом Go2Market, финансируемыми XjenzaMalta для и от имени Фонда науки и технологий. Рисунок 1 был создан с помощью BioRender.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Starlab | E1415-1510 | |
| 10 µL micropipette (P10) | Gilson | F144802 | |
| 10/20 µL pipette tips | Starlab | S1110-3810 | |
| 1000 µL micropipette (P1000) | Gilson | F123602 | |
| 1000 µL pipette tips | Starlab | S1111-6001 | |
| 12-well plate | Starlab | CC7672-7512 | Sterile, single-wrapped, non-treated, with lid |
| 20 µL micropipette (P20) | Gilson | F123600 | |
| 200 µL micropipette (P200) | Gilson | F123601 | |
| 200 µL multi-channel pipette | Gilson | F81024 | |
| 200 µL pipette tips | Starlab | S1113-1006 | |
| 96-well plate | Starlab | CC7672-7596 | Sterile, single-wrapped, flat-bottom, non-treated, with lid |
| Breeding tanks with inside grid sloping bottom, tank dividers and lids | Tecniplast | ZB17BTISLOP, ZB17BTE, ZB17BTL, ZB17BTD | Sloped inner tank |
| Mesh strainer | / | / | |
| Nitrile gloves | Mercator | / | / |
| Petri-dish | Starlab | CC7672-3394/CC7672-3359 | 100 x 20 mm or 60 x 15 mm |
| Leica M205 FCA Fluorescence stereo microscope | Leica | 10450826 | |
| Peltier-cooled incubator including 2 shelves with light module cold white | Memmert | IPP110ecoplus, T8 | Equipped with day/night cycle |
| Dimethyl Sulfoxide | Biochem Chemopharma | 504341000 | To prepare a 1% solution in E3 |
| Calcium chlorided dihydrate | Biochem Chemopharma | 303080500 | To prepare E3 |
| Magnesium sulfate heptahydrate | Biochem Chemopharma | 313060500 | To prepare E3 |
| Potassium Chloride | Biochem Chemopharma | 316030500 | To prepare E3 |
| SCREEN-WELL Wnt Pathway library (Bosutinib) | Enzo | BML-2838-0500 | |
| Sodium Chloride | Fisher Scientific | S/3161/53 | To prepare E3 |
Ссылки
- Teame, T., et al. The use of zebrafish (Danio rerio) as biomedical models. Anim Front. 9 (3), 68-77 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: From preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- Clift, D., Richendrfer, H., Thorn, R. J., Colwill, R. M., Creton, R. High-throughput analysis of behavior in zebrafish larvae: Effects of feeding. Zebrafish. 11 (5), 455-461 (2014).
- Keenan, S. R., Currie, P. D. The developmental phases of zebrafish myogenesis. J Dev Biol. 7 (2), 12 (2019).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders. Front Endocrinol (Lausanne). 11, 489 (2020).
- OECD. . Test no. 236: Fish embryo acute toxicity (FET). , (2013).
- Chen, J. R., Lai, Y. H., Tsai, J. J., Hsiao, C. D. Live fluorescent staining platform for drug-screening and mechanism-analysis in zebrafish for bone mineralization. Molecules. 22 (12), 2068 (2017).
- He, H., Wang, C., Tang, Q., Yang, F., Xu, Y. Possible mechanisms of prednisolone-induced osteoporosis in zebrafish larva. Biomed Pharmacother. 101, 981-987 (2018).
- Huang, H. X., et al. Application of bone transgenic zebrafish in anti-osteoporosis chemical screening. Animal Model Exp Med. 1 (1), 53-61 (2018).
- Haney, M. G., Moore, L. H., Blackburn, J. S. Drug screening of primary patient derived tumor xenografts in zebrafish. J Vis Exp. (158), e60996 (2020).
- Nishimura, Y., et al. Using zebrafish in systems toxicology for developmental toxicity testing. Congenit Anom (Kyoto). 56 (1), 18-27 (2016).
- Hayot, G., et al. Evaluating toxicity of chemicals using a zebrafish vibration startle response screening system. J Vis Exp. (203), e66153 (2024).
- Hoyberghs, J., et al. DMSO concentrations up to 1% are safe to be used in the zebrafish embryo developmental toxicity assay. Front Toxicol. 3, 804033 (2021).
- Lipton, J. H., Brümmendorf, T. H., Sweet, K., Apperley, J. F., Cortes, J. E. Practical considerations in the management of patients treated with bosutinib for chronic myeloid leukemia. Ann Hematol. 103 (9), 3429-3442 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены