Method Article
Dépistage de petites molécules et essais de toxicité chez les larves de poisson-zèbre à un stade précoce
Dans cet article
Résumé
Ce protocole décrit une procédure de dépistage de médicaments chez les larves de poisson-zèbre 3 à 7 jours après la fécondation, suivie d’une évaluation morphologique.
Résumé
Le poisson-zèbre est devenu un organisme modèle de premier plan pour la recherche translationnelle humaine, les tests de toxicité de petites molécules et de polluants environnementaux, la découverte de médicaments thérapeutiques et d’autres applications de recherche biomédicale. Le protocole présenté vise à fournir un guide clair pour le dépistage de médicaments et les tests de toxicité chez les larves de poisson-zèbre à un stade précoce (âgées de 3 à 7 jours après la fécondation). Plusieurs méthodologies décrivant les tests de toxicité chez les larves de poisson-zèbre ont été publiées, bien qu’il n’existe pas de protocole standardisé pour les durées d’exposition, le taux de changements de milieu et l’évaluation de la morphologie, entre autres. Nous avons déterminé expérimentalement l’âge idéal des larves pour mener les expériences, les tailles de plaque qui conviennent le mieux à ces âges, le taux de changements de milieu qui fournissent des résultats fiables tout en limitant le gaspillage du composé d’essai, et un système de notation morphologique facilement quantifiable de manière statistique. Le manuscrit décrit en détail un protocole pour les tests de toxicité chez les larves de poisson-zèbre âgées de 3 à 7 dpf, visant à cibler les lacunes dans les tests de toxicité des médicaments et à faire le premier pas vers une méthode standardisée similaire au test de toxicité aiguë de l’embryon de poisson.
Introduction
Le poisson-zèbre (Danio rerio) est récemment apparu comme un puissant organisme modèle de vertébré, devenant de plus en plus populaire pour les études visant à faire progresser la recherche biomédicale1. Environ 70 % des gènes codant pour des protéines humaines ont au moins un orthologue de poisson-zèbre, avec ~82 % des gènes causant des maladies humaines ayant au moins un gène orthologue chez le poisson-zèbre2. La conservation génétique, associée à un modèle et à une morphologie similaires des organes de base, fait du poisson-zèbre un modèle intéressant pour la recherche sur les maladies humaines, permettant des comparaisons inter-espèces au niveau moléculaire 1,2,3, ce qui est crucial pour le développement de médicaments.
Le poisson-zèbre se développe rapidement, le bourgeon caudal se formant 10 h après la fécondation (hpf) et les premiers somites apparaissant à 16 hpf. Les embryons émergent du chorion à ~2-3 jours après la fécondation (dpf). À 4 dpf, leur tube digestif est complètement développé et à 5 dpf, leur vessie natatoire s’est gonflée, ce qui leur permet de nager librement et de chasser pour se nourrir. Malgré la capacité de se nourrir avec 5 dpf, les larves qui ne sont pas nourries peuvent survivre uniquement avec des nutriments dérivés du jaune jusqu’à au moins 7 dpf, contournant ainsi la nécessité d’une alimentation externe qui peut provoquer une contamination et interférer avec le dépistage de drogues, la toxicologie et les tests comportementaux4. À 7 dpf, les larves développent également un plan corporel complet avec plusieurs systèmes d’organes rudimentaires, y compris le cœur et le système vasculaire, les muscles et les os 5,6. Les embryons de poisson-zèbre sont également fécondés ex vivo, se développant à l’extérieur, et sont optiquement transparents dans les premiers stades de la vie, ce qui les rend très accessibles pour l’édition de gènes et le criblage de petites molécules3. De plus, leur petite taille et leur taux de fécondité élevé permettent d’inclure plus de répétitions, ce qui augmente la puissance statistique, ainsi que l’utilisation de plaques multipuits, ce qui permet d’économiser des volumes de médicaments et d’augmenter le débit.
Le criblage de nouvelles petites molécules dans un modèle animal est important pour déterminer la capacité des médicaments à produire des effets bénéfiques ou indésirables, identifiant ainsi les composés viables pour des tests plus approfondis et d’autres qui pourraient nécessiter une modification pour modifier leur activité. Dans le cadre du processus de dépistage de drogues, la concentration létale de 50 (CL50) du ou des composés cibles doit être identifiée. Cela permet d’obtenir une concentration de travail qui cause la mort chez 50 % des animaux d’essai dans le cadre des essais de toxicité préliminaires.
Il existe un protocole normalisé pour les essais de toxicité sur les embryons de poisson-zèbre jusqu’à 96 h après la fécondation (hpf), à savoir l’essai de toxicité aiguë sur les embryons de poisson (FET) (TG236)7. Dans l’essai FET, les œufs nouvellement fécondés sont exposés à cinq concentrations d’un produit chimique pendant une période allant jusqu’à 96 h et on observe des signes de létalité, à savoir (i) la coagulation de l’œuf, (ii) l’absence de formation de somite, (iii) l’absence de détachement du bourgeon caudal du sac vitellin et (iv) l’absence de battement cardiaque. L’essai permet de déterminer la toxicité aiguë et la CL50. En outre, il conseille également sur les tailles de chambre d’essai à utiliser pour le criblage (plaques à 24 puits), la distribution des œufs dans la chambre d’essai et les conditions de logement, entre autres, afin de garantir des résultats valides et reproductibles7.
Bien que l’essai FET soit adapté aux essais de toxicité au stade embryonnaire, il ne dépasse pas 4 dpf. Pour les phénotypes qui commencent à se développer à peu près à ce moment-là (par exemple, la minéralisation de la notocorde6), le dépistage des médicaments doit aller au-delà de 4 dpf pour permettre l’évaluation morphologique de ce tissu. De plus, nous recommandons que l’exposition au médicament commence au moins un jour avant le développement du phénotype d’intérêt. À notre connaissance, il n’existe pas de protocole standardisé similaire au FET pour le criblage de médicaments chez les larves de poisson-zèbre à un stade précoce, en particulier chez le poisson zèbre âgé de 3 à 7 dpf. Bien que plusieurs études aient été publiées décrivant des tests de dépistage de drogues chez des larves de poisson-zèbre au-delà de 4 dpf, il y a un manque d’uniformité dans la méthodologie utilisée, y compris la taille des chambres d’essai, le nombre de répétitions biologiques et techniques, le taux de changements de milieux, les durées d’exposition et les défauts morphologiques évalués 8,9,10,11,12,13 . Pour cette raison, nous avons développé un protocole validé pour des tests de toxicité standardisés suivis d’une observation visuelle des changements morphologiques chez les larves de poisson-zèbre à 3-7 dpf. Le protocole proposé peut par la suite être utilisé pour d’autres tests de phénotypage en aval, tels que l’analyse comportementale, le profilage de l’expression génique et l’histomorphométrie.
Protocole
Les poissons-zèbres ont été manipulés conformément à la directive européenne 2010/63/UE. Toutes les expériences ont été approuvées par le Comité d’éthique de la recherche de la Faculté (FREC) et le Sous-comité sectoriel de la recherche animale (JFARSS) de l’Université de Malte. Un organigramme du protocole proposé se trouve à la figure 1.
1. Production, collecte et conservation des œufs
- Installez les poissons dans des bassins de reproduction la veille, au moins une heure après le dernier repas, avec des séparateurs en place séparant les mâles et les femelles. Pour de meilleurs résultats de production d’œufs, utilisez un rapport plus élevé entre les femelles et les mâles. Installez le poisson dans une pièce équipée d’un cycle lumière/obscurité de 14 h : 10 h et à une température ambiante de 27-28 °C.
REMARQUE : Un bassin d’élevage de 1 L peut contenir trois poissons adultes, tandis qu’un bassin d’élevage de 1,7 L peut contenir cinq poissons adultes. - Le lendemain matin, après le début de la lumière, remplacez l’eau dans les bassins d’élevage et retirez les séparateurs. Si le bassin d’élevage n’est pas facilement incliné, placez-le en position inclinée pour vous assurer que de l’eau peu profonde est disponible pour favoriser l’accouplement. En cas de production d’œufs et d’accouplement ralentis, remplacez l’eau des bassins d’élevage toutes les 45 min. Laissez le poisson s’accoupler jusqu’à 3 h ou au besoin.
- Une fois l’accouplement terminé, pressez doucement les femelles qui n’ont pas produit d’œufs pour éviter la fixation à long terme. Remettez les poissons dans leurs aquariums respectifs.
- Collectez tous les œufs dans les bassins d’élevage à l’aide d’une passoire à mailles, rincez-les à l’eau de l’embryon (E3) et placez-les dans une boîte de Pétri avec E3. Pour préparer l’E3, mélanger 16,67 mL de 60x E3 (300 mM de NaCl ; 10 mM de KCl ; 20 mM de CaCl2,2H 2O ; 20 mM de MgSO 4,7H2O) avec 1 mL de bleu de méthylène à 0,01 % et 982 mL d’eau désionisée. Retirez tous les œufs non fécondés ou les débris. Assurez-vous que les boîtes de Pétri ne sont pas surpeuplées, avec 50 œufs par boîte de Pétri de 100 mm x 15 mm et 120 œufs par boîte de Pétri de 150 mm x 15 mm.
- Conservez les œufs dans un incubateur réglé à 28,5 °C et équipé d’un cycle jour/nuit de 14 h : 10 h. À 1 dpf, rafraîchir l’E3 et retirer les œufs non viables pour limiter la croissance fongique.
2. Préparation de la plaque d’essai
- À 3 dpf, transférez un embryon éclos d’apparence saine dans chaque puits dans une plaque de 96 puits à l’aide d’une micropipette de 1 000 μL réglée sur un volume de 100 μL.
REMARQUE : Il ne faut pas utiliser d’embryons non éclos, car cela pourrait entraîner une absorption variable du composé. L’utilisation d’embryons qui semblent sains limite également les biais lors des tests. La taille de la pointe de la pipette permet de collecter facilement l’embryon de poisson-zèbre sans causer de dommages physiques. De plus, une micropipette permet un meilleur contrôle du volume distribué dans le puits par rapport à une pipette de transfert. - Dans une plaque à 12 puits, préparer la ou les concentrations souhaitées pour chaque produit chimique d’essai dans des puits séparés (ici, le bosutinib, à une concentration allant de 100 μM à 6,25 μM). Dans chaque puits, ajouter le volume nécessaire de produit chimique d’essai à l’aide de micropipettes et porter à 2,4 mL à l’aide de E3.
NOTA : Il faut effectuer une recherche documentaire afin de déterminer les concentrations adéquates à utiliser pour les produits chimiques d’essai pertinents. Si aucune information n’est disponible, plusieurs concentrations peuvent être testées jusqu’à ce qu’une plage de concentration appropriée soit déterminée. Un minimum de cinq concentrations doit être utilisé, la concentration la plus élevée causant une mortalité de 100 % et la concentration la plus faible ne causant aucun effet observable7. - Préparez un contrôle du véhicule en fonction du solvant utilisé pour dissoudre la substance chimique d’essai.
REMARQUE : De nombreux composés d’essai ne sont pas solubles dans l’eau et, pour cette raison, ils doivent être dissous dans des solvants spécifiques (« véhicules ») tels que l’éthanol ou le diméthylsulfoxyde (DMSO) pour générer une solution aqueuse. Il est préférable que le DMSO ne dépasse pas une concentration de 1 % lorsqu’il est utilisé comme témoin de véhicule, ce qui est la concentration jugée sans danger chez le poisson-zèbre14. - Prélever toute solution E3 présente dans la plaque à 96 puits à l’aide d’une micropipette de 200 μL et la remplacer par 100 μL du milieu correspondant testé. Assurez-vous de tester un total de 24 larves par concentration. À l’aide d’une micropipette simple ou à 8 canaux de 200 μL, les produits chimiques d’essai sont transférés dans les puits correspondants de la plaque d’essai. Inclure des contrôles (p. ex., E3, véhicule chimique, contrôles positifs, etc.).
REMARQUE : La configuration de la plaque peut accueillir jusqu’à quatre produits chimiques d’essai différents ou quatre concentrations différentes du même produit chimique. La figure 1 montre un exemple de plaques d’essai installées pour l’étude de cinq concentrations du même produit chimique (p. ex., bosutinib) accompagnées de témoins. - 24 h après l’exposition, effectuer un marquage morphologique (tel que décrit à la section 3) et un demi-changement de milieu, en retirant 50 μL de milieu et en le remplaçant par un milieu fraîchement préparé. Retirez et enregistrez toutes les larves mortes dans le processus. Conservez les larves dans un incubateur réglé à 28,5 °C et équipé d’un cycle jour/nuit de 14 h : 10 h. Répétez le processus jusqu’à 7 dpf.
3. Évaluation morphologique
- À l’aide d’un microscope stéréoscopique, observez les larves d’essai à un grossissement approprié.
REMARQUE : Le tableau 1 donne des exemples de défauts morphologiques qui peuvent être évalués. - Faire évaluer la morphologie par deux correcteurs indépendants, un troisième étant consulté en cas de désaccord entre les deux correcteurs.
- Notez la morphologie à l’aide d’une méthode binaire (c’est-à-dire présent/absent), où « absent » indique une morphologie normale (noté « 0 ») et « présent » indique la présence d’une anomalie morphologique (noté « 1 »). La figure 2 montre des exemples de poissons-zèbres à 5 dpf après 2 jours d’exposition au médicament, y compris un poisson-zèbre non affecté (figure 2A), un poisson-zèbre avec un léger œdème péricardique (figure 2B), un œdème péricardique sévère avec hémorragie vitelline et extension du vitellus (figure 2C), un développement retardé avec une pigmentation réduite, une vessie natatoire et une longueur totale (figure 2D), un jaune d’œuf gonflé et une nageoire caudale pliée (figure 2E), nageoire caudale absente (figure 2F), notochorde incurvée (figure 2G), troncature (figure 2H) et mort avec nécrose (figure 2I). Évaluez tous les phénotypes anormaux à « 1 » et le poisson-zèbre non affecté à « 0 ».
4. Détermination de la CL50
- Après l’évaluation morphologique, tracer le pourcentage cumulé de mortalité à 7 dpf en fonction de la concentration. La figure 3 en montre un exemple. Utilisez la courbe de concentration pour estimer la concentration qui cause 50 % de mortalité.
- Une fois la concentration de CL50 estimée, répéter l’expérience décrite ci-dessus en exposant 24 larves répétées dans une plaque de 96 puits à cette seule concentration estimée de CL50 .
5. Répliques techniques
- Répétez toute la procédure en utilisant les cinq concentrations sélectionnées du même produit chimique au moins deux fois à deux reprises pour vous assurer que les résultats sont reproductibles.
Résultats
Les anomalies peuvent être examinées individuellement ou cumulativement sur la chronologie expérimentale jusqu’à 7 dpf. Le score morphologique maximal par anomalie peut être utilisé pour calculer les anomalies morphologiques en pourcentage du nombre de larves utilisées. Par exemple, si au jour 7, les scores morphologiques de l’œdème péricardique sont de 19 et 20 pour les marqueurs 1 et 2, respectivement, sur un score possible de 24, c’est-à-dire que 19 ou 20 larves sur 24 présentent un œdème péricardique, le score en pourcentage peut être calculé comme suit :
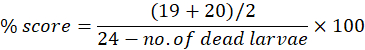
Le tableau supplémentaire S1 montre les résultats du score morphologique (des deux scoreurs) à 4 dpf après des essais de toxicité pour le composé Bosutinib, un inhibiteur de la tyrosine kinase indiqué pour le traitement de la leucémie myéloïde chronique15. Le même score morphologique est répété pour les poissons exposés âgés de 5 dpf à 7 dpf. Le composé a été testé en utilisant une plage de concentration de 100 μM à 6,25 μM. Trois répétitions techniques ont été effectuées à différents moments, et le taux de mortalité cumulatif moyen à 7 dpf a été utilisé pour déterminer la CL50, la concentration à laquelle 50 % des larves survivent. La CL50 peut être déterminée à n’importe quel point de temps d’exposition. Cependant, nous recommandons de le calculer à 7 dpf.
La mortalité moyenne cumulée à 7 dpf a été utilisée pour générer une courbe CL50 , que l’on peut voir à la figure 3. Pour le bosutinib, la concentration de CL50 a été estimée à 37,95 μM.
REMARQUE : Cette concentration estimée de CL50 s’applique strictement à ce système modèle et peut ensuite être utilisée pour d’autres tests de phénotypage en aval.
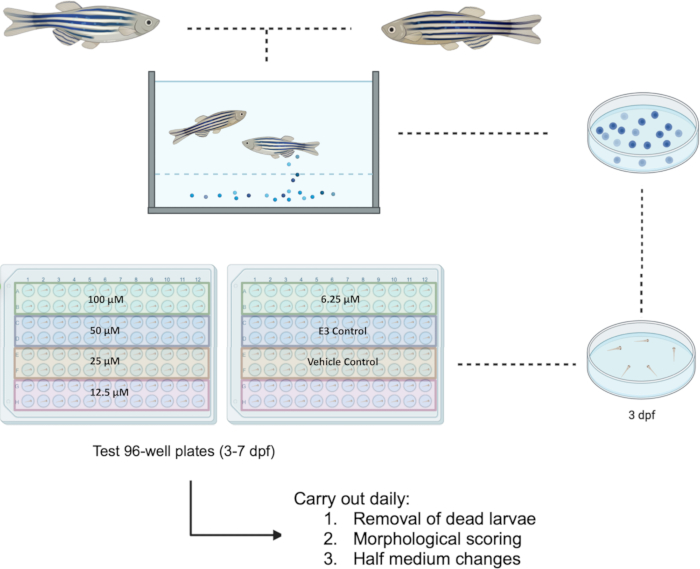
Figure 1 : Schéma du dépistage de drogues proposé chez les larves à 3-7 dpf. Les plaques d’essai à 96 puits sont configurées pour l’étude de cinq concentrations allant de 100 μM à 6,25 μM pour le composé Bosutinib. Abréviation : dpf = jours après la fécondation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Défauts morphologiques représentatifs observés chez les larves de poisson-zèbre à 5 dpf exposées à diverses concentrations chimiques (2 jours après l’exposition). (A) Poisson-zèbre témoin (non affecté), (B) Larve de poisson-zèbre présentant un léger œdème péricardique, (C) Poisson-zèbre présentant un œdème péricardique sévère et une hémorragie vitelline, (D) Poisson-zèbre présentant un retard de développement, une pigmentation réduite, une petite vessie natatoire, (E) Poisson zèbre avec un jaune gonflé et une nageoire caudale pliée, (F) Poisson zèbre sans nageoire caudale, (G) Poisson zèbre avec notocorde incurvée, (H) Poisson zèbre avec queue tronquée, et (I) Poisson zèbre mort avec nécrose. Les défauts sont signalés par des pointes de flèches rouges. Barres d’échelle = 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
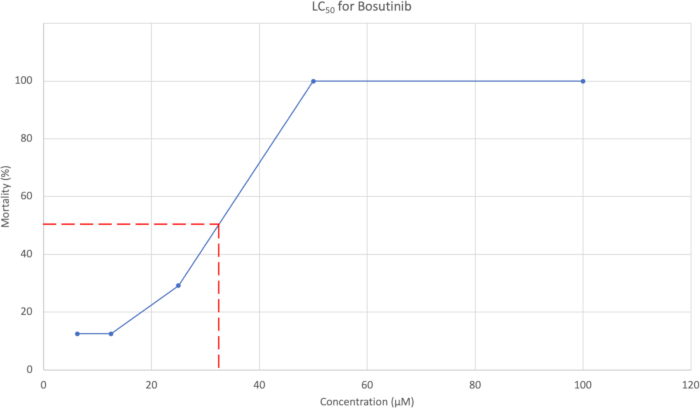
Figure 3 : Courbe LC50 montrant la concentration en fonction du % de mortalité. Les cinq concentrations testées étaient de 100 μM, 50 μM, 25 μM, 12,5 μM et 6,25 μM, le % de mortalité étant respectivement de 100 %, 100 %, 29,2 %, 12,5 % et 12,5 %. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Défauts morphologiques | Description |
| Œdème péricardique | Accumulation de liquide autour du cœur avec un cœur étiré et un dysfonctionnement de la circulation sanguine |
| Battements cardiaques (par minute) | Réduction du nombre de battements par minute |
| Jaune | Présence ou absence d’œdème ou d’hémorragie du vitellus pouvant survenir en même temps que des anomalies cardiaques |
| Extension du jaune d’œuf | Jaune gonflé, mince ou absent |
| Notocorde incurvée | Présence d’une notocorde pliée ou ondulée, et/ou d’une queue incurvée |
| Vessie natatoire | Présence, absence ou développement partiel de la vessie natatoire |
| Pigmentation | Moins ou pas de mélanocytes par rapport aux poissons non traités du même âge |
| Nécrose | Présence (légère ou grave) ou absence de nécrose dans n’importe quelle partie du corps |
| Développement retardé | Développement retardé ou bloqué par rapport aux témoins de type sauvage du même âge. |
| Réponse au toucher | Réponse retardée ou inexistante à la suite d’un sursaut (p. ex., utilisation d’une pointe de pipette) |
| Troncature | Absence de corps postérieur du poisson-zèbre (c’est-à-dire formation de la queue) |
| Ailettes | Présence ou absence de la nageoire caudale qui peut être accompagnée d’une mince extension vitellline |
| Axe du corps réduit | Les poissons qui semblent normaux, mais qui, lorsqu’ils sont mesurés, sont plus courts |
Tableau 1 : Une liste des défauts morphologiques visuels qui peuvent être observés à la suite d’études d’exposition aux médicaments.
Tableau supplémentaire S1 : Résultats morphologiques représentatifs pour le bosutinib à 4 dpf (1 jour après l’exposition). Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Les poissons-zèbres sont devenus un modèle important pour le dépistage de drogues. En essayant de déterminer une méthodologie pour effectuer des tests de toxicité, nous avons trouvé plusieurs méthodes contrastées provenant de différents laboratoires 8,9,10,11,12,13. Les méthodes décrites utilisent des larves à différents âges, à des chronologies expérimentales variables, à des taux différents de changements de milieu et à des systèmes de notation morphologique différents. Par essais et erreurs, nous avons établi la méthodologie décrite, qui a fourni des résultats fiables et reproductibles.
Choisir une taille de plaque
Initialement, les expériences ont été effectuées dans une plaque à 24 puits pour s’assurer que les larves avaient suffisamment d’espace pour se déplacer et grandir. Les plaques ont été disposées avec 10 larves par puits, deux puits par concentration et 1 mL de solution médicamenteuse par puits. Cet arrangement n’a pas donné de résultats reproductibles, ce qui a conduit à la conclusion que les larves n’absorbaient pas des quantités égales de médicament du puits. Les essais ont ensuite été effectués à l’aide d’une plaque de 96 puits et de 48 puits avec une larve par puits, ce qui a montré que les larves dans des plaques de 96 puits ne présentaient aucun problème de croissance. Par conséquent, les expériences ont été poursuivies dans une plaque de 96 puits en utilisant moins d’espace et de volumes de médicament.
Changement moyen quotidien
Étant donné que les poissons-zèbres absorbent le médicament du milieu, nous avons déterminé qu’un certain degré de changement de milieu est nécessaire pour maintenir une concentration constante du médicament dans le milieu. De plus, un changement de milieu élimine les déchets potentiels accumulés dans le puits, ce qui peut créer un environnement toxique et conduire à des résultats biaisés. Un essai a été réalisé avec le Bosutinib, où trois plaques ont été installées pour le même médicament, l’une sans changement moyen quotidien, l’autre avec un changement moyen quotidien demi-moyen et l’autre avec un changement moyen quotidien complet. Alors que les plaques sans changement de milieu présentaient des taux de mortalité accrus, les plaques avec des demi-changements et des changements de milieu complet ont donné le même résultat de 7 dpf. Ainsi, un changement quotidien de moitié moyen a été choisi. Ce choix garantit une consommation moindre du matériel d’essai coûteux et limité, qui pourrait être nécessaire pour d’autres expériences en aval.
Durée d’exposition
L’âge des larves d’essai utilisées et la durée d’exposition au médicament sélectionnées dans ce protocole ont été déterminés par notre phénotype d’intérêt étant la minéralisation osseuse. Étant donné que la formation osseuse commence à ~4 dpf, nous avons choisi de commencer avec le poisson-zèbre à 3 dpf pour déterminer si les produits chimiques d’essai affectaient le début du développement osseux. Par la suite, nous avons terminé les études d’exposition aux médicaments à 7 dpf car un degré élevé de mortalité a été observé à partir de 8 dpf compte tenu du manque d’alimentation qui pourrait biaiser les résultats. Néanmoins, les délais peuvent être ajustés en fonction de la nature de l’étude et du phénotype d’intérêt.
Limitations
Cette méthodologie présente certaines limites. Le transfert de 3 dpf de poisson-zèbre sur des plaques d’essai multi-puits prend du temps. Retirer le milieu des puits sans ramasser les larves est tout aussi laborieux. Le milieu doit être retiré lentement de chaque puits à l’aide d’une pipette monocanal, afin de s’assurer que les larves ne sont pas endommagées au cours du processus. De plus, bien qu’un changement quotidien de la moitié de la moyenne permette de reconstituer le composé d’essai et d’assurer l’élimination des déchets du puits, il ne garantit pas qu’une concentration stable de médicament puisse être maintenue dans le puits tout au long des 5 jours d’exposition. Bien que l’analyse par chromatographie liquide à haute performance puisse donner un aperçu supplémentaire de la quantité réelle de médicament absorbée par chaque larve, le test ne serait plus considéré comme une méthode de dépistage à haut débit.
En conclusion, cette méthodologie vise à combler les lacunes dans les essais de toxicité utilisant le poisson-zèbre au-delà de 4 dpf, en prenant des mesures vers un protocole standardisé applicable aux lignées de poissons-zèbres de type sauvage, mutant et transgénique, et qui soit à égalité avec le FET au stade embryonnaire. Cela ouvre la voie à d’autres tests de phénotypage en aval qui pourraient ne pas être possibles à des stades plus précoces.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs sont soutenus par les projets ZeEBRA (R&I-2019-018), un fonds du Programme de développement technologique (TDP), STRONG (R&I-2024-007L), un fonds TDPLite, NASDAC (SINO-MALTA-2022-08), une subvention de coopération scientifique et technologique, et DEMONSTRATE (R&I-2018-007A), une subvention Go2Market, tous financés par XjenzaMalta pour et au nom de la Fondation pour la science et la technologie. La figure 1 a été créée à l’aide de BioRender.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Starlab | E1415-1510 | |
| 10 µL micropipette (P10) | Gilson | F144802 | |
| 10/20 µL pipette tips | Starlab | S1110-3810 | |
| 1000 µL micropipette (P1000) | Gilson | F123602 | |
| 1000 µL pipette tips | Starlab | S1111-6001 | |
| 12-well plate | Starlab | CC7672-7512 | Sterile, single-wrapped, non-treated, with lid |
| 20 µL micropipette (P20) | Gilson | F123600 | |
| 200 µL micropipette (P200) | Gilson | F123601 | |
| 200 µL multi-channel pipette | Gilson | F81024 | |
| 200 µL pipette tips | Starlab | S1113-1006 | |
| 96-well plate | Starlab | CC7672-7596 | Sterile, single-wrapped, flat-bottom, non-treated, with lid |
| Breeding tanks with inside grid sloping bottom, tank dividers and lids | Tecniplast | ZB17BTISLOP, ZB17BTE, ZB17BTL, ZB17BTD | Sloped inner tank |
| Mesh strainer | / | / | |
| Nitrile gloves | Mercator | / | / |
| Petri-dish | Starlab | CC7672-3394/CC7672-3359 | 100 x 20 mm or 60 x 15 mm |
| Leica M205 FCA Fluorescence stereo microscope | Leica | 10450826 | |
| Peltier-cooled incubator including 2 shelves with light module cold white | Memmert | IPP110ecoplus, T8 | Equipped with day/night cycle |
| Dimethyl Sulfoxide | Biochem Chemopharma | 504341000 | To prepare a 1% solution in E3 |
| Calcium chlorided dihydrate | Biochem Chemopharma | 303080500 | To prepare E3 |
| Magnesium sulfate heptahydrate | Biochem Chemopharma | 313060500 | To prepare E3 |
| Potassium Chloride | Biochem Chemopharma | 316030500 | To prepare E3 |
| SCREEN-WELL Wnt Pathway library (Bosutinib) | Enzo | BML-2838-0500 | |
| Sodium Chloride | Fisher Scientific | S/3161/53 | To prepare E3 |
Références
- Teame, T., et al. The use of zebrafish (Danio rerio) as biomedical models. Anim Front. 9 (3), 68-77 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: From preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- Clift, D., Richendrfer, H., Thorn, R. J., Colwill, R. M., Creton, R. High-throughput analysis of behavior in zebrafish larvae: Effects of feeding. Zebrafish. 11 (5), 455-461 (2014).
- Keenan, S. R., Currie, P. D. The developmental phases of zebrafish myogenesis. J Dev Biol. 7 (2), 12 (2019).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders. Front Endocrinol (Lausanne). 11, 489 (2020).
- OECD. . Test no. 236: Fish embryo acute toxicity (FET). , (2013).
- Chen, J. R., Lai, Y. H., Tsai, J. J., Hsiao, C. D. Live fluorescent staining platform for drug-screening and mechanism-analysis in zebrafish for bone mineralization. Molecules. 22 (12), 2068 (2017).
- He, H., Wang, C., Tang, Q., Yang, F., Xu, Y. Possible mechanisms of prednisolone-induced osteoporosis in zebrafish larva. Biomed Pharmacother. 101, 981-987 (2018).
- Huang, H. X., et al. Application of bone transgenic zebrafish in anti-osteoporosis chemical screening. Animal Model Exp Med. 1 (1), 53-61 (2018).
- Haney, M. G., Moore, L. H., Blackburn, J. S. Drug screening of primary patient derived tumor xenografts in zebrafish. J Vis Exp. (158), e60996 (2020).
- Nishimura, Y., et al. Using zebrafish in systems toxicology for developmental toxicity testing. Congenit Anom (Kyoto). 56 (1), 18-27 (2016).
- Hayot, G., et al. Evaluating toxicity of chemicals using a zebrafish vibration startle response screening system. J Vis Exp. (203), e66153 (2024).
- Hoyberghs, J., et al. DMSO concentrations up to 1% are safe to be used in the zebrafish embryo developmental toxicity assay. Front Toxicol. 3, 804033 (2021).
- Lipton, J. H., Brümmendorf, T. H., Sweet, K., Apperley, J. F., Cortes, J. E. Practical considerations in the management of patients treated with bosutinib for chronic myeloid leukemia. Ann Hematol. 103 (9), 3429-3442 (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon