Method Article
Triagem de pequenas moléculas e testes de toxicidade em larvas de peixe-zebra em estágio inicial
Neste Artigo
Resumo
Este protocolo descreve um procedimento de triagem de drogas em larvas de peixe-zebra 3-7 dias após a fertilização, seguido de avaliação morfológica.
Resumo
O peixe-zebra tornou-se um organismo modelo proeminente para pesquisa translacional humana, testes de toxicidade de pequenas moléculas e poluentes ambientais, descoberta de medicamentos terapêuticos e outras aplicações de pesquisa biomédica. O protocolo apresentado visa fornecer um guia claro para triagem de drogas e testes de toxicidade em larvas de peixe-zebra em estágio inicial (com idade de 3 a 7 dias após a fertilização, dpf). Várias metodologias que descrevem testes de toxicidade em larvas de peixe-zebra foram publicadas, embora sem um protocolo padronizado para durações de exposição, taxa de mudanças de mídia e pontuação morfológica, entre outros. Determinamos experimentalmente as idades ideais das larvas para a realização dos experimentos, os tamanhos das placas que funcionam melhor para essas idades, a taxa de mudanças de mídia que fornecem resultados confiáveis, limitando o desperdício do composto de teste e um sistema de pontuação morfológica que é facilmente quantificável de maneira estatística. O manuscrito descreve em detalhes um protocolo para testes de toxicidade em larvas de peixe-zebra com idade entre 3 a 7 dpf, com o objetivo de direcionar a lacuna nos testes de toxicidade de drogas e dar o primeiro passo em direção a um método padronizado semelhante ao teste de toxicidade aguda de embriões de peixes.
Introdução
O peixe-zebra (Danio rerio) emergiu recentemente como um poderoso organismo modelo de vertebrado, tornando-se cada vez mais popular para estudos para avançar na pesquisa biomédica1. Cerca de 70% dos genes codificadores de proteínas humanas têm pelo menos um ortólogo de peixe-zebra, com ~ 82% dos genes causadores de doenças humanas tendo pelo menos um gene ortólogo no peixe-zebra2. A conservação genética, juntamente com padrões e morfologia de órgãos básicos semelhantes, tornam o peixe-zebra um modelo interessante para a pesquisa de doenças humanas, permitindo comparações entre espécies no nível molecular 1,2,3, o que é crucial para o desenvolvimento de medicamentos.
O peixe-zebra se desenvolve rapidamente com o botão da cauda se formando em 10 h após a fertilização (hpf) e os primeiros somitos aparecendo em 16 hpf. Os embriões emergem do córion em ~ 2-3 dias após a fertilização (dpf). Em 4 dpf, seu trato digestivo está totalmente desenvolvido e em 5 dpf, sua bexiga natatória inflou, permitindo que eles nadem livremente e procurem comida. Apesar da capacidade de se alimentar em 5 dpf, as larvas não alimentadas podem sobreviver apenas com nutrientes derivados da gema até pelo menos 7 dpf, contornando a necessidade de alimentação externa que pode causar contaminação e interferir na triagem de drogas, toxicologia e testes comportamentais4. Por volta de 7 dpf, as larvas também desenvolvem um plano corporal completo com vários sistemas de órgãos rudimentares, incluindo o coração e a vasculatura, o músculo e o osso 5,6. Os embriões de peixe-zebra também são fertilizados ex vivo, desenvolvendo-se externamente, e são opticamente transparentes nos estágios iniciais da vida, tornando-os altamente acessíveis para edição de genes e triagem de pequenas moléculas3. Além disso, seu pequeno tamanho e alta taxa de fecundidade permitem a inclusão de mais repetições, o que aumenta o poder estatístico, bem como o uso de placas de múltiplos poços, o que economiza no volume de medicamentos e aumenta o rendimento.
A triagem de novas moléculas pequenas em um modelo animal é importante para determinar a capacidade dos medicamentos de produzir efeitos benéficos ou adversos, identificando assim quais compostos são viáveis para testes adicionais e outros que podem exigir modificação para alterar sua atividade. Como parte do processo de triagem de drogas, a concentração letal 50 (CL50) do(s) composto(s) alvo precisa ser identificada. Isso fornece uma concentração de trabalho que causa a morte em 50% dos animais de teste como parte do teste preliminar de toxicidade.
Existe um protocolo padronizado para testes de toxicidade em embriões de peixe-zebra até 96 h após a fertilização (hpf), ou seja, o teste de Toxicidade Aguda de Embriões de Peixes (FET) (TG236)7. No teste FET, os ovos recém-fertilizados são expostos a cinco concentrações de um produto químico por até 96 h e observados quanto a sinais de letalidade, a saber: (i) coagulação do ovo, (ii) falta de formação de somito, (iii) falta de descolamento do botão da cauda do saco vitelino e (iv) falta de batimentos cardíacos. O ensaio permite a determinação da toxicidade aguda e da CL50. Além disso, também aconselha sobre os tamanhos das câmaras de teste a serem usadas para triagem (placas de 24 poços), distribuição de ovos na câmara de teste e condições de alojamento, entre outros, garantindo resultados válidos e reprodutíveis7.
Embora o teste FET seja adequado para testes de toxicidade na fase embrionária, ele não vai além de 4 dpf. Para fenótipos que começam a se desenvolver por volta desse ponto de tempo (por exemplo, mineralização da notocorda6), a triagem de drogas deve prosseguir além de 4 dpf para permitir a avaliação morfológica desse tecido. Além disso, recomendamos que a exposição ao medicamento comece pelo menos um dia antes do desenvolvimento do fenótipo de interesse. Até onde sabemos, não existe um protocolo padronizado semelhante ao FET para triagem de drogas em larvas de peixe-zebra em estágio inicial, especificamente em peixes-zebra com idade entre 3 e 7 dpf. Embora vários estudos tenham sido publicados descrevendo testes de drogas em larvas de peixe-zebra além de 4 dpf, há uma falta de consistência na metodologia utilizada, incluindo o tamanho das câmaras de teste, número de réplicas biológicas e técnicas, taxa de mudanças de meio, duração da exposição e defeitos morfológicos avaliados 8,9,10,11,12,13 . Por esse motivo, desenvolvemos um protocolo validado para testes de toxicidade padronizados seguidos de observação visual de alterações morfológicas em larvas de peixe-zebra a 3-7 dpf. O protocolo proposto pode ser posteriormente utilizado para outros ensaios de fenotipagem a jusante, como análise comportamental, perfil de expressão gênica e histomorfometria.
Protocolo
O peixe-zebra foi tratado de acordo com a Diretiva da UE 2010/63/UE. Todos os experimentos foram aprovados pelo Comitê de Ética em Pesquisa do Corpo Docente (FREC) e pelo Subcomitê Setorial Conjunto de Pesquisa Animal do FREC (JFARSS) da Universidade de Malta. Um fluxograma do protocolo proposto pode ser encontrado na Figura 1.
1. Produção, coleta e manutenção de ovos
- Coloque os peixes em tanques de reprodução no dia anterior, pelo menos uma hora após a última alimentação, com divisórias separando os machos e as fêmeas. Para melhores resultados de produção de ovos, use uma proporção maior de fêmeas para machos. Coloque o peixe em uma sala equipada com um ciclo claro/escuro de 14 h:10 h e à temperatura ambiente de 27-28 °C.
NOTA: Um tanque de reprodução de 1 L pode conter três peixes adultos, enquanto um tanque de reprodução de 1,7 L pode conter cinco peixes adultos. - Na manhã seguinte, após o início da luz, recoloque a água nos tanques de reprodução e remova as divisórias. Caso o tanque de reprodução não seja facilmente inclinado, coloque-o em uma posição inclinada para garantir que haja água rasa disponível para promover o acasalamento. Em caso de produção lenta de ovos e atividade de acasalamento, substitua a água nos tanques de reprodução a cada 45 min. Deixe o peixe acasalar por até 3 h ou conforme necessário.
- Quando o acasalamento estiver completo, aperte suavemente todas as fêmeas que não produziram ovos para evitar a ligação dos ovos a longo prazo. Coloque os peixes de volta em seus respectivos tanques.
- Colete todos os ovos nos tanques de reprodução usando uma peneira de malha, enxágue com água do embrião (E3) e coloque em uma placa de Petri com E3. Para preparar E3, misture 16,67 mL de 60x E3 (300 mM NaCl; 10 mM KCl; 20 mM CaCl2,2H 2O; 20 mM MgSO4,7H 2O) com 1 mL de azul de metileno 0,01% e 982 mL de água deionizada. Remova todos os ovos ou detritos não fertilizados. Certifique-se de que as placas de Petri não estejam lotadas, com 50 ovos por placa de Petri de 100 mm x 15 mm e 120 ovos por placa de Petri de 150 mm x 15 mm.
- Manter os ovos numa estufa regulada para 28,5 °C e equipada com um ciclo dia/noite de 14 h:10 h. A 1 dpf, atualize o E3 e remova os ovos não viáveis para limitar o crescimento de fungos.
2. Preparação da placa de teste
- A 3 dpf, transfira um embrião eclodido de aparência saudável para cada poço em uma placa de 96 poços usando uma micropipeta de 1.000 μL ajustada para um volume de 100 μL.
NOTA: Embriões não eclodidos não devem ser usados, pois isso pode resultar em absorção variável de compostos. O uso de embriões que parecem saudáveis também limita o viés durante os testes. O tamanho da ponta da pipeta permite uma fácil coleta do embrião de peixe-zebra sem causar nenhum dano físico. Além disso, uma micropipeta permite um melhor controle do volume que está sendo dispensado no poço, em oposição a uma pipeta de transferência. - Numa placa de 12 alvéolos, preparar a(s) concentração(ões) desejada(s) para cada produto químico em estudo em alvéolos separados (neste caso, o Bosutinib numa gama de concentrações compreendida entre 100 μM e 6,25 μM). Em cada alvéolo, adicionar o volume necessário do produto químico em estudo com micropipetas e perfazer o volume de 2,4 ml com E3.
NOTA: Deve ser efectuada uma pesquisa bibliográfica para determinar as concentrações adequadas a utilizar para os produtos químicos em estudo pertinentes. Se não existirem informações disponíveis, podem ser testadas várias concentrações até que seja determinada uma gama de concentrações adequada. Deve ser utilizado um mínimo de cinco concentrações, sendo que a concentração mais elevada provoca 100% de mortalidade e a concentração mais baixa não causa qualquer efeito observável7. - Preparar um comando do veículo em função do solvente utilizado para dissolver o produto químico em estudo.
NOTA: Muitos compostos de teste não são solúveis em água e, por esse motivo, precisam ser dissolvidos em solventes específicos ("veículos"), como etanol ou dimetilsulfóxido (DMSO) para gerar uma solução aquosa. O DMSO não deve, de preferência, exceder uma concentração de 1% quando usado como controle de veículo, que é a concentração considerada segura no peixe-zebra14. - Remova qualquer solução E3 presente na placa de 96 poços usando uma micropipeta de 200 μL e substitua-a por 100 μL do meio correspondente que está sendo testado. Certifique-se de testar um total de 24 larvas por concentração. Utilizar uma micropipeta de 200 μl de um ou 8 canais para transferir os produtos químicos em estudo para os poços das placas de ensaio correspondentes. Inclua controles (por exemplo, E3, veículo químico, controles positivos, etc.).
NOTA: A configuração da placa acomoda até quatro produtos químicos de teste diferentes ou quatro concentrações diferentes do mesmo produto químico. Um exemplo das placas de teste montadas para a investigação de cinco concentrações do mesmo produto químico (por exemplo, Bosutinibe) acompanhadas de controles é mostrado na Figura 1. - Às 24 h após a exposição, efectue a pontuação morfológica (conforme descrito na secção 3) e uma mudança de meio meio, removendo 50 μL de meio e substituindo-o por meio recém-preparado. Remova e registre todas as larvas mortas no processo. Manter as larvas numa incubadora regulada para 28,5 °C e equipada com um ciclo dia/noite de 14 h:10 h. Repita o processo até 7 dpf.
3. Avaliação morfológica
- Usando um microscópio óptico estéreo, observe as larvas de teste individuais com uma ampliação apropriada.
NOTA: Exemplos de defeitos morfológicos que podem ser avaliados são fornecidos na Tabela 1. - Ter a morfologia avaliada por dois avaliadores independentes, sendo consultado um terceiro em caso de discordância entre os dois pontuadores.
- Pontue a morfologia usando um método binário (ou seja, presente/ausente), onde 'ausente' indica morfologia normal (pontuado como '0') e 'presente' indica a presença de anormalidade morfológica (pontuado como '1'). A Figura 2 mostra exemplos de peixe-zebra a 5 dpf após 2 dias de exposição ao medicamento, incluindo um peixe-zebra não afetado (Figura 2A), um peixe-zebra com edema pericárdico leve (Figura 2B), edema pericárdico grave com hemorragia da gema e extensão da gema (Figura 2C), desenvolvimento retardado com pigmentação reduzida, bexiga natatória e comprimento total (Figura 2D), gema inchada e barbatana caudal dobrada (Figura 2E), nadadeira caudal ausente (Figura 2F), notocorda curva (Figura 2G), truncamento (Figura 2H) e óbito com necrose (Figura 2I). Pontue todos os fenótipos anormais como '1' e o peixe-zebra não afetado como '0'.
4. Determinação do LC50
- Após a avaliação da morfologia, traçar a percentagem cumulativa de mortalidade a 7 dpf em relação à concentração. Um exemplo é mostrado na Figura 3. Use a curva de concentração para estimar a concentração que causa 50% de mortalidade.
- Uma vez estimada a concentração de CL50 , repita o experimento descrito acima, expondo 24 larvas replicadas em uma placa de 96 poços a essa única concentração estimada de LC50 .
5. Réplicas técnicas
- Repita todo o procedimento usando as cinco concentrações selecionadas do mesmo produto químico pelo menos mais duas vezes em duas ocasiões separadas para garantir que os resultados sejam reprodutíveis.
Resultados
As anormalidades podem ser analisadas individualmente ou cumulativamente ao longo do cronograma experimental até 7 dpf. A pontuação morfológica máxima por anormalidade pode ser usada para calcular anormalidades morfológicas como uma porcentagem do número de larvas usadas. Por exemplo, se no dia 7 os escores da morfologia do edema pericárdico estiverem em 19 e 20 para os pontuadores 1 e 2, respectivamente, de uma pontuação possível de 24, o que significa que 19 ou 20 larvas de 24 apresentam edema pericárdico, a pontuação percentual pode ser calculada como:
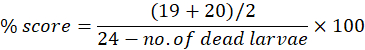
A Tabela Suplementar S1 mostra os resultados da pontuação morfológica (de ambos os pontuadores) a 4 dpf após o teste de toxicidade para o composto Bosutinibe, um inibidor da tirosina quinase indicado para o tratamento da leucemia mieloide crônica15. A mesma pontuação morfológica é repetida para peixes expostos com idade de 5 dpf a 7 dpf. O composto foi testado usando uma faixa de concentração de 100 μM a 6,25 μM. Três repetições técnicas foram conduzidas em diferentes momentos, e a taxa média de mortalidade cumulativa a 7 dpf foi usada para determinar a CL50, a concentração na qual 50% das larvas sobrevivem. O LC50 pode ser determinado em qualquer ponto de exposição. No entanto, recomendamos calcular isso em 7 dpf.
A mortalidade média acumulada em 7 dpf foi usada para gerar uma curva de CL50 , que pode ser vista na Figura 3. Para o Bosutinibe, a concentração de LC50 foi estimada em 37,95 μM.
NOTA: Esta concentração estimada de LC50 aplica-se estritamente a este sistema modelo e pode então ser usada para outros ensaios de fenotipagem a jusante.
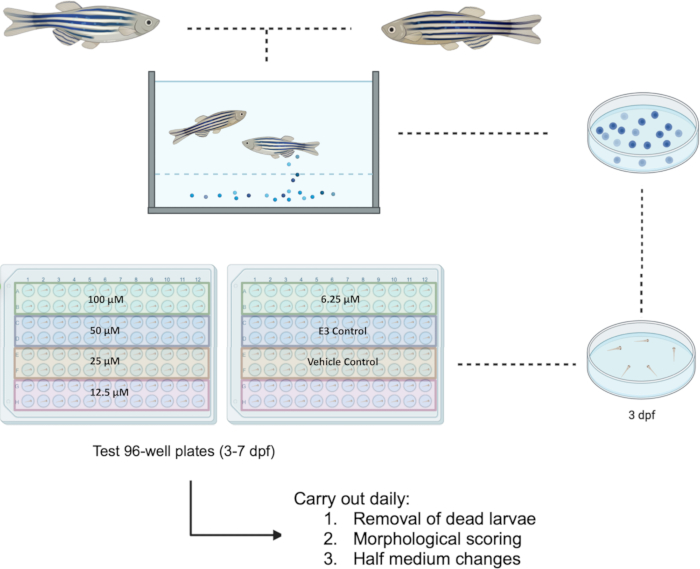
Figura 1: Esquema da triagem de drogas proposta em larvas a 3-7 dpf. As placas de teste de 96 poços são configuradas para a investigação de cinco concentrações que variam de 100 μM a 6,25 μM para o composto Bosutinibe. Abreviatura: dpf = dias após a fertilização. Clique aqui para ver uma versão maior desta figura.

Figura 2: Defeitos morfológicos representativos observados em larvas de peixe-zebra a 5 dpf expostas a várias concentrações químicas (2 dias após a exposição). (A) Peixe-zebra controle (não afetado), (B) Larva de peixe-zebra com edema pericárdico leve, (C) Peixe-zebra com edema pericárdico grave e hemorragia na gema, (D) Peixe-zebra com atraso no desenvolvimento, pigmentação reduzida, bexiga natatória pequena, (E) Peixe-zebra com gema inchada e barbatana caudal dobrada, (F) Peixe-zebra com ausência de barbatana caudal, (G) Peixe-zebra com notocorda curva, (H) Peixe-zebra com cauda truncada, e (I) Peixe-zebra morto com necrose. Os defeitos são observados com pontas de setas vermelhas. Barras de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
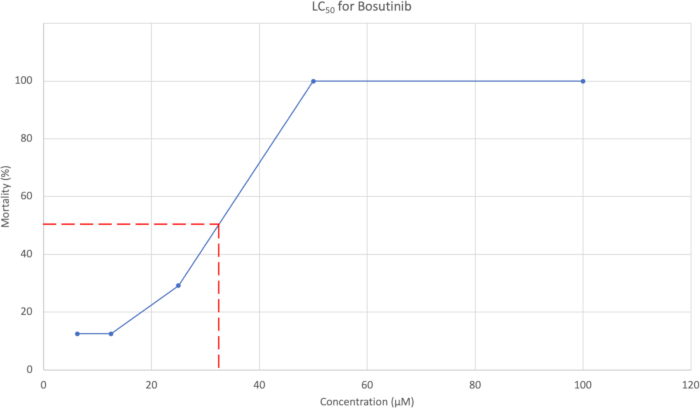
Figura 3: Curva CL50 mostrando concentração em relação à % de mortalidade. As cinco concentrações testadas foram 100 μM, 50 μM, 25 μM, 12,5 μM e 6,25 μM, com % de mortalidade de 100%, 100%, 29,2%, 12,5% e 12,5%, respectivamente. Clique aqui para ver uma versão maior desta figura.
| Defeitos morfológicos | Descrição |
| Edema pericárdico | Acúmulo de líquido ao redor do coração com um coração esticado e mau funcionamento da circulação sanguínea |
| Batimentos cardíacos (por minuto) | Número reduzido de batimentos por minuto |
| Gema | Presença ou ausência de edema vitelino ou hemorragia que pode ocorrer simultaneamente com defeitos cardíacos |
| Extensão da gema | Gema inchada, fina ou ausente |
| Notacorda curva | Presença de notocorda dobrada ou ondulada e/ou cauda curva |
| Bexiga natatória | Presença, ausência ou desenvolvimento parcial da bexiga natatória |
| Pigmentação | Menos ou nenhum melanócito em comparação com os peixes não tratados da mesma idade |
| Necrose | Presença (leve ou grave) ou ausência de necrose em qualquer parte do corpo |
| Desenvolvimento atrasado | Desenvolvimento atrasado ou estagnado em comparação com controles do tipo selvagem da mesma idade. |
| Resposta ao toque | Resposta atrasada ou nenhuma resposta após um sobressalto (por exemplo, usando uma ponta de pipeta) |
| Truncamento | Ausência do corpo posterior do peixe-zebra (ou seja, formação da cauda) |
| Barbatanas | Presença ou ausência da nadadeira caudal que pode ser acompanhada por extensão fina da gema |
| Eixo do corpo reduzido | Peixes que parecem normais, mas quando medidos são mais curtos em comprimento |
Tabela 1: Uma lista de defeitos morfológicos visuais que podem ser observados após estudos de exposição a medicamentos.
Tabela Suplementar S1: Resultados morfológicos representativos para Bosutinib a 4 dpf (1 dia após a exposição). Clique aqui para baixar esta tabela.
Discussão
O peixe-zebra tornou-se um modelo importante para o rastreio de drogas. Ao tentar determinar uma metodologia para realizar testes de toxicidade, encontramos vários métodos contrastantes de diferentes laboratórios 8,9,10,11,12,13. Os métodos descritos usam larvas em diferentes idades, cronogramas experimentais variáveis, diferentes taxas de mudanças de meio e diferentes sistemas de pontuação morfológica. Por tentativa e erro, estabelecemos a metodologia descrita, que forneceu resultados confiáveis e reprodutíveis.
Escolhendo um tamanho de prato
Inicialmente, os experimentos foram realizados em uma placa de 24 poços para garantir que as larvas tivessem espaço suficiente para se mover e crescer. As placas foram dispostas com 10 larvas por poço, dois poços por concentração e 1 mL de solução medicamentosa por poço. Esse arranjo não forneceu resultados reprodutíveis, levando à inferência de que as larvas não estavam absorvendo quantidades iguais de droga do poço. Os testes foram então realizados usando uma placa de 96 e 48 poços com uma larva por poço, o que mostrou que as larvas em placas de 96 poços não apresentavam problemas de crescimento. Assim, os experimentos foram continuados em uma placa de 96 poços, utilizando menos espaço e volumes de drogas.
Variação média diária
Como o peixe-zebra está absorvendo a droga do meio, verificamos que é necessário um grau de mudança do meio para manter uma concentração consistente da droga no meio. Além disso, uma mudança de meio remove o potencial desperdício acumulado no poço, o que pode fornecer um ambiente tóxico e levar a resultados tendenciosos. Foi realizado um ensaio com Bosutinibe, onde foram instaladas três placas para o mesmo medicamento, uma sem troca diária de meio-dia, uma com meia troca diária e outra com troca diária completa de meio-dia. Enquanto a placa sem alteração do meio apresentou aumento das taxas de mortalidade, as placas com metade e meia alteração completa resultaram no mesmo desfecho em 7 dpf. Assim, optou-se por uma troca diária de meio meio-médio. Essa escolha garante menos consumo do material de teste caro e limitado, que pode ser necessário para outros experimentos a jusante.
Duração da exposição
A idade das larvas de teste usadas e a duração da exposição ao medicamento selecionadas neste protocolo foram impulsionadas pelo nosso fenótipo de interesse ser a mineralização óssea. Como a formação óssea começa em ~ 4 dpf, optamos por começar com o peixe-zebra a 3 dpf para determinar se os produtos químicos de teste afetaram o início do desenvolvimento ósseo. Posteriormente, encerramos os estudos de exposição a medicamentos em 7 dpf, uma vez que foi observado um alto grau de mortalidade a partir de 8 dpf, tendo em vista a falta de alimentação que poderia enviesar os resultados. No entanto, os prazos podem ser ajustados dependendo da natureza do estudo e do fenótipo de interesse.
Limitações
Essa metodologia tem algumas limitações. A transferência de peixe-zebra de 3 dpf para placas de teste de vários poços é demorada. Remover o meio dos poços sem pegar as larvas é igualmente trabalhoso. O meio precisa ser removido de cada poço lentamente usando uma pipeta de canal único, garantindo que as larvas não sejam danificadas no processo. Além disso, embora uma troca diária de meio meio reabastece o composto de teste e garanta a remoção de resíduos do poço, ela não garante que uma concentração estável do medicamento possa ser mantida no poço durante os 5 dias de exposição. Embora a análise de cromatografia líquida de alta eficiência possa fornecer mais informações sobre a quantidade real de droga absorvida por cada larva, o teste não se qualificaria mais como um método de triagem de alto rendimento.
Em conclusão, esta metodologia visa abordar a lacuna nos testes de toxicidade usando peixe-zebra além de 4 dpf, dando passos em direção a um protocolo padronizado aplicável a linhagens de peixe-zebra selvagem, mutante e transgênico, e que esteja no mesmo nível do FET no estágio embrionário. Isso abre caminhos para outros ensaios de fenotipagem a jusante que podem não ser possíveis em estágios anteriores.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Os autores são apoiados pelos projetos ZeEBRA (R&I-2019-018), um fundo do Programa de Desenvolvimento Tecnológico (TDP), STRONG (R&I-2024-007L), um fundo TDPLite, NASDAC (SINO-MALTA-2022-08), uma bolsa de Cooperação em Ciência e Tecnologia, e DEMONSTRATE (R&I-2018-007A), uma bolsa Go2Market, todos financiados pela XjenzaMalta para e em nome da Fundação para a Ciência e Tecnologia. A Figura 1 foi criada usando BioRender.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Starlab | E1415-1510 | |
| 10 µL micropipette (P10) | Gilson | F144802 | |
| 10/20 µL pipette tips | Starlab | S1110-3810 | |
| 1000 µL micropipette (P1000) | Gilson | F123602 | |
| 1000 µL pipette tips | Starlab | S1111-6001 | |
| 12-well plate | Starlab | CC7672-7512 | Sterile, single-wrapped, non-treated, with lid |
| 20 µL micropipette (P20) | Gilson | F123600 | |
| 200 µL micropipette (P200) | Gilson | F123601 | |
| 200 µL multi-channel pipette | Gilson | F81024 | |
| 200 µL pipette tips | Starlab | S1113-1006 | |
| 96-well plate | Starlab | CC7672-7596 | Sterile, single-wrapped, flat-bottom, non-treated, with lid |
| Breeding tanks with inside grid sloping bottom, tank dividers and lids | Tecniplast | ZB17BTISLOP, ZB17BTE, ZB17BTL, ZB17BTD | Sloped inner tank |
| Mesh strainer | / | / | |
| Nitrile gloves | Mercator | / | / |
| Petri-dish | Starlab | CC7672-3394/CC7672-3359 | 100 x 20 mm or 60 x 15 mm |
| Leica M205 FCA Fluorescence stereo microscope | Leica | 10450826 | |
| Peltier-cooled incubator including 2 shelves with light module cold white | Memmert | IPP110ecoplus, T8 | Equipped with day/night cycle |
| Dimethyl Sulfoxide | Biochem Chemopharma | 504341000 | To prepare a 1% solution in E3 |
| Calcium chlorided dihydrate | Biochem Chemopharma | 303080500 | To prepare E3 |
| Magnesium sulfate heptahydrate | Biochem Chemopharma | 313060500 | To prepare E3 |
| Potassium Chloride | Biochem Chemopharma | 316030500 | To prepare E3 |
| SCREEN-WELL Wnt Pathway library (Bosutinib) | Enzo | BML-2838-0500 | |
| Sodium Chloride | Fisher Scientific | S/3161/53 | To prepare E3 |
Referências
- Teame, T., et al. The use of zebrafish (Danio rerio) as biomedical models. Anim Front. 9 (3), 68-77 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: From preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- Clift, D., Richendrfer, H., Thorn, R. J., Colwill, R. M., Creton, R. High-throughput analysis of behavior in zebrafish larvae: Effects of feeding. Zebrafish. 11 (5), 455-461 (2014).
- Keenan, S. R., Currie, P. D. The developmental phases of zebrafish myogenesis. J Dev Biol. 7 (2), 12 (2019).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders. Front Endocrinol (Lausanne). 11, 489 (2020).
- OECD. . Test no. 236: Fish embryo acute toxicity (FET). , (2013).
- Chen, J. R., Lai, Y. H., Tsai, J. J., Hsiao, C. D. Live fluorescent staining platform for drug-screening and mechanism-analysis in zebrafish for bone mineralization. Molecules. 22 (12), 2068 (2017).
- He, H., Wang, C., Tang, Q., Yang, F., Xu, Y. Possible mechanisms of prednisolone-induced osteoporosis in zebrafish larva. Biomed Pharmacother. 101, 981-987 (2018).
- Huang, H. X., et al. Application of bone transgenic zebrafish in anti-osteoporosis chemical screening. Animal Model Exp Med. 1 (1), 53-61 (2018).
- Haney, M. G., Moore, L. H., Blackburn, J. S. Drug screening of primary patient derived tumor xenografts in zebrafish. J Vis Exp. (158), e60996 (2020).
- Nishimura, Y., et al. Using zebrafish in systems toxicology for developmental toxicity testing. Congenit Anom (Kyoto). 56 (1), 18-27 (2016).
- Hayot, G., et al. Evaluating toxicity of chemicals using a zebrafish vibration startle response screening system. J Vis Exp. (203), e66153 (2024).
- Hoyberghs, J., et al. DMSO concentrations up to 1% are safe to be used in the zebrafish embryo developmental toxicity assay. Front Toxicol. 3, 804033 (2021).
- Lipton, J. H., Brümmendorf, T. H., Sweet, K., Apperley, J. F., Cortes, J. E. Practical considerations in the management of patients treated with bosutinib for chronic myeloid leukemia. Ann Hematol. 103 (9), 3429-3442 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados