Method Article
Screening di piccole molecole e test di tossicità nelle larve di zebrafish in fase iniziale
In questo articolo
Riepilogo
Questo protocollo descrive una procedura di screening farmacologico nelle larve di zebrafish 3-7 giorni dopo la fecondazione, seguita da una valutazione morfologica.
Abstract
Il pesce zebra è diventato un importante organismo modello per la ricerca traslazionale umana, i test di tossicità di piccole molecole e inquinanti ambientali, la scoperta di farmaci terapeutici e altre applicazioni di ricerca biomedica. Il protocollo presentato mira a fornire una guida chiara per lo screening farmacologico e i test di tossicità nelle larve di zebrafish in fase iniziale (di età compresa tra 3 e 7 giorni dopo la fecondazione, dpf). Sono state pubblicate diverse metodologie che descrivono i test di tossicità nelle larve di zebrafish, anche se mancano di un protocollo standardizzato per la durata dell'esposizione, il tasso di cambiamenti dei mezzi e il punteggio morfologico, tra gli altri. Abbiamo determinato sperimentalmente l'età ideale delle larve per condurre gli esperimenti, le dimensioni delle piastre che funzionano meglio per quelle età, il tasso di cambiamenti dei terreni che forniscono risultati affidabili limitando lo spreco del composto in esame e un sistema di punteggio morfologico facilmente quantificabile in modo statistico. Il manoscritto descrive in dettaglio un protocollo per i test di tossicità in larve di zebrafish di età compresa tra 3 e 7 dpf, con l'obiettivo di colmare le lacune nei test di tossicità dei farmaci e di fare il primo passo verso un metodo standardizzato simile al test di tossicità acuta dell'embrione di pesce.
Introduzione
Il pesce zebra (Danio rerio) è recentemente emerso come un potente organismo modello di vertebrati, diventando sempre più popolare per gli studi volti a far progredire la ricerca biomedica1. Circa il 70% dei geni codificanti proteine umane ha almeno un ortologo di zebrafish, con ~82% dei geni che causano malattie umane che hanno almeno un gene ortologo in zebrafish2. La conservazione genetica, unita a un simile modello di base degli organi e alla morfologia, rende il pesce zebra un modello interessante per la ricerca sulle malattie umane, consentendo confronti tra specie a livello molecolare 1,2,3, che è fondamentale per lo sviluppo di farmaci.
Il pesce zebra si sviluppa rapidamente con il germoglio caudale che si forma a 10 ore dopo la fecondazione (hpf) e i primi somiti che compaiono a 16 hpf. Gli embrioni emergono dal corion a ~2-3 giorni dopo la fecondazione (dpf). Entro 4 dpf, il loro tratto digestivo è completamente sviluppato e entro 5 dpf, la loro vescica natatoria si è gonfiata, permettendo loro di nuotare liberamente e cacciare cibo. Nonostante la capacità di nutrirsi con 5 dpf, le larve che non vengono nutrite possono sopravvivere esclusivamente con nutrienti derivati dal tuorlo fino ad almeno 7 dpf, eludendo la necessità di alimentazione esterna che può causare contaminazione e interferire con lo screening farmacologico, la tossicologia e i test comportamentali4. Entro 7 dpf, le larve sviluppano anche un piano corporeo completo con diversi sistemi di organi rudimentali, tra cui il cuore e il sistema vascolare, i muscoli e le ossa 5,6. Gli embrioni di zebrafish sono anche fecondati ex vivo, si sviluppano esternamente e sono otticamente trasparenti nelle prime fasi di vita, il che li rende altamente accessibili per l'editing genetico e lo screening di piccole molecole3. Inoltre, le loro dimensioni ridotte e l'elevato tasso di fecondità consentono l'inclusione di più repliche, che aumentano la potenza statistica, nonché l'uso di piastre multipozzetto, che consente di risparmiare sui volumi di farmaci e aumenta la produttività.
Lo screening di nuove piccole molecole in un modello animale è importante per determinare la capacità dei farmaci di produrre effetti sia benefici che avversi, identificando così quali composti sono vitali per ulteriori test e altri che potrebbero richiedere modifiche per alterare la loro attività. Nell'ambito del processo di screening farmacologico, è necessario identificare la concentrazione letale 50 (LC50) del/i composto/i target. Ciò fornisce una concentrazione di lavoro che causa la morte nel 50% degli animali da laboratorio come parte dei test preliminari di tossicità.
Esiste un protocollo standardizzato per i test di tossicità negli embrioni di zebrafish fino a 96 ore dopo la fecondazione (hpf), ovvero il test di tossicità acuta (FET) per embrioni di pesce (TG236)7. Nel test FET, gli ovuli appena fecondati sono esposti a cinque concentrazioni di una sostanza chimica per un massimo di 96 ore e osservati per segni di letalità, vale a dire (i) coagulazione dell'uovo, (ii) mancanza di formazione di somite, (iii) mancanza di distacco della gemma caudale dal sacco vitellino e (iv) mancanza di battito cardiaco. Il test consente di determinare la tossicità acuta e l'LC50. Inoltre, fornisce anche consulenza sulle dimensioni della camera di prova da utilizzare per lo screening (piastre a 24 pozzetti), sulla distribuzione delle uova nella camera di prova e sulle condizioni di stabulazione, tra le altre cose, garantendo risultati validi e riproducibili7.
Sebbene il test FET sia adatto per i test di tossicità allo stadio embrionale, non supera i 4 dpf. Per i fenotipi che iniziano a svilupparsi intorno a questo punto temporale (ad esempio, la mineralizzazione della notocorda6), lo screening farmacologico deve procedere oltre i 4 dpf per consentire la valutazione morfologica di tale tessuto. Inoltre, si raccomanda che l'esposizione al farmaco inizi almeno un giorno prima dello sviluppo del fenotipo di interesse. Per quanto ne sappiamo, non esiste un protocollo standardizzato simile al FET per lo screening farmacologico nelle larve di zebrafish in fase iniziale, in particolare nel zebrafish di età compresa tra 3 e 7 dpf. Sebbene siano stati pubblicati diversi studi che descrivono i test farmacologici nelle larve di zebrafish oltre i 4 dpf, vi è una mancanza di coerenza nella metodologia utilizzata, comprese le dimensioni delle camere di prova, il numero di repliche biologiche e tecniche, il tasso di cambiamenti dei mezzi, la durata dell'esposizione e i difetti morfologici valutati 8,9,10,11,12,13 . Per questo motivo, abbiamo sviluppato un protocollo convalidato per test di tossicità standardizzati seguiti dall'osservazione visiva dei cambiamenti morfologici nelle larve di zebrafish a 3-7 dpf. Il protocollo proposto può essere successivamente utilizzato per altri saggi di fenotipizzazione a valle, come l'analisi comportamentale, la profilazione dell'espressione genica e l'istomorfometria.
Protocollo
Il pesce zebra è stato gestito secondo la direttiva UE 2010/63/UE. Tutti gli esperimenti sono stati approvati dal Comitato Etico per la Ricerca della Facoltà (FREC) e dal Sottocomitato Settoriale per la Ricerca Animale del FREC (JFARSS) dell'Università di Malta. Un diagramma di flusso del protocollo proposto è disponibile nella Figura 1.
1. Produzione, raccolta e mantenimento degli ovuli
- Sistemare i pesci in vasche di riproduzione il giorno prima, almeno un'ora dopo l'ultima poppata, con divisori in posizione che separano i maschi e le femmine. Per ottenere migliori risultati nella produzione di uova, utilizzare un rapporto più elevato tra femmine e maschi. Sistemare il pesce in una stanza dotata di un ciclo luce/buio di 14 h:10 h e a una temperatura ambiente di 27-28 °C.
NOTA: Una vasca di riproduzione da 1 L può contenere tre pesci adulti, mentre una vasca da riproduzione da 1,7 L può contenere cinque pesci adulti. - La mattina seguente, dopo l'inizio della luce, riposizionare l'acqua nelle vasche di riproduzione e rimuovere i divisori. Nel caso in cui la vasca di riproduzione non sia facilmente inclinata, posizionarla in una posizione inclinata per garantire che sia disponibile acqua bassa per favorire l'accoppiamento. In caso di lenta produzione di uova e attività di accoppiamento, sostituire l'acqua nelle vasche di riproduzione ogni 45 minuti. Lasciare accoppiare il pesce per un massimo di 3 ore o secondo necessità.
- Una volta completato l'accoppiamento, spremere delicatamente le femmine che non hanno prodotto uova per evitare che si leghino le uova a lungo termine. Rimetti i pesci nelle rispettive vasche.
- Raccogliere le uova nelle vasche di riproduzione utilizzando un colino a rete, sciacquare con acqua per embrioni (E3) e metterle in una capsula di Petri con E3. Per preparare l'E3, mescolare 16,67 mL di 60x E3 (300 mM NaCl; 10 mM KCl; 20 mM CaCl2,2H 2O; 20 mM MgSO4,7H 2O) con 1 mL di blu di metilene allo 0,01% e 982 mL di acqua deionizzata. Rimuovi eventuali uova o detriti non fecondati. Assicurarsi che le piastre di Petri non siano affollate, con 50 uova per piastra di Petri da 100 mm x 15 mm e 120 uova per piastra di Petri da 150 mm x 15 mm.
- Conservare le uova in un'incubatrice impostata a 28,5 °C e dotata di un ciclo giorno/notte di 14 ore:10 ore. A 1 dpf, rinfrescare l'E3 e rimuovere le uova non vitali per limitare la crescita dei funghi.
2. Preparazione della piastra di prova
- A 3 dpf, trasferire un embrione schiuso dall'aspetto sano in ciascun pozzetto in una piastra da 96 pozzetti utilizzando una micropipetta da 1.000 μl impostata su un volume di 100 μl.
NOTA: Gli embrioni non nati non devono essere utilizzati, poiché ciò potrebbe comportare un assorbimento variabile dei composti. L'uso di embrioni che sembrano sani limita anche i pregiudizi durante i test. Le dimensioni della punta della pipetta consentono una facile raccolta dell'embrione di pesce zebra senza causare danni fisici. Inoltre, una micropipetta consente un migliore controllo del volume erogato nel pozzetto rispetto a una pipetta di trasferimento. - In una piastra a 12 pozzetti, preparare la concentrazione o le concentrazioni desiderate per ciascuna sostanza chimica in esame in pozzetti separati (in questo caso, Bosutinib in un intervallo di concentrazione compreso tra 100 μM e 6,25 μM). In ciascun pozzetto, aggiungere il volume necessario di sostanza chimica in esame utilizzando micropipette e portare a 2,4 mL utilizzando E3.
NOTA: È necessario effettuare una ricerca bibliografica per determinare le concentrazioni adeguate da utilizzare per le sostanze chimiche in esame pertinenti. Se non sono disponibili informazioni, è possibile provare diverse concentrazioni fino a determinare un intervallo di concentrazione adeguato. Devono essere utilizzate almeno cinque concentrazioni, con la concentrazione più alta che causa il 100% di mortalità e la concentrazione più bassa che non causa alcun effetto osservabile7. - Preparare un controllo del veicolo in base al solvente utilizzato per sciogliere la sostanza chimica in esame.
NOTA: Molti composti in esame non sono solubili in acqua e per questo motivo devono essere disciolti in solventi specifici ("veicoli") come l'etanolo o il dimetilsolfossido (DMSO) per generare una soluzione acquosa. Il DMSO non deve preferibilmente superare una concentrazione dell'1% quando viene utilizzato come controllo del veicolo, che è la concentrazione risultata sicura nel pesce zebra14. - Rimuovere l'eventuale soluzione E3 presente nella piastra a 96 pozzetti utilizzando una micropipetta da 200 μl e sostituirla con 100 μl del terreno corrispondente da testare. Assicurati di testare un totale di 24 larve per concentrazione. Utilizzare una micropipetta da 200 μl a uno o 8 canali per trasferire le sostanze chimiche in esame nei pozzetti della piastra di prova corrispondenti. Includi controlli (ad es. E3, veicolo chimico, controlli positivi, ecc.).
NOTA: La configurazione della piastra può ospitare fino a quattro diverse sostanze chimiche in esame o quattro diverse concentrazioni della stessa sostanza chimica. Un esempio delle piastre di prova predisposte per l'indagine di cinque concentrazioni della stessa sostanza chimica (ad esempio, Bosutinib) accompagnate da controlli è mostrato nella Figura 1. - A 24 ore dall'esposizione, eseguire il punteggio morfologico (come descritto nella sezione 3) e un cambio di mezzo terreno, rimuovendo 50 μL di terreno e sostituendolo con un terreno appena preparato. Rimuovere e registrare eventuali larve morte durante il processo. Conservare le larve in un'incubatrice impostata a 28,5 °C e dotata di un ciclo giorno/notte di 14 ore:10 ore. Ripetere il processo fino a 7 dpf.
3. Valutazione morfologica
- Utilizzando uno stereomicroscopio ottico, osservare le singole larve di prova con un ingrandimento appropriato.
NOTA: Esempi di difetti morfologici che possono essere valutati sono forniti nella Tabella 1. - Far valutare la morfologia da due valutatori indipendenti, con un terzo consultato in caso di disaccordo tra i due valutatori.
- Assegna un punteggio alla morfologia utilizzando un metodo binario (cioè presente/assente), dove "assente" indica una morfologia normale (valutato come "0") e "presente" indica la presenza di anomalie morfologiche (valutato come "1"). La Figura 2 mostra esempi di zebrafish a 5 dpf dopo 2 giorni di esposizione al farmaco, tra cui un zebrafish non affetto (Figura 2A), un zebrafish con lieve edema pericardico (Figura 2B), grave edema pericardico con emorragia del tuorlo ed estensione del tuorlo (Figura 2C), sviluppo ritardato con pigmentazione ridotta, vescica natatoria e lunghezza totale (Figura 2D), tuorlo gonfio e pinna caudale attorcigliata (Figura 2E), pinna caudale assente (Figura 2F), notocorda curva (Figura 2G), troncamento (Figura 2H) e morte con necrosi (Figura 2I). Assegna un punteggio a tutti i fenotipi anomali come "1" e al pesce zebra non interessato come "0".
4. Determinazione LC50
- Dopo la valutazione morfologica, tracciare la percentuale cumulativa di mortalità a 7 dpf rispetto alla concentrazione. Un esempio è mostrato nella Figura 3. Utilizzare la curva di concentrazione per stimare la concentrazione che causa il 50% di mortalità.
- Una volta stimata la concentrazione di LC50 , ripetere l'esperimento sopra descritto esponendo 24 larve replicate in una piastra da 96 pozzetti a questa singola concentrazione stimata di LC50 .
5. Repliche tecniche
- Ripetere l'intera procedura utilizzando le cinque concentrazioni selezionate della stessa sostanza chimica almeno altre due volte in due occasioni separate per garantire che i risultati siano riproducibili.
Risultati
Le anomalie possono essere osservate singolarmente o cumulativamente nel corso della sequenza temporale sperimentale fino a 7 dpf. Il punteggio morfologico massimo per anomalia può essere utilizzato per calcolare le anomalie morfologiche come percentuale del numero di larve utilizzate. Ad esempio, se il giorno 7 i punteggi morfologici dell'edema pericardico sono rispettivamente a 19 e 20 per i punteggi 1 e 2, su un punteggio possibile di 24, il che significa che 19 o 20 larve su 24 mostrano edema pericardico, il punteggio percentuale può essere calcolato come:
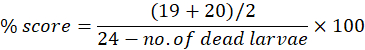
La tabella supplementare S1 mostra i risultati del punteggio morfologico (di entrambi i punteggi) a 4 dpf a seguito di test di tossicità per il composto Bosutinib, un inibitore della tirosin-chinasi indicato per il trattamento della leucemia mieloide cronica15. Lo stesso punteggio morfologico viene ripetuto per i pesci esposti di età compresa tra 5 dpf e 7 dpf. Il composto è stato testato utilizzando un intervallo di concentrazione da 100 μM a 6,25 μM. Tre repliche tecniche sono state condotte in momenti diversi e il tasso medio di mortalità cumulativa a 7 dpf è stato utilizzato per determinare LC50, la concentrazione alla quale sopravvive il 50% delle larve. La LC50 può essere determinata in qualsiasi momento di esposizione. Tuttavia, si consiglia di calcolarlo a 7 dpf.
La mortalità media cumulativa a 7 dpf è stata utilizzata per generare una curva LC50 , che può essere vista nella Figura 3. Per Bosutinib, la concentrazione di LC50 è stata stimata in 37,95 μM.
NOTA: Questa concentrazione stimata di LC50 si applica strettamente a questo sistema modello e può quindi essere utilizzata per ulteriori saggi di fenotipizzazione a valle.
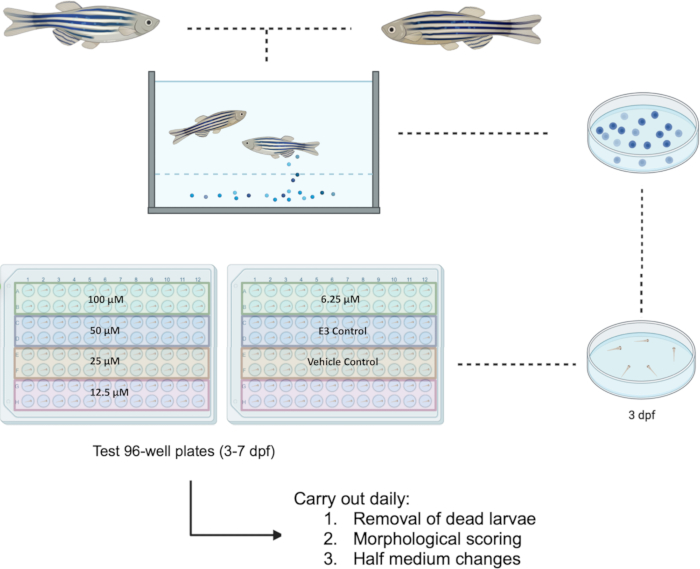
Figura 1: Schema dello screening farmacologico proposto nelle larve a 3-7 dpf. Le piastre di prova a 96 pozzetti sono predisposte per lo studio di cinque concentrazioni che vanno da 100 μM a 6,25 μM per il composto Bosutinib. Abbreviazione: dpf = giorni dopo la fecondazione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Difetti morfologici rappresentativi osservati nelle larve di zebrafish a 5 dpf esposte a varie concentrazioni chimiche (a 2 giorni dall'esposizione). (A) Zebrafish di controllo (non affetto), (B) Larva di zebrafish che mostra lieve edema pericardico, (C) Zebrafish con grave edema pericardico ed emorragia del tuorlo, (D) Zebrafish con ritardo dello sviluppo, pigmentazione ridotta, vescica natatoria piccola, (E) Zebrafish con tuorlo gonfio e pinna caudale attorcigliata, (F) Zebrafish con assenza di pinna caudale, (G) Zebrafish con notocorda ricurva, (H) Zebrafish con coda tronca, e (I) Pesce zebra morto con necrosi. I difetti sono indicati con punte di freccia rosse. Barre della scala = 1 mm. Clicca qui per visualizzare una versione più grande di questa figura.
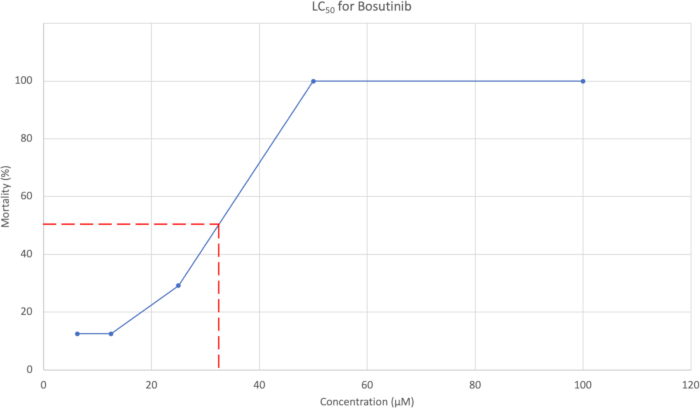
Figura 3: Curva LC50 che mostra la concentrazione rispetto alla % di mortalità. Le cinque concentrazioni testate erano 100 μM, 50 μM, 25 μM, 12,5 μM e 6,25 μM, con una percentuale di mortalità rispettivamente del 100%, 100%, 29,2%, 12,5% e 12,5%. Clicca qui per visualizzare una versione più grande di questa figura.
| Difetti morfologici | Descrizione |
| Edema pericardico | Accumulo di liquidi intorno al cuore con cuore teso e malfunzionamento della circolazione sanguigna |
| Battiti cardiaci (al minuto) | Riduzione del numero di battiti al minuto |
| Tuorlo | Presenza o assenza di edema o emorragia del tuorlo che possono verificarsi contemporaneamente a difetti cardiaci |
| Prolunga del tuorlo | Tuorlo gonfio, sottile o assente |
| Notocorda curva | Presenza di una notocorda attorcigliata o ondulata e/o di una coda curva |
| Vescica natatoria | Presenza, assenza o sviluppo parziale della vescica natatoria |
| Pigmentazione | Meno o nessun melanocito rispetto ai pesci non trattati della stessa età |
| Necrosi | Presenza (lieve o grave) o assenza di necrosi in qualsiasi parte del corpo |
| Sviluppo ritardato | Sviluppo ritardato o in stallo rispetto ai controlli wild-type della stessa età. |
| Risposta al tocco | Risposta ritardata o assente a seguito di uno spavento (ad esempio, utilizzando un puntale per pipetta) |
| Troncamento | Assenza del corpo posteriore del pesce zebra (cioè formazione della coda) |
| Pinne | Presenza o assenza della pinna caudale che può essere accompagnata da una sottile estensione del tuorlo |
| Asse del corpo ridotto | Pesci che sembrano normali ma che vengono misurati sono di lunghezza inferiore |
Tabella 1: Un elenco di difetti morfologici visivi che possono essere osservati a seguito di studi sull'esposizione ai farmaci.
Tabella supplementare S1: Risultati morfologici rappresentativi per Bosutinib a 4 dpf (1 giorno dopo l'esposizione). Clicca qui per scaricare questa tabella.
Discussione
Il pesce zebra è diventato un modello importante per lo screening dei farmaci. Quando abbiamo cercato di determinare una metodologia per eseguire i test di tossicità, abbiamo trovato diversi metodi contrastanti provenienti da diversi laboratori 8,9,10,11,12,13. I metodi descritti utilizzano larve a diverse età, tempistiche sperimentali variabili, diversi tassi di cambiamenti medi e diversi sistemi di punteggio morfologico. Attraverso tentativi ed errori, abbiamo stabilito la metodologia descritta, che ha fornito risultati affidabili e riproducibili.
Scelta della dimensione della piastra
Inizialmente, gli esperimenti sono stati eseguiti in una piastra a 24 pozzetti per garantire che le larve avessero abbastanza spazio per muoversi e crescere. Le piastre sono state disposte con 10 larve per pozzetto, due pozzetti per concentrazione e 1 mL di soluzione farmacologica per pozzetto. Questa disposizione non ha fornito risultati riproducibili, portando alla deduzione che le larve non assorbivano quantità uguali di farmaco dal pozzo. Le prove sono state quindi effettuate utilizzando una piastra da 96 pozzetti e 48 pozzetti con una larva per pozzetto, il che ha dimostrato che le larve in piastre da 96 pozzetti non mostravano problemi di crescita. Pertanto, gli esperimenti sono stati continuati in una piastra a 96 pozzetti utilizzando meno spazio e volumi di farmaci.
Cambio medio giornaliero
Poiché i pesci zebra assorbono il farmaco dal terreno, abbiamo accertato che è necessario un certo grado di variazione del terreno per mantenere una concentrazione costante del farmaco nel terreno. Inoltre, un cambiamento del mezzo rimuove il potenziale materiale di scarto accumulato nel pozzo, che può fornire un ambiente tossico e portare a risultati distorti. È stata effettuata una prova con Bosutinib, in cui sono state impostate tre piastre per lo stesso farmaco, una senza un cambio giornaliero del terreno, una con un cambio giornaliero del mezzo medio e una con un cambio giornaliero completo del mezzo. Mentre la piastra senza variazione del medio ha mostrato un aumento dei tassi di mortalità, le piastre con variazioni del mezzo metà e pieno hanno prodotto lo stesso risultato di 7 dpf. Pertanto, è stato scelto un cambio medio medio giornaliero. Questa scelta garantisce un minor consumo del costoso e limitato materiale di prova, che potrebbe essere necessario per ulteriori esperimenti a valle.
Durata dell'esposizione
L'età delle larve di prova utilizzate e la durata dell'esposizione al farmaco selezionate in questo protocollo sono state guidate dal nostro fenotipo di interesse che è la mineralizzazione ossea. Poiché la formazione ossea inizia a ~4 dpf, abbiamo scelto di iniziare con il pesce zebra a 3 dpf per determinare se le sostanze chimiche in esame influenzassero l'inizio dello sviluppo osseo. Successivamente, abbiamo concluso gli studi sull'esposizione al farmaco a 7 dpf poiché è stato osservato un alto grado di mortalità da 8 dpf in poi in considerazione della mancanza di alimentazione che potrebbe influenzare i risultati. Tuttavia, i tempi possono essere adattati a seconda della natura dello studio e del fenotipo di interesse.
Limitazioni
Questa metodologia presenta alcune limitazioni. Il trasferimento di 3 dpf di zebrafish su piastre di prova multipozzetto richiede molto tempo. Rimuovere il terreno dai pozzetti senza raccogliere le larve è altrettanto laborioso. Il terreno deve essere rimosso lentamente da ciascun pozzetto utilizzando una pipetta a canale singolo, assicurandosi che le larve non vengano danneggiate durante il processo. Inoltre, mentre un cambio giornaliero di mezzo mezzo reintegra il composto in esame e assicura la rimozione del materiale di scarto dal pozzetto, non garantisce che una concentrazione stabile del farmaco possa essere mantenuta nel pozzetto durante i 5 giorni di esposizione. Mentre l'analisi cromatografica liquida ad alte prestazioni potrebbe fornire ulteriori informazioni sulla quantità effettiva di farmaco assorbita da ciascuna larva, il test non si qualificherebbe più come metodo di screening ad alto rendimento.
In conclusione, questa metodologia mira a colmare il divario nei test di tossicità con zebrafish oltre i 4 dpf, facendo passi verso un protocollo standardizzato applicabile alle linee di zebrafish wild-type, mutanti e transgenici, e che sia alla pari con il FET allo stadio embrionale. Ciò apre la strada ad altri saggi di fenotipizzazione a valle che potrebbero non essere possibili nelle fasi precedenti.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Gli autori sono supportati dai progetti ZeEBRA (R&I-2019-018), un fondo per il Programma di Sviluppo Tecnologico (TDP), STRONG (R&I-2024-007L), un fondo TDPite, NASDAC (SINO-MALTA-2022-08), una sovvenzione per la cooperazione scientifica e tecnologica, e DEMONSTRATE (R&I-2018-007A), una sovvenzione Go2Market, tutti finanziati da XjenzaMalta per e per conto della Fondazione per la Scienza e la Tecnologia. La Figura 1 è stata creata utilizzando BioRender.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Starlab | E1415-1510 | |
| 10 µL micropipette (P10) | Gilson | F144802 | |
| 10/20 µL pipette tips | Starlab | S1110-3810 | |
| 1000 µL micropipette (P1000) | Gilson | F123602 | |
| 1000 µL pipette tips | Starlab | S1111-6001 | |
| 12-well plate | Starlab | CC7672-7512 | Sterile, single-wrapped, non-treated, with lid |
| 20 µL micropipette (P20) | Gilson | F123600 | |
| 200 µL micropipette (P200) | Gilson | F123601 | |
| 200 µL multi-channel pipette | Gilson | F81024 | |
| 200 µL pipette tips | Starlab | S1113-1006 | |
| 96-well plate | Starlab | CC7672-7596 | Sterile, single-wrapped, flat-bottom, non-treated, with lid |
| Breeding tanks with inside grid sloping bottom, tank dividers and lids | Tecniplast | ZB17BTISLOP, ZB17BTE, ZB17BTL, ZB17BTD | Sloped inner tank |
| Mesh strainer | / | / | |
| Nitrile gloves | Mercator | / | / |
| Petri-dish | Starlab | CC7672-3394/CC7672-3359 | 100 x 20 mm or 60 x 15 mm |
| Leica M205 FCA Fluorescence stereo microscope | Leica | 10450826 | |
| Peltier-cooled incubator including 2 shelves with light module cold white | Memmert | IPP110ecoplus, T8 | Equipped with day/night cycle |
| Dimethyl Sulfoxide | Biochem Chemopharma | 504341000 | To prepare a 1% solution in E3 |
| Calcium chlorided dihydrate | Biochem Chemopharma | 303080500 | To prepare E3 |
| Magnesium sulfate heptahydrate | Biochem Chemopharma | 313060500 | To prepare E3 |
| Potassium Chloride | Biochem Chemopharma | 316030500 | To prepare E3 |
| SCREEN-WELL Wnt Pathway library (Bosutinib) | Enzo | BML-2838-0500 | |
| Sodium Chloride | Fisher Scientific | S/3161/53 | To prepare E3 |
Riferimenti
- Teame, T., et al. The use of zebrafish (Danio rerio) as biomedical models. Anim Front. 9 (3), 68-77 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: From preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- Clift, D., Richendrfer, H., Thorn, R. J., Colwill, R. M., Creton, R. High-throughput analysis of behavior in zebrafish larvae: Effects of feeding. Zebrafish. 11 (5), 455-461 (2014).
- Keenan, S. R., Currie, P. D. The developmental phases of zebrafish myogenesis. J Dev Biol. 7 (2), 12 (2019).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders. Front Endocrinol (Lausanne). 11, 489 (2020).
- OECD. . Test no. 236: Fish embryo acute toxicity (FET). , (2013).
- Chen, J. R., Lai, Y. H., Tsai, J. J., Hsiao, C. D. Live fluorescent staining platform for drug-screening and mechanism-analysis in zebrafish for bone mineralization. Molecules. 22 (12), 2068 (2017).
- He, H., Wang, C., Tang, Q., Yang, F., Xu, Y. Possible mechanisms of prednisolone-induced osteoporosis in zebrafish larva. Biomed Pharmacother. 101, 981-987 (2018).
- Huang, H. X., et al. Application of bone transgenic zebrafish in anti-osteoporosis chemical screening. Animal Model Exp Med. 1 (1), 53-61 (2018).
- Haney, M. G., Moore, L. H., Blackburn, J. S. Drug screening of primary patient derived tumor xenografts in zebrafish. J Vis Exp. (158), e60996 (2020).
- Nishimura, Y., et al. Using zebrafish in systems toxicology for developmental toxicity testing. Congenit Anom (Kyoto). 56 (1), 18-27 (2016).
- Hayot, G., et al. Evaluating toxicity of chemicals using a zebrafish vibration startle response screening system. J Vis Exp. (203), e66153 (2024).
- Hoyberghs, J., et al. DMSO concentrations up to 1% are safe to be used in the zebrafish embryo developmental toxicity assay. Front Toxicol. 3, 804033 (2021).
- Lipton, J. H., Brümmendorf, T. H., Sweet, K., Apperley, J. F., Cortes, J. E. Practical considerations in the management of patients treated with bosutinib for chronic myeloid leukemia. Ann Hematol. 103 (9), 3429-3442 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon