Uso del medidor de pH
Visión general
Fuente: Laboratorio del Dr. Zhongqi He - Departamento de agricultura de Estados Unidos
Ácidos y bases son sustancias capaces de donar protones (H+) y los iones hidróxido (OH–), respectivamente. Son dos extremos que describen productos químicos. Mezcla de ácidos y bases puede anular o neutralizar sus efectos extremos. Una sustancia que no es ni ácida ni básica es neutral. Los valores de concentración de protones ([H+]) para la mayoría de las soluciones son inconvenientemente pequeñas y difíciles de comparar por lo que una cantidad más práctica, el pH, se ha introducido. pH fue definido originalmente como el logaritmo decimal de la inversa de la concentración molar de protones 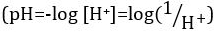 , pero fue actualizado para el logaritmo decimal de la inversa de la actividad del ion hidrógeno
, pero fue actualizado para el logaritmo decimal de la inversa de la actividad del ion hidrógeno 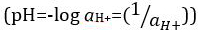 . La definición anterior ahora se expresa en ocasiones como p [H]. La diferencia entre p [H] y el pH es muy pequeña. Ha sido indicado que el pH = p [H] + 0,04. Es práctica común utilizar el término 'del pH' para ambos tipos de mediciones.
. La definición anterior ahora se expresa en ocasiones como p [H]. La diferencia entre p [H] y el pH es muy pequeña. Ha sido indicado que el pH = p [H] + 0,04. Es práctica común utilizar el término 'del pH' para ambos tipos de mediciones.
El pH típicamente escala oscila entre 0 y 14. Una solución 1 M de un ácido fuerte, pH = 0 y para una solución de 1 M de una fuerte base, pH = 14. Así, valores de pH medidos se mienten sobre todo en el rango de 0 a 14, aunque valores fuera de este rango son totalmente posibles. El agua pura es neutro pH = 7. Un pH inferior a 7 es ácida y un pH mayor que 7 es básico. Como la escala de pH es logarítmica, el pH es una cantidad adimensional. Cada valor entero de pH debajo de 7 es 10 veces más ácida que el entero siguiente. Por ejemplo, un pH de 4 es 10 veces más ácido que un pH de 5 y 100 x (10 x 10) más ácido que un pH de 6. Lo mismo es válido para valores de pH superiores a 7, cada una de ellas es 10 x más básico (o alcalino) que el siguiente valor entero inferior. Por ejemplo, un pH de 10 es 10 x más básico que un pH de 9.
Procedimiento
1. pH Calibración
- Encienda del medidor pulsando el botón "power".
- Conecte la sonda de compensación (ATC) de la temperatura automática si está disponible o no es con el electrodo.
- Compruebe que el modo de medición de pH. Si no, presione el botón "MODE" hasta que "pH" aparece en la pantalla LCD.
- Consulte a la guía de referencia rápida en la parte inferior del medidor o cerca si es necesario.
- Siempre use tampones de pH frescas, sin usar, vigente para la calibración. Almace
Resultados
La figura 1 muestra el pH de suelos agrícolas afectados por el manejo de cultivo y riego de agua subterránea. Se recolectaron las muestras de suelo de 5 campos de papa bajo diferentes prácticas agrícolas de rotación con o sin irrigación de agua subterránea. El pH más bajo se observa en campo 4 suelos de secano y de aguas subterráneas riego serie. Riego de las aguas subterráneas aumentó constantemente el pH del suelo en todos los 5 campos. La información del pH es esencial para la recomendación de encalado apropi...
Aplicación y resumen
el pH es uno de los parámetros químicos más comúnmente medidos de las soluciones acuosas. Es un parámetro crítico en el tratamiento de aguas y aguas residuales para aplicaciones municipales e industriales, producción química, investigación agrícola y producción. También es fundamental en la investigación química y Ciencias de la vida, monitoreo ambiental, bioquímica y farmacéutica de la investigación, producción electrónica y muchas más aplicaciones. Figura 2 muestra los valores de pH...
Saltar a...
Vídeos de esta colección:

Now Playing
Uso del medidor de pH
General Chemistry
347.0K Vistas

Cristalería de laboratorio y usos comunes
General Chemistry
659.5K Vistas

Soluciones y concentraciones
General Chemistry
275.6K Vistas

Determinación de la densidad de un sólido y líquido
General Chemistry
557.1K Vistas

Determinación de la composición porcentual en masa de una solución acuosa
General Chemistry
383.9K Vistas

Determinación de la fórmula empírica
General Chemistry
183.9K Vistas

Determinación de las reglas de solubilidad de compuestos iónicos
General Chemistry
141.6K Vistas

Introducción a la titulación
General Chemistry
425.8K Vistas

Ley del Gas ideal
General Chemistry
79.5K Vistas

Determinación espectrofotométrica de la constante de un equilibrio
General Chemistry
158.9K Vistas

Principio de le Châtelier
General Chemistry
265.9K Vistas

Depresión del punto de congelación para determinar un compuesto desconocido
General Chemistry
160.9K Vistas

Determinación de las leyes de la velocidad y el orden de la reacción
General Chemistry
196.5K Vistas

Uso de la calorimetría diferencial para medir los cambios en la entalpía
General Chemistry
44.8K Vistas

Complejos de coordinación
General Chemistry
91.8K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados