Utiliser un pH-mètre
Vue d'ensemble
Source : Laboratoire du Dr Zhongqi He - United States Department of Agriculture
Acides et bases sont des substances capables de faire un don de protons (H+) et les ions hydroxydes (OH–), respectivement. Ils sont deux extrêmes qui décrivent les produits chimiques. Mélange d’acides et les bases peut s’annulent ou neutraliser leurs effets extrêmes. Une substance qui n’est ni acide ni base est neutre. Les valeurs de concentration de protons ([H+]) pour la plupart des solutions sont malencontreusement petites et difficiles à comparer pour qu’une quantité plus pratique, le pH, a été introduite. pH a été initialement définie comme le logarithme décimal de l’inverse de la concentration molaire de protons 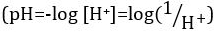 , mais a été mis à jour pour le logarithme décimal de l’inverse de l’activité en ions hydrogène
, mais a été mis à jour pour le logarithme décimal de l’inverse de l’activité en ions hydrogène 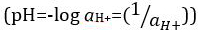 . L’ancienne définition est maintenant parfois exprimée en p [H]. La différence entre p [H] et le pH est assez petite. Il a été indiqué que le pH = p [H] + 0,04. Il est pratique courante d’utiliser le terme « pH » pour les deux types de mesures.
. L’ancienne définition est maintenant parfois exprimée en p [H]. La différence entre p [H] et le pH est assez petite. Il a été indiqué que le pH = p [H] + 0,04. Il est pratique courante d’utiliser le terme « pH » pour les deux types de mesures.
Le pH à l’échelle en général varie entre 0 et 14. Pour une solution 1 M d’un acide fort, pH = 0 et d’une solution 1 M d’un fort base, pH = 14. Ainsi, les valeurs de pH mesuré résidera principalement dans la gamme 0 à 14, bien que les valeurs en dehors de cette plage sont tout à fait possibles. L’eau pure est neutre pH = 7. Un pH inférieur à 7 est acide, et un pH supérieur à 7 est basique. Comme l’échelle du pH est logarithmique, pH est une grandeur sans dimension. Chaque ensemble de pH inférieur à 7 est 10 x plus acide que l’entier suivant. Par exemple, un pH de 4 est 10 x plus acide qu’un pH de 5 et 100 x (10 x 10) plus acide qu’un pH de 6. Va de même pour les valeurs de pH supérieures à 7, dont chacun est 10 x plus basic (ou alcaline) que la prochaine valeur entiθre infιrieure. Par exemple, un pH de 10 est 10 x plus basic à un pH de 9.
Procédure
1. pH Calibration
- Allumez la puissance du compteur en appuyant sur le bouton « power ».
- Fixer la sonde automatique de compensation (CAT) si elle est disponible ou n’est pas avec l’électrode.
- Vérifiez que le mode de mesure est pH. Si ce n’est pas le cas, appuyez sur la touche « MODE » jusqu'à ce que le mode « pH » apparaît sur l’écran LCD.
- Consulter le guide de référence rapide en bas du compteur ou à proximité de l’aide si nécessaire.
- Toujours utiliser des tampons pH fr
Résultats
La figure 1 illustre le pH des sols agricoles touchés par la gestion des culture et d’irrigation des eaux souterraines. Ces échantillons de sol ont été prélevés de 5 champs de pommes de terre sous différentes pratiques culturales de rotation avec ou sans irrigation souterraine. Le pH le plus bas est observé dans champ 4 sols en culture pluviale et des eaux souterraines série irriguées. Irrigation souterraine a augmenté constamment le pH du sol dans tous les 5 domaines. Les informations de pH sont essentielles po...
Applications et Résumé
pH est l’un des paramètres chimiques couramment mesurés des solutions aqueuses. C’est un paramètre essentiel dans le traitement de l’eau et des eaux usées pour les applications municipales et industrielles, production de produits chimiques, recherche sur l’agriculture et la production. Il est également essentiel dans la recherche environnementale surveillance, chimie et sciences de la vie, recherche biochimique et pharmaceutique, production électronique et bien d’autres applications. La figure 2
Passer à...
Vidéos de cette collection:

Now Playing
Utiliser un pH-mètre
General Chemistry
344.6K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
654.6K Vues

Solutions et Concentrations
General Chemistry
273.3K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
555.0K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.1K Vues

Déterminer la formule empirique
General Chemistry
180.4K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.1K Vues

Introduction au titrage
General Chemistry
423.6K Vues

Loi des gaz parfaits
General Chemistry
78.2K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.3K Vues

Principe de Le Châtelier
General Chemistry
264.4K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.5K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
195.8K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.4K Vues

Complexes de coordination
General Chemistry
91.2K Vues