Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Génération expérimentale de carcinome Associated fibroblastes (CAF) à partir des fibroblastes mammaires
Dans cet article
Résumé
Carcinome associé fibroblastes (CAF) riche en myofibroblastes présents dans le stroma tumoral, jouent un rôle majeur dans la conduite progression tumorale. Nous avons développé un modèle xengraft coimplantation tumeur pour générer expérimentalement CAF à partir de fibroblastes humains mammaires. Le protocole décrit comment établir myofibroblastes CAF qui acquièrent une capacité de promouvoir la tumorigenèse.
Résumé
Les carcinomes sont des tissus complexes composé de cellules néoplasiques et d'un compartiment non cancéreuse appelée la «stroma». Le stroma est constitué d'une matrice extracellulaire (MEC) et une variété de cellules mésenchymateuses, y compris les fibroblastes, les myofibroblastes, cellules endothéliales, les péricytes et les leucocytes 1-3.
Le stroma tumoral associé est sensible aux signaux paracrines importante libérée par les cellules de carcinome voisins. Pendant le processus de la maladie, le stroma devient souvent peuplées par un carcinome associé fibroblastes (CAF), y compris un grand nombre de myofibroblastes. Ces cellules ont déjà été extraits de nombreux types de cancers humains in vitro pour leur culture en. Une sous-population des CAF se distingue grâce à leur régulation à la hausse de l'actine musculaire lisse α (α-SMA) l'expression 4,5. Ces cellules sont une caractéristique de «fibroblastes activés» qui partagent des propriétés similaires aux myofibroblastes commonly observée dans les tissus blessés et fibrotiques 6. La présence de ce sous-ensemble myofibroblastique CAF est fortement liée à la haute qualité des tumeurs malignes et associé à un mauvais pronostic chez les patients.
Beaucoup de laboratoires, y compris la nôtre, ont montré que les CAF, lorsqu'il est injecté avec des cellules de carcinome dans des souris immunodéficientes, sont capables de promouvoir la tumorigenèse nettement 7-10. CAF préparés à partir de patients atteints de cancer, cependant, subissent fréquemment la sénescence cours de la propagation de la culture en limitant l'ampleur de leur utilisation à travers l'expérimentation en cours. Pour surmonter cette difficulté, nous avons développé une nouvelle technique pour générer des expérimentalement humaines immortalisées lignées cellulaires mammaires CAF (exp-CAF) à partir de fibroblastes humains mammaires, en utilisant un sein coimplantation xénogreffes de tumeurs du modèle.
Afin de générer exp-CAF, des parents humains fibroblastes mammaires, obtenues à partir des tissus mammoplastie de réduction, ont d'abord été immortalised avec hTERT, la sous-unité catalytique de l'holoenzyme télomérase, et pour exprimer la GFP et un gène de résistance puromycine. Ces cellules ont été coimplanted avec MCF-7 des cellules de carcinome du sein exprimant un oncogène ras activé (MCF-7-ras cellules) dans une xénogreffe de souris. Après une période d'incubation in vivo, les fibroblastes humains initialement injecté mammaires ont été extraites des xénogreffes de tumeur sur la base de leur résistance à la puromycine 11.
Nous avons observé que le résident des fibroblastes mammaires se sont différenciées, en adoptant un phénotype tumoral myofibroblastique et acquis des propriétés favorisant au cours de la progression tumorale. Fait important, ces cellules, définie comme exp-CAF, imitent le phénotype tumoral de promotion de la CAF myofibroblastique isolées de cancers du sein chez des patients disséqués. Notre tumeur xénogreffe dérivés exp-CAF donc fournir un modèle efficace pour étudier la biologie de la CAF dans les Breas humainecarcinomes t. Le protocole décrit peut également être étendue pour générer et caractériser les différentes populations CAF provenant d'autres types de carcinomes humains.
Protocole
1. L'isolement des cultures primaires de fibroblastes humains normaux mammaires
Les procédures expérimentales permettant d'isoler cultures primaires de fibroblastes humains normaux mammaires sont décrites dans la Fig. 1A.
- Préparer le tampon de dissociation cellulaire, comme décrit précédemment 12: Medium Eagle modifié par Dulbecco (DMEM) avec 10% sérum de veau foetal (FCS), de pénicilline-streptomycine (200 unités / ml), la collagénase de type I (1 mg / ml) et de l'hyaluronidase ( 125 unités / ml).
- Laver le tissu mammaire disséqué d'une réduction mammaire (~ 0,5 gramme) à plusieurs reprises dans un tampon phosphate salin (PBS). Hacher le tissu en petits fragments (<1,5 mm 3) en utilisant des lames de rasoir stérile.
- Transfert des fragments de tissu dans un tube de 15 ml conique contenant une quantité appropriée de ce qui précède la cellule tampon de dissociation (10 ml par 0,5 gramme de tissu) et le vortex pendant 1 min à vitesse maximale.
- Recueil des fragments de tissu dans la cellule tampon de dissociation fou 12-18 h à 37 ° C avec agitation lente. * Notez que il y aura encore de nombreux morceaux de fragments de tissus non digérés restent dans le tube.
- Incuber le tube pendant 5 min à température ambiante sans agitation. Transférer la résultante cellules stromales enrichi surnageant dans un nouveau tube conique en utilisant une pipette 5 ml sérologique.
- Centrifuger la fraction stroma pendant 5 min à 250 X g et resuspendre le culot cellulaire dans du PBS. Centrifuger à nouveau pendant 5 min à 250 X g et remettre en suspension les cellules dans du DMEM granulés complété avec 10% de FCS. Culture des cellules dans du DMEM contenant 10% de SVF dans un plat de 15 cm de Pétri à 37 ° C et le dioxyde de carbone de 5%.
- Propager les cellules jusqu'à confluence. Il prend généralement 8-10 jours. Stocker les cellules à -80 ° C en utilisant un milieu de congélation (10% de diméthylsulfoxyde et 20% de SVF en DMEM). Préparer 5 flacons congelés comme un stock initial. Décongelez un flacon et d'élargir les cellules pour préparer 5 flacons pour le stock secondaires contenant des fibroblastes passages dans les 5 de la populationdoublements (PDS) pour les expériences ultérieures. Ces procédures de minimiser la sélection clonale et le stress de la culture qui pourraient survenir pendant la culture de tissus étendus. * Notez que P1.1-7 peut également être utilisé pour isoler les CAF de carcinomes mammaires obtenus par une mastectomie 12.
2. Génération de GFP-étiquetée, puromycine résistant, immortalisée humaine normale fibroblastes mammaires
- Pour immortaliser le principal fibroblastes humains normaux mammaires isolés dans P1.7), introduire une rétroviraux pMIG (MSCV-IRES-GFP) vecteur 12, exprimant à la fois hTERT et GFP. Culture des cellules pendant 4-5 jours et ensuite trier les cellules positives pour la GFP en utilisant la cytométrie de flux.
- Introduire un rétroviraux pBabe-puro construction codant pour un gène de résistance à la puromycine fibroblastes GFP-étiquetée immortalisé. Culture des cellules pendant 5-7 jours, en présence de puromycine (concentration finale: 1 pg / ml) pour isoler la GFP-positives (GFP +), la puromycine-résistantes (R puro ) humaines immortalisées fibroblastes mammaires.
- Ensuite, pour examiner si ces fibroblastes produisent des virus actifs, ce qui peut conduire au transfert horizontal de gènes codant pour la GFP et résistance à la puromycine, grandir 2.5x10 5 GFP + puro R fibroblastes mammaires humaines immortalisées dans un plat de Pétri de 6 cm pour 2 jours.
- Filtre moyenne conditionnée par ces fibroblastes en utilisant un filtre à seringue (taille des pores: 0,45 um) et l'ajouter sur 10T1 / 2 cellules de souris fibroblastique pour 12h, en présence de sulfate de protamine (5 pg / ml) ce qui augmente l'efficacité de l'infection par le virus. Le milieu est ensuite changé pour 10% de SVF-DMEM pour deux jours supplémentaires.
- Examiner les cellules par un microscope à fluorescence. 10T1 / 2 cellules infectées par le virus de la GFP deviendra GFP-positives. Traiter également les cellules avec puromycine (1 pg / ml) pendant 5-7 jours et observez la plaque le cas échéant puro R 10T1 / 2 sont présents et forment des colonies après le traitement de puromycine.
- Notez que l'horizontal de gènes TRANSFER par des virus actifs produits par la GFP parentale + puro R des fibroblastes mammaires pourrait rendre les cellules environnantes murin et / ou cellules de carcinome GFP + puro R au sein de xénogreffes tumorales. Cela peut entraver le processus d'isolement de la GFP initialement injecté + puro R des fibroblastes mammaires de la xénogreffes tumorales.
3a. Co-injection de fibroblastes humains avec des cellules mammaires carcinome mammaire en une souris immunodéficientes
Les procédures expérimentales pour générer des exp-CAF sont illustrés dans la Fig. 1BA.
- Mélanger 1x10 6 cellules MCF-7-ras des cellules de carcinome du sein et 3x10 6 cellules GFP + puro R, fibroblastes mammaires humaines immortalisées généré en P2.2). Préparer les cellules dans 400 pi de milieu de culture avec 50% (v / v) Matrigel par injection.
- Injecter le mélange cellulaire sous-cutané dans une souris immunodéficientes nude. Lorsque les CAF sont extraites indépendamment par différentstumeurs, l'implant chaque mélange dans les flancs droit et gauche de plusieurs souris.
3b. L'injection de fibroblastes humains mammaires dans une souris immunodéficientes
- Pour générer les fibroblastes de lutte contre exp-CAF, préparer 3x10 6 cellules GFP + puro R fibroblastes mammaires humaines immortalisées généré en P2.2 dans 400 pi de milieu de culture avec 50% (v / v) Matrigel par injection (fig. 1BB). Ne pas mélanger les fibroblastes avec des cellules cancéreuses.
- Implant des fibroblastes préparés dans des sites sous-cutanés P3b.1 des souris nude.
* Notez que les fibroblastes inoculé formeront le tissu fibroblastique tumorale mais pas sous la peau.
4a. Dissection de xénogreffes de tumeurs
- Euthanasier la souris hébergeant une xénogreffe sous-cutanée humaine de cancer du sein 42 jours post-implantation (Fig. 1BA). * Notez que lorsque d'autres cellules de carcinome et / ou des fibroblastes sont coimplanted, Les fibroblastes peuvent avoir besoin d'être incubé pendant plus de 42 jours dans le xénogreffes de tumeurs de lancer leur phénotype myofibroblastique.
- Récolter les xénogreffes de tumeurs du flanc de la souris par dissection à l'aide de pinces et ciseaux. Immerger le tissu tumoral dans le PBS.
4b. Dissection de xénogreffe fibroblastes
- Euthanasier la souris porteuse de la xénogreffe fibroblastes 42 jours post-implantation (Fig. 1BB).
- Disséquer la xénogreffe sous-cutanée fibroblastes aide de pinces et de ciseaux. Placer le tissu fibroblastique dans le PBS. * Notez que la xénogreffe fibroblastes, qui apparaît comme un tissu minuscules transparente, peut être difficile à trouver sous la peau.
5. Préparation de cellules primaires en culture à partir xénogreffes
- Utilisez une armoire stériles biosécurité pour disséquer la tumeur (~ 0,5 gramme) ou d'un tissu fibroblastique (~ 0,1 gramme). Transférer les tissus excisés sur le sommet d'une culture de 15 cm dish avec 1 ml de PBS. Emincez les tissus en fragments de tissu (<1,5 mm 3) en utilisant des lames de rasoir stérile. * Notez que si la xénogreffe fibroblastes pèse moins de 0,1 gramme, de recueillir une xénogreffes quelques fibroblastes supplémentaires et de les mélanger ensemble pour augmenter le nombre de cellules pour l'isolement.
- Transfert des fragments de tissu dans un tube de 15 ml conique contenant la cellule tampon de dissociation (10 ml par 0,5 gramme de tissu) et le vortex pendant 1 min à vitesse maximale.
- Incuber la suspension cellulaire pendant 3 h à 37 ° C avec une agitation lente et continue.
6. L'isolement de la puromycine cellules résistantes à la culture
- Centrifuger la suspension cellulaire dissociée soit à partir de xénogreffes de tumeurs ou de fibroblastes pendant 5 min à 250 X g et remettre en suspension les cellules dans du PBS à granulés. Centrifuger à nouveau pendant 5 min à 250 g. X Reprendre le culot dans la cellule résultant 10% FCS-DMEM. Culture des cellules dans un plat de 15 cm de Pétri, en présence de puromycine (1 pg / ml) à 37 ° Cet de dioxyde de carbone de 5% afin d'éliminer tout contaminant cellules de carcinome et / ou les cellules stromales murines. Propager les cellules confluentes jusqu'à (2-4 semaines). Stocker les cellules à -80 ° C en utilisant un milieu de congélation. * Notez que la résultante puro cellules R, désigné 42 jours d'âge exp-CAF1 (fig. 1BA) ou le contrôle des fibroblastes-1 cellules (fig. 1BB), sont immortels et positive pour la GFP. Il est recommandé de vérifier si ces cellules produisent des virus actifs en utilisant 10T1 / 2, tel que décrit dans P2.3-6.
7a. Isolement des exp-CaF2 cellules en culture
Pour dynamiser davantage le phénotype activé myofibroblastique du CEFA, mélanger les 42 jours d'âge exp-CAF1 cellules avec MCF-7-ras cellules et les injecter à nouveau sous-cutanée dans une souris nude pour des périodes supplémentaires de 200 jours. Disséquer et dissocier les xénogreffes tumorales dans une suspension mono-culture de cellules et les cellules dans un plat de 15 cm de Pétri avec 10% de SVF-DMEM en présence de puromycine (1 pg / ml), comme indiqué dans P60.1. Propager les cellules confluentes jusqu'à ce (8-10 jours). Stocker les cellules à -80 ° C en utilisant un milieu de congélation. Le résultant R puro cellules sont nommées 242 jours d'âge exp-CaF2 cellules (fig. 1BA).
7b. Extraction de contrôle des fibroblastes-2 de cellules en culture
Pour générer les fibroblastes de lutte contre exp-CaF2 cellules, injecter de 42 jours, âgé de contrôle des fibroblastes-1 des cellules seules, sans cellules de carcinome sous-cutanée dans une souris nude de plus de 200 jours. Disséquer et dissocient le tissu fibroblastique dans une suspension cellulaire unique et la culture des cellules dans un plat de 15 cm de Pétri avec 10% de SVF-DMEM en présence de puromycine (1 pg / ml), comme indiqué dans P6.1. Propager les cellules confluentes jusqu'à (3-4 semaines). Stocker les cellules à -80 ° C en utilisant un milieu de congélation. Le résultant R puro cellules sont nommées fibroblastes-2 des cellules témoins (Fig. 1BB).
8. Les résultats représentatifs:
Contrôle des fibroblastes-2 et exp-CaF2 cells, qui ont été extraits de xénogreffes de tumeur du sein, teinté fortement positives pour les marqueurs mésenchymateux, y compris les humains spécifiques à la vimentine, prolyl-4-hydroxylase, le collagène 1A, la fibronectine, S100A4, et la protéine de surface des fibroblastes (Fig. 2A) 11, indiquant humaine origine et la nature de ces cellules mésenchymateuses. En revanche, la cytokératine, un marqueur des cellules épithéliales, n'a pas été souillé dans ces fibroblastes GFP + (figure 2B). Ces résultats suggèrent donc que la extraites exp-CaF2 et le contrôle des fibroblastes-2 cellules ont des parents originaires du fibroblastes humains mammaires initialement introduits dans les xénogreffes de souris.
Surtout, une proportion plus élevée de exp-CaF2 cellules colorées positives pour α-SMA et de la glycoprotéine de la matrice extracellulaire ténascine-C 5, qui sont tous deux marqueurs de myofibroblastes, comparativement à 42 jours d'âge exp-CAF1 et le contrôle des fibroblastes-2 cellules (Fig. . 2C, D) 11. Ces données indiquent que réside Fibr mammaires humainesoblasts évoluer progressivement en myofibroblastes CAF au sein de xénogreffes tumorales.

Représentation schématique figure 1 de l'isolement des fibroblastes humains mammaires. A) Le tissu a été haché mammoplastie de réduction en utilisant des lames de rasoir stérile (P1.2) et transféré dans un tube de 15 ml conique (P1.3). Les petits fragments de tissus ont été digérés dans la cellule tampon de dissociation (P1.4) et préparées pour la culture in vitro (P1.5-7). Pour immortaliser l'isolement primaire des fibroblastes mammaires, une pMIG rétroviraux (MSCV-IRES-GFP) vecteur, exprimant à la fois hTERT et la GFP, a été introduit, et la GFP-positives résultant cellules ont été triées par cytométrie en flux (P2.1). Un rétrovirus pBabe-puro vecteur codant pour un gène de résistance puromycine a été ensuite introduit dans ces cellules. Lors du traitement de puromycine, GFP-étiquetée (GFP +) puromycine-résistante (Puro R), immortalised humaine fibroblastes mammaires ont été isolés (P2.2).
Ba) Pour générer exp-CAF, la GFP + R puro humaines immortalisées fibroblastes mammaires ont été coinjected avec MCF-7-ras cellules de carcinome mammaire sous-cutanée dans une souris immunodéficientes nude (P3a). La xénogreffe tumorale a été réséqué à 42 jours après l'implantation (P4a) et dissocié en une suspension unicellulaire (P5). Ces cellules ont ensuite été cultivés in vitro en présence de puromycine afin d'éliminer tout contaminant et cellules de carcinome des cellules de souris stromales (P6). Le résultant puromycine cellules résistantes ont été qualifiées expérimentalement généré CAF1 (exp-CAF1) des cellules. Ces cellules, réséqué 42 jours post-implantation, ont été une nouvelle fois mélangé avec MCF-7-ras et les cellules implantées sous la peau dans une souris hôte comme avant (P7A). La tumeur résultant a été autorisé à se développer pour des périodes supplémentaires de 200 jours, puis disséquée, dissocié, et cultivés en présence de puromycine. Les isoléspuromycine cellules résistantes ont été qualifiées de exp-CaF2 cellules (242 jours d'âge).
Bb) pour isoler les cellules de lutte contre exp-CAF, la GFP + R puro humaines immortalisées fibroblastes mammaires ont été injectées par voie sous cutanée dans une souris nude comme des cultures pures, sans MCF-7-ras cellules (P3b). Le tissu fibroblastique, disséqués 42 jours post-implantation (P4b), a été dissocié en une seule cellule suspensions (P5) et puromycine cellules résistantes, nommé le contrôle des fibroblastes-1 des cellules, ont été isolés comme décrit précédemment (P6). Ces fibroblastes ont été une nouvelle fois implanté sous la peau dans une souris nude, sans MCF-7-ras cellules de plus de 200 jours (P7B). Le tissu fibroblastique a été disséqué, dissocié, et cultivés en présence de puromycine. Les isolés puromycine cellules résistantes ont été qualifiées de fibroblastes-2 des cellules témoins (242 jours d'âge).
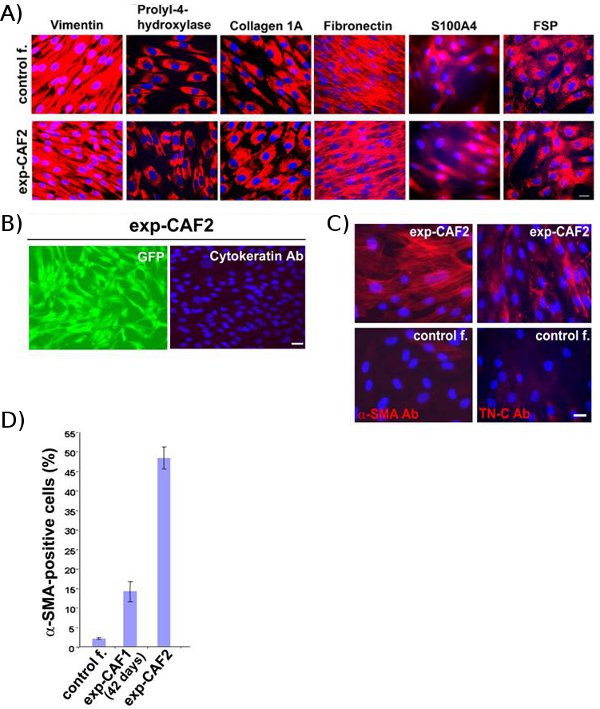
Figure 2 Exp-CAF et les fibroblastes de contrôle proviennent des parents humains fibroblastes mammaires. (A) analyses par immunofluorescence de contrôle des fibroblastes-2 (contrôle f.) et exp-CaF2 cellules. Les deux types de cellules positives pour les marqueurs de coloration mésenchymateuses (rouge), y compris les humains vimentine, prolyl-4-hydroxylase, le collagène 1A, la fibronectine, S100A4, et des protéines de surface des fibroblastes. (B) En revanche, le pan-cytokératine, un marqueur des cellules épithéliales , n'est pas détecté dans exp-CaF2 cellules exprimant la GFP (green). Noyaux cellulaires sont colorés avec des 4'-6-diamidino-2-phénylindole (DAPI) (bleu). La barre d'échelle, 50 um (référés par Kojima et al. 11)
(C) par immunofluorescence de cellules exp-CaF2 et le contrôle des fibroblastes-2 des cellules (commande f.) utilisant des anticorps contre α-SMA (rouge) ou la ténascine-C (TN-C) (rouge). Noyaux cellulaires sont colorés au DAPI (bleu). La barre d'échelle, 50 um. (D) 48% des exp-CaF2 cellules positives pour tache de α-SMA, alors une4% de 42-jours-vieille-exp CAF1 et 2,5% des populations de contrôler les cellules de fibroblastes-2 sont positifs pour α-SMA. (Référés par Kojima et al.11)
Discussion
Le manque de marqueurs spécifiques CAF et le niveau d'hétérogénéité observée entre les CAF rendent la caractérisation de ce type de cellule un défi en soi. CAF étudier in vitro a également été entravée par la complication supplémentaire que ces cellules sénescentes et arrêter la prolifération lorsqu'elles sont cultivées pendant une longue période. Notre tentative précédente pour immortaliser directement CAF primaires en utilisant une construction hTERT rétroviraux ADNc a ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions le Dr. Robert A. Weinberg (Whitehead Institute for Biomedical Research, Cambridge) pour son généreux soutien et la supervision de ce travail et M. Kieran Mellody (Université de Manchester, Manchester) pour l'édition critique de ce manuscrit. Ce projet a été soutenu par la recherche au Royaume-Uni (CR-Royaume-Uni) le numéro de subvention C147/A6058 (AO)
matériels
| Nom du produit | Tapez | Société | Numéro de catalogue | Commentaire |
| DMEM | Invitrogen | 61965-026 | ||
| Sérum de veau fœtal | GIBCO | 10270 | ||
| La pénicilline-streptomycine | Invitrogen | 15140-122 | ||
| Collagénase de type I | Sigma | C0130-1G | ||
| hyaluronidase | Sigma | H4272 | ||
| Vimentine (V9) antibody | Laboratoires Novocastra | NCL-L- VIM-V9 | ||
| La ténascine C (BC-8) antibody | un don de | |||
| α-SMA-Cy3 (1A4) antibody | Sigma | C6198 | ||
Prolyl-4-hydroxylase | Dako | M0877 | ||
| (5B5) antibody | ||||
| Collagène type1 1A anticorps | Sigma | HPA011795 | ||
| Pan-cytokératine d'anticorps | Sigma | C5992 | ||
| D'anticorps fibronectine | BD Biosciences | 610077 | ||
S100A4/FSP-1 (fibroblastes protein-1 spécifiques) antibody | Dako | A5114 | ||
Protéine de surface des fibroblastes (Clone 1B10) antibody | Abcam | ab11333 | ||
| MSCV-IRES-GFP | Demander aux auteurs de la | |||
| pBabe-puro construire | Achat à partir Addgene | |||
| Puromycine | Sigma | P8833 | ||
| DAPI | Sigma | D9564 | ||
| 15 ml tube conique | Corning | 430766 | ||
| Souris nude | Taconic | NCRNU-F | Femme nue RCN | |
| C3H/10T1/2 cellules | ATCC | CCL-226 |
Références
- Ronnov-Jessen, L., Bissell, M. J. Breast cancer by proxy: can the microenvironment be both the cause and consequence?. Trends Mol. Med. 15, 5-13 (2009).
- Mueller, M. M., Fusenig, N. E. Friends or foes - bipolar effects of the tumour stroma in cancer. Nat. Rev. Cancer. 4, 839-849 (2004).
- Bhowmick, N. A., Neilson, E. G., Moses, H. L. Stromal fibroblasts in cancer initiation and progression. Nature. 432, 332-337 (2004).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat. Rev. Cancer. 6, 392-401 (2006).
- De Wever, O. Tenascin-C and SF/HGF produced by myofibroblasts in vitro provide convergent pro-invasive signals to human colon cancer cells through RhoA and Rac. 18, 1016-1018 (2004).
- Serini, G., Gabbiani, G. Mechanisms of myofibroblast activity and phenotypic modulation. Exp. Cell. Res. 250, 273-283 (1999).
- Shimoda, M., Mellody, K. T., Orimo, A. Carcinoma-associated fibroblasts are a rate-limiting determinant for tumour progression. Semin. Cell. Dev. Biol. 21, 19-25 (2010).
- Pietras, K., Ostman, A. Hallmarks of cancer: interactions with the tumor stroma. Exp. Cell. Res. 316, 1324-1331 (2010).
- Polyak, K., Haviv, I., Campbell, I. G. Co-evolution of tumor cells and their microenvironment. Trends in Genetics. 25, 30-38 (2009).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Semin. Cell. Dev. Biol. 21, 33-39 (2010).
- Kojima, Y. Autocrine TGF-beta and stromal cell-derived factor-1 (SDF-1) signaling drives the evolution of tumor-promoting mammary stromal myofibroblasts. Proc. Natl. Acad. Sci. U. S. A. 107, 20009-20014 (2010).
- Orimo, A. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell. 121, 335-348 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon