Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экспериментальные Генерация Карцинома-Associated Фибробласты (CAFS) из молочной железы человека Фибробласты
В этой статье
Резюме
Карцинома связанных фибробластов (CAFS) богаты миофибробластов присутствует в опухоли стромы, играют важную роль в продвижении опухолевой прогрессии. Мы разработали xengraft coimplantation опухоли модель экспериментально генерации CAFS из молочной железы человека фибробластов. Протокол описывает, как установить CAF миофибробластов, которые приобретают способность продвигать tumourigenesis.
Аннотация
Carcinomas are complex tissues comprised of neoplastic cells and a non-cancerous compartment referred to as the 'stroma'. The stroma consists of extracellular matrix (ECM) and a variety of mesenchymal cells, including fibroblasts, myofibroblasts, endothelial cells, pericytes and leukocytes 1-3.
The tumour-associated stroma is responsive to substantial paracrine signals released by neighbouring carcinoma cells. During the disease process, the stroma often becomes populated by carcinoma-associated fibroblasts (CAFs) including large numbers of myofibroblasts. These cells have previously been extracted from many different types of human carcinomas for their in vitro culture. A subpopulation of CAFs is distinguishable through their up-regulation of α-smooth muscle actin (α-SMA) expression4,5. These cells are a hallmark of 'activated fibroblasts' that share similar properties with myofibroblasts commonly observed in injured and fibrotic tissues 6. The presence of this myofibroblastic CAF subset is highly related to high-grade malignancies and associated with poor prognoses in patients.
Many laboratories, including our own, have shown that CAFs, when injected with carcinoma cells into immunodeficient mice, are capable of substantially promoting tumourigenesis 7-10. CAFs prepared from carcinoma patients, however, frequently undergo senescence during propagation in culture limiting the extensiveness of their use throughout ongoing experimentation. To overcome this difficulty, we developed a novel technique to experimentally generate immortalised human mammary CAF cell lines (exp-CAFs) from human mammary fibroblasts, using a coimplantation breast tumour xenograft model.
In order to generate exp-CAFs, parental human mammary fibroblasts, obtained from the reduction mammoplasty tissue, were first immortalised with hTERT, the catalytic subunit of the telomerase holoenzyme, and engineered to express GFP and a puromycin resistance gene. These cells were coimplanted with MCF-7 human breast carcinoma cells expressing an activated ras oncogene (MCF-7-ras cells) into a mouse xenograft. After a period of incubation in vivo, the initially injected human mammary fibroblasts were extracted from the tumour xenografts on the basis of their puromycin resistance 11.
We observed that the resident human mammary fibroblasts have differentiated, adopting a myofibroblastic phenotype and acquired tumour-promoting properties during the course of tumour progression. Importantly, these cells, defined as exp-CAFs, closely mimic the tumour-promoting myofibroblastic phenotype of CAFs isolated from breast carcinomas dissected from patients. Our tumour xenograft-derived exp-CAFs therefore provide an effective model to study the biology of CAFs in human breast carcinomas. The described protocol may also be extended for generating and characterising various CAF populations derived from other types of human carcinomas.
протокол
1. Изоляция первичной культивированных человеческих фибробластов нормальной молочной
Экспериментальные процедуры выделения первичных культивированных человеческих фибробластов нормальной молочной приводятся на рис. 1А.
- Подготовка буфера клеточной диссоциации, как описано выше 12: Средний Дульбеко изменения Орла (DMEM) с 10% эмбриональной телячьей сыворотки (FCS), пенициллин-стрептомицина (200 ед / мл), коллагеназы типа I (1 мг / мл) и гиалуронидазы ( 125 единиц / мл).
- Вымойте ткань молочной железы от расчлененного сокращение маммопластика (~ 0,5 г) несколько раз в фосфатном буферном растворе (PBS). Фарш ткань на мелкие фрагменты (<1,5 мм 3), используя стерильные лезвия бритвы.
- Передача фрагментов тканей в 15 мл коническую трубку с соответствующим количеством выше клеточной диссоциации буфера (10 мл за 0,5 грамм ткани) и вихрь в течение 1 мин при максимальной скорости.
- Дайджест фрагментов тканей в клеточной диссоциации буфера еили 12-18 часов при 37 ° С при медленном перемешивании. * Обратите внимание, что там будет еще много частей непереваренных фрагментов тканей, оставшихся в трубе.
- Инкубируйте пробирку в течение 5 мин при комнатной температуре без перемешивания. Трансфер в результате стромальных клеток обогащенного супернатант в новую коническую трубку с использованием 5 мл серологические пипетки.
- Центрифуга стромальных доли в течение 5 мин при 250 Х г и ресуспендируют осадок клеток в PBS. Центрифуга снова в течение 5 мин при 250 Х г и ресуспендируют осадок клеток в DMEM с добавлением 10% FCS. Культуры клеток в DMEM, содержащей 10% FCS в 15 см блюдо Петри при 37 ° С и 5% углекислого газа.
- Размножаются клетки до сливной. Обычно этот процесс занимает 8-10 дней. Магазин клетки при -80 ° С с использованием замораживания среды (10% диметилсульфоксида и 20% FCS в DMEM). Подготовка 5 замороженных флаконов в качестве оригинального состава. Оттепель один флакон и расширить клетки подготовить 5 ампул для вторичного фондового содержащих фибробласты пассировать в течение 5 населенияудвоений (PD) для последующих экспериментов. Эти процедуры минимизации клональной селекции и культуры стресса, которые могут возникнуть при длительном культуры ткани. * Обратите внимание, что P1.1-7 также может быть использован для выделения CAFS из молочной железы получены мастэктомии 12.
2. Генерация GFP-маркированы, пуромицин материалы, увековечил человека нормальной молочной фибробласты
- Чтобы увековечить первичных человеческих фибробластов нормальной молочной изолированы в P1.7), ввести ретровирусных pMIG (MSCV-IRES-GFP) вектора 12, выражая как hTERT и GFP. Культура клетки в течение 4-5 дней, а затем отсортировать GFP-положительных клеток методом проточной цитометрии.
- Ввести ретровирусных pBabe-Пуро построить кодирования генов пуромицин сопротивления в GFP-меченых увековечены фибробластов. Культура клетки в течение 5-7 дней при наличии пуромицин (конечная концентрация: 1 мкг / мл), чтобы изолировать GFP-положительных (GFP +), пуромицин устойчивостью (Puro R ) увековечены молочной железы человека фибробластов.
- Далее, чтобы изучить, являются ли эти фибробласты производят активные вирусы, которые могут привести к горизонтальный перенос генов, кодирующих GFP и пуромицин сопротивления, растут 2.5x10 5 GFP + R Puro увековечены молочной железы человека фибробластов в 6 см чашку Петри на 2 дня.
- Фильтрующего материала обусловлена этих фибробластов при помощи шприца фильтром (размер пор: 0,45 мкм) и добавить его на 10T1 / 2 мыши фибробластов клеток для 12 часов в присутствии протамина сульфата (5 мкг / мл), что повышает эффективность вирусной инфекции. Среда затем изменен на 10% FCS-DMEM дополнительных 2 дней.
- Изучение клетки флуоресцентной микроскопии. 10T1 / 2 клетки, инфицированные вирусом GFP станет GFP-положительных. Лечить также клетки с пуромицином (1 мкг / мл) в течение 5-7 дней и наблюдать табличку, если какой-либо Puro R 10T1 / 2 клетки присутствуют и форме колоний после пуромицин лечения.
- Обратите внимание, что горизонтальные гена переходыSFER активными вирусами производства родительских GFP + R Puro молочной железы человека фибробласты могут сделать окружающие мышиных клеток и / или опухолевых клеток GFP + R Puro в опухоли ксенотрансплантаты. Это может затруднить процесс выделения изначально вводили GFP + R Puro молочной железы человека фибробластов из опухоли ксенотрансплантаты.
3a. Инжекции из молочной железы человека фибробластов с клетками карциномы молочной железы в иммунодефицитных мышей
Экспериментальные процедуры для генерации ехр-CAFS показаны на рис. 1BA.
- Смешайте 1x10 6 MCF-7-РАН карциномы молочной железы человека и клетки 3x10 6 GFP + R Puro, увековечены молочной железы человека фибробластов генерируется в P2.2). Подготовка клеток в 400 мкл культуральной среде с 50% (объем / объем) Матригель на инъекцию.
- Inject Смесь клеток подкожно в обнаженном иммунодефицитных мышей. Когда CAFS извлекаются независимо от различныхопухолями, насадить каждой смеси в правый и левый фланги нескольких мышей.
3b. Инъекция молочной железы человека фибробластов в иммунодефицитных мышей
- Для создания контроль фибробластов против ехр-CAFS, готовить 3х10 6 GFP + R Puro увековечены молочной железы человека фибробластов генерируется в P2.2 в 400 мкл культуральной среде с 50% (объем / объем) Матригель на инъекцию (рис. 1BB). Не смешивайте с фибробласты клетки карциномы.
- Имплантат фибробластов подготовлен в P3b.1 на участки подкожной голым мышам.
* Обратите внимание, что прививка фибробласты образуют фибробластов ткани, но не опухоли под кожей.
4а. Препарирование опухоли ксенотрансплантата
- Euthanise мыши укрывательство груди подкожной рака у человека ксенотрансплантата 42 дней после имплантации (рис. 1BA). * Обратите внимание, что, когда другие клетки карциномы и / или фибробласты coimplanted, Фибробласты, возможно, придется инкубировали в течение больше чем 42 дней в течение опухоли ксенотрансплантата инициировать их myofibroblastic фенотипа.
- Урожай опухоли ксенотрансплантата с фланга мыши, тупой диссекции использованием щипцы и ножницы. Погрузитесь опухолевой ткани в PBS.
4б. Препарирование фибробластов ксенотрансплантата
- Euthanise мыши укрывательство фибробластов ксенотрансплантата 42 дней после имплантации (рис. 1BB).
- Рассеките ксенотрансплантата подкожных фибробластов использованием щипцы и ножницы. Место фибробластов ткани в PBS. * Обратите внимание, что фибробласты ксенотрансплантата, который выглядит как крошечная прозрачная ткань, возможно, будет трудно найти под кожу.
5. Подготовка первичной культуре клеток из ксенотрансплантаты
- Используйте стерильный кабинет биобезопасности препарировать опухоли (~ 0,5 г) или фибробластов тканей (~ 0,1 грамм). Передача изолированных тканей на вершину 15 см культуры гиш с 1 мл PBS. Фарш тканей на небольшие фрагменты ткани (<1,5 мм 3), используя стерильные лезвия бритвы. * Заметим, что если фибробластов ксенотрансплантата весит менее 0,1 грамма, собрать несколько дополнительных ксенотрансплантаты фибробластов и смешать их вместе, чтобы увеличить количество клеток для изоляции.
- Передача фрагментов тканей в 15 мл коническую трубку с клеточной диссоциации буфера (10 мл за 0,5 грамм ткани) и вихрь в течение 1 мин при максимальной скорости.
- Инкубируйте клеточной суспензии в течение 3 ч при температуре 37 ° С при непрерывном медленном перемешивании.
6. Выделение пуромицин-резистентных клеток в культуре
- Центрифуга клеточную суспензию диссоциированных либо из опухоли или фибробластов ксенотрансплантата в течение 5 мин при 250 Х г и ресуспендируют осадок клеток в PBS. Центрифуга снова в течение 5 мин при 250 X g. Ресуспендируют результате осадок клеток в 10% FCS-DMEM. Культуры клеток в 15 см блюдо Петри в присутствии пуромицин (1 мкг / мл) при 37 ° Cи 5% углекислого газа с целью устранения любых загрязняющих карциномы клеток и / или мышиных стромальных клеток. Размножаются клетки до сливной (2-4 недели). Магазин клетки при -80 ° С с использованием замораживания среды. * Обратите внимание, что в результате Puro R клетки, назначенного 42-дневного возраста ехр-CAF1 (рис. 1BA) или контроля фибробластов-1 клеток (рис. 1BB), бессмертны и положительные для GFP. Рекомендуется, чтобы проверить, если эти клетки вырабатывают активные вирусы, использующие 10T1 / 2 клетки, как это описано в P2.3-6.
7а. Выделение ехр-CAF2 клеток в культуре
Для дальнейшего повышения активированного myofibroblastic фенотип CAFS, смешайте 42-дневных ехр-CAF1 клеток MCF-7-клетки РАН и ввести их снова подкожно в обнаженном мыши на дополнительные периоды в 200 дней. Препарировать и отделить опухоль ксенотрансплантата в одной клеточной суспензии и культуре клеток в 15 см чашки Петри с 10% FCS-DMEM в присутствии пуромицин (1 мкг / мл), как указано в P6.1. Размножаются клетки до сливной (8-10 дней). Магазин клетки при -80 ° С с использованием замораживания среды. В результате Puro R клетки называются 242-дневных ехр-CAF2 клеток (рис. 1BA).
7б. Добыча контроль фибробластов-2 клеток в культуре
Для создания контроль фибробластов против ехр-CAF2 клеток, вводят 42-дневных контроль фибробластов-1 клетки в одиночку без клетки карциномы подкожно в обнаженном мышь дополнительно в течение 200 дней. Препарировать и отделить фибробластов ткани в суспензии отдельных клеток и культура клеток в 15 см чашки Петри с 10% FCS-DMEM в присутствии пуромицин (1 мкг / мл), как указано в P6.1. Размножаются клетки до сливной (3-4 недели). Магазин клетки при -80 ° С с использованием замораживания среды. В результате Puro R клетки называются контроль фибробластов-2 клеток (рис. 1BB).
8. Представитель Результаты:
Управление фибробластов-2 и ехр-CAF2 челLS, которые были извлечены из ксенотрансплантаты опухоли молочной железы, витражи сильно положительным для мезенхимальных маркеров, в том числе человека конкретных виментин, пролил-4-гидроксилазы, коллагена 1А, фибронектина S100A4 и фибробластов поверхностного белка (рис. 2) 11, что указывает на человека происхождения и мезенхимальных природе этих клеток. В противоположность этому, цитокератин, маркер эпителиальных клеток, не окрашенные в эти GFP + фибробластов (рис. 2В). Эти результаты позволяют предположить, что таким образом извлеченный ехр-CAF2 и контроля фибробластов-2 клетки, происходит от родительской молочной железы человека фибробластов первоначально введен в мышь ксенотрансплантаты.
Важно отметить, что высокая доля ехр-CAF2 клеток, окрашенных положительным для α-SMA и внеклеточной матрицы tenascin гликопротеин-C 5, оба из которых являются маркерами миофибробластов по сравнению с 42-дневных ехр-CAF1 и контроля фибробластов-2 клетки (рис. . 2C, D) 11. Эти данные свидетельствуют о том, что резидент молочной железы человека ФиБробластей постепенно эволюционировать в миофибробласты CAF в опухоли ксенотрансплантаты.

Рисунок 1 Схема выделения молочной железы человека фибробластов. ) Тканей сокращение маммопластика была фарш стерильные лезвия бритвы (P1.2) и переносили в 15 мл коническую трубку (P1.3). Небольшие фрагменты ткани перевариваются в клеточной диссоциации буфер (Р1.4) и подготовлены к культуре в пробирке (P1.5-7). Чтобы увековечить изолированных первичных молочной железы человека фибробластов, ретровирусные pMIG (MSCV-IRES-GFP) вектора, выражая как hTERT и GFP, был введен, и в результате GFP-положительных клеток были отсортированы с использованием проточной цитометрии (P2.1). Ретровирусных pBabe-Пуро вектора, кодирующего ген пуромицин сопротивление затем вводится в этих клетках. После лечения пуромицина, GFP-меченых (GFP +) пуромицин устойчивостью (Puro R), immortaliSED молочной железы человека фибробласты были выделены (P2.2).
Ba) Для создания ехр-CAFS, GFP + R Puro увековечены молочной железы человека фибробласты coinjected с MCF-7-РАН клетки карциномы молочной железы подкожно в обнаженном иммунодефицитных мышей (P3A). Опухоль была ксенотрансплантата резекции на 42 дней после имплантации (P4a) и распадается на одной клеточной суспензии (С-5). Эти клетки затем культивировали в пробирке при наличии пуромицин, чтобы устранить любые загрязняющие клетки карциномы и мышь стромальных клеток (P6). В результате пуромицин-резистентные клетки были названы экспериментально порожденных CAF1 (ехр-CAF1) клеток. Эти клетки, резекция 42 дней после имплантации, еще раз смешать с MCF-7-клетки РАН и имплантируется подкожно в хост мыши как и раньше (P7a). В результате опухоли могут расти на дополнительные периоды в 200 дней, затем рассеченные, диссоциированных, и культивировали в присутствии пуромицин. Изолированыпуромицин-резистентные клетки были названы ехр-CAF2 клетки (242-дневных).
Bb) Чтобы изолировать контроль клетки от ехр-CAFS, GFP + R Puro увековечены молочной железы человека фибробластов вводили подкожно в обнаженном мышь, как чистых культур без MCF-7-РАН клеток (P3B). Фибробластов ткани, расчлененный 42 дней после имплантации (P4B), был распадается на одноклеточных суспензий (С-5) и пуромицин-резистентные клетки, названные контроль фибробластов-1 клеток, были изолированы, как описано ранее (P6). Эти фибробласты были вновь имплантировали подкожно в обнаженном мыши без MCF-7-клетки РАН дополнительно в течение 200 дней (P7B). Фибробластов ткани рассеченные, диссоциированных, и культивировали в присутствии пуромицин. Изолированных пуромицину резистентные клетки были названы контроль фибробластов-2 клетки (242-дневных).
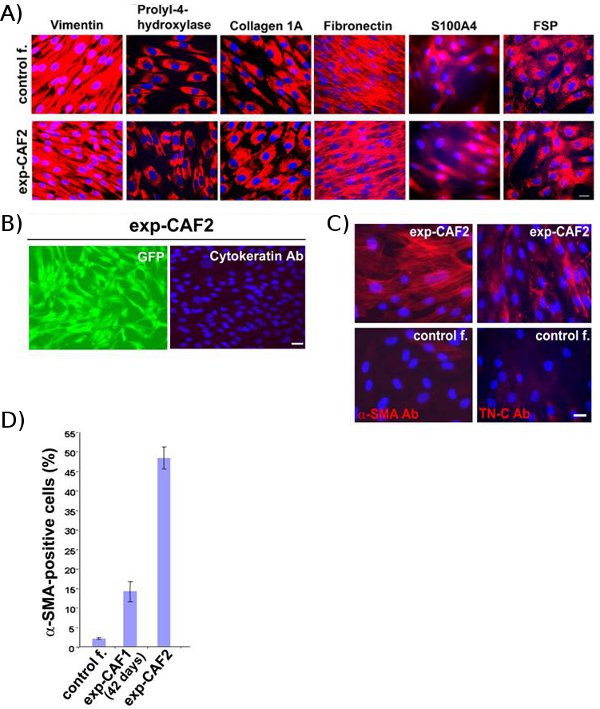
Рисунок 2 Взр-CAFS и контроль фибробластов происходят из родительского молочной железы человека фибробластов. (А) иммунофлуоресценции анализа управления фибробластов-2 (контроль f.) и ехр-CAF2 клеток. Обоих типов клеток пятно положительным для мезенхимальных маркеров (красный), в том числе человека виментин, пролил-4-гидроксилазы, коллагена 1А, фибронектина S100A4, и белок фибробластов поверхности. (В) С другой стороны, пан-цитокератин, маркер эпителиальных клеток , не обнаружен в ехр-CAF2 клеток, экспрессирующих GFP (зеленый). Сотовые ядер окрашивали 4'-6-Diamidino-2-фенилиндола (DAPI) (синий). Шкала бар, 50 мкм (далее от Kojima и соавт. 11)
(C) иммунофлуоресценции ехр-CAF2 клеток и фибробластов контроль-2 клеток (контроль f.) с использованием антител против α-SMA (красный) или tenascin-C (TN-C) (красный). Сотовые ядер окрашивали DAPI (синий). Шкала бар, 50 мкм. (D) 48% от ехр-CAF2 клетки пятно положительным для α-SMA, а 14% из 42-дневных ехр-CAF1 и 2,5% в контрольной фибробластов-2 клеточных популяций являются позитивными для α-SMA. (Ссылка на эту Кодзима и др. al.11)
Обсуждение
Отсутствие CAF-специфических маркеров и уровень неоднородности наблюдается среди CAFS оказывают характеристики этого типа клеток задача сама по себе. Изучение CAFS в пробирке была также затруднена дополнительные сложности, что эти клетки стареть и остановить пролиферирующих когда к?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим д-р Роберт А. Вайнберга (Уайтхед Институт медико-биологических исследований, Кембридж) за щедрую поддержку и надзор за этой работой и г-н Киран Mellody (Манчестерский университет, Манчестер) для критических редактирование этой рукописи. Этот проект был поддержан исследований Великобритании (CR-Великобритания) номер гранта C147/A6058 (АО)
Материалы
| Материал Имя | Тип | Компания | Номер по каталогу | Комментарий |
| DMEM | Invitrogen | 61965-026 | ||
| Фетальной телячьей сыворотки | GIBCO | 10270 | ||
| Пенициллин-стрептомицин | Invitrogen | 15140-122 | ||
| Коллагеназы типа I. | Сигма | C0130-1G | ||
| гиалуронидазы | Сигма | H4272 | ||
| Виментин (V9) антител | Novocastra лаборатории | NCL-L- ВИМ-V9 | ||
| Tenascin C (БК-8) антител | подарок от | |||
| α-SMA-Cy3 (1А4) антител | Сигма | C6198 | ||
Пролил-4-гидроксилазы | Dako | M0877 | ||
| (5B5) антител | ||||
| Коллаген type1 1A антител | Сигма | HPA011795 | ||
| Пан-цитокератин антител | Сигма | C5992 | ||
| Фибронектин антител | BD Biosciences | 610077 | ||
S100A4/FSP-1 (фибробластов- специфического белка-1) антител | Dako | A5114 | ||
Белок фибробластов поверхности (Клон 1B10) антител | Abcam | ab11333 | ||
| MSCV-IRES-GFP построить | Просьба к авторам | |||
| pBabe-Пуро построить | Покупка от Addgene | |||
| Пуромицин | Сигма | P8833 | ||
| DAPI | Сигма | D9564 | ||
| 15 мл коническую трубку | Гранулирование | 430766 | ||
| Обнаженная мыши | Taconic | NCRNU-F | Женский NCr обнаженной | |
| C3H/10T1/2 клетки | АТСС | CCL-226 |
Ссылки
- Ronnov-Jessen, L., Bissell, M. J. Breast cancer by proxy: can the microenvironment be both the cause and consequence?. Trends Mol. Med. 15, 5-13 (2009).
- Mueller, M. M., Fusenig, N. E. Friends or foes - bipolar effects of the tumour stroma in cancer. Nat. Rev. Cancer. 4, 839-849 (2004).
- Bhowmick, N. A., Neilson, E. G., Moses, H. L. Stromal fibroblasts in cancer initiation and progression. Nature. 432, 332-337 (2004).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat. Rev. Cancer. 6, 392-401 (2006).
- De Wever, O. Tenascin-C and SF/HGF produced by myofibroblasts in vitro provide convergent pro-invasive signals to human colon cancer cells through RhoA and Rac. 18, 1016-1018 (2004).
- Serini, G., Gabbiani, G. Mechanisms of myofibroblast activity and phenotypic modulation. Exp. Cell. Res. 250, 273-283 (1999).
- Shimoda, M., Mellody, K. T., Orimo, A. Carcinoma-associated fibroblasts are a rate-limiting determinant for tumour progression. Semin. Cell. Dev. Biol. 21, 19-25 (2010).
- Pietras, K., Ostman, A. Hallmarks of cancer: interactions with the tumor stroma. Exp. Cell. Res. 316, 1324-1331 (2010).
- Polyak, K., Haviv, I., Campbell, I. G. Co-evolution of tumor cells and their microenvironment. Trends in Genetics. 25, 30-38 (2009).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Semin. Cell. Dev. Biol. 21, 33-39 (2010).
- Kojima, Y. Autocrine TGF-beta and stromal cell-derived factor-1 (SDF-1) signaling drives the evolution of tumor-promoting mammary stromal myofibroblasts. Proc. Natl. Acad. Sci. U. S. A. 107, 20009-20014 (2010).
- Orimo, A. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell. 121, 335-348 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены