È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione sperimentale di carcinoma-Associated fibroblasti (CAF) da fibroblasti umani mammari
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Carcinoma associato fibroblasti (CAF), ricco di miofibroblasti presenti nello stroma del tumore, svolgono un ruolo importante nel guidare la progressione del tumore. Abbiamo sviluppato un tumore modello coimplantation xengraft per generare sperimentalmente CAF da fibroblasti umani mammaria. Il protocollo descrive come stabilire miofibroblasti CAF che acquisiscono la capacità di promuovere la tumorigenesi.
Abstract
I carcinomi sono i tessuti complesso composto di cellule neoplastiche e non-cancerosa comparto denominato 'stroma'. Lo stroma è costituito da matrice extracellulare (ECM) e una varietà di cellule mesenchimali, tra cui fibroblasti, miofibroblasti, cellule endoteliali, periciti e leucociti 1-3.
Il tumore-associati stroma è sensibile a sostanziali segnali paracrini rilasciati da cellule di carcinoma vicine. Durante il processo della malattia, lo stroma diventa spesso popolato da carcinoma associato fibroblasti (CAF), tra cui un gran numero di miofibroblasti. Queste cellule sono stati precedentemente estratti da diversi tipi di carcinomi umani per la loro cultura in vitro. Una sottopopolazione di CAF si distingue attraverso la loro up-regulation di α-actina del muscolo liscio (α-SMA) espressione 4,5. Queste cellule sono un marchio di garanzia 'fibroblasti attivati' che condividono proprietà similari con miofibroblasti commonly osservato nei tessuti fibrotici feriti e 6. La presenza di questo sottoinsieme myofibroblastic CAF è fortemente legate ad alto grado di malignità e associata a prognosi non favorevole nei pazienti.
Molti laboratori, compreso il nostro, hanno dimostrato che la CAF, una volta iniettato con cellule di carcinoma in topi immunodeficienti, sono in grado di promuovere sostanzialmente tumorigenesi 7-10. CAF preparato da pazienti carcinoma, però, frequentemente sottoposti a senescenza durante la propagazione della cultura limitare la vastità del loro utilizzo per tutta la sperimentazione in corso. Per superare questa difficoltà, abbiamo sviluppato una nuova tecnica per generare sperimentalmente immortalato umano mammario linee cellulari CAF (exp-CAF) da fibroblasti umani mammari, utilizzando un modello di tumore al seno coimplantation xenotrapianto.
Al fine di generare exp-CAF, dei genitori fibroblasti umani mammari, ottenute dal tessuto mastoplastica riduttiva, sono stati Immortalised con hTERT, la subunità catalitica della telomerasi oloenzima, e progettato per esprimere la GFP e un gene di resistenza puromicina. Queste cellule sono state coimplanted con cellule MCF-7 di carcinoma mammario umano esprime un oncogene attivato ras (MCF-7-ras cellule) in caso di trapianto di mouse. Dopo un periodo di incubazione in vivo, inizialmente iniettato fibroblasti umani mammari sono stati estratti dal xenotrapianti tumorali sulla base della loro resistenza puromicina 11.
Abbiamo osservato che il residente fibroblasti umani mammari hanno differenziato, l'adozione di un fenotipo tumorale myofibroblastic e acquisiti di promozione proprietà nel corso della progressione del tumore. È importante sottolineare che queste cellule, definite come exp-CAF, in stretta imitare il tumore di promozione fenotipo myofibroblastic del CAF isolate da carcinomi del seno sezionato dai pazienti. Il nostro tumore xenotrapianto-derivato exp-CAF quindi fornire un modello efficace per studiare la biologia del CAF in BREAS umanot carcinomi. Il protocollo descritto può essere esteso anche per la generazione e la caratterizzazione varie popolazioni CAF derivate da altri tipi di carcinomi umani.
Protocollo
1. Isolamento di fibroblasti umani in coltura primaria mammaria normale
Procedure sperimentali per isolare fibroblasti umani in coltura primaria mammaria normale, sono illustrate nella fig. 1A.
- Preparare il tampone di cellule dissociazione, come descritto in precedenza 12: Media Dulbecco Modified Eagle (DMEM) con 10% di siero fetale bovino (FCS), penicillina-streptomicina (200 unità / ml), collagenasi di tipo I (1 mg / ml) e ialuronidasi ( 125 unità / ml).
- Lavare il tessuto del seno sezionato da una mastoplastica riduttiva (~ 0,5 grammi), più volte in tampone fosfato (PBS). Tritare il tessuto in piccoli frammenti (<1,5 mm 3) con lame di rasoio sterile.
- Trasferire i frammenti di tessuto in un tubo da 15 ml contenente una quantità appropriata di quanto sopra cellula dissociazione tampone (10 ml per 0,5 grammo di tessuto) e vortex per 1 minuto alla massima velocità.
- Digerire i frammenti di tessuto nella cella di dissociazione buffer di fo 12-18 ore a 37 ° C con agitazione lenta. * Nota che ci saranno ancora molti pezzi di frammenti di tessuto digerito ancora nel tubo.
- Incubare la provetta per 5 minuti a temperatura ambiente senza agitazione. Trasferire il risultante delle cellule stromali arricchito surnatante in un nuovo tubo conico con una pipetta da 5 ml sierologici.
- Centrifugare la frazione stromale per 5 minuti a 250 g X e risospendere il pellet di cellule in PBS. Centrifugare ancora per 5 minuti a 250 g X e risospendere il pellet cellulare in DMEM supplementato con 10% FCS. Coltivare le cellule in DMEM contenente 10% FCS in una capsula di Petri cm 15 a 37 ° C e l'anidride carbonica del 5%.
- Propagare le celle fino confluenti. E 'norma compresi tra i 8-10 giorni. Conservare le cellule a -80 ° C con media di congelamento (10% dimetilsolfossido e il 20% di FCS in DMEM). Preparare 5 flaconcini congelato come uno stock originale. Scongelare un flaconcino ed espandere le cellule per preparare 5 flaconi per lo stock secondario contenente fibroblasti diversi passaggi entro 5 della popolazioneraddoppi (PD) per gli esperimenti successivi. Queste procedure minimizzare selezione clonale e lo stress della cultura che potrebbero verificarsi durante coltura tissutale esteso. * Nota che P1.1-7 può essere utilizzato anche per l'isolamento CAF da carcinoma mammario ottenuto da una mastectomia 12.
2. Generazione di GFP-etichettata, puromicina resistente, immortalata fibroblasti umani normali mammaria
- Per immortalare il primario fibroblasti umani mammaria normale, isolato in P1.7), introdurre un retrovirale pMIG (MSCV-IRES-GFP) vettore di 12, che esprime sia hTERT e GFP. Coltivare le cellule per 4-5 giorni e quindi ordinare la GFP-positive cellule citometria a flusso.
- Introdurre un retrovirale pBabe-puro costruire la codifica di un gene di resistenza puromicina nei fibroblasti immortalato GFP-etichettati. Coltivare le cellule per 5-7 giorni in presenza di puromicina (concentrazione finale: 1 mg / ml) per isolare la GFP-positive (GFP +), puromicina-resistente (puro R ) immortalato umano fibroblasti mammari.
- Successivamente, esaminare se questi fibroblasti producono virus attivo, che può portare al trasferimento orizzontale di geni che codificano GFP e la resistenza puromicina, crescere 2.5x10 5 GFP + puro R immortalato umano fibroblasti mammari in una capsula di Petri 6 centimetri per 2 giorni.
- Mezzo filtrante condizionata da questi fibroblasti utilizzando un filtro siringa (dimensione dei pori: 0,45 micron) e aggiungerlo su 10T1 / 2 cellule di topo fibroblastica per 12h in presenza di solfato di protamina (5 mg / ml), che aumenta l'efficienza della infezione da virus. Il mezzo è poi cambiato al 10% FCS-DMEM per ulteriori 2 giorni.
- Esaminare le cellule da un microscopio a fluorescenza. 10T1 / 2 cellule infettate da virus GFP diventerà GFP-positive. Trattare anche le cellule con puromicina (1 mg / ml) per 5-7 giorni e osservare la piastra se puro R 10T1 / 2 colonie di cellule sono presenti e formano dopo il trattamento puromicina.
- Si noti che il gene orizzontale transfer da virus attivo prodotto dalla GFP genitori + puro R fibroblasti umani mammari potrebbe rendere le cellule circostanti murino e / o cellule di carcinoma puro GFP + R entro xenotrapianti tumorali. Ciò può ostacolare i processi di isolare il GFP + inizialmente iniettato puro R fibroblasti umani mammari dal xenotrapianti tumorali.
3 bis. Co-iniezione di fibroblasti umani con cellule di carcinoma mammario nel seno di un mouse immunodeficienti
Procedure sperimentali per la generazione di exp-CAF sono illustrati nella fig. 1BA.
- Mix 1x10 6 MCF-7-ras cellule umane di carcinoma mammario e 3x10 6 GFP + R puro, immortalate fibroblasti umani mammaria generata in P2.2). Preparare le cellule in 400 ml di terreno di coltura con il 50% (v / v) Matrigel per iniezione.
- Iniettare la miscela di cellule per via sottocutanea in un mouse immunodeficienti nudo. Quando CAF sono estratti in modo indipendente da diversitumori, ogni impianto composto in fianchi destro e sinistro del mouse diversi.
3b. Iniezione di fibroblasti umani mammaria in un mouse immunodeficienti
- Per generare fibroblasti di controllo contro exp-CAF, preparare 3x10 6 GFP + puro R immortalato fibroblasti umani mammaria generata in P2.2 in 400 ml di terreno di coltura con il 50% (v / v) Matrigel per iniezione (Fig. 1BB). NON miscelare i fibroblasti con cellule di carcinoma.
- Impianto i fibroblasti preparati in P3b.1 all'interno di siti o sottocutanea di topi nudi.
* Si noti che i fibroblasti inoculati formeranno il tessuto fibroblastico, ma non del tumore sotto la pelle.
4 bis. Dissezione di xenotrapianto del tumore
- Euthanise il mouse ospitare un seno umana sottocutanea xenotrapianto cancro 42 giorni dopo l'impianto (Fig. 1BA). * Nota che quando le cellule di carcinoma e / o fibroblasti sono coimplanted, Fibroblasti potrebbe essere necessario essere incubate per più di 42 giorni entro i xenotrapianto del tumore di avviare il loro fenotipo myofibroblastic.
- Raccolto il xenotrapianto del tumore dal fianco del mouse per via smussa con pinze e forbici. Immergere il tessuto tumorale in PBS.
4b. Dissezione dei trapiantati fibroblasti
- Euthanise il mouse ospitare il xenotrapianto fibroblasti 42 giorni dopo l'impianto (Fig. 1BB).
- Sezionare il xenotrapianto fibroblasti sottocutanei con pinze e forbici. Posizionare il tessuto fibroblastica in PBS. * Nota che di trapianto di fibroblasti, che appare come un tessuto trasparente piccolo, può essere difficile da trovare sotto la pelle.
5. Preparazione delle primarie cellule in coltura da xenotrapianti
- Utilizzare un armadio sterile biosicurezza di sezionare il tumore (~ 0,5 grammi) o tessuto fibroblastico (~ 0,1 grammi). Trasferire i tessuti asportati sulla parte superiore di una cultura 15 centimetri dish con 1 ml di PBS. Tritare i tessuti in frammenti di tessuto di piccole dimensioni (<1,5 mm 3) utilizzando lame di rasoio sterile. * Si noti che se il xenotrapianto fibroblasti pesa meno di 0,1 grammi, raccogliere un paio di xenotrapianti fibroblasti aggiuntivi e mescolarli insieme per aumentare il numero di celle per l'isolamento.
- Trasferire i frammenti di tessuto in un tubo da 15 ml contenente la cella di dissociazione del buffer (10 ml per 0,5 grammo di tessuto) e vortex per 1 minuto alla massima velocità.
- Incubare la sospensione cellulare per 3 ore a 37 ° C con continua agitazione lenta.
6. Isolamento di puromicina resistenti cellule in coltura
- Centrifugare la sospensione cellulare sia dissociato da xenotrapianto del tumore o dei fibroblasti per 5 min a 250 g X e risospendere il pellet di cellule in PBS. Centrifugare ancora per 5 minuti a 250 x g. Risospendere il pellet di cellule risultante nel 10% FCS-DMEM. Coltivare le cellule in una capsula di Petri cm 15, in presenza di puromicina (1 mg / ml) a 37 ° Ce anidride carbonica del 5% al fine di eliminare eventuali cellule di carcinoma contaminanti e / o cellule stromali murine. Propagare le celle fino confluenti (2-4 settimane). Conservare le cellule a -80 ° C con media di congelamento. * Nota che il conseguente puro cellule R, designato di 42 giorni di età exp-CAF1 (Fig. 1BA) o il controllo dei fibroblasti-1 le cellule (Fig. 1BB), sono immortali e positive per GFP. Si consiglia di verificare se queste cellule producono virus attiva utilizzando 10T1 / 2 celle, come descritto nella P2.3-6.
7 bis. Isolamento di exp-CaF2 cellule in coltura
Per migliorare ulteriormente il fenotipo attivato myofibroblastic di CAF, mix di 42 giorni di età exp-CAF1 cellule MCF-7-ras cellule e iniettare per via sottocutanea di nuovo in un topo nudo per ulteriori periodi di 200 giorni. Sezionare e dissociare il xenotrapianto del tumore in una cella singola sospensione e coltivare le cellule in una capsula di Petri cm 15 con 10% FCS-DMEM in presenza di puromicina (1 mg / ml), come indicato in P6.1. Propagare le celle fino confluenti (8-10 giorni). Conservare le cellule a -80 ° C con media di congelamento. Il risultato puro R cellule prendono il nome 242-giorno-vecchio-exp CaF2 cellule (Fig. 1BA).
7b. Estrazione di controllo fibroblasti-2 cellule in coltura
Per generare fibroblasti di controllo contro exp-CaF2 cellule, iniettare di 42 giorni di età il controllo dei fibroblasti-1 le cellule da solo, senza cellule di carcinoma per via sottocutanea in un topo nudo in aggiunta, per 200 giorni. Sezionare e dissociare il tessuto fibroblastico in una sospensione singola cella e la cultura delle cellule in una capsula di Petri cm 15 con 10% FCS-DMEM in presenza di puromicina (1 mg / ml) come indicato nella P6.1. Propagare le celle fino confluenti (3-4 settimane). Conservare le cellule a -80 ° C con media di congelamento. Il risultato puro cellule R sono chiamati fibroblasti-2 le celle (Fig. 1BB).
8. Rappresentante dei risultati:
Controllo dei fibroblasti-2 e exp-CaF2 cells, che sono stati estratti da xenotrapianti di tumori al seno, tinto fortemente positivo per i marcatori mesenchimali, tra umano specifico per vimentina, prolil-4-idrossilasi, 1A collagene, fibronectina, S100A4, e la superficie delle proteine dei fibroblasti (Fig. 2A) 11, indicando umano origine e la natura di queste cellule mesenchimali. Al contrario, la citocheratina, un marker per le cellule epiteliali, non è stato macchiato in questi fibroblasti + GFP (Fig. 2B). Questi risultati suggeriscono quindi che l'estratto exp-CaF2 e controllo dei fibroblasti-2 le cellule hanno avuto origine dai genitori fibroblasti umani mammari inizialmente introdotti nella xenotrapianti mouse.
Soprattutto, una maggiore proporzione di exp-CaF2 cellule colorate positivo per α-SMA e glicoproteina della matrice extracellulare tenascina C-5, che sono entrambi marcatori di miofibroblasti rispetto a 42 giorni di età exp-CAF1 e controllo dei fibroblasti-2 cellule (Fig. . 2C, D) 11. Questi dati indicano che residenti fibr umano della mammellaoblast progressivamente evolvere in miofibroblasti CAF in xenotrapianti tumorali.

Figura 1 Rappresentazione schematica di isolamento di fibroblasti umani mammaria. A) Il tessuto mastoplastica riduttiva è stata tritata con lame di rasoio sterile (P1.2) e trasferito in un tubo da 15 ml (P1.3). I piccoli frammenti di tessuto sono stati digeriti nella cella buffer di dissociazione (P1.4) e preparato per la cultura in vitro (P1.5-7). Per immortalare il isolato primario fibroblasti umani mammari, un pMIG retrovirale (MSCV-IRES-GFP) vettore, esprimendo sia hTERT e GFP, è stata introdotta, e la GFP-positive conseguenti cellule sono state ordinate in citometria a flusso (P2.1). Un retrovirali pBabe-puro vettore di codifica un gene di resistenza puromicina è stato poi introdotto in queste cellule. Al momento il trattamento puromicina, GFP-etichettata (GFP +) puromicina-resistenti (Puro R), Immortalised fibroblasti umani della mammella sono state isolate (P2.2).
B bis) Per generare exp-CAF, GFP + puro R immortalato fibroblasti umani mammari sono stati coinjected con MCF-7-ras cellule di carcinoma mammario per via sottocutanea in un mouse immunodeficienti nudo (P3A). Il xenotrapianto del tumore è stato asportato a 42 giorni dopo l'impianto (P4A) e dissociato in una cella singola sospensione (P5). Queste cellule sono state poi coltivate in vitro in presenza di puromicina per eliminare eventuali cellule di carcinoma contaminanti topo e cellule stromali (P6). La risultante puromicina resistenti cellule sono state definite in via sperimentale generato CAF1 (exp-CAF1) cellule. Queste cellule, asportato 42 giorni dopo l'impianto, sono stati ancora una volta mescolato con MCF-7-ras cellule e impiantato per via sottocutanea in un topo host come prima (P7a). Il tumore risultante è stato permesso di crescere per ulteriori periodi di 200 giorni, poi sezionato, dissociato, e coltivate in presenza di puromicina. L'isolatopuromicina cellule resistenti erano chiamati exp-CaF2 cellule (242 giorni di età).
Bb) Per isolare le cellule di controllo contro exp-CAF, GFP + puro R immortalato fibroblasti umani mammari sono stati iniettati per via sottocutanea in un topo nudo come le colture pure senza MCF-7-ras cellule (P3B). Il tessuto fibroblastico, sezionato 42 giorni post-impianto (P4B), è stato dissociato in cella singola sospensioni (P5) e puromicina cellule resistenti, chiamato control fibroblasti-1 le cellule, sono stati isolati come descritto in precedenza (P6). Questi fibroblasti sono stati ancora una volta impiantato per via sottocutanea in un topo nudo senza MCF-7-ras cellule in aggiunta, per 200 giorni (p7b). Il tessuto fibroblastico è stato sezionato, dissociato, e coltivate in presenza di puromicina. L'isolato puromicina cellule resistenti erano chiamati fibroblasti-2 le celle (242 giorni di età).
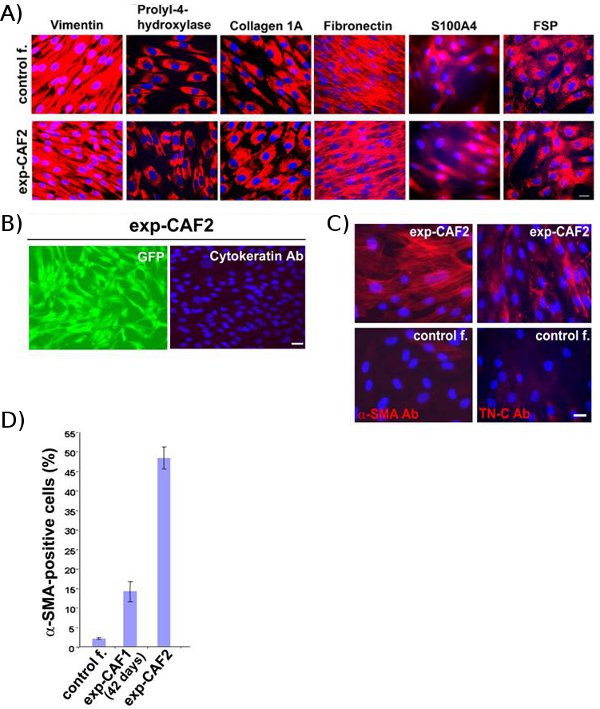
Figura 2 Exp-CAF e fibroblasti di controllo provengono da genitori fibroblasti umani mammaria. (A) analisi di immunofluorescenza di controllo dei fibroblasti-2 (controllo f.) e exp-CaF2 cellule. I due tipi di cellule macchia positivo per i marcatori mesenchimali (rosso), compresi gli esseri umani vimentina, prolil-4-idrossilasi, 1A collagene, fibronectina, S100A4, e la superficie delle proteine dei fibroblasti. (B), invece, pan-citocheratina, un marcatore per le cellule epiteliali , non viene rilevato in exp-CaF2 cellule che esprimono GFP (verde). Nuclei delle cellule sono colorate con 4'-6-Diamidino-2-fenilindolo (DAPI) (blu). Barra della scala, 50 micron (da cui Kojima et al. 11)
(C) Immunofluorescenza di exp-CaF2 cellule di fibroblasti e di controllo-2 cellule (controllo f.) utilizzando anticorpi contro α-SMA (rosso) o tenascina-C (TN-C) (rosso). Nuclei delle cellule sono colorate con DAPI (blu). Barra della scala, 50 micron. (D) 48% di exp-CaF2 cellule macchia positivo per α-SMA, mentre 14% di 42-giorno-vecchio-exp CAF1 e il 2,5% della popolazione di controllo fibroblasto-2 celle sono positivi per α-SMA. (Di cui da Kojima et al.11)
Discussione
La mancanza di CAF-specifici marcatori e il livello di eterogeneità osservata tra CAF rendere la caratterizzazione di questo tipo di cellule una sfida in sé. CAF studio in vitro è stato ostacolato dalla complicazione ulteriore che queste cellule senesce e fermare la proliferazione quando in coltura per un lungo periodo. Il nostro precedente tentativo di immortalare direttamente CAF primaria utilizzando un costrutto retrovirale hTERT cDNA non ha avuto successo. Pertanto, per approfondire lo studio del tumore ...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Ringraziamo il Dr. Robert A. Weinberg (Whitehead Institute for Biomedical Research, Cambridge) per il generoso sostegno e la supervisione di questo lavoro e il Sig. Kieran Mellody (Università di Manchester, Manchester) per la modifica critica di questo manoscritto. Questo progetto è stato sostenuto da Research UK (CR-UK) concedere numero C147/A6058 (AO)
Materiali
| Nome del materiale | Tipo | Azienda | Numero di catalogo | Commento |
| DMEM | Invitrogen | 61965-026 | ||
| Siero di vitello fetale | GIBCO | 10270 | ||
| Penicillina-streptomicina | Invitrogen | 15140-122 | ||
| Collagenasi tipo I | Sigma | C0130-1G | ||
| ialuronidasi | Sigma | H4272 | ||
| Vimentina (V9) anticorpi | Novocastra Laboratori | NCL-L- VIM-V9 | ||
| Tenascina C (AC-8) anticorpi | un dono di | |||
| α-SMA-Cy3 (1A4) anticorpi | Sigma | C6198 | ||
Prolil-4-idrossilasi | Dako | M0877 | ||
| (5B5) anticorpi | ||||
| Collagene tipo1 1A anticorpi | Sigma | HPA011795 | ||
| Pan-citocheratina anticorpi | Sigma | C5992 | ||
| Anticorpi fibronectina | BD Biosciences | 610077 | ||
S100A4/FSP-1 (fibroblasti- proteina-1 specifica) degli anticorpi | Dako | A5114 | ||
Fibroblasti superficie proteica (Clone 1B10) anticorpi | Abcam | ab11333 | ||
| MSCV-IRES-GFP costruire | Richiesta ai autori | |||
| pBabe-puro costruire | Acquisto da Addgene | |||
| Puromicina | Sigma | P8833 | ||
| DAPI | Sigma | D9564 | ||
| Tubo 15 ml conica | Corning | 430766 | ||
| Topo nudo | Taconic | NCRNU-F | NCR nudo femminile | |
| C3H/10T1/2 cellule | ATCC | CCL-226 |
Riferimenti
- Ronnov-Jessen, L., Bissell, M. J. Breast cancer by proxy: can the microenvironment be both the cause and consequence?. Trends Mol. Med. 15, 5-13 (2009).
- Mueller, M. M., Fusenig, N. E. Friends or foes - bipolar effects of the tumour stroma in cancer. Nat. Rev. Cancer. 4, 839-849 (2004).
- Bhowmick, N. A., Neilson, E. G., Moses, H. L. Stromal fibroblasts in cancer initiation and progression. Nature. 432, 332-337 (2004).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat. Rev. Cancer. 6, 392-401 (2006).
- De Wever, O. Tenascin-C and SF/HGF produced by myofibroblasts in vitro provide convergent pro-invasive signals to human colon cancer cells through RhoA and Rac. 18, 1016-1018 (2004).
- Serini, G., Gabbiani, G. Mechanisms of myofibroblast activity and phenotypic modulation. Exp. Cell. Res. 250, 273-283 (1999).
- Shimoda, M., Mellody, K. T., Orimo, A. Carcinoma-associated fibroblasts are a rate-limiting determinant for tumour progression. Semin. Cell. Dev. Biol. 21, 19-25 (2010).
- Pietras, K., Ostman, A. Hallmarks of cancer: interactions with the tumor stroma. Exp. Cell. Res. 316, 1324-1331 (2010).
- Polyak, K., Haviv, I., Campbell, I. G. Co-evolution of tumor cells and their microenvironment. Trends in Genetics. 25, 30-38 (2009).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Semin. Cell. Dev. Biol. 21, 33-39 (2010).
- Kojima, Y. Autocrine TGF-beta and stromal cell-derived factor-1 (SDF-1) signaling drives the evolution of tumor-promoting mammary stromal myofibroblasts. Proc. Natl. Acad. Sci. U. S. A. 107, 20009-20014 (2010).
- Orimo, A. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell. 121, 335-348 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon