Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un système 3D pour les chondrocytes articulaires humains Culture dans le liquide synovial
Dans cet article
Résumé
Un système 3D de chondrocytes articulaires humains en culture dans les niveaux élevés du liquide synovial est décrite. Le liquide synovial reflète le microenvironnement plus naturelle pour le cartilage articulaire, et peut être facilement obtenu et stocké. Ce système peut donc être utilisée pour étudier la régénération du cartilage et de dépistage pour les thérapies pour traiter l'arthrite.
Résumé
Cartilage de destruction est un élément central pathologiques de l'arthrose, une des principales causes d'invalidité dans les Etats-Unis. Cartilage de l'adulte ne se régénère pas très efficace in vivo, et par conséquent, l'arthrose conduit à une perte irréversible du cartilage et est accompagné par la douleur chronique et 1,2 immobilité. Génie tissulaire du cartilage offre un potentiel prometteur pour régénérer et restaurer la fonction des tissus. Cette technologie implique généralement chondrocytes semis dans des échafaudages naturel ou synthétique et la culture de la 3D résultant de construire dans un milieu équilibré sur une période de temps avec un but de l'ingénierie biochimique et un tissu biomécaniquement matures qui peuvent être transplantées dans un site de la lésion in vivo 3-6 . Atteindre une condition optimale pour la croissance des chondrocytes et dépôt de matrice est essentiel pour la réussite de l'ingénierie tissulaire du cartilage.
Dans la cavité natale, conjointe du cartilage à l'articla surface de l'os EXCLUES baigne dans le liquide synovial. Ce liquide clair et visqueux fournit des nutriments au cartilage articulaire avasculaire et contient des facteurs de croissance, des cytokines et des enzymes qui sont importants pour le métabolisme des chondrocytes 7,8. Par ailleurs, le liquide synovial facilite faible coefficient de frottement entre les surfaces cartilagineuses mouvement principalement par sécrétant deux éléments clés, le hyaluronane et Lubricin 9 10. En revanche, l'ingénierie tissulaire du cartilage est le plus souvent cultivés en milieu artificiel. Bien que ces médias sont vraisemblablement en mesure d'offrir des conditions plus définies pour étudier le métabolisme des chondrocytes, le liquide synovial reflète le plus fidèlement l'environnement naturel, dont les chondrocytes articulaires résident po
En effet, le liquide synovial a l'avantage d'être facile à obtenir et à stocker, et peut souvent être régulièrement réapprovisionné par le corps. Plusieurs groupes ont complété le milieu de culture avec du liquide synovial dans la croissance humaine, bovine, lapin et chien chondrocytes, mais surtout utilisé seulement de faibles niveaux de liquide synovial (inférieur à 20%) 11-25. Alors que les chondrocytes de poulet, de cheval et humaines ont été cultivées dans le milieu avec des pourcentage plus élevé de liquide synovial, ces systèmes de culture ont été à deux dimensions 26-28. Ici, nous présentons notre méthode de culture de chondrocytes articulaires humains dans un système 3D avec un pourcentage élevé de liquide synovial (jusqu'à 100%) sur une période de 21 jours. Ce faisant, nous avons surmonté un obstacle majeur présenté par la haute viscosité du liquide synovial. Ce système offre la possibilité d'étudier des chondrocytes humains dans le liquide synovial, dans un cadre 3D, qui peut être combiné avec deux autres facteurs importants (la tension d'oxygène et le chargement mécanique) 29,30 qui constituent l'environnement naturel pour le cartilage d'imiter le milieu naturel pour la croissance du cartilage. Par ailleurs, ce système peut également être utilisé pour le dosage de l'activité du liquide synovial sur les chondrocytes et de fournir une plateforme pour le développementcartilage de technologies de régénération et les options thérapeutiques pour l'arthrite.
Protocole
Un système 3D pour les chondrocytes articulaires humains en culture dans le liquide synovial
Dans ce travail, nous avons encapsulé chondrocytes articulaires humains en billes d'alginate en utilisant une modification de fabrication-a suggéré d'encapsulation de protocole (Lonza, et 31). En utilisant ces constructions 3D, nous avons développé un système de culture de cellules dans un milieu de culture contenant des pourcentages variés de liquide synovial humain et ont évalué ces constructions 3D pour l'expression des gènes du cartilage.
1. Préparer chondrocytes articulaires humains (HAC) pour trois dimensions (3D) d'encapsulation
- Décongelez un flacon (1 ml) de chondrocytes articulaires humains (HAC) (Lonza) (passage 2) dans 37 ° C l'eau de bain pendant 1 min.
- Mélanger avec 1ml de milieu de croissance de chondrocytes (Lonza) et centrifuger à 3000 rpm pendant 3-5 min pour recueillir les cellules. Jeter le surnageant.
- Resuspendre le culot cellulaire dans les milieux de croissance de chondrocytes (Lonza).
- Cellules de la plaque dans un tissu de 10 cmplaque de culture (BD Biosciences), et la culture dans les milieux de croissance de chondrocytes (Lonza) jusqu'à ce que les cellules sont confluentes. HAC devrait être utilisé à un nombre de passage ne dépasse pas 3 ou 4 (P3 ou P4).
- Lavez CAH sur la plaque avec 155mm de NaCl au lieu de la PBS standard, suivie par trypsinzation pour recueillir des cellules pour l'encapsulation d'alginate de perles. Une fois que les cellules sont détachées, ralentit les cellules à 3000rpm pendant 5 min. Les cellules sont maintenant prêts pour l'encapsulation 3D.
2. Encapsuler HAC en perles 3D
Reprendre le HAC dans une solution d'alginate de 1,2% (Sigma) à une densité de 8x10 5 cellules / ml. Les nombres de cellules ont été déterminés avant encapsulation, utilisant un compteur de cellules standard. Il est très important de bien mélanger afin d'assurer une répartition homogène des cellules dans les billes.
- Pipeter le HAC / mélange de solution d'alginate dans une seringue de 12 ml attachée à une aiguille de calibre 22 (Tyco Healthcare, Inc.)
- Pendant ce temps, préparer un bécher de 50 mL avec 102 mM CaCl 2 à 5 fois le volume que de la solution HAC / aginate. Placer un barreau aimanté à l'intérieur du bécher et agiter le 102 mM de CaCl2 solution lentement (à environ 150 rpm).
- Tenez le bout de la seringue d'environ 6 pouces au-dessus de la surface de la solution de CaCl 2 et ajouter le mélange HAC / alginate dans le CaCl 2 goutte à goutte une solution. En général, les billes d'alginate qui en résultent sont de 2mm de diamètre avec une densité d'encapsulation d'environ 10 4 cellules / perle. Note: La hauteur de la seringue sur la solution de CaCl 2 est important. Courte distance se traduira par la déchirure en forme de goutte au lieu de perles sphériques en forme, causant inégale intégrité mécanique et l'encapsulation cellulaire.
- Laissez les perles remous dans le solution de CaCl 2 pendant 20-25 min. Alors que d'autres protocoles d'encapsulation d'alginate indiquent un temps d'incubation beaucoup plus courte de 10min, nous avons constaté que le temps d'incubation plus longue avec la solution de CaCl 2 amélioré l'intégrité de l'êtreannonces.
- Retirer la solution de CaCl 2, lavez-les perles 2-3 fois en 2-3 volumes de NaCl, puis une fois dans le milieu de différenciation des chondrocytes (Lonza). Alors que d'autres protocoles d'encapsulation perles d'alginate impliquent l'utilisation d'un filtre pour le lavage des procédures ci-dessus, nous avons constaté que les billes d'alginate deviennent souvent piégés dans le filtre et sèche, réduisant ainsi l'efficacité de l'encapsulation. Nous avons trouvé le plus efficace pour permettre aux billes de se déposer au fond du bécher avant de jeter la solution.
- Utilisez une spatule standards pour transférer les billes dans des boîtes de culture. En général, nous la culture 12 perles par cm 3 ainsi pendant 2 jours dans un milieu de croissance de chondrocytes pour permettre de s'adapter à des chondrocytes du processus d'encapsulation dans la moyenne, ils ont été cultivés en avant de passer au milieu de différenciation de chondrocytes (Lonza) avec le liquide synovial.
3. Chondrocytes culture en milieu liquide synovial de la culture
- Frais liquide synovial peut être obtenu à partir d'un oClinique utpatient (Nous avons obtenu le liquide synovial de la Tufts Medical Center). Le liquide synovial peuvent être transférées dans des tubes Falcon de 15 ml au laboratoire, et immédiatement centrifugé à 3000 rpm pendant 15min pour enlever les débris cellulaires. Aliquoter acellulaire du liquide synovial dans 1,5 ml microtubes, pour éviter répétés de congélation-décongélation. Surnageant peut être conservé à -80 ° C jusqu'à utilisation.
- Avant de se cultiver, mélanger le liquide synovial avec un milieu de différenciation des chondrocytes (MDP, Lonza) à différents rapports volumétriques, avec une concentration constante de l'acide ascorbique 100mm et 9 mM CaCl 2 (ce montant trace de CaCl 2 est de garantir l'intégrité de l'alginate perles).
- Conservez la plaque sur une plateforme à bascule dans un incubateur à 37 ° C (fréquence bascule: environ 75 fois / min) pour aider à la distribution des nutriments dans les billes d'alginate, et pour réduire l'agglutination des billes. Ceci est particulièrement important que nous la culture de ces chondrocytes pour une période de temps prolongée (jusqu'à 4 semaines). Remarque: Alors que la croissance des chondrocytes et des médias de différenciation (Lonza) contiennent deux antibiotiques couramment utilisés gentamycine et amphotéricine, nous n'avons pas compléter toute antibiotiques lorsque nous avons utilisé des pourcentages différents du liquide synovial pour la culture des chondrocytes. Aucune contamination n'a jamais été observé.
- Changer mélanges des médias tous les 2-3 jours. La viscosité du liquide synovial a été un obstacle majeur dans les chondrocytes en culture encapsulés dans des billes d'alginate lors de cultures à long terme. Nous avons trouvé le plus efficace pour diluer le liquide synovial, complétés avec des moyennes de 102 mm de CaCl 2 (50% V / V), ce qui renforce également l'intégrité des billes d'alginate. De cette façon, le milieu peut être retiré lentement avec une pipette, sans endommager les perles.
4. HAC récolte dans des billes d'alginate pour l'analyse de l'expression des gènes
Des précautions particulières doivent être prises lors de la récolte de la CAH à partir des billes d'alginate pour l'analyse de l'expression génique.
- Laver les billes d'alginate 3 tiMES dans 102 mM de CaCl 2 pendant environ 5 min à chaque fois.
- Récupérer les chondrocytes en ajoutant 55 mM NaCitrate à un volume 4-5 fois que des perles. Il est important que les billes d'alginate sont totalement immergés dans la solution NaCitrate. Agiter ou de roche pour 20-30 min.
- Isoler les cellules et jeter le surnageant.
- Pour l'analyse par RT-PCR, remettre en suspension les cellules dans un tampon de lyse cellulaire culot (Qiagen ARN kit d'isolement), et de procéder à la purification d'ARN.
5. Fix HAC en billes d'alginate pour l'analyse histologique
Un soin particulier doit être pris à la récolte de la CAH à partir des billes en 3D pour l'analyse histologique.
- Laver les billes d'alginate 3 fois dans 102 mM de CaCl 2 pendant environ 5 min à chaque fois. Pour complètement laver le fluide visqueux synoviale, nous avons trouvé le plus efficace de se laver avec un milieu de différenciation des chondrocytes (Lonza) pendant la nuit, bascule dans un incubateur à 37 ° C (fréquence bascule: environ 75 foiss / min). Le milieu de croissance des chondrocytes a été utilisé pour assurer la survie de chondrocytes dans cette lave et prolongée pour permettre une pénétration maximale de l'agent de fixation.
- Fixer les perles dans de l'éthanol 70% pendant la nuit, et procéder à une analyse histologique. Pour effectuer coloration DAPI, incuber avec des billes d'alginate Dapi solution (500ng/ml) pendant 1 heure sous doux balancement, et laver 3 fois avec 102mm de CaCl 2 pendant 15 min à chaque fois. Dapi images peuvent ensuite être visualisées sous un microscope à fluorescence. Les billes peuvent également être sectionnés pour bleu alcian et coloration H & E.
6. Les résultats représentatifs
Notre méthode de culture en 3D pour des chondrocytes humains dans des pourcentages élevés de liquide synovial est représentée dans le schéma indiqué dans la Fig.1. Après chondrocytes humains ont été encapsulés dans des billes d'alginate, ils ont été autorisés à croître en milieu supplémenté avec différents ratios de liquide synovial. En raison de la viscosité du liquide synovial, il est essentiel dechondrocytes culture dans des conditions à bascule constamment pour empêcher l'agglutination des constructions de cartilage et d'assurer une répartition homogène des nutriments. Il est également essentiel de se laver les billes d'alginate longuement avant de récupérer les chondrocytes, de sorte que la fixation ou du tampon de lyse peuvent pénétrer les perles (Fig.1). Lumineux terrain (BF) des images de chondrocytes dans les billes d'alginate sont présentés sur la Fig.2. Coloration DAPI a été réalisée pour confirmer la distribution usniform des cellules dans les billes (Fig. 2). A la fin de la période de culture de 21 jours, l'analyse d'expression génique a été réalisée par qRT-PCR. La référence gène GAPDH a été utilisée pour la normalisation de tous les rapports d'achèvement, comme il a été déterminé à être l'un des gènes de référence les plus fiables pour l'analyse qPCR sur les chondrocytes 32. Un exemple est montré dans la Fig. 3, où nous avons analysé les résultats de chondrocytes articulaires humains en culture dans le liquide synovial poolées de six patients souffrant d'arthrose. Cohérent avec le fait que les chondrocytes à partirLonza ont été élargis dans les cultures en 2D, ce qui conduirait inévitablement à la dédifférenciation 33, nous avons constaté que le jour 0 chondrocytes ont exprimé un niveau minimal de gènes matrice cartilagineuse (Fig. 3). Culture 3D de chondrocytes avec un milieu de différenciation des chondrocytes (Lonza) ou milieu supplémenté avec du liquide synovial augmenté de façon significative l'expression du gène du collagène du cartilage, aggrécane et MMP13, qui indique chondrocytes re-différenciation par Jour 21 (Fig.3) 34. Augmenter le pourcentage de liquide synovial dans les médias a entraîné des niveaux comparables de marqueurs matrice cartilagineuse II de collagène et d'expression de l'ARNm aggrécane (Fig.3A et 3B). Par ailleurs, les chondrocytes cultivés dans 100% de liquide synovial, même présentaient une diminution dans le cartilage d'enzymes dégradant l'expression des ARNm MMP13 par rapport à celles cultivées en milieu seul (Fig.3C). Fait intéressant, le niveau d'expression de la mort cellulaire indicateur de la caspase 3 a progressivement diminué avec l'augmentation des ratios de liquide synovial, ce qui suggère que sculture du liquide ynovial a conduit à des niveaux diminution de l'apoptose (Fig. 3D). Par conséquent, nos résultats montrent que les chondrocytes articulaires humains en culture dans les niveaux élevés de liquide synovial, dans un cadre 3D est une technologie réalisable.
Tableaux et figures

Figure 1. Schéma de la méthode à la culture de chondrocytes articulaires humains en pourcentages élevés de liquide synovial dans des billes d'alginate 3D. Premièrement, les chondrocytes et la solution d'alginate sont mélangés. Lorsqu'il est appliqué goutte à goutte à la solution de CaCl 2, les chondrocytes sont immobilisées dans des billes d'hydrogel réticulé Ca-alginate. Ces constructions en 3D sont ensuite cultivées dans le milieu de différenciation de chondrocytes (Lonza) avec différents ratios de liquide synovial humain. Après 21 jours de culture dans une condition à bascule, des billes d'alginate contenant des cellules sont lavées abondamment après quoi les cellules sont récupérées pour le gèneanalyse de l'expression.
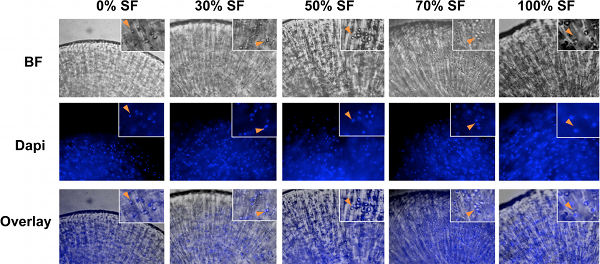
Figure 2. Fond clair (BF) et des images Dapi des chondrocytes articulaires humains cultures encapsulées avec 0%, 30%, 50%, 70% et 100% liquide synovial. Les chondrocytes ont été de forme sphérique dans toutes les conditions de culture. Images du champ clair (BF) et Dapi ont été superposées pour confirmer l'emplacement et la distribution des chondrocytes. EISN, des images agrandies. Pointes de flèches, colocalisation des chondrocytes au BF et images coloration DAPI.
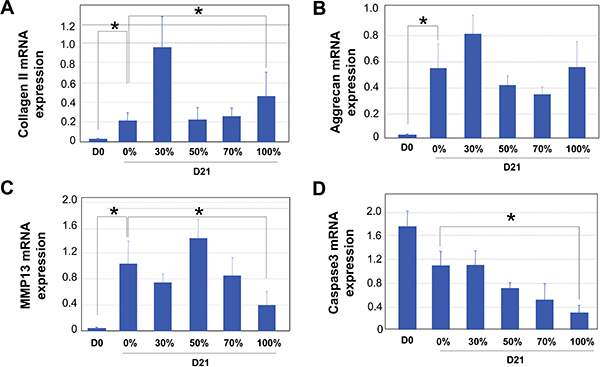
Figure 3. QRT PCR analyse des encapsulée chondrocytes articulaires humains au jour 0 (J0) une après 21 jours de culture (D21) en milieu supplémenté avec des proportions variables de liquide synovial (SF) (0%, 30%, 50%, 70 % et 100%). Les résultats de quatre échantillons indépendants sont montrés ici. GAPDH a été utilisé comme référence interne pour toutes les PCR. A. L'expression du collagène ARNm II. B. Expression de l'ARNm aggrécane. C. MMP13 expression de l'ARNm. D. L'expression d'ARNm Caspase 3. La signification statistique a été évaluée pour la Journée des échantillons et 0 Jour 21 échantillons de 0% et 100% liquide synovial (SF) en culture, en utilisant le logiciel INSTAT. * Indique P <0,05.
Discussion
Dans ce rapport, nous avons développé une méthode qui permet la culture de chondrocytes articulaires humains dans un environnement 3D en milieu contenant des concentrations élevées de liquide synovial humain. Le liquide synovial est l'un des principaux composants qui constituent l'environnement naturel dans la cavité articulaire, où résident les chondrocytes articulaires. Cependant, la viscosité du liquide synovial a été un défi majeur pour trois dimensions à long terme de culture des chondrocytes. ...
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Nous tenons à remercier Robin Nye (Tufts Medical Center), Tomoya Uchimura et Dana Cairns (Tufts University) pour fournir une aide au stockage du liquide synovial et la centrifugation. Ce travail a été financé par le NIH (1R01AR059106-01A1) pour LZ
matériels
Table des réactifs spécifiques et des équipements:
| Le nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Alginate (sel de sodium d'acide alginique) | Sigma | A2158-250G | Solution de 2,4% stockés à 40 ° C |
| Chlorure de calcium granulaire | JT Baker | A19339 | |
| Les milieux de croissance chondrocytaire | Lonza | CC-3156 (base des médias) | |
| CC-4409 (supplément) | |||
| Médias différenciation chondrocytaire | Lonza | CC-3226 (base des médias) | |
| CC-4408 (supplément) | |||
| Chondrocytes articulaires humains | Lonza | CC-2550 | |
| DAPI (4 ',6-diamidino-2-phénylindole dichlorhydrate) | Sigma-Aldrich | D9542 | |
| RNeasy mini kit (pour l'extraction de l'ARN) | Qiagen | 74104 | |
| Réactifs de PCR: SYBR-vert | Quanta | 95053-500 | |
| Seringue 12 ml | Tyco-Kendall-Monoject | 512852 | |
| Aiguille hypodermique de 22 Gague | Tyco-KendalL-Monoject | 8881 | |
| Microscope | Olympus | IX71 | |
| Rocker plate-forme | Thermolyne Thermoscientific | Vari-mix | |
| Séquences amorces | |||
| Collagène IIa-forward | 5'-TTC ATC CCA CCC TCT CAC AGT-3 ' | ||
| Collagène IIa-reverse | 5'-CCTCTGCCTTGACCCGAA-3 ' | ||
| MMP13-forward | 5'-TGT GCC CTT CTT CAC GAC ACA ACT-3 ' | ||
| MMP13-reverse | 5'-GAG CAG AGA CTT TGA GTC ATT GCC-3 ' | ||
| Caspase 3-forward | 5'-TCA TTA TTC AGG CCT GCC GTG GTA-3 ' | ||
| Caspase 3-reverse | 5'-TGG ATG CAA ACG GAG CCA TCC TTT -3 ' |
Références
- Centers for Disease Control and P. Projected state-specific increases in self-reported doctor-diagnosed arthritis and arthritis-attributable activity limitations--United States, 2005-2030. MMWR. Morb. Mortal. Wkly. Rep. 56, 423-425 (2007).
- Theis, K. A., Murphy, L., Hootman, J. M., Helmick, C. G., Yelin, E. Prevalence and correlates of arthritis-attributable work limitation in the US population among persons ages 18-64: 2002 National Health Interview Survey Data. Arthritis Rheum. 57, 355-363 (2007).
- Chung, C., Burdick, J. A. Engineering cartilage tissue. Adv. Drug. Deliv. Rev. 60, 243-262 (2008).
- Glowacki, J. In vitro engineering of cartilage. J. Rehabil. Res. Dev. 37, 171-177 (2000).
- Chokalingam, K., Hunter, S. A., Gooch, C. 3D-In vitro Effects of Compression and Time in Culture on Aggregate Modulus and on Gene Expression and Protein content of Collagen Type II in Murine Chondrocytes. Tissue Eng. Part A. , (2009).
- Butler, D. L., Goldstein, S. A., Guilak, F. Functional tissue engineering: the role of biomechanics. J. Biomech. Eng. 122, 570-575 (2000).
- Goldring, M. B., Goldring, S. R. Osteoarthritis. J. Cell. Physiol. 213, 626-634 (2007).
- Zvaifler, N. J., Firestein, G. S. Cytokines in chronic inflammatory synovitis. Scand. J. Rheumatol. Suppl. 76, 203-210 (1988).
- Rhee, D. K., Marcelino, J., Baker, M. The secreted glycoprotein lubricin protects cartilage surfaces and inhibits synovial cell overgrowth. J. Clin. Invest. 115, 622-631 (2005).
- Campo, G. M., Avenoso, A., Nastasi, G. Hyaluronan reduces inflammation in experimental arthritis by modulating TLR-2 and TLR-4 cartilage expression. Biochim. Biophys. Acta. , (2011).
- van de Lest, C. H., van den Hoogen, B. M., van Weeren, P. R. Loading-induced changes in synovial fluid affect cartilage metabolism. Biorheology. 37, 45-55 (2000).
- Saxne, T., Heinegard, D., Wollheim, F. A. Human arthritic synovial fluid influences proteoglycan biosynthesis and degradation in organ culture of bovine nasal cartilage. Coll. Relat. Res. 8, 233-247 (1988).
- Lee, D. A., Salih, V., Stockton, E. F., Stanton, J. S., Bentley, G. Effect of normal synovial fluid on the metabolism of articular chondrocytes in vitro. Clin. Orthop. Relat. Res. , 228-238 (1997).
- Schalkwijk, J., Joosten, L. A., van den Berg, W. B., van de Putte, L. B. Chondrocyte nonresponsiveness to insulin-like growth factor 1 in experimental arthritis. Arthritis Rheum. 32, 894-900 (1989).
- Schalkwijk, J., Joosten, L. A., van den Berg, W. B., van Wyk, J. J., van de Putte, L. B. Insulin-like growth factor stimulation of chondrocyte proteoglycan synthesis by human synovial fluid. Arthritis Rheum. 32, 66-71 (1989).
- Joosten, L. A., Schalkwijk, J., van den Berg, W. B., van de Putte, L. B. Chondrocyte unresponsiveness to insulin-like growth factor-1. A novel pathogenetic mechanisms for cartilage destruction in experimental arthritis. Agents Actions. 26, 193-195 (1989).
- Schuerwegh, A. J., Dombrecht, E. J., Stevens, W. J. Synovial fluid and peripheral blood immune complexes of patients with rheumatoid arthritis induce apoptosis in cytokine-activated chondrocytes. Rheumatol. Int. 27, 901-909 (2007).
- Hegewald, A. A., Ringe, J., Bartel, J. Hyaluronic acid and autologous synovial fluid induce chondrogenic differentiation of equine mesenchymal stem cells: a preliminary study. Tissue Cell. 36, 431-438 (2004).
- Xu, Q. R., Dong, Y. H., Chen, S. L., Bao, C. D., Du, H. Degeneration of normal articular cartilage induced by late phase osteoarthritic synovial fluid in beagle dogs. Tissue Cell. 41, 13-22 (2009).
- Kruger, J. P., Endres, M., Neumann, K., Haupl, T., Erggelet, C., Kaps, C. Chondrogenic differentiation of human subchondral progenitor cells is impaired by rheumatoid arthritis synovial fluid. J. Orthop. Res. 28, 819-827 (2010).
- Steinhagen, J., Bruns, J., Niggemeyer, O. Perfusion culture system: Synovial fibroblasts modulate articular chondrocyte matrix synthesis in vitro. Tissue Cell. 42, 151-157 (2010).
- Yang, K. G., Saris, D. B., Verbout, A. J., Creemers, L. B., Dhert, W. J. The effect of synovial fluid from injured knee joints on in vitro chondrogenesis. Tissue Eng. 12, 2957-2964 (2006).
- Skoog, V., Widenfalk, B., Ohlsen, L., Wasteson, A. The effect of growth factors and synovial fluid on chondrogenesis in perichondrium. Scand. J. Plast. Reconstr. Surg. Hand. Surg.. 24, 89-95 (1990).
- Nuver-Zwart, I., Schalkwijk, J., Joosten, L. A., van den Berg, W. B., van de Putte, L. B. Effects of synovial fluid and synovial fluid cells on chondrocyte metabolism in short term tissue culture. J. Rheumatol. 15, 210-216 (1988).
- Beekhuizen, M., Bastiaansen-Jenniskens, Y. M., Koevoet, W. Osteoarthritic synovial tissue inhibits proteoglycan production in human osteoarthritic cartilage; Establishment and characterisation of a long-term coculture. Arthritis Rheum. , (2011).
- Rodrigo, J. J., Steadman, J. R., Syftestad, G., Benton, H., Silliman, J. Effects of human knee synovial fluid on chondrogenesis in vitro. Am. J. Knee. Surg. 8, 124-129 (1995).
- van den Hoogen, B. M., van de Lest, C. H., van Weeren, P. R. Loading-induced changes in synovial fluid affect cartilage metabolism. Br. J. Rheumatol. 37, 671-676 (1998).
- Webb, G. R., Westacott, C. I., Elson, C. J. Osteoarthritic synovial fluid and synovium supernatants up-regulate tumor necrosis factor receptors on human articular chondrocytes. Osteoarthritis Cartilage. 6, 167-176 (1998).
- Kook, S. H., Son, Y. O., Lee, K. Y. Hypoxia affects positively the proliferation of bovine satellite cells and their myogenic differentiation through up-regulation of MyoD. Cell. Biol. Int. 32, 871-878 (2008).
- Knobloch, T. J., Madhavan, S., Nam, J., Agarwal, S., Agarwal, S. Regulation of chondrocytic gene expression by biomechanical signals. Crit. Rev. Eukaryot. Gene. Expr. 18, 139-150 (2008).
- Guo, J. F., Jourdian, G. W., MacCallum, D. K. Culture and growth characteristics of chondrocytes encapsulated in alginate beads. Connect. Tissue. Res. 19, 277-297 (1989).
- Toegel, S., Huang, W., Piana, C. Selection of reliable reference genes for qPCR studies on chondroprotective action. BMC. Mol. Biol. 8, 13-13 (2007).
- Lin, Z., Fitzgerald, J. B., Xu, J. Gene expression profiles of human chondrocytes during passaged monolayer cultivation. J. Orthop. Res. 26, 1230-1237 (2008).
- Goessler, U. R., Bieback, K., Bugert, P. Human chondrocytes differentially express matrix modulators during in vitro expansion for tissue engineering. Int. J. Mol. Med. 16, 509-515 (2005).
- Anat, J. . 121, 107-118 (1976).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon