Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
3D системы для культивирования правам суставные хондроциты в синовиальной жидкости
В этой статье
Резюме
3D системы культивирования человеческих хондроцитов суставного к высоким уровням синовиальной жидкости описывается. Синовиальная жидкость отражает наиболее естественный микросреду для суставного хряща, и может быть легко получена и сохранена. Эта система при этом может быть использована для изучения регенерации хряща и для скрининга терапии для лечения артрита.
Аннотация
Cartilage destruction is a central pathological feature of osteoarthritis, a leading cause of disability in the US. Cartilage in the adult does not regenerate very efficiently in vivo; and as a result, osteoarthritis leads to irreversible cartilage loss and is accompanied by chronic pain and immobility 1,2. Cartilage tissue engineering offers promising potential to regenerate and restore tissue function. This technology typically involves seeding chondrocytes into natural or synthetic scaffolds and culturing the resulting 3D construct in a balanced medium over a period of time with a goal of engineering a biochemically and biomechanically mature tissue that can be transplanted into a defect site in vivo 3-6. Achieving an optimal condition for chondrocyte growth and matrix deposition is essential for the success of cartilage tissue engineering.
In the native joint cavity, cartilage at the articular surface of the bone is bathed in synovial fluid. This clear and viscous fluid provides nutrients to the avascular articular cartilage and contains growth factors, cytokines and enzymes that are important for chondrocyte metabolism 7,8. Furthermore, synovial fluid facilitates low-friction movement between cartilaginous surfaces mainly through secreting two key components, hyaluronan and lubricin 9 10. In contrast, tissue engineered cartilage is most often cultured in artificial media. While these media are likely able to provide more defined conditions for studying chondrocyte metabolism, synovial fluid most accurately reflects the natural environment of which articular chondrocytes reside in.
Indeed, synovial fluid has the advantage of being easy to obtain and store, and can often be regularly replenished by the body. Several groups have supplemented the culture medium with synovial fluid in growing human, bovine, rabbit and dog chondrocytes, but mostly used only low levels of synovial fluid (below 20%) 11-25. While chicken, horse and human chondrocytes have been cultured in the medium with higher percentage of synovial fluid, these culture systems were two-dimensional 26-28. Here we present our method of culturing human articular chondrocytes in a 3D system with a high percentage of synovial fluid (up to 100%) over a period of 21 days. In doing so, we overcame a major hurdle presented by the high viscosity of the synovial fluid. This system provides the possibility of studying human chondrocytes in synovial fluid in a 3D setting, which can be further combined with two other important factors (oxygen tension and mechanical loading) 29,30 that constitute the natural environment for cartilage to mimic the natural milieu for cartilage growth. Furthermore, This system may also be used for assaying synovial fluid activity on chondrocytes and provide a platform for developing cartilage regeneration technologies and therapeutic options for arthritis.
протокол
3D системы для культивирования человеческих хондроцитов суставного в синовиальной жидкости
В этой работе мы инкапсулированные человеческих хондроцитов суставного в альгинат бисера с использованием модифицированного производства, предложил протокол инкапсуляции (Lonza, и 31). Используя эти 3D конструкции, мы разработали системы для культивирования клеток в культуральной среде, содержащей разнообразные проценты человека синовиальной жидкости и оценили эти 3D-конструкции для экспрессии генов хряща.
1. Подготовка человека суставные хондроциты (HAC) для трехмерных (3D) инкапсуляции
- Оттепель флакон (1 мл) человеческих хондроцитов суставного (HAC) (Lonza) (Прохождение 2) в 37 ° С водяной бане в течение 1 мин.
- Смешайте с 1 мл питательной среды хондроцитов (Lonza) и центрифуге при 3000 оборотов в минуту в течение 3-5 мин для сбора клеток. Удалите супернатант.
- Ресуспендируют осадок клеток в хондроцитов питательной среды (Lonza).
- Пластина клеток в 10 см тканикультуры пластины (BD Biosciences), и культуры в средствах массовой информации хондроцитов роста (Lonza), пока клетки вырожденная. HACs должны быть использованы на пассаж не выше, чем 3 или 4 (P3 или P4).
- Вымойте HACs на 155 мм пластины с NaCl вместо стандартных PBS, после чего trypsinzation собирать клетки для альгината бусинка инкапсуляции. Как только клетки отделяются, спин вниз клеток на 3000rpm за 5 мин. Клетки готов к 3D инкапсуляции.
2. Инкапсуляция HACs в 3D бисером
Ресуспендируют HACs в 1,2% раствор альгината (Sigma) с плотностью 8x10 5 клеток / мл. Сотовые номера были определены до инкапсуляции, используя стандартный счетчик клеток. Это очень важно, чтобы хорошо перемешать, чтобы обеспечить равномерное распределение клеток в бисер.
- Внесите HAC / смесь альгината раствора в 12 мл шприц прилагается к 22-иглы (Tyco Healthcare, Inc.)
- Между тем, готовить 50 мл стакан с 102 мМ CaCl 2 в объеме 5 раз больше, HAC / aginate решение. Место мешалкой внутри стакана и размешать 102 мМ CaCl 2 раствор медленно (примерно 150 оборотов в минуту).
- Держите шприц наконечником около 6 дюймов над поверхностью CaCl 2 раствора и добавить HAC / альгинат смесь в CaCl 2 решение по каплям. В общем, в результате бисером альгината 2 мм в диаметре с инкапсуляцией плотности приблизительно 10 4 клеток / гранулы. Примечание: высота шприц над CaCl 2 решение имеет важное значение. Более короткие расстояния приведет к слезоточивый падение форме, а не сферическую форму шариков, вызывая неравномерное механической целостности и клеточной инкапсуляции.
- Пусть бисером переполох в CaCl 2 решения в течение 20-25 мин. Хотя другие протоколы инкапсуляции альгинат указывают гораздо короче инкубационный период от 10 минут, мы обнаружили, что более длительное время инкубации с CaCl 2 решения расширенной целостности бытьобъявлений.
- Удалить CaCl 2 решения, мыть бусин 2-3 раза в 2-3 объемах NaCl, а затем один раз в хондроцитов среду дифференцирования (Lonza). Хотя другие альгинат бусинка протоколы инкапсуляции связаны с использованием фильтра для стиральных выше процедур, мы обнаружили, что альгинат бисером часто попасть в ловушку фильтр и высыхания, тем самым снижая эффективность инкапсуляции. Мы обнаружили, что наиболее эффективным, чтобы бусы оседают на дно стакана, прежде чем выбросить решение.
- Используйте стандартные лопаточку, чтобы передача бусин в культуру блюд. Мы обычно культуры 12 бусин на 3 см и в течение 2 дней в хондроцитов среднего роста, чтобы хондроциты, чтобы приспособиться к инкапсуляции процесса в среде они были выращены в перед переключением на хондроцитов среду дифференцирования (Lonza) с синовиальной жидкости.
3. Культура хондроцитов в синовиальной жидкости культуральной среде
- Свежий синовиальной жидкости может быть получен из оutpatient клинике (Мы получили синовиальной жидкости из Медицинского центра Тафтс). Синовиальной жидкости могут быть переданы в 15 мл пробирки сокола в лабораторию, и сразу же центрифугировали при 3000 оборотов в минуту для 15 минут, чтобы удалить ячейку мусора. Алиготе бесклеточной синовиальной жидкости в пробирки на 1,5 мл микроцентрифужных, чтобы избежать повторного замораживания-оттаивания. Супернатант можно хранить при температуре -80 ° C до использования.
- До культивирования, смешать синовиальной жидкости с хондроцитов среду дифференцирования (МЧР, Lonza) при различных соотношениях объемные, с постоянной концентрации 100 мМ аскорбиновой кислоты и 9 мм CaCl 2 (это малое количество CaCl 2 является обеспечение целостности альгинат бусы).
- Держите пластинку на качалке платформе в 37 ° С инкубатор (частота качания: около 75 раз / мин), чтобы помочь питательных распределения внутри альгинат бисером, и уменьшить стук бисером. Это особенно важно, поскольку мы эти культуре хондроцитов в течение длительного периода времени (до 4 недель). Примечание: В то время хондроцитов роста и дифференциации средств массовой информации (Lonza) содержат два широко используемых антибиотиков гентамицин и амфотерицин, мы не дополнением любого антибиотики, когда мы использовали различные процент синовиальной жидкости для культивирования хондроцитов. Отсутствие загрязнения был когда-либо наблюдавшихся.
- Изменение СМИ смеси каждые 2-3 дня. Вязкость синовиальной жидкости является основным препятствием на культивирование хондроцитов инкапсулированных в альгинат бисером при длительном культур. Мы обнаружили, что наиболее эффективным для разбавления синовиальной жидкости-добавляемой среде с 102 мм CaCl 2 (50% V / V), который также укрепляет целостность альгинат бисером. Таким образом, среда может медленно удаляются при помощи пипетки, не повреждая бисером.
4. Урожай HACs в альгинат шарики для анализа экспрессии генов
Особое внимание должно быть принято при сборе HACs из альгината шарики для анализа экспрессии генов.
- Вымойте альгинат бисером 3 TiМЧС в 102 мМ CaCl 2 в течение приблизительно 5 минут каждый раз.
- Получить хондроциты, добавив 55 мм NaCitrate в объеме в 4-5 раз, что из бисера. Важно, что альгинат бисером полностью погружены в NaCitrate решение. Встряхните или рок в течение 20-30 мин.
- Спином вниз клетки и отбрасывать супернатант.
- Для ПЦР-анализа, ресуспендируют осадок клеток в ячейке буфера для лизиса (Qiagen РНК изоляции комплект), и приступить к очистке РНК.
5. Fix HACs в альгинат шарики для гистологического анализа
Особое внимание должны быть приняты для урожая HACs от 3D шарики для гистологического анализа.
- Вымойте альгинат бисером 3 раза в 102 мМ CaCl 2 в течение приблизительно 5 минут каждый раз. Чтобы полностью смыть вязкой синовиальной жидкости, мы обнаружили, что наиболее эффективным для умывания хондроцитов среду дифференцирования (Lonza) в течение ночи, покачиваясь в 37 ° С инкубатор (частота качания: около 75 разс / мин). Хондроцитов средний рост был использован для обеспечения хондроцитов выживания в этой длительной стирки и для обеспечения максимального проникновения закрепитель.
- Fix бисером в 70% этанола в одночасье, и приступить к гистологического анализа. Для выполнения DAPI окрашивания, инкубировать альгинат бусины с DAPI решение (500ng/ml) за 1 час при легком качалки и промыть 3 раза с 102 мм CaCl 2 в течение 15 минут каждый раз. DAPI изображения затем можно смотреть под флуоресцентным микроскопом. Бусины могут быть также секционные для Альциановый синий и H & E окрашивания.
6. Представитель Результаты
Наши 3D метод культивирования для человека хондроцитов в высокий процент синовиальной жидкости изображен на схеме показана на рис.1. После человеческих хондроцитов была представлена в альгинат бусы, им было позволено расти в среде с различной отношения синовиальной жидкости. Из-за вязкости синовиальной жидкости, важно, чтобыкультуре хондроцитов при постоянных условиях качалка для предотвращения слипания хряща конструкций и обеспечить равномерное распределение питательных веществ. Важно также, чтобы вымыть альгинат бисером широко, прежде чем извлекать хондроцитов, так что фиксация или лизис буфера может проникнуть шариков (рис. 1). Светлые поля (BF) изображения хондроцитов в альгинат бисер показано на рис.2. DAPI окрашивание проводилось для подтверждения usniform распределение клеток в шарики (рис. 2). В конце 21-дневного периода культивирования, анализа экспрессии генов была выполнена QRT-PCR. Ссылка гена GAPDH была использована для нормализации для всех ПЦР, так как он был определен как один из самых надежных генов ведения КПЦР анализ на хондроциты 32. Пример показан на рис. 3, где мы проанализировали результаты от человеческих хондроцитов суставного культивировали в синовиальной жидкости объединения с шести пациентов с остеоартритом. В соответствии с тем, что из хондроцитовLonza были расширены в 2D культур, которое неизбежно приведет к де-дифференциация 33, мы обнаружили, что День 0 хондроцитов выразил минимальных уровней хрящей генов матрицы (рис. 3). 3D культивирование хондроцитов с хондроцитов среду дифференцирования (Lonza) или среде, дополненной синовиальной жидкости значительно увеличили хряща экспрессии генов коллагена, агрекана и MMP13, что указывает на хондроцитов повторно дифференциация по 21-й день (рис. 3) 34. Увеличение доли синовиальной жидкости в средствах массовой информации привели к сопоставимым уровнем хрящевой ткани маркеров коллагена II и агрекана экспрессию мРНК (рис.3а и 3B). Кроме того, хондроциты культивируют в 100% синовиальной жидкости даже выставлялись снижение хряща разрушающего фермента MMP13 экспрессию мРНК по сравнению с теми, культивировали в среду в одиночку (Fig.3C). Интересно, что уровень экспрессии гибели клеток индикатор каспазы 3 постепенно уменьшается с увеличением отношения синовиальной жидкости, предполагая, что сynovial культивирования жидкости привело к снижению апоптоза уровней (рис. 3D). Таким образом, наши результаты показывают, что культивирование человеческих хондроцитов суставного к высоким уровням синовиальной жидкости в 3D настройка возможности технологии.
Таблицы и рисунки

Рисунок 1. Принципиальная схема метода к культуре человеческих хондроцитов суставного в высокий процент синовиальной жидкости в 3D бисером альгината. Во-первых, хондроциты и альгинат решения носят смешанный характер. При применении каплям, чтобы раствор CaCl 2, хондроциты закреплены в сшитый Са-альгината бисером гидрогеля. Эти 3D-конструкций, затем культивировали в среде хондроцитов дифференциации (Lonza) при изменении отношения человека синовиальной жидкости. После 21 дней культивирования в качалке состоянии, альгинат бисером содержащие клетки промывают широко после чего клетки извлекаются для геннойвыражение анализа.
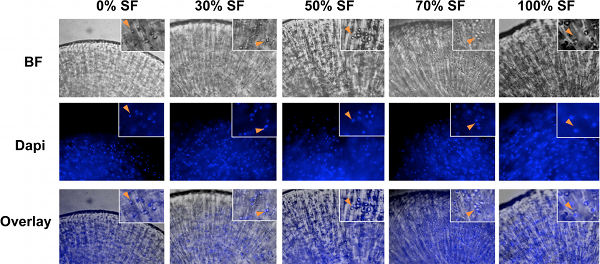
Рисунок 2. Светлого поля (BF) и DAPI изображения человеческих хондроцитов суставного инкапсулированные культур с 0%, 30%, 50%, 70% и 100% синовиальной жидкости. Хондроциты были сферическую форму во всех условий культивирования. Изображения светлого поля (BF) и DAPI были наложены, чтобы подтвердить местоположение и распределение хондроцитов. Вставки, увеличенных изображений. Стрелки, колокализации хондроцитов в BF и изображения DAPI окрашивания.
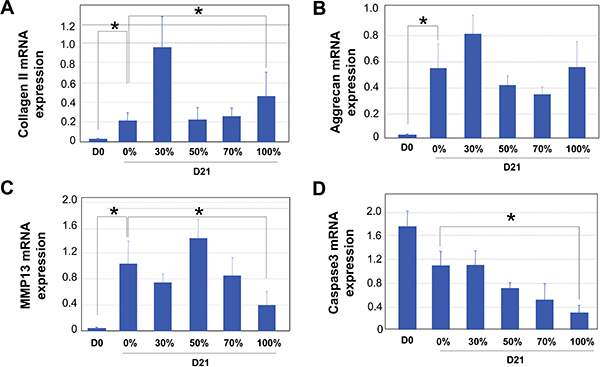
Рисунок 3. QRT-PCR анализ инкапсулированных человеческих хондроцитов суставного днем 0 (D0) после 21 дней культивирования (D21) в среде с различной отношения синовиальной жидкости (SF) (0%, 30%, 50%, 70 % и 100%). Результаты четырех независимых выборок показаны здесь. GAPDH был использован в качестве внутреннего отсчета для всех PCR. . Коллаген II экспрессию мРНК. B. Агрекана экспрессию мРНК. C. MMP13 экспрессию мРНК. D. Каспазы 3 экспрессию мРНК. Статистическая значимость была оценена на День 0 пробы и образцы 21-й день от 0% и 100% синовиальной жидкости (SF) культивирование, использование ИНСТАТ программного обеспечения. * Обозначает р <0,05.
Обсуждение
В этом докладе, мы разработали метод, который позволяет культуре человеческих хондроцитов суставного в 3D среде в среде, содержащей высокие концентрации человеческого синовиальной жидкости. Синовиальная жидкость является одним из основных компонентов, составляющих природной среды в ...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Робина Най (Тафтс Медицинский центр), Tomoya Uchimura и Дана Кэрнс (Университет Тафта) за оказание помощи в синовиальной жидкости хранения и центрифугирования. Эта работа финансировалась NIH (1R01AR059106-01A1) для LZ
Материалы
Таблица специфических реагентов и оборудования:
| Название реагента | Компания | Номер по каталогу | Комментарии |
|---|---|---|---|
| Альгинат (альгиновая кислота натриевая соль) | Сигма | A2158-250G | 2,4% раствор хранится при температуре 40 ° C |
| Дигидрат хлорида кальция, гранулированный | JT Baker | A19339 | |
| Хондрогенного СМИ Роста | Lonza | CC-3156 (база СМИ) | |
| CC-4409 (дополнение) | |||
| Хондрогенного СМИ Дифференциация | Lonza | CC-3226 (база СМИ) | |
| CC-4408 (дополнение) | |||
| Человек суставные хондроциты | Lonza | CC-2550 | |
| DAPI (4 ',6-Diamidino-2-фенилиндола дигидрохлорид) | Sigma-Aldrich | D9542 | |
| RNeasy мини-комплект (для экстракции РНК) | Qiagen | 74104 | |
| ПЦР реагентов: SYBR-зеленый | Quanta | 95053-500 | |
| 12 мл шприц | Tyco-Kendall-Monoject | 512852 | |
| 22-Gague шприц | Tyco-Кендалл-Monoject | 8881 | |
| Микроскоп | Олимп | IX71 | |
| Платформа рокер | Thermoscientific thermolyne | Vari-микс | |
| Грунтовки последовательности | |||
| Коллаген IIa вперед | 5'-TTC CCC ATC ОСО TCT CAC АГТ-3 ' | ||
| Коллаген IIa-реверс | 5'-CCTCTGCCTTGACCCGAA-3 ' | ||
| MMP13 вперед | 5'-TGT GCC СТТ СТТ CAC ACA GAC ACT-3 ' | ||
| MMP13-реверс | 5'-GAG AGC AGA СТТ TGA GTC ATT GCC-3 ' | ||
| Каспазы 3-вперед | 5'-TCA TTA TTC AGG CCT GCC GTG GTA-3 ' | ||
| Каспазы 3-обратный | 5'-TGG ATG AAC CAG GAG ОСО TCC ТТТ -3 ' |
Ссылки
- Centers for Disease Control and P. Projected state-specific increases in self-reported doctor-diagnosed arthritis and arthritis-attributable activity limitations--United States, 2005-2030. MMWR. Morb. Mortal. Wkly. Rep. 56, 423-425 (2007).
- Theis, K. A., Murphy, L., Hootman, J. M., Helmick, C. G., Yelin, E. Prevalence and correlates of arthritis-attributable work limitation in the US population among persons ages 18-64: 2002 National Health Interview Survey Data. Arthritis Rheum. 57, 355-363 (2007).
- Chung, C., Burdick, J. A. Engineering cartilage tissue. Adv. Drug. Deliv. Rev. 60, 243-262 (2008).
- Glowacki, J. In vitro engineering of cartilage. J. Rehabil. Res. Dev. 37, 171-177 (2000).
- Chokalingam, K., Hunter, S. A., Gooch, C. 3D-In vitro Effects of Compression and Time in Culture on Aggregate Modulus and on Gene Expression and Protein content of Collagen Type II in Murine Chondrocytes. Tissue Eng. Part A. , (2009).
- Butler, D. L., Goldstein, S. A., Guilak, F. Functional tissue engineering: the role of biomechanics. J. Biomech. Eng. 122, 570-575 (2000).
- Goldring, M. B., Goldring, S. R. Osteoarthritis. J. Cell. Physiol. 213, 626-634 (2007).
- Zvaifler, N. J., Firestein, G. S. Cytokines in chronic inflammatory synovitis. Scand. J. Rheumatol. Suppl. 76, 203-210 (1988).
- Rhee, D. K., Marcelino, J., Baker, M. The secreted glycoprotein lubricin protects cartilage surfaces and inhibits synovial cell overgrowth. J. Clin. Invest. 115, 622-631 (2005).
- Campo, G. M., Avenoso, A., Nastasi, G. Hyaluronan reduces inflammation in experimental arthritis by modulating TLR-2 and TLR-4 cartilage expression. Biochim. Biophys. Acta. , (2011).
- van de Lest, C. H., van den Hoogen, B. M., van Weeren, P. R. Loading-induced changes in synovial fluid affect cartilage metabolism. Biorheology. 37, 45-55 (2000).
- Saxne, T., Heinegard, D., Wollheim, F. A. Human arthritic synovial fluid influences proteoglycan biosynthesis and degradation in organ culture of bovine nasal cartilage. Coll. Relat. Res. 8, 233-247 (1988).
- Lee, D. A., Salih, V., Stockton, E. F., Stanton, J. S., Bentley, G. Effect of normal synovial fluid on the metabolism of articular chondrocytes in vitro. Clin. Orthop. Relat. Res. , 228-238 (1997).
- Schalkwijk, J., Joosten, L. A., van den Berg, W. B., van de Putte, L. B. Chondrocyte nonresponsiveness to insulin-like growth factor 1 in experimental arthritis. Arthritis Rheum. 32, 894-900 (1989).
- Schalkwijk, J., Joosten, L. A., van den Berg, W. B., van Wyk, J. J., van de Putte, L. B. Insulin-like growth factor stimulation of chondrocyte proteoglycan synthesis by human synovial fluid. Arthritis Rheum. 32, 66-71 (1989).
- Joosten, L. A., Schalkwijk, J., van den Berg, W. B., van de Putte, L. B. Chondrocyte unresponsiveness to insulin-like growth factor-1. A novel pathogenetic mechanisms for cartilage destruction in experimental arthritis. Agents Actions. 26, 193-195 (1989).
- Schuerwegh, A. J., Dombrecht, E. J., Stevens, W. J. Synovial fluid and peripheral blood immune complexes of patients with rheumatoid arthritis induce apoptosis in cytokine-activated chondrocytes. Rheumatol. Int. 27, 901-909 (2007).
- Hegewald, A. A., Ringe, J., Bartel, J. Hyaluronic acid and autologous synovial fluid induce chondrogenic differentiation of equine mesenchymal stem cells: a preliminary study. Tissue Cell. 36, 431-438 (2004).
- Xu, Q. R., Dong, Y. H., Chen, S. L., Bao, C. D., Du, H. Degeneration of normal articular cartilage induced by late phase osteoarthritic synovial fluid in beagle dogs. Tissue Cell. 41, 13-22 (2009).
- Kruger, J. P., Endres, M., Neumann, K., Haupl, T., Erggelet, C., Kaps, C. Chondrogenic differentiation of human subchondral progenitor cells is impaired by rheumatoid arthritis synovial fluid. J. Orthop. Res. 28, 819-827 (2010).
- Steinhagen, J., Bruns, J., Niggemeyer, O. Perfusion culture system: Synovial fibroblasts modulate articular chondrocyte matrix synthesis in vitro. Tissue Cell. 42, 151-157 (2010).
- Yang, K. G., Saris, D. B., Verbout, A. J., Creemers, L. B., Dhert, W. J. The effect of synovial fluid from injured knee joints on in vitro chondrogenesis. Tissue Eng. 12, 2957-2964 (2006).
- Skoog, V., Widenfalk, B., Ohlsen, L., Wasteson, A. The effect of growth factors and synovial fluid on chondrogenesis in perichondrium. Scand. J. Plast. Reconstr. Surg. Hand. Surg.. 24, 89-95 (1990).
- Nuver-Zwart, I., Schalkwijk, J., Joosten, L. A., van den Berg, W. B., van de Putte, L. B. Effects of synovial fluid and synovial fluid cells on chondrocyte metabolism in short term tissue culture. J. Rheumatol. 15, 210-216 (1988).
- Beekhuizen, M., Bastiaansen-Jenniskens, Y. M., Koevoet, W. Osteoarthritic synovial tissue inhibits proteoglycan production in human osteoarthritic cartilage; Establishment and characterisation of a long-term coculture. Arthritis Rheum. , (2011).
- Rodrigo, J. J., Steadman, J. R., Syftestad, G., Benton, H., Silliman, J. Effects of human knee synovial fluid on chondrogenesis in vitro. Am. J. Knee. Surg. 8, 124-129 (1995).
- van den Hoogen, B. M., van de Lest, C. H., van Weeren, P. R. Loading-induced changes in synovial fluid affect cartilage metabolism. Br. J. Rheumatol. 37, 671-676 (1998).
- Webb, G. R., Westacott, C. I., Elson, C. J. Osteoarthritic synovial fluid and synovium supernatants up-regulate tumor necrosis factor receptors on human articular chondrocytes. Osteoarthritis Cartilage. 6, 167-176 (1998).
- Kook, S. H., Son, Y. O., Lee, K. Y. Hypoxia affects positively the proliferation of bovine satellite cells and their myogenic differentiation through up-regulation of MyoD. Cell. Biol. Int. 32, 871-878 (2008).
- Knobloch, T. J., Madhavan, S., Nam, J., Agarwal, S., Agarwal, S. Regulation of chondrocytic gene expression by biomechanical signals. Crit. Rev. Eukaryot. Gene. Expr. 18, 139-150 (2008).
- Guo, J. F., Jourdian, G. W., MacCallum, D. K. Culture and growth characteristics of chondrocytes encapsulated in alginate beads. Connect. Tissue. Res. 19, 277-297 (1989).
- Toegel, S., Huang, W., Piana, C. Selection of reliable reference genes for qPCR studies on chondroprotective action. BMC. Mol. Biol. 8, 13-13 (2007).
- Lin, Z., Fitzgerald, J. B., Xu, J. Gene expression profiles of human chondrocytes during passaged monolayer cultivation. J. Orthop. Res. 26, 1230-1237 (2008).
- Goessler, U. R., Bieback, K., Bugert, P. Human chondrocytes differentially express matrix modulators during in vitro expansion for tissue engineering. Int. J. Mol. Med. 16, 509-515 (2005).
- Anat, J. . 121, 107-118 (1976).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены